Del 2
Utvikling, godkjenning og bruk av legemidler
3 Utvikling og godkjenning av legemidler

Figur 3.1
Legemiddelloven definerer legemidler på følgende måte:
«Med legemidler forstås i denne lov stoffer, droger og preparater som er bestemt til eller utgis for å brukes til å forebygge, lege eller lindre sykdom, sykdomssymptomer eller smerter, påvirke fysiologiske funksjoner hos mennesker eller dyr, eller til ved innvortes eller utvortes bruk å påvise sykdom.»
Mennesket har i uminnelige tider brukt midler fra plante-, dyre- og mineralriket ved sykdom. Skriftlige kilder fra Mesopotamia og antikkens Egypt og Hellas dokumenterer dette, men bruken er trolig langt eldre.
Tidlig på 1200-tallet forbød Laterankonsilet (kirkemøte i Roma) klostrene å tilby medisinsk hjelp til folk flest. Dette førte til at medisinundervisning og legegjerningen måtte foregå andre steder. Samtidig ble de første universitetene opprettet, blant annet i Bologna, Padova, Montpellier og Paris.
Boktrykkekunsten og renessansen ga store endringer i medisin og farmasi. På 1500-tallet levde «folkelig» medisin og en mer rasjonell medisin side om side. På slutten av 1700-tallet begynte vitenskapsfolk å lete etter de aktive stoffene i drogene fra plante-, dyre- og mineralriket. Dette arbeidet førte til at en rekke naturstoffer ble isolert, for eksempel morfin i 1805, kinin i 1821, atropin i 1822 og kokain i 1860. Acetylsalicylsyre fra F. Bayer & Co. var det første industrielt produserte legemidlet som ble solgt i stor skala. Det kom på markedet i 1896.
Skillet mellom medisin og farmasi oppsto sannsynligvis på Sicilia i første halvdel av 1200-tallet, gjennom det såkalte Salernoediktet. Forordningen slo fast et klart skille mellom leger og de som fremstilte legemidler. Tilberedningen av legemidler skulle foregå etter en nærmere beskrevet fremgangsmåte, og de som utførte arbeidet, måtte dokumentere sin dyktighet overfor legene. Myndighetene skulle fastsette prisene på legemidlene, og apoteknæringen skulle ikke være fri, men avhengig av konsesjon eller privilegium.
Fra Italia spredde apotekene seg til Sør-Frankrike og England på 1200–1300-tallet og til Tyskland på 1400-tallet. Bortsett fra i England ble virksomheten regulert ved lover som var i tråd med Salernoediktet. Mens privilegiene i Italia og Frankrike ble gitt til laug, ble de i Tyskland gitt til enkeltpersoner.
Det første apoteket i Norge ble opprettet i Bergen i 15951. Skillet mellom leger og apotek og kravet om at leger ikke kunne eie apotek ble innført i Danmark og Norge ved Christian den Femtes forordning av 4. desember 1672.
Fram til midten av 1900-tallet foregikk en stor del av legemiddelproduksjonen i Norge i apotekenes laboratorier. Selvstendige apotek hadde da laboratorium, der de kunne fremstille legemidler som ikke ble masseprodusert i industrien. Apotekene produserte for eksempel salver, tabletter, miksturer, øyedråper og injeksjonsvæsker.
På slutten av 60-tallet ble kravene til legemiddelproduksjon kraftig skjerpet. Dette gjorde det vanskelig for mange apotek å opprettholde produksjon.
3.1 Utvikling av legemidler
I dag utvikles de fleste legemidler av legemiddelindustrien, og apotekproduksjon er nesten helt borte. Legemiddelindustrien er en sammensatt bransje som spenner fra høyteknologiske og forskningsbaserte selskap, til selskap som baserer seg på fremstilling av legemidler som ikke lenger har patent. Det er også en enorm variasjon i størrelsen på selskapene, fra små forskningsbaserte selskap som utvikler enkeltpreparat, til de store multinasjonale farmasøytiske selskapene. Det stilles høye krav til sikkerhet, kvalitetskontroll og oppfølging ved utvikling av legemidler. Industrien er også pålagt omfattende overvåkning og rapportering til myndighetene etter markedsføring.
Figur 3.2 viser antall virkestoff med markedsføringstillatelse2. Figuren viser at det er et høyt antall virkestoff på markedet og at det har økt ganske betydelig fra 2005 og fram til og med 2014. Det har vært hevdet at det er en innovasjonskrise når det gjelder nye virkestoff. Tallene indikerer imidlertid at det ikke er noen innovasjonskrise, i alle fall ikke når det gjelder kvantitet.
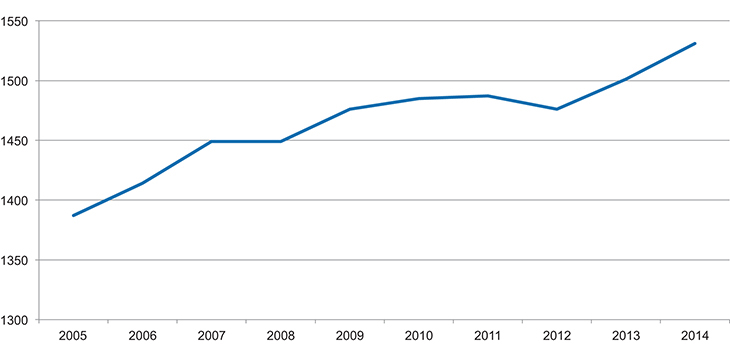
Figur 3.2 Antall virkestoff som er på markedet 2005–2014
Kilde: Statens legemiddelverk
Det tar gjerne mellom 10 og 15 år å utvikle et nytt legemiddel. Det er en kostbar prosess, anslagene over reelle kostnader varierer betydelig og avhenger av i hvilken grad forskning som ikke leder fram til et nytt virkestoff inkluderes. I prinsippet er det to tilnærmingsmåter for å utvikle nye legemidler. Den første er å ta utgangspunkt i kjente substanser, og så teste disse substansene i forskjellige biologiske system for å finne signaler på effekt. Den andre er å ta utgangspunkt i sykdommens årsak på molekylært nivå og ut fra det forsøke å designe nye målrettede molekyler til behandling av sykdommen. Disse prosessene er krevende og det er mange spor som ikke leder fram til nye virkestoff, i alle fall ikke i første omgang. Andre ganger oppdages det effekter tilfeldig hvis et virkestoff har effekt på andre områder enn det som ble dokumentert først. For eksempel ble sildenafil, som er virkestoffet i Viagra, først dokumentert å ha effekt på pulmonal hypertensjon (forhøyet trykk i lungekretsløpet). Effekten på erektil dysfunksjon var et tilfeldig funn.
Når forskerne har funnet et stoff som virker lovende er det klart for prekliniske studier, det vil si undersøkelser i laboratoriet og forsøk på dyr. Hvis de prekliniske studiene er vellykkede er det klart for kliniske studier.
Figur 3.3 viser prosessen fra prekliniske studier og industriell godkjenning til kliniske studier, søknad om markedsføringstillatelse og studier etter godkjenning (fase IV-studier). Tidsforløpene er ment som illustrasjon på hvordan en prosess kan være.
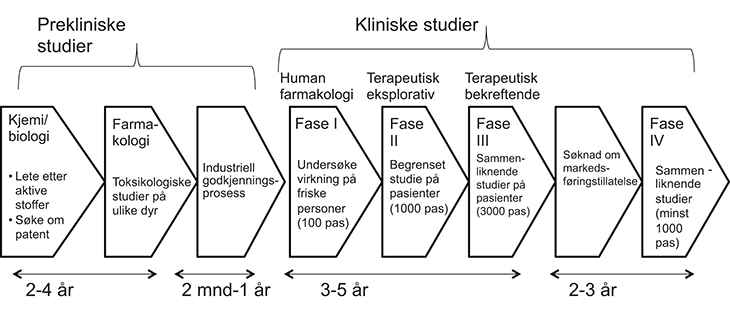
Figur 3.3 Illustrasjon av prekliniske og kliniske studier
Hensikten med kliniske studier av legemidler er å finne ut hvordan legemidlet virker, hvilke bivirkninger det gir og hvordan legemidlet omsettes i kroppen. Kliniske studier må gjennomføres før et nytt legemiddel gis markedsføringstillatelse. Slike studier omtales nærmere i kapittel 22.
3.2 Markedsføringstillatelse
Norge deltar i det europeiske samarbeidet for godkjenning av legemidler gjennom EØS-avtalen og det europeiske legemiddelbyrået (EMA). I dette samarbeidet blir søknader om markedsføringstillatelser behandlet av landene i fellesskap.
Når et legemiddel får markedsføringstillatelse innebærer det at produsenten får tillatelse til å markedsføre legemidlet, i henhold til de betingelser som er spesifisert i den godkjente preparatomtalen.
Et legemiddel får innvilget markedsføringstillatelse dersom legemidlet vurderes å ha en nytte som overstiger risikoen ved bruk. Vurderingen av nytte-/risikoforholdet til et legemiddel er basert på dokumentasjon som produsenten må sende inn når de søker om markedsføringstillatelse. I søknaden må produsenten dokumentere legemidlets farmasøytiske kvalitet, sikkerhet og medisinske effekt, samt systemer og aktiviteter for å minimere og håndtere risiko i bruk. En markedsføringstillatelse gjelder den eller de bruksområder og doseringer som er spesifisert i preparatomtalen. Når et legemiddel får markedsføringstillatelse innebærer det ikke nødvendigvis at det blir anbefalt brukt, for eksempel gjennom refusjonssystemet eller som etablert behandling i sykehus. Hvorvidt det blir anbefalt brukt og finansiert avhenger av hvor godt det er, sammenliknet med eksisterende behandling. Finansieringssystemene er omtalt i kapittel 19.
Produsenten kan ikke markedsføre legemidler utover bruksområdet som er godkjent i markedsføringstillatelsen. Det er imidlertid tillatt å bruke legemidler på andre måter (off-label) enn den som er godkjent. Som for all annen behandling kreves det at bruken er faglig forsvarlig etter reglene i helsepersonelloven, jf. omtale i Meld. St. 11 (2014–2015) Kvalitet og pasientsikkerhet 2013.
Boks 3.1 Prosedyrer for godkjenning av legemidler
Søknader om markedsføringstillatelse vurderes etter forskjellige prosedyrer avhengig av hva slags type legemiddel det søkes godkjenning for, og i hvilket marked produsenten ønsker tillatelse for markedsføring. I Europa er det fire forskjellige prosedyrer for vurdering av søknader om markedsføringstillatelse.
Sentral prosedyre (CP): preparatet får markedsføringstillatelse i alle EU-/EØS-land. Denne prosedyren er obligatorisk for de fleste nye virkestoffer. Her sendes det en søknad til EMA og søknaden utredes av to land. Deretter diskuteres søknaden i EMAs ekspertkomiteer før det eventuelt gis en anbefaling om godkjenning. EU-kommisjonen gir deretter en markedsføringstillatelse som er gyldig i hele EU. Statens legemiddelverk treffer et tilsvarende vedtak som gir rett til å markedsføre legemidlet i Norge.
Gjensidig anerkjennelsesprosedyre (MRP): Preparatet får sin eksisterende nasjonale markedsføringstillatelse utvidet til to eller flere land. Andre lands godkjenning baserer seg på anerkjennelse av den vurderingen av søknaden som ble gjort av den legemiddelmyndigheten som først godkjente legemidlet. Et land kan nekte godkjenning dersom de mener det innebærer en alvorlig fare for folkehelsen.
Desentralisert prosedyre (DCP): Preparatet får sin første markedsføringstillatelse i to eller flere land. Et land utreder søknaden på vegne av de øvrige. Andre land anerkjenner den vurderingen av søknaden som ble gjort av utrederlandet. Andre land kan nekte dersom de mener godkjenning innebærer en alvorlig fare for folkehelsen.
Nasjonal prosedyre: Preparatet får markedsføringstillatelse i ett land. Denne godkjenningen kan siden benyttes til å søke gjensidig anerkjennelse i et eller flere andre EØS-land.
Statens legemiddelverk deltar aktivt i det europeiske legemiddelsamarbeidet og bidrar ved dette til beslutninger som fremmer riktig medisinsk bruk av legemidler i Europa. Norge tar ansvar for utredninger og deltar i alle vitenskapelige komiteer administrert av det europeiske legemiddelbyrået EMA.
I det europeiske legemiddelsamarbeidet stiller hvert land med nasjonal utredningskompetanse og godkjenningsarbeidet koordineres underveis i enkeltlandene. Det vil si at den faglig aktive kompetansen ikke ligger sentralt i EU-systemet, men i de nasjonale myndighetene.
Ved å delta i de europeiske legemiddelkomiteene, bidrar Legemiddelverket med nasjonal kunnskap til EØS-samarbeidet. Det europeiske samarbeidet bygger på et politisk valgt arbeidsdelingsprinsipp, for å utnytte de ressursene som finnes i EØS på legemiddelområdet.
Kravene som stilles til markedsføringstillatelse sikrer at legemidlene har god kvalitet og er trygge å bruke for pasientene. Det europeiske samarbeidet som Norge deltar i er en viktig bærebjelke for å sikre god kvalitet og ivareta pasientsikkerheten.
Boks 3.2 Legemidler til behandling av sjeldne sykdommer (orphan drugs)
For legemidler til sjeldne sykdommer (orphan drugs) vil det gjerne ikke være kommersielt lønnsomt å fremskaffe dokumentasjonen som er nødvendig for å få markedsføringstillatelse. EU har derfor vedtatt et eget regelverk for sjeldne sykdommer som skal gi industrien incentiver til å utvikle slike legemidler1 .
En sykdom regnes som sjelden dersom den i EØS opptrer sjeldnere enn fem tilfeller per 10.000 innbyggere, eller der man ikke kan forvente å tjene inn kostnadene ved å utvikle legemidlet på vanlig måte. Omtrent 300.000 mennesker i Norge (30 millioner i EU) har en sjelden sykdom.
Regelverket gjelder for legemidler som skal brukes ved tilstander som er livstruende eller kronisk invalidiserende og der det ikke finnes godkjent behandling fra før. Finnes det allerede behandling, gjelder regelverket likevel dersom legemidlet vil være til betydelig nytte for pasientene. For slike legemidler gir EMA gratis regulatorisk og vitenskapelig rådgivning, avgiftene for å søke markedsføringstillatelse er strekt reduserte, og legemidlet gis ti års eksklusiv markedsbeskyttelse for det godkjente bruksområdet.
EMA har siden 2000 gitt ca 1400 legemidler status som legemidler til sjeldne sykdommer. Rundt 100 av disse har fått markedsføringstillatelse. I 2014 var 17 (20 pst.) av de godkjente legemidlene i sentral prosedyre til sjeldne sykdommer. Det forventes at antallet og andelen fortsetter å øke i årene som kommer.
1 Forordning (EF) nr. 141/2000
Industrien avgjør selv hvilke legemidler de ønsker å utvikle, basert på tilgjengelig kunnskap om sykdommer, mekanismer i kroppen, potensielle virkestoff og ikke minst markedspotensialet for et nytt legemiddel. Det finnes fortsatt store og viktige sykdomsgrupper som mangler effektiv behandling. I lys av dette har det europeiske legemiddelbyrået EMA åpnet for spesialordninger for legemidler til behandling av sjeldne sykdommer og antibiotika som er omtalt i boks 3.2 og 3.3. Spesialordningene er utformet for å gi industrien bedre vilkår for å utvikle legemidler til disse gruppene. Nye ordninger, som regulatorisk veiledning og adaptive pathways er også virkemidler som skal stimulere industrien til å utvikle og kommersialisere nye legemidler. Dette omtales i kapittel 23.
I oktober 2014 besluttet EMA å offentliggjøre kliniske rapporter fra søknader om markedsføringstillatelse, innsendt etter 1. januar 2015. Søknader om markedsføringstillatelse må inneholde alle studier, også de som ikke er publiserte. Offentliggjøring vil bidra til at samfunnet og forskerne får et mer helhetlig bilde av legemidlenes sikkerhet og effekt.
Boks 3.3 Antibiotika
I Europa og resten av verden er utvikling og spredning av resistente bakterier et problem. I framtiden er det derfor en fare for at vi ikke lenger vil ha effektive antibiotika tilgjengelig mot flere av de bakteriene som forårsaker infeksjoner hos mennesker.
Det pågår lite forskning for å utvikle nye, virksomme legemidler mot bakterielle infeksjoner. Myndighetene prøver å legge til rette for industrien slik at det skal bli mer attraktivt å forske på nye antibakterielle midler, og søke om markedsføringstillatelse. Industrien kan søke EMA om Scientific Advice og få råd om hvordan studier skal designes. EMA har dessuten opprettet muligheten for en raskere regulatorisk prosess ved søknad om markedsføringstillatelse, og kan frita små og mellomstore bedrifter for gebyrer. Det kan også søkes om slik spesialbehandling hos EMA i spesielle tilfeller, for eksempel for antibakterielle legemidler med helt ny virkemekanisme.
Det blir arbeidet med harmonisering av preparatomtaler for allerede markedsførte antibakterielle legemidler i alle EØS-land. Dette arbeidet blir gjennomført for legemidler der det er stor variasjon i eksempelvis hvilke indikasjoner, dosering og kontraindikasjoner som er godkjent i de ulike europeiske land. De europeiske legemiddelmyndighetene samarbeider i vurderingen av legemidlenes sikkerhet og effekt og fatter i felleskap beslutning angående hvilke indikasjoner og dosering det finnes tilstrekkelig dokumentasjon for.
Norge deltar aktivt for å påvirke avgjørelsen slik at bruken av antibakterielle midler samsvarer med de restriktive norske holdningene i bruk av antibiotika. Dette medfører for eksempel at infeksjoner som med stor sannsynlighet helbredes spontant uten antibiotikabehandling (eksempelvis otitis media (ørebetennelse) og akutt bronkitt), ikke blir godkjent som indikasjon for bredspektret antibiotika.
Et prosjekt er startet av EU-kommisjonen for å skaffe oppdatert kunnskap om eldre antibakterielle legemidler som ble godkjent med begrenset dokumentasjon av sikkerhet og effekt, og hvor det derfor gjerne mangler dokumentasjon for optimal dose, doseringsfrekvens og varighet.
3.2.1 Patent, dokumentbeskyttelse, generika og biotilsvarende
Et patent gir innehaveren enerett til å utnytte en oppfinnelse i nærings- eller driftsøyemed i en periode. Dette hindrer andre i å kopiere oppfinnelsen, og gir innehaveren mulighet til å få tilstrekkelig avkastning fra investeringen. Patenttiden er 20 år. Alle nye innovative legemidler er patentert.
Patent søkes tidlig i et legemiddels utvikling, men på grunn av den lange tiden utviklingen kan ta, er det ikke alltid så mye igjen av patenttiden når legemidlet får markedsføringstillatelse. På legemiddelområdet kan innehaveren derfor i tillegg søke om et supplerende beskyttelsessertifikat, som forlenger beskyttelsen i inntil fem ekstra år.
For ytterligere å sikre produsentene, er det i legemiddelregelverket regler om dokumentbeskyttelse. Disse reglene hindrer generikaprodusenter å sende inn søknad om markedsføringstillatelse før originalen har vært på markedet i åtte år i EØS-området. Videre kan den markedsføringstillatelsen som oppnås tidlig benyttes ti år etter første tillatelse i EØS.
Generiske legemidler
Nye legemidler kan få markedsføringstillatelse i Norge dersom en samlet vurdering av kvalitet, sikkerhet og effekt viser at legemidlet har et positivt nytte-/risikoforhold, jf. kapittel 3.2. Det første godkjente legemidlet med et nytt aktivt virkestoff kalles originallegemiddel. Når patenttiden utløper, kan andre produsenter lage en kopi av legemidlet. For kjemiske virkestoff kalles slike kopier generiske legemidler.
Generiske legemidler og originallegemidlet har alltid samme virkestoff i lik mengde, men kan inneholde ulike hjelpestoff og ha ulikt utseende. Teksten på pakningen og i pakningsvedlegget kan variere mellom legemidlene. Generiske legemidler må ha egen kvalitetsdokumentasjon, mens dokumentasjonen av sikkerhet og effekt skjer ved henvisning til originallegemidlet. I søknaden om markedsføringstillatelse må det vises at virkestoffet i legemidlene tas opp på samme måte.
Trinnprissystemet brukes for å redusere prisene når det oppstår generisk konkurranse. Systemet har ført til lave priser for legemidler som har generisk konkurranse. Trinnprissystemet er omtalt i kapittel 16. Pasienters bruk av generiske legemidler og bytte i apotek er omtalt i kapittel 11.
Biotilsvarende legemidler
Biologiske legemidler er framstilt ved hjelp av genteknologi i levende celler. Biologiske legemidler er viktige i behandlingen av sykdommer som kreft, diabetes, inflammatoriske sykdommer og blødersykdommer. Legemidlene har en komplisert struktur som er vanskelig å karakterisere. Det er derfor ikke mulig å lage identiske kopier av disse. Betegnelsen biotilsvarende legemiddel er derfor innført. Det indikerer at produktet likner et originalpreparat, men ikke er identisk.
Flere biotilsvarende legemidler er godkjent i EØS. Større konkurranse gjennom økende produksjon av biotilsvarende legemidler vil kunne redusere kostnadene, se kapittel 16.
Boks 3.4 Oversikt over biotilsvarende med markedsføringstillatelse
I dag markedsføres fem biotilsvarende legemidler i Norge innenfor følgende legemiddelgrupper: Filgrastimer (stimulerer dannelsen av hvite blodlegemer), veksthormon (stimulerer lengdevekst), epoetiner (stimulerer dannelsen av røde blodlegemer), follitropiner (kjønnshormoner, gonadal stimulering) og tumornekrose-faktor a-hemmere (monoklonalt antistoff som brukes mot inflammatoriske sykdommer). Det forventes flere søknader om biotilsvarende produkter de nærmeste årene, fordi patenttiden for mange biologiske originalpreparater snart løper ut.
Biotilsvarende legemidler gjennomgår samme grundige vurdering av EMA som andre legemidler, med tilsvarende krav til kvalitet, sikkerhet og effekt. Det vil si at biotilsvarende legemidler skal ha tilsvarende effekt og sikkerhet som originalen; de er terapeutiske alternativer innenfor samme indikasjonsområde som referanseproduktet.
Det pågår en studie for å øke kunnskapen om bytte til biotilsvarende. Studien omtales i kapittel 11.
3.3 Hvilke legemidler er på markedet i dag?
Tabell 3.1 viser at det er mange legemidler til behandling av leddgikt, multippel sklerose og kreft blant de 25 legemidlene med høyest omsetning. Samtidig viser tabellen at reseptfrie legemidler som nesespray og røykeavvenningsmidler har høy total omsetning. Disse legemidlene refunderes ikke av det offentlige.
Tabell 3.1 Oversikt over 25 mest omsatte virkestoff, målt i omsetning, i 2014
Virkestoff | Eksempel på bruksområde |
|---|---|
Adalimumab | Leddgikt |
Etanercept | Leddgikt |
Infliximab | Leddgikt |
Salmeterol og flutikason | Astma/KOLS |
Nikotin | Røykeavvenning |
Koagulasjonsfaktor VIII | Blødningsprofylakse (blødere) |
Formoterol og budesonid | Astma/KOLS |
Sofosbuvir | Hepatitt C |
Paracetamol | Smerter |
Rituximab | Kreft og leddgikt |
Fingolimod | Multippel sklerose |
Xylometazolin | Tett nese |
Golimumab | Leddgikt |
Abirateron | Prostatakreft |
Tiotropium bromid | KOLS |
Trastuzumab | Brystkreft |
Natalizumab | Multippel sklerose |
Somatropin | Veksthormon |
Methylfenidat | ADHD |
Esomeprazol | Reflukssykdom |
Ibuprofen | Smerter |
Immunglobulin, normal human, til intravaskulær adm. | Immunsviktsyndrom, leukemi |
Rivaroxaban | Blodproppforebygging |
Certolizumab pegol | Leddgikt |
Pregabalin | Nevropatisk smerte |
Kilde: Nasjonalt folkehelseinstitutt (Grossistbasert legemiddelstatistikk)
De tre legemidlene med høyest omsetning er biologiske legemidler til behandling av inflammatorisk revmatisk sykdom, inflammatorisk tarmsykdom og psoriasis.
Tabell 3.2 viser at når bruken måles i doser, og ikke i omsetning så er det legemidler mot blodpropp, høyt kolesterol og blodtrykk som dominerer. Mange av disse legemidlene har vært lenge på markedet, og det er åpent for generisk konkurranse, som er nærmere omtalt i kapittel 3.2.1.
Tabell 3.2 De 25 mest omsatte legemidlene, målt i DDD1, i 2014
Virkestoff | Eksempel på bruksområde |
|---|---|
Acetylsalisylsyre | Blodpropp |
Atorvastatin | Høyt kolesterol |
Simvastatin | Høyt kolesterol |
Natriumfluorid | Tannråte |
Paracetamol | Smerter |
Cetirizin | Allergi |
Amlodipin | Høyt blodtrykk |
Zopiklon | Søvnvansker |
Xylometazoline | Tett nese |
Ramipril | Høyt blodtrykk |
Askorbinsyre | Vitaminmangel |
Kandesartan | Høyt blodtrykk |
Levotyroksinnatrium | Lavt stoffskifte |
Metoprolol | Høyt blodtrykk |
Vitamin B-kompleks, usammensatte preparater | Vitaminmangel |
Levonorgestrel og etinyløstradiol | Prevensjon |
Escitalopram | Depresjon |
Esomeprazol | Reflukssykdom |
Pantoprazol | Reflukssykdom |
Ibuprofen | Smerter |
Kalsium, kombinasjoner med vitamin D og/eller andre stoffer | Kalsiummangel/ osteoporose |
Metformin | Diabetes |
Desloratadin | Allergi |
Losartan | Høyt blodtrykk |
Furosemid | Høyt blodtrykk |
1 DDD står for definerte døgndoser og er et mål for doser av legemidler.
Kilde: Nasjonalt folkehelseinstitutt (Grossistbasert legemiddelstatistikk)
Tall fra Reseptregisteret viser at antibiotika og ulike smertestillende legemidler er blant legemidlene med flest brukere, jf. tabell 3.3. Dette er ofte kortvarig behandling. Det er også mange som bruker ulike legemidler til forebygging og behandling av hjerte- og karsykdommer, og målt i antall doser er dette de mest brukte legemidlene jf. tabell 3.2. Også sovemidler, midler mot allergi og astma og midler mot spiserørsbetennelse er på listen over de 25 mest brukte legemidlene, både målt i antall brukere og i antall doser.
Tabell 3.3 De 30 virkestoffene som har flest brukere i 2014 (utlevert på resept fra apotek)
Virkestoff | Eksempel på bruksområde |
|---|---|
Fenoksymetylpenicillin | Infeksjoner |
Paracetamol1 | Smerter |
Acetylsalisylsyre | Blodpropp |
Kodein, kombinasjoner ekskl. psykoleptika | Smerter |
Diklofenak1 | Smerter |
Zopiklon | Søvnvansker |
Cetirizin1 | Allergi |
Metoprolol | Høyt blodtrykk |
Simvastatin | Høyt kolesterol |
Etylmorfin | Hoste |
Salbutamol | Astma |
Ibuprofen1 | Smerter |
Atorvastatin | Høyt kolesterol |
Pivmecillinam | Infeksjoner |
Levotyroksinnatrium | Lavt stoffskifte |
Pantoprazol1 | Reflukssykdom |
Kloramfenikol | Infeksjoner |
Tramadol | Smerter |
Prednisolon | Betennelsestilstander |
Desloratadin | Allergi |
Mometason | Allergi |
Esomeprazol | Reflukssykdom |
Levonorgestrel og etinyløstradiol | Prevensjon |
Doksysyklin | Infeksjoner |
Oksazepam | Angst og uro |
Amoksicillin | Infeksjoner |
Amlodipin | Høyt blodtrykk |
Østradiol | Østrogenmangel |
Diazepam | Angst og uro |
Escitalopram | Depresjon |
1 Inkluderer ikke reseptfritt salg.
Kilde: Nasjonalt folkehelseinstitutt (Reseptregisteret)
3.4 Hvilke legemidler kan vi forvente i fremtiden?
Kunnskapsnivået innen både medisin og teknologi er i rivende utvikling. Det er flere typer kunnskap og teknologier som kan gi nye muligheter for utvikling av legemidler. De viktigste er genetisk kunnskap og mulighetene for genomsekvensering, økt medisinsk forståelse gjennom molekylærbiologisk og genetisk forskning, samt ulike teknologier som nanoteknologi, billedteknologi og radiologi.
Metodikken med systematisk testing av kjente stoffer i biologiske testmodeller var forskningsstrategien som skaffet oss mange av de kjemiske legemidlene på 80- og 90-tallet. De siste 10-årenes utvikling av genteknologi og molekylærmedisin innebærer at legemiddelutvikling i dag i større grad tar utgangspunkt i sykdommenes molekylære årsak.
Biologiske legemidler
Nye behandlingsformer kan omfatte målrettede molekyler som kan regulere eller angripe mekanismer som er årsak til sykdommen, uten å forstyrre normal funksjon av cellen eller organet. Biologiske legemidler kan derfor ofte ha mindre alvorlige bivirkninger enn tradisjonell systemisk behandling.
Monoklonale antistoff er den største gruppen av nye biologiske legemidler. De gjenkjenner spesifikke strukturer på celler eller proteiner, og kan for eksempel stimulere immunsystemet til å angripe disse strukturene. I tillegg kan de hemme eller blokkere uønskede molekylære prosesser. Monoklonale antistoff rettet mot immunsystemets reguleringsmekanismer kan gjøre behandling med andre legemidler mer effektiv og blir derfor ofte brukt i kombinasjon med annen behandling. Kombinasjonsbehandling hvor immunsystemet aktiveres mot mål på kreftceller i forbindelse med stråleterapi eller kirurgisk inngrep, er et felt som er i sterk utvikling.
30 år etter at de første monoklonale antistoff ble produsert, har de utviklet seg til å bli et viktig terapeutisk verktøy til bekjempelse av sykdommer der det tidligere ikke fantes adekvat behandling. Rekombinant DNA teknologi kan også brukes til å lage sammensatte proteiner som kan forbedre de terapeutiske egenskapene til legemidlet. For eksempel er det utviklet insulinpreparater mot diabetes som har lengre levetid i blodet, ved å fusjonere med bestandige proteiner.
Nanoteknologi
Nanoteknologi er fremvoksende, men foreløpig lite utnyttet. I medisin er hensikten gjerne å bruke nanoteknologi til å transportere legemidler i kroppen til definerte organ, for diagnose og behandling. Nanoteknologi kan bidra til å øke løselighet av virkestoffet, redusere toksisitet og påvirke biodistribusjon.
Det europeiske legemiddelbyrået har godkjent flere nanomedisinske produkt, der for eksempel virkestoff er kapslet i fettkuler i nanostørrelse eller der selve virkestoffet er laget i nanostørrelse. Innen kreftbehandling fins det eksempler på toksiske (giftighet) legemidler som er koblet til nanopartikler både for å oppnå målrettet levering og for å redusere legemidlets toksiske virkning.
Boks 3.5 Metoder for utvikling av legemidler
Det foregår forskning på nye metoder for å utvikle og teste legemidler, som for eksempel modellering og simuleringsmetoder (M&S). Dette er avanserte matematiske og statistiske metoder, som kan brukes til å strukturere, analysere og simulere data – både farmakologiske, fysiologiske og patofysiologiske data.
Det europeiske legemiddelbyrået har opprettet en ny arbeidsgruppe (MSWG) som evaluerer modellerings- og simuleringsmetodikk (M&S metodikk). Gruppens arbeid bidrar til å oppfylle EMAs ønske om sterkere integrasjon av modellerings- og simuleringsmetodikk både i utviklingen av legemidler og i myndighetenes regulatoriske evaluering av legemidler. EMA anser modellerings- og simuleringsmetodikk som et viktig verktøy for å forbedre effektiviteten av legemiddelutvikling, og for å støtte myndighetenes evaluering av legemidlene. Modellerings- og simuleringsmetodikk kan bidra til å redusere usikkerhet i vurderingen av sikkerhet og effekt, gi bedre informasjon og i enkelte tilfeller bidra til å redusere behovet for kliniske studier.
Persontilpasset medisin
Persontilpasset medisin innebærer at behandlingen skreddersys den enkelte pasient i forebygging, diagnostikk og behandling3.
I persontilpasset medisin kobles sykdomshistorie, kliniske funn, livsstilsfaktorer og miljøpåvirkning med analyser av pasientens arvemateriale (DNA) og eventuelle patogener som bakterier og virus. Arvematerialet er styrende for mange fysiologiske og patologiske prosesser. Den teknologiske utvikling de seneste årene gjør at det kan samles inn store mengder biologiske data, med et høyere presisjonsnivå enn tidligere. Sammen med bedre kunnskap om DNA, bedre muligheter for genomsekvensering og mer kunnskap om sammenhengen mellom gener og sykdomsutvikling gir dette persontilpasset medisin et mer presist fundament.
Persontilpasset medisin inkluderer legemidler som er utviklet til å virke med størst mulig presisjon. De siste ti årene har det vært en utvikling av nye, målrettede legemidler som enten blokkerer defekter eller retter opp spesifikke feil på molekylært nivå. Persontilpasset behandling er særlig aktuelt for pasienter med kreft, for pasienter med sjeldne arvelige sykdommer, og for pasienter med infeksjonssykdommer. I 2013 fikk 81 nye legemidler markedsføringstillatelse i Europa. Av disse var det 16 legemidler til behandling av kreft, og de aller fleste av disse er såkalte målrettede terapier hvor den diagnostiske prosessen og behandlingsvalget er basert på informasjon om biomarkører. Flere av de nye legemidlene lanseres sammen med diagnostiske verktøy som forenkler den diagnostiske prosessen og som er sentrale for å finne frem til hvilke undergrupper av pasienter som vil ha nytte av målrettet behandling. Et eksempel på slik målrettet behandling er Herceptin, brukt i behandling av brystkreft.
Boks 3.6 Eksempler på persontilpasset medisin
Alle trender tyder på fortsatt vekst i utvikling og bruk av persontilpasset behandling. Antallet artikler som publiseres om studier som undersøker sammenhengen mellom genuttrykk og sykdom øker hvert år. DNA-sekvensering og karakterisering av det humane genomet har avslørt tusenvis av nye angrepsmål for legemidler.
Eksempler på persontilpassede terapier:
Dabrafenib (Tafinlar) til behandling av pasienter med en type hudkreft, kalt melanom med en BRAF V600E-mutasjon. Tafinlar angriper proteiner produsert av det modifiserte BRAF-genet og reduserer eller stopper kreftutviklingen.
Ataluren (Translarna) til behandling av Duchenne muskeldystrofi, en sjelden arvelig sykdom som bare rammer gutter. Pasienter med denne tilstanden har en mutasjon i genet som koder for proteinet dystrofin, og dystrofin i musklene hos disse pasientene fungerer dermed ikke normalt. Ataluren sørger for at apparatet i cellene som produserer protein ikke stopper opp på grunn av mutasjonen, slik at cellene produserer normalt og funksjonelt dystofin.
Det tilbys stadig mer persontilpasset medisinsk behandling. Helse- og omsorgsdepartementet har for 2015 gitt Helsedirektoratet i oppdrag å utarbeide en nasjonal strategi for persontilpasset medisin. Den nasjonale strategien skal blant annet basere seg på rapport fra nasjonal utredning om persontilpasset medisin i helsetjenesten, gjennomført av de regionale helseforetakene i 2014. Persontilpasset medisin kan gi økt nytte for pasienten i form av raskere og mer presis diagnostikk og bedre muligheter for individuelt tilpasset behandling med bedre effekt og færre bivirkninger.
Avansert terapi
Avanserte terapiprodukter (ATMP) omfatter genterapi, celleterapi og vevsterapi, og kan gi banebrytende ny og effektiv behandling for en rekke sykdommer og skader slik som kreft, nevrologiske sykdommer og brannskader.
Genterapi innebærer overføring av nytt genetisk materiale til mennesker, for eksempel for å reparere eller kompensere for et defekt gen i en bestemt type celler. Celleterapi betyr at celler blir gitt til mennesker for å behandle sykdom ved hjelp av cellenes farmakologiske, immunologiske eller metabolske virkemekanismer. Vevsterapi er celler eller vev som blir gitt til mennesker for å reparere eller erstatte humant vev eller organ.
Gen-, celle- og vevsterapi regnes som legemidler og de må få markedsføringstillatelse før de kan tas i bruk. Kravet om markedsføringstillatelse begrunnes med behovet for å sikre god og trygg behandling samt fremme lik tilgang til disse behandlingsformene for alle pasienter i EØS-området. Det er imidlertid mulighet for fritak fra krav om sentral godkjenning for å sikre fleksibiliteten for enkelte sykehusmiljø som utvikler nye behandlingsformer av mer eksperimentell karakter. Dette såkalte sykehusunntaket gjelder for preparat som ikke brukes rutinemessig. I Norge må slike unntak godkjennes av Legemiddelverket.
Siden forordningen for avanserte terapiprodukter trådte i kraft i 2009 har det vært 14 søknader om markedsføringstillatelse. Fem former for avansert terapi har blitt godkjent. De kommende to årene er det forventet 14 nye søknader. Det er en omfattende forskningsaktivitet på området. I perioden 2004–2010 var det 318 kliniske utprøvninger for 250 ulike former for avansert terapi registrert. Celleterapi og vevsterapi utgjør den største andelen studier og kreft er den dominerende indikasjonen som studeres. Akademia og små firma står bak de fleste studiene.
Avanserte terapiprodukt kan brukes til å behandle sykdommer som tidligere ikke hadde noen behandling. Et eksempel er genterapiproduktet Glybera, som ble godkjent i 2012, der en kan kompensere for manglende evne til å produsere enzym som bryter ned fettstoff i blodet. Det brukes da et virus som budbringer, for å få det funksjonelle genet inn i muskelceller slik at disse kan produsere enzymet. Til behandling av dårlig kne kan det dyrkes ny brusk basert på pasientens egne celler. Dette er eksempel på vevsterapi som allerede er godt etablert med to godkjente preparat på markedet. Eksempel på celleterapi er immunceller som tas ut av kroppen og manipuleres, slik at de kjenner igjen kreftceller, og så settes inn igjen for å stimulere immunsystemet til å kjempe mot kreftcellene. Det er godkjent et produkt av denne typen celleterapi (Provenge ble godkjent i 2013), og en rekke slike behandlingsformer er under utvikling. Det første produktet basert på stamceller ble godkjent i 2014 (Holoclar), og er en behandling for øyeskader. Flere slike produkt basert på stamceller er under utvikling. Mange av pasientene som får behandling med avansert terapi i Norge i dag inngår i kliniske studier ved universitetssykehus eller blir behandlet under sykehusunntaket.
4 Aktører i legemiddelmarkedet
Det er mange aktører i legemiddelmarkedet. De viktigste er pasientene, legemiddelindustrien, forskrivere og annet helsepersonell, apotek og myndighetene. Dette kapittelet gir en kort oversikt over de viktigste aktørene og hvilke oppgaver de har i dag.
4.1 Pasienter og brukere
Regjeringen vil skape pasientens helsetjeneste, og legge til rette for at pasienter og brukere bedre kan mestre et liv med sykdom. Norge var tidlig ute med å lovfeste brukermedvirkning, og brukermedvirkning er nå nedfelt i både pasient- og brukerrettighetsloven og i helse- og omsorgstjenesteloven.
I pasient- og brukerrettighetsloven § 3-1 heter det at:
«Pasient og bruker har rett til å medvirke ved gjennomføring av helse- og omsorgstjenester. Pasienten har herunder rett til å medvirke ved valg mellom tilgjengelige og forsvarlige undersøkelses- og behandlingsmetoder. Medvirkningens form skal tilpasses den enkeltes evne til å gi og motta informasjon.»
Brukermedvirkning skjer, både i møtet mellom helsepersonell og enkeltpasienter og på et mer overordnet nivå ved at pasientforeninger deltar i planprosesser, evaluering av tjenester, brukerråd, kvalitetsutvalg mv.
I Meld. St. 26 (2014–2015) Fremtidens primærhelsetjeneste – nærhet og helhet omtales brukermedvirkning i kapittel 12, og det pekes på at det er et stort potensial for forbedring, særlig når det gjelder å styrke brukernes kunnskap og å styrke kommunikasjon mellom brukere og helsepersonell. Likemannsarbeid og pårørende trekkes også fram.
Samtidig med at brukermedvirkning har blitt en rettighet har rollene til både pasienter, brukere og helsepersonell endret seg. For en generasjon eller to siden, fikk medisinstudentene høre at de ikke skulle informere pasientene fordi de skulle skåne dem for unødvendig engstelse og misforståelser. Dette var på mange måter en patriarkalsk holdning. Legene mente at mesteparten av informasjonen var faglitteratur, som var skrevet på en måte som krevde medisinsk bakgrunn, og som de færreste av pasientene hadde forutsetninger for å kunne forstå. Det var derfor en stor risiko for at pasientene ville bli mer forvirret enn opplyst, av å få denne informasjonen.
Framveksten av informasjonssamfunnet og en høyt utdannet befolkning har ført til at det er umulig å unngå at innbyggerne får tak i informasjon om legemidler. I 1984 ble Felleskatalogen tillatt solgt til allmennheten. I dag har pasienter, brukere og helsepersonell tilgang til omfattende informasjon om legemidler gjennom internett. Det kan imidlertid være vanskelig å sortere, tolke og utnytte informasjonen som er tilgjengelig.
For å skape pasientens helsetjeneste må det arbeides med kunnskapsformidling og informasjonssystemer som gjør innbyggerne i stand til å fatte gode beslutninger om egen helse.
Legemiddelbruk og utfordringene knyttet til uheldig legemiddelbruk tas opp i kapittel 5.3. Videre er en rekke av virkemidlene som foreslås i kapittel 7, rettet inn mot å gi pasienter bedre muligheter for brukerinnflytelse samt følge opp behandlingen og mestre livet med sykdom.
4.2 Legemiddelindustrien
Legemiddelindustriens viktigste rolle er å utvikle, produsere, markedsføre og selge legemidler. Utvikling og produksjon av legemidler er omtalt i kapittel 3.
Legemiddelindustrien markedsfører egne produkt og informerer på ulike måter om legemidler, for eksempel gjennom Felleskatalogen. Legemiddelindustrien bidrar på ulike måter til å nå flere av de legemiddelpolitiske målene. For det første ved å utvikle legemidler som er nye behandlingsformer, og dermed gi muligheter til god kvalitet ved behandlingen, deretter ved at de følger kvalitetskrav for utvikling og produksjon av legemidler, som også sikrer god kvalitet.
Legemiddelindustrien er i praksis global, og den er stadig i endring. I HelseOmsorg21-strategien omtales et globalt paradigmeskifte, hvor forskning og innovasjon nå ofte skjer i mindre selskap, framfor i de større internasjonale farmasøytiske selskapene. Mange nye virkestoff er oppdaget og forsket fram av mindre legemiddelfirmaer, gjerne med utspring i akademiske forskningsmiljø. I mange tilfeller skjer videreutvikling, produksjon og markedsføring i partnerskap med et av de store internasjonale legemiddelfirmaene. Parallelt skalerer en del av de større internasjonale legemiddelselskapene ned sin legemiddelutvikling i preklinisk fase og inngår partnerskap med disse mindre selskapene. Dette viser at grunnforskning og preklinisk forskning er en viktig premiss for videre innovasjon.
Legemiddelindustri i Norge
I Norge finnes det et 40-talls forskningsintensive små og mellomstore virksomheter som har som mål å utvikle nye legemidler.
Utvikling av nye legemidler er krevende både kunnskapsmessig, økonomisk og regulatorisk. For å få markedsføringstillatelse er det helt avgjørende at dokumentasjon av kvalitet, sikkerhet og effekt er akseptabel for legemiddelmyndighetene. For å legge til rette for at mindre selskap skal greie å tilfredsstille de regulatoriske kravene, er det hensiktsmessig med regulatorisk veiledning, dette omtales i kapittel 23. Dette kan bidra til å styrke innovasjonsevnen i Norge, jf. målsettingen om å legge til rette for innovasjon.
Boks 4.1 Xofigo
Xofigo (Radium-233) er et legemiddel som har blitt utviklet i Norge for pasienter med kastrasjonsresistent prostatakreft og spredning til skjellettet. Legemidlet har utspring i kreftforskning fra Oslo universitetssykehus og Universitetet i Oslo og ga i 1997 opphav til etableringen av selskapet Algeta. I 2006 ble Algeta børsnotert i Oslo. I 2009 gikk de inn i et strategisk partnerskap med Bayer for å utvikle og markedsføre Xofigo globalt. Våren 2014 overtok Bayer AS 98,2 pst. av aksjene i Algeta. Selskapet ble da priset til 17,6 milliarder kroner. I februar 2015 avgjorde beslutningsforum for nye metoder at Xofigo kan innføres til behandling ved kastrasjonsresistent prostatakreft med symptomgivende benmetastaser. Produksjonen av Xofigo skjer på institutt for energiteknikk (IFE) på Kjeller.
I følge Legemiddelindustrien (LMI) er i underkant av 700 ansatte i medlemsbedriftene sysselsatt innen forskning og utvikling, mens det totale sysselsettingstallet for LMIs medlemsbedrifter er om lag 3800 personer.
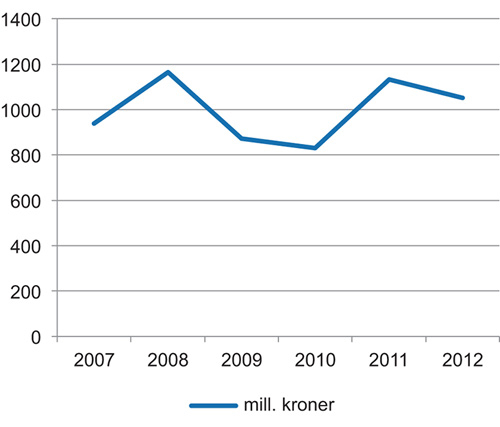
Figur 4.1 Legemiddelindustriens investeringer i FOU i Norge 2007–2012
Kilde: LMI
LMI opplyser at industrien investerte om lag 30 mrd. Euro i forskning og utvikling i Europa og over 40 mrd. Euro i USA. Industrien sysselsetter mer enn 650 000 mennesker i Europa.
Markedsføring og informasjon
Legemiddellovgivningen definerer hva som er legemiddelreklame og hvordan reklamen skal utformes. Reklamen er regulert for å sikre at den er balansert og bidrar til rasjonell bruk av legemidler.
Helsepersonelloven og forskrift om gaver m.v. til helsepersonell slår fast at helsepersonell ikke må ta i mot gave, provisjon, tjeneste eller annen ytelse som er egnet til å påvirke helsepersonells tjenstlige handlinger på en utilbørlig måte. Forholdet mellom helsepersonell og legemiddelindustri er omtalt i lovens forarbeider, se Ot.prp. nr. 13 (1998–99) Om lov om helsepersonell m.v. s. 64–65.
LMI har interne bransjeregler som slår fast at legemiddelfirmaer bare kan invitere personell som kan motta reklame for reseptpliktige legemidler. LMI har også inngått en avtale med Legeforeningen om retningslinjer for samarbeid og samhandling. Hensikten er å bidra til at samhandling mellom leger og legemiddelindustrien skjer på en troverdig og tillitvekkende måte.
Legemiddelindustrien har nettsider med informasjon til pasienter og helsepersonell. Nettsider for helsepersonell skal være merket med beregnet for helsepersonell. Noen legemiddelprodusenter tilbyr også pasientskoler og helse-app’er knyttet til sine legemidler.
Felleskatalogen er et heleid datterselskap av LMI. Selskapet utgir Felleskatalogen, som er et oppslagsverk over legemidler som er markedsført i Norge, både humane og veterinære. Tekstene er sammendrag av preparatomtalene. Katalogen finnes i papirversjon, og har nettsider med ca. 9000 unike besøkende hver dag. Felleskatalogen tilbys også som app til nettbrett og smarttelefoner, og er integrert i Helsebibliotekets søk og på helsenorge.no. Legemiddelindustriens rolle i informasjonsarbeidet er nærmere omtalt i kapittel 10.
4.3 Helsepersonell
Et av de viktige virkemidlene for å oppnå god kvalitet ved behandling med legemidler er å sørge for gode utdanninger for alle typer helsepersonell. I denne meldingen går vi ikke inn på selve utdanningene, men viser til Meld. St. 26 (2014–2015). Fremtidens primærhelsetjeneste – nærhet og helhet. Helsetjenesten er personellintensiv og tjenestenes kvalitet er avhengig av personellets kvalifikasjoner, kunnskap og holdninger.
De helsepersonellgruppene som har forskrivningsrett er viktige når det er snakk om legemiddelbruk, det samme gjelder personellgrupper som leverer ut legemidler til pasienter og farmasøyter, som har spisskompetanse på legemidler.
Forskrivere
Rekvirering omfatter ordinering av legemidler til egen praksis, helseinstitusjon og pasient. Det er bare leger og tannleger som kan rekvirere reseptbelagte legemidler (helsepersonelloven § 11). I tillegg kan departementet bestemme ved forskrift at annet helsepersonell kan få begrenset rekvireringsrett. Veterinærer kan rekvirere reseptbelagte legemidler til dyr (dyrehelsepersonelloven § 17).
Begrenset rekvireringsrett innebærer at annet helsepersonell enn leger og tannleger får adgang til å forskrive nærmere angitte legemidler.
Forskrift om rekvirering og utlevering av legemidler fra apotek kapittel 2 har bestemmelser om rett til rekvirering.
Eksempler på begrenset rekvireringsrett er at farmasøyter kan rekvirere legemidler til farmasøytiske avdelinger ved sykehus og helsesøstre og jordmødre kan rekvirere vaksiner til godkjente vaksinasjonsprogram og alle hormonelle prevensjonsmidler til kvinner fra 16 år (det siste trer i kraft 1. januar 2016).
Helsepersonell som rekvirerer legemidler forvalter både pasientens interesser og store offentlige ressurser. Hovedkravet til slik rekvirering er at den må være forsvarlig, jf. helsepersonelloven § 4.
Fastlegen har flere oppgaver når det gjelder oppfølging av legemiddelbruk for pasienter som bor hjemme. I henhold til fastlegeforskriften § 25 skal fastlegen koordinere legemiddelbehandlingen til innbyggerne på listen. Når fastlegen endrer eller får informasjon om at legemiddelbehandlingen er endret, skal legemiddellisten oppdateres.
Listeinnbyggere skal få oppdatert legemiddelliste etter hver konsultasjon hos fastlegen hvis legemiddelbruken er endret. For listeinnbyggere som bruker fire legemidler eller mer, skal fastlegen gjennomføre en legemiddelgjennomgang når dette anses nødvendig ut fra en medisinsk vurdering.
Fastlegen skal gi en oppdatert legemiddelliste til andre tjenesteytere i helse- og omsorgstjenesten dersom dette er nødvendig for å gi et forsvarlig tilbud til listeinnbyggeren.
Pleiepersonell
Pleiepersonell har en viktig rolle når det gjelder å sørge for riktig utlevering av legemidler. I tillegg har de en viktig rolle i å observere og følge opp pasientenes legemiddelbruk. Legemiddelhåndteringsforskriften for virksomheter og helsepersonell som yter helsehjelp, fra 2008, er revidert per 1. januar 2015. I denne revisjonen er det tatt hensyn til utfordringen med mangelfull informasjon om pasientens legemiddelbruk ved overflytting mellom virksomheter, og det er stilt krav til at virksomhetsleder skal sørge for internkontrollsystem.
Helsedirektoratet har utarbeidet er nytt rundskriv (IS 7/2015) til forskriften, som inneholder en detaljert beskrivelse av hvordan forskriften skal forstås, samt en veiledning som gir råd og praktiske eksempler på gode rutiner. Håndtering av legemidler er nærmere omtalt i kapittel 12.
Farmasøyter
Farmasifaget dekker kunnskap knyttet til legemidler og legemiddelbruk. Farmasøytisk kunnskap er sentral i apotekvesenet og i andre sammenhenger der det er nødvendig å veilede og følge opp bruken av legemidler. Kunnskapen inngår også i et bredt spekter av forskningsområder og danner grunnlaget for farmasøytisk industri.
Farmasøyter er ansatt i hele helsesektoren, i offentlig forvaltning, i undervisning og i forskning. Majoriteten av farmasøyter arbeider i apotek, og sørger daglig for at pasientene får de legemidlene som legene har forskrevet. Farmasøyter har også sentrale roller i legemiddelindustrien. Kliniske farmasøyter, primært på sykehus, bidrar i tverrfaglige team sammen med behandlende lege for å sikre at legemiddelbehandlingen blir optimal for den enkelte pasient.
Boks 4.2 Farmasiutdanningene i Norge
Norge har fem lærersteder som tilbyr farmasiutdanning. Universitetet i Oslo og Universitet i Bergen har et 5-årig integrert masterprogram. Universitetet i Tromsø har et treårig bachelor og et toårig masterprogram. Høgskolene i Nord-Trøndelag og Oslo- og Akershus har et treårig bachelorprogram, mens NTNU tilbyr et toårig masterprogram.
Det treårige bachelorprogrammet kvalifiserer til autorisasjon som reseptarfarmasøyt, mens masterprogrammet kvalifiserer til autorisasjon som provisorfarmasøyt. Bare mastergraden oppfyller kravene til artikkel 44 av direktiv 2005/36/EC, og som i europeisk og i internasjonal sammenheng tilsvarer det engelske begrepet pharmacist.
En erfaringsbasert master i klinisk farmasi ble opprettet ved UiO høsten 2009. UiO har nå avsluttet den erfaringsbaserte masteren, og i stedet opprettet en ny spesialisering i klinisk farmasi innenfor rammen av den 5-årige mastergraden i farmasi.
Tverrfaglig samarbeid er lagt inn i de fleste studieplanene, og de fleste nyutdannede farmasøyter har fått trening i legemiddelsamtale, legemiddelsamstemming og legemiddelgjennomgang. Det er også et økende fokus på å oppdage og håndtere legemiddelrelaterte problemer for å sikre riktig legemiddelbruk.
Det er behov for å vurdere hvordan farmasøytenes kompetanse best kan benyttes for å gjøre kvaliteten på legemiddelbehandlingen enda bedre.
Apotekteknikere
Apotektekniker er en fagutdanning fra videregående skole. Apotektekniker assisterer farmasøytene i apoteket, og har oppgaver i forbindelse med reseptekspedisjon, service og kundekontakt, informasjon til publikum, varebehandling og kontorarbeid. Apotekteknikere har ikke rett til selvstendig å ekspedere legemidler etter resept eller rekvisisjon.
4.4 Apotek
Et apotek selger legemidler, i noen tilfeller lager de også legemidler. Apotekenes virksomhet er regulert i apotekloven. Apotekloven skal sikre forsvarlig utlevering av legemidler til sluttbruker. Den skal bidra til riktig legemiddelbruk og sikre at alle deler av landet har tilgang til legemidler og farmasøytiske tjenester, som har god kvalitet og rimelig pris.
I henhold til formålsbestemmelsen kan apotekenes hovedvirksomhet kategoriseres i to deler; det første er å ha en effektiv og sikker distribusjon og utlevering av legemidler. Dette bidrar til at målet om likeverdig og rask tilgang til legemidler kan oppnås. Disse oppgavene og videreutvikling omtales i kapittel 18.
Den andre oppgaven er knyttet til å medvirke til riktig legemiddelbruk gjennom veiledning av brukere og pasienter. Apotekansatte har en nøkkelrolle i formidlingen av legemiddelinformasjon. De møter brukerne ansikt til ansikt, og apotekenes legemiddelkompetanse er tilgjengelig i apotek over hele landet. Brukerne trenger ingen timeavtale for å få informasjon om legemidlene sine, stille spørsmål eller diskutere legemiddelrelaterte problemer. Videreutvikling av disse oppgavene omtales i kapittel 7.1.4.
4.5 De regionale helseforetakene og kommunene
Både de regionale helseforetakene og kommunene er aktører i legemiddelmarkedet. En stor del av forskrivning og bruk av legemidler foregår innenfor disse virksomhetene.
Legemiddelhåndteringsforskriften for virksomheter og helsepersonell som yter helsehjelp stiller krav til virksomhetene. Legemiddelhåndtering er omtalt i kapittel 12. Forsvarlig legemiddelhåndtering er viktig for å sikre at pasientsikkerheten ivaretas og at behandlingen kan ha god kvalitet.
Informasjon og opplæring
I spesialisthelsetjenesten er det etablert lærings- og mestringstilbud ved alle helseforetakene. I den kommunale helse- og omsorgstjenesten er lærings- og mestringstilbud i en oppbyggingsfase. Organiseringen av kommunale lærings- og mestringstilbud varierer. De kan for eksempel være knyttet til egne lærings- og mestringssentre eller frisklivssentraler, frisklivs- og mestringssentre, lokalmedisinske sentre eller helsehus. Mange helseforetak og kommuner samarbeider om lærings- og mestringstilbud, som et ledd i å bidra til gode og helhetlige pasientforløp.
Ved langvarige helseutfordringer kan bekymringer, praktiske utfordringer og lite kunnskap om egen sykdom forverre situasjonen og gi redusert livskvalitet. Lærings- og mestringstilbud skal gi pasienter og pårørende bedre innsikt i egen situasjon, slik at de kan mestre hverdagen bedre. I tillegg til medisinske forhold, tas forholdet til jobb, familie og venner opp. Gjennom likeverdig samarbeid mellom fagpersoner og brukerrepresentanter, sikrer lærings- og mestringstilbudene at pasientenes og de pårørendes behov er i sentrum, jf. Meld. St. 26 (2014–2015) Fremtidens primærhelsetjeneste – nærhet og helhet.
4.6 Forvaltningen
Forvaltningen har oppgaver knyttet til å utstede markedsføringstillatelse for legemidler, som omtalt i kapittel 3.2. Forvaltningen har oppgaver og virkemidler som skal bidra til å nå alle målene som er fastsatt i kapittel 2. Det er Helse- og omsorgsdepartementet som har det overordnede ansvaret, men flere etater har viktige oppgaver.
4.6.1 Statens legemiddelverk
Statens legemiddelverk er fagetat for legemidler, og har ansvar knyttet til godkjenning av legemidler, herunder vurdere søknader om markedsføringstillatelse og vurdere søknader om klinisk utprøving av legemidler. Legemiddelverket har ansvar for å forvalte regelverket for forsyningskjeden for legemidler, herunder gi tillatelse til tilvirkning, import, grossistvirksomhet, inn- og utførsel samt omsetning av legemidler. Legemiddelverket har ansvar for å fastsette priser på reseptbelagte legemidler, for å vurdere refusjon over blåreseptordningen og utføre metodevurderinger av legemidler som finansieres av de regionale helseforetakene. Videre har Legemiddelverket ansvar for legemiddelovervåkning og fører tilsyn med produsenter, grossister, apotek, kliniske utprøvinger og reklame. Sist men ikke minst har Legemiddelverket informasjons- og veiledningsoppgaver. Disse vil bli nærmere omtalt nedenfor. Legemiddelverket har ansvar for virkemidler som til sammen skal bidra til å nå alle de legemiddelpolitiske målene som er omtalt i kapittel 2.
Informasjon om legemidler
Når et legemiddel får markedsføringstillatelse, godkjenner Legemiddelverket samtidig et pakningsvedlegg og en preparatomtale (SPC), som oppsummerer den kunnskapen som godkjenningen av legemidlet er basert på. Informasjonen i pakningsvedlegget er rettet mot pasient, og informasjonen i SPC er rettet mot helsepersonell. Disse dokumentene er også juridiske rammer for produsentenes markedsføring.
Legemiddelverket publiserer legemiddelanmeldelser for nye legemidler. Her vurderes nytten og risikoen av det nye legemidlet opp mot eksisterende behandling. Anmeldelsene publiseres på Legemiddelverkets nettside og i Nytt om legemidler i Tidsskriftet for den norske legeforening.
Det europeiske legemiddelbyrået publiserer informasjon om legemidler som godkjennes gjennom sentral prosedyre, som beskrevet i kapittel 3. Der finnes også utredningsrapporter som beskriver vurderingene som ligger til grunn for godkjenningen.
Legemiddelverket har utviklet elektronisk forskrivnings- og ekspedisjonsstøtte (FEST). For nærmere omtale av FEST, se kapittel 7.2.1.
Legemiddelverket publiserer løpende informasjonssaker på nett og i sosiale medier, knyttet til legemidlers kvalitet, sikkerhet, effekt og tilgjengelighet.
4.6.2 Helsedirektoratet
Helsedirektoratet er et forvaltningsorgan som er ansvarlig for å iverksette vedtatt politikk på vegne av regjering og Storting, og forvalte eksisterende lovverk.
Helsedirektoratet er også faglig rådgiver med ansvar for å følge med på forhold som påvirker folkehelsen og utviklingen i helse- og omsorgstjenestene. Direktoratet skal sammenstille kunnskap og erfaringer og opptre nasjonalt normerende på ulike områder. Helsedirektoratet er et kompetanseorgan, som opptrer som en selvstendig og uavhengig rådgiver.
Helsedirektoratet har et lovfestet ansvar for å utvikle, formidle og vedlikeholde nasjonale faglige retningslinjer og veiledere. Det finnes per i dag 50 nasjonale faglige retningslinjer og om lag 120 veiledere. Nasjonale faglige retningslinjer skal bidra til god kvalitet, riktige prioriteringer og hindre uønsket variasjon i tjenesten. Mange av retningslinjene inneholder ikke spesifikk informasjon om legemidler, men de angir når behandling med legemidler er relevant, sammenliknet med forebygging og andre behandlingsformer.
Direktoratet har utarbeidet flere veiledere som er relevante for riktig legemiddelbruk, som for eksempel veileder for riktig legemiddelbruk for eldre og veileder for hvordan legemiddelgjennomganger bør gjennomføres.
Direktoratet har ansvar for e-helse, herunder e-resept og kjernejournal. Videre er direktoratet sekretariat for nasjonalt system for innføring av nye metoder i spesialisthelsetjenesten og sekretariat for pasientsikkerhetsprogrammet. Helseøkonomiforvaltningen (HELFO) er direktoratets ytre etat som blant annet behandler søknader om individuell refusjon og forvalter bidragsordningen.
Helsedirektoratet er sekretariat for nasjonalt system for innføring av nye metoder i spesialisthelsetjenesten. Helsedirektoratet skal også utvikle tiltak for å monitorere, evaluere og informere om bruken av nye metoder.
Helsedirektoratet etablerte i 2011 nettportalen helsenorge.no. Helsenorge.no tilbyr kvalitetssikret informasjon om sykdommer, behandling, helseråd og tjenester i helsevesenet. Min helse på helsenorge.no gir pasienten innsyn i egne helseopplysninger, og vil over tid gi pasienten mulighet til å kommunisere digitalt med helsetjenesten.
4.6.3 Nasjonalt kunnskapssenter for helsetjenesten
Kunnskapssenteret oppsummerer forskning, gjennomfører helseøkonomiske analyser, måler kvalitet på utvalgte tjenester, arbeider for bedre pasientsikkerhet, fremmer bruk av forskningsresultater, utvikler metoder og underviser. Kunnskapssenteret utfører også fullstendige metodevurderinger på legemidler i system for nye metoder i spesialisthelsetjenesten.
Informasjon om legemidler
Et av de sentrale virkemidlene for informasjon og veiledning som Kunnskapssenteret drifter er Helsebiblioteket. Helsebiblioteket.no er et offentlig finansiert nettsted som gir helsepersonell og nettbrukere gratis tilgang til en rekke sentrale kunnskapskilder. Det meste av innholdet er fritt tilgjengelig for alle innbyggere i Norge, mens noe innhold er begrenset til helsepersonell og ansatte i helsetjenesten.
Formålet med Helsebiblioteket er å heve kvaliteten på helsetjenestene ved å tilby fri tilgang til nyttig og pålitelig kunnskap. Helsebiblioteket kjøper tilgang til lisensbelagte ressurser som oppslagsverk, databaser og tidsskrifter. I tillegg tilbyr helsebiblioteket en tjeneste for klinikere og beslutningstakere i helsetjenesten der de kan sende inn spørsmål om effekt av tiltak og få hjelp til å finne oppsummert forskning som belyser spørsmålet. Helsebiblioteket publiserer også norske retningslinjer, veiledere, fagprosedyrer og annet stoff som utvikles av det offentlige.
Helsebiblioteket bidrar til å redusere dobbeltarbeid, til kvalitetsforbedring og til deling og åpenhet i helsevesenet.
På helsebiblioteket.no er det lenker til kvalitetsvurdert og sentral legemiddelinformasjon. Helsebiblioteket har også utviklet et spesialsøk for legemiddelinformasjon, som henter informasjon fra FEST, Norsk legemiddelhåndbok, Felleskatalogen, HELFO, regionale legemiddelinformasjonssentre (RELIS), Micromedex, UpToDate med Lexicomp med mer.
Boks 4.3 British National Formulary for Children
British National Formulary for Children (BNFC) er et oppslagsverk som tilbyr praktisk informasjon om bruk av legemidler, også om off-label bruk, fra fødsel til pubertet. BNFC er fritt tilgjengelig gjennom helsebiblioteketet.no, og finansieres av Nasjonalt kompetansenettverk for legemidler til barn. Det internasjonale legemiddeloppslagsverket Micromedex Solutions er fritt tilgjengelig for alle i Norge gjennom Helsebiblioteket. Lexicomp er et oppslagsverk om legemidler som er integrert i det medisinske oppslagsverket UpToDate.
4.6.4 Kontaktpunkt for tverretatlig legemiddelinformasjon
Kontaktpunktet for tverretatlig legemiddelinformasjon ble etablert i 2006, som en oppfølging av forslaget i legemiddelmeldingen som ble lagt fram i 2005 (St.meld. nr. 18 (2004–2005)). I dag består kontaktpunktet av representanter fra Statens legemiddelverk, Helsedirektoratet og Kunnskapssenteret. I tillegg har kontaktpunktet en referansegruppe bestående av representanter fra Nasjonalt folkehelseinstitutt, Norsk legemiddelhåndbok for helsepersonell, RELIS, Kollegabasert terapiveiledning og Legemiddelinnkjøpssamarbeidet (LIS).
Målsettingen for kontaktpunktet er å sikre god og effektiv informasjon om riktig bruk av legemidler, både medisinsk og samfunnsøkonomisk, og sikre at ressursene som de offentlige institusjonene bruker på informasjon blir godt utnyttet.
Kontaktpunktet har blant annet utført utredningsoppdrag i forbindelse med utarbeidelsen av denne meldingen.
4.6.5 Folkehelseinstituttet
Folkehelseinstituttet er et statlig forvaltningsorgan underlagt Helse- og omsorgsdepartementet. Instituttet er en nasjonal kompetanseinstitusjon på følgende fagområder:
smittevern,
psykisk og fysisk helse,
miljøfaktorer, rusmidler, tobakk, ernæring, fysisk aktivitet og andre forhold som påvirker helsetilstanden og ulikhet i helse,
helsefremmende og forebyggende tiltak i befolkningen,
internasjonal helse og
rettsmedisin.
Folkehelseinstituttet skal først og fremst levere kunnskap om folkehelse og rettssikkerhet. Kunnskapen understøtter instituttets aktiviteter når det gjelder beredskap, rådgivning, helseanalyse, forskning og tjenester.
Folkehelseinstituttet har ansvar for legemiddelepidemologi, drift av reseptregisteret og et WHO-senter for klassifikasjon av legemidler. Reseptregisteret omtales nærmere i kapittel 8.
Instituttet er fagetat når det gjelder vaksiner. Behov for bedre system for vurdering av vaksiner omtales kapittel 19.6.
Instituttet har også ansvar for Giftinformasjonen, som er det nasjonale rådgivnings- og kompetanseorganet på akutte forgiftninger og forgiftningsfarer. Kjerneoppgaven er en døgnåpen telefontjeneste, som årlig mottar i underkant av 40 000 henvendelser. Rundt 40 pst. eller 16 000 henvendelser dreier seg om legemidler. Rundt 2/3 av henvendelsene kommer fra allmennheten, 1/3 fra helsetjenesten. Som et ledd i sin informasjonstjeneste overfor helsetjenesten, publiserer Giftinformasjonen behandlingsanbefalinger ved ulike forgiftninger i et eget emnebibliotek på helsebiblioteket.no. Giftinformasjonen utarbeider også en antidotliste med anbefaling av lagerhold av antidoter ved norske sykehus. Giftinformasjonen har pasientrettet informasjon på helsenorge.no. I tillegg utarbeides og distribueres brosjyremateriell og annen skriftlig informasjon.
4.6.6 Tilsynsmyndighetene
Tilsynsmyndighetene består av Statens helsetilsyn og fylkesmennene. Statens helsetilsyn er overordnet faglig tilsynsorgan. Fylkesmannen er tillagt myndighet til å føre tilsyn med helse- og omsorgstjenesten og er da direkte underlagt Statens helsetilsyn.
Tilsynsmyndighetene fører tilsyn med hvorvidt tjenesten leverer i henhold til regelverket, herunder forsvarlighetskravet. Tilsynsmyndighetene er en viktig aktør når det gjelder å avdekke og dokumentere mangler i tjenesten. Tilsynsmyndighetens klagebehandling, tilsyn og rådgivning skal blant annet medvirke til at befolkningens behov for tjenester ivaretas og at svikt i tjenestene forebygges, avdekkes og følges opp.
4.7 Andre aktører som utarbeider og formidler kunnskap om legemidler
Noe av det viktigste for å sørge for god kvalitet ved behandling med legemidler er at alle aktører som er involvert har relevant kunnskap om legemidlene og hvordan de bør brukes. I dette avsnittet gir vi en oversikt over andre aktører enn de som er omtalt i kapittel 4.6. I tillegg til disse aktørene lager profesjonsforeninger, bransjeforeninger og pasientforeninger informasjon og veiledere som brukes i helsevesenet. Mange pasientforeninger gjør en stor innsats med opplæring. Informasjonen de benytter er i mange tilfeller laget i samarbeid med Legeforeningen og med støtte fra legemiddelindustrien. Forslag til forbedring av kunnskap og informasjon om legemidler omtales i del III av meldingen.
Legemiddelhåndboken
Norsk legemiddelhåndbok for helsepersonell fullfinansieres over statsbudsjettet og er en oppslagsbok om behandling med legemidler. Den retter seg hovedsakelig mot allmennlegepraksis og sykehjemsleger. Det er derfor lagt særlig vekt på tilstander som behandles i primærhelsetjenesten.
Legemiddelhåndboken utgis i papirversjon, har egen nettside og tilbys som app til smarttelefoner og nettbrett. Nettsiden til legemiddelhåndboken er søkbar via Helsebiblioteket.
RELIS
RELIS, regionale legemiddelinformasjonssentre, er en del av helseforetakssystemet, og driften er lagt til universitetssykehusene. Legemiddelverket har en sentral rolle i styringen av sentrene. RELIS er etablert for å bidra til rasjonell og riktig legemiddelbruk gjennom produsentuavhengig legemiddelinformasjon. RELIS tilbyr en spørsmål- og svartjeneste der helsepersonell kan stille spørsmål om legemiddelbruk hos pasienter. Informasjonssentrene har en felles hjemmeside (relis.no) der de publiserer nyheter og problemstillinger. Hjemmesiden gir tilgang til spørsmål-svar databasen (relis.no/database). Den er beregnet for helsepersonell.
RELIS har også to nettbaserte veiledningstjenester for publikum. Trygg Medisin og Trygg mammamedisin, og tilbyr individuell rådgivning i legemiddelbruk.
Boks 4.4 Trygg mammamedisin
Trygg Mammamedisin (tryggmammamedisin.no) er en nettbasert tjeneste der gravide og ammende kan stille spørsmål om legemidler. Målgruppen for tjenesten er friske personer som har behov for utdypende informasjon om legemidler ved graviditet og amming. Tjenesten ble startet i juni 2011 av RELIS, og vel 8000 spørsmål er besvart ved utgangen av april 2015. De legemidlene det ble spurt hyppigst om i 2014 var paracetamol, ibuprofen og cetirizin. Svar formidles innen 2 virkedager, henvender er anonym og tjenesten er gratis. Spørsmålene besvares av farmasøyter og leger tilknyttet universitetssykehusene i Tromsø, Bergen, Trondheim og Oslo. Helse Bergen ved RELIS Vest er driftsansvarlig og innehar konsesjon fra Datatilsynet for driften av tjenesten.
RELIS har også en viktig rolle i bivirkningsovervåkingen, ved at de mottar bivirkningsmeldinger, vurderer årsakssammenhenger og gir tilbakemeldinger til legene. Sammen med bivirkningsrapportering fra EU-landene og WHO gir dette grunnlag for oppdatert informasjon om legemidler.
Norsk Elektronisk Legehåndbok og Norsk Helseinformatikk (nhi.no)
Norsk Elektronisk Legehåndbok (NEL) er et medisinsk oppslagsverk som gir beslutningsstøtte i diagnostikk og behandling. NEL er et abonnementsprodukt som 95 pst. av norske allmennleger abonnerer på. Det samme gjør en rekke sykehus, universiteter, høgskoler og kommuner. Innholdet oppdateres fortløpende og kvalitetssikres av nærmere 200 fagpersoner fra helse- og omsorgstjenesten og utdanningsinstitusjonene. I dag inneholder håndboken om lag 7 000 artikler som omtaler store deler av det medisinske fagfeltet. Pasientrettet informasjon fra NEL finnes fritt tilgjengelig på NHI.no. Denne nettsiden er reklamefinansiert.
5 Helsetilstand og bruk av legemidler
Legemidler er en viktig innsatsfaktor på alle nivåer i helsetjenesten, både til forebygging og behandling. Data fra Reseptregisteret viser at om lag 3,5 millioner nordmenn, 70 pst. av den norske befolkningen, fikk utlevert minst ett legemiddel på resept i løpet av 2014. Legemidler er den vanligste medisinske behandlingsformen i den industrialiserte delen av verden. 60 pst. av konsultasjonene i norsk allmennpraksis resulterer i forskrivning av legemidler.
I tillegg til legemidler på resept kommer bruk av legemidler til innlagte pasienter i sykehus og sykehjem, samt bruk av reseptfrie legemidler, naturlegemidler, naturmidler og kosttilskudd. Legemiddelbruken varierer med alderen: I aldersgruppen 10–14 år fikk omtrent 40 pst. utlevert minst ett legemiddel på resept, blant de over 70 år var tilsvarende tall rundt 95 pst.
5.1 Helsetilstand
I følge folkehelsemeldingen som nylig ble lagt frem, er helsetilstanden i den norske befolkningen svært god. Levealderen er høy og vil sannsynligvis øke framover. De sosiale ulikhetene i levealder har økt, men det er nå tegn på at ulikhetene er i ferd med å flate ut. Den største andelen av tidlig død og tapte kvalitetsjusterte leveår i den norske befolkningen skyldes de ikke-smittsomme sykdommene – som hjerte-karsykdommer, diabetes (type 2), kroniske lungesykdommer og kreft4.
Institute for health metrics and evaluation (IHME) har publisert data vedrørende sykdomsbyrde, som viser at fra 1990 til 2010 er hjertekarsykdommer og trafikkskader betydelig redusert, mens rusmisbruk og Alzheimer er de områdene hvor sykdomsbyrden øker mest.
5.1.1 Smittsomme sykdommer
Alvorlige smittsomme sykdommer er mindre vanlig i Norge enn i de fleste andre land. Denne situasjonen kan imidlertid endre seg. Økt smittepress gjennom internasjonal handel med matvarer og dyr, migrasjon og reising kan få konsekvenser for folkehelsen, også i Norge. Hver 20. pasient i helseinstitusjoner rammes av en sykehusinfeksjon. Om lag 20 000 personer er kroniske bærere av hepatitt B, de fleste er smittet før de kom til Norge. Om lag 20 000 personer er bærere av hepatitt C, de fleste er smittet gjennom sprøyter. Antall nye tilfeller av tuberkulose har økt til om lag 400 tilfeller i året. Antibiotikaresistens er et økende problem.
5.1.2 Ikke smittsomme sykdommer og NCD-strategien
I mai 2012 vedtok Verdens helseforsamling (WHA) målet om å redusere for tidlig død av NCD-sykdommene, dvs. hjerte- og karsykdommer, diabetes, kroniske lungesykdommer og kreft med 25 pst. innen 2025. Norge har sluttet seg til målet. Dette er også bakgrunnen for at Norge i 2013 laget en egen NCD-strategi, der målet er en mer samlet og ensartet innsats på alle nivåer i arbeidet med disse sykdommene, samtidig som det særegne ved den enkelte sykdom ivaretas. Strategien er delt inn i en felles del med felles utfordringer og tiltak, samt en del med spesifikke utfordringer, mål og tiltak for den enkelte sykdomsgruppe.
For å nå målene i strategien er det behov for mange ulike tiltak. Forebyggende tiltak på befolkningsnivå er i stor grad de samme for alle de fire sykdommene. Folkehelsemeldingen adresserer dette. Det er også mange felles utfordringer og løsninger i helse- og omsorgstjenesten, innen forebygging, diagnostisering, behandling og rehabilitering. Det må i sterkere grad enn i dag legges vekt på forebyggende tjenester, opplæring, aktiv oppfølging og gode pasientforløp. Alt for mange går i dag uten å være klar over at de har en sykdom, for eksempel diabetes eller kols. Når risiko og sykdom avdekkes, må brukeren og deres pårørende få opplæring slik at de kan stoppe eller bremse videreutvikling. Personer med etablert sykdom må følges opp i tråd med faglige retningslinjer og de må også få god opplæring slik at de best mulig kan mestre livet med sykdom og forhindre forverring.
5.2 Legemidler i bruk
Helseregistre er en viktig kilde til kunnskap om helsetilstanden i befolkningen og kvaliteten på tjenestene. Opplysninger om legemiddelbruk finnes både i medisinske kvalitetsregistre og sentrale helseregistre. Reseptregisteret som ble etablert i 2004, er den datakilden som har mest fullstendig informasjon om legemiddelbruk på individnivå. System for bivirkningsrapportering er et viktig verktøy for legemiddelovervåkingen og benyttes til å avdekke signaler om bivirkninger som ikke var kjent da legemidlet fikk markedsføringstillatelse. Behovet for registre til forskning, helseanalyser og kvalitetssikring er omtalt i kapittel 8.
5.2.1 Bivirkninger
Bivirkninger er en av utfordringene ved bruk av legemidler. Som nevnt ovenfor er registrering av bivirkninger viktig for å få kunnskap om effekten av legemidler i klinisk praksis, og eventuelt kunne advare visse grupper pasienter mot visse typer legemidler. Nedenfor beskrives to eksempler hvor bivirkningsregistrering og ny kunnskap har ført til endringer i anbefalt forskrivning.
P-piller og risiko for blodpropp
Risikoen for blodpropp ved bruk av p-piller har lenge vært kjent. Tidligere knyttet man risikoen til østrogenkomponenten i pillen. Gestagenkomponentens betydning var ukjent. De første årene etter markedsføring av produkter med det nye gestagenet drospirenon, mottok Legemiddelverket en rekke meldinger om blodpropp, inkludert flere meldinger om lungeemboli og dødsfall.
P-piller med drospirenon ble satt på Legemiddelverkets overvåkingsliste. Basert på data fra bivirkningsregistrering og data som etter hvert kom fra epidemiologiske studier, ble det gitt råd til forskrivere om at de p-pillene som har lavest risiko for blodpropp skal være førstevalg. Rådene førte til en betydelig endring i forskrivningsmønsteret i Norge. Senere har en europeisk gjennomgang av data vist at ulike gestagener i forskjellig grad motvirker østrogenets blodpropprisiko.
Bivirkninger ved overgang fra digitoksin til digoksin
Digitalisglykosider (digitoksin og digoksin) er mye brukt i behandling av hjertesvikt og hjerterytmeforstyrrelser. I Norge var det tradisjon for å bruke digitoksin til voksne og digoksin til barn. Dette var ulikt resten av den vestlige verden, hvor det i hovedsak ble brukt digoksin. Disse to produktene har lik effekt, men fordeles og brytes ned ulikt i kroppen. Spesielt er det viktig å være oppmerksom på at digoksin skilles ut i nyrene, og at dosen derfor må reduseres hos pasienter med nedsatt nyrefunksjon.
Etter en periode med leveringsproblemer ble digitoksin avregistrert i desember 2011. Dette gjorde at alle pasienter som brukte digitoksin måtte byttes over til digoksin.
For digitalisglykosider er det relativt liten forskjell på effektiv dose og en farlig høy dose. Digitoksin ble brukt av svært mange eldre med dårlig nyrefunksjon, og det var dermed stor bekymring for overdosering ved bytte av digitalispreparat.
Legemiddelverket informerte, i samarbeid med helseforetakene, om hvordan bytte skulle foregå. Likevel ble det observert en økning i bivirkningsmeldinger for digitalisglykosider fra 2011 til 2012. Bytte ble en utfordring i klinisk praksis. Det ble gitt informasjon i flere runder, men dette illustrerer hvor viktig informasjon er. I og med at byttet kun var relevant i Norge, illustrerer det at det er behov for et velfungerende system nasjonalt.
5.2.2 Barn
Norske barn har svært god helse i et globalt perspektiv. Tall fra Reseptregisteret viser at i 2014 fikk rundt 494 000 barn og unge 0–17 år (45 pst. av barna i denne aldersgruppen) utlevert ett eller flere legemidler på resept. Andelen brukere er høyest blant ett- og toåringene (rundt 60 pst.) og lavest hos 8–11 åringer (rundt 37 pst.). De legemidlene barn og unge bruker mest er antibiotika, antiastmatika, allergi- og forkjølelsesmidler og øyedråper, noe som også gjenspeiler de diagnosene som settes i allmennpraksis i denne aldersgruppen: astma, allergi, otitt (ørebetennelse), øvre luftveisinfeksjon og konjunktivitt (øyebetennelse).
15–20 pst. av barn og unge mellom 3 og 18 år har nedsatt funksjon på grunn av psykiske plager som angst, depresjon og atferdsproblemer. Omtrent 8 pst. av barn og unge har så alvorlige problemer at det tilfredsstiller kriteriene til en psykisk lidelse. De siste ti årene har det vært en økning i totalbruken av psykofarmaka i aldersgruppen 0–17 år. Økningen gjelder både gutter og jenter. Det vises til kapittel 13.2 for nærmere omtale. Både folkehelsemeldingen og primærhelsetjenestemeldingen omtaler psykisk helse blant barn og unge og her vektlegges det å skape oppvekstvilkår som fremmer psykisk helse, styrke helsestasjonene og skolehelsetjenesten samt videreføre tilskudd til psykologer i kommunene. Det er behov for mer forskningsbasert kunnskap om legemiddelbruk hos barn og unge, særlig når det gjelder psykofarmaka.
5.2.3 Eldre
Den norske befolkningen lever lengre, og selv om det innebærer flere friske leveår, vil en aldrende befolkning også føre til at det blir flere kronisk syke. Sykdommer som tidligere innebar tidlig død, for eksempel type 2-diabetes, hjertesykdommer og kreft, er nå blitt kroniske sykdommer der forekomsten øker med økende alder. Eldre har ofte flere sykdommer samtidig, som sammen påvirker funksjonsevne, livskvalitet og psykisk helse.
I følge Folkehelseinstituttet er legemiddelbruken hos eldre omfattende. I aldersgruppen 65 år eller eldre fikk 92 pst. minst ett legemiddel på resept i 2014. Personer over 65 år utgjør om lag 15 pst. av befolkningen, men bruker nesten halvparten av alle legemidler målt i definerte døgndoser. Gruppen på 65 år og eldre bruker 47 pst. av alle sovemidler og beroligende midler. Denne aldersgruppen bruker også 44 pst. av legemidlene mot muskel- og skjelettlidelser og 63 pst. av legemidlene for hjerte/karsykdommer.
Mange eldre har flere sykdommer og bruker flere legemidler samtidig (polyfarmasi). Dette øker sjansen for unødvendig bruk og uheldige kombinasjoner. Data fra 2011 viser at 57 pst. av eldre legemiddelbrukere (≥ 65 år) fikk utlevert mer enn fem ulike legemidler i løpet av et år, mens 21 pst. fikk mer enn ti ulike legemidler.
Eldre er sårbare for bivirkninger og andre legemiddelrelaterte problemer. Beboere på sykehjem bruker i gjennomsnitt sju legemidler, og en av tre beboere bruker minst ett overflødig legemiddel5. Det finnes flere studier som viser feilbruk av legemidler både på sykehus og hos hjemmeboende pasienter. Avhengig av hvilke kriterier som legges til grunn, er det rapportert om feilforskrivninger av legemidler til eldre i 10–25 pst. av forskrivningene678 og studier viser at om lag 10 pst. av alle innleggelser av eldre i medisinsk avdeling i sykehus er forårsaket av legemiddelrelaterte problemer. Det er behov for økt forskning på legemiddelbruk hos eldre og utvikling av nye innovative løsninger som kan bidra til å redusere legemiddelrelaterte problem hos eldre.
Statistikk fra Kreftregisteret viser at antall nye krefttilfeller har vært stabilt for de eldste aldersgruppene de siste tiårene, med unntak av brystkreft og prostatakreft der antallet har økt (blant annet som følge av screening). Andelen eldre som lever med kreft (forekomsten) har derimot økt i befolkningen, og kan skyldes for eksempel at flere tidligere kommer i gang med behandling, bedre behandling og bedre overlevelse.
De siste tiårene har dødeligheten av hjerte- og karsykdommer hos eldre gått ned i Norge. Det er forventet at flere vil leve med hjerte- og karsykdommer, på grunn av bedret overlevelse.
Hvert år faller om lag en tredjedel av de som er over 65 år, og halvparten av de over 80 år. I 2012 døde 479 personer som følge av fall med påfølgende brudd, av disse var 70 pst. over 80 år. Forekomsten av brudd i Norge er blant de høyeste i verden, årsakene til dette er i stor grad ukjente. Om lag 70 pst. av alle hoftebrudd skjer blant kvinner. Mange brudd skyldes redusert benmasse (osteoporose) kombinert med fall.
Risikoen for å utvikle en infeksjon som trenger antibiotikabehandling er relativt høy blant eldre. Det er beregnet at seks pst. av all antibiotika som brukes i Norge, gis til beboere på sykehjem, til tross for at mindre enn 40 000 personer bor på slike institusjoner.
Helse- og levekårsundersøkelsene til Statistisk sentralbyrå tyder på at psykiske helseproblemer er mindre utbredt blant eldre enn blant yngre. Forekomsten av angst- og depresjon er forholdsvis jevnt fordelt gjennom livet i voksen alder.
Andelen med demens øker med økende alder. Risikofaktorer for demens ser for en stor del ut til å være de samme som risikofaktorene for hjerte- og karsykdommer. Det er anslått at om lag 70 000 personer i Norge har demens.
5.2.4 Ulikheter mellom kjønn i bruk av legemidler
Tall fra Reseptregisteret for 2014 viser at 76 pst. av kvinnene bruker reseptbelagte legemidler, mot 62 pst. av mennene. Flere kvinner enn menn bruker legemidler ved psykiske lidelser, smertestillende og sovemedisin.
Det er imidlertid en høyere andel menn enn kvinner som bruker legemidler til forebygging av hjerte/karsykdommer og diabeteslegemidler. Kjønnsforskjeller i bruk har vært konstante over tid. Det er uklart om årsaken til dette er forskjeller i sykelighet, alderssammensetning, forbruk av helsetjenester eller helseatferd. Kobling av data fra ulike registre gir mulighet til å undersøke hva årsaken til ulik bruk kan være.
Ved søknader om markedsføringstillatelse for et nytt virkestoff, må firmaet vurdere om kjønnsforskjeller kan ha betydning for dosering av legemidlet. Vektrelaterte forskjeller foreligger ofte mellom kjønn, men får sjelden betydning for endringer i dosering. Sykelig overvektige, gravide og andre subpopulasjoner med egenskaper som avviker fra hovedpopulasjonen, men som kan påvirke legemiddelomsetningen og sikkerhetsprofilen, utgjør i dag en større utfordring enn kjønnsforskjeller.
Helsedirektoratet skal i løpet av 2015 sette i gang et arbeid med en kunnskapsoppsummering på kjønnsrelaterte forskjeller med hensyn til effekt og bivirkninger av legemidler.
5.3 Uheldig legemiddelbruk
Riktig legemiddelbruk var også tema i den forrige legemiddelmeldingen, St.meld. nr. 18 (2004–2005) Rett kurs mot riktigere legemiddelbruk, det var tema i Meld. St. 16 (2010–2011) Nasjonal helse- og omsorgsplan (2011–2015) og det var tema i Meld. St. 10 (2012–2013) God kvalitet – trygge tjenester (kvalitetsmeldingen).
Uheldig bruk av legemidler kan ha alvorlige konsekvenser for enkeltpasienter i form av bivirkninger og i verste fall død, og for samfunnet i form av betydelige ekstra kostnader knyttet til for eksempel sykefravær og unødvendig bruk av helsetjenester. Kun 20–30 pst. av legemidlene tas som anbefalt9. Avhengig av hvilke kriterier som legges til grunn, er det rapportert om uheldig forskrivning i 10–25 pst. av tilfellene101112. I den forrige legemiddelmeldingen ble det vist til at 5–10 pst. av alle akuttinnleggelser på indremedisinsk avdeling på sykehus skyldtes uheldig legemiddelbruk og at om lag halvparten kunne vært unngått.
Boks 5.1 Definisjon av legemiddelrelaterte problem
Legemiddelrelaterte problemer (LRP) kan defineres som en hendelse eller et forhold som skjer i forbindelse med legemiddelbehandling og som reelt eller potensielt interferer med ønsket helseeffekt. Med potensielt problem menes forhold som kan forårsake legemiddelrelatert sykelighet eller død, dersom man unnlater å følge opp, mens et reelt problem allerede manifesterer seg med tegn og symptomer1.
1 Ruths S, KK. Viktil, HS Blix. Klassifisering av legemiddelrelaterte problemer. Tidsskriftet for Den norske legeforening. 2007.
Flere studier viser at det forekommer legemiddelrelaterte problemer på alle nivå i helsetjenesten. Eksempler på legemiddelrelaterte problemer er at pasienten bruker unødvendig mange legemidler, får for høye eller for lave doser eller uheldige kombinasjoner av legemidler. I en studie blant sykehjemsbeboere i Bergen brukte pasientene i gjennomsnitt 11,5 legemidler og det ble påvist 5,5 legemiddelrelaterte problem per sykehjemsbeboer. 33 pst. av de legemiddelrelaterte problemene var bruk av unødvendige legemidler13. Tre av fire pasienter i sykehjem har ett eller flere legemiddelrelaterte problem14. En multisenterstudie i sykehus i Norge viste at over 80 pst. av pasientene i gjennomsnitt hadde 2,1 relevante legemiddelrelaterte problem.
En rekke studier viser at personer som har startet en behandling ofte vil fortsette med denne i lang tid, selv om indikasjonen for behandling kan ha falt bort15161718. Flere eldre har mange sykdommer og bruker mange legemidler samtidig (polyfarmasi). Eldre er sårbare for bivirkninger og andre legemiddelrelaterte problemer. Undersøkelser både i Norge og internasjonalt viser klare indikasjoner på kvalitetssvikt knyttet til legemiddelbehandling for denne gruppen.
Ved å bruke mange legemidler samtidig øker sjansen for feilmedisinering, eller for at kombinasjoner enten forsterker eller utligner hverandre. Når man behandles med legemidler for flere sykdommer samtidig, øker sannsynligheten for legemiddelrelaterte problemer19.
Spesialisthelsetjenesten har etter § 3-3 i spesialisthelsetjenesteloven plikt til å melde fra om betydelig personskade på pasient som følge av helsetjeneste og om hendelser som kunne ført til betydelig personskade. Formålet med meldeplikten er å forbedre pasientsikkerheten ved at meldingene skal brukes for å avklare årsaker til hendelser og for å forebygge at tilsvarende hendelser skjer igjen. Nasjonalt kunnskapssenter for helsetjenesten overtok ansvaret for ordningen fra Statens helsetilsyn 1. juli 2012.
I 2013 gjaldt 19 pst. av meldingene svikt knyttet til legemiddelbruk. Tildeling av legemidler og legemiddel i feil dose, styrke eller frekvens, var den vanligste feilen. I ni pst. av tilfellene resulterte hendelsen i betydelig skade eller død for pasienten. Spesialisthelsetjenesten har etter § 3-3a i spesialisthelsetjenesteloven også plikt til å varsle Statens helsetilsyn om alvorlige hendelser, herunder dødsfall eller betydelig skade på pasient hvor utfallet er uventet i forhold til påregnelig risiko.
Forveksling av legemidler er et kjent problem i helsetjenesten. Med forveksling menes her at pasienten får feil legemiddel som følge av likelydende navn, likheter i skrivemåte, emballasje eller etiketter. Forveksling av legemidler er uønskede hendelser på systemnivå og har blitt definert som legemiddelfeil som kan forebygges. Meldeordningen har mottatt 50 meldinger om hendelser hvor pasienter har mottatt feil legemiddel som følge av forveksling. De fleste forvekslingsfeil har skjedd i forbindelse med tilberedning og utdeling av legemidlene. Rapporter viser at av alle legemiddelfeil handler 10–50 pst. om forveksling på grunn av navnelikhet og opptil 35 pst. tilskrives paknings- eller etikettlikhet20. Utvikling av nye teknologiske løsninger for beslutningsstøtte og kontrollrutiner vil kunne redusere denne typen svikt.
I pasientsikkerhetskampanjen og -programmet er pasientskader ved alle norske sykehus kartlagt siden 2010. I 2013 ble om lag 11 000 pasientopphold undersøkt. Ved 13 pst. av oppholdene ble det funnet minst en pasientskade, og 15 pst. av skadene var knyttet til legemidler. Det anslås at halvparten av legemiddelskadene kan forebygges.
Hovedutfordringene knyttet til uønskede hendelser ved legemiddelbruk kan relateres til at:
helsepersonell mangler oversikt over pasientens faktiske legemiddelbruk
legen forskriver feil legemiddel, for mange legemidler, uheldige kombinasjoner av legemidler, feil dosering eller gir for dårlig oppfølging
pleiepersonell utleverer feil legemidler, feil dose eller følger ikke opp at pasienten faktisk tar legemidlet
pasienten ikke får god nok veiledning, bruker legemidlene på feil måte eller ikke følger opp behandlingen fordi de ikke har tiltro til den.
5.3.1 Manglende oversikt over legemidler i bruk
En av hovedutfordringene for riktig legemiddelbruk er at helsepersonell og pasient i dag ikke har god nok oversikt over hvilke legemidler pasienten faktisk bruker. Problemet er særlig alvorlig for de sykeste, de som bruker mange legemidler samtidig og for de som skifter mellom ulike helsetjenester eller omsorgsnivå. En stor andel av disse pasientene er brukere av pleie- og omsorgstjenesten.
I en undersøkelse fant man at 39 pst. av pasientene som ble lagt inn på akuttmottak ikke hadde oppdatert medisinliste21.Det er dokumentert at «Nødvendig informasjon om pasientenes legemiddelbruk var vanskelig tilgjengelig og tidkrevende å få tak i for involvert personell. Kvaliteten av informasjonen ble opplevd som varierende og upålitelig.»22En studie viser bl.a. at det for over 60 pst. av pasientene ikke var samsvar mellom fastlegens legemiddeloversikt, og det som var ført på hjemmesykepleiens lister. Pasientene brukte 25 pst. flere legemidler enn det fastlegen kjente til23.
Manglende oversikt over pasientens legemiddelbruk gjør at det lett kan oppstå svikt i legemiddelbehandlingen. Behandlende lege har ikke et godt nok grunnlag for å ta beslutninger om legemiddelbehandlingen, og pasienten vil kunne få dårlig tilpasset behandling, eller få legemidler i uheldige kombinasjoner.
Virkemidler for å få bedre oversikt over legemidler i bruk omtales i kapittel 6.2.
5.3.2 Brukervennlig informasjon om legemidler til helsepersonell
Helsepersonell, særlig de som forskriver legemidler, har behov for oppdatert kunnskap om legemidler. Det finnes mye god og kvalitetssikret informasjon om legemidler beregnet på helsepersonell, men det er en utfordring at informasjonen ikke er tilgjengelig for personellet på en effektiv måte, for eksempel i journalsystemet og sykehusenes kurvesystem. Det finnes sammenfallende og overlappende informasjon om legemidler og det er utfordringer knyttet til samordning, roller og ansvar for produksjon av informasjon til helsepersonell. Dette omtales nærmere i kapittel 7.2.
5.3.3 Etterlevelse av behandling
Begrepet etterlevelse av legemiddelbruk benyttes for å beskrive i hvilken grad en pasient henter ut et legemiddel på apoteket, tar det til riktig tid, i rett dose, og fullfører behandlingen24.
Litteraturen viser at lav etterlevelse av legemiddelbehandling er et stort problem, særlig blant eldre og pasienter med kroniske lidelser. I henhold til en WHO-rapport25 følger 30–50 pst. av pasientene ikke anbefalt behandling. Den samme rapporten dokumenterer at en av tre pasienter lar være å ta legemidlene i frykt for bivirkninger.
En norsk litteraturgjennomgang for sju vanlige legemiddelgrupper (antidiabetika, antiepileptika, antihypertensiver, statiner, psykofarmaka, antibiotika, analgetika) viste stor variasjon i etterlevelsen for alle legemiddelgruppene, uavhengig av diagnose. Etterlevelsen varierte fra 20–80 pst., generelt var etterlevelsen fallende over tid. Et knippe nøkkelfaktorer er assosiert med lav etterlevelse:
dosering mer enn én gang daglig
komplekse behandlingsregimer
nedsatt kognitiv funksjon og depresjon
utilstrekkelig oppfølging
Følgelig vil tiltak rettet mot denne typen faktorer kunne øke etterlevelsen, slik som forenkling av doseringen (f.eks. depottabletter, kombinasjonspreparater), tilrettelegging av praktiske forhold (f.eks. doseringshjelpemidler, allianse med pårørende, involvering av hjemmetjenesten) og tettere oppfølging (f.eks. hyppige kontroller, korte ventetider).
En rapport fra Verdens helseorganisasjon fra 2003 viser at om lag halvparten av pasientene med kroniske lidelser har lav etterlevelse av behandlingen. Et eksempel på dette kan være pasienter med KOLS eller astma som ofte bruker inhalasjonslegemidlene feil. Et annet eksempel er pasienter som er usikre på behandlingen og er redde for bivirkninger og som derfor ikke tar legemidlene slik de er forskrevet. Noen pasienter reduserer legemiddelbruken i gode perioder for å redusere bivirkningene, mens andre pasienter rett og slett glemmer å ta medisinen.
Det finnes mye god og kvalitetssikret informasjon om legemidler, men det er en utfordring at informasjonen i liten grad er tilpasset brukergruppen og kan være vanskelig å forstå. Det finnes sammenfallende og overlappende informasjon om legemidler rettet mot pasient, og det er utfordringer knyttet til samordning, roller og ansvar for produksjon av slik informasjon.
Å bedre etterlevelsen av legemiddelbehandlingen både gjennom å tilpasse informasjon til pasient og utvikle verktøy for brukermedvirkning, kan gi bedre kommunikasjon mellom helsepersonell og pasient og bedre etterlevelse av behandling. Dette omtales nærmere i kapittel 7.
5.3.4 Håndtering av legemidler
I 2009/2010 gjorde Helsetilsynet tilsyn med legemiddelbehandling og -håndtering overfor eldre både i sykehjem og i hjemmebasert omsorg. Det ble påvist mangler i 40 av de 63 kommunene hvor det ble ført tilsyn i sykehjem, og i 9 av 12 kommuner i hjemmebasert omsorg. Helsetilsynet mente at funnene var så alvorlige at de overleverte en bekymringsmelding til Helse- og omsorgsdepartementet om dårlig kontroll på legemiddelbehandlingen. Sentrale funn var utydelig rolle- og ansvarsfordeling og personell med utilstrekkelig faglig kompetanse og manglende rutiner for å sikre korrekt informasjon om hvilke legemidler pasientene brukte.
Som en oppfølging av avvikene, utarbeidet Helsedirektoratet rapporten Riktig legemiddelbruk til eldre pasienter/beboere på sykehjem og i hjemmesykepleien i 2011. Målgruppene for rapporten var kommuner/kommuneleger, fastleger, ledere og annet helsepersonell som har ansvar for legemiddelbehandling til eldre. For å bedre legemiddelbruken til eldre i og utenfor helseinstitusjonene ble det pekt på at det er viktig med ledelsesforankring, hensiktsmessig rollefordeling og klare ansvarsforhold, teamarbeid, økt fagkompetanse, god kommunikasjon og samhandling. Dette omtales nærmere i kapittel 12.
5.3.5 Generelle utfordringer
Som tidligere nevnt er sykdomsbildet i Norge preget av ikke-smittsomme sykdommer. Disse sykdommene krever behandling og oppfølging over lang tid. I mange tilfeller vil den enkelte ha behov for behandling og oppfølging i store deler av livet.
Stadig flere brukere med store og sammensatte behov mottar heldøgns hjemmetjenester i omsorgsbolig og samlokaliserte omsorgsboliger som på mange måter fungerer som et sykehjem. God oppfølging av brukere med de mest sammensatte behovene krever god informasjonsflyt. Dette gjelder særlig i den kritiske fasen etter innleggelse i sykehus, slik at de som skal overta oppfølgingen av pasienten er kjent med hvilken behandling som er gitt og dermed kan følge opp behandlingen på en hensiktsmessig måte. Mye tyder på at informasjonen ikke alltid er god nok og at oppfølgingen etter utskriving ikke er tilstrekkelig systematisk. Pasienter med sammensatte behov skrives ut fra sykehus til hjemmesykepleien, ofte med avansert medisinsk behandling, uten at det blir etablert et samarbeid mellom fastlegen og hjemmetjenesten om den medisinske oppfølgingen. Som eksempler på behandling som kan gis i kommunenes regi kan nevnes komplisert legemiddelbehandling som intravenøs antibiotika, smertelindring og kreftbehandling. Sykehusene varsler kommunen om at pasienter som trenger kommunale tjenester er utskrivingsklare, men få sykehus eller andre institusjoner har rutiner for å varsle fastlegen om behov for medisinsk oppfølging. Det skal de ifølge fastlegeforskriften § 14 gjøre før pasienten utskrives, når det er behov for at fastlegen følger opp. Helse- og omsorgsdepartementet vil ta initiativ til at det utvikles en veileder for kommunene for oppfølging av pasienter med store og sammensatte behov for tjenester i kommunene. Det vises for øvrig til omtale og tiltak som foreslås i den nylig framlagte Meld. St. 26 (2014–2015) Fremtidens primærhelsetjeneste – nærhet og helhet.
Det kan bli behov for å vurdere hvordan tilgjengelig helsepersonell kan benyttes på en mer effektiv måte og det kan bli aktuelt med nye oppgaver for flere typer helsepersonell. En annen oppgavefordeling og annen organisering av tjenestene fordrer nasjonale grep for sikre god informasjon og kompetanse om legemidler.
I tillegg kommer utfordringer knyttet til antibiotikaresistens, som omtales i kapittel 13.1 og som skal følges opp med en egen strategi, planlagt lagt fram første halvår 2015 og handlingsplan som er planlagt lagt fram i løpet av 2015.
Fotnoter
Det første Apotekprivilegium blir gitt til Nicolaus de Freudt ved Svaneapoteket i Bergen 13. desember 1595 av kong Christian IV.
Figuren viser nettotallet, det vil si at nye virkestoff er lagt til, samtidig som avregistrerte virkestoff er tatt ut.
Rapport fra nasjonal utredning av persontilpasset medisin i helsetjenesten (2014).
Non-communicable diseases (NCD).
Halvorsen Kjell H. Drug prescribing quality for older patients, explicit indicators and multidisciplinary medication reviews. Dissertation for the degree philosophiae doctor (PhD) at the University of Bergen. 2012.
Brekke et al. Pharmacologically inappropriate prescriptions for elderly patients in general practice. Scandinavian Journal of Primary Health Care. 2008. 26: 80–5.
Straand J et al. Elderly patients in general practice: diagnoses, drugs and inappropriate prescriptions. The Journal of Family Practice. 1999.
Curtis LH, et al. Inappropriate prescribing for elderly Americans in a large outpatient population. JAMA Internal Medicine. 2004.
Bosworth, H. Improving Patient Treatment Adherence: A Clinical Guidebook. NY, USA, Springer. 2010.
Brekke et al. Pharmacologically inappropriate preseriptions for elderly patients in general practice. Scandinavian Journal of primary Health Care. 2008. 26: 80–5.
Straand J et al. Elderly patients in general practice : diagnoses, drugs and inappropriate prescriptions. The Journal of Family Practice. 1999.
Curtis LH, et al. Inappropriate prescribing for elderly Americans in a large outpatient population. JAMA Internal’ Medicine 2004.
Halvorsen Kjell H et al. Multidisciplinary intervention to identify and resolve drug-related problems in Norwegian nursing homes. Scandinavian Journal of Primary Health Care. 2010. 28: 82–88.
Halvorsen Kjell H. Drug prescribing quality for older patients, explicit indicators and multidisciplinary medication reviews. Dissertation for the degree philosophiae doctor (PhD) at det University of Bergen. 2012.
Halvorsen Kjell H et at. Multidisciplinary intervention to identify and resolve drug related problems in Norwegian nursing homes. Scandinavian Journal of Priimary Health.
Blix HS et al. The majority of hospitalised patients have drug-related problems: results from a prospective study in general hospitals. European Journal of Clinical Pharmacology. 2004. 60: 651–58.
Viktil, KK, HS Blix, TA Moger. Interview of patients by pharmacists contributes significantly to the identification of drug-related problems (DRPs). Pharmacoepidemiology and Drug Safety 2006; 15: 667–74.
Pretsch P et al. Klinisk farmasøyt forbedrer legemiddelbruken i sykehus. Tidsskriftet for Den norske legeforening. 2004.
Viktil KK et al. Polypharmacy as commonly defined is an indicator of limited value in the assessment of drug-related problems. British Journal of Clinical Pharmacology. 2007. 63: 187–95.
Saastad E, K Klem, KN Nguyen, Ø Flesland. Forveksling av legemidler. Læringsnotat – Læringsnotat fra Meldeordningen – 2013. ISBN 978-82-8121-642-6. Nasjonalt kunnskapssenter for helsetjenesten. 2013.
Frydenberg K, M Brekke. Kommunikasjon om medikamentbruk i henvisninger, innleggelsesskriv og epikriser. Tidsskriftet for Den norske legeforening. 2011.
Bakken et al. Mangelfull kommunikasjon om legemiddelbruk i primærhelsetjenesten. Tidsskriftet for Den norske legeforening. 2007.
Rognstad S, J Straand. Vet fastlegen hvilke medisiner hjemmesykepleien gir pasientene? Tidsskriftet for Den norske legeforening. 2004.
Hov I, M Bjartnes, L Slørdal, O Spigset. Tas legemidler som foreskrevet? Tidsskriftet for Den norske legeforening 2012.
WHO. Adherence to long-term therapies – Evidence from action. 2003.