Del 3
God kvalitet ved behandling med legemidler
6 God kvalitet ved behandling med legemidler

Figur 6.1
God kvalitet skal sikres ved all behandling med legemidler. Dette innebærer best mulig effekt, færrest mulig bivirkninger og at pasienten mestrer livet med behandling på en god måte. God kvalitet forutsetter at pasientsikkerheten er ivaretatt, det vil si at pasienter ikke blir unødig skadet ved bruk av legemidler.
I forbindelse med arbeidet med denne meldingen, ga Helse- og omsorgsdepartementet Kontaktpunktet for tverretatlig legemiddelinformasjon i oppdrag å utrede informasjons- og beslutningsstøtte for diagnostikk, behandlingsvalg, oppfølging og etterlevelse av legemiddelbehandling. Helsedirektoratet fikk i oppdrag å utrede farmasøyttjenester og utrede etterlevelse av behandling med legemidler. Folkehelseinstituttet fikk bl.a. i oppdrag å utarbeide en rapport om bruk av vanedannende legemidler med utgangspunkt i data fra Reseptregisteret.
I arbeidet med utredningene av informasjon, etterlevelse og farmasøyttjenester ble det avholdt et åpent rådslag for å sikre innspill fra alle aktører. Det ble gitt anledning til å komme med innspill både i forkant og i etterkant av rådslaget123.
I del III beskrives eksisterende og nye tiltak og virkemidler som skal bidra til å heve kvalitet og pasientsikkerhet.
6.1 Kvalitet og pasientsikkerhet
I St.meld. nr. 18 (2004–2005) Rett kurs mot riktigere legemiddelbruk ble det foreslått flere tiltak for å bedre legemiddelbehandlingen. Tiltakene har blant annet vært å styrke Legemiddelverkets informasjonsarbeid og etablere et samarbeid mellom flere etater i kontaktpunktet for tverretatlig legemiddelinformasjon. Et annet viktig område har vært utvikling av e-resept, forskrivnings- og ekspedisjonsstøtte (FEST) og kjernejournal.
Boks 6.1 Nasjonalt kompetansenettverk for legemidler til barn
Kompetansenettverkets arbeidsområder omfatter pasientsikkerhet, kompetanseheving og formidling/utveksling av kunnskap. Nettverket har utviklet detaljerte beskrivelser for praktisk bruk og utblanding for en rekke legemidler, og har i samarbeid med eksterne fagmiljø utarbeidet informasjon til foreldre om legemidler til bruk hos barn. Kompetansenettverket skal være en bidragsyter til vitenskapelig kompetanseutvikling og kunnskapsoppsummering i samarbeid med nasjonale og internasjonale fagmiljøer, og innehar sekretariatet for et nasjonalt forskningsnettverk for legemidler til bruk hos barn (NorPedMed).
Nasjonalt kompetansenettverk for legemidler til barn består av leger, sykepleiere og farmasøyter, som arbeider for at legemidler til barn skal være en prioritert oppgave blant produsenter, apotek og helsepersonell. Alle de regionale helseforetakene er representert i nettverket, og det er opprettet utvalg for legemidler til barn ved alle landets barneavdelinger. Primærhelsetjenesten er en sentral del av nettverket, for å sikre riktig bruk av legemidler til barn hos fastleger, helsestasjonsleger og legevakt, og for å sikre samhandling på tvers.
Legemiddelbruk hos barn har også vært et viktig innsatsområde etter forrige legemiddelmelding. Nasjonalt kompetansenettverk for legemidler til barn ble etablert i 2009. Dette er et tverrfaglig nettverk som arbeider for at legemiddelbehandling til barn skal være hensiktsmessig og trygg og i størst mulig grad basert på dokumentert kunnskap. Nettverket arbeider for at alle som er involvert i legemiddelbehandling til barn skal ha tilgang til nødvendig og relevant kunnskap, slik at de kan handle og samhandle på en hensiktsmessig, korrekt og trygg måte.
Mange av utfordringene ved legemiddelbruk hos barn skyldes mangel på godkjente legemidler til barn, i egnet formulering. Dette fører til utstrakt bruk av ikke-godkjente legemidler og bruk utenfor godkjent bruksområde, særlig i sykehus. Kompetanse innen legemiddelformuleringer og kunnskap om legemiddelbruk hos barn er nødvendig for å løse legemiddelrelaterte problemer, inkludert kunnskap om muligheter og begrensninger ved å bearbeide formuleringer laget for voksne. Utfordringene er spesielt store innen fagene nyfødtmedisin, barneintensiv og barneonkologi, med høy grad av intravenøs behandling med potente legemidler.
Boks 6.2 Pasientsikkerhetsprogrammet
Den nasjonale pasientsikkerhetskampanjen I trygge hender ble initiert og gjennomført på oppdrag fra Helse- og omsorgsdepartementet i perioden 2011–2013. Kampanjens målsetting var å redusere pasientskader, bygge varige strukturer for pasientsikkerhet og forbedre pasientsikkerhetskulturen i helse- og omsorgstjenesten. Kampanjen har jobbet langs to akser:
styrking av kompetanse i forbedringsarbeid hos helsepersonell og ledere
implementering av tiltak som vil redusere skader og bedre pasientsikkerheten på utvalgte innsatsområder
Til sammen 11 innsatsområder ble valgt ut basert på kunnskap om hva som forårsaker flest pasientskader. Det ble utviklet tiltakspakker som bestod av de viktigste tiltakene for å oppnå forbedring. Tre av innsatsområdene omhandler riktig bruk av legemidler – det er samstemming av legemiddellister, samt riktig legemiddelbruk i sykehjem – og i hjemmetjenesten.
Kampanjen var en nasjonal satsning som er videreført i Nasjonalt program for pasientsikkerhet (2014–2018). Spesialisthelsetjenesten er pålagt å delta i programmet og ta i bruk tiltakspakkene, mens kommunene oppfordres til å delta. Ved utgangen av 2014 var 55 pst. av kommunene involvert i ett eller flere innsatsområder i pasientsikkerhetsprogrammet.
Størst spredning har tiltakspakkene for riktig legemiddelbruk i sykehjem og hjemmetjeneste. Tiltakene har ført til at en langt større andel av brukerne ved de deltagende sykehjemmene får jevnlig legemiddelgjennomgang. Tiltakspakken for samstemming av legemidler forutsetter aktiv deltakelse fra fastlegene – noe som har vært krevende å få til.
Det er utarbeidet egne plakater og brosjyrer rettet mot pasienter og brukere med formål å få dem til å etterspørre medisinlisten sin. Tiltakspakkene fra pasientsikkerhetsprogrammet er nyttige verktøy for å sikre at pasienten har oppdatert og samstemt legemiddelliste, og bidrar til riktig bruk av legemidler. Det er derfor viktig å fortsette implementeringen av legemiddeltiltakene i det nasjonale pasientsikkerhetsprogrammet I trygge hender. Programmet skal ikke selv initiere forskning, men bidra til å understøtte forskning som gir økt kunnskap om pasientsikkerhetsarbeidet i Norge.
Pasienter, brukere og pårørende skal få en god og sikker helse- og omsorgstjeneste. Bedre kvalitet og pasientsikkerhet sikres gjennom å forbedre systemer, ledelse og kultur i tjenestene. Viktige tiltak er å sikre at alle sykehus implementerer tiltakene i pasientsikkerhetsprogrammet og oppfordre alle kommuner til å ta i bruk tiltakspakkene i programmet. De siste årene er det gjennomført en rekke tiltak for å sikre arbeidet med kvalitet og pasientsikkerhet.
Som oppfølging av regjeringsplattformen har regjeringen besluttet å legge frem en årlig melding om kvalitet og pasientsikkerhet. Den første, Meld. St. 11 (2014–2015) Kvalitet og pasientsikkerhet 2013, ble lagt frem i desember 2014, og behandlet i Stortinget 17. mars 2015, jf. Innst. 195 S (2014–2015). Meldingen gir et bilde av status og utfordringer innen kvalitet og pasientsikkerhet i helse- og omsorgstjenesten, slik det kommer til uttrykk i årsmeldinger fra Pasient- og brukerombudene, Statens helsetilsyn, Norsk pasientskadeerstatning, samt gjennom Kunnskapssenterets meldeordning, sluttrapporten fra den nasjonale pasientsikkerhetskampanjen og nasjonale og internasjonale kvalitetsindikatorer.
6.2 Felles legemiddelliste
Det er et mål at helseopplysninger skal være tilgjengelig for helsepersonell når de måtte ha tjenstlig behov, uavhengig av hvor pasienten tidligere har vært behandlet. Hvilke legemidler en pasient bruker eller har brukt er viktige helseopplysinger. I tillegg er det et mål at innbyggerne skal ha tilgang til egne opplysninger, og at data skal være tilgjengelig for kvalitetsforbedring, helseanalyser, styring og forskning.
Status og ufordringer
En av hovedutfordringene på legemiddelfeltet er at det ikke eksisterer en felles sanntids oversikt på tvers av behandlere og behandlingsnivå over hvilke legemidler en pasient bruker, se kapittel 5.3.1. I dag registreres legemiddelopplysninger i IKT-systemene hos ulike behandlere, men informasjonen er ikke tilgjengelig dersom pasienten går fra én behandler til en annen. Å samle inn legemiddelopplysninger fra ulike kilder manuelt er både tidkrevende, og forbundet med risiko for feil og unøyaktigheter. Som et eksempel ble det ved generell indremedisinsk sengepost ved Oslo Universitetssykehus avdekket uoverensstemmelser i legemiddellisten hos 77 pst. av pasientene, hvorav de fleste var knyttet til faste legemidler4.
Manglende oversikt over legemidler i bruk svekker pasientsikkerheten, for eksempel ved at feil legemidler brukes, nødvendige legemidler ikke brukes eller at legemidlene brukes i feil dose. Dette er eksempler som kan føre til feil behandling eller uheldige bivirkninger. Mangel på en samlet legemiddeloversikt gir et dårligere kunnskaps- og beslutningsgrunnlag for helsepersonell og pasient i den videre behandlingen. Alle helsepersonellgrupper som yter helsehjelp gjennom forskrivning, utlevering og veiledning om legemidler har behov for tilgang til en felles sanntids oversikt over hvilke legemidler en pasient bruker – dette omtales ofte som Legemidler i bruk (LIB).
Dagens løsninger for e-resept har bidratt til bedre kommunikasjon mellom lege og apotek og gir pasienten, via min helse på helsenorge.no, god oversikt over gyldige resepter. E-resept gir derimot ikke historiske data for ikke-gyldige resepter. E-resept ble innført nasjonalt i februar 2013 hos fastleger, avtalespesialister og legevakter. Funksjonalitet for elektroniske resepter blir nå gradvis innført på sykehus i hele landet. Det er planlagt at e-resept skal utvikles til å omfatte nye rekvirentgrupper, for eksempel tannleger. Løsningen blir videreutviklet med blant annet støtte for bruk av multidose i pleie- og omsorgssektoren, se omtale av multidose i kapittel 12.
Alle helseregionene har igangsatt ulike prosjekter for elektronisk kurve, men har kommet ulikt i innføringen av slike verktøy. En kurve er det verktøyet legene blant annet bruker for å notere medisindoser og type behandling pasientene får, blodprøvesvar, observasjoner og annen relevant informasjon. Elektronisk kurve vil være et viktig tiltak for legemiddelhåndtering på sykehus.
Kjernejournal er en elektronisk løsning som samler utvalgte helseopplysninger som anses spesielt viktige, blant annet legemiddelopplysninger. Kjernejournalen skal være tilgjengelig både for innbygger og helsepersonell. Løsningen har vært utprøvd i deler av landet siden høsten 2013 og blir nå gradvis ubredt i resten av landet. Kjernejournal vil kunne bidra til økt pasientsikkerhet, bedre samhandling og pasientmedvirkning. I første omgang får fastleger og helsepersonell i den akuttmedisinske kjeden rask og sikker tilgang til opplysningene i en portalløsning tilknyttet sitt journalsystem. En kjernejournal med korrekte og oppdaterte legemiddelopplysninger vil bidra til bedre pasientsikkerhet ved at helsepersonell og pasienter får tilgang til liste over hvilke legemidler pasienten i løpet av de siste tre årene har fått utlevert på resept i norske apotek.
Det er utarbeidet en nasjonal handlingsplan for e-helse (2014–2016) som gir en samlet fremstilling av pågående og planlagte e-helsetiltak av nasjonal betydning for perioden, blant annet på legemiddelområdet.
Videre har Helse- og omsorgsdepartementet bedt Helsedirektoratet om å utrede hvordan ambisjonen én innbygger – én journal kan realiseres. En forstudierapport skal leveres innen utgangen av 2015. Utredningen skal anbefale det langsiktige målbildet for fremtidens helseinformasjonssystemer.
Tiltak
Helse- og omsorgsdepartementet foreslår å utrede en felles legemiddelliste, det vil si en felles infrastruktur som tilgjengeliggjør legemiddelopplysninger fra både primær- og spesialisthelsetjenesten. En felles infrastruktur må sees i sammenheng med pågående arbeid med utredningen av Én innbygger – én journal og andre relevante aktiviteter i den nasjonale handlingsplanen for e-helse, slik som e-resept og kjernejournal.
En slik konseptuell løsning, se figur 6.2, skal gi helsepersonell sikker tilgang til opplysninger om hvilke legemidler pasientene bruker (LIB) og hvilke man eventuelt ikke bør bruke, og samtidig gi viktige data for å følge utviklingen i legemiddelbruk på befolkningsnivå og til kvalitetssikring og forskning. For å gi god behandling vil helsepersonell ønske å se pasientens bruk av legemidler i sammenheng med annen klinisk informasjon som allergier, pågående behandlinger, nylige undersøkelser, tidligere sykdomshistorie m.fl. Tilgang til legemidler (og annen klinisk informasjon) forutsetter en felles infrastruktur som kan håndtere store trafikkvolum, høye oppetidskrav og strenge krav til sikkerhet.
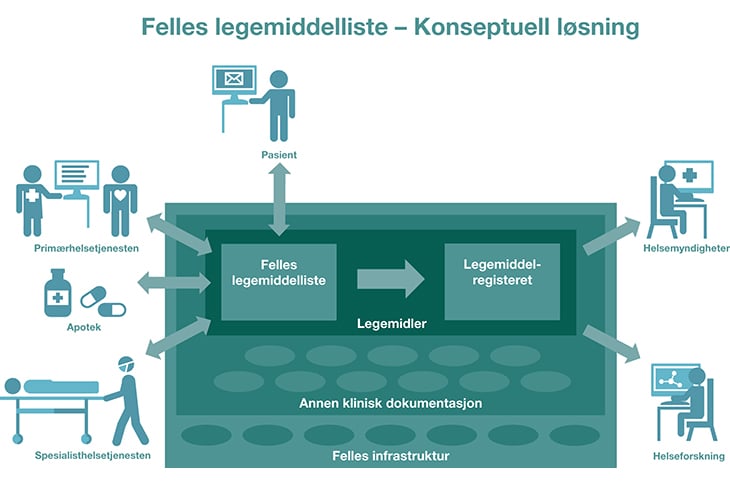
Figur 6.2 Felles legemiddelliste
En felles legemiddelliste bør også tilgjengeliggjøre informasjon om hvilke legemidler som har vært i bruk (tidsfestet periode), hvilke som er seponert (stoppet) på grunn av bivirkninger eller manglende effekt, og hvilke som bør unngås på grunn av allergier eller kontraindikasjoner. Det bør også inkluderes en plan for hvor lenge man skal stå på legemidlet før en ny evaluering gjøres, eventuelt at det skal initieres endring i behandling, dosereduksjon e.l.
Personvern og informasjonssikkerhet skal være en integrert del av utvikling og innføring av alle IKT-tiltak. Det skal være tillit i befolkningen til at opplysningene blir behandlet på en trygg og sikker måte. Helseopplysninger skal være tilgjengelige, og opplysningenes konfidensialitet og integritet skal ivaretas. Helseopplysninger skal sikres ved både tekniske funksjoner, opplæring og organisatoriske løsninger for å hindre uautorisert bruk.
På kort og mellomlang sikt, og i påvente av at helsepersonell får tilgang til en felles sanntids oversikt over legemidler i bruk, er det behov for å presisere viktigheten av å gjøre en legemiddelsamstemming, og å tydeliggjøre fastlegens ansvar i dette arbeidet, for eksempel via en informasjonskampanje rettet mot forskrivere, annet helsepersonell og pasienter. Videre er det behov for å utnytte potensialet som ligger i de eksisterende nasjonale elektroniske løsningene slik som e-resept og kjernejournal.
Boks 6.3 Legemiddelsamstemming
En legemiddelsamstemming er å lage en liste over alle legemidler pasienten bruker. Listen kalles Legemidler i bruk (LIB). Listen skal inneholde opplysninger om produktnavn, virkestoff, legemiddelform, styrke, dosering og bruksområde.
Samstemming av legemiddellister skjer i dag ofte med utdaterte opplysninger, fordi en fullstendig oversikt over pasientens legemiddelbruk ikke er tilgjengelig, eller det er forsinkelser i informasjonsutvekslingen mellom ulike aktører. Fastlegen er via fastlegeforskriften tildelt et ansvar for å vedlikeholde pasientens liste over legemidler i bruk, jf. kapittel 4.3.
Boks 6.4 Samstemmingsprosjektet
Norsk forening for allmennmedisin har utviklet et elektronisk verktøy som kan hjelpe fastlegene med å oppdatere legemiddellister i sin pasientjournal.
Beskjed om endringer i en pasientens legemiddelbruk som skjer et annet sted i helsevesenet sendes til fastlegen i epikrisen. Siden epikrisen er i fritekstformat, er det en stor manuell jobb for fastlegen å samstemme egen liste over legemidler i bruk med de opplysningene som legen mottar fra ulike samarbeidspartnere. Verktøyet bidrar til å forenkle jobben med slik legemiddelsamstemming. Fastleger som har tatt verktøyet i bruk er godt fornøyde, men foreløpig er det få brukere.
Helse- og omsorgsdepartementet vil ha større oppmerksomhet på arbeidet med samstemming av legemiddellister, inkludert å følge opp og fortsette implementeringen av samstemmingstiltakene i Pasientsikkerhetsprogrammet.
I dag har innbyggerne tilgang til en oversikt over legemidler de har fått på resept gjennom løsningen Mine resepter og innsyn i egen kjernejournal på helsenorge.no. Dette gir likevel ikke innbyggerne en liste over legemidler i faktisk bruk. For eksempel vil ikke doseendringer etter at resepten er skrevet, eller legemidler utlevert på institusjoner (sykehjem, sykehus) være synlige. Det er behov for å bevisstgjøre pasienten om viktigheten av å ha med en oppdatert liste over legemidler i bruk, og at pasienten etterspør dette fra fastlegen.
6.3 Legemiddelgjennomgang
Helsedirektoratet har siden St.meld. nr. 18 (2004–2005) Rett kurs mot riktigere legemiddelbruk støttet en rekke prosjekter knyttet til legemiddelgjennomganger både i sykehus, sykehjem, hjemmesykepleie og apotek. I Meld. St. 16 (2010–2011) Nasjonal helse- og omsorgsplan ble det anbefalt å gjøre legemiddelgjennomganger metodisk på sykehjem, i sykehus og for hjemmeboende pasienter med omfattende legemiddelbruk. Helsedirektoratet ferdigstilte i 2012 en nasjonal veileder for legemiddelgjennomgang. Denne implementeres nå gjennom det nasjonale pasientsikkerhetsprogrammets tiltak for riktig legemiddelbruk i sykehjem og hjemmetjeneste. Statens legemiddelverk, Helsedirektoratet og Pasientsikkerhetsprogrammet laget i 2014 en sjekkliste til bruk ved legemiddelgjennomgang. Sjekklisten er et praktisk verktøy for å gjennomføre en legemiddelgjennomgang. En legemiddelgjennomgang forutsetter at det finnes en korrekt liste over pasientens legemidler i bruk.
Boks 6.5 Legemiddelgjennomgang
Legemiddelgjennomgang (LMG) er en systematisk gjennomgang av pasientens legemidler for å sikre hensiktsmessig bruk og forebygge pasientskader. Legemiddelgjennomgang utføres av legen alene eller sammen med farmasøyt og/eller sykepleier. Pasienten og pårørende kan delta. Legemiddelgjennomgang utføres ved endringer i pasientens tilstand eller omsorgstilbud og årlig for pasienter som bruker flere enn tre legemidler.
I § 25 i fastlegeforskriften som trådte i kraft 1. januar 2013, går det fram at fastlegen skal gjennomføre en legemiddelgjennomgang for listeinnbyggere som bruker fire legemidler eller mer når dette anses nødvendig ut fra en medisinsk vurdering. Fra mai 2013 kan fastlegene bruke en egen takst ved gjennomføring av en legemiddelgjennomgang (2ld).
I første avtaleår (2013–2014) ble taksten utløst om lag 100 000 ganger. Departementet la til grunn et betydelig høyere antall ved innføringen av taksten. Denne taksten gir imidlertid ikke hele bildet når det gjelder fastlegens arbeid med legemiddelgjennomganger. Dette har blant annet sammenheng med at fastlegen også kan bruke andre takster når de gjør legemiddelgjennomganger. Det vil uansett være ønskelig med en økning i frekvensen, og utviklingen vil bli fulgt i tiden fremover.
Boks 6.6 Legemiddelgjennomgang ved sykehjem i Oslo kommune
Sykehjemsetaten i Oslo kommune har gjennomført et omfattende legemiddelprosjekt med tre delprosjekter: Legemiddelgjennomganger, utarbeidelse og presentasjon av legemiddelstatistikk og kompetanseheving for leger og sykepleiere ved sykehjem i Oslo.
I delprosjekt for legemiddelgjennomganger ble det gjennomført 2464 standardiserte legemiddelgjennomganger for langtidspasienter i to perioder (2011–12 og 2013–2014). Legemiddelgjennomgang ble gjennomført i team med sykehjemslege, sykepleier og farmasøyt. Forberedelse, gjennomføring og oppfølging av legemiddelgjennomgangen var detaljert beskrevet. Farmasøytisk kompetanse ble kjøpt inn fra ekstern leverandør i begge periodene av prosjektet.
Gjennomsnittsalderen på pasientene var 85 år.
Pasientene brukte i gjennomsnitt 7,2 faste legemidler og 3 behovslegemidler før legemiddelgjennomgang i 2011–2012. Tilsvarende tall for 2013–14 var 7,6 og 3.
Legemiddelgjennomgang i 2011–2012 resulterte i en reduksjon på i gjennomsnitt 1,3 legemidler per pasient, 0,7 faste og 0,6 behovslegemidler. Reduksjonen i 2013–14 var henholdsvis 0,1 og 0,3. Den beskjedne reduksjonen i siste periode kan skyldes behovet for nye legemidler ved at det ble påvist relativt mange pasienter med vitamin-D-mangel i siste periode.
Hver pasient hadde i gjennomsnitt 2,7 legemiddelrelaterte problemer før legemiddelgjennomgang i begge perioder. De fleste ble løst i løpet av legemiddelgjennomgangen.
Resultater i prosjektet:
Økt overskudd og livskvalitet for mange av pasientene.
Andelen unødvendige legemidler ble redusert.
Sykehjemmene reduserte bruken av sovemidler, antidepressiva, vanndrivende legemidler og blodfortynnende midler.
Isteden tok de i bruk mer smertestillende midler (paracetamol) og demensmidler som virkemiddel mot uro og forvirring.
Sykehjemsetaten i Oslo har etter prosjektet innført som standard at legemiddelgjennomgang skal gjennomføres innen tre uker etter innkomst for langtidspasienter og deretter halvårlig. Oslo kommune har også gjennomført prosjekter på legemiddelgjennomgang i hjemmebasert omsorg og i omsorgsboliger. Erfaringen i dette prosjektet er at bruken av legemiddelstatistikk øker nytteverdien av det samlede arbeid for å bedre kvaliteten på legemiddelbruken på sykehjemmene.
Flere sykehjem har gjennomført legemiddelgjennomganger, enten gjennom pasientsikkerhetskampanjen/-programmet eller via egne legemiddelprosjekter. Resultatene viser at de fleste pasientene får en reduksjon i antall legemidler etter gjennomgangen. Legemiddelgjennomgang gir bedre helse og livskvalitet for pasienten og kan føre til færre sykehusinnleggelser.
En reduksjon i legemiddelbruken vil også føre til reduserte legemiddelutgifter for kommunene. Et omfattende legemiddelprosjekt fra Sykehjemsetaten i Oslo har vist at utgiftene har gått ned, der innføring av legemiddelgjennomgang og legemiddelstatistikk antas å være en påvirkende faktor.
Regjeringen vil forskriftsfeste en plikt for kommunene til å sørge for systematiske legemiddelgjennomganger for pasienter på sykehjemmene de har ansvar for. Dette tydeliggjør at arbeidet med implementering av legemiddelgjennomgang i sykehjem og hjemmetjeneste skal prioriteres. I denne sammenheng vises det til Helsedirektoratets pågående arbeid med å utvikle kvalitetsindikatorer for kommunale helse- og omsorgstjenester, hvor legemidler er et prioritert område.
6.4 Riktig legemiddelbruk i spesialisthelsetjenesten
Tall fra pasientsikkerhetsprogrammet viser at det ved 13 pst. av innleggelsene i spesialisthelsetjenesten i 2013 inntrådte uønskede hendelser som førte til en pasientskade som gjorde det nødvendig med tiltak, forlenget sykehusopphold eller førte til alvorlige konsekvenser for pasienten. 15 pst. av disse pasientskadene var forårsaket av legemidler. Det antas at om lag 50 pst. av de uønskede hendelsene kunne vært unngått.
Med økt oppmerksomhet på pasientsikkerhet og mer kunnskap om hvor det svikter på legemiddelområdet er klinisk farmasi innført ved flere sykehus, som ett av flere tiltak for å sikre riktig legemiddelbruk.
Boks 6.7 Klinisk farmasi
Klinisk farmasi er definert som farmasøytisk legemiddelkunnskap anvendt på pasientens farmakoterapeutiske problemstillinger, basert på kliniske data der farmasøyten har en direkte eller indirekte kontakt med pasienten. Dette betyr at farmasøytene har fokus på pasientens bruk av legemidler, og at farmasøytene samarbeider i tverrfaglige team med øvrige helsepersonell1.
1 Definisjon fra masterprogrammet i klinisk farmasi
Diakonhjemmet sykehus tok i bruk farmasøyter i klinikken allerede på 1980-tallet. Etter modell fra England og Skottland ble farmasøytene inkludert i tverrfaglige team på revmatologisk avdeling, og etter hvert andre avdelinger på sykehuset. Ved Diakonhjemmet sykehus gjøres legemiddelgjennomganger daglig som del av previsitten på sykehuspost. Her deltar lege, sykepleier, farmasøyt og annet helsepersonell ved behov.
De kliniske farmasøytene jobber etter IMM-metoden (Integrated Medicine Management). Dette er en forskningsbasert, tverrfaglig og standardisert metode. Modellen ble utviklet i Nord-Irland på 2000-tallet og benyttes blant annet i Sverige. IMM har som mål å forbedre legemiddelbehandlingen til den enkelte pasient og legger vekt på tverrfaglig samarbeid. IMM har som mål å øke pasientsikkerheten og forbedre kvaliteten på legemiddelbehandlingen, og er en systematisk måte å jobbe på for å:
Kvalitetssikre pasientens legemiddelliste (legemiddelsamstemming).
Individualisere og optimalisere legemiddelbehandlingen (legemiddelgjennomgang).
Sikre informasjonsoverføring til andre omsorgsnivåer.
Veilede pasienten og sikre at de forstår legemiddelbehandlingen (legemiddelsamtale ved utskriving).
Studier fra Sverige og Irland viser at IMM er en god metode for å avdekke legemiddelrelaterte problemer hos pasienter og har effekt på liggetid og reinnleggelse. Arbeidet som klinisk farmasøyt er et tverrfaglig arbeid, og det er alltid lege som stiller diagnose og tar beslutning om legemiddelbehandlingen, mens farmasøyt er rådgiver for å sikre best mulig behandling.
Boks 6.8 Klinisk farmasi i Helse Midt-Norge
Helse Midt-Norge RHF har besluttet at IMM og bruk av kliniske farmasøyter skal benyttes som et verktøy for å sikre riktig legemiddelbruk. Siden 2010 har sykehusapotekene i Midt-Norge HF videreutviklet metoden i samarbeid med sykehusforetakene og det regionale helseforetaket. Klinisk farmasi er nå innført ved alle sykehusene i regionen.
De kliniske farmasøytene er ansatt ved sykehusapotekene som også er ansvarlige for opplæring og faglig oppfølging av farmasøytene. Helseforetakene og sykehusapotekene regulerer aktiviteten til de kliniske farmasøytene gjennom databehandleravtaler og samarbeidsavtaler.
Fram til og med 2014 finansierte helseforetakene tjenesten fullt ut. Per 31. desember 2014 var det 11,5 stillinger for kliniske farmasøyter. Ti av farmasøytene har master i klinisk farmasi.
For å sikre en opptrapping og styrking av klinisk farmasi etter IMM-modellen, har Helse Midt-Norge RHF vedtatt å styrke finansieringen av klinisk farmasi i en femårsperiode fra 2015, gjennom årlige rammetilskudd i størrelsesorden 20 mill. kroner. Dette vil bety mer enn en fordobling av aktiviteten i forhold til 2014.
Flere sykehusapotek har samarbeidsavtaler med helseforetakene om å levere klinisk farmasi som tjeneste. Dette kan være i form av en sentral avtale med helseforetaket eller avtale med den enkelte avdeling. Det er opp til det enkelte regionale helseforetak, som eier av både sykehusapotek og helseforetak, å avgjøre hvordan en slik tjeneste skal organiseres.
Fordi farmasøyter innehar en viktig kompetanse om legemidler som kan komme pasienten til gode, bør farmasøyter ha en rolle i pasientbehandlingen. Dette er særlig viktig ved kompleks behandling med legemidler i spesialisthelsetjenesten. Klinisk farmasi er et viktig tiltak som kan sikre riktig legemiddelbruk og bedre pasientsikkerheten.
Boks 6.9 Samstemming av legemiddellister ved Oslo universitetssykehus
Ved generell indremedisinsk sengepost ved Oslo Universitetssykehus (OUS) ble det avdekket uoverensstemmelser i legemiddellisten hos 77 pst. av pasientene, hvorav de fleste var knyttet til faste legemidler. Som en konsekvens av dette gjennomføres det nå en studie hvor farmasøyt har gått inn og sett på hele prosessen fra innkomst til utskrivning av pasient. I tillegg foregår det nå et prosjekt hvor farmasøyt lærer opp sykepleiere i legemiddelsamstemming.
Oslo universitetssykehus kjøper klinisk farmasi fra Sykehusapotekene Oslo tilsvarende syv årsverk. I tillegg er det inngått en overordnet avtale mellom Oslo Universitetssykehus og Sykehusapoteket Oslo tilsvarende seks årsverk. Oppgaver som utføres innenfor en slik avtale er blant annet å utarbeide- og vedlikeholde kliniske støtteverktøy (forlikelighetstabell, antibiotikatabell, knuse-deletabell mv.), bistå OUS med å utarbeide og implementere prosedyrer, undervisning, tiltak for samstemming av legemiddellister mv.
Boks 6.10 Legemiddelpoliklinikk ved Diakonhjemmet sykehus
Diakonhjemmet sykehus har etablert en legemiddelpoliklinikk på geriatrisk avdeling. Pasienter kan henvises fra fastlege, sykehjemslege eller fra sykehusets leger. Pasienten er aktivt inkludert i alle trinn. Sykepleier vurderer funksjonen i daglige gjøremål, klinisk farmasøyt samtaler med pasienten og gjør en legemiddelgjennomgang, geriater gjør en medisinsk evaluering av pasienten. Besøket avsluttes med et tverrfaglig møte med pasienten hvor man blir enige om tiltak og videre oppfølging.
Legemiddelkomiteer
Det har i mange år vært vanlig praksis å ha legemiddelkomiteer på sykehusene, men det er ikke et krav til helseforetakene å ha slik komité. Mandat og aktivitet for legemiddelkomiteene i de ulike sykehus varierer, men de er ofte tverrfaglig sammensatt og gir råd til ledelsen i legemiddelspørsmål. Legemiddelkomiteene har som overordnet mandat å fremme rasjonell, sikker og kostnadseffektiv legemiddelbruk, samt sikre effektiv legemiddelforsyning og forsvarlig legemiddelberedskap i helseforetakene. I Helse Sørøst RHF er det etablert et Regionalt legemiddelforum (RLF) som skal bidra til regional faglig koordinering og være rådgivende til administrerende direktør i Helse Sørøst RHF. RLF arbeider for at praksis på legemiddelområdet i regionen skal bli mest mulig ensartet og likeverdig.
I Sverige ble det i 1996 vedtatt en lov hvor det ble et krav om at alle landsting skal ha minst en legemiddelkomité. I Stockholms län ble det etablert en legemiddelkomité og et samarbeid i hele regionen for å sikre rasjonell bruk av legemidler. Stockholms län legemiddelkomité (SLK) er et rådgivende ekspertorgan som jobber for en sikker, rasjonell og kostnadseffektiv legemiddelbruk. SLK utarbeider blant annet Kloka listan, som er en anbefaling om legemiddelbruk i Stockholms län, basert på evidensbasert sammenstilling av kostnadseffektive legemidler. Den gjelder for hele helsevesenet i länet, og inngår som en del av en samlet legemiddelstrategi for länet. Listen omfatter om lag 200 legemidler til bruk ved de vanligste sykdommene.
6.5 Riktig legemiddelbruk i den kommunale helse- og omsorgstjenesten
Utviklingen går i retning av at mer avansert pasientbehandling i større grad foregår i den kommunale helse- og omsorgstjenesten, og er en ønsket utvikling. Dette krever økt kompetanse på legemiddelområdet, både på system- og pasientnivå, og kompetanse på tilberedning av legemidler. Farmasøyter kan ha en viktig rolle i flerfaglige samarbeid organisert på ulike måter i den kommunale helse- og omsorgstjenesten og i team som følger opp pasienter med sammensatte behov.
I den kommunale helse- og omsorgstjenesten utføres legemiddelleveranse og ulike farmasøytiske tjenester på ulike måter. Det vanligste er at den kommunale helse- og omsorgstjenesten utlyser anbud på kjøp av slike tjenester. Dette er tjenester som krever legemiddelkompetanse og som hovedsakelig utføres av farmasøyter. Det dreier seg om legemiddelleveranser, legemiddelhåndtering og legemiddelbruk, både på system- og pasientnivå. På systemnivå utføres for eksempel generell veiledning om håndtering og bruk av legemidler (herunder tilberedning, utblanding og administrasjon), revisjon, tilsyn, undervisning og opplæring. På pasientnivå utføres legemiddelsamstemming, legemiddelgjennomgang, multidose, undervisning av pasienter og pårørende.
Enkelte kommuner har etablert legemiddelkomiteer, som bistår enhetene i utvikling og vedlikehold av et kvalitetssystem for legemiddelhåndtering.
Kommuner som har prioritert innsatsområdene i Pasientsikkerhetsprogrammet, viser til at legemiddelsamstemming og legemiddelgjennomganger har bidratt til bedre legemiddelhåndtering og -bruk i kommunene. Implementering av tiltakene krever blant annet prioritering av ressurser og kompetanse innen legemiddelområdet. Bruk av utviklingssykehjem og farmasøyter har bidratt til spredningen av innsatsområdene i Pasientsikkerhetsprogrammet.
Kommuner som har tatt i bruk farmasøytisk kompetanse i den kommunale helse- og omsorgstjenesten rapporterer om gode erfaringer. Noen kommuner, som Trondheim, Stavanger og Drammen, har gjort dette ved å ansette kommunefarmasøyter. Oslo kommune har ansatt farmasøyt i prosjektstilling for å gjennomføre legemiddelgjennomgang for pasienter i hjemmebasert omsorg og i omsorgsboliger. I mindre kommuner kan det være hensiktsmessig med et interkommunalt samarbeid om kommunefarmasøyt, eller å inngå samarbeid med spesialisthelsetjenesten eller det lokale apoteket om kjøp av tjenester. Tilbakemelding fra kommuner som har ansatt farmasøyter er at man opplever en økt interesse for riktig legemiddelbruk, økt kvalitet i legemiddelhåndteringen og økt legemiddelkompetanse.
Boks 6.11 Kommunefarmasøyt i Stavanger kommune
Erfaringen fra Stavanger kommune er at man ved ansettelse av kommunefarmasøyt oppnår bedre integrering og tilgjengelighet av farmasøyten i kommunens organisasjon. Det skaper muligheter for å bli kjent med kommunens organisasjon som er viktig for et konstruktivt samarbeid. Kommunefarmasøyten bedrer legemiddelhåndtering i kommunen, gjennom tett oppfølging av rutiner, kompetansehevingstiltak og implementering av gode verktøy for riktig og sikker legemiddelbruk.
Kommunefarmasøyten i Stavanger jobber overordnet på systemnivå med legemiddelhåndtering og legemiddelbehandling, både på langs og tvers av organisasjonen og kommunens ulike virksomheter. Dette gjelder alt fra sykehjem og hjemmetjeneste, til legevakt, fengselshelsetjeneste, skoler og barnehager. Kommunefarmasøyten er også involvert i direkte pasientrettede oppgaver for å sikre riktig legemiddelbruk hos den enkelte pasient, f.eks. i et sykehjem. Arbeidet innebærer alt fra utarbeidelse og revidering av rutiner, utføring av legemiddelrevisjoner og gjennomføring av legemiddelgjennomganger i tverrfaglig team, til å undervise ulike typer helsepersonell og gi råd og veiledning ved spørsmål fra kommunens virksomheter og ansatte. I tillegg er kommunefarmasøyten en nøkkelperson i kommunens legemiddelkomité, samt i ulike kvalitetsutvalg som behandler avvik, klager og tilsynssaker, og en mulig ressursperson for fastlegetjenesten når det gjelder legemiddelkompetanse og legemiddelgjennomganger.
7 Pasienter og helsepersonellets behov for informasjon om legemidler
Behovet for informasjon om legemidler til både pasienter og helsepersonell er avhengig av en rekke faktorer som for eksempel tidligere erfaring og kunnskap om sykdom og legemiddelbehandling, og behovet vil variere med hensyn til hvor i behandlingsforløpet man befinner seg.
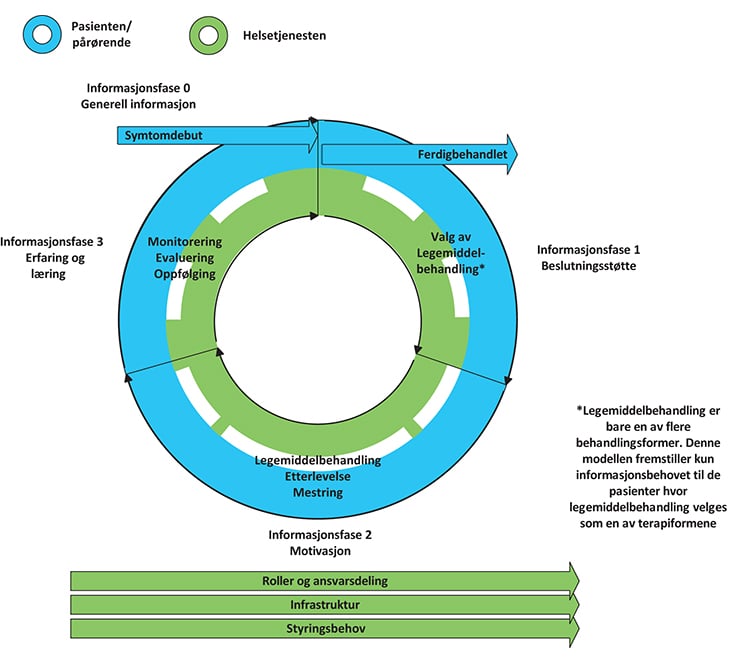
Figur 7.1 Informasjonsbehovet i ulike deler av behandlingsforløpet
Pasienter og helsepersonells behov for informasjon ved legemiddelbehandling kan deles i tre ulike faser, hvor informasjonen skal understøtte ulike formål:
Valg av behandling – beslutningsstøtte
Etter at diagnosen er stilt, finnes det ofte flere aktuelle behandlinger eller tiltak. Pasientens oppfatninger av hvor alvorlig sykdommen er, tiltakets effekt og egen risikovillighet vil påvirke valget, motivasjon og etterlevelse av behandlingen. I valg mellom ulike tiltak er det derfor behov for informasjon om sykdommen, tiltakenes nytte (effekt), risiko (bivirkninger) og praktisk gjennomførbarhet. Tiltak kan være av medikamentell og ikke-medikamentell art (som for eksempel kost- og livsstilsveiledning). For legen vil tilgang til faglige retningslinjer og informasjon om hva som refunderes av det offentlige, for eksempel på blå resept, være viktig i denne fasen. I pasientens helsetjeneste vil det være høye forventninger til informasjon i denne fasen av behandlingen. For pasienter og pårørende vil informasjon gjennom for eksempel elektroniske samvalgsverktøy (shared decision making) være viktig for å kunne medvirke til egen behandling.
Gjennomføring og mestring av behandling – motivasjon og ferdigheter
Når legemiddelbehandling er valgt, er det viktig at pasienten får praktisk informasjon og opplæring i riktig bruk av legemidlene, og at helsepersonell sikrer at pasienten har forstått innholdet i det som er kommunisert. Forskrivende lege har plikt til å informere om behandlingen, og apotek har veiledningsplikt ved utlevering av legemidlet. Dette innebærer blant annet informasjon om viktigheten av å ta legemidlene, hvordan legemidlene skal tas (for eksempel inhalasjons- eller injeksjonsteknikk), hvordan behandlingen påvirker eller påvirkes av hverdagslivet (matinntak, bilkjøring, alkohol o.l.), hvordan legemidlene ev. påvirkes av andre legemidler pasienten bruker, hva som skjer dersom behandlingen ikke etterleves, hjelpemidler for å lette etterlevelse (dosett, påminnelsesfunksjoner o.l.), råd om bivirkningsforebygging, samt symptomer på bivirkninger eller behandlingssvikt som bør medføre legekontakt.
Oppfølging og evaluering av behandling – erfaring og læring
Valg av behandling og forventninger om nytte og risiko er basert på legemidlenes gjennomsnittlige effekter på befolkningsnivå. Det er imidlertid store individuelle variasjoner med hensyn på både effekt og bivirkninger. Det er derfor viktig at man evaluerer effekten hos den enkelte pasient. Til dette kan både objektive målinger (for eksempel blodtrykk, blodprøver) og mer subjektive registreringer (for eksempel pasientdagbøker) være nyttige. Kvalitetsregisterdata gir informasjon om effekter og bivirkninger av ulike behandlingsalternativer for en gitt pasientgruppe, mens registerdata gir mulighet til å følge og analysere legemiddelbruk på befolkningsnivå.
Fasene kan overlappe, men behovet for informasjon vil være ulikt i de ulike fasene. Den legemiddelinformasjonen som er tilgjengelig i dag er ikke strukturert på en måte som fyller informasjonsbehovet i de ulike fasene.
7.1 Pasienters behov for informasjon om legemidler
Formålet med legemiddelbehandling er at pasientens helse skal bli bedre. Informasjon og beslutningsstøtte til pasienter skal bidra til bedre etterlevelse av behandling og redusere risikoen for feil. Moderne IKT-løsninger vil i større grad kunne hjelpe innbyggerne til å ta aktive valg rundt egen helse og til å påvirke behandling.
For å sikre riktig bruk av legemidler (god etterlevelse) er god dialog mellom pasient og behandlende lege viktig. Pasientmøtet gir muligheten for å individualisere informasjonen, og tiltak som kan støtte gode pasientmøter er viktig.
Det er et mål å lage pasientens helse- og omsorgstjeneste. Da må det blant annet legges til rette for at pasient- og brukerrettighetene kan realiseres. Innflytelse på behandling og informert samtykke til undersøkelser og behandlinger som helsepersonell anbefaler, er sentrale elementer. For å bidra til reell medvirkning og samtykke basert på relevant kunnskap, kan noen enkle kontrollspørsmål være til god hjelp.
Skal jeg bruke dette legemidlet? Hva er alternativene? Hva er nytten av behandlingen og hva er risikoen?
Hvordan skal jeg bruke legemidlet for å få størst mulig effekt av behandlingen og færrest mulig bivirkninger?
Hvordan kan jeg vurdere om behandlingen virker og hvilke bivirkninger bør jeg eventuelt melde fra om?
En beslutning som er tatt i felleskap kan gi bedre etterlevelse. Tilrettelegging av praktiske forhold, forenkling av dosering og tettere oppfølging kan også gi bedre etterlevelse. Kommunikasjon med pasient og informasjon om legemidler må tilpasses, for eksempel minoritetsgrupper hvor språk eller dårlige leseferdigheter kan være en utfordring. Videre er det viktig at behandler sikrer seg at pasienten har forstått innholdet i det som er blitt kommunisert. Etterlevelse er en særskilt utfordring hos pasienter med kroniske lidelser som bruker flere legemidler samtidig.
En Cochrane-gjennomgang i 2008 og 2014 konkluderte med at det er vanskelig å dokumentere vitenskapelig at enkelttiltak gir bedre etterlevelse5. Det er derimot vist at flere samtidige og skreddersydde tiltak påvirker etterlevelsen og kan gi forbedret effekt av behandlingen6. Det er derfor viktig å individualisere tiltak for den enkelte bruker. Like viktig er tiltak på systemnivå som vil gi helsepersonell og pasient mulighet til god oppfølging av behandlingen.
7.1.1 Brukerinnflytelse – samvalg
God informasjon om effekt og bivirkninger av behandlinger legger grunnlaget for informerte valg og er viktig for å gi pasienten eierskap til behandlingen. Samvalg (shared decision making) innebærer at pasienten deltar i å ta beslutninger slik de selv ønsker. Det utvikles nå flere elektroniske samvalgsverktøy, inkludert på nettbrett- og mobilplattform, for blant annet astma, antikoagulasjon og bipolare lidelser. Samvalgsverktøy kan også brukes ved beslutninger om legemiddelbehandling, men er kanskje særlig aktuelt i situasjoner der valg og oppfølging av legemiddel har store konsekvenser for pasienten, og der valget avhenger av hva som er viktig for den enkelte.
Boks 7.1 Samvalgsverktøy for bipolare lidelser under utvikling av Kunnskapssenteret og Sykehuset innlandet
Ved behandling av bipolar lidelse er ulike behandlingstiltak aktuelle, herunder bruk av legemidler. Legemidlene varierer både med hensyn på ønskede effekter og bivirkninger. Hva som er best behandling for den enkelte er både et spørsmål om kunnskap om effekter, og en prioritering av fordeler og ulemper – hva som er viktigst for den enkelte pasient. Et samvalgsverktøy utviklet for langtidsbehandling av bipolar lidelse gjør det mulig for pasient og behandler å samarbeide om å finne den beste behandlingen. Verktøyet er interaktivt, og pasient og behandler kan sammen utforske hvordan pasientens egne avveininger virker inn på hva som er det beste behandlingsvalget. Det er også mulig å sammenligne effektene av ulike legemidler og legemiddelkombinasjoner. Aktuelle behandlingsalternativer, og hvilke effekter pasient og behandler legger vekt på, kan skreddersys for den enkelte. Både kunnskap om tidligere behandling og hva som er viktig for enkeltpasienten, kan legges inn i verktøyet og brukes som basis for valget. Tekst og grafikk legger til rette for en felles forståelse av beslutningen. Verktøyet gjør det mulig å følge opp behandlingen systematisk, med jevnlige målinger av de effektene som er viktigst for pasienten. Også etterlevelsen av behandlingen kan følges over tid.
Helse- og omsorgsdepartementet foreslår at det gjennomføres en pilot om hvordan samvalgsverktøy i større grad kan tas i bruk ved valg av legemiddelbehandling. Hensikten vil være å involvere pasienten i valg av behandling, bedre kommunikasjonen mellom pasient og lege, bedre etterlevelse, og bidra til en behandling som er tilpasset pasientens individuelle preferanser.
7.1.2 Informasjon om legemidler for å styrke etterlevelse av behandling
Under behandlingen har pasient og pårørende behov for kunnskap om riktig bruk av legemidlet. Dette kan være hvordan legemidlet tas (svelges hel, tas med mat, bruk av inhalator), forebygging av bivirkninger og hvilke bivirkninger man skal være særlig oppmerksom på, forholdsregler i forbindelse med bilkjøring, bruk av alkohol og lignende. Påminnelse om doseringstidspunkt, multidose, legemiddelabonnementsordninger etc., kan gjøre etterlevelse av behandlingen enklere.
Det kan være utfordringer knyttet til dårlige lese- og skriveferdigheter og språkforståelse hos befolkningen med innvandrerbakgrunn. Dette gjør god kommunikasjon ekstra viktig, men også vanskeligere. Studier viser at språkbarrierer mellom tjenesten og brukere utgjør en fare for pasientsikkerheten. Språkbarrierer kan svekke pasientens forståelse av anbefalinger, og av egen sykdom, og dette kan føre til at pasienten i mindre grad følger anbefalt behandling. Manglende kommunikasjon mellom behandler og enkelte innvandrergrupper kan medføre at legemidler tas feil eller ikke tas, noe som kan få fatale konsekvenser. For pasienter med dårlig eller ingen leseforståelse kan det være nyttig å bruke bilder i fremstillingen. Kulturelle forskjeller kan også medføre at personer fra andre kulturer kan ha et annet forhold til legemiddelbruk enn de som er født og oppvokst i Norge. Det er behov for mer kunnskap om hvordan informasjon om legemidler til enkelte minoritetsgrupper skal utarbeides.
Samiske brukere har krav på likeverdige helse- og omsorgstjenester som den øvrige befolkningen. Likeverdige helse- og omsorgstjenester for samiske pasienter innebærer at tjenester må tilrettelegges slik at samiske pasienters språk og kulturelle bakgrunn ikke er til hinder for at det kan ytes forsvarlige tjenester. Dette er nærmere omtalt i Meld. St. 26 (2014–2015) Fremtidens primærhelsetjeneste – nærhet og helhet.
Den offentlige utredningen NOU 2014: 8 Tolking i offentlig sektor beskriver flere tiltak for å bedre språk og kommunikasjon. I Meld. St. 26 (2014–2015) Fremtidens primærhelsetjeneste – nærhet og helhet framgår det at Regjeringen vil vurdere hvordan NOU 2014: 8 Tolking i offentlig sektor skal følges opp. Forslagene i utredningen vil kunne bidra til å bedre kommunikasjon mellom tjenesten og ulike grupper.
Dagens pasientrettede informasjon om legemidler er i for liten grad tilpasset brukerne, og kan være vanskelig å forstå. Pakningsvedlegget er utarbeidet for pasienten og oppsummerer den kunnskapen som godkjenningen av legemidlet er basert på. Pakningsvedlegget inneholder noe informasjon om nytte av behandling, mye informasjon om risikoen ved behandling, og i tillegg praktiske råd om riktig bruk. Samtidig er informasjonen ofte lite brukertilpasset, og vanskelig å forstå. Et pakningsvedlegg omtaler både vanlige og sjeldne bivirkninger, og i mange tilfeller er det bred omtale av sjeldne bivirkninger. Dette kan virke skremmende på pasienten, og undersøkelser har vist at pasienter som leser pakningsvedlegget i noen tilfeller lar være å gjennomføre behandlingen. Det er viktig at oversettelsen fra engelsk til norsk er av god kvalitet og informasjonen må være forståelig og tilpasset pasienten. Legemiddelverket bør være en pådriver i det europeiske legemiddelsamarbeidet for å endre regelverket, slik at informasjon i pakningsvedlegg og preparatomtale i større grad tilpasses pasienters og helsepersonellets forutsetninger og behov. Legemiddelverket gjennomførte høsten 2014 et pilotprosjekt hvor pakningsvedlegg ble supplert med et informasjonsark (medisinråd). Informasjonen er kortfattet og fremhever de delene av legemiddelbruken som pasienten selv kan påvirke for å få best mulig nytte av behandlingen. Figur 7.2 viser et eksempel på medisinråd.

Figur 7.2 Medisinråd Penicillin
Kilde: Statens legemiddelverk
Resultater fra pilotundersøkelsen viser at både helsepersonell og pasienter syns formatet og informasjonen er nyttig og relevant. Helse- og omsorgsdepartementet vil utrede hvordan eksisterende informasjonsformat kan omarbeides eller nye format utarbeides slik at pasienten forstår den informasjon som er ment for dem.
I USA er det testet ut Drug fact box som gir en kort oppsummering av legemidlets forventede absolutte effekter og bivirkningsfrekvenser sammenlignet med placebo eller annen behandling. Oppsummeringene er korte, tabellariske og i et enkelt språk. Studier har vist at Drug fact box gir pasientene bedre forståelse av nytte og risiko ved å bruke det aktuelle legemidlet. Ved å vise legemidlenes absolutte effekt og bivirkningsfrekvens i forhold til placebo eller annen behandling, kan pasienten enklere vurdere den kliniske relevansen av en behandling og vurdere forskjellen mellom alternative behandlinger. Innføring av Drug fact box eller tilsvarende oppsummeringer blir evaluert av amerikanske legemiddelmyndigheter. Helse- og omsorgsdepartementet vil utrede og utarbeide en nasjonal standard for hvordan informasjon om et legemiddels nytte og risiko skal presenteres.
Mange aktører tilbyr nyttig pasientinformasjon om legemidler, blant annet Legemiddelverket, Helsedirektoratet, Felleskatalogen, pasientforeninger, pasientinformasjon i NEL, tryggmedisin og tryggmammamedisin fra RELIS, helsenorge.no, apotek mv.
Boks 7.2 Diabeteslinjen
Diabeteslinjen er et veiledningstilbud som tilbys av Diabetesforbundet til alle som har spørsmål om diabetes. Tjenesten skal være et godt kjent lavterskeltilbud, og et supplement til den offentlige helsetjenesten. På Diabeteslinjen kan en stille spørsmål på telefon og skriftlig via nettsiden diabeteslinjen.no. I 2014 hadde Diabeteslinjen om lag 3000 henvendelser, hvorav om lag 73 pst. på telefon og 27 pst. på nett. Om lag 440 av spørsmålene i 2014 omhandlet legemidler og legemiddelbruk, og omlag 330 av spørsmålene omhandlet behandling. Tjenesten er tilgjengelig på ulike språk (norsk, engelsk, urdu/punjabi, tyrkisk, somali og arabisk). Spørsmål til Diabeteslinjen besvares av en førstelinjetjeneste (90 pst. av spørsmålene besvares her) med erfarne veiledere, eller av andrelinjetjeneste, et ekspertpanel bestående av helsepersonell og fagpersoner. Ekspertpanelet har bred fagkompetanse og består av allmennlege, barnelege, spesialist, farmasøyt, klinisk ernæringsfysiolog og psykologer.
Det er behov for å samordne den offentlige informasjonen til pasient, fordi det er flere aktører som gir samme type informasjon. For å oppnå økt kvalitet, hensiktsmessig arbeidsdeling, brukertesting og brukerinvolvering vil Helse- og omsorgsdepartementet utrede muligheten for å etablere et nettverk som ivaretar standardisering og utarbeiding av god pasientrettet informasjon. Et slikt nettverk bør koples til eksisterende nettverk, som for eksempel nasjonalt nettverk for fagprosedyrer og kontaktpunktet for tverretatlig legemiddelinformasjon. Legemiddelindustrien foreslås invitert til et slikt samarbeid, se kapittel 10 for ytterligere informasjon. Pasientorganisasjoner bør også inviteres som representant for brukerne og som en viktig aktør for distribusjon av informasjon.
7.1.3 Digital legemiddelinformasjon
Den norske befolkningen er aktive nettbrukere og vant til å innhente informasjon og utføre tjenester selv. Selv om helse- og omsorgssektoren har ligget noe bak andre sektorer når det gjelder tjenester på nettet, blir tilbudet stadig utvidet.
Helsenorge.no ble etablert i 2011 og skal være en felles inngangsport til offentlige helsetjenester på nett. I løpet av noen få år har helsenorge.no blitt en viktig informasjonskilde og kommunikasjonskanal for pasienter og brukere. Portalen har selvbetjeningstjenester som gir innsyn i egne pasientopplysninger, slik som resepter og kjernejournal. Deler av primærhelsetjenesten har også tilgang til denne informasjonen. Dette er ett viktig steg på veien mot visjonen om én innbygger – én journal. Flere tjenester er under utvikling, herunder løsning for digital dialog mellom innbygger og fastlege. Her skal det bli mulig å gjennomføre e-konsultasjon, bestille time, fornye resept og ha enklere kontakt med legekontoret. Det arbeides med tilsvarende løsninger for spesialisthelsetjenesten.
Offentlige data på legemiddelområdet skal gjøres tilgjengelig for utvikling av apper og tjenester på nett. Helsenorge.no har allerede tilrettelagt for slike åpne datasett på enkelte områder. Ved å gjøre data tilgjengelig, inviteres næringslivet med i arbeidet for å utvikle gode digitale tjenester. På denne måten kan man oppnå et innovativt samspill mellom innbyggere, den offentlige helsetjenesten og private leverandører. Resultatet kan bli utvikling av brukertilpassede nettbaserte helsetjenester og apper som det offentlige ikke bør utvikle alene.
Boks 7.3 Pasientapplikasjon fra Felleskatalogen AS
Felleskatalogen AS utvikler en pasientapplikasjon om legemidler. Appen vil bestå av nærmere 3000 pakningsvedlegg og i underkant av 2000 foto av kapsler og tabletter, og pasientvarsler fra Statens legemiddelverk. Det vil være mulig å bygge opp en personlig liste over legemidler i bruk. Legemidler kan enkelt legges til i listen ved å skanne strekkodene på medisinpakningene. For de som ønsker det, kan det legges inn dosering og varsling.
Felleskatalogen AS konverter nå alle pakningsvedlegg til et strukturert format (XML). Dette vil gi helt andre muligheter for visning av pakningsvedleggene, både på nettsiden og i pasientapplikasjonen. Dette vil også gi nye muligheter for andre som benytter pakningsvedlegg fra Felleskatalogen, slik som Statens legemiddelverk, Helsedirektoratet (helsenorge.no) og apotekkjedene.
Legemiddelprodusentene kan søke om å ha QR-kode på pakningen, og det er allerede godkjent bruk av QR-kode på noen legemiddelpakninger. En QR-kode er en todimensjonal strekkode som er godt egnet for scanning med kamera på for eksempel mobiltelefon. Bruk av QR-kode eller annen henvisning på pakningen kan lette tilgangen til godkjent pasientinformasjon om legemidlet i digitale formater. Digitale format gir blant annet mulighet for økt skriftstørrelse, tekstopplesning og videoinstruksjon. Dette kan bedre både lesbarhet og forståelse. Digital pasientinformasjon sikrer også tilgang til oppdatert informasjon.
7.1.4 Veiledning fra apotek for å styrke etterlevelse av behandling
Apotek skal sikre forsvarlig utlevering av legemidler til sluttbrukere. Apotek er i lov og forskrift underlagt strenge krav til virksomheten. Fagpersonalet i apotek består i hovedsak av farmasøyter og apotekteknikere. Begge grupper er autorisert helsepersonell og er underlagt bestemmelsene i helsepersonelloven. For å kunne ekspedere legemidler i apotek, må man være autorisert farmasøyt i Norge. Per 15. desember 2014 var det 8 186 ansatte i norske apotek (6 516 årsverk), hvorav 3 361 farmasøyter og 3 495 apotekteknikere med fagutdanning.
Apotek er et lavterskeltilbud for helsetjenester der det skal informeres om riktig bruk av legemidler. Apotekansatte har en sentral rolle når det gjelder å veilede i riktig bruk av legemidler.
Hovedaktiviteten i et apotek er å ekspedere legemidler og sikre at legemidlene brukes riktig. Apotekloven stiller krav om at apotek skal sørge for at de som kjøper legemidler (både reseptfrie og reseptpliktige) har tilstrekkelig informasjon til at legemidlene kan brukes riktig (apotekloven § 6-6 og § 6-7). Mange apotek har utarbeidet standarder for hvilken informasjon som skal gis. Likevel vil det i stor grad være opp til den enkelte apotekansatte å vurdere hvem som trenger hvilken informasjon i hvert tilfelle. Studier fra blant annet Sverige og erfaringer fra pasientforeninger indikerer at informasjonen i apotek er varierende, både i innhold og omfang. Informasjonsarbeidet bør derfor systematiseres ytterligere.
Fordi apotek er et godt lavterskeltilbud for helsetjenester, er det viktig å vurdere hvordan man kan styrke rådgiverrollen apotekfarmasøyter har, for å sikre bedre etterlevelse av behandling.
Dagens tjenestetilbud i apotek
I dag finnes det ingen tjenester i norske primærapotek som refunderes av det offentlige. En del apotek tilbyr tjenester for å kartlegge helserisiko som blodtrykksmåling, kolesterolmåling, blodsukkermåling, føflekkscanning, klamydiatest, tarmkrefttest, og test for å kartlegge risiko for hjerte- og karsykdom. Bruken av disse betalingsbaserte tjenestene varierer, men tilbakemelding fra apotekene tilsier at kundene er interessert i et slikt tilbud.
Enkelte apotek tilbyr også legemiddelsamtale. Denne tjenesten tar utgangspunkt i at pasienten stiller spørsmål om egen legemiddelbruk. Farmasøyten prøver å avdekke legemiddelrelaterte problemer og gi pasienten råd og veiledning.
Apotek i andre land som det er naturlig å sammenligne seg med, tilbyr ulike tjenester i apotek. Dette tjenestetilbudet kan deles i fire kategorier og eksempler på slike tjenester er vist i tabell 7.1.
Tabell 7.1 Tjenestetilbud i apotek i andre land
Kategori | Tjeneste |
|---|---|
Forebygging av sykdom | Vaksinasjon Sprøyteutlevering Hjelp ved røykeslutt Livsstilrådgiving |
Kartlegging av helserisiko | Blodtrykksmåling Måling av kolesterolnivå Allergitesting Hudkreftscreening Andre tester |
Oppstart eller endring av behandling | Oppstartssamtale Teknisk veiledning Farmasøytforskrivning |
Oppfølging av behandling | Legemiddelgjennomgang som støtte til etterlevelse Klinisk legemiddelgjennomgang Farmasøytforskrivning Teknisk veiledning |
I Norge kan apotekenes mulighet til å støtte riktig legemiddelbruk utnyttes bedre. Et eksempel er kampanjen apotekene gjennomførte i samarbeid med Legemiddelverket ved overgangen til nye antikoagulantia (NB2013). Erfaring fra kampanjen er god. Apotekforeningen har gjennomført en pilot på tjenesten Oppstartsveiledning etter modell fra New Medicine Service, en tjeneste som er etablert i Storbritannia.
Boks 7.4 New Medicine Service (oppstartsamtale)
New Medicine Service (NMS) ble innført i England i 2011. Målet med tjenesten er å øke etterlevelse av behandlingen. Tjenesten tilbys til pasienter som skal starte på en langvarig behandling innenfor terapiområdene astma/KOLS, type 2 diabetes, blodfortynnende terapi eller høyt blodtrykk.
Pasienter som oppfyller kriteriene for å motta tjenesten, kan tilbys denne av farmasøyten i apoteket, eller henvises fra lege eller annet helsepersonell. Pasientene må signere et samtykke der farmasøyten får anledning til å dele informasjon med pasientens lege og NMS.
Tjenesten består av to samtaler; en intervensjonssamtale og en oppfølgingssamtale. Samtalene skal bidra til å øke pasientens trygghet og motivasjon til å følge anbefalt behandling. Samtalene kan foregå ansikt-til-ansikt i apoteket eller over telefon, og varer i 10–15 minutter hver gang.
Intervensjonssamtalen foregår om lag to uker etter ekspedering av det nye legemidlet. I denne samtalen forsøker farmasøyten å avdekke om pasienten følger behandlingen som anbefalt, og om det har dukket opp legemiddelrelaterte problemer. I tillegg kartlegges pasientens behov for informasjon og opplæring. På bakgrunn av dette gir farmasøyten individualiserte råd og informasjon. Samtalen avsluttes med at en blir enige om en oppfølgingsplan for pasienten.
Oppfølgingssamtalen foregår 2–3 uker etter intervensjonssamtalen. I denne samtalen forsøker farmasøyten igjen å avdekke pasientens etterlevelse av behandlingen. Problemer som allerede er avdekket følges opp. Eventuelle nye legemiddelrelaterte problemer registreres og diskuteres, og man blir enige om nye tiltak.
Under begge samtalene vil farmasøyten vurdere om pasienten har legemiddelrelaterte problemer som tilsier at legen må involveres. Dette kan gjøres ved å henvise pasienten tilbake eller ved å rapportere til lege etter samtalen.
Publiserte resultater fra New Medicine Service, viser at mer informasjon og oppfølging rundt medisinstart fører til at flere pasienter bruker legemidlene som anbefalt. Undersøkelsen viser også at tjenesten kan gi pasientene lengre liv, bedre livskvalitet, og at den kan gi en samfunnsøkonomisk gevinst.
Fra høsten 2014 gjennomfører Apotekforeningen et forskningsprosjekt (Medisinstart) for å undersøke effekt av oppstartsveiledning. Dette er en videreføring av piloten Oppstartsveiledning. Målet med studien er å undersøke om tjenesten øker etterlevelse av forskrevet behandling. Studien vil avdekke om medisinstart har nytteverdier for pasient, samfunn og apotek. Det er lagt opp til en 12 måneders rekrutteringsperiode og resultater forventes å foreligge våren 2016. Helse- og omsorgsdepartementet vil vurdere om oppstartsveiledning kan være en egnet tjeneste dersom forsøket med Medisinstart viser gode resultater.
For å oppnå bedre etterlevelse av legemiddelbehandlingen, er det imidlertid viktig med flere individ- og systemrettede tiltak. Forskrivere, apotek, pasientorganisasjoner og lærings- og mestringssentre er arenaer for hvor pasienten kan få informasjon om riktig legemiddelbruk.
Et utvidet informasjonstilbud bør særlig rettes mot de pasientgruppene som har størst behov for veiledning. For eksempel er det dokumentert at over 50 pst. av pasientene med KOLS har dårlig etterlevelse av behandling7. Pasienter med astma/KOLS besøker apotek jevnlig for å hente ut sine legemidler. Farmasøyter gir veiledning om riktig bruk og god inhalasjonsteknikk, men det er ingen faste rutiner for regelmessig oppfølging av pasientene. En kontroll av inhalasjonsteknikk og en veiledning i hvordan inhalasjonsmedisinene skal brukes, kan forebygge feilbruk og gi bedre etterlevelse av behandlingen. I Danmark tilbyr apotekene allerede en lignende tjeneste hvor de sjekker om brukere av astmainhalator bruker medisinen riktig.
Boks 7.5 Inhalasjonssjekk i Danmark
I Danmark tilbyr apotekene en tjeneste for å sjekke om brukere av astmainhalatorer bruker legemidlene riktig og dermed oppnår best utbytte av behandlingen. Tjenesten tilbys alle førstegangsbrukere, og til flergangsbrukere der man opplever at pasienten har problemer med inhalasjonsteknikken eller legemiddelbruken. Lege kan også henvise til tjenesten.
Tjenesten omfatter individuelt tilpasset instruksjon i inhalasjonsteknikk og demonstrasjon av riktig inhalasjonsteknikk. Det gis råd om riktig bruk, og om nødvendig, henvisning til andre tjenester. Samtalen tar omtrent 10 minutter. Alle ansatte i apoteket kan identifisere og henvise pasienter til tjenesten, men det er kun farmasøyter og farmakonomer1 med spesiell opplæring som kan gjennomføre tjenesten. Det er utarbeidet sjekklister for samtalen. Utfylte skjemaer lagres i 5 år som dokumentasjon for at tjenesten er gjennomført, og det kreves pasientsamtykke. Tjenesten betales av det offentlige. De siste årene er det gjennomført mellom 50 000 og 60 000 inhalasjonssjekker ved danske apotek.
1 En farmakonom har en treårig utdanning fra videregående skole, gir ikke ekspedisjonsrett. Finnes kun i Danmark.
Helse- og omsorgsdepartementet vil utrede muligheten for å innføre standardiserte veiledningstjenester. En mulig tjeneste kan være veiledning fra apotekfarmasøyt til pasienter med astma og KOLS. På sikt kan det også være aktuelt at andre instanser som lærings- og mestringssentre, sykepleiere på fremtidens primærhelsekontor og pasientorganisasjoner gir dette tilbudet. En slik veiledningstjeneste, som teknisk inhalasjonsveiledning i apotek, vil imidlertid gå utover dagens informasjonsplikt.
En forutsetning for å kunne drive god veiledning i riktig bruk av legemidler er å ha tilgang til opplysninger om pasientens faktisk legemiddelbruk. I Meld St. 9 (2012–2013) Én innbygger – én journal er målet at helseopplysninger skal være tilgjengelig for helsepersonell når de måtte ha tjenestelig behov og uavhengig av hvor pasienten tidligere har vært behandlet. Slik tilgang må også sikres farmasøyter i forbindelse med utlevering av legemidler.
7.2 Helsepersonells behov for informasjon om legemidler
I forrige stortingsmelding om legemidler ble det foreslått at informasjon fra det offentlige må bidra til å balansere informasjonen fra legemiddelindustrien, og at myndighetene må bli mer effektive på dette feltet. Videre ble det sagt at det er behov for informasjon om legemidler både fra myndigheter og uavhengige fagmiljø. I meldingen ble det fastsatt hvordan oppgavene med offentlig legemiddelinformasjon skulle fordeles mellom tre ulike, offentlige informasjonskilder:
Kunnskapsoppsummeringen på legemiddelområdet og tilgang til uavhengige informasjonskilder (Helsebiblioteket) – ivaretatt av Nasjonalt kunnskapssenter for helsetjenesten
Informasjon om godkjente legemidler, bivirkninger og refusjonsstatus – ivaretatt av Statens legemiddelverk og
Myndighetenes terapianbefalinger, inklusiv legemiddelbruk – ivaretatt av Helsedirektoratet.
Helsepersonell kan i dag finne informasjon om legemidler i en rekke kilder. På nasjonalt nivå utvikles det blant annet oppslagsverk og nasjonale faglige retningslinjer og veiledere. Dette er informasjon av høy faglig kvalitet, men informasjonen er i mange tilfeller lite tilgjengelig og lite brukervennlig. I tillegg til informasjon fra de tre overnevnte aktørene, finnes det flere andre informasjonskilder som Legemiddelhåndboken, Norsk elektronisk legehåndbok (NEL), Felleskatalogen, RELIS mv. De ulike informasjonskildene er omtalt i kapittel 4. Det er mange gode kilder til legemiddelinformasjon som bør videreutvikles og bevares. Det er over flere år utviklet redaksjoner som kjenner dette feltet godt, og som vet hvilken informasjon helsepersonell etterspør og bruker. Innholdet i mange av informasjonskildene er imidlertid delvis overlappende, og informasjonen er ikke alltid godt tilrettelagt for enkel deling i ulike kanaler. Det er grunn til å vurdere om den offentlige finansierte legemiddelinformasjonen kan bli bedre koordinert og strukturert. Dette kan trolig redusere behovet for å søke opp informasjon fra flere kilder.
Helse- og omsorgsdepartementet vil utrede hvordan informasjonsproduksjonen i størst mulig grad kan samordnes, og hvordan det offentlige kan ivareta, bevare og tilby gode informasjonskilder til helsepersonell. Kontaktpunktet for tverretatlig legemiddelinformasjon, jf. omtale i kapittel 4.6.4, bør ha en rolle i en slik utredning.
I Norge har man tilgang til flere gode oppslagsverk både på norsk og engelsk, men det er behov for mer legemiddelinformasjon av god kvalitet på norsk. Helsebiblioteket gir i dag tilgang for helsepersonell til sentrale internasjonale oppslagsverk. Det er viktig å videreutvikle innhold og tjenester på helsebiblioteket.no og opprettholde tilgangen til internasjonale oppslagsverk.
7.2.1 Elektronisk beslutningsstøtte til helsepersonell
Meld. St. 9 (2012–2013) Én innbygger – én journal peker på at IKT-verktøy i helse- og omsorgssektoren bør tilby funksjonalitet for beslutnings- og prosesstøtte. Dette støtter helsepersonells arbeidsprosesser basert på retningslinjer, veiledere, prosedyrer og forskningsbasert kunnskap. Slik funksjonalitet bør være tilgjengelig for helsepersonell via den elektroniske pasientjournalen. Eksempler på situasjoner hvor støtte kan være nyttig, er diagnostisering, planlegging av behandling, forskriving av legemidler og henvisning. Kvalitetssikret informasjon og beslutningsstøtte til forskriver, annet helsepersonell og pasienten selv, kan redusere risikoen for feilbruk av legemidler og bedre etterlevelsen av behandling. Elektroniske verktøy, som e-resept og etter hvert kjernejournal, bidrar til å bedre kommunikasjonen om legemiddelbruk mellom de ulike aktørene i helsetjenesten, og til innbyggerne.
Samstemte legemiddellister vil gjøre det lettere for legen å få oversikt over pasientens legemiddelbruk og vil være viktig for å kunne ta riktigere valg om behandling. For at informasjon om pasientens legemiddelbruk skal kunne bidra til informerte og riktige valg, bør også elektroniske kurvesystemer på sykehusene og elektroniske pasientjournaler tilby beslutnings- og prosesstøtte. En forutsetning for slik beslutningsstøtte er økt bruk av strukturerte kunnskapskilder, hvor informasjon deles opp og gjøres tilgjengelig for ulike formål og systemer. Bruk av standardisert kodeverk og terminologi i IKT-systemene er også viktig for at informasjon kan utveksles og gjenbrukes.
Legemiddelverket forvalter strukturert informasjon om legemidler gjennom FEST (forskrivnings- og ekspedisjonsstøtte). FEST er et datagrunnlag og den primære kilden til informasjon om legemidler og refusjonsinformasjon i legenes journalsystem, apotekenes ekspedisjonssystem, e-resept, kjernejournal mv. Via FEST kan Legemiddelverket sende varsler med viktig informasjon direkte til legens journalsystem, for eksempel informasjon om alvorlige bivirkninger, tilbaketrekkinger og legemiddelinteraksjoner mv.
Stadig nye grupper tar i bruk FEST, som for eksempel sykehus og sykehjem. Dette krever en pålitelig, fleksibel og tilgjengelig FEST-tjeneste. FEST er, slik den er bygd opp i dag, ikke egnet for å møte de kommende behovene. Det er behov for å utvikle FEST til en åpen datakilde. Dette innebærer at informasjonen gjøres så tilgjengelig som mulig og at data presenteres på en måte som tillater direkte spørring.
Sykehusene har behov for informasjon som per i dag ikke ligger i FEST. Eksempel på slik informasjon er blandingsprotokoller som gir en oversikt over hvilke legemidler som kan blandes. Sykehusene har også behov for tilpasset informasjon for eksempel knyttet til dosering. Der fastlegen forholder seg til mengden i én hel flaske, forholder sykehusene seg til innholdet i for eksempel milliliter. For å dekke behovet er det en forutsetning at data i FEST er tilgjengelige som lenkede, åpne data.
Også Helsebibliotekets informasjon kan presenteres som strukturert informasjon og gjøres tilgjengelig som åpne data for å oppnå bedre integrasjon med strukturert informasjon i andre tjenester. Det foreslås derfor å gjennomføre et pilotprosjekt der innhold fra Helsebiblioteket, for eksempel fagprosedyrer, tilgjengeliggjøres som åpne data. Slik data kan deretter integreres med legemiddelinformasjon fra for eksempel FEST.
Det bør legges til rette for at slike informasjonskilder videreutvikles for å inkludere informasjon tilpasset ulike brukergrupper som sykehus og fastleger, og for å kunne tilby strukturerte og åpne data. En slik utvikling vil møte DIFI (Direktorat for forvaltning og IKT) sine anbefalinger om at nasjonale felleskomponenter skal være tilgjengelig som åpne data, og vil være viktig for å stimulere til deling, gjenbruk, beslutningsstøtte og innovasjon av nye tjenester.
7.2.2 Kunnskapsbaserte oppdateringsvisitter
Leger har god tilgang til mye informasjon av høy faglig kvalitet, men informasjonen er ofte lite tilgjengelig og brukervennlig. Dette kan få konsekvenser for implementering av for eksempel nasjonale retningslinjer og veiledere. Det er etterspørsel blant leger og annet helsepersonell etter legemiddelkompetanse, og flere publikasjoner89 viser at feil bruk av legemidler og legemiddelbivirkninger kan forebygges ved at forskrivers legemiddelkompetanse opprettholdes og bedres.
Academic Detailing eller oppdateringsvisitter er en metode hvor en fagperson med spesiell opplæring møter forskrivere i en-til-en møter eller grupper og tilbyr en kunnskapsbasert oppdatering på legemiddelbehandling innen et sentralt terapiområde. Denne metoden benyttes på nasjonalt nivå i Australia og Canada. I USA bruker Kaiser Permanente academic detailing som kostnadseffektiv legemiddelinformasjonsformidling. Innenfor rammen av oppdateringsvisitter kan kliniske farmakologer, farmasøyter og andre med spesialkompetanse formidle kunnskap tilpasset ulike faggrupper i helsetjenesten. Tjenesten kan utøves både i primærhelsetjenesten og i spesialisthelsetjenesten.
Avdeling for legemidler ved St. Olavs hospital har gjennomført academic detailing i liten skala gjennom undervisning av allmennleger i Trondheimsregionen, med gode tilbakemeldinger.
Boks 7.6 Pilotprosjekt – Kunnskapsbaserte oppdateringsvisitter (KUPP) i norsk allmennpraksis
Helse- og Omsorgsdepartementet og Helsedirektoratet har gitt RELIS Midt-Norge i oppdrag å gjennomføre et pilotprosjekt på academic detailing i samarbeid med Avdeling for klinisk farmakologi ved St. Olav hospital og RELIS Nord-Norge. Pilotprosjektet kalles KUPP – kunnskapsbaserte oppdateringsvisitter. Tema for piloten er riktig bruk av NSAIDs, og det gjennomføres faglige oppdateringsvisitter hos samtlige fastleger i Trondheim og Tromsø. Det forventes at prosjektet vil medføre økt kunnskap blant fastleger om bruk av aktuelle legemidler, som kan medføre endring i forskrivningsmønster. Endringer skal evalueres ut i fra reseptdata. Resultatet vil danne grunnlag for å vurdere om metoden er egnet for innføring på nasjonalt nivå.
Det er behov for å utvikle et helhetlig og systematisert undervisningstjeneste for helsepersonell tilpasset norske forhold. Tjenesten kan benyttes for å oppnå mer rasjonell bruk av legemidler og for en raskere implementering av for eksempel retningslinjer og veiledere. Helse- og omsorgsdepartementet vil vurdere kunnskapsbaserte oppdateringsvisitter (KUPP/academic detailing) som varig undervisningsmetode dersom pilotering gir gode resultater.
8 Legemiddelopplysninger til forskning, helseanalyser og kvalitetssikring
Dagens reseptbaserte legemiddelregister (Reseptregisteret) som ble etablert i 2004, inneholder data om utleverte reseptforskrevne legemidler fra apotek. Formålet med Reseptregisteret er å få økt kunnskap om hvordan legemidler forskrives og brukes i befolkningen, samt å forske på kort- og langtidseffekter av legemiddelbruk ved å kople registeret mot andre sentrale helseregistre og kvalitetsregistre (sekundærbruk av helsedata). Reseptregisteret er i dag den viktigste datakilden om legemiddelbruk på individnivå i befolkningen, og registeret har i over 10 år vært brukt til forskning, helseanalyser og kvalitetssikring av legemiddelforskrivning og -bruk.
Reseptregisteret er et pseudonymt register. Personvernhensyn var bakgrunnen for at pseudonymisering ble valgt som krypteringsform. Løsningen med et pseudonymt register innebærer begrensninger i muligheten for å sammenstille dataene i registeret med andre registre og/eller datakilder og hindrer gjennomføring av viktig forskning på legemidler og bivirkninger av legemidler. Registerformen gjør det vanskelig å følge opp intensjonen og formålet med Reseptregisteret. I dag vil personvernet kunne sikres på andre gode måter med krypteringsformer som bidrar til gjenbruk og bedre utnyttelse av data. For eksempel er Norsk pasientregister og Nasjonalt register over hjerte- og karlidelser etablert som personidentifiserbare registre der personvernhensynet er ivaretatt med andre krypteringsformer.
Et annet formål med Reseptregisteret er at forskrivere skal kunne bruke uttrekk av forskrivningsdata som grunnlag for internkontroll og kvalitetsforbedring. Studier viser at forskrivningspraksis kan påvirkes og forbedres varig gjennom fagfellegrupper som gjennomgår den enkelte leges forskrivning. Flere store prosjekter ønsker om å bruke data fra Reseptregisteret for å gi tilbakemelding til klinikere om deres forskrivningspraksis som grunnlag for kvalitetsforbedring. Mangelfulle tekniske løsninger gjør imidlertid at slike uttrekk i dag må gjøres manuelt for legemiddelrekvirenter som ber om innsyn og ønsker en oversikt over egen forskrivning av legemidler.
Boks 8.1 Tilbakemelding om forskrivningspraksis
Et prosjekt ved Universitetet i Oslo skal undersøke om en forenklet versjon av Kollegabasert terapiveiledning (KTV-prosjektet) kan endre forskrivningsmønster og gjøre at antibiotika forskrives mer i tråd med de nasjonale retningslinjene. Intervensjonen vil rette seg mot norske allmennleger, benytte kollegabaserte grupper (som spesialister i allmennmedisin må delta i for å beholde spesialisttittelen) og både høyforbruks- og lavforbrukskommuner inkluderes i studien. Intervensjonen er ett møte med faglig påfyll om antibiotika og diskusjon. Det er fokus på de oppdaterte Retningslinjene for antibiotikabruk i allmennpraksis. Videre får deltakerne tilbud om en pakke med IT-verktøy med pop-up-påminnelser om retningslinjene og pasientbrosjyrer. I kollegabasert gruppe diskuterer legene egen praksis ved hjelp av tilbakemelding fra Reseptregisteret (tilrettelagt for antibiotikaforskrivning). Ved hjelp av Reseptregisteret vil man evaluere: Total mengde av antibiotika; frekvensen av penicillin i forhold til amoxicillin, makrolider og doxycyklin og frekvensen av ciprofloksacin i forhold til trimetoprim, pivmecillinam og furadantin. Det vil spesielt bli fokusert på bruken hos barn under 12 år.
Reseptregisteret mangler i dag informasjon på individnivå om legemidler forskrevet internt og utdelt til pasienter innlagt i sykehus, sykehjem og andre helseinstitusjoner. Det betyr at det ikke er mulig å måle systematisk kvaliteten av intern forskrivning av legemidler eller konsekvenser av legemiddelbehandling/-bruk hos innlagte pasienter i institusjon. Det er heller ikke mulig å kartlegge og analysere kontinuiteten av legemiddelbehandling når pasienten skifter omsorgsnivå.
Felles legemiddelopplysninger i helsetjenesten, uansett omsorgsnivå eller hvor pasienten oppholder seg, vil legge grunnlaget for data og analyser av legemiddelbruk i hele pasientforløpet inkludert hos innlagte pasienter i sykehjem og sykehus og andre helseinstitusjoner.
Tiltak
Det er satt i gang et omfattende arbeid for å modernisere og samordne sentrale helseregistre og medisinske kvalitetsregistre gjennom Nasjonalt helseregisterprosjekt. Nasjonalt helseregisterprosjekt følges opp gjennom toårige handlingsplaner og registerarbeidet samordnes med e-helsearbeidet. Integreringen av helseregisterarbeidet med det nasjonale e-helsearbeidet betyr at det arbeides med å utvikle felles teknologiske løsninger for innrapportering og datafangst, overføring til nasjonale helseregistre, forvaltning av helseregistre, tilbakemeldingssystemer, publiseringsløsninger og andre brukertjenester.
I handlingsplanen for helseregistre for perioden 2014–2015 er et av de prioriterte områdene innhenting av data om legemiddelbruk i institusjoner, dvs. sykehus og sykehjem. Folkehelseinstituttet som har ansvaret for denne handlingsplanen, har i en forstudie anbefalt modernisering og utvidelse av Reseptregisteret. En slik løsning vil være i tråd med det langsiktige målbildet på e-helseområdet som innebærer å benytte rutinemessige innsamlede strukturerte data fra helsetjenesten til helseregisterformål for i størst mulig grad unngå separate datainnsamlinger10. Slik utvikling i retning av sømløs innrapportering til helseregistrene fordrer at teknologiske løsninger for helseregistrene samkjøres med løsninger fra helsesektoren forøvrig. En felles infrastruktur hvor alle legemiddelopplysninger er tilgjengelige vil være i tråd med Nasjonal handlingsplan for e-helse, hvor det skal utredes muligheter for å få bedre oversikt over legemidler i bruk. Standardisert og strukturert informasjon om legemiddelbruk i elektronisk kurve og EPJ-systemene (Elektronisk pasientjournal) er en forutsetning for å sikre entydig utveksling av legemiddelopplysninger gjennom hele behandlingsforløpet. Dette er også en forutsetning for å utvide Reseptregisteret med data fra institusjon.
Det er behov for å etablere en mer automatisk uttrekksløsning for legemiddelrekvirenter som ber om innsyn og ønsker en oversikt over egen forskrivning av legemidler. En slik uttrekksløsning vil samtidig kunne gi forskriverne et sammenligningsgrunnlag basert på andre legers forskrivning. Antibiotikabruk er et eksempel på et område der en automatisk rapporteringsløsning vil kunne være et viktig virkemiddel for å oppnå en mer hensiktsmessig forskrivningspraksis, jf. omtale i kapittel 13.1.
Ny lov om helseregistre og behandling av helseopplysninger (helseregisterloven) trådte i kraft 1. januar 2015. Lovendringen gjør det enklere å benytte registrene i forskning, helseanalyser og kvalitetssikring, blant annet ved å gi unntak fra taushetsplikten ved utlevering av indirekte identifiserbare personopplysninger. Regjeringen ønsker en videreutvikling og utvidelse av dagens reseptregister slik at det ivaretar fremtidige behov, og vil utrede mulig etablering av et personidentifiserbart legemiddelregister basert på dagens reseptregister og supplert med data om legemiddelbruk i institusjon når felles legemiddelliste muliggjør dette, jf. etablering av felles legemiddelliste og utredningen av Én innbygger – én journal. I utredningen skal personvernkonsekvenser av et personidentifiserbart legemiddelregister utredes grundig. Personvern skal tillegges stor vekt i interesseavveiningen av fordeler og ulemper med et slikt register. Datatilsynet trekkes inn i utredningen så langt som mulig.
8.1 System for bivirkningsrapportering
Myndighetene får i dag kunnskap om legemiddelbivirkninger på ulike måter:
Helsepersonell skal melde inn bivirkninger de får kjennskap til i sitt daglige arbeid.
Innehavere av markedsføringstillatelse for legemidler har også plikt til å rapportere bivirkninger av legemidlet til myndighetene.
Pasienten kan melde bivirkninger selv.
Meldeordningen for pasienter er nettbasert og meldingene sendes elektronisk til Legemiddelverket. Helsepersonell sender bivirkningsmeldinger til sitt regionale legemiddelinformasjonssenter (RELIS) når de mistenker sammenheng mellom en reaksjon og et legemiddel.
Bivirkningsmeldinger fra helsepersonell er et viktig bidrag til legemiddelovervåkingen. Meldingene fra helsepersonell, legemiddelindustri og pasienter samles i den nasjonale bivirkningsdatabasen som benyttes til å avdekke signaler om nye bivirkninger. Alle bivirkningsmeldinger som mottas, blir kodet etter et internasjonalt kodeverk, slik at symptomer, sykdommer og legemidler får et standardisert format. Kodingen gjør det mulig å søke etter nye bivirkningssignaler på tvers av landegrenser. Etter koding inneholder ikke meldingene direkte personidentifiserbare opplysninger. Meldingene som er lagt inn i den nasjonale bivirkningsdatabasen, sendes også til firmaet som har markedsføringstillatelsen for produktet. Disse samler bivirkningsmeldinger i standardiserte formater fra ulike land, og søker etter nye bivirkningssignaler.
Kontrollerte, kliniske utprøvinger av legemidler skal sikre at legemidler som markedsføres er sikre og effektive. Slike studier danner grunnlaget for godkjenning og markedsføring av nye legemidler. Kunnskapen om nye legemidler er likevel begrenset når nye legemidler kommer på markedet. Sjeldne bivirkninger er vanskelige å oppdage før legemidlet kommer i alminnelig bruk, fordi antall behandlede pasienter er relativt lavt i kliniske utprøvninger, og fordi pasienter som inngår i studiene er selektert ut i fra ulike kriterier. For å avdekke uforutsette bivirkninger av et legemiddel så raskt som mulig, har de fleste land opprettet et system for innrapportering av alvorlige og ukjente legemiddelbivirkninger (spontanrapportering). Hensikten med spontanrapportering av bivirkninger er å fange opp signaler om bivirkninger som ikke var kjent da legemidlet fikk markedsføringstillatelse. Spontanrapportene vil bli samlet i det nye systemet for bivirkningsrapportering (Bivirkningsregisteret).
Hjemmel for system for bivirkningsrapportering for legemidler er tatt inn i ny helseregisterlov § 11. Registreringen skal ikke være basert på samtykke. Det fremgår av bestemmelsen at det skal utarbeides nærmere regler i forskrift.
En forskrift vil gi regler om hvilke opplysninger Bivirkningsregisteret kan inneholde. Dette kan være opplysninger om bivirkninger eller mistenkte bivirkninger av legemidler og direkte personidentifiserbare opplysninger om den som har hatt bivirkningene.
Overvåking og vurdering av bivirkningssignaler foregår både nasjonalt, på europeisk nivå og internasjonalt. Kunnskap om bivirkninger kan føre til at et legemiddel må trekkes fra markedet, eller at preparatomtale og pakningsvedlegg oppdateres med ny sikkerhetsinformasjon.
Spontanrapporteringssystemet er godt egnet til å fange opp bivirkninger som opptrer raskt etter behandlingsstart. Systemet kan i mindre grad identifisere bivirkninger som opptrer etter lang tids bruk, for eksempel økt kreftrisiko.
Systematiske analyser basert på koblinger mellom Reseptregisteret og andre sentrale helseregistre og kvalitetsregistre kan også gi ny kunnskap om positive og negative effekter av legemiddelbruk over tid.
9 Kvalitetsindikatorer
Helsedirektoratet skal utvikle, formidle og vedlikeholde nasjonale kvalitetsindikatorer som hjelpemiddel for ledelse og kvalitetsforbedring i helsetjenesten, og som grunnlag for at pasienter kan ivareta sine rettigheter. Nasjonalt kvalitetsindikatorsystem skal bidra til å sikre befolkningen likeverdig tilgang til helsehjelp av god kvalitet gjennom gyldig og pålitelig informasjon om det norske helsesystemets kvalitet og prestasjoner, både når det gjelder status og langsiktig trender. Når kvalitetsindikatorer kombineres med pasientrapporterte effektmål og resultat av pasient- og brukerundersøkelser, gir det et mer fullstendig bilde av kvalitet i tjenestene.
En kvalitetsindikator er et indirekte mål, en pekepinn, som sier noe om kvaliteten på det området som måles. Kvalitetsindikatorer tar utgangspunkt i en eller flere av dimensjonene av kvalitet og kan for eksempel måle helsetjenestens tilgjengelige ressurser, pasientforløpet og resultatet av helsetjenesten for pasientene. Kvalitetsindikatorer bør sees i sammenheng og kan samlet gi et bilde av kvaliteten i tjenesten. Det er vanlig å dele inn i tre typer indikatorer:
Strukturindikatorer (rammer og ressurser, kompetanse, tilgjengelig utstyr, registre)
Prosessindikatorer (aktiviteter i pasientforløpet for eksempel diagnostikk, behandling)
Resultatindikatorer (overlevelse, helsegevinst, tilfredshet)
På legemiddelområdet er det ikke fastsatt noen overordnede mål for hvor høyt legemiddelforbruket bør være for ulike indikasjoner eller legemiddelgrupper. I forbindelse med utarbeidelsen av strategi og handlingsplan mot antibiotikaresistens jf. omtale i kapittel 13.1, vil det være aktuelt å fastsette mål og indikatorer for antibiotikaforbruket. I nasjonalt kvalitetsindikatorsystem jobbes det også med utvikling av indikatorer innen infeksjon og antibiotikabruk.
Helsedirektoratet arbeider med en utredning om nasjonale kvalitetsindikatorer som måler om etterlevelse av legemiddelgjennomgang er i tråd med Veileder om legemiddelgjennomganger (IS-1998). De foreslåtte indikatorene er:
Andel beboere i institusjon (≥ 65 år) som har fått legemiddelgjennomgang, i henhold til Veileder om legemiddelgjennomganger IS-1998, siste seks måneder
Andel brukere i hjemmebaserte tjenester (≥ 65 år) som har fått legemiddelgjennomgang, i henhold til Veileder om legemiddelgjennomganger IS-1998, siste seks måneder
Etter planen vil et pilotprosjekt settes i gang i januar 2016.
10 Legemiddelindustriens rolle i informasjonsarbeidet
Legemiddelindustrien informerer om reseptpliktige legemidler til helsepersonell, som kan rekvirere eller utlevere legemidler. Det er tillatt å rette reklame mot denne gruppen helsepersonell. Reklame betyr i denne sammenhengen aktiviteter som er utformet for å fremme salget eller bruken av legemidler. Reklame for reseptfrie legemidler kan også rettes mot allmennheten.
Disse reglene har grunnlag i EUs legemiddeldirektiv11 som er tatt inn i norsk rett som følge av EØS-avtalen. Det stilles klare krav til reklamens innhold. Reklamen skal være nøktern og saklig, og fremme rasjonell bruk av legemidler. Reklamen må ikke gi et misvisende eller overdrevet bilde av et legemiddels egenskaper og medisinske verdi, og den må ikke føre til bruk som ikke er medisinsk begrunnet. Reklamen skal samsvare med innholdet i preparatomtalen, og er bare tillatt dersom legemidlet har markedsføringstillatelse.
Legemiddelverkets tilsynsaktivitet med industriens markedsføring av legemidler har stor allmenn interesse, og rapportene fra slike tilsyn publiseres på Legemiddelverkets nettsider.
Boks 10.1 Legemiddelreklame til annet helsepersonell
Kun helsepersonell som har rett til å forskrive, og helsepersonell som har selvstendig rett til å utlevere legemidler, kan motta reklame om reseptpliktige legemidler.
Mange grupper helsepersonell har utdanning innen farmakologi og vil være i befatning med legemidler uten at det er snakk om å forskrive eller utlevere, slik vilkåret er i direktivets art. 91 (direktiv 2001/83/EF). Gruppene av helsepersonell som er omfattet av legemiddelforskriften § 13-7 er derfor en snever gruppe sammenliknet med helsepersonell i helsepersonelloven § 48. Helsepersonell i legemiddelforskriften § 13-7 er definert etter adgang til å forskrive legemidler eller utlevere legemidler.
Myndighetene har med grunnlag i reklamedefinisjonen lagt til grunn en vid forståelse av hvilke aktiviteter som regnes som reklame. Legemiddelindustrien (LMI) mener regelverket for legemiddelinformasjon må tilpasses dagens informasjonssamfunn slik at legemiddelindustrien gis adgang til å bidra med informasjon om sykdom og legemidler til både helsepersonell og allmennheten. En liberalisering av praksis kan etter LMI sitt syn bidra til godt informerte pasienter gjennom tilbud om pasientbrosjyrer, mobilapplikasjoner og instruksjonsbrosjyrer om konkrete legemidler.
Det siste året har myndighetene åpnet for at legemiddelindustrien i større grad enn tidligere kan informere allmennheten om sykdom, helse og legemidler. For noen legemidler kan det være nyttig med materiell som demonstrerer injeksjonsteknikk og inhalasjonsteknikk. Legemiddelverket tillater derfor at legemiddelindustrien lager instruksjonsvideoer og illustrasjoner av praktisk bruk av legemidler, forutsatt at demonstrasjonen samsvarer med tekst og eventuelle illustrasjoner i pakningsvedlegget.
Høsten 2014 åpnet departementet for at legemiddelindustrien også kan gi sykdomsinformasjon med omtale av legemidler på gruppenivå. Grunnlaget for endringen er en bestemmelse i legemiddeldirektivet som sier at reklamereglene ikke gjelder for informasjon om helse eller sykdom når den ikke direkte eller indirekte kobles med omtale av ett eller flere legemidler. I retningslinjer gitt av Legemiddelverket fremgår det at informasjonen skal være korrekt, enkel å forstå og tilpasset allmennheten. Den skal legge vekt på helse- og sykdomsinformasjon og ikke informasjon om behandlingsvalgene. Legemidler kan nevnes som et av flere behandlingsalternativ, men det er ikke adgang til å nevne produktnavn eller spesifikke virkestoff.
TV-reklame for reseptfrie legemidler
Reklame for legemidler er ikke tillatt i fjernsyn, jf. legemiddelforskriften § 13-4. Det er folkehelseperspektivet som ligger til grunn for forbudet.
TV-reklame for reseptfrie legemidler er tillatt i flere europeiske land, inkludert Sverige og Storbritannia. For reklame som blir sendt fra utlandet gjelder som utgangspunkt «senderlandsprinsippet»; det er regelverket i sendestatens som regulerer hva som kan vises av reklame på TV. Enkelte norske TV-kanaler sender reklame som er myntet på det norske markedet fra utlandet. Dette medfører at forbudet mot reklame for legemidler på TV i Norge er uthulet.
Det norske forbudet synes ikke lenger mengingsfullt for reseptfrie legemidler, og vurderingen er at en opphevelse ikke vil ha større negative konsekvenser for folkehelsen. Et forslag om å tillate reklame for reseptfrie legemidler på TV er nå på høring.
Informasjon om legemidler til allmennheten
LMI ønsker at informasjonsbrosjyrer fra Legemiddelindustrien som deles ut etter at legemidlet er forskrevet, ikke skal regnes som reklame. De viser til at Danmark, Sverige, Finland, Nederland og Storbritannia tillater dette. Andre land i EU, som Norge, vurderer imidlertid slike pasientbrosjyrer som reklame for reseptpliktige legemidler.
En pasientbrosjyre som skal deles ut etter at legemidlet er forskrevet vil kunne påvirke legens forskrivning og bruken av legemidlet. En slik aktivitet omfattes derfor av reklameforbudet. Bestemmelsen må leses i lys av EUs legemiddeldirektiv, hvor reklame defineres som enhver form for oppsøkende informasjonsvirksomhet, kundeoppsøkning eller holdningspåvirkning, som tar sikte på å fremme rekvirering, utlevering, salg eller bruk av legemidler.
Boks 10.2 Avgjørelse fra EU-domstolen
Rekkevidden av reklamedefinisjonen er belyst i en avgjørelse fra EU-domstolen i 2011. Domstolen viste til at definisjonsleddet enhver form medfører at reklamedefinisjonen er svært vid1. Domstolen viser til at det vide begrepet er begrunnet i beskyttelsen av folkehelsen og den alvorlige helserisikoen uriktig bruk eller overforbruk av reseptpliktige legemidler medfører.
Domstolen viste så til at reklamedefinisjonen kun omfatter aktiviteter som har til hensikt å fremme forskrivning, utlevering, salg og forbruk av legemidler. I denne saken kom domstolen til at tilgjengeliggjøring av pakningsvedlegget på hjemmesiden til et legemiddelfirma ikke hadde reklamehensikt. Hadde produsenten imidlertid valgt ut visse av opplysningene i pakningsvedlegget eller omformulert dem, mente domstolen at aktiviteten måtte anses for å ha reklameformål. At opplysningene ble gjort tilgjengelig på produsentens hjemmeside for dem som søker dem, og ikke påtvunget personer som ikke ønsker opplysningene ble tillagt vekt i vurderingen av at det ikke var reklame.
1 Se sak c-316/09.
EU-domstolens praksis viser at utdeling av pasientbrosjyrer etter sin ordlyd dekkes av reklamedefinisjonen, og publisering av slike på hjemmesiden vil være å regne som reklame. Kan det likevel tenkes at slike pasientbrosjyrer er så verdifulle at de bør tillates utedelt av helsepersonell etter at legemidlet er forskrevet?
Legemiddelindustrien har stor kunnskap om egne legemidler og en pasientbrosjyre kan derfor isolert sett gi verdifull informasjon til pasienten.
Legen og pasienten har ofte et valg mellom behandling med legemiddel og bruk av andre tiltak. En pasientbrosjyre fra industrien som kan deles ut etter at legemidlet er forskrevet, vil kunne avlaste legens veiledningsplikt, og gjøre det fristende å velge en medikamentell løsning på problemet. Slike aktiviteter kan derfor gå på tvers av myndighetenes anbefaling.
Praksis viser at legemiddelindustrien først og fremst informerer om patenterte (og kostbare) legemidler.
Tilsyn med markedsføring av legemidler har vist at informasjonen ofte er ubalansert og at legemidlets positive sider ofte fremheves i for stor grad.
Helse- og omsorgsdepartementet ønsker ikke på nåværende tidspunkt å åpne for at informasjonsmateriale fra industrien som deles ut til pasienten etter forskrivning ikke skal regnes som reklame.
Legemiddelindustrien er en kunnskapsrik aktør, og deres ønske om å bidra til bedre informasjon til allmennheten bør utnyttes. Det er i kapittel 7.1.2 foreslått å utrede muligheter for å etablere et nettverk, som ivaretar standardisering og utarbeiding av god informasjon til pasienter. Helse- og omsorgsdepartementet foreslår at legemiddelindustrien inviteres til et samarbeid med myndighetene for å lage pasientrettet informasjon om legemidler.
Det er en forutsetning at informasjonen må gjøres tilgjengelig for alle legemidler, også de som er gått av patent.
11 Generiske og biotilsvarende legemidler
11.1 Generiske legemidler og bytte i apotek
Statens legemiddelverk vurderer om godkjente generiske legemidler bør settes på byttelisten. Byttelisten finnes i en søkbar database, som inneholder en oversikt over hvilke legemidler som til enhver tid kan byttes i apotek. Listen oppdateres månedlig, og publiseres på Legemiddelverkets hjemmeside.
Før generiske legemidler settes på byttelisten, vurderer Legemiddelverket om bytte i apotek vil være trygt når en tar hensyn til
sykdommen
pasientgruppen
faren for alvorlige problemer ved feil bruk
behovet for spesielt utstyr
Generisk bytte i apotek ble innført i 2001, og fører til reduksjon i kostnader til legemidler som finansieres over Folketrygden jf. omtale i kapittel 16.5. Apotekene kan bare bytte mellom legemidler i henhold til byttelisten. Legen kan reservere mot bytte når det er medisinske grunner som taler mot bytte, mens pasienten kan si nei til bytte uten å oppgi grunn. Både leger og pasienter reserverer mot bytte i 7–8 pst. av tilfellene.
To norske studier1213 har vist at generisk bytte kan skape bekymring og bidra til at pasienten mister oversikten over legemidlene. Den vanligste feilen etter bytte, er at pasienten bruker både original- og kopilegemidlet samtidig. Håkonsen fant at fem pst. av norske pasienter, og ti pst. av første generasjons innvandrere brukte både original- og kopimedisin en periode etter bytte i apotek. Språkproblemer og erfaring med falske legemidler i hjemlandet, kan bidra til usikkerhet og feilbruk i enkelte innvandrergrupper.
Legemiddelverket har drevet et utstrakt informasjonsarbeid om generisk bytte i apotek. I 2008 gjennomførte Legemiddelverket en stor informasjonskampanje om medisinbytte i apotek. Kampanjen var rettet mot apotek, leger og pasienter, og brukte virkemidler som brev, plakater, brosjyrer og animasjonsfilm. Ulike sider ved generisk bytte er siden gjentatt og utdypet på Legemiddelverkets nettside og i Nytt om legemidler (Legemiddelverkets faste informasjonsside i Legeforeningens tidsskrift).
Det mangler fortsatt mye kunnskap om de faktiske kostnader og problemer med bytteordningen. Det er heller ikke gjort systematiske undersøkelser av legenes erfaringer med generisk bytte.
Det bør fremskaffes mer kunnskap om hvilke tiltak som kan motvirke de negative konsekvensene av ordningen, som eksempel standardisert merking av legemiddelpakninger eller hjemmebesøk hos pasienter med komplisert legemiddelbruk (i Sverige innføres nå hjemmebesøk hos alle 75-åringer).
Det svenske Läkemedelsverket har, i samarbeid med Tandvårds- och läkemedelsförmånsverket og eHälsomyndighetene, åpnet for at farmasøyter i apotek kan reservere mot generisk bytte fra og med 1. januar 2015. Muligheten til å reservere mot generisk bytte kan benyttes når farmasøyten mener at et slikt bytte vil innebære en vesentlig ulempe for pasienten.
Standardisert merking av legemiddelpakninger med virkestoffnavnet
Legemiddelverket har pekt på behovet for felles europeiske regler som sikrer at virkestoffnavnet får en fremtredende og standardisert plass på legemiddelpakningen. Legemiddelverket har presentert forslaget i møte i EMA (CMDh i 2013) og på flere internasjonale kongresser. Sammen med psykologisk institutt (UiO) har Legemiddelverket gjennomført en eksperimentell studie som viser at tydelig og standardisert merking med virkestoffnavnet gjør det langt lettere å avgjøre om to pakninger inneholder det samme eller ulike virkestoff.
Legemiddelverket bør arbeide videre i EMA, og eventuelt i samarbeid med WHO, for et internasjonalt regelverk som sikrer at virkestoffnavnet får en fremtredende og standardisert plassering på alle legemiddelpakninger.
Generisk forskrivning
Generisk forskrivning innebærer at legen bruker virkestoffnavnet i stedet for et salgsnavn på resepten. Generisk forskrivning er tillatt i Norge og brukes på rundt to pst. av reseptene (tall fra 2007).
Nye europeiske regler krever at virkestoffnavnet skal angis på alle resepter (eventuelt sammen med salgsnavnet) for å gjøre det enkelt for pasienten å bruke resepten i andre land. Generisk forskrivning er obligatorisk i Portugal, i enkelte områder i Spania og brukes ved rundt 80 pst. av forskrivningene i Storbritannia. Ved Universitetssykehuset Nord Norge er generisk forskrivning innført som standard.
Legemiddelverket arbeider for økt bruk av virkestofforskrivning. Det viktigste argumentet for dette er at bruk av virkestoffnavnet vil lette kommunikasjonen mellom helsepersonell og mellom helsepersonell og pasienter. Blant annet vil bruk av virkestoffnavnet redusere misforståelser og usikkerhet ved generisk bytte i apotek, og når pasienter oppsøker helsepersonell i utlandet.
I tillegg er virkestoffnavnet en del av et felles medisinsk språk som brukes av fagfolk og i vitenskapelig litteratur over hele verden. For å øke bruken av virkestofforskrivning er det viktig at Legemiddelverkets database over legemidler (FEST) er tilpasset forskrivning av virkestoff. Journalsystemene bør tilrettelegge for at leger kan velge virkestofforskrivning. Helse- og omsorgsdepartementet vil vurdere informasjonstiltak ovenfor leger, apotek, pasienter og interesseorganisasjoner for å fremme generisk forskrivning.
11.2 Biologiske og biotilsvarende legemidler
Bruken av biotilsvarende legemidler er økende i Norge. Når europeiske legemiddelmyndigheter godkjenner et biotilsvarende legemiddel er det en bekreftelse på at det har samme virkning som originallegemidlet. Et eventuelt bytte mellom det originale og det biotilsvarende legemidlet hos pasienter som allerede får behandlingen er imidlertid ikke en del av godkjenningen. Vitenskaplige studier av bytte vil kunne ha stor betydning når det gjelder å skaffe større innpass for biotilsvarende legemidler i behandlingen i Norge og andre land. Apotekloven åpner ikke for bytte i apotek mellom biologiske og biotilsvarende legemidler.
I Stortingets behandling av Prop. 1 S (2013–2014) ble det gitt et tilskudd på 20 mill. kroner til kliniske studier av bytte mellom biologiske og biotilsvarende legemidler. Byttestudien NOR-SWITCH gjennomføres i samarbeid mellom de regionale helseforetakene under ledelse av Helse Sør-Øst RHF. Byttestudien skal øke kunnskapen om skifte av behandling med det biologiske legemidlet Remicade med det biotilsvarende legemidlet Remsima. Studien vil omfatte om lag 500 pasienter fra alle helseregioner.
Det arbeides i EU med et identifiseringssystem (2D-merking) av biologiske legemidler for nøyaktig å kunne spore hvilket legemiddel pasienten har fått. For å høyne sikkerheten ved bruk av biologiske legemidler skal man til enhver tid spore hvilket produkt (original produkt eller biotilsvarende, handelsnavn, batchnummer mv.) som blir administrert.
12 Håndtering av legemidler
Legemiddelhåndteringsforskriften for virksomheter og helsepersonell som yter helsehjelp fra 2008 er revidert 1. januar 2015. I denne revisjonen er det stilt krav om at virksomhetsleder skal sørge for at virksomheten har rutiner som kvalitetssikrer informasjonen om pasientens legemiddelbruk ved innleggelse og utskriving, og ved overflytting innen virksomheten. I tillegg er det i § 5 stilt krav om at «en oppdatert og samstemt liste over legemidler i bruk, skal i forståelse med pasienten, alltid følge pasienten ved skifte av omsorgsnivå».
Boks 12.1 Velferdsteknologi
Velferdsteknologi er teknologiske løsninger og produkter som kan bidra til mestring, selvstendighet og trygghet i egen hverdag. Velferdsteknologi er ett av flere virkemidler i møte med fremtidens utfordringer innenfor helse- og sosialtjenestene. Bydelene St. Hanshaugen, Gamle Oslo, Grünerløkka og Sagene og Lovisenberg Diakonale Sykehus deltar i prosjektet Velferdsteknologi i sentrum, i samarbeid med Helsedirektoratet og kommunenes fellesorganisasjon. I bydel St. Hanshaugen tester de blant annet ut ti elektroniske medisindispensere (Pilly). Pilly varsler med lyd og lys når legemidlene skal tas. Pasienten kan motta påminnelser som tekstmelding på mobilen, og pårørende eller hjemmetjenesten kan også motta slike påminnelser. Medisindispenseren fylles vanligvis opp med syv dagers forbruk av legemidler, og én medisindispenser kan spare hjemmetjenesten for 20 min. besøkstid pr. dag. Bruk av Pilly forutsetter blant annet at bruker forstår at legemidlene skal tas når det piper/ blinker og at bruker forstår hvordan legemidlene skal tas. Videre er det viktig med god opplæring av ansatte og et organisatorisk system for å fungere.
Disse to bestemmelsene underbygger kravet i fastlegeforskriftens § 25 om at fastlegen skal sørge for at listepasientene har en oppdatert legemiddelliste, og at fastlegen skal gi en oppdatert legemiddelliste til andre tjenesteytere i helse- og omsorgstjenesten dersom dette er nødvendig for å gi et forsvarlig tilbud til listeinnbyggeren.
Boks 12.2 Lukket legemiddelsløyfe
Ved anskaffelse og implementering av nye IT- systemer i sykehus, er lukket legemiddelsløyfe (Closed loop medication) vurdert som et viktig systemforbedringstiltak, for å redusere uønskede legemiddelhendelser – både i Norge, Europa og USA. Lukket legemiddelsløyfe (LLS) er en metode for å sikre at pasienter i sykehus får rett legemiddel, i rett dose, til rett tid og på rett måte ved å ta i bruk nye teknologiske løsninger.
De forutsetninger som legges til grunn er i hovedsak:
en elektronisk kurve (e-kurve) med elektronisk beslutningsstøttefunksjonalitet for blant annet ordinasjon, istandgjøring og utdeling av legemidler
elektronisk og manuelt identifiserbare legemidler
elektroniske kommunikasjons- og dokumentasjonssystemer.
Hovedintensjonen at legemiddelhåndtering og -logistikk interagerer på en måte som forbedrer pasientsikkerheten.
Det er i dag ingen sykehus som har implementert en lukket legemiddelsløyfe i Norge, men Sykehuset Østfold arbeider for å implementere LLS i det nye sykehuset. Akershus universitetssykehus og St. Olavs hospital arbeider mot en løsning med pasientbundene legemidler (legemidlene er gjort i stand i et automatisert system til den enkelte pasient) som vil kunne tilfredsstille kravene til en lukket legemiddelsløyfe når elektroniske kurveløsninger er på plass.
Forskriften understreker kvalitets- og kompetansekrav ved tilberedning av legemidler i institusjoner, både i sykehus og i kommunehelsetjenesten, og det er krav om risikovurdering før tilberedning av legemidler kan starte.
Helsedirektoratet har utarbeidet et nytt rundskriv (IS 7/2015) til forskriften slik den nå lyder. Dette rundskrivet inneholder en mer detaljert beskrivelse av hvordan forskriften skal forstås, samt en veiledning som gir råd og praktiske eksempler for å kunne opprettholde gode rutiner og sikre kvalitet i legemiddelhåndteringen.
12.1 Multidose
Multidose er tabletter/kapsler som pakkes sammen i en pose for hvert doseringstidspunkt. Systemet er godt egnet for hjemmeboende pasienter som bruker flere legemidler, som har stabil medisinering, og brukes oftest der hjemmesykepleien har ansvar for legemiddelhåndteringen. Formålet med multidose er mindre feil under dispensering, mindre kassasjon med legemidler samt å spare sykepleiertid.
Multidose som system ble anbefalt som et forbedringstiltak i forrige legemiddelmelding, med mål om at multidose skulle implementeres i større omfang. I 2002 brukte 3000 pasienter multidose, i 2014 er det nærmere 70 000 brukere. Hoveddelen (80 pst.) av de 70 000 multidosebrukerne er tilknyttet kommunal hjemmetjeneste. I tillegg benytter sykehjem ordningen, og noen få benytter systemet på eget initiativ.
HELFO tilbyr kommuner avtale om refusjon på 500 kroner per år per pasient i hjemmetjenesten som bruker multidose. Tilskuddet skal svare til om lag 20 pst. av kostnaden ved multidosepakking. Når det gjelder privatpersoner som bruker multidose, får de ingen refusjon for utgifter til multidosepakking.
Multidose er ikke godt egnet til å håndtere hyppige endringer i legemiddeldosering. Legemidler til bruk ved behov, som vanedannende legemidler må håndteres utenom multidose. Helsedirektoratet har i nasjonal faglig veileder for vanedannende legemidler anbefalt at vanedannende legemidler til bruk ved behov ikke bør gis i multidosepakker.
Multidose er et godt kvalitetstiltak og et viktig virkemiddel for å sikre riktig legemiddelbruk. Innføring av multidose har i undersøkelser vist å gi bedre samstemming av legemiddellistene, bedret pasientens oppfølging av behandling, forenklet pasientens legemiddelhåndtering og medført høyere etterlevelse av behandlingen.
Aktørene i helsetjenesten har imidlertid påpekt en del forhold som bør forbedres. Studier har vist at pasientens legemiddelliste sjelden blir revidert, at pasienten står på unødvendige legemidler over lengre tid, og at pasienten og hjemmesykepleien blir mindre opptatt av hvilke legemidler pasienten bruker. Legene har også ulik oppfatning av hvem som er ansvarlig for legemiddellisten når flere leger kan forskrive multidose til en pasient.
Inntil nå har multidose vært en papirbasert ordning hvor telefax har vært benyttet for å kommunisere legemiddellister mellom aktørene (lege, hjemmetjeneste/sykehjem og apotek) i en legemiddelkjede. Denne prosessen inneholder mange udefinerte, manuelle kontroller.
Det er behov for å ivareta elektronisk formidling av legemiddelinformasjon mellom fastlege og multidoseapotek ved pakking av multidose, og elektronisk forordning av multidose til pasienten er nå pilotert. Ny funksjonalitet i e-reseptløsningen skal erstatte dagens ordinasjonskort og telefaks som informasjonskanal mellom lege og apotek. Løsningen dekker foreløpig ikke pasienter som mottar multidose som en del av et internt forordningssystem (f.eks. i sykehjem). En evaluering av multidosepiloten viste at det var samsvar mellom apotekets og fastlegens legemiddellister i 30 pst. av tilfellene. I de tilfellene hvor apoteket i forkant sendte over legemiddellisten til fastlegen, med forutgående legemiddelsamstemming var det samsvar i 64 pst. av tilfellene. Nasjonal innføring av elektronisk rekvirering av multidose skal etter planen skje i løpet av 2015.
Det kan være behov for regulatoriske, organisatoriske, finansielle og IKT endringer for å sikre multidose som et godt verktøy i fremtiden. Helsedirektoratet skal i løpet av 2015 utrede hvilke korrigerende tiltak som må iverksettes, og hvordan disse skal implementeres, for å bedre kvaliteten på multidose.
13 Særskilte grupper
13.1 Bruk av antibiotika og antibiotikaresistens
Antibiotika er legemidler som brukes til behandling av infeksjoner som skyldes bakterier. Det er en klar sammenheng mellom bruk av antibiotika til mennesker og dyr og utvikling av antibiotikaresistens. Forekomsten av antibiotikaresistente bakterier øker, og er en alvorlig trussel mot folkehelsen, dyrehelsen og mattryggheten14. I tillegg har utviklingen av nye antibiotika stoppet opp. Det er derfor viktig å ha gode strategier for å motvirke utviklingen av antibiotikaresistens slik at eksisterende antibiotikatyper blir virksomme også i fremtiden.
EU har vurdert at kunnskapsbehovet innenfor antibiotikaresistens er så stort at det er nødvendig med en felleseuropeisk forskningsinnsats. Dette er bakgrunnen for etableringen av det felleseuropeiske forskningssamarbeidet om antibiotikaresistens Joint Programming Initiative on Antimicrobial Resistance (JPIAMR).
Regjeringen vil legge fram en tverrsektoriell strategi mot antibiotikaresistens innen utgangen av juni 2015. Dette er i tråd med anbefalingene fra Verdens helseforsamling og ekspertgruppen som har gitt regjeringen råd om hvordan Norge bør møte utfordringene med antibiotikaresistens15. Ekspertgruppen ble oppnevnt i 2013 av Helse- og omsorgsdepartementet, Landbruks- og matdepartementet, daværende Fiskeri- og kystdepartementet og Miljøverndepartementet. Ekspertgruppen peker særlig på at det er behov for en bred faglig tilnærming, og et bredt samarbeid på tvers av sektorer for å møte utfordringene.
I Norge er forbruket av antibiotika relativt lavt, både hos mennesker og dyr. I 2013 var 87 pst. av forbruket til humant bruk, 12 pst. til husdyr og 1 pst. til oppdrettsfisk. Det har vært en jevn økende trend i bruken hos mennesker de siste årene. Forbruket av penicilliner målt i doser er for eksempel fordoblet fra midten av 1970-tallet fram til i dag. Antibiotika brukes for ofte, i uhensiktsmessige doser og over for lang tid. Videre forskrives ikke alltid et antibiotikum med gunstig resistensprofil. Utvikling av antibiotikaresistens er en konsekvens av overforbruk, og kan begrenses ved at legemidlene brukes på riktig måte. Det er derfor viktig at det utvikles tiltak som kan redusere forbruket, og sikre rasjonell bruk av antibiotika i Norge.
Systemet for overvåkning av antibiotikabruk i Norge er mangelfullt. De kildene som finnes viser mulig overforskrivning til kvinner, barn, ungdom og eldre16. Forbruket er om lag 50 pst. høyere hos voksne kvinner enn hos menn i samme aldersgrupper. Det er også geografiske forskjeller, for eksempel er forbruket lavere i Helseregion Nord, enn i de tre sørlige helseregionene. Forskjellene i forbruk kan skyldes ulik forskrivningspraksis og i noen grad forskjeller i forventninger hos publikum. Tilgang til medisinske tjenester og apotek kan også spille en rolle.
Som et ledd i operasjonaliseringen av strategien mot antibiotikaresistens, vil regjeringen i løpet av 2015 også fremme en handlingsplan i helsevesenet mot utbredelsen av antibiotikaresistente bakterier, med mål om å redusere antibiotikabruken i befolkningen med 30 pst. innen utløpet av 2020. Helse- og omsorgsdepartementet har gitt Folkehelseinstituttet i oppdrag å lage utkast til en slik handlingsplan. Sentrale momenter i handlingsplanen vil være hvordan tiltakene skal gjennomføres og organiseres, og hvordan nedgangen i antibiotikabruk skal måles (indikatorer). Det er viktig å benytte effektive virkemidler for å påvirke antibiotikabruken.
En rekke studier har vist at det er vanskelig å påvirke legers forskrivningspraksis. Prosjekter hvor leger diskuterer egne forskrivningsmønstre i kollegabaserte grupper har vist seg å være effektive tiltak17, jf. kapittel 8.
Det er to kompetansesentre i Norge som arbeider for å fremme rasjonell og begrenset bruk av antibiotika, ett for primærhelsetjenesten og ett for spesialisthelsetjenesten. Antibiotikasenteret for primærmedisin (ASP) har ansvar for oppdatering av retningslinjene for antibiotikabruk i allmennpraksis. De skal arbeide for å fremme forståelse for riktig antibiotikabruk ved informasjon rettet mot forskrivere og befolkningen, samt gjennom forskning, kvalitetssikring, fagutvikling og kursvirksomhet rettet mot leger i primærhelsetjenesten. Nasjonal kompetansetjeneste for antibiotikabruk i spesialisthelsetjenesten (KAS) skal bidra til ansvarlig og riktig antibiotikabruk i sykehus, gjennom støtte til implementering og revisjon av nasjonale faglige retningslinjer.
Nær 90 pst. av all antibiotika forskrives i primærhelsetjenesten. Tannleger står for om lag fem pst. av antibiotikaforskrivningen, målt i DDD. I den nyeste utgaven av nasjonal faglig retningslinje for antibiotikabruk i primærhelsetjenesten fra 2013, er det inkludert et nytt kapittel om tannbehandling og et eget nytt kapittel om antibiotikabehandling hos barn.
Boks 13.1 Antibiotikafrie resepter
Folkehelseinstituttet har utarbeidet flere faktabrosjyrer, «Når barnet ditt har… halsbetennelse / feber / ørebetennelse / bronkitt», til bruk for leger i konsultasjon med småbarnsforeldre. Brosjyrene underbygger budskapet om at barnets infeksjon vil gå over av seg selv – uten behandling med antibiotika. Brosjyrene er derfor kalt «antibiotikafrie resepter».
De antibiotikafrie reseptene inneholder informasjon om barnets tilstand, og hvorfor antibiotika ikke har noen effekt på denne. De forteller også hva foreldrene selv kan gjøre for å lindre sitt barns plager, og hva foreldrene må være spesielt oppmerksomme på.
Det er viktig å ha objektive mål og gode målemetoder for bruk av antibiotika. I Sverige er det nylig innført mål for forskrivning av antibiotika (250 resepter/1000 innbyggere/år). Til sammenlikning ble det i Norge i 2014 forskrevet 428 antibiotikaresepter/1000 innbyggere/år. Konkrete mål for antibiotikaforskrivning vil være viktig i arbeidet mot antibiotikaresistens også i Norge. I forbindelse med nasjonalt kvalitetsindikatorsystem (jf. kapittel 9) er det nedsatt en nasjonal kvalitetsindikatorgruppe som utarbeider ulike kvalitetsindikatorer knyttet til antibiotikabruk og helsetjenesteassosierte infeksjoner i helsetjenesten. Etter planen vil fire kvalitetsindikatorer som kan gi et bilde på bruk av antibiotika på kommunenivå bli publisert på helsenorge.no i løpet av 2015.
På sykehus og sykehjem brukes oftere bredspektret antibiotika og det brukes høyere doser. Flytting av pasienter mellom institusjoner kan føre til spredning av antibiotikaresistens. Det er derfor viktig å få bedre oversikt over antibiotikabruken i institusjoner. I dag finnes kun oversikt over bruk av antibiotika på avdelingsnivå i sykehus, mens det ikke finnes noen samlet oversikt over antibiotikaforbruket i sykehjem, jf. også kapittel 8.
For individer som har fått antibiotika på resept, gir Reseptregisteret i dag god oversikt over forbruket av ulike antibiotika med hensyn til alder, kjønn og geografisk fordeling. Opplysninger om diagnose mangler imidlertid i Reseptregisteret, og det er derfor ikke mulig å få oversikt over hvilke typer antibiotika som brukes i behandlingen av ulike infeksjonssykdommer. Dette gjør det vanskelig å vurdere om dagens forskrivningspraksis er i tråd med anbefalinger i retningslinjene. Ved å innføre krav om diagnosekoder på alle antibiotikaresepter, eller på annen måte sørge for at opplysninger om diagnose inngår i Reseptregisteret, vil registeret kunne gi statistikk som er nyttig for kvalitetssikring av antibiotikabruk, styring og planlegging. Videre vil diagnosekoder kunne legge til rette for bedre tilbakemeldinger til forskriver, og øke forståelsen av forskrivningsmønstre i fagfellediskusjoner. Legene vil kunne bruke denne kunnskapen som grunnlag for internkontroll og kvalitetsforbedring.
Stortinget vedtok 17. februar 2015 (vedtak nr. 425) anmodning til regjeringen om: «snarest å innføre krav om diagnosekoder ved forskrivning av antibiotika på alle typer resepter, på en måte som ivaretar personvernet». Helse- og omsorgsdepartementet har gitt Helsedirektoratet i oppdrag å vurdere mulige løsninger for å innføre krav om diagnosekoder på alle antibiotikaresepter, herunder behov for juridiske og tekniske rammer.
13.2 Bruk av legemidler ved psykiske lidelser og smertetilstander
Regjeringen satser særlig på å gi mennesker med psykisk helse- og rusproblemer et styrket tilbud. Eksempler på dette er gjeninnføringen av den gylne regel om at psykisk helsevern og rusbehandling hver for seg skal ha større vekst enn somatikk, styrking av kommunenes frie inntekter for å bedre psykisk helsetjenester og helsestasjon- og skolehelsetjenesten og øremerkingen av 100 mill. kroner til kommunalt rusarbeid i statsbudsjettet for 2015. Det har de senere årene vært en markant økning i forskningsinnsatsen innenfor psykisk helse både gjennom helseforskningsprogrammene i Norges forskningsråd, og i de regionale helseforetakene.
Meld. St. 26 (2014–2015) Fremtidens primærhelsetjeneste – nærhet og helhet, presenterer en rekke tiltak som skal bidra til å styrke tjenestene til mennesker med psykisk helse- og rusproblemer. Blant de mest sentrale tiltakene er innføring av krav om psykologkompetanse i de kommunale helse- og omsorgstjenestene, innføring av betalingsplikt for utskrivningsklare pasienter innen psykisk helsevern og tverrfaglig spesialisert rusbehandling (TSB), tydeliggjøring av at den kommunale plikten til øyeblikkelig hjelp døgntilbud også gjelder mennesker med psykisk helse- og rusproblemer og gjennomføringen av en forsøksordning med kommunalt driftsansvar for distriktspsykiatriske sentre (DPS). Videre skal det fremmes en opptrappingsplan for rusfeltet i løpet av 2015.
Tiltakene er ment å skape et mer forutsigbart, likere og faglig mer solid lokalt tilbud til mennesker med psykisk helse- og rusproblemer. Ved å flytte kompetanse, oppfølging og behandling nærmere der brukerne bor, senkes terskelen for å få hjelp og mulighetene for tidlig og rask intervensjon øker.
Regjeringen vil også inkludere psykisk helse som en likeverdig del av folkehelsearbeidet. I Meld. St. 19 (2014–2015) Folkehelsemeldingen beskrives flere tiltak med mål om at flere skal oppleve god psykisk helse og trivsel, og at de sosiale forskjellene i psykisk helse skal reduseres.
Flere bruker- og pasientorganisasjoner innen psykisk helse har etablert en fellesaksjon for medikamentfrie tilbud innen psykisk helsevern. Departementet har fulgt opp dette gjennom oppdrag til de regionale helseforetakene for 2015.
13.2.1 Bruk av psykofarmaka
Legemidler til bruk ved psykiske lidelser kalles også psykofarmaka. I tillegg til beroligende legemidler og sovemidler jf. kapittel 13.2.2, inngår hovedsaklig legemidler ved depressive lidelser (antidepressiva), og antipsykotika til behandling av blant annet schizofreni i denne gruppen.
Legemidler er et av flere behandlingstilbud ved depresjon og bør alltid brukes i kombinasjon med andre tiltak som samtaleterapi, psykososial intervensjon mv. Pasienter som skal starte behandling med antidepressiva bør få både muntlig og forståelig skriftlig informasjon. Pasienten skal også tilbys tett oppfølging av effekt og bivirkning.
314 000 personer over 18 år (7,8 pst.) av den norske befolkningen fikk utlevert minst én resept på et antidepressiva i 2014. Andelen brukere av antidepressiva har vært nesten konstant i perioden 2005–2014. Det er en høyere andel kvinner, enn menn som bruker antidepressiva.
I 2014 fikk 2,7 pst. av den voksne befolkningen utlevert et antipsykotikum minst én gang. I aldersgruppen 18–39 år var andelen kvinner og menn like store, men i eldre grupper er det en større andel blant kvinner, enn blant menn som får antipsykotika. Kjønnsforskjellene øker med alderen, og er størst i aldersgruppen over 65 år. I denne aldersgruppen er andelen brukere av antipsykotika blitt noe mindre i perioden fra 2005 til 2014, både blant kvinner og menn.
Bruken av vanedannende legemidler er mye hyppigere blant brukere av antidepressiva enn i befolkningen generelt, dette gjelder for både kvinner og menn og i alle aldersgrupper. Pasienter med psykiske lidelser er en sårbar pasientgruppe som har mange utfordringer og som trenger differensiert behandling. Det er behov for mer forskning der man blant annet kobler bruken av disse legemidlene til diagnoser.
Fra 2005 til 2014 har det vært en sterk økning i antall personer i aldersgruppen 15 til 19 år som bruker antidepressiva, i følge tall fra Reseptregisteret. I denne 10-årsperioden har det vært en økning på 28 pst. i antall brukere av antidepressiva blant unge menn, og en økning på 37 pst. blant unge kvinner. Økningen har vært langt mindre i andre aldersgrupper. Endringer i legemiddelbruk påvirkes av en rekke faktorer og kan ikke brukes alene som indikator på endringer i sykeligheten.
Legemiddelverket og de europeiske legemiddelmyndighetene advarte i 2003 mot bruk av antidepressiva hos unge. Folkehelseinstituttet gjennomførte en oppfølgingsstudie med data fra Reseptregisteret som viste at advarselen ga en forbigående reduksjon i bruken av antidepressiva hos barn og unge på 17 pst. fra 2004–200518.
Informasjonen om at bruk av antidepressiva kan gi risiko for psykiske bivirkninger hos unge er kjent for legemiddelmyndighetene, og informasjon er tidligere gitt av Legemiddelverket og i andre kanaler. Psykiske bivirkninger hos unge, inkludert selvmordstanker og selvmordsatferd er omtalt i preparatomtale og pakningsvedlegg for antidepressiva i Norge.
Legemiddelverket vurderer løpende nytten mot risikoen ved bruk av legemidler. Denne vurderingen gjøres både på nasjonalt og internasjonalt nivå, basert på informasjon fra innrapporterte bivirkningsmeldinger (spontanrapporter) og informasjon fra kliniske studier. Alle legemidler blir evaluert i periodevise sikkerhetsrapporter (PSUR) hvor man gjør rede for all bivirkningsinformasjon som har vært tilgjengelig innenfor en tidsperiode. De fleste antidepressiva gjennomgås i en syklus på tre eller fem år. På bakgrunn av den informasjonen som avdekkes gjennom denne kontinuerlige nytte/risiko-vurderingen, har myndighetene mulighet til å iverksette tiltak som å gi nye advarsler, endre forskrivningsregler og lignende. Ofte fører nytte/risiko-vurderingen til at preparatomtale og pakningsvedlegg blir oppdatert med ny informasjon, som dermed blir tilgjengelig for helsepersonell og pasienter.
Det er fortsatt behov for mer kunnskap om bruk av antidepressiva hos unge. Det mangler gode kliniske langtidsstudier på bruk av antidepressiva, og det er høy grad av publikasjonsskjevhet på området. Helsedirektoratet vil vurdere behovet for et oppdatert kunnskapsgrunnlag for medikamentell behandling av depresjon, særlig hos unge. Folkehelseinstituttet vil ved hjelp av Reseptregisteret, eventuelt med kobling til andre datakilder, studere bruken av antidepressiva blant unge nærmere, blant annet for å få mer kunnskap om hva som kjennetegner brukere og forskrivere av disse legemidlene.
13.2.2 Bruk av vanedannende legemidler
Vanedannende legemidler omfatter i hovedsak sovemidler, angstdempende midler, sentralt virkende smertestillende midler (opioider), sentralstimulerende midler (legemidler brukt i behandling av ADHD/narkolepsi), midler til behandling av opioidavhengighet og enkelte hostestillende midler.
Psykiske lidelser og ulike smertetilstander er utbredt, og riktig behandling av pasienter med disse lidelsene er viktig. Mange av pasientene med disse tilstandene blir behandlet med ulike typer legemidler og flere av legemidlene som forskrives kan potensielt være vanedannende. Brukt på en forsvarlig måte kan disse legemidlene være til stor nytte, men det kan også utvikles skadelig bruk, ofte i kombinasjon med alkohol og/ eller illegale rusmidler og det kan utvikles avhengighet. Bruk av vanedannende legemidler kan også gi uheldige korttidseffekter slik som redusert koordinasjon, fall, redusert kognitiv funksjon og ruseffekt.
Tall fra Reseptregisteret viser at rundt 900 000 nordmenn får utlevert minst én resept på smertestillende, angstdempende eller søvngivende legemidler i løpet av ett år. En stor andel (30–60 pst.) av brukerne får kun en utlevering i løpet av et år19. Noen bruker imidlertid disse legemidlene over lang tid. Andelen av befolkningen som bruker vanedannende legemidler øker med alderen og flere kvinner enn menn bruker slike legemidler.
Smertestillende opioider er de mest brukte vanedannende legemidlene i Norge, og over en halv million mennesker hentet ut opioider på apoteket i 2013. Av disse fikk rundt 54 000 sterke opioider.
Sovemidler er den nest mest brukte gruppen. Det finnes to grupper sovemidler, benzodiazepiner og z-hypnotika (benzodiazepinlignende). Over 350 000 personer fikk z-hypnotika i 2013, mens i underkant av 30 000 fikk sovemidler som inneholder benzodiazepiner. En stor gruppe mennesker bruker også angstdempende legemidler som inneholder benzodiazepiner. Rundt 250 000 personer fikk slike legemidler i 2013.
Etter en gradvis økning i bruken av opioider fra 1999 har den totale bruken av opioider vært relativt stabilt i perioden 2010–2013. Det har imidlertid vært en økning i bruken av sterke opioider i perioden 2005 til 2013. Dette kan henge sammen med at det i perioden har vært stor oppmerksomhet på optimal smertelindring hos pasienter med ikke-kreftrelaterte kroniske smerter. Opioidbruk blant denne gruppen har blitt mer akseptert og kanskje kan dette forklare noe av den økte bruken.
Bruk av benzodiazepiner som sovemiddel har gått ned etter at z-hypnotika kom på markedet på 1990-tallet. Bruken av z-hypnotika økte kraftig i starten og de dominerer i dag sovemiddelmarkedet. Bruken har imidlertid flatet ut, og det ses en svak nedgang de siste årene. Blant nye brukere av z-hypnotika fortsetter omtrent 20 pst. å bruke disse i lang tid (minst 4 år). Over halvparten av de som bruker disse over lang tid, har et forbruksnivå som tilsvarer nesten daglig bruk. Dette tyder på at forskrivningen ofte avviker fra det som er anbefalt bruk. I situasjoner hvor det blir avdekket langvarig bruk utover indikasjon bør fastlege søke veiledning hos spesialisthelsetjenesten. Det er behov for videre forskning for å undersøke eventuelt uheldige sider ved slik bruk.
Det er til dels store regionale forskjeller i bruken av vanedannende legemidler i Norge, og forskjellene holder seg over tid. Det er ikke dokumentert at dette skyldes forskjeller i sykelighet. De geografiske forskjellene reflekterer trolig ulik forskrivningspraksis eller terapitradisjoner.
Forbruket av vanedannende legemidler i Norge skiller seg ikke vesentlig ut fra forbruket i de andre nordiske landene. Forbruket av opioider i Norge ligger høyere enn forbruket i Finland, men på nivå med de andre nordiske landene. Norge har et høyere forbruk av angstdempende benzodiazepiner enn Sverige og Danmark, men lavere enn Finland og Island. Forbruket av sovemidler varierer mye mellom de nordiske landene. Island brukte mest, Danmark minst, mens de andre landene ligger på omtrent samme nivå.
Også kortvarig bruk av vanedannende legemidler kan gi bivirkninger. Det kan dreie seg om økt falltendens, nedsatt kjøreferdighet, kortsiktig hukommelsestap og psykiske reaksjoner. Det er viktig at legen informerer pasienten om både nytte og risiko ved behandlingen, og at det ved oppstart avtales behandlingsvarighet og plan for avslutning.
Helsedirektoratet publiserte i april 2014 en oppdatert veileder om rekvirering og forsvarlighet av vanedannende legemidler. Målet med veilederen er å gi god faglig støtte til helsepersonell som rekvirerer vanedannende legemidler, slik at avhengighet kan unngås og pasienter som allerede er avhengige kan få hjelp til å trappe ned.
En viktig anbefaling fra veilederen er at forskriver skal vurdere ikke-medikamentelle tiltak og eventuell annen legemiddelbehandling før behandling med vanedannende legemidler. En slik vurdering skal gjøres i samarbeid med pasienten.
Samtidig bruk av flere vanedannende legemidler er et problem som angår mange pasienter. Den nye veilederen anbefaler at forskriver kun rekvirerer ett vanedannende legemiddel til samme pasient, siden samtidig bruk av slike legemidler kan gi forsterkede effekter og uheldige bivirkninger. Videre anbefaler veilederen at bare en rekvirent – fastlegen – bør forskrive vanedannende legemidler, og at det ved oppstart legges en plan for behandlingsvarighet og nedtrapping. Det er behov for å følge utviklingen av kombinasjonsbruken fremover, noe som forutsetter gode registerdata som grunnlag for forskning.
I oktober 2014 ble også en oppdatert nasjonal faglig veileder i bruk av opioider ved langvarige ikke-kreftrelaterte smerter utgitt av Helsedirektoratet. I veilederen legges det vekt på at fastlegen skal være ansvarlig for behandlingen, og at det må legges en individuell behandlingsplan i samarbeid med pasienten.
Som et ledd i implementeringen av veilederne vil Helsedirektoratet i løpet av våren 2015 ha gitt midler til et eget veiledningsopplegg for allmennleger om behandling med vanedannende legemidler. Videre vil veilederne for bruk av vanedannende legemidler og opioider i løpet av 2015 overføres til Helsedirektoratets nye publiseringsverktøy for retningslinjer. I det nye publiseringsverktøyet vil innholdet bli strukturert, noe som blant annet vil legge til rette for å kunne vise anbefalingene som beslutningsstøtte i elektroniske journalssystemer.
Forskrivning og bruk av vanedannende legemidler truer i mange sammenhenger pasientsikkerheten og er et hyppig tema i tilsynssaker. Helsetilsynets tilsynsansvar omfatter overordnet tilsyn/områdeovervåking, hendelsesbasert og planlagt tilsyn inkludert tilsynsbasert veiledning. For at tilsynsmyndighetene skal kunne opprette en tilsynssak, forutsetter det at det foreligger en bekymringsmelding om utforsvarlig forskrivning/rekvirering. De fleste slike meldinger kommer i dag fra apotekene. Apotekbransjen har uttrykt behov for en mer forutsigbar saksbehandling av bekymringsmeldinger hos Fylkesmannen og et ønske om at avsender skal forbli anonym. Apotekbransjen har også uttrykt behov for en mer konkret veiledning om hvordan apotekene skal håndtere mistanke om uforsvarlig rekvirering og skadelig bruk.
I den nasjonale faglige veilederen for rekvirering og bruk av vanedannende legemidler er det beskrevet aktuelle handlingsalternativer for apotekansatte, samtidig som det påpekes at enhver situasjon er unik. Dette krever at apotekpersonalet i hver enkelt situasjon må gjøre en selvstendig vurdering på hvilke tiltak som er best egnet. Apotekansatte må derfor ha erfaring og kunnskap om å kunne håndtere slike situasjoner på en god måte. Apotekforeningens kurssenter Apokus vil i 2015 utvikle et kompetansehevende kurs om vanedannende legemidler for ansatte i apotek.
Ved mistanke om uforsvarlig forskrivning av vanedannende legemidler viser det seg ofte at legen ikke har tilstrekkelig oversikt over den mengden som forskrives til hver enkelt pasient. Tilsynsmyndighetene har en utfordring med å få sikret reseptdata på en enhetlig og enkel måte, da dette fordrer at journalsystemene har funksjonalitet for å få oversikt over forskrevet mengde. Enkelte leger er ikke kjent med hensiktsmessig bruk av vanedannende legemidler, særlig knyttet til behandlingseffekt over tid, og mangler et bevisst forhold til hvilken måte avhengighet kan utvikles på. Det forventes at den oppdaterte veilederen vil føre til en bedre praksis blant forskrivende leger.
Helsetilsynet har benyttet elektroniske verktøy for innsamling og sammenstilling av reseptdata i tilsynssaker siden 2005, men opplever at det er krevende å få tilgang til nødvendige data i legenes journalsystem. Reseptregisteret inneholder data om legers forskrivning, men bruken av slike data er avgrenset fra individrettet innsyn jf. forskrift om reseptregisteret § 1-3 pkt 3. som kun hjemler et overordnet tilsyn. I utredningen av en felles legemiddelliste bør det også vurderes om tilsynsmyndighetene kan få tilgang til data til bruk innenfor tilsynets ansvarsområde.
Boks 13.2 Tilbaketrekking av Somadril
Data fra Reseptregisteret og andre studier fra Norge har vist økt risiko for forgiftninger, misbruk eller avhengighet ved bruk av Somadril (karisoprodol). Dette bidro til at Somadril ble trukket fra markedet i 2008, både i Norge og EU. Senere studier har vist at avregistreringen har redusert problemene som var knyttet til bruken av Somadril. Pasienter som tidligere brukte Somadril har i liten grad gått over til å bruke andre legemidler med potensial for skadelig bruk.
13.3 Legemiddelassistert rehabilitering
Legemiddelassistert rehabilitering (LAR) er et behandlingstilbud for rusavhengige som har utviklet en opiatavhengighet. LAR innebærer at pasienten får legemidler (metadon eller Subutex/Suboxone) som forhindrer abstinens. I tillegg til medikamenter forutsettes også at pasienten skal ha oppfølging av fastlege og motta andre kommunale tjenester i tillegg til nødvendig oppfølging av spesialisthelsetjenesten.
Tilbud om legemiddelassistert rehabilitering i organisert form ble første gang gitt i 1991 som et prøveprosjekt (HIV-MET) til 25 hiv-positive opiatavhengige. Som en følge av metadonbehandling skulle pasientene bli stabilisert og få bedre nytte av den medisinske behandling for hiv-infeksjonen. Resultatene fra HIV-MET var positive og forsøket ble i 1994 utvidet til 50 pasienter (MiO). Erfaringene fra MiO var også positive. I 1997 vedtok Stortinget at LAR skulle bli et landsdekkende tilbud fra 1998.
Etter Rusreformen i 2004 ble ansvaret for behandling av rusavhengige (inkludert LAR) overført fra fylkeskommunene til de regionale helseforetakene. Fra 2010 er LAR regulert gjennom en forskrift om legemiddelassistert rehabilitering. Samtidig ga Helsedirektoratet ut Nasjonal retningslinje for legemiddelassistert rehabilitering for opiatavhengighet.
Fra 1998 til 2014 har rundt 10 000 opiatavhengige vært inkludert i LAR. Ved utgangen av 2014 var det noe over 7 430 i aktiv behandling. Fra 2004 har de regionale helseforetakene hatt ansvaret for legemiddelkostnadene i LAR, fra 2014 har helseforetakene også hatt ansvaret for utleveringskostnadene. Statusrapporten for 2014 fra SERAF (Senter for rus- og avhengighetsforskning ved UiO) viser at 52 pst. av LAR-pasientene fikk utlevert LAR-legemidler på apotek, 28 pst. fra kommunale tjenester, 16 pst. fra fastlege og fengselshelsetjeneste o.l. og 4 pst. fra LAR-tiltak.
Rapporten viser videre at 43 pst. av LAR-pasientene ble behandlet med metadon og 57 pst. med et buprenorfin (Subutex 35 pst./Suboxone 21 pst.).
Helsedirektoratet anbefaler buprenorfin som førstevalg. Den høye andelen pasienter som bruker metadon, skyldes for en del at metadon var det første legemidlet som ble brukt i LAR, mens buprenorfin først ble tilgjengelig noen år senere. Metadon gir større fare for bivirkninger, overdosering og dødsfall enn buprenorfin.
LAR er den behandlingsform for opiatavhengige som har best dokumentert effekt. Frafallsprosenten i LAR er langt lavere enn ved ikke-medikamentell behandling av opiatavhengige pasienter. Statusrapport fra SERAF (Senter for rus- og avhengighetsforskning) for 2013 viser at 2/3 av pasientene er rusfrie eller har oppnådd en betydelig bedring i sin livssituasjon.
Norge har i mange år ligget høyt på den europeiske statistikken over antall overdosedødsfall. De senere årene har antall overdosedødsfall gått ned, men det er fortsatt mange som hvert år dør av overdoser. Det er registrert en økning i antall overdosedødsfall som hovedsakelig skyldes inntak av metadon. I 2013 var det like mange overdosedødsfall med metadon som med heroin. Det er grunn til å tro at legalt forskrevet metadon i LAR har blitt omsatt på det illegale markedet. Helsedirektoratet har fått i oppdrag å gjennomføre en femårig overdosestrategi der overdoser ved metadon er et viktig element. I tillegg vil Helsedirektoratet revidere den nasjonale retningslinjen for LAR. Ved denne gjennomgangen vil også henteordning for LAR-legemiddel bli vurdert.
Helse Stavanger har i januar 2015 kunngjort anbud overfor apotekene om utlevering av LAR-legemidler fra apotek. OUS forsøkte en slik anbudsprosess i 2014 uten å få noen tilbud fra apotekene. Bortsett fra dette er det ikke gjennomført noen anbudskonkurranse for utlevering av LAR-legemidler i noen helseregion. Helse- og omsorgsdepartementet har i februar 2015 i brev til Statens legemiddelverk fastslått at det ikke gjelder en ubetinget rett til fritt apotekvalg i tilfeller der apotek utleverer LAR-legemidler på oppdrag fra spesialisthelsetjenesten. I slike tilfeller kan pasientens valg av apotek begrenses til de apotek som spesialisthelsetjenesten har inngått avtale om utlevering med.
Helsedirektoratet ga i 2012 ut Nasjonal retningslinje for gravide i legemiddelassistert rehabilitering (LAR) og oppfølging av familiene frem til barnet når skolealder. Retningslinjen anbefaler at kvinner som blir gravide i LAR fortsetter med LAR. I tillegg anbefaler den at gravide opiatavhengige som ikke er i LAR søker oppstart i LAR. Disse anbefalingene bygger på kunnskap som viser at det går best med foster og barn dersom den gravide blir stabilisert i LAR. Hos pasienter i ikke-medikamentell behandling er frafallet betydelig høyere sammenliknet med LAR. Faren for overdose ved tilbakefall til aktiv rus er derfor stor.
I tråd med retningslinjene skal kvinner som er i LAR og som blir gravide få tilbud om nedtrapping dersom de ønsker det – forutsatt at nedtrappingen kan gjennomføres under betryggende forhold. Videre har Helse- og omsorgsdepartementet i brev til Stortinget påpekt at det er enighet i berørte fagmiljøer på LAR-området at det mangler kunnskap om hvordan fosteret blir påvirket av LAR-legemidler i løpet av svangerskapet.
Dessuten er det også mangelfulle kunnskaper om hvordan barn som er født av mødre under LAR utvikler seg i skolepliktig alder. I brevet til Stortinget ble det understreket behovet for mer forskning på de nevnte områdene.
14 Veterinære legemidler
14.1 Godkjenning av veterinære legemidler
Legemidler til dyr godkjennes med tilsvarende krav og gjennom de samme prosedyrene som legemidler til mennesker. Det innebærer at søknaden om markedsføringstillatelse må vedlegges dokumentasjon av legemidlets kvalitet, sikkerhet og effekt, og markedsføringstillatelse gis bare dersom nytte-/risikoforholdet er dokumentert positivt. Sikkerhetsdokumentasjonen må vise at legemidlet er sikkert for dyr som behandles, for miljøet, for de som tilfører legemidlet til dyr og for de som spiser næringsmidler fra dyr som er behandlet med legemidlet. De fleste legemidler til dyr godkjennes i samarbeid med EUs legemiddelbyrå (EMA) og de øvrige legemiddelmyndighetene i EØS-området.
Legemidlenes effekt på miljøet er en viktig del av vurderingen ved godkjenningen, og miljøeffekter vektlegges i den endelige nytte-/risikovurderingen av legemidlet. En søknad om markedsføringstillatelse for legemidler til flokkdyr må derfor inneholde omfattende miljødokumentasjon.
I EU-samarbeidet kan norske legemiddelmyndigheter argumentere for sitt syn. De vil imidlertid ikke alltid få gjennomslag og har derfor begrensede muligheter til å påvirke godkjenningen av antibakterielle midler. Det blir godkjent legemidler som ikke har en naturlig plass innenfor norsk antibakteriell terapitradisjon, og disse midlene kan markedsføres også her i landet.
14.2 Forslag til nytt EU-regelverk for veterinære legemidler
Europakommisjonen la 8. september 2014 fram utkast til nytt regelverk for godkjenning og bruk av veterinære legemidler. Forslaget er sendt til Parlamentet og Rådet. Det forventes at et nytt regelverk blir endelig vedtatt tidligst i 2017. Forslaget viderefører i stor grad det eksisterende regelverket, men inneholder også en del viktige endringer som omtales under.
Formålet med forslaget er å øke tilgjengeligheten av veterinære legemidler, effektivisere godkjenningsordningene, stimulere til økt konkurranseevne og innovasjon, gi et mer effektivt indre marked og hindre resistensutvikling.
For å hindre resistens skal søknader for antibiotika inneholde forslag til tiltak som hindrer slik utvikling. Myndighetene skal videre samle og rapportere data om salg og bruk av antibiotika. For å sikre fortsatt effekt hos mennesker får Europakommisjonen rett til å begrense eller forby bruk av nærmere bestemte antibiotika til dyr. Tiltakene mot resistensutvikling støttes også av EU-kommisjonens forslag til nytt regelverk for medisinert for.
Markedet for veterinære legemidler er begrenset for en rekke lite tallrike dyrearter. Dette gir begrenset mulighet til fortjeneste, og det foreslås derfor å forlenge beskyttelsen mot generisk konkurranse, som et incentiv til å utvikle nye legemidler. Legemidler har i dag normalt 10 års markedsbeskyttelse mot generisk konkurranse. Denne beskyttelsen beholdes for legemidler til de tallrike dyreartene storfe, sau, gris, kylling, hund og katt. For lite tallrike dyrearter, som for eksempel fisk, utvides dokumentbeskyttelsen til 14 år, og den samme beskyttelsen gjelder for nye antibiotika. Produsentene kan få forlenget beskyttelse hvis de får godkjent legemidlene til nye arter, men forlengelsen kan maksimalt bli 18 år. Videre innebærer forslaget at flere legemidler vil og kan bli godkjent i EUs sentrale prosedyre.
I samarbeidsprosedyrene, jf. kapittel 3.2, skal CMD(V) nå kunne fatte flertallsbeslutninger om godkjenning. Koordineringsgruppen CMD(V) består av representanter fra EØS-landenes legemiddelmyndigheter. Ved uenighet må slike saker i dag behandles av EMA, og endelig beslutning fattes av Europakommisjonen. Berørte land vil etter forslaget ikke motta selve søknaden, kun referanselandets utredning og forslag til informasjon.
Det foreslås også å åpne for at legemidler kan godkjennes med begrenset dokumentasjon av sikkerhet og effekt dersom legemidlet er beregnet på et begrenset marked. I det framlagte forslaget vil det gjelde for legemidler til alle andre dyrearter enn storfe, sau, gris, kylling, hund og katt. Legemidler til oppdrettsfisk vil derfor kunne godkjennes på denne måten.
Departementets vurdering av forslaget
Forslaget inneholder en rekke bestemmelser som kan bidra til å fremme de angitte målene. Det er et stort behov for nye legemidler. Det en utfordring for akvakultur, husdyrbruk og kjæledyreiere at det er få legemidler som har markedsføringstillatelse.
Regjeringens grunnleggende holdning til lovforslaget er derfor positiv. Her fremheves særlig de tiltakene som foreslås for å hindre resistensutvikling, samt insentiver for å få utviklet nye antibiotika og legemidler generelt. Forslaget som gir Europakommisjonen rett til å begrense eller forby bruk av nærmere bestemte antibiotika til dyr vil på sikt kunne hindre resistensutvikling og sikre mennesker nødvendig behandling ved sykdom.
I en del land innenfor EØS har veterinærer rett til å selge antibiotika. Forskrivning og bruk av antibiotika bør utelukkende være basert på faglige grunner. Når en veterinær har mulighet til å tjene penger på salg, kan dette føre til at det brukes mer antibiotika enn nødvendig. Departementet ønsker å påvirke EU slik at det blir forbud mot at veterinærer kan selge antibiotika.
Sentral prosedyre er en effektiv godkjenningsordning der søknaden underlegges grundig vitenskapelig vurdering. Økt bruk av sentral prosedyre kan gi økt tilgjengelighet av veterinære legemidler. Dette er positivt, men økt sentralisering kan føre til at de nasjonale legemiddelmyndighetene bygges ned på grunn av få oppgaver og avgiftsfinansiering. Med dette mister man lokal kunnskap som er viktig ved godkjenning av veterinære legemidler.
I samarbeidsprosedyrene vil kvaliteten på godkjenningen være en sum av referanselandets utredning og innspill fra de øvrige nasjonale legemiddelmyndighetene. Kvaliteten på godkjenningen kan svekkes dersom de berørte landene ikke får tilgang til søknaden, men må forholde seg til utrederlandets rapport. Dette vil svekke norske legemiddelmyndigheters mulighet til å vurdere om legemidlets nytte/-risikoforhold er positivt også når det brukes på dyr i Norge. Norske legemiddelmyndigheter har i en årrekke vært en pådriver for å begrense resistensutvikling ved å bidra til at godkjent bruksområde for antibiotika gjøres så snevert som mulig. Uten tilgang til søknaden, vil dette bli vanskelig.
Forslaget til nytt EU-regelverk åpner for at legemidler til fisk kan godkjennes med begrenset dokumentasjon. Dersom dette blir gjennomført, kan man risikere påstander om at fisk fra norsk oppdrettsnæring ikke er trygg. Med den betydelige oppdrettsnæringen som finnes i Norge og i EU, bør det være økonomisk grunnlag for å kreve at produsentene av legemidler til laks fremlegger full dokumentasjon av legemidlenes sikkerhet og effekt.
Ved uenighet mellom landene i samarbeidsprosedyrene, bør sakene fortsatt løftes til EMA og Europakommisjonen. Her vil uenigheten drøftes av komiteen for legemidler til dyr (CVMP) som har stor legemiddelfaglig kompetanse. Her deltar også eksperter fra Norge. En endelig kommisjonsbeslutning vil også sikre at beslutningen er godt rettslig forankret. Hvis ikke må CMD(V) tilføres betydelig vitenskapelig kompetanse. Den danske Regjeringen har uttrykt at de anser en slik bestemmelse for å stride mot Lisboatraktaten.
Regjeringen vil følge forhandlingene om nytt regelverk for veterinære legemidler nøye, og norske synspunkter er allerede formidlet til Europaparlamentet, EU-kommisjonen og EUs medlemsland.
14.3 Ansvarlig bruk av legemidler
I intensiv husdyrproduksjon er gode driftsrutiner og optimal ernæring viktige elementer for å hindre sykdom. Bruk av legemidler må fremme dyrehelsen, hindre unødvendig resistensutvikling og ikke belaste miljøet unødvendig.
Bryter det ut infeksjon i et oppdrettsanlegg, må hele lokaliteten behandles. Behandling av samtlige individ kan også unntaksvis være nødvendig ved smittsom sykdom hos landdyr, som for eksempel i en slaktekyllingflokk med flere tusen dyr. Både syke og friske dyr behandles, og forbruket av legemidler blir derfor større enn om en kan drive individuell behandling. Forebyggende arbeid for å unngå sykdom og behov for behandling er enda viktigere i store dyreflokker enn der det kan drives enkeltdyrbehandling.
Riktig bruk av legemidlene kan være en stor utfordring ved flokkbehandling fordi det dreier seg om så mange individer uten at en kjenner absolutt antall og vekt. Legemidler med god avstand mellom terapeutisk dose og dose som kan ha uheldig effekt er derfor av stor betydning for å unngå underdosering.
Samarbeidet om behandling av søknader om markedsføringstillatelse medfører at det blir godkjent legemidler i Norge som ikke har en naturlig plass innenfor norsk antibakteriell terapitradisjon. Det samme gjelder for mange av de anti-parasittmidlene som godkjennes, spesielt til hund og katt, og som ikke har noen naturlig plass i parasittbehandlingen av norske husdyr. Resistensrisiko er det også for legemidler mot parasitter. Norge er foreløpig i en gunstig situasjon sammenlignet med mange EU-land. Det er viktig å unngå unødvendig parasittbehandling for å hindre eller bremse utviklingen av resistens. Dette ivaretas best ved at behandling kun gjøres etter påvisning og identifisering av parasitter, eksempelvis av veterinær. Godkjennes disse legemidlene som reseptfrie i EØS, mister Norge muligheten til å styre parasittbehandlingen via veterinærene. Det er derfor svært viktig at de norske terapianbefalingene til husdyr og kjæledyr jevnlig oppdateres.
For å fremme bruk av antibiotika og antiparasittmidler i samsvar med norsk tradisjon og reelt medisinsk behov, bør det gis regler som sikrer at dyrehelsemyndigheter og legemiddelmyndigheter kan gi konkrete og bindende anbefalinger for hvordan nye legemidler til dyr skal brukes. Preparatomtalene for slike legemidler legger opp til at de enkelte land skal kunne gi anbefalinger ut fra nasjonale og lokale forhold.
I Norge har fiskehelsebiologer, i tillegg til veterinærer, rett til å rekvirere legemidler til akvatiske dyr, unntatt sjøpattedyr. Dette skal sikre at det er nok personell med kompetanse til å diagnostisere sykdom, og som kan drive en ansvarlig forskrivning av legemidler til fisk.
Forbruket av antibiotika til norske husdyr er blant de aller laveste i Europa. I perioden 1995–2013 ble forbruket til landdyr redusert med 35 pst. Hvis man bare ser på matproduserende dyr, var reduksjonen på 38 pst. For kjæledyr var det en økning på 18 pst. i perioden. Det relative forbruket av smalspektret penicillin til landdyr økte til om lag 50 pst. av totalt salg i samme periode. Dette er en positiv utvikling, ettersom smalspektrede antibiotika i mindre grad enn bredspektrede fører til resistensutvikling. Til kjæledyr utgjorde penicillin 87 pst. av totalforbruket i 2013. Innenfor havbruksnæringen er bruken av antibiotika sterkt redusert som følge av utviklingen av effektive vaksiner mot de mest alminnelige tapsbringende fiskesykdommene.
All bruk av reseptpliktige legemidler brukt til dyr meldes til Mattilsynet av utleverer via Mattilsynets skjematjeneste. Dette er forskriftsfestet og gir myndighetene mulighet til å ha god oversikt over legemiddelbruken. Veterinært legemiddelregister (Vetreg) er norske myndigheters verktøy for å overvåke forskrivning og bruk av legemidler til dyr. Systemene som skal registrere og behandle disse dataene må videreutvikles før det enkelt kan føres kontroll med bruken av legemidlene.
Mattilsynet har ansvaret for å føre tilsyn med at dyrehelsepersonellets forskrivning av legemidler både til landdyr og akvatiske dyr er forsvarlig. Gjennom tilsyn kan Mattilsynet sikre at hensynet til dyrevelferden, dyrehelsen, mattryggheten og eventuell fare for resistensutvikling knyttet til legemiddelbruk blir ivaretatt. Bruk av legemidler innen akvakulturnæringen er fortsatt nødvendig for å forebygge sykdom, behandle sykdom og redusere smittespredning. Bruk av legemidler til oppdrettsfisk er også viktig for å beskytte viltlevende bestander. Eksempelvis er myndighetenes strenge krav til lave nivåer av lakselus i oppdrettsanlegg satt for å unngå at viltlevende laksefisk utsettes for uakseptable nivåer av lakselus.
Den omfattende bruken av legemidler mot lakselus, samt den økende resistensen hos lakselus, er den største enkeltutfordringen knyttet til bruk av legemidler til dyr i Norge. Situasjonen kan ikke løses ved å utvikle stadig nye legemidler. Det er nødvendig å finne løsninger som baserer seg på andre prinsipper, slik at behovet for rutinemessig legemiddelbruk blir sterkt redusert. Så lenge oppdrett foregår i sjøbaserte anlegg, må det likevel være legemidler tilgjengelig til sporadisk støttebehandling når andre tiltak ikke strekker til. Med oppdrett av nye akvatiske dyrearter vil det følge nye sykdommer som vil kreve vaksiner og kurative legemidler.
14.4 Forskning og utvikling
Utviklingen av nye fiskevaksiner ble avgjørende for å få kontroll med kaldtvannsvibriose og furunkulose på slutten av åtti- og begynnelsen av nittitallet og har vært avgjørende for veksten i norsk fiskeoppdrett. Det er fortsatt behov for nye vaksiner mot virusinfeksjoner og parasittangrep. Selv om det satses mye for å finne alternativer til kjemisk avlusning, trenger vi nye midler mot lakselus. Med oppdrett av nye arter vil det følge nye sykdommer som vil kreve vaksiner og legemidler. Utvikling av diagnostiske hjelpemidler som gir raskt svar betyr mye for riktig valg av legemiddel ved sykdom.
14.5 Legemidler og miljøeffekter/miljøbelastning
Etter apotekloven plikter apotek å ta i retur legemidler for kassasjon uten kostnad for kunden. Apotekene tar imot legemiddelrestene, sorterer dem og sender dem til forsvarlig destruering. Noe sendes til forbrenning, mens andre medisiner behandles som spesialavfall. Apotekforeningen gjennomførte i 2010 en studie som viste at av totalt 474 personer som oppga å ha kastet legemidler, svarte kun 48 pst. at de hadde levert legemidlene på apoteket. Resten kastes og havner dermed i miljøet. Undersøkelser gjennomført i Sverige viste at 69 pst. leverte legemidlene til apotek, et tall som økte til 75 pst. etter en gjennomført informasjonskampanje.
Legemidler i miljøet kan utgjøre et problem, spesielt for organismer som lever i vann, og i siste instans for mennesker. Menneskene bruker omtrent 3000 forskjellige legemidler. I tillegg kommer legemidlene som benyttes til dyr. Legemidler og legemiddelmetabolitter som dannes i kroppens skilles ut via avføring og urin, og ender opp i miljøet. Legemidler og deres nedbrytningsprodukter kan påvirke livet i vann. Det er stor kunnskapsmangel om forekomst, egenskaper og effekter av legemidlers virkestoffer og deres nedbrytningsprodukter i miljøet.
En rapport om miljørisikoene ved legemidler ble overlevert EU i desember 2013 og vil danne grunnlag for en EU-strategi vedrørende legemidler i miljøet. Denne er planlagt vedtatt i september 2015. EU tar også sikte på å fremme lovforslag i løpet av 2017. Dette vil kunne endre reglene for godkjenning av legemidler og vil på sikt kunne bli del av EØS-avtalen og norsk rett.
EU har oppført Etinyløstradiol (EE2) (P-piller), Betaøstradiol (E2) (P-piller og til kvinner i menopause) og Diklofenak (betennelsesdempende middel) på sin Watch List under Vanndirektivet. Dette innebærer at medlemslandene må overvåke disse stoffene i vannforekomstene. Miljøeffektene vektlegges ved beslutningen om det skal gis markedsføringstillatelse for legemidler til dyr. Det er omfattende krav til miljødokumentasjon for legemidler til flokkdyr. Det er viktig at miljøeffektene overvåkes over tid når nye legemidler til flokkdyr tas i bruk.
Avløpsrenseanlegg er ikke bygget for å fjerne legemidler eller andre miljøskadelige stoffer fra avløpsvann. Miljøskadene legemidlene kan forårsake, og den lave bruken av kassasjonsordningen, viser at det er behov for å orientere befolkningen om hvordan ubrukte legemidler skal håndteres. I helsetjenesten er det behov for tydelige avhendingsrutiner og korrekt avfallsbehandling, og dette bør inngå i miljøsertifiseringen av helseinstitusjonene.
Helse- og omsorgsdepartementet foreslår at Statens legemiddelverk får i oppdrag å gjennomføre en informasjonskampanje i samarbeid med Apotekforeningen, LMI og Norsk Vann om retur av ubrukte legemidler til apotek.
Boks 14.1 Regjering vil, for å sikre god kvalitet ved behandling med legemidler:
Utrede felles legemiddelliste.
Forskriftsfeste en plikt for kommunene til å sørge for systematiske legemiddelgjennomganger for pasienter på sykehjemmene de har ansvar for.
Vurdere pilotprosjekt på bruk av samvalgsverkøy ved valg av legemiddelbehandling, for eksempel til pasienter med bipolare lidelser.
Vurdere hvordan NOU 2014: 8 Tolking i offentlig sektor skal følges opp.
Utrede hvordan informasjon om legemidler bør utarbeides slik at pasient forstår den informasjon som er ment for dem.
Utrede muligheter for å etablere et nettverk som ivaretar standardisering og utarbeiding av god pasientrettet informasjon.
Vurdere om oppstartsveiledning kan være en egnet tjeneste dersom forsøket med Medisinstart viser gode resultater.
Utrede muligheten for å innføre standardiserte veiledningstjenester som for eksempel veiledning fra apotekfarmasøyt til pasienter med astma og KOLS.
Utrede hvordan informasjonsproduksjon i størst mulig grad kan samordnes, og hvordan det offentlige kan ivareta, bevare og tilby gode informasjonskilder til helsepersonell.
Fortsette videreutviklingen av innhold og tjenester på helsebiblioteket.no.
Legge til rette for åpne, strukturerte data (for eksempel FEST og Helsebiblioteket).
Vurdere kunnskapsbaserte oppdateringsvisitter (KUPP/academic detailing) som varig undervisningsmetode dersom pilotering gir gode resultater.
Vurdere å videreutvikle og utvide dagens reseptregister slik at det ivaretar fremtidige behov.
Utrede mulig etablering av et personidentifiserbart legemiddelregister basert på dagens reseptregister og supplert med data om legemiddelbruk i institusjon når felles legemiddelliste muliggjør dette. Personvernkonsekvenser skal utredes grundig.
Videreføre dagens forståelse av reklamebegrepet.
Foreslå at legemiddelindustrien inviteres til et samarbeid med myndighetene for utarbeidelse av pasientrettet informasjon om legemidler.
Vurdere informasjonstiltak for å øke bruk av virkestofforskrivning.
Utrede regulatoriske og organisatoriske endringer for å bedre kvaliteten på multidose.
Følge forhandlingene om nytt regelverk for veterinære legemidler nøye.
Gjennomføre en informasjonskampanje om retur av ubrukte legemidler til apotek.
Fotnoter
Helsedirektoratet. Utredning: Farmasøyttjenester og etterlevelse av legemiddelbehandling. 2014. IS-0246.
Skurtveit S, S Sakshaug, V Hjellvik, C Berg, M Handal. Bruk av vanedannende legemidler i Norge 2005–2013. Basert på data fra Reseptregisteret. Folkehelseinstituttet. 2014.
Kontaktpunkt for tverretatlig legemiddelinformasjon. Informasjon og beslutningsstøtte for legemiddelbehandling. 2014.
Sykehusapoteket i Oslo.
Haynes RB, E Ackloo, N Sahota, HP McDonald, X Yao. Interventions for enhancing medication adherence. 2008. Cochrane database system review.
Mistry N et al. Technology-mediated interventions for enhancing medication adherence. Journal of the American Medical Informatics Association Advance Access. 2015. 2015; 0: 1–17. doi: 10.1093/jamia/ocu047.
Lareau SC, Improving adherence with inhaler therapy in COPD, Int J Chron Obstruct Pulmon Dis. 2010 Nov 24; 5: 401–6. doi: 10.2147/COPD.S14715.
Kalisch LM, Caughey GE, Barratt JD, Ramsay EN, Killer G, Gilbert AL, Roughead EE. Prevalence of preventable medication-related hospitalizations in Australia: an opportunity to reduce harm. Int J Qual Health Care. 2012 Jun; 24(3): 239–49. doi: 10.1093/intqhc/mzs015. Epub 2012 Apr 11. PubMed PMID: 22495574.
Thomsen LA, Winterstein AG, Søndergaard B, Haugbølle LS, Melander A. Systematic review of the incidence and characteristics of preventable adverse drug events in ambulatory care. Ann Pharmacother. 2007 Sep; 41(9): 1411–26. Epub 2007 Jul 31. Review. PubMed PMID: 17666582.
Helsedirektoratet. Nasjonal handlingsplan for e-helse 2014–2016. 2014. IS-2179.
Direktiv 2001/83/EF.
Håkonsen H et al. Generic substitution: additional challenge for adherence in hypertensive patients. Current Medical Research and Opinion. 2009. 10; 2515–2521.
Håkonsen H, EL Toverud. Special challenges for drug adherence following generic substitution in Pakistani immigrants living in Norway. European Journal of Clinical Pharmacology. 2010.
World Health Organization. Antimicrobial resistence: global report on surveillance. 2014.
Nasjonalt folkehelseinstitutt. Rapport fra tverrsektoriell ekspertgruppe. Antiobiotikaresistens – kunnskapshull, utfordringer og aktuelle tiltak. 2014.
NORM/NORM-VET 2013. Usage of Antimicrobial Agents and Occurrence of Antimicrobial Resistance in Norway. Tromsø/Oslo 2014. ISSN: 1502-2307 (print)/1890-9965 (electronic).
Gjelstad S et al. Improving antibiotic prescribing in acute respiratory tract infections: cluster randomized trial from Norwegian general practice (prescription peer academic detailing (Rx-PAD) study). 2013. British Medical Journal. Jul 26; 347: f4403.
Bramness JG, A Engeland, K Furu. Antidepressiver hos barn og ungdom – førte advarsler til færre forskrivninger? Tidsskriftet for Den norske legeforening. 2007.
Skurtveit S, S Sakshaug, V Hjellvik, C Berg, M Handal. Bruk av vanedannende legemidler i Norge 2005–2013. Basert på data fra Reseptregisteret. Folkehelseinstituttet. 2014.