Del 6
Forskning og innovasjon
20 Forskning og innovasjon

Figur 20.1
Målet om å legge til rette for forskning og innovasjon skal bidra til å nå visjonen om bedre folkehelse og målet om å sikre god kvalitet ved behandling med legemidler. Det skal også bidra til regjeringens mål om å legge til rette for en sterk utvikling i norsk legemiddelindustri.
Det er et potensial for å utnytte dagens strukturer for forskning og innovasjon bedre gjennom økt samspill på tvers av sektorer og nivåer og gjennom økt deltakelse i nasjonale og internasjonale konkurransearenaer for forskningsfinansiering. Det er økende forventninger til deltakelse i europeisk og internasjonalt samarbeid om legemiddelrelatert forskning og innovasjon.
Denne delen gir en kort oversikt over forskning, med særlig oppmerksomhet på innovasjon og næringsutvikling. Videre behandles kliniske studier inngående. Deretter gis det en kort oversikt over virkemidler som kan bidra til innovasjon og kommersialisering, med vekt på regulatorisk veiledning. Til slutt gis det en kort oversikt over aktuelle virkemidler fra næringspolitikken.
Arbeidet med å tilrettelegge for en næringsutvikling innen legemiddelområdet vil skje med utgangspunkt i den generelle næringspolitikken. Eksisterende næringspolitiske virkemidler gir et godt grunnlag for videre arbeid. Det kan samtidig være behov for å endre innretning og dimensjonering av de ulike næringspolitiske virkemidlene, i takt med nye utfordringer.
Oppfølging av HelseOmsorg21
HelseOmsorg21 er en nasjonal forsknings- og innovasjonsstrategi som er laget av sentrale aktører fra næringsliv, pasientorganisasjoner, sykehus, kommuner, universitets- og høyskolemiljøer. Strategien ble overlevert regjeringen i juni 2014. Det er første gang det er laget en tverrsektoriell forskningsstrategi for helse- og omsorgstjenestene.
Hovedansvaret for oppfølgingen av HelseOmsorg21-strategien ligger på aktørene selv. De har ansvar for å dra utviklingen fremover og understøtte implementering av strategien i egen sektor eller bransje. Helse- og omsorgsdepartementet offentliggjorde i januar 2015 at regjeringen skal lage en handlingsplan for regjeringens oppfølging av HelseOmsorg21-strategien og at det opprettes et HelseOmsorg21-råd. Rådet består av 27 personer fra næringsliv, sykehus, universitetene og høyskolene, offentlig forvaltning, kommunesektoren og brukere. Rådet skal sikre dialog og en koordinert oppfølging av HelseOmsorg21-strategien på tvers av sektorer og aktører.
Handlingsplanen skal sette HelseOmsorg21-strategien i sammenheng med regjeringens politikk innenfor forskning, innovasjon og helse og omsorg. Planen skal samtidig vise hva regjeringen følger opp innenfor de ti satsingsområdene i HelseOmsorg21-strategien.
Flere av satsingsområdene i HelseOmsorg21-strategien omfatter tematikk som er relevant for legemiddelpolitikken.
21 Legge til rette for forskning
Det er ikke bare legemiddelindustrien som finansierer og gjennomfører forskning på legemidler og legemiddelbruk. Det offentlige bidrar også med å finansiere forskning knyttet til utvikling og bruk av legemidler, samt forskning i de prekliniske fasene, og legger således til rette for forskning. Norges forskningsråd er en sentral aktør som finansierer forskning i Norge. Forskningsrådet har programmer innen behandling, folkehelse og tjenesteforskning, i tillegg til områder som bioteknologi. EU er en viktig finansieringskilde gjennom Horisont 2020 som er verdens største forsknings- og innovasjonsprogram. Horisont 2020 ble startet opp i 2014. EU har også en forskningsstrategisk satsing gjennom Innovative Medicines Initiative (IMI) som er et offentlig-privat samarbeid mellom EU og den Europeiske legemiddelindustriforeningen. Målet med IMI er å stimulere til raskere og mer utvikling av nye legemidler. De regionale helseforetakene er en viktig aktør, som både finansierer og utfører forskning, ofte i samarbeid med universiteter og høyskoler. Spesialisthelsetjenesten har et særskilt ansvar for kliniske studier. Kliniske studier er nærmere omtalt i kapittel 22.
Helseregistre
Et annet viktig virkemiddel som legger til rette for forskning er helseregistre. De gir oss mulighet til å følge med på helsetilstanden i befolkningen, studere kvalitet på behandling, finne årsaker til sykdom samt planlegge og styre helsetjenesten.
Et helseregister består av systematisk innsamlede opplysninger om befolkningens helse. Det finnes ulike typer helseregistre, som for eksempel kvalitetsregistre eller sentrale helseregistre. Enkelte av helseregistrene inneholder personidentifiserbare opplysninger.
Helse- og omsorgsdepartementet iverksatte i 2008 forprosjektet Nasjonalt helseregisterprosjekt for å samordne og modernisere de nasjonale medisinske kvalitetsregistrene og de sentrale helseregistrene. Våren 2011 vedtok Regjeringen en ti-årig strategi for modernisering og samordning av nasjonale helseregistre.
Hovedprosjektet Nasjonalt helseregisterprosjekt ble etablert høsten 2011. Formålet er bedre utnyttelse, bedre kvalitet og enda sikrere håndtering av de nasjonale helseregistrene.Det overordnede målet er at helseregistrene skal gi kunnskap som bidrar til at kvaliteten på helsetjenestene blir bedre, og til utvikling av bedre behandling, forebygging, helseovervåking og forskning. De nasjonale helseregistrene skal, sammen med samhandlingsreformen og arbeidet med e-helse, være vesentlige virkemidler for å nå helse- og omsorgspolitiske mål. Reseptregisteret og bivirkningsregisteret omtales i kapittel 8.
Ordninger som stimulerer til forskning
Forskningsrådet har flere programmer, sentre og satsingsområder som stimulerer til forskning. FRIPRO er en åpen konkurransearena for alle fag og disipliner, der det ikke legges tematiske føringer eller settes krav om anvendelse og umiddelbar nytteverdi. FRIPRO skal fremme vitenskapelig kvalitet i internasjonal forskningsfront, dristig og nyskapende forskning samt karriere for unge forskertalenter. FRIPRO er delt inn i tre aktiviteter fordelt på fagområder: FRIHUMSAM, FRIMEDBIO (medisin, biologi og bioteknologi) og FRINATEK.
Senter for fremragende forskning (SFF) er en egen ordning rettet mot grunnforskningsmiljøer og som Forskningsrådet administrerer og medfinansierer. SFF-ordningen skal sikre nødvendig langsiktighet og kvalitet for forskningen. Av SFFene etablert i 2007 ble åtte etter midtveisevalueringen (etter fem år) besluttet videreført. Tre av disse var innen det medisinske området. Gjennom ny utlysning av 13 nye SFFer i 2014, var hele fem innenfor helsesektoren.
BIOTEK2021 er den store nasjonale satsingen innen bioteknologi for perioden 2012–2021. Programmet er oppfølgeren til Funksjonell genomforskning (FUGE), den største satsingen i Norge på bioteknologi noen sinne, som ble avsluttet i 2011. BIOTEK2021 har en klar næringsrelevant profil. Medisinsk teknologi og tilhørende temaområder står sentralt i BIOTEK2021. For å oppnå programmets mål benyttes og videreutvikles en rekke forskjellige søknadstyper. Store, langsiktige prosjekter som stiller krav til problemstilling og næringsrelevans er sentrale elementer i programmet. Under BIOTEK2021 er ellers utviklet en helt ny støtteordning, kalt optimaliseringsmidler. Disse skal finansiere forskning og utvikling av bioteknologiske produkter, prosesser og tjenester med et kommersielt potensial, men der det er behov for utvikling og konseptualisering av teknologien for å kunne tilpasses kommersiell anvendelse. Dette bidrar til at forskningsresultater og ideer fremkommet fra tidligere bioteknologisk forskning, skal kunne videreutvikles for næringsmessig anvendelse.
Programmet Brukerstyrt innovasjonsarena (BIA) i Forskningsrådet er rettet mot bedrifter som kan gjennomføre krevende forskningsprosjekter med betydelig risiko, men stort potensial. BIA er en åpen konkurransearena hvor prosjekter fra ulike næringsområder konkurrerer om tildeling av midler. Prosjektene er i hovedsak initiert av bedriftene selv, basert på egne strategier og behov. Konkurransen avgjøres på bakgrunn av vurdering av forskningsinnhold, innovasjonsgrad, samfunnsnytte og verdiskapingspotensial. BIA realiserer i betydelig grad prosjekter innenfor områder som miljøteknologi, fornybar energi, IKT og bioteknologi og helse/life science. BIAs innretning muliggjør satsinger på tvers av bransjer og sektorer som blant annet skaper positive virkninger med hensyn til klynger. Helserelaterte prosjekter har bred gjennomslagskraft i BIA og i den siste BIA-tildelingen var ca 20 pst. av prosjektene innenfor helsesektoren. Fra og med 2012 frem til i dag er det innenfor BIA innvilget støtte til 31 bedriftsrettede prosjekter i tilknytning til legemiddelutvikling og seks innenfor diagnostikk.
Nevnte ordninger kan følgelig også legge grunnlag for innovasjon og næringsutvikling, som er nærmere behandlet i kapittel 23.
Boks 21.1 Strategiske satsinger
Norge har store strategiske satsinger innenfor informasjons- og kommunikasjonsteknologi samt nanoteknologi. IKT og nanoteknologi samvirker i økende grad med bioteknologi og er med på å frembringe nye løsninger også innen det biomedisinske området. Bioinformatikk er blitt et eget fagfelt hvor informatikk benyttes for å innhente, organisere, analysere og tolke biologiske data, særlig innen molekylærbiologi og bioteknologi. Sentralt er også utvikling av teori og statistiske/matematiske modeller som gjør det mulig å stille og besvare grunnleggende spørsmål om molekylær evolusjon, biologisk funksjon og samspillet mellom biologiske prosesser på ulike nivåer i levende organismer. Nanoteknologi kan benyttes for målstyring av legemidlet til virkestedet. Dette kan bidra til nye og mer effektive legemidler.
22 Kliniske studier
Regjeringen har som mål å styrke helseforskningen og gi flere pasienter mulighet til å delta i utprøvende behandling1. Regjeringens målsetning om å øke pasienters tilgang til utprøvende behandling skal realiseres innen rammen av de nasjonale prinsippene for utprøvende behandling som ble presentert i Meld. St. 10 (2012–2013) God kvalitet – trygge tjenester. Prinsippene innebærer at utprøvende behandling som hovedregel skal tilbys gjennom kliniske studier for å sikre krav til kvalitet og pasientsikkerhet. Hvis målsettingen om at flere pasienter skal gis mulighet til å få tilgang til utprøvende behandling ved å delta i kliniske studier skal nås, må tilgangen økes ved at det gjennomføres flere kliniske studier i Norge. Kliniske studier gir også mulighet for næringsutvikling i Norge. Gjennom forskning utvikles nye og effektive behandlingsmetoder på en kontrollert måte. Kliniske studier bidrar både til oppdatert kunnskap om sikkerhet og effekt av ny behandling og kunnskap om behandlingsresultater i klinisk praksis. Kunnskap oppnådd gjennom kliniske studier er til støtte ved prioritering og beslutningstaking i helsetjenesten om hvilke metoder som skal tilbys pasienter, og er et sentralt virkemiddel for å nå helsepolitiske mål.
Helse- og omsorgssektoren bør ha som et langsiktig mål å gjennomføre flere kliniske studier på ulike typer behandlingsmetoder. Disse kan være studier med legemidler, medisinsk utstyr eller en kirurgisk prosedyre. Klinisk utprøving med legemidler utgjør i dag hovedtyngden av kliniske studier både i Norge og internasjonalt. Den systematiske tilnærmingen som er etablert for å sikre kvalitet og pasientsikkerhet i gjennomføring av kliniske legemiddelstudier har stor overføringsverdi også til andre teknologier og behandlingsformer. I politikkutformingen er det derfor viktig å legge til rette for tiltak som kan øke omfanget av og kvaliteten på kliniske studier innenfor alle behandlingsmetoder, samtidig som det må tilrettelegges for å møte de utfordringene som er spesifikke for legemiddelstudier. Omtalen av klinisk forskning og kliniske studier vil derfor også omfatte andre prosedyrer enn legemidler. De foreslåtte tiltakene i dette kapitlet om flere og større kliniske studier av høy kvalitet vil gjelde for alle typer behandlingsmetoder og vil bidra til å styrke forskningen også på legemiddelområdet.
22.1 Regulatoriske krav til klinisk utprøving av legemidler
Godkjenning av legemidler skjer på grunnlag av en vurdering av legemidlets sikkerhet og effekt, og markedsføringstillatelse gis for bruksområder som har et dokumentert positivt nytte-/risikoforhold. Ved søknad om markedsføringstillatelse må det derfor vedlegges resultater fra kliniske legemiddelstudier som dokumenterer sikkerheten og effekten av legemidlet. Gjennomføring av slike studier er nødvendig for godkjenning av legemidler og nye bruksområder for legemidler.
Klinisk utprøving av legemidler til mennesker innebærer imidlertid en klar risiko for pasientene. For å beskytte pasientene stilles det derfor strenge krav før slik utprøving kan starte. Gjennom EØS-avtalen har Norge et detaljert internasjonalt regelverk for kliniske legemiddelstudier. Studien må søkes godkjent både av Statens legemiddelverk og regional komité for medisinsk og helsefaglig forskningsetikk (REK). Klinisk utprøving av et nytt virkestoff kan bare skje dersom farmakologiske og toksikologiske studier først er utført på dyr. Godkjenning av studien forutsetter videre at det kjente nytte-/risikoforholdet er veiet opp mot den antatte gevinsten for den enkelte forsøksperson og for andre nåværende og fremtidige pasienter.
Forsøkspersonen skal avgi et informert samtykke til deltakelse i studien basert på informasjon godkjent av REK som skal gis pasienten før samtykke. Kliniske legemiddelstudier skal videre gjennomføres i samsvar med en internasjonal standard for god legemiddelutprøving (GCP). Bestemmelsene i helseforskningsloven gjelder utfyllende så langt den passer, jf. § 2.
Boks 22.1 BerGenBio
I Bergen gjennomføres en fase I-studie på et legemiddel for pasienter med blodkreft. Legemidlet, BGB324, gis i tablettform og er utviklet av det norske selskapet BerGenBio AS. I alt 50 pasienter i Norge, Tyskland og USA deltar i utprøvingen. Ved at legemidlet prøves ut i Norge, gis norske pasienter mulighet til å motta en behandling de ellers ikke ville fått.
BerGenBio ble etablert i 2007 av forskere ved Universitetet i Bergen med støtte fra Bergen Teknologioverføring AS og Unifob AS. Selskapet utvikler nye behandlingsmåter for aggressive former for kreft som er blitt motstandsdyktig mot eksisterende terapi og som dermed gir dårlige prognoser for pasientene. Medisinene fra BerGenBio er utviklet på bakgrunn av kunnskap om epitelial-mesenkymal transisjon (EMT), en grunnleggende biologisk mekanisme som er viktig i prosessen når kreftceller sprer seg og utvikler motstand mot behandling. Medisinene som utvikles av BerGenBio skal hemme virkningen av EMT, og dermed hindre spredning av kreft og legemiddelresistens.
22.2 Fase IV-studier og sammenlignede effektstudier
Fasene i kliniske studier er omtalt i kapittel 3.1. Fase IV-studier undersøker bruk av legemidler etter at de er gitt markedsføringstillatelse og kan fremskaffe kunnskap om effekter og kostnader ved bruk av legemidlet i en klinisk hverdag. Det kan omfatte en nærmere undersøkelse av nytte-/risikoforholdet generelt eller i spesielle populasjoner, raffinering av doseanbefalinger eller identifisering av mindre vanlige bivirkninger. En fase IV-studie vil kunne følge legemiddelbehandling over tid for alle pasienter, og skiller seg fra tidligere fase studier som kun omfatter et utvalg selekterte pasienter. Her kan man samle ytterligere data om sikkerhet, effekt og kostnadseffektivitet ved bruk av legemidlet i ordinær bruk. Fase IV-studier initieres og finansieres som regel av det offentlige, ofte fordi slike studier ikke prioriteres av industrien2. I tillegg kan nasjonale medisinske kvalitetsregistre benyttes til såkalte kvalitetsregister-randomiserte kliniske studier3, der utgangspunktet for inklusjon er pasienter i et nasjonalt medisinsk kvalitetsregister. Overvåkning av legemidler i slike studier supplerer også den ordinære overvåkningen av legemidler som foretas av legemiddelindustrien og legemiddelmyndighetene i henhold til legemiddelregelverket.
Nasjonalt og internasjonalt er det helsepolitisk satsning på «comparative effectiveness research», på norsk kalt sammenlignende effektstudier. Slike studier genererer og oppsummerer forskning som direkte sammenligner alternative metoder for forebygging, diagnostikk, behandling og oppfølging av kliniske tilstander. Denne type studier initieres og finansieres vanligvis av det offentlige. Målet med sammenlignende effektstudier er å styrke kunnskapen om hvilke behandlinger som virker best og gir mest igjen for investeringene. Dette kan både omfatte sammenligning av ulike legemidler eller en sammenligning av bruk av legemiddel med en annen intervensjon. Det offentlige legger stor vekt på at slike studier skal gjenspeile hvorvidt behandlingen er effektiv når den brukes i vanlig klinisk praksis. Denne type informasjon kan være viktig grunnlag også i arbeidet med utvikling og revidering av nasjonale faglige retningslinjer og prosedyrer.
Samfunnet har behov for flere studier som gir beslutningstakerne kunnskap om behandlingsmetoders effekt i klinisk hverdag og om kostnadseffektivitet i vanlig klinisk praksis. Nasjonalt råd for kvalitet og prioritering har anbefalt at fase IV-studier i større grad gjennomføres på kostbare legemidler, som for eksempel kreftlegemidler4. Slik systematisk observasjon og oppsummering av funn om effekt og bivirkninger av legemidler er blant annet relevant for nasjonalt system for innføring av nye metoder. Et av formålene i systemet er å gjennomføre re-evalueringer av innførte metoder og utarbeide nye metodevurderinger for å sikre at de mest virkningsfulle og kostnadseffektive metodene er i bruk. For å kunne realisere dette målet er systemet avhengig av at innførte nye legemidler monitoreres og at fase IV-studier gjennomføres på disse legemidlene.
Boks 22.2 Sammenlignende effektstudie
Forskere ved Stavanger universitetssykehus og Haukeland universitetssykehus har gjennomført en offentlig initiert og finansiert randomisert kontrollert studie med 73 norske pasienter med terapiresistent depresjon, som enten fikk elektrosjokk eller medikamentell behandling. Studien viste at elektrosjokk er den mest effektive behandlingen for deprimerte bipolare pasienter når ingenting annet fungerer. Artikkelen «ECT or Pharmacotherapy for Treatment-Resistant Bipolar Depression», som ble publisert i American Journal of Psychiatry, er kåret som en av de ti viktigste kliniske forskningsartiklene innen psykiatri i 2014 av redaktørene i New England Journal of Medicine.
22.3 Utprøvende behandling gjennom kliniske studier
Regjeringens målsetning om å øke pasienters tilgang til utprøvende behandling skal realiseres innen rammen av de nasjonale prinsippene for utprøvende behandling, som ble presentert i kvalitetsmeldingen. Som hovedregel skal utprøvende behandling tilbys gjennom kliniske studier, men kan unntaksvis tilbys enkeltpasienter, se boks 22.3. De nasjonale prinsippene er utviklet for å ivareta pasientens behov for informasjon om behandlingstilbudet, samtykke til behandling og nødvendig oppfølging, sikre god kvalitet og pasientsikkerhet ved behandlingstilbudet og helsetjenestens behov for kunnskapsutvikling. Det er stilt krav om at de regionale helseforetakene følger disse prinsippene.
Boks 22.3 Utprøvende behandling
I Meld. St. 10 (2012–2013) God kvalitet – trygge tjenester (kvalitetsmeldingen) ble utprøvende behandling definert som all behandling der effekt, risiko og bivirkninger ikke er tilstrekkelig dokumentert til at behandlingen kan inngå i det ordinære behandlingstilbudet. Det inkluderer behandling som prøves ut gjennom kliniske studier og udokumentert behandling som gis utenfor kliniske studier til enkeltpasienter. For legemidler vil dette kunne gjelde der legemidlet ikke har markedsføringstillatelse, eller der bruken skjer utenfor godkjent bruksområde.
Pasienter har ingen juridisk rett til utprøvende behandling. Pasienter har likevel ofte et sterkt ønske om å få tilbud om behandling med et legemiddel før det har markedsføringstillatelse for det aktuelle bruksområdet. Dersom det finnes et tilbud om en klinisk legemiddelstudie og pasienten faller inn under de krav som stilles til deltakelse, kan pasienten få tilbud om utprøvende behandling gjennom helsetjenesten. Selv om deltakelse i kliniske studier innebærer økt risiko sammenlignet med etablert behandling, indikerer enkelte forskningsstudier at pasienter som deltar i kliniske studier innen behandling av kreft og hjertesykdommer, har bedre overlevelse og/eller livskvalitet enn sammenlignbare pasienter som ikke inngår i studiene.
I Danmark er det etablert en ordning for utprøvende behandling under Sundhetsstyrelsen, kalt «Second Opinion», for å styrke pasienters muligheter for utprøvende behandling. Sykehusleger kan henvise pasienten til programmet dersom annen behandling viser seg ikke å være effektiv, og det vurderes om pasienten skal gis tilbud om utprøvende behandling, enten i Danmark eller i utlandet.
22.4 Situasjonsbeskrivelse og utfordringsbilde
I Norge er det gode forutsetninger for å utvikle og evaluere nye behandlingsmetoder inkludert legemidler gjennom kliniske studier. Deltakelse i og oppslutning om kliniske studier er god, det er sterke fagmiljøer, en velorganisert offentlig helsetjeneste, gode system for etiske godkjenninger og et personnummersystem som sikrer at personer gjenfinnes. Diagnosekoder og data fra helseregistre muliggjør utvikling av kvalitetssikrede data, og Norge har flere lovende foretak innenfor bioteknologi og farmakologi, jf. omtale i kapittel 3. Med utviklingen i persontilpasset medisin er biologisk materiale fra biobanker en viktig ressurs for klinisk pasientrettet forsking, fordi man kan forske på genetiske endringer knyttet til sykdomsutvikling.
Internasjonalt samarbeid
Gjennom samarbeid i internasjonale kliniske multisenterstudier vil en raskere kunne rekruttere pasienter, gjennomføre studiene og dermed raskere kunne implementere resultatene av den kliniske forskningen til forbedring av pasientbehandlingen.
Organisasjonen for økonomisk samarbeid og utvikling (OECD) har gjennom et globalt samarbeid om forskning, Global Science Forum, rettet et søkelys mot betydningen av ikke-kommersielle kliniske studier som grunnlag for myndighetenes politikkutforming5. I en rapport pekes det på hindre for internasjonalt samarbeid om slike studier og det arbeides med å etablere et målrettet samarbeid for å styrke infrastruktur, kompetanse, harmonisering av regulatoriske mekanismer, sammenlignende effektstudier og involvering av pasienter i kliniske studier i et samarbeid mellom OECD, Verdens helseorganisasjon og National Institute of Health i USA.
Internasjonalt samarbeid kan også bidra til identifisering av forskningsspørsmål. Eksempelvis vil de europeiske nettverkene for samarbeid om metodevurderinger6 kunne avdekke kunnskapshull.
Norge deltar sammen med 12 andre europeiske land og 13 afrikanske land i den andre fasen av European and Developing Countries Clinical Trials Partnership (EDCTP), som er en del av det europeiske rammeprogrammet for forskning og innovasjon, Horisont2020.
EDCTP har som mål å intensivere utviklingen av nye eller forbedrede legemidler, vaksiner og diagnostiske hjelpemidler mot HIV/AIDS, tuberkulose, malaria og enkelte infeksjonssykdommer, ved å gjennomføre alle faser av kliniske studier i Afrika sør for Sahara.
Norge deltar også i det europeiske samarbeidet om forskningsinfrastruktur for kliniske studier European Clinical Research Infrastructure Network, ECRIN. ECRIN har som mål å gjøre Europa til en integrert arena for klinisk forskning og tilby forskere i Europa tilgang til «state-of-the-art» fasiliteter, trenings- og støtteservice for studier innen forebygging, diagnose og behandling. Den norske noden NorCRIN (Norwegian Clinical Research Infrastructure Network) er medlem i ECRIN. NorCRIN-partnere vil få mulighet til å søke støtte til gjennomføring av deler av prosjekter gjennom felles utlysinger i ECRIN.
Boks 22.4 ECRIN
ECRIN skal tilby støtte innenfor følgende områder:
Informasjon og rådgiving under planlegging av forskningsprosjekt
Tilpasning av protokoll til lokal kontekst
Informasjon om regulatoriske og etiske krav
Informasjon om relevante steder for gjennomføring av kliniske studier og rekruttering av deltakere
Informasjon om kliniske forskningsstøtteenheter
Informasjon om kostnadsvurdering og finansieringsmuligheter
Informasjon om kontrakter
Støtte til gjennomføring av prosjektet, etter vurdering av Scientific Board
Innsending til og samspill med relevante myndigheter og etiske komiteer
Støtte til kontrakter om forsikring
Bivirkningsrapport (Pharmacovigilance)
Monitorering
Datahåndtering
Legemiddelhåndtering i studier
Link til ECRIN: http://www.ecrin.org/
Nedgang i antall kliniske legemiddelstudier
Det har vært en nedgang i antallet kliniske legemiddelstudier i Norge etter 2000-årene. Figur 22.1 viser antall søknader om nye kliniske legemiddelstudier til Statens legemiddelverk. Figuren viser antall søknader om kliniske legemiddelstudier fra industrien, fra ikke-kommersielle aktører og totalantallet. Figuren viser at antall legemiddelstudier er betraktelig redusert. Figuren viser også at reduksjonen er mindre kraftig for ikke-kommersielle legemiddelstudier enn for kommersielle legemiddelstudier. Nå ser det imidlertid ut som om nedgangen har flatet ut og stabilisert seg på et lavere nivå enn tidlig på 2000-tallet. Antall pasienter som deltar i kliniske legemiddelstudier har også blitt redusert. I 2003 var om lag 16 000 pasienter involvert i industrifinansierte legemiddelstudier, og i 2013 var tallet redusert til 6 700.
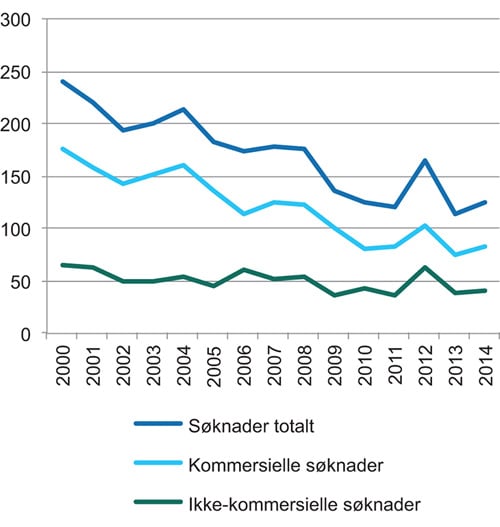
Figur 22.1 Antall søknader om kliniske legemiddelstudier
Kilde: Statens legemiddelverk
Nedgangen i kliniske legemiddelstudier ses også i Norden og i Europa. Nordisk samarbeidsnemnd for medisin utga i 2011 en rapport om status og fremtidige muligheter for helseforskning i de nordiske landene7. En av rapportens konklusjoner var at klinisk forskning trenger økt oppmerksomhet. Videre ble det trukket frem at det ligger et stort potensial for økt klinisk forskning i alle de nordiske landene, dersom ensarten landene imellom utnyttes bedre. Dette var noe av bakgrunnen for etableringen av et treårig prosjekt (2013–2015) om et nordisk samarbeid om kliniske multisenterstudier, Nordic Trials Alliance. Prosjektet inngår i programmet Holdbar nordisk velferd i regi av Nordisk ministerråd. I 2014 leverte den tidligere svenske helseministeren Bo Könberg en rapport om det fremtidige nordiske helsesamarbeidet8. Rapporten omtaler blant annet behovet for å styrke og videreføre det nordiske forskningssamarbeidet om kliniske studier, dataregister og biobanker. Det anbefales å legge til rette for tilgangen til registerdata og en modell for felles etisk godkjenning for nordiske forskningsprosjekter. Klinisk forskning og persontilpasset medisin er tillagt betydelig vekt i det felleseuropeiske helseprogrammet i Horisont 2020. Dette åpner for større deltakelse fra helseforetakene, så vel som de andre forskningsutførende sektorene og industrien i dette programmet.
Figur 22.2 viser at det har vært en nedgang for kliniske legemiddelstudier i alle faser, bortsett fra fase I. Nedgangen har vært størst for fase III studier.
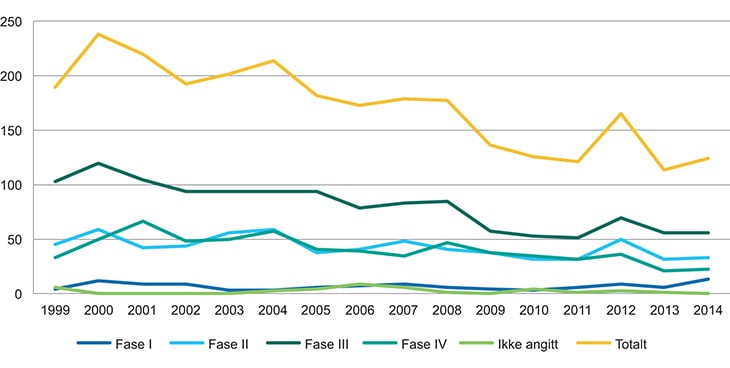
Figur 22.2 Antall kliniske studier fordelt på ulike faser, 2000–2014
Kilde: Statens legemiddelverk
Deltagelse i kliniske studier
Pasienters deltakelse i kliniske studier begrenses blant annet ved at utprøvende behandling ikke er en rettighet, men også av at det ikke gjennomføres mange nok og store nok kliniske studier i Norge. Deltakelse begrenses også ved at pasienten ikke oppfyller kriteriene for deltakelse i en klinisk studie, eller at de ikke er kjent med at det pågår en studie. Tilgangen til kliniske studier kan bedres hvis det gjennomføres flere større nasjonale og internasjonale fase II og III studier, såkalte multisenterstudier, som inkluderer langt flere pasienter.
I HelseOmsorg21-strategien foreslås det at muligheten for pasienter til å delta i kliniske studier og utprøvende behandling må styrkes, at tilfeldige og geografiske ulikheter i helsetjenestetilbudet må utjevnes og at raskere inkludering av pasienter i kliniske studier må sikres.
Hvis målsettingen om at flere pasienter skal gis mulighet til å delta i kliniske studier skal nås, må tilgjengeligheten av kliniske studier økes. Pasient, pårørende eller helsepersonell må videre ha kjennskap til at studien pågår, og pasienten må tilfredsstille kriteriene for å delta i studien. Relevant informasjon om kliniske studier, herunder kliniske legemiddelutprøvinger, for pasienter og pårørende har vært etterspurt av pasientorganisasjoner og Nasjonalt råd for kvalitet og prioritering i helse- og omsorgstjenesten.
Pasienten har i for liten grad blitt trukket inn som meningsbærere i den kliniske forskningen. Dersom pasientene i større grad er med på å identifisere forskningsspørsmål og endepunkt9 i offentlig initierte kliniske studier, kan det øke sannsynligheten for at resultatene fra studien tas i bruk i pasientbehandlingen. Det er gjort studier som viser at pasienter og forskere prioriterer ulike behandlingsintervensjoner ulikt10, eksempelvis når det gjelder hva som er det viktigste utfallsmålet/resultatet sett i fra henholdsvis pasientens og behandlerens ståsted. Brukermedvirkning i forskning er i de senere år vektlagt i helsetjenesten og i Helse- og omsorgsdepartementets styring av de regionale helseforetakene og Norges forskningsråd. De regionale helseforetakene har utarbeidet felles retningslinjer for brukermedvirkning i forskning i spesialisthelsetjenesten. Forskningsrådet vil innarbeide krav til brukermedvirkning i de programplanene Helse- og omsorgsdepartementet finansierer.
Historisk sett har det vært reduserte muligheter for kvinner, barn, eldre og pasienter med flere diagnoser til å delta i kliniske studier. Det har vært iverksatt tiltak for å motvirke slike ulikheter. Den nasjonale forskningsetiske komité for medisin og helsefag har utarbeidet retningslinjer for inklusjon av begge kjønn i medisinsk forskning, med særlig vekt på inklusjon av kvinner i fertil alder og gravide, og behovet for kjønnsspesifikke analyser. I følge retningslinjene må det i de tilfeller hvor det ene kjønnet utelates fra studien gis en holdbar begrunnelse for dette både etisk og vitenskapelig.
De europeiske retningslinjene for kliniske legemiddelstudier angir at populasjonene som studeres skal gjenspeile populasjonene som anses relevant for den terapeutiske behandlingen av det aktuelle legemidlet. Undersøkelser viser at dette også følges i praksis med hensyn til kjønnsfordeling11. EU vedtok i 2014 et nytt regelverk for kliniske studier hvor det er krav om at de som inngår i kliniske studier skal være representative for populasjonen med hensyn til kjønn og alder12. Det finnes ikke sammenstilte nasjonale data på hvor mange kvinner og menn som er inkludert i kliniske legemiddelstudier i dag. Tiltakene nevnt over har imidlertid bidratt til en bedre ivaretakelse av kjønnsperspektivet i kliniske studier i Norge i dag.
Kunnskap om legemidler til barn har i stor grad har vært erfaringsbasert, og det er behov for mer forskningsbasert kunnskap. I EU er legemiddelrelatert forskning på barn en viktig helsepolitisk målsetning, og i 2006 vedtok EU forordning nr. 1901/2006 om legemidler til barn. Forordningen skal bidra til å fremme utviklingen av og godkjenningen av legemidler til barn, blant annet ved å stille krav om at barn blir tatt med i utviklingsprogrammet for legemidler. Søknader om markedsføringstillatelse for nye legemidler og søknader om indikasjonsutvidelser og nye formuleringer for legemidler med gyldig patent, skal etter reglene vedlegges resultater fra kliniske studier gjennomført i samsvar med en utprøvingsplan, som på forhånd er fastsatt av en ekspertkomite for legemidler til barn under EMA. Kravene trådte i kraft i 2008 og 2009. Forordningen er enda ikke del av EØS-avtalen, men siden nye legemidler i Norge godkjennes i EUs samarbeidsprosedyrer inngår slike studier utført på barn også i den norske godkjenningen.
Klinisk forskningspost for barn ved Haukeland universitetssykehus er etablert for å øke antallet studier og bygge opp kompetanse på kliniske utprøvinger på barn. Det foreligger planer om å etablere tilsvarende enheter i Oslo, Trondheim, Stavanger og Tromsø. Siden pasientpopulasjonen er liten, er det nødvendig med samarbeid mellom de pediatriske miljøene i Norden, og mellom helseforetak og industrien. Nasjonalt kompetansenettverk for legemidler til barn har etablert et nasjonalt pediatrisk forskningsnettverk, NorPedMed, og har sammen med den finske søsterorganisasjonen FinPedMed tatt initiativet til etablering av et nordisk nettverk for kliniske utprøvinger blant barn, kalt NordicPedMed. Nettverket vil bidra til å imøtekomme legemiddelindustriens behov for å få tilgang til kliniske miljøer for å gjennomføre kliniske utprøvinger som kan bidra til å fremskaffe kunnskap om legemiddelbehandling til barn.
22.4.1 Klinisk forskning som en del av pasientbehandlingen
Internasjonalt er det en økende oppmerksomhet om klinisk pasientrettet forskning som en integrert del av pasientbehandlingen. I National Health Service i England er det et mål å tilby alle pasienter, med behov for og ønske om det, mulighet til å delta i forskning og kliniske studier. Dette er også forankret i lovverket13. Imperial College i London benytter antall pasienter som inngår i kliniske studier som en kvalitetsindikator. Sverige har de siste årene også rettet økt oppmerksomhet mot klinisk forskning. I 2009 anbefalte en offentlig utredning i Sverige blant annet at forskning bør integreres i pasientbehandlingen ved universitetssykehusene. På nordisk nivå er kliniske multisenterstudier et av de prioriterte områdene under Ministerrådet for sosial- og helsepolitikk.
Klinisk forskning i spesialisthelsetjenesten
Alle helseforetak er kunnskapsinstitusjoner og skal ha pasientrettet forskning som en integrert del av sin virksomhet. Forskning er viktig for å bidra til ny kunnskap, og til kompetanse- og kvalitetsutvikling i helseforetakene. Med sin nærhet til pasientbehandling har helseforetakene en særlig rolle i den kliniske forskningen. Det har vært en satsning på klinisk forskning i helseforetakene de siste ti årene. De viktigste grepene har vært å regulere forskning som en hovedoppgave14, understøttet av en særskilt finansieringsordning med resultatbaserte insentiver for å øke den pasientnære forskningen i sykehusene, samt styringssignaler med krav om å øke den kliniske forskningen. Målet er å styrke kvalitet og pasientsikkerhet blant annet ved at forskningen utføres av klinikere tett integrert med pasientbehandling. I tillegg gir den resultatbaserte finansieringsordningen uttelling for omfang og kvalitet på vitenskapelige publikasjoner, avlagte doktorgrader og eksternfinansiert forskning fra EU og Norges forskningsråd15. I HelseOmsorg21-strategien vurderes det som en vellykket strategi at forsknings- og finansieringsansvar for klinisk og pasientrettet forskning er gitt til tjenestene og sektoren. Samtidig er det etablert et omfattende samarbeid mellom helseforetakene, universiteter og høgskoler om forskning, og aktiviteten blir koordinert i en rekke samarbeidsfora på regionalt og nasjonalt nivå.
I 2012 ble det etablert et nasjonalt infrastrukturnettverk i spesialisthelsetjenesten for kliniske studier, NorCRIN, etter initiativ fra departementet, se også kapittel 22.5.2. Nettverket gir råd og veiledning for å sikre gjennomføring av kliniske studier av høy kvalitet. Nettverket inngår også i det nordiske samarbeidet Nordic Trial Alliance, og det europeiske forskningsinfrastruktursamarbeidet ECRIN.
Satsningen på klinisk forskning i helseforetakene har gitt resultater i form av økt klinisk forskningsaktivitet, flere kliniske studier og høy kvalitet i de kliniske forskningsmiljøene, særlig ved universitetssykehusene. Klinisk medisin, som også inkluderer forskning ved universitetene, er det største fagfeltet målt i publiseringsvolum16. Klinisk medisin har nest høyest siteringsindeks i Norge17. Siteringsindeks er et mål på forskningskvalitet. Tall fra 2013 viser at om lag halvparten av kliniske studier i helseforetakene gjennomføres innen regionen, 27 pst. med deltakelse fra flere regioner, 8 pst. med deltakelse fra andre nordiske land og 14 pst. med internasjonal deltakelse18. Det er fortsatt behov for å stimulere til mer klinisk forskning i helseforetakene for å øke antall kliniske studier, og å legge til rette for flere større nasjonale kliniske studier som kan understøtte kunnskapsbehov i klinisk praksis.
I spesialisthelsetjenesten er mye av infrastrukturen for klinisk forskning på plass. Det er tidlig fase-enheter ved fire av landets seks universitetssykehus. Tidlig fase kliniske studier krever betydelig infrastruktur og støttefunksjoner dersom alvorlige bivirkninger oppstår for pasienten. Haukeland universitetssykehus leder et nasjonalt kompetansenettverk for legemidler til barn, som blant annet bistår i klinisk forskning slik at legemiddelbehandling til barn skal være trygg og i størst mulig grad basert på dokumentert kunnskap. Akershus universitetssykehus og Stavanger universitetssykehus har ikke egne forskningsposter med utstyr og personell til å gjennomføre studier i de ulike utprøvingsfasene19.
Utviklingen av persontilpasset medisin, jf. kapittel 3, har innvirkning på design av legemiddelstudier. Med persontilpasset medisin blir studiepopulasjonene mindre, og det er økt behov for multisenterstudier både nasjonalt og internasjonalt for å få store nok pasientpopulasjoner.
Utfordringsbildet sett fra spesialisthelsetjenesten
Kapasiteten til de kliniske utprøvingsenhetene er i følge fagmiljøene begrenset. Særlig oppleves en knapphet på nøkkelpersonell som studiesykepleiere og studiekoordinatorer. Studiesykepleiere bidrar til at den kliniske studien er i henhold til studieprotokoll og følger retningslinjer for god klinisk praksis. Studiekoordinatorer følger pasienten gjennom deltakelse i en klinisk studie, tar nødvendige prøver, koordinerer studien og registrerer data underveis. Det har ikke vært tradisjon for at kostnader til slik nøkkelpersonell dekkes gjennom søknader om forskningsmidler.
Mangel på tid til å drive klinisk forskning er en annen utfordring som trekkes frem i tjenesten. Det kan henge sammen med prioritering mellom klinikk og forskning fra ledelsesnivå, at gjennomføring av kliniske studier i dag ikke premieres utover publiseringspoeng og at den administrative arbeidsmengden forbundet med gjennomføring av en klinisk studie beskrives som økende. I HelseOmsorg21-strategien anbefales det å lage insentiver for deltakelse og inkludering i kliniske studier, slik at avdelinger og klinikker i universitetssykehus i større grad definerer klinisk utprøving som en av sine oppgaver.
Utfordringsbildet sett fra den kommunale helse- og omsorgstjenesten
Forskning og innovasjon skal bidra til utvikling av fremtidens helse- og omsorgstjeneste. De kommunale helse- og omsorgstjenestene har behov for et styrket kunnskapsgrunnlag med bedre kunnskap om både tjenesteinnhold og tjenestekvalitet, organisering, styring og ledelse og effekter av nye arbeidsformer og faglige tilnærminger. Vi vet ikke nok om hva som gjøres i den kommunale helse- og omsorgstjenesten og kvaliteten på tjenestene som ytes. Dette gjelder også legemiddelbehandling. For spesialisthelsetjenesten har det siden 2008 eksistert et pasientregister med personidentifiserbar informasjon om alle pasienter som mottar helsehjelp. Det er ingen tilsvarende samlet kunnskapskilde for de kommunale helse- og omsorgstjenestene. Et nytt helseregister for kommunenes helse- og omsorgstjenester vil kunne dekke flere behov. Helse- og omsorgsdepartementet har gitt Helsedirektoratet i oppdrag å utrede innholdet i et kommunalt helse- og omsorgstjenesteregister (KHOR) og det er bevilget 30 mill. kroner i 2015 til utvikling av et slikt register. Hovedformålet for KHOR er å gi grunnlag for planlegging, styring, finansiering og evaluering av kommunale helse- og omsorgstjenester for sentrale og kommunale myndigheter. Opplysningene i registeret skal også være en viktig datakilde for statistikk, helseanalyser, kvalitetsforbedringsarbeid, beredskap, forebyggende arbeid og forskning.
Økt kunnskap om legemiddelbruk i kommunale helse- og omsorgstjenester vil også skape bedre forutsetninger for kvalitetsforbedring og pasientsikkerhetsarbeid i denne delen av tjenesten.
En annen del av problemstillingen er tilgangen på forskerkompetanse i den kommunale helse- og omsorgstjenesten. For å legge til rette for kunnskapsbaserte tjenester trengs relevant og praksisnær forskning av god kvalitet. Samarbeid på tvers av fagfelt, enheter og miljøer er sentralt.
I dag eksisterer det en rekke fagmiljøer/enheter i ulike deler av tjenesten som er rettet inn mot smale fagområder, mens pasientene ofte har sammensatte behov som krever en tverrfaglig tilnærming. Kommuneledelsen har et ansvar for at den lovpålagte plikten om medvirkning til og tilrettelegging for forskning faktisk blir overholdt. Brukermedvirkning i forskning og innovasjon kan bidra til å møte brukernes behov på en best mulig måte og gjøre tjenestene bedre. Det er derfor viktig at brukeren involveres i hele prosessen, fra idé til implementering.
22.4.2 Klinisk forskning av høy kvalitet og nytte
Helse- og omsorgsdepartementet finansierer i 2015 to helseforskningsprogrammer gjennom Norges forskningsråd spesielt rettet inn mot klinisk forskning. Disse er program for klinisk forskning og program for offentlig initierte kliniske studier på kreftområdet. I tillegg finansieres kliniske studier gjennom fri prosjektstøtte (FRIPRO).
Fra 2016 vil de programmene Helse- og omsorgsdepartementet finansierer gjennom Norges forskningsråd få en ny programstruktur. Det innebærer etablering av større programmer av 10-årig varighet, og med nye virkemidler som skal bidra til at forskningen i større grad rettes inn mot behov identifisert av pasienter og beslutningstakere, i helsetjenesten, forvaltningen, eller industrien. Alle prosjektsøknader skal som i dag vurderes for forskningskvalitet. I tillegg skal prosjektene vurderes for nytte for pasienten, tjenesten og helsemyndighetene. Med nytte menes eksempelvis forskning som bidrar til bedre kunnskap om sikkerhet, effekt og kostnadseffektivitet av tiltak, som gir kunnskap i form av endepunkter med direkte nytte for pasienten og klinisk praksis, som resultater i form av sykelighet eller dødelighet, livskvalitet og ressursbruk eller kostnader knyttet til omsorg av pasienter og forskning som genererer kunnskap til bruk i nasjonale retningslinjer eller prosedyrer for behandling20. National Institute for Health Research (NIHR) i England har en slik tilnærming i sine helseprogrammer, med gode erfaringer. Videre har departementet lagt føringer om et nytt virkemiddel, kalt behovsidentifisert forskning, som skal supplere dagens modell for utlysning av forskningsmidler. En andel av midlene til de programmene departementet finansierer gjennom Forskningsrådet reserveres behovsidentifisert forskning og lyses ut og behandles etter en egen modell. Det innebærer at det må etableres systemer for kunnskapsinnhenting, spissing av problemstillinger, involvering av pasienter og andre brukere, evaluering og prioritering av hvilke problemstillinger det bør forskes på.
Utfordringsbildet sett fra beslutningstakere og forvaltning
Statens legemiddelverk godkjenner alle kliniske legemiddelutprøvinger og mener at kvaliteten på søknadene fra akademia og kliniske miljø må bedres. Bedre kvalitet ved studiene vil kunne bidra til at nytten av forskningen økes.
De senere årene er det tildelt midler over statsbudsjettet til enkelte, større nasjonale kliniske legemiddelutprøvinger, slik som den nasjonale studien på legemidlet ipilimumab for pasienter med føflekkreft, studien på bytte til biotilsvarende legemiddel og studien på rituksimab for pasienter med ME. Overgangen fra studier med legemidler for en mindre gruppe pasienter som har hatt særskilt statlig finansiering og til etablert behandlingstilbud i spesialisthelsetjenesten representerer i dag en utfordring ved at det legger et press på aktivitetsveksten til helseforetakene. Prioritering og særskilt finansiering av enkeltstudier fra helsemyndighetene er i fremtiden ikke en ønsket utvikling, også fordi helsemyndighetene ikke sitter med total oversikt over eller kompetanse til å prioritere enkeltstudier.
22.4.3 Industriens rolle i utvikling av nye legemidler og gjennomføring av kliniske studier
De aller fleste nye legemidler og vaksiner utvikles av legemiddelindustrien. I følge HelseOmsorg21-strategien vises den omtalte nedgangen i antallet kliniske studier spesielt innen industrien. I 2014 var antall søkte industrifinansierte kliniske studier 84, mens det i 2005 var 136 søkte studier fra industrien. I tillegg kommer nedgangen til syne i hvor mange pasienter som deltar og firmaenes investeringer i forskning og utvikling. Flere internasjonale farmasøytiske bedrifter har redusert sin forskningsaktivitet i Norge og til dels erstattet den med samarbeid og oppkjøp rettet mot offentlige forskningsinstitusjoner og mindre bioteknologiselskaper. Reduksjonen i antall kliniske industrifinansierte studier vil i følge HelseOmsorg21-strategien bidra til å marginalisere Norge i de store multinasjonale studiene, en marginalisering som forsterkes av at Norge tradisjonelt sett har hatt en begrenset legemiddelindustri.
Utfordringsbildet sett fra legemiddelindustrien
En utfordring som er trukket frem av LMI er tiden det tar å igangsette en klinisk studie med legemidler. Det handler om å koordinere arbeidet med relevant fagmiljø i helsetjenesten, få de nødvendige forhåndsgodkjenningene og rekruttere et tilstrekkelig antall pasienter som kan delta i den kliniske studien. LMI mener videre det bør være insentiver for å gjennomføre kliniske studier i helseforetakene.
Det er dyrt å gjennomføre kliniske legemiddelutprøvinger i Norge, noe som gjør Norge mindre attraktiv for legemiddelutprøving enn land med lavere kostnadsnivå.
Dersom kapasiteten for tidlig fase studier styrkes, kan det virke positivt inn på om de videre fasene i en klinisk studie gjennomføres i Norge.
Utviklingen i retning av en mer persontilpasset medisin gjør at industrien ønsker samarbeid med helseforetakene om utprøving av legemidler som er målrettet mot subgrupper av pasienter. Dette mener de vil kreve en forberedelse i tjenesten i form av oppbygning av kompetanse og teknologi.
22.5 Flere og større kliniske studier av høy kvalitet
Nedgangen i antall kliniske studier representerer utfordringer på flere nivåer. Pasienters tilgang til nye legemidler eller behandlingsformer begrenses og industriens muligheter til å gjennomføre kliniske legemiddelstudier i Norge begrenses. For tjenesten kan nedgangen i kliniske studier påvirke kvaliteten og pasientsikkerheten ved behandlingstilbudet, blant annet ved at helsepersonellets muligheter til å holde seg faglig oppdatert og for å drive kunnskapsbasert undervisning vil bli svakere. I et prioriteringsperspektiv er det ønskelig og en fordel med kunnskap om bruk av nye behandlingsmetoder i en klinisk hverdag for å vurdere hvilke legemidler som skal tas i bruk i tjenesten. For å fremskaffe slik kunnskap, er det behov for kliniske studier.
En sentral helsepolitisk målsetning er å øke antall, størrelse på og kvaliteten på kliniske studier med og uten legemidler, noe som også er et ønske fra industrien, helsetjenesten og pasientorganisasjonene. Det er videre et mål at de studiene som gjennomføres vurderes som nyttige og understøtter tjenestens behov for kunnskap om både nye og eksisterende behandlingsmetoder.
For å øke antall, størrelse og kvalitet på kliniske studier av nytte for tjenesten, vil Helse- og omsorgsdepartementet etablere et felles forskningsprogram for nasjonale kliniske multisenterstudier i helseforetakene og styrke infrastruktur for kliniske studier og tverrsektorielt og internasjonalt samarbeid.
22.5.1 Nasjonale kliniske multisenterstudier
Kliniske multisenterstudier er større studier som gjennomføres ved flere kliniske utprøvingsenheter parallelt. I tillegg til at det gir flere pasienter over hele landet mulighet til å delta, bidrar slike studier til økt koordinering av kompetanse, ressurser og infrastruktur og styrker grunnlaget for å gi sikre data av god kvalitet. Kliniske multisenterstudier kan være kostbare å gjennomføre, spesielt i de tilfeller der legemiddelkostnadene betales av det offentlige. I HelseOmsorg21-strategien omtales behovet for en særskilt finansiering av store nasjonale kliniske multisenterstudier og sammenlignende effektstudier innen områder som ikke prioriteres av industrien.
Identifiserte kunnskapsbehov benyttes i for liten grad som utgangspunkt for oppstart av forskningsprosjekter. Fraværet av et system som kan fange opp behov og igangsette en studie med utgangspunkt i behovet, kan potensielt øke sannsynligheten for at resultatene fra forskningen ikke tas i bruk i tjenesten eller ikke reiser de spørsmål som vurderes som mest viktige. Pasienter, pårørende og helsepersonell er tett på sykdom og behandling og har ofte viktige spørsmål som kan være relevante i en klinisk studie. Eksempler på miljøer som fanger opp slike kunnskapsbehov er nasjonalt system for innføring av nye metoder og Nasjonalt kunnskapssenter for helsetjenesten.
For å imøtekomme behovet for større nasjonale kliniske studier, med forutsigbar finansiering og som svarer til behov identifisert av pasienten, i tjenesten, av beslutningstakere og av forskeren selv, ønsker Helse- og omsorgsdepartementet fra 2016 å etablere en felles satsing på kliniske multisenterstudier i helseforetakene, organisert som et felles forskningsprogram. I tillegg til nasjonale kliniske multisenterstudier som vil kunne gi pasienter tilgang til utprøvende behandling, skal programmet finansiere sammenliknende effektstudier med dokumentert nytte for pasienten og tjenesten. Programmet foreslås eiet og finansiert primært gjennom de øremerkede midlene til nasjonale kliniske studier i helseforetakene21, slik at den kliniske forskningen er tett knyttet opp mot pasientbehandling og tjenestens behov for kliniske studier. For å trekke på eksisterende systemer for utlysning, søknadsbehandling og fagfellevurdering ved større, nasjonale studier, vil Norges forskningsråd gjennomføre utlysningen og administrere programmet på oppdrag av de regionale helseforetakene. I tillegg vil midler som inngår i Forskningsrådets Program for offentlig initierte kliniske studier på kreftområdet kanaliseres inn i programmet. Sammen med pasienter vil de regionale helseforetakene være sentrale i vurderingen av prosjektenes nytte for pasientbehandlingen. Virkemidlet behovsidentifisert forskning, nærmere omtalt i kapittel 22.4.2, vil brukes i programmet. Prosjektene som finansieres av programmet skal vurderes for kvalitet og nytte, ha brukerinvolvering, være forankret i og ledet av helseforetakene, ha deltakelse fra alle helseregioner og det skal rapporteres på hvordan resultatene implementeres i tjenesten. Det bør være en kobling til nasjonalt system for innføring av nye metoder i spesialisthelsetjenesten. Programmet vil åpne for industrisamarbeid, forutsatt at studien imøtekommer pasientens og tjenestens behov og at det er forankret i helseforetakene.
22.5.2 Infrastruktur og samarbeid
Det nasjonale nettverket for klinisk forskningsinfrastruktur, NorCRIN, gir råd og veiledning for å sikre gjennomføring av kliniske studier av høy kvalitet. Det kan omfatte råd om nasjonale prosedyrer for klinisk legemiddelforskning, kurs i god klinisk utprøvingspraksis og datahåndtering. Kliniske multisenterstudier, slik som den nasjonale studien på legemidlet ipilimumab for føflekkreft, biotilsvarende legemidler og legemidlet rituksimab for pasienter med CFS/ME, er forankret i NorCRIN.
NorCRIN er ikke en egen juridisk enhet, men et nettverk bestående av de seks universitetssykehusene (partnerne), med et sekretariat lagt til St. Olavs Hospital HF. Besluttende organ er en nettverkskomité med to representanter fra hver partner. I perioden 2012–2014 er det gjennomført ulike arbeidspakker bestående av blant annet nasjonalt program for god klinisk utprøvingspraksis, oversikt over nasjonale fagnettverk, tilvirkning av studiemedisin mv. NorCRIN-sekretariatet kan påta seg operative oppgaver i forbindelse med gjennomføring av flerregionale kliniske multisenterstudier. Nettverket er et av infrastrukturprosjektene som er plassert på Norges forskningsråds Veikart for forskningsinfrastruktur, og vurdert som investeringsklart, men det er så langt ikke tildelt midler. For ytterligere å støtte gjennomføringen av kliniske studier, kan det være aktuelt å se på om enkelte sponsoroppgaver ved en klinisk studie kan legges til nettverket (sekretariatet). Dette er anbefalt i HelseOmsorg21-strategien. For bedre å legge til rette for samarbeid med industrien, bør industrien inviteres inn i nettverket. God oversikt over kunnskap og kapasitet i universitetssykehusene, andre helseforetak og forskningsnettverk for kommunehelsetjenesten vil være viktig slik at eksterne oppdragsgivere kan betjenes trygt og raskt og nettverket raskt kan mobilisere ved nasjonale og internasjonale utlysninger av forskningsmidler.
For å bidra til økt volum av tidlig fase-studier, er det ønskelig at det opprettes et kontaktpunkt for slike studier under NorCRIN, med forbindelser til de øvrige helseregionene. Kontaktpunktet skal bidra til at pasienter i hver helseregion skal gis mulighet til å delta i tidlig fase-studier, selv om de pågår i en annen region. Da trengs et kontaktpunkt for formidling av informasjon og vurdering av eventuell deltakelse. Det er naturlig at kontaktpunktet legges til Helse Sør-Øst RHF, der tyngdepunktet for tidlig fase utprøvinger ligger.
Tidlig fase kliniske studier, utprøving av ny, kostbar medisinsk teknologi og bruk av genetiske og biologiske data vil kreve en sentralisering, så vel som en oppbygging av infrastruktur og kompetanse ved universitetssykehusene. En flaskehals for utviklingsarbeidet er tidlig fase utprøvingsenheter. Kliniske utprøvingsenheter bidrar til at kunnskap og investeringer i medisinsk grunnforskning overføres til praktisk medisin og utvikling av ny diagnostikk og behandling til nytte for pasientene. Det er behov for å styrke kapasiteten ved de kliniske utprøvingsenhetene. De regionale helseforetakene har derfor fått i oppdrag for 2015 å styrke infrastruktur, utprøvingsenheter og støttefunksjoner for kliniske studier ved universitetssykehusene innen gjeldende rammer. Dette vil være et langsiktig arbeid. Økt kapasitet vil gi flere pasienter tilgang til utprøvende behandling.
Forskningsnettverk bidrar til å øke kompetansen og forskningsinnsatsen innen enkelte kliniske områder. Slike nettverk muliggjør flerregionalt og nasjonalt samarbeid og kan bidra til at større kliniske studier raskere kommer i gang. Det er behov for en bedre oversikt over eksisterende forskningsnettverk for å kunne vurdere om det er områder der det ikke eksisterer slike, men der det er samfunnsmessige behov for kunnskap, og formålstjenelig med nettverk for å heve kompetansen og forskningsinnsatsen. De regionale helseforetakene har i 2015 fått i oppdrag å etablere nasjonale forskningsnettverk innen områder der det er behov for slike, eksempelvis innen persontilpasset medisin. Videre bør utlysninger i det foreslåtte forskningsprogrammet for nasjonale kliniske multisenterstudier i helseforetakene stimulere til etablering av nasjonale forskningsnettverk.
22.5.3 Nasjonal nettportal
Som et ledd i at pasienter skal gis økt tilgang til utprøvende behandling og deltakelse i kliniske studier, er det behov for å utvikle en samlet og tilgjenglig informasjonsløsning over planlagte og pågående kliniske studier. Løsningen skal gi tilpasset informasjon om studiene slik at pasienter og pårørende kan gis mulighet til å kontakte fagmiljøene for en vurdering av deltakelse i studien. Videre vil en slik nettportal kunne være til hjelp for fastleger, klinikere og forskere til å rekruttere pasienter til sine kliniske forsøk.
Helse- og omsorgsdepartementet ga i 2014 Helsedirektoratet, i samarbeid med de regionale helseforetakene, i oppdrag å etablere en løsning for pasientrettet informasjon om kliniske studier, via portalen helsenorge.no. Løsningen planlegges lansert høsten 2015.
Gjennom det resultatbaserte tilskuddet til forskning i helseforetakene belønnes ulike sider ved forskningen. Disse er kvalitet, samarbeid på tvers av regioner, tildelinger fra nasjonale og internasjonale konkurransearenaer som EU, publiseringer og avlagte doktorgrader. For å stimulere til at det gjennomføres flere kliniske studier, vil det bli vurdert om disse faktorene skal suppleres med en faktor for antall pasienter som deltar i kliniske studier, som gir en omfordeling av det resultatbaserte tilskuddet. Forutsetningen er at det finnes gode data om pågående kliniske studier og deltakende pasienter. Det er under etablering en database for kliniske intervensjonsstudier, som har til formål å gi slike data i regi av de regionale helseforetakene og i samarbeid med forskningsinformasjonssystemet CRIStin og de regionale etiske komiteene for helsefaglig og medisinsk forskning.
22.5.4 Nordisk og internasjonalt samarbeid
Samarbeid på nordisk nivå gir et langt større pasientgrunnlag ved gjennomføring av kliniske studier. Med utviklingen innen persontilpasset medisin, der subgrupper av pasienter identifiseres på bakgrunn av genetiske markører/informasjon, vil det bli enda større behov for et større pasientgrunnlag for å få utført kliniske utprøvinger.
Det treårige (2013–2015) nordiske samarbeidsprosjektet om kliniske multisenterstudier har omfattet etablering av et nettverk kalt Nordic Trial Allicance med sekretariat i Nordforsk og forankring i alle de nordiske landene, utvikling av en felles web-portal22 med relevant informasjon og gjennomføring av flere nordiske demonstrasjonsstudier. Helse- og omsorgsdepartementet har de to siste årene gitt de regionale helseforetakene i oppdrag å støtte opp om Nordic Trials Alliance. Det ble i 2014 lyst ut 16 mill. kroner til kliniske multisenterstudier gjennom Nordic Trials Alliance. Norge deltar i flere av prosjektene, og det er opprettet arbeidspakker innen åtte sentrale temaer som er viktige for økt gjennomføring av kliniske multisenterstudier.
Den nye forordningen i EU på kliniske studier innebærer etablering av en felles portal som alle prosjektsøknader legges inn i. Bare ett land skal være rapportør for samme prosjekt, selv om det pågår i flere land. Forordningen gjelder alle intervensjonsstudier med legemidler, dvs. alle forsøk der legemidler skal testes på mennesker. Forordningen skal implementeres i norsk godkjenningssystem og lovverk. Den nye portalen og databasen vil være funksjonell tidligst mai 2016.
I Bo Könbergs rapport23 handler et av forslagene om en modell for gjensidig anerkjennelse mellom landene, av forskningsetiske vurderinger av nordiske forskningsprosjekter. Oppfølging av rapporten vurderes av de nordiske helseministrene.
23 Legge til rette for innovasjon og næringsutvikling
Det eksisterer mange ulike virkemidler for å legge til rette for innovasjon. Forskningsrådet har ansvar for noen ordninger. Innovasjon Norge har flere virkemidler. Helsetjenesten har selv muligheter til å legge til rette for innovasjon og til for eksempel å søke tilskudd til pilotprosjekt fra Helsedirektoratet, som forvalter en rekke tilskuddsordninger, hvorav noen er øremerket innovasjon.
Forskningsrådet har ansvaret for ordningen kalt Senter for forskningsdrevet innovasjon (SFI). Denne skal styrke innovasjon gjennom satsing på langsiktig forskning i et nært samarbeid mellom forskningsintensive bedrifter og fremstående forskningsmiljøer. SFI skal utvikle kompetanse på høyt internasjonalt nivå på områder som er viktig for innovasjon og verdiskaping. I dag er det i alt fire SFIer som er medisinsk rettet.
23.1 Mulighetsrom og utfordringer
På tross av å være et lite land, har Norge greid å utvikle en biomedisinsk klynge som regnes med i internasjonal forstand, særlig innenfor kreftområdet. Aktiviteten gjennom Oslo Universitetssykehus, Universitetet i Oslo og et førtitalls bedrifter med i alt om lag 4000 tilhørende forskere, er i stor grad preget av basalforskning og i mindre grad av bedriftsnær forskning og utvikling.
De fleste norske biomedisinske foretak befinner seg i førkommersiell fase, og kun et lite et mindretall har godkjente produkter ute på markedet. Følgelig er det svært få av disse som går med overskudd, og de fleste er avhengig av betydelig kapitaltilførsel for videre utvikling og drift. Det man kan kalle en biomedisinsk klynge i bred forstand, omfatter i Norge et syttitalls bedrifter, inkludert bedrifter innen andre segmenter som bioinformatikk, tjenestetilbydere innen klinisk forskning, diagnostikk samt mat- og fôringrediensindustri.
Utviklingstiden for legemidler er lang. Flere av de nyere selskapene, for eksempel Algeta som i fjor ble solgt til tyske Bayer for 17,6 mrd. kroner, har sin opprinnelse ofte helt tilbake på begynnelsen av 1990-tallet – noen enda tidligere. Forskningen som ligger til grunn, kan i mange tilfelle gå gjerne 25 år tilbake. Dette illustrerer også kompleksiteten ved denne type virksomhet.
Konkurransen innenfor legemiddelutvikling er global og økende. Mange av de store farmasiselskapene konsentrerer sine aktiviteter både innad i Europa og i USA foruten at aktiviteter overføres til Kina og India. BRICS-landene har dette som satsingsområde.
Betydningen av klynger er et fremtredende trekk globalt. De beste klyngene i global sammenheng har mange fellestrekk som fremragende FoU-miljøer og tilgang til gode forskere og talenter. Det er nære og godt samarbeid mellom akademia og sykehus. En annen viktig faktor er tilgang på kapital, både risikokapital (VC)24 for å sikre nødvendig omløp og dynamikk samt mer langsiktig industriell kapital25. Store internasjonale legemiddelfirmaer er også til stede i klyngene og aktivt understøtter nye virksomheter gjennom sin kjennskap til regulatoriske forhold, internasjonale markeder og ellers ved å bidra med kapital og risikoavlastning. Videre er offentlige myndigheter med å sikre stabile og forutsigbare rammevilkår for øvrig.
I et slikt perspektiv har Norge både fortrinn og utfordringer. Regjeringen satser på forskning og utdanning. Innovasjon og nyskaping er sentrale elementer i næringspolitikken og skal sikre framtidig verdiskaping. Norge har over tid satset på å frambringe vitenskaplige og teknologiske miljøer av fremragende kvalitet. Både innenfor nevrovitenskap og immunonkologi, er det norske forskningsmiljøer av høy internasjonal klasse. Norge har svært avansert forskningsinfrastruktur i form av biobanker og helseregistre, som er gjenstand for betydelig internasjonal oppmerksomhet. Utviklingstrekk ved dagens høyteknologiske medisin og krav til kvalitet i alle ledd indikerer at det fremover kan bli mer attraktivt å utføre kliniske studier i land med infrastruktur av høy kvalitet som Norge.
Norge har stort potensial for å utvikle kunnskapsindustri, blant annet ved å ta i bruk den høye kompetansen vi har i petroleumssektoren også innenfor andre næringsområder. Dette er aktuelt ved legemiddelutvikling, blant annet med hensyn til simulering, bildebehandling og håndtering av store datamengder.
Norge står overfor flere utfordringer som må håndteres for å kunne utvikle en biomedisinsk næringsklynge av internasjonalt format. Arbeidet med å omsette forskningspotensialet kommersielt må videreføres. Det innebærer at akademia, helseforetak, virkemiddelapparat som industri og investorer bør utvikle en felles forståelse for hvordan det næringsmessige potensialet kan utløses. Gjennom oppfølgingen av HelseOmsorg21-strategien etableres viktige samhandlingsarenaer. Dette vil understøtte samarbeidet mellom akademi og helseforetak og på den annen side ulike næringsaktører.
Det er over tid tatt viktige grep for å styrke og profesjonalisere teknologioverføringskontorer og kommersialiseringsenheter for å oppnå bedre næringsmessig utnyttelse av den offentlige forskningsinnsatsen. Regjeringen har økt de økonomiske rammene til kommersialiseringstiltak for å verifisere prosjekters potensial og modenhet, både teknologisk og markedsmessig, noe som også gjør det enklere for private investorer å gjøre sine vurderinger. Dette er et område Regjeringen prioriterer.
Norge har i siden 1990-tallet opplevd en framvekst av mange mindre forskningsbaserte og innovative små og mellomstore bedrifter innenfor så vel diagnostikk som legemiddelutvikling. Større selskap kan tjene som flaggskip og derved også tiltrekke internasjonal oppmerksomhet og ellers utgjøre et slags reservoar av human kapital. Det er i dag få store farmasøytiske selskaper med forskning, utvikling og produksjon i Norge. Tilstedeværelse av internasjonale aktører anses ellers å kunne bedre tilgang til privat kapital i tidlig fase foruten at slike selskaper har ledelseserfaring og kommersiell kompetanse som små og mellomstore bedrifter kan nyttegjøre seg. Å fremskaffe tilstrekkelig tidligfasekapital er krevende. Det hevdes også at utfordringen er særlig stor mht. biomedisinsk sektor. Regjeringen arbeider bl.a. med å utvikle robuste ordninger i samvirke med private.
23.2 Støtte til kommersialisering
Kommersialiseringsprogrammet Forny2020 under Norges forskningsråd skal bidra til å bringe resultater fra offentlig finansierte forskningsinstitusjoner fram til markedet. Programmet gir prosjektstøtte til både nystartede bedrifter og til teknologioverføringskontorer/kommersialiseringsaktører. Regjeringen har for hvert av årene siden den tiltrådte, styrket bevilgningene til Forny2020 – fra om lag 118 mill. kroner i 2013, til om lag 139 mill. kroner i 2014 og med ytterligere vekst for 2015 slik at bevilgningen nå er på om lag 172 mill. kroner (16,4 mill. kroner fra Kunnskapsdepartementet og resterende over Nærings- og fiskeridepartementets budsjett). Helseprosjekter får godt gjennomslag i Forny2020. Av basisbevilgningen i perioden 2011–2013 gikk 144 mill. kroner, dvs. 30 pst., til helseprosjekter. Det er i dag 28 pågående prosjekter finansiert over basisbevilgningen til Forny2020 innenfor terapi (herunder også legemiddelutvikling) og diagnostikk. Av de lokale prosjektmidler, tildelt i 2014, er det anslått at helseprosjekter utgjorde 30 pst. (av i alt 49 mill. kroner). Dette indikerer at Forny2020 er et viktig verktøy for å legge forholdene enda bedre til rette for kommersiell utnyttelse innenfor det biomedisinske området.
For å få frem flere gode gründere og flere vekstkraftige bedrifter i norsk næringsliv har Regjeringen i 2015 styrket den landsdekkende etablerertilskuddsordningen under Innovasjon Norges med 110 mill. kroner.
Offentlige og Industrielle Utviklingskontrakter (OFU/IFU) er Innovasjon Norges viktigste virkemiddel for risikoavlastning av FoU. Bruken av OFU/IFU innenfor helse har vært uendret de siste fire årene. En utfordring i denne forbindelse er at OFU/IFU-tilskudd også innebærer krav om medfinansiering. Både for legemidler og medisinsk utstyr er utviklingsløpene lange. Dersom en industripartner skal ta risiko på et tidlig stadium, vil denne ofte kreve betydelige rettigheter til et fremtidig produkt. Dette kan redusere utviklerbedriftens potensielle oppside. Også mange offentlige anskaffere finner det problematisk å satse på mindre og nye leverandører ut fra blant annet krav til sikkerhet og økonomisk handlingsrom.
23.3 Regulatorisk veiledning
I Norge finnes det en rekke forskningsintensive små og mellomstore virksomheter som har som mål å utvikle et nytt legemiddel. I tillegg utfører ikke-kommersielle forskere kliniske legemiddelstudier. Innovasjon på legemiddelområdet er svært krevende både økonomisk, kunnskapsmessig og regulatorisk. Det stilles strenge krav til dokumentasjon av kvalitet, sikkerhet og effekt for å få markedsføringstillatelse for et legemiddel. Det er derfor et klart behov for protokollveiledning og generelle råd om regelverket. Økt rådgivning sammen med etablerte forskningsstøtteinstitusjoner som NorCrin er derfor viktig.
HelseOmsorg21 anbefaler at:
«Innovasjon og næringsutvikling må innlemmes i norsk helse- og omsorgsforvaltning. Forsknings- og innovasjonsprosjekter skal ha tilgang til regulatorisk rådgivning og kompetanse. Et eksempel er at Statens legemiddelverk får mandat og ressurser til å etablere et nasjonalt innovasjons- og veiledningskontor for å støtte norsk legemiddelforskning og norske små og mellomstore bedrifter (SMEer).»
En vitenskapelig veiledningstjeneste er etablert hos EMA i London. Her kan farmasøytisk industri få råd om nødvendige tester og studier som er nødvendig for å få godkjent et legemiddel. Tjenesten har som mål å fremme utviklingen og tilgjengeligheten av nye legemidler. Vitenskapelig veiledning hos EMA må anses som et høyterskeltilbud. Det krever at søker allerede i utgangspunktet besitter betydelig vitenskapelig og regulatorisk kompetanse. Avgiftene for å søke råd varierer. Det kreves eksempelvis EUR 83 600 for førstegangs vitenskapelig rådgivning knyttet til utvikling av dokumentasjon av sikkerhet og effekt for legemidler til mennesker. For legemidler til dyr er avgiften den halve, mens små og mellomstore virksomheter kan få avgiften redusert med 90 pst. for vanlige legemidler og 100 pst. for orphanlegemidler.
Regulatorisk veiledning er etablert i Sverige hvor man nå har et innovasjonskontor ved Läkemedelsverket i Uppsala og et i Gøteborg. Innovasjonskontoret fungerer som lavterskel førstelinjekontakt for å gi rask veiledning og dermed redusere tiden til konklusivt resultat, tilrettelegge for kontakt med intern ekspertise ved mer kompliserte spørsmål og koordinere rådgivningsmøter ved forespørsel. I Sverige må kommersielle aktører betale 45 000 SEK for et møte av 1,5 t varighet, som også dekker legemiddelmyndighetenes forberedelser.
Også andre europeiske myndigheter har etablert regulatoriske veiledningstjenester for å gi støtte og råd til nasjonale aktører. Et av tilbudene er nasjonale rådgivningsmøter som er spesielt nyttig for små og mellomstore bedrifter og akademiske forskningsmiljøer (f.eks. sykehusavdelinger).
Legemiddelverket har etablert et eget prosjekt, VIRIL (Veiledning og Råd i Legemiddelutvikling) som har som mål å utvide veiledning overfor små norske bedrifter og akademiske institusjoner. I løpet av 2013 og 2014 gjennomførte Legemiddelverket 46 rådgivningsmøter med slike bedrifter og institusjoner for å bidra til oppbygging av nødvendig dokumentasjon. Av disse møtene omhandlet 12 av dem legemidler til fisk.
I EU-kommisjonenes forslag til nytt regelverk for godkjenning av veterinære legemidler, er det inntatt en bestemmelse om at nasjonale legemiddelmyndigheter skal tilby en regulatorisk veiledningstjeneste til små og mellomstore virksomheter.
Det finnes fortsatt store og viktige sykdomsgrupper som mangler effektiv behandling. Myndighetene har derfor et ansvar for å tilrettelegge for at ny og effektiv behandling utvikles og faktisk når frem til pasientene (mennesker og dyr).
EMAs regulatoriske veiledningstjeneste er ikke er egnet for mindre virksomheter uten betydelig vitenskapelig og regulatorisk kompetanse. Akademiske miljøer har ikke tilgang til EMAs rådgivning, og nasjonal rådgivning er derfor den eneste muligheten for disse.
Legemiddelverket besitter stor legemiddelregulatorisk ekspertise. Denne er tilegnet og utviklet gjennom utredning av søknader i både nasjonale og europeiske prosedyrer for godkjenning av legemidler. Denne kunnskapen er svært verdifull for forskere og legemiddelprodusenter som arbeider for å utvikle dokumentasjon som må vedlegges en søknad om markedsføringstillatelse.
Legemiddelverket kan gjennom VIRIL bidra til at forskningsmiljøer og små og mellomstore bedrifter gjennomfører sine studier i henhold til regulatoriske krav og på en slik måte at det kan føre til et produkt som oppnår markedsføringstillatelse og kommer næringen til nytte. Sub-optimale forsøk som ikke gir pålitelige eller tolkbare resultater kan i verste fall forårsake at gode legemiddelkandidater velges bort.
Bedrifter som arbeider med ny og innovativ medisin for å bedre fiskehelse, er kanskje blant de som vil ha størst nytte av slik veiledning.
Regulatorisk veiledning gir brukerne:
Forståelse av veien fra idé til godkjent produkt.
Tilgang på ekspertise med erfaring fra utredning av søknader om klinisk utprøving og markedsføringstillatelse.
Mulighet til å diskutere en søknad før den sendes inn, slik at dokumentasjonen er i henhold til regulatoriske krav.
Råd om hvordan gjennomføre studier for at de skal kunne gi tolkbare resultater første gang studiene gjennomføres slik at bedrifter og samfunnet sparer tid og ressurser.
Informasjon om hvilke studier som er søkepliktige, hvordan søke kliniske studier, hva skal til for å få godkjent en studie, hvilke dokumentasjonskrav stilles og sykehusunntak for avanserte terapier.
For å bedre tilgangen til nye effektive legemidler til mennesker og dyr og legge til rette for utvikling av farmasøytisk industri i Norge, vil Statens legemiddelverk gjennom sin veiledningstjeneste Viril bistå legemiddelindustrien og akademia med regulatorisk veiledning, samtidig som det etablerte samarbeidet mellom Viril og NorCRIN videreføres.
23.4 Adaptive pathways
Det er utviklet mange sikre og effektive legemidler, og muligheten til å forebygge og behandle sykdom er derfor vesentlig bedre enn tidligere. Det er likevel fortsatt områder hvor det mangler effektive legemidler, og det er derfor viktig at det legges til rette for utvikling av ny behandling.
Utvikling av nye legemidler er kostbart og tidkrevende og mange utviklingsprosesser fører aldri frem til en markedsføringstillatelse. Dette er særlig uheldig på sykdomsområder hvor det ikke finnes et godt behandlingstilbud. Dette gjelder for de fleste sjeldne sykdommer, det vil si der det er færre enn 5 pasienter per 10.000 personer i EØS, og innenfor kreftområdet hvor man blant annet mangler legemidler til behandling av kreft i bukspyttkjertelen, lungekreft og hjernetumorer.
En rekke tiltak er iverksatt for å bidra til at legemidler kommer raskere på markedet. Er legemidlet terapeutisk nyskapende og viktig for folkehelsen, kan godkjenningen i sentral prosedyre reduseres fra 210 til 150 dager. For sykdommer hvor det ikke finnes god etablert behandling, kan legemidler godkjennes selv om foreliggende dokumentasjon av legemidlets sikkerhet og effekt ikke er tilstrekkelig til å oppnå ordinær markedsføringstillatelse. Er sykdommen svært sjelden, eller det ikke er mulig eller uetisk å skaffe slike data, kan det i visse tilfeller gis en tillatelse under exceptional circumstances. Er det vanskelig å fremskaffe tilstrekkelige data vedrørende legemidlets sikkerhet og effekt, eksempelvis fordi sykdommen er sjelden, kan det også gis en betinget markedsføringstillatelse. I motsetning til en tillatelse under exceptional circumstances stilles det her krav til legemiddelfirmaet om å skaffe mer kliniske data for å kunne bekrefte sikkerhet og effekt innen en viss tid etter godkjenning. Slike tillatelser skal revurderes årlig. I 2013 og 2014 ble henholdsvis 11 pst. og 9 pst. av alle nye legemidler godkjent med slik begrenset dokumentasjon.
EU ser nå nærmere på hvordan prosedyrene for godkjenning med begrenset dokumentasjon kan utnyttes bedre for sykdommer det ikke finnes god etablert behandling. Ved EUs legemiddelbyrå ble det i 2014 startet en pilot for såkalt adaptive pathways (tidligere adaptive licensing). Adaptive pathways er en utviklingsplan som skal sikre at nye legemidler blir raskere tilgjengelig for pasientene samtidig som behovet for å kunne gi tilstrekkelig og oppdatert informasjon om legemidlenes nytte og risiko ivaretas. Adaptive pathways er særlig relevant for legemidler til behandling av alvorlige tilstander der det ikke finnes tilstrekkelig behandling i dag. Det er forutsatt av EU-kommisjonen at slik godkjenning skal skje innen dagens gjeldende regelverk.
Ved Adaptive pathways kan produktet godkjennes for en veldefinert pasientgruppe som mangler effektiv behandling. Utviklingsplanen for produktet legger deretter til rette for at bruksområdet kan utvides til en større pasientgruppe basert på innsamling av mer kliniske data. En annen mulighet er at det først gis en betinget markedsføringstillatelse (conditional approval), og at man deretter samler inn mer data slik at en ordinær markedsføringstillatelse kan utstedes.
Adaptive pathways innebærer at det skal være en tett dialog mellom legemiddelfirmaer, myndigheter, helseøkonomer og pasientorganisasjoner fra et tidlig tidspunkt i utviklingsforløpet for et nytt produkt, for å sikre at riktige og reelle data av tilstrekkelig kvalitet blir samlet inn og at alle regulatoriske virkemidler iverksettes på riktig tidspunkt.
Den vesentlige forskjellen mellom dagens praksis og Adaptive pathways er at i sistnevnte tilfelle inngås et tettere samarbeid mellom legemiddelfirmaet, myndigheter, tjenesten og pasientorganisasjoner som resulterer i en prospektiv planlagt utviklingsplan for produktet frem mot en eventuell markedsføringstillatelse. Dette skal sikre rask pasienttilgang og samtidig ivareta behovet for å kunne gi tilstrekkelig og oppdatert informasjon om legemidlenes nytte og risiko. Om Adaptive pathways blir et verdifullt alternativ til de eksisterende prosedyrene for godkjenning av legemidler i Europa, vet man først senere.
Raskere tilgang til legemidler er positivt for industri, samfunn og pasienter, og er særlig viktig på områder der effektiv behandling mangler. Godkjenning av legemidler med begrenset dokumentasjon innebærer på den annen side større usikkerhet vedrørende legemidlets sikkerhet og effekt enn det som er tilfellet der fullstendig dokumentasjon er fremlagt. Slik godkjenning kan også medføre at utprøving av nye legemidler i realiteten flyttes fra kliniske studier, der pasientsikkerheten er særlig godt ivaretatt, til ordinær klinisk bruk der pasienten ikke følges like nøye.
Rask tilgang gjør at man på tidspunktet for godkjenning har begrenset tilgang på data om legemidlet. Dette vil være en utfordring for myndighetene, som vil mangle viktige opplysninger for å vurdere om krav til kostnadseffektivitet, og andre prioriteringskriterier for om legemidlet skal tas i bruk i helsetjenesten er oppfylt. Flere land i EU har påpekt at det er avgjørende for tidlig adgang at det parallelt med godkjenningen av legemidlet fremskaffes dokumentasjon for legemidlets kostnadseffektivitet.
Norske myndigheter vil følge piloten nøye. Det vil være vesentlig at prosedyren settes opp slik at den bidrar til tidlig godkjenning der det er et særlig behov, samtidig som behovet for å beskytte pasienter ivaretas. Ordningen bør derfor begrenses til godkjenninger der det medisinske behovet er stort, og må ikke lede til at standarden for godkjenning av legemidler reduseres. Hvorvidt man parallelt fremskaffer gode data for legemidlets kostnadseffektivitet vil ha stor betydning for når legemidlet tas i bruk i Norge og for øvrig i EØS.
24 Næringspolitikk
Regjeringens mål med næringspolitikken er størst mulig samlet konkurransekraft og verdiskaping i norsk økonomi. Verdiskaping er grunnlaget for sysselsetting, høyt velstandsnivå og gode velferdsordninger, deriblant en solid helse- og omsorgssektor. Næringspolitikken skal ivareta og videreutvikle landets konkurransefortrinn og legge til rette for et næringsliv som er bærekraftig, innovasjonsrettet, kunnskapsbasert og omstillingsdyktig.
Norges forskningsråd og Innovasjon Norge forvalter en stor andel av regjeringens næringsrettede virkemidler. Hensikten med de næringsrettede virkemidlene er å utløse samfunns- og bedriftsøkonomisk lønnsomme prosjekter som ellers ikke ville blitt iverksatt, uavhengig av bransje. Den offentlige støtten skal bidra til bedre utnyttelse av samfunnets ressurser, enn hva som hadde vært tilfellet dersom virkemiddelet ikke hadde vært tatt i bruk. Markedet er imidlertid den viktigste kilden til kapital for nye prosjekter. Virkemiddelapparatet er således ikke den eneste eller den sentrale finansieringskilde for de prosjektene som finansieres, men skal bidra til å utløse privat kapital.
Regjeringen vurderer at helse- og omsorgssektoren er et område med et stort verdiskapingspotensial. Derfor er det viktig at virkemidlene er tilpasset sektorens behov. Norge har et meget godt sett av virkemidler, som sektoren og tilhørende bedrifter utnytter på godt vis og med gode resultater.
Gjennom satsing på både grunnleggende, anvendt og bedriftsrettet forskning og kommersialiseringsaktiviteter, legger Regjeringen et godt grunnlag for næringsutvikling innen legemiddelområdet.
24.1 Ordninger som skal fremme kommersialisering
24.1.1 Skatteinsentiver
SkatteFUNN-ordningen er en skattefradragsordning som er særlig viktig for nye forskningsbaserte bedrifter. SkatteFUNN bidrar til mer forskning i bedriftene enn hva som bedriftene ellers ville investert. Dette gir flere forbedrede og nye produkter og prosesser i bedriftene. Gjennom SkatteFUNN kan små og mellomstore bedrifter få 20 pst. av prosjektkostnadene som skattefradrag gjennom skatteoppgjøret. Store bedrifter kan få 18 pst. fradrag av prosjektkostnadene. Bedriftene innenfor sektor helse er godt kjent med SkatteFUNN-ordningen og har brukt den lenge. Helseprosjektene har tradisjonelt et vesentlig innhold av forskning og utvikling.
Prosjektene henvender seg mot ulike deler av helsemarkedet. De største områdene er utvikling av nye diagnostikk- og analysemetoder, nye legemidler, nye behandlingsmetoder, samt utvikling av tekniske og elektroniske hjelpemidler til bruk for både helsepersonell og pasienter. En stor del av prosjektene har et vesentlig innslag av IKT, for eksempel i form av nye systemer for behandling av helseinformasjon og elektroniske løsninger for tolking og samordning av diagnostiske analyser. Iht. årsrapport 2013 for SkatteFUNN utgjorde helse 9 pst. av porteføljen og var derved det tredje største næringsområdet (etter petroleum og IKT-næringer). Innenfor legemiddelutvikling har det i perioden fra 2011 frem til i dag vært hele 180 SkatteFUNN-prosjekter. Disse som rommer et bredt spekter av aktiviteter, inkludert klinisk utprøving.
24.1.2 Nettverksprogrammer
Gjennom Innovasjon Norge er det opprettet en nettverksordning, Norwegian Centres of Expertise (NCE), og Oslo Cancer Cluster er ett slikt NCE. Oslo Medtech er en klynge bestående av bedrifter, sykehus, investeringsmiljøer samt kunnskaps- og forskningsinstitusjoner som fokuserer på medisinsk teknologi og innovasjon. Dette initiativet støttes av arena-programmet. Erfaringene viser at for biomedisinsk sektor er klynger og nettverk av særlig stor betydning. Slike regionale innovasjonssystemer utvikles gjennom kulturell, geografisk og institusjonell nærhet som skaper og letter samhandling blant aktørene.
24.1.3 Egenkapitalvirkemidler
Tilgang på tidligfasekapital tillegges stor betydning for utvikling av biomedisinsk næringsvirksomhet. I tidlige faser hvor risikoen er særlig høy med hensyn til fremtidig inntjening, er det viktig å stimulere privat kapital.
I statsbudsjettet for 2015 ble det bevilget 300 mill. kroner i investeringskapital til to landsdekkende såkornfond. Disse såkornfondene opprettes etter samme modell som for de to såkornfondene som ble etablert i 2014. Det innebærer at private deltar med minst 50 pst. av kapitalen og at Innovasjon Norge forvalter statens engasjement i fondene og velger ut private forvaltere for fondene basert på konkurranse. Regjeringen har besluttet at de to fondene som nå opprettes skal ha sin forvaltning lokalisert i Bergen og Nord-Norge. Investorene og forvalterne velger bransje fondene investerer i. Fondene som ble opprettet i Trondheim og Oslo i 2014 investerer i henholdsvis olje og gass og IKT.
Det statlige investeringsselskapet Investinor AS kan også bidra med egenkapitalfinansiering på kommersielle vilkår.
Boks 24.1 Regjeringen vil for å legge til rette for forskning og innovasjon:
Etablere et felles forskningsprogram for nasjonale kliniske multisenterstudier i de regionale helseforetakene.
Styrke forskningsinfrastrukturen for kliniske studier gjennom NorCRIN og kapasiteten til kliniske utprøvingsenheter ved universitetssykehusene, samt et eget kontaktpunkt for tidlig fase studier.
Bedre nasjonalt forskningssamarbeid om kliniske studier gjennom forskernettverk.
Etablere pasientrettet informasjon om kliniske studier på helsenorge.no.
Vurdere om pasienters deltakelse i kliniske studier skal bli en del av det resultatbaserte finansieringssystemet for forskning i de regionale helseforetakene.
Videreføre nordisk og internasjonalt samarbeid om kliniske studier.
Bistå legemiddelindustrien og forskningsmiljøene med regulatorisk veiledning gjennom veiledningstjenesten Viril i Statens legemiddelverk. Legemiddelverket vil samarbeide med NorCRIN.
Fotnoter
Regjeringsplattformen.
I perioden 2009–2014 lå prosentandelen av søkte fase IV-studier finansiert av det offentlige (universitet/sykehus) på mellom 73 og 88 pst., med høyest andel i 2012.
Registry based randomized clinical trials, for eksempel TASTE-studien.
http://www.kvalitetogprioritering.no.
OECD Global Science Forum. Facilitating International Co-operation in Non-Commercial Clinical Trials. 2011.
European Network for Health Technology Assessment og Health Technology Assessment Network.
The Joint Committee of the Nordic Medical Research Councils. Present status and future potential for Medical Research in the Nordic Countries. Nordic White paper on Medical Research. 2011.
Bo Könberg. Det framtida nordiska hälsosamarbetet. Nordisk Ministerråd. 2014.
Eksempler på endepunkter i en klinisk studie er total overlevelse, hendelsesfri overlevelse og tid til neste behandling (www.helsebiblioteket.no).
Tallon D et al. Exploring the priorities of patients with osteoarthritis of the knee. Arthritis Care Res. 2000; 13: 312–19.
ICH: Gender considerations in the conduct of clinical trials, EMEA/CHMP/3916/2005.
Regulation (EU) No 536/2014 of the European Parliament and of the Council of 16 April 2014 on clinical trials on medicinal products for human use, and repealing Directive 2001/20/EC.
«Research is a core part of the NHS. Research enables the NHS to improve the current and future health of the people it serves. The NHS will do all it can to ensure that patients, from every part of England, are made aware of research that is of particular relevance to them. The NHS is therefore putting in place procedures to ensure that patients are notified of opportunities to join in relevant ethically approved research and will be free to choose whether they wish to do so.» Handbook to the NHS Constitution, (2009).
Spesialisthelsetjenestelovens § 3-8 og helseforetakslovens §§ 1 og 2.
Systemet har vært under endring i de senere år, gjeldende indikatorer ble innført med virkning fra 1. januar 2013.
Norges forskningsråd/NIFU. Det norske forsknings- og innovasjonssystemet – statistikk og indikatorer. 2013.
Norges forskningsråd/NIFU. Det norske forsknings- og innovasjonssystemet – statistikk og indikatorer. 2014.
De regionale helseforetakene. Forskning og innovasjon til pasientens beste. Nasjonal rapport fra spesialisthelsetjenesten 2014.
www.norcrin.no.
Fra program for offentlig initierte kliniske studier på kreftområdet i Norges forskningsråd.
Prop. 1 S (2014–2015), kap. 732, post 78.
http://nta.nordforsk.org/
Bo Könberg. Det framtida nordiska hälsosamarbetet. Nordisk Ministerråd. 2014.
VC er en type privat egenkapital med sikte på tidlig å kunne identifisere prosjekter gjerne innenfor nye teknologiområder og med potensial til å generere høy avkastning i tidlig fase. Tidshorisonten for engasjementene strekker seg vanligvis ikke utover fem, seks år.
Industrielle investeringsselskap utøver aktivt eierskap i bedriftene de investerer i og styrer bedriftene de eier finansielt og strategisk, men ikke operativt. Tidshorisonten deres er lengre enn VC. Mange mener derfor at denne type kapital er viktig for å kunne utvikle legemiddelbedrifter gitt lang utviklingstid og stort kapitalbehov.