3 Om kreft
3.1 Hva er kreft?
Kreft er en biologisk prosess som igangsetter en kaskade av prosesser i organismen. Tross mangfoldet, har kreftsykdommene visse fellestrekk. Det kan beskrives på cellulært nivå, virkning på enkeltorganer, organsystemer og de reaksjoner og endringer i kroppsfunksjoner som pasienten registrerer. Den enkelte pasients sykdomsopplevelse vil ikke være begrenset til de utløsende biologiske prosessene. Pasientens daglige tilværelse blir endret. Sykdom og behandling har følger for arbeidssituasjon, økonomi og familie.
Kreftsykdommenes biologi
Biologisk karakteriseres kreft ved manglende kontroll av celledelingen. Cellene har også en tendens til å spre seg ved direkte innvekst til nærliggende organer. Den normale struktur og funksjon av disse organene kan bli ødelagt. Innvekst i skjelettet kan føre til en svekkelse av knokkelens bæreevne. Dette kan føre til smerter og brudd.
De såkalt solide svulstene starter i et organ ( moderorganet) og danner en svulst eller tumor som man både kan kjenne og se. Brystkreft er et eksempel på en solid svulst. ( Solid henspiller på vekstformen og har i denne forbindelse ingen ting med svulstens konsistens å gjøre). Kreftcellene kan fraktes til andre deler av kroppen via lymfebanene og/eller blodbanene og danne kolonier av nye dattersvulster som i sin tur kan ødelegge vertsorganet.
I motsetning til de solide svulstene består leukemiene av enkeltceller som sirkulerer med blodet og eventuelt lymfen. De ondartede cellene stammer opprinnelig fra benmargen, der de produseres uten normal kontroll. Cellene kan ha varierende modningsgrad. De mest umodne formene kan være meget aggressive i sin vekstform. Symptomene kan forverres fra dag til dag (f. eks. de akutte leukemiene hos barn og voksne).
Noen ganger opprettholder kreftcellene rester av sin normale funksjon, f. eks. ved produksjon av eggehvitestoffer, hormoner eller andre signalsubstanser. Produksjonen blir imidlertid som et hakk i plata, og det kan hope seg opp i store mengder. Dette kan igjen føre til skade på andre organer, som nyrer, hjerte, øye, etc.
Veksthastigheten (utviklingstiden) viser en enorm variasjon. For noen svulster kan en registrere vekst fra dag til dag. For andre kan det være tilsynelatende stillstand i mange år. Vi vet lite om hvor lang tid en svulst bruker på å utvikle seg fra den første syke celle til den har nådd en størrelse som gir symptomer og kan bli oppdaget, men for de fleste kreftformene dreier det seg om mange år. Når en svulst når en størrelse på 1 cm3 eller veier 1 g, er det allerede blitt 1 milliard celler! I praksis er dette den nedre grense for hva som kan påvises ved vanlige undersøkelser, f. eks. med røntgenundersøkelser. En svulst som består av 100 millioner celler er vanskelig å oppdage og gir heller ingen symptomer! Derfor finnes ingen garanti for at en er frisk (eller kreftfri) selv om et røntgenbilde eller en klinisk undersøkelse er normal. Helsesjekk og usystematisk jakt på kreftsykdom er derfor oftest bortkastet (se pkt. 7.2.2).
Kreftsykdommene representerer et biologisk mangfold som gjenspeiles både i manifestasjon av symptomer og sykdomsforløp. Følgelig er den enkelte pasienten unik. Sykdomsopplevelsen er en individuell erfaring. Det er ikke alltid pasientens sykdomsopplevelse korresponderer med helsevesenets objektive beskrivelser og funn. Behandlingsresultatene skal måles og verdsettes av den som er rammet av sykdommen. Dette må være utgangspunktet for diagnostikk og behandling.
Selv om helsevesenet skal ha fokus på den enkelte pasienten, er forutsetningen for å finne frem til de mest effektive tiltakene, at sykdommen identifiseres og karakteriseres. For en gruppe på ti tilfeldig valgte brystkreftpasienter vil sykdomsforløpet ganske sikkert arte seg svært forskjellig, men det vil avvike enda mer fra en gruppe på ti leukemipasienter. Alle diagnosegrupper er videre inndelt i undergrupper der hensikten er å finne frem til likhetstrekk som gjør sykdomsforløp og reaksjon på behandlingen mest mulig forutsigbart. All tilnærming til kreftproblemet i videste forstand må baseres på kunnskap. Innsamlingen av denne kunnskapen forutsetter en gruppering av pasientene. Denne gruppering foregår på mange plan og består i å identifisere svulstcellenes opprinnelsesorgan, cellenes modningsgrad, sykdommens utbredelse i organismen, etc. Den praktiske anvendelsen av denne kunnskapen skal tilpasses det enkelte individ, som karakteriseres av alder, allmenntilstand, kjønn, eventuelle andre sykdommer, etc.
Behandlingen rettes primært mot selve kreftsvulsten. Kreftbehandling vil imidlertid alltid ha uønskede effekter. Den rammer langt flere biologiske prosesser enn det som er behandlingens primære mål, enten det dreier seg om operasjoner, strålebehandling, cellegift eller hormoner. Bivirkninger og andre følgetilstander av kreftbehandlingen på kort og lang sikt må følges og om mulig lindres. Eventuelle alvorlige langtidsskader er som regel ikke kjent når nye metoder tas i bruk.
Helsevesenets arbeidsform er av og til blitt beskrevet som en konflikt mellom individ versus gruppe. Det bør ikke fortone seg slik. Grupperingen er et helt nødvendig hjelpemiddel både for å komme frem til en best mulig behandling for den enkelte og for å erverve ny kunnskap som kan nyttiggjøres for senere pasienter med samme krefttype.
Behandling må også rettes mot sekundæreffektene. Vårt ansvar vil derfor omfatte både sykdomsprosessen og konsekvensene den gir for enkeltindividet. Heri innbefatter pasientens daglige tilværelse, de psykososiale behov, arbeidssituasjon og familie.
3.1.1 Hvordan oppstår kreft?
Kreft oppstår ved et komplisert samspill mellom ytre påvirkninger og indre (medfødte), av og til arvelige faktorer. I noen tilfeller er ytre påvirkninger den dominerende årsak, mens i andre tilfeller er arvelige faktorer viktigst.
En kreftsvulst starter ved at en enkelt celle begynner å dele seg uten hensyn til vevets behov. Hvordan og hvorfor dette skjer er nøye undersøkt i forsøk hvor celler dyrkes utenfor organismen i skåler og glass, og i eksperimenter på forsøksdyr.
Omdannelsen av en normal celle til en kreftcelle skjer i flere trinn som fører til at cellen avviker stadig mer fra en normal celle i sine egenskaper. Prosessen starter med at det oppstår kjemiske endringer i cellens arveanlegg, genene, som styrer og regulerer alle prosesser i cellene, inklusive deres delingshastighet, differensiering (spesialisering) og celledød. Det kreves en rekke genskader i samme celle for å danne en fullt utviklet kreftcelle med evne til ukontrollert vekst og spredning.
Genene sitter i kromosomene, som er trådformede dannelser i cellekjernene. Selve gensubstansen, som med en forkortelse kalles DNA, består av et langt trådformet molekyl som danner en dobbeltspiral. Et gen er et definert stykke av en DNA-tråd. Rekkefølgen av de kjemiske byggesteinene i genet representerer en instruks til cellene, en oppskrift på hvordan de skal danne bl.a. proteiner og viktige cellebestanddeler som styrer cellestoffskiftet. Kreftutviklingen kan påskyndes av stoffer, bl.a. av visse hormoner og vekstfaktorer, som ikke fremkaller genforandringer, men som øker celledelingshastigheten.
I de senere år har forskerne lært meget om hvordan skader på genene kan føre til kreft. Det er forandringer i genene som normalt påskynder celledelingen og de som normalt bremser celledelingen som fører til kreft. Ved forandringer av den kjemiske strukturen til gener som normalt påskynder celledelingen kan genets aktivitet øke sterkt, det blir til et såkalt onkogen eller kreftgen. Kjemiske forandringer av gener som normalt hemmer celledelingen, såkalte repressor- eller suppressorgener (suppress/repress, eng. = undertrykke) kan føre til at genet mister sin virkning, hvilket svarer til at bremsen svikter.
Endringer i genet, såkalte mutasjoner, kan oppstå på flere måter. En rekke kjemiske stoffer, såkalte karsinogener, fremkaller mutasjoner og kreft hos forsøksdyr og mennesker. Genskader og kreft kan også fremkalles ved bestråling, og visse virusarter kan fremkalle kreft ved at en del av virusets genmateriale blir bygget inn i cellenes arvemateriale.
Årsaker til kreft hos mennesker
Selv om medfødte, arvelige faktorer spiller en rolle ved utviklingen av kreft, er vår personlig atferd og livsstil, vårt miljø i videste forstand, av avgjørende betydning.
I de fleste tilfeller kan man ikke fastslå med sikkerhet hvorfor den enkelte pasient er blitt rammet av kreft. Det er flere grunner til dette. Fra vuggen til graven utsettes vi for en rekke faktorer som kan disponere for utvikling av kreft. En enkelt krefttype kan fremkalles av flere forskjellige kreftdisponerende faktorer, og det går oftest mange år fra skade oppstår på arvestoffet til en kreftsvulst viser seg. Dessuten kan våre celler reparere skader på arvematerialet. Disse mekanismene kan være mer eller mindre effektive hos forskjellige individer.
En rekke av de viktigste kreftformene viser store geografiske variasjoner i hyppighet. For eksempel er hyppigheten av brystkreft og kreft i tykktarm og endetarm lavere i Japan og andre land i Østen enn i USA og i andre vestlige industriland. Ved å sammenholde kreftforekomsten i ulike befolkningsgrupper med deres levekår, kan man identifisere en rekke faktorer i vår livsstil som påvirker kreftforekomsten og som er ansvarlig for den store økningen i krefthyppigheten som er skjedd i løpet av den siste generasjon. De viktigste kreftdisponerende faktorene er røyking, uheldige kostvaner, daglig bruk av alkohol samt overdreven soling. Den kunnskap vi nå har om disse faktorenes virkning på kreftforekomsten har åpnet muligheten for forebygging av kreft. Enkelte forskere har beregnet at opptil 80 % av alle krefttilfeller i prinsippet kan forebygges (se pkt. 7.1).
Tobakksrøyking er langt den viktigste ytre kreftfremkallende faktor vi kjenner. Tobakksrøyk inneholder en rekke kreftfremkallende stoffer, og røyking er ansvarlig for ca. 30 % av alle dødsfall av kreft.
Nest etter røyking er feilaktig kosthold ansett for å være den viktigste ytre faktor når det gjelder utvikling av kreft. På verdensbasis kan opptil 30 % av alle dødsfall av kreft ha sammenheng med kostholdet. I de vestlige industriland er det særlig kreft i tykktarm og endetarm, samt brystkreft og prostatakreft som henger sammen med kostholdet. Den dramatisk høyere forekomst av disse kreftformene hos oss sammenliknet med landene i Østen antas særlig å henge sammen med vårt høye forbruk av kjøtt og animalsk mettet fett. Fedme er en disponerende faktor. Fettet i kosten virker muligens på brystkjertelen og prostata via hormonelle mekanismer. Frukt og grønnsaker og kostfaktorer som vitamin A, E og C ser ut til å ha en beskyttende virkning mot kreft. (Det vises for øvrig til pkt. 7.1.2.)
Arvelig kreft
De fleste tilfeller av kreft er sporadiske, dvs. at de opptrer uten at det foreligger noen tydelig familiær opphopning. Noen kreftformer opptrer imidlertid med økt hyppighet i bestemte familier. Dette gjelder bl.a. retinoblastom (en sjelden svulst i øyebunnen hos barn) samt visse undergrupper av kreft i tykktarmen, brystkjertelen og eggstokkene.
Arvelige former for kreft opptrer ofte hos yngre individer. I dobbeltsidige organer som øynene, brystkjertlene og eggstokkene, opptrer arvelig kreft ikke sjelden på begge sider. Familiær opptreden av kreft tyder på at de som rammes, har arvet et gen som fører til økt kreftrisiko hos alle individer som har arvet dette genet.
Omtrent 5 % av tilfellene av brystkreft viser familiær forekomst. Hvis en kvinne har flere nære slektninger, mor og/eller søster som har fått brystkreft før fylte 50 år, kan hennes risiko for å få brystkreft være henimot 50 %. Noen ganger opptrer brystkreft og eggstokkreft i samme familie.
I den senere tid har man identifisert flere gen som er ansvarlig for utvikling av kreft i familier med arvelig kreft. I slike familier er noen individer bærere av genet og har høy risiko for å få kreft, mens andre medlemmer av familien ikke er bærere. Risikoen for å få kreft vil for disse ( ikkebærere) være som for andre mennesker. For visse arvelige kreftformer kan man ved laboratorieundersøkelser fastslå om et individ er bærer av et kreftgen eller ikke.
Arvelige faktorer spiller antakelig også en rolle hos individer som er utsatt for en ytre kreftdisponerende faktor, som f. eks. sigarettrøyking. Dette kan skyldes, i alle fall delvis, at organismens evne til å bryte ned og ufarliggjøre kreftfremkallende stoffer er avhengig av arvelige faktorer.
Arvelig kreft kan defineres som økt risiko for kreftutvikling, en risiko som er knyttet til egenskaper i genene og som opptrer hos flere individer i samme familie. Arvelig kreft kjennetegnes ved opphopning av kreft i visse familier, men det kan også være andre årsaker til familiær forekomst av kreft, som felles miljøfaktorer og tilfeldigheter. Kreft er en hyppig sykdom. Tilfeldigheter kan derfor føre til at enkelte familier eller miljøer tilsynelatende kan bli hardt rammet uten at det ligger noen spesiell årsak til grunn for denne opphopningen.
Årsakene til kreft kan sammenfattes i tre hovedgrupper:
de endogene ( indre) faktorene: individets arv, anatomiske og fysiologiske karakteristika
atferdsfaktorene som individet kan kontrollere: tobakk, ernæring, alkohol o.l. Atferden vår er påvirket av sosiale og kulturelle faktorer.
de eksogene (ytre) faktorer: miljø og sosioøkonomiske forhold – som igjen er en funksjon av det samfunnet individet bor og arbeider i
3.1.2 Ondartet, godartet eller svulst med usikker utvikling
Selv om man kan gi en typisk beskrivelse av ondartet, godartet og svulst med usikker utvikling kan grensene mellom dem være uskarp og vanskelig å definere. Det er ikke vanskelig å forstå at det forekommer overgangsformer på bakgrunn av sykdommens trinnvise utvikling (se pkt. 3.1.1).
Kreftdiagnosen baseres på en mikroskopisk bedømmelse av vevet. Leukemiene diagnostiseres på tilsvarende måte ved å mikroskopere blod og/eller utstryk fra benmarg. Denne undersøkelsen viser om det er kreft, hvilken type kreft og om den er aggressiv eller en snillere form. Det er spesialister i patologi som foretar disse undersøkelsene. (For leukemiene er det hematologene 1 som foretar undersøkelsene.) Svaret baserer seg i stor grad på en subjektiv vurdering, men det utvikles stadig nye hjelpemidler som både bidrar til å kvalitetssikre diagnosen og gjør en i stand til å gi en mer detaljert subklassifisering av svulstene. Valg av behandlingsmetode vil være helt avhengig av diagnosen man kommer frem til.
Det som kjennetegner en ondartet sykdom er knyttet til en rekke avvik fra det normale i cellenes egenskaper. Celletilveksten styres ikke av de normale kontrollmekanismene, og veksten vil derfor være ukontrollert og ukoordinert i forhold til normalvevet svulsten går ut fra. Vekstformen karakteriseres av infiltrasjon, dvs. at cellene ikke respekterer grensene mellom de ulike vevsstrukturer. Kreftsvulsten vokser inn i naboorganer og vil etter hvert fortrenge og ødelegge det normale vevet. Ondartede celler kan også ha evne til spredning, dvs. at de kan vokse inn i blodårer, lymfeårer eller hulrom i kroppen og fraktes til et nytt sted, for så å fortsette å vokse. Dette kalles metastasering eller spredning. Spredning via lymfebanene er svært vanlig for brystkreft, tykktarmskreft og kreft i ØNH-regionen (øre-nese-hals-regionen). Spredning via blodet vil oftest gi opphav til nye dattersvulster i lunge, lever og/eller benmarg.
En godartet svulst karakteriseres også av celletilvekst som ikke er underlagt normal kontroll. Cellene i den godartede svulsten har ikke evne til å spre seg via blod eller lymfe. De vil også respektere vevsgrensene. De vokser ekspansivt og skyver det normale vevet til side (i motsetning til de ondartede svulstene som infiltrerer). Dersom man får fjernet hele svulsten, vil pasienten være helbredet.
Det finnes en lang rekke overgangsfaser og forstadier til kreft. Forstadier til kreft er lettest å oppdage i slimhinner og andre overflatestrukturer. Livmorhalsundersøkelsen (screening av underlivet) vil kunne oppdage disse forstadiene. Man kan unngå kreftutvikling ved at forstadiet behandles. Forstadiet karakteriseres med urolige celler som viser mange likhetstrekk med ondartede celler i sitt utseende, men de har ikke utviklet evne til infiltrasjon og spredning (ennå) (se pkt. 7.2).
Noen svulster har karakteristiske trekk fra både en ondartet og godartet tumor. Ofte kan det da være tilstrekkelig med en enklere form for behandling. Dette understreker betydningen av en nøyaktig karakteristikk av svulsten ( primærdiagnosen) før behandlingen fastlegges (se pkt. 3.1.3).
3.1.3 Klassifikasjon – behovet for et internasjonalt felles språk
Den medisinske kunnskap skal og bør være en felles global eiendom. Forutsetningen er at man har et felles språk, dvs. at man har en internasjonal felles begrepsoppfatning. Det er også forutsetningen for den vitenskapelige informasjonsutvekslingen. Språket er klassifikasjonssystemer, dvs. en felles norm for beskrivelse av diagnose, sykdomsutbredelse, resultater av undersøkelsene og en felles beskrivelse av resultatet av behandlingen, mv. Til daglig er klassifikasjonssystemene først og fremst et hjelpemiddel for å komme frem til riktig behandling. Ny kunnskap om svulstens biologiske egenskaper og innføring av ny behandling vil stadig endre forutsetningene for dette systemet. Klassifikasjonssystemene må derfor jevnlig oppdateres og justeres. Det er m.a.o. en kontinuerlig prosess, og det må omfatte mange separate fagområder og problemstillinger. Nye kommer stadig til.
Patologi (histologisk diagnostikk)
Verdens helseorganisasjon (WHO) har stått sentralt i å bygge opp et internasjonalt klassifikasjonssystem for histologisk diagnostikk (den mikroskopiske undersøkelsen av svulster). Det finnes mange varianter av f. eks. lungekreft. Lungekreft inndeles i grupper som igjen kan inndeles i diverse undergrupper. For å gi den beste behandlingen må man kjenne disse detaljene. Gjennom en slik klassifikasjon vil man være bedre i stand til å forutsi sykdommens naturlige utvikling, dvs. vekstform og spredningstendens, og dermed ha et bedre grunnlag for å velge den beste behandlingen. Det er den histologiske klassifikasjonen som er grunnlaget for kreftdiagnosen. Sammen med informasjon om sykdomsutbredelsen (se senere) er den utgangspunktet for valg av den medisinske behandlingen.
For de fleste diagnosegruppene har man oppnådd aksept for et internasjonalt klassifikasjonssystem, for andre eksisterer imidlertid både europeiske og amerikanske varianter. Det kan skape store problemer ved sammenlikning av behandlingsresultater på tvers av landegrensene. Man lykkes i å komme frem til felles systemer på stadig flere områder.
Sykdomsutbredelse – stadier
Initiativet til felles klassifikasjonssystem som beskriver sykdomsutbredelsen ble tatt for over 50 år siden og videreført av Verdens helseorganisasjon i 1950-årene 2 . UICC (Union Internationale Contre le Cancer) nedsatte en Committee on Tumour Nomenclature and Statistics, som lanserte det såkalte TNM-systemet. Det blir jevnlig revidert og tilpasset, slik at det skal være et godt og praktisk redskap i behandlingen.
T står for tumor og beskriver utbredelse av svulsten lokalt i moderorganet (som størrelsen og innvekst i andre organer).
N står for node, som i denne sammenheng betyr lymfeknute og beskriver eventuell spredning til lymfeknutene. Det er oftest av avgjørende betydning for valg av behandling å kartlegge hvilke og hvor mange lymfeknuter som eventuelt er angrepet av sykdommen.
M står for metastases (metastaser), som i denne sammenheng betyr spredning til fjerntliggende organer.
På bakgrunn av karakteristika for T + N + M kan svulsten inndeles i stadier, som regel på en skala fra 1 til 4. Stadium 1 betyr som regel at sykdommen er lokalisert og begrenset til ett sted, mens stadium 4 betyr fjernspredning eller spredning til andre nærliggende organer.
TNM-systemet er med andre ord et internasjonalt felles klassifikasjonssystem som gir en beskrivelse av svulstens lokale vekstforhold og utbredelse, regional sykdomsutbredelse og fjernspredning.
ICD – International Classification of Diseases
ICD er et internasjonalt sykdomskodeverk som beskriver hvilket organ svulsten har oppstått i. Kodesystemet består av flere siffer, hvorav de tre første angir selve organet, f.eks. leppe, tunge, spiserør, magesekk, livmorhals, etc. De øvrige sifrene beskriver ytterlige detaljer, som f.eks. overleppa, underleppa, munnviken, innsiden/utsiden av leppa, etc. Dette er detaljer som er viktige for de som skal behandle pasienten, mens det for andre formål kan være upraktisk å foreta en slik fininndeling. Både Kreftregisteret og Rikstrygdeverket anvender ICD-systemet i sine registre. Også ICD-kodene blir justert og endret. For tiden anvendes ICD–9, men man i ferd med å innføre ICD–10 i flere land.
3.2 Begreper og definisjoner i kreftbehandlingen
Et godt samspill mellom bruker, fagmiljø, administrasjon og politisk ledelse forutsetter en felles forståelse og aksept av sentrale begreper. For kreftomsorgen vil en felles forståelse av behandlingens målsetting eller behandlingens intensjon være avgjørende for gode helsepolitiske prioriteringer og administrative valg og at pasienten får formidlet korrekt informasjon.
M.a.o.: en må ha en felles forståelse av begrepene for å kunne sortere problemene.
3.2.1 Målsetting med behandlingen – behandlingsintensjon
Kurativ intensjon
Behandlingens målsetting må bygge på kjent virkning av de terapeutiske hjelpemidler på den aktuelle sykdom (diagnosegruppe, sykdommens utbredelse og biologiske egenskaper). Det primære ønsket vil naturligvis være å helbrede pasienten: dvs. ha en kurativ målsetting. Ved visse kreftsykdommer lykkes det i 90 % av tilfellene. For andre er mulighetene langt dårligere, f.eks. 50 % eller 30 %. I det siste tilfellet vil en lykkes i 3 av 10 tilfeller. Behandlingens målsetting vil like fullt være kurasjon ved behandlingsstart for hele gruppen, men det er bare for 30 % av pasientene at en oppnår et ønsket behandlingsresultat. For eksempel ved visse former for lymfekreft, vil ca. 30 % av pasientene være i live uten sykdom etter 5 år. I utgangspunktet vet man ikke hvem som blir helbredet. Den enkelte pasient starter behandlingen i håp om at han eller hun tilhører de 30 %. Behandlingens målsetting vil derfor være helbredelse.
Det er en nedre grense for hva som realistisk kan defineres som kurativ målsetting pga. usikkerhet knyttet til alle målemetoder. Det skyldes flere forhold. Den viktigste vil ofte være sykdommens naturlige forløp som kan variere svært mye. Et uventet gunstig forløp kan skyldes sykdommens naturlige forløp og behøver ikke være en effekt av behandlingen. Sammenlignende undersøkelser der statistiske målemetoder brukes, er en nødvendig forutsetning for å klargjøre en behandlingseffekt eller om en ny metode er bedre enn den etablerte behandlingen.
I en totalvurdering av hva som er en realistisk behandlingsintensjon, må også mulige komplikasjoner forbundet med behandlingen tas med. Ved intensiv cellegiftbehandling vil risikoen for komplikasjoner med dødelig utgang være reell. Ved høydose-cellegiftbehandling med stamcellestøtte kan den ramme opp mot 5–10 % av pasientene. Disse faktorer må selvsagt vektlegges i en totalvurdering.
Palliativ (lindrende) intensjon
Målsettingene ved lindrende behandling kan beskrives som:
symptomlindring
symptomforebygging
forlenget overlevelse
eller en kombinasjon av de ovennevnte faktorene
Det kan være vanskelig å fremskaffe god dokumentasjon over lindrende (palliativ) effekt. Det skyldes bl.a. at kurativ behandling blir prioritert i klinisk forskning. Dokumentasjonen av palliativ behandling må favne både en objektiv faktor og en subjektiv symptombeskrivelse fra pasienten. Livskvalitetsundersøkelser, som er et viktig måleinstrument for palliativ behandling, har først utviklet brukbare metoder de senere år. Effekten av en behandling med smertelindring som intensjon, må baseres på enkeltindividers subjektive opplevelser av smerter over tid (før og etter en behandling). Behandlingsintensjonen er da en bedring av pasientens smerteopplevelse.
De sanseinntrykk som ligger til grunn for sykdoms- og smerteopplevelsen vil imidlertid være meget sammensatte. Smerte lindring vil følgelig være avhengig av mange faktorer! Vi må akseptere at pasientene ofte beskriver sine symptomer og sykdomsopplevelser annerledes enn det vi (til nå) har fått uttrykt i vitenskapelige termer.
Målsettingen med palliativ behandling har altså to hovedelementer: det ene er knyttet til pasientens sykdomsopplevelse der og da (symptomene), det andre elementet ligger inn i fremtiden (forbygging av plagsomme symptomer og forlenget overlevelse)
3.2.1.1 Kunnskapsbasert medisin, kunnskapsbasert praksis
Kunnskap er ikke synonymt med erfaring. Kunnskapsbasert virksomhet kan defineres som systematisk akkumulert erfaring. Det er et begrep som altså ikke bare er knyttet til en person, men bygger på systematisk registrering av effekter av de ulike tiltak. Kunnskapsbasert virksomhet innebærer at vi med en viss grad av sannsynlighet kan forutsi effekten av behandling på gruppenivå. Ut fra dette kan en anta effekten på individnivå. Kunnskapsbasert praksis innebærer personlige ferdigheter og erfaring (se pkt. 6.6.2.2).
For valg av behandling må vi med andre ord kunne si noe om sannsynligheten for å oppnå effekter av behandlingen. I praktisk medisin må en ta hensyn til en rekke prognostiske faktorer før valg av behandling. Prognostiske faktorer er karakteristiske egenskaper eller særtrekk ved sykdommen eller pasienten som virker inn på sykdomsforløpet eller behandlingsresultatet.
Eksempler på prognostiske faktorer er svulstens størrelse, spredningsmønster og omfang, biologiske egenskaper som registreres ved ulike laboratorieteknikker, pasientens alder, andre sykdommer, etc. De prognostiske faktorer som finnes hos enkeltpasienten er avgjørende for valg av behandling. Det ligger ofte et møysommelig arbeid til grunn før man kan definere prognostiske faktorer.
3.2.1.2 Individ versus gruppe
Beskrivelse av enkelteksempler kalles kasuistikker. Det er ikke mulig å trekke allmenngyldige slutninger fra ett enkelt eksempel. At en røykende onkel lever i 90 år betyr ikke at røyking er sunt. Vi må samle erfaring fra en stor gruppe røykere og sammenligne med en tilsvarende gruppe ikke-røykere for å kunne trekke konklusjoner om eventuelle skadelige effekter.
På tilsvarende måte må vi møysommelig bygge opp kunnskap om ny behandling. Ved innføring av ny behandling kan det være stor risiko for seleksjon, dvs. utvelgelse av en gruppe enkeltindivider som ikke er representative for gruppen som helhet. For eksempel ved utprøving av et nytt medikament kan pasienter med gunstige prognostiske faktorer bli valgt ut. Behandlingsresultatet vil da ikke være representativt for den aktuelle pasientgruppen. Man risikerer å innføre et nytt behandlingsprinsipp på gale premisser hvis sammenligningsgrunnlaget er feil.
Målet er å bygge terapivalget på sannsynligheten for effekt. Sannsynligheten baseres på statistiske vurderinger der hensikten er å utelukke at effektene skyldes tilfeldigheter. Mange av fremskrittene i kreftbehandlingen har utviklet seg i små skritt. Kunnskapen bygges m.a.o. opp trinn for trinn (se pkt. 8.1.1).
3.2.2 Mål og målemetoder – behandlingseffekt/resultatmål
Resultatene av en behandling må defineres. Eksempler på slike definisjoner relatert til kreftbehandling er helbredelse, remisjon, palliasjon, overlevelse og overbehandling, se pkt. 3.2.2.1–3.2.2.5.
3.2.2.1 Helbredelse eller kurasjon
En filologisk oppfatning av begrepet helbredet må bety at sykdommen er fjernet eller at alle svulstcellene er døde. Det må i så fall også bety at det ikke er risiko for tilbakefall. I praksis er definisjonen mer komplisert. Dersom man kjenner alle relevante prognostiske faktorer, kan en beskrive sannsynligheten for helbredelse på gruppenivå, men det er bare tiden som kan avgjøre dette på individnivå. Den enkelte pasient må leve med en usikkerhet i et visst antall år før utfallet kan sies å være sikkert. Tiden varierer fra diagnosegruppe til diagnosegruppe. For noen diagnosegrupper er dette tre år, for andre fem år eller 20 år. Kriterier for helbredelse for den enkelte er knyttet til tid etter diagnosetidspunktet og i biologisk forstand vil det variere fra krefttype til krefttype.
For praktiske formål og i den generelle beskrivelse, f.eks. i Kreftregisterets rapporter, er helbredet/kurert definert som i live etter et bestemt antall år etter primærbehandling uten at det kan påvises tegn til den aktuelle kreftsykdommen. Ofte settes grensen til fem år. Ved noen kreftformer vil det fortsatt være risiko for tilbakefall også etter denne tiden. Ved enkelte meget hissige kreftformer vil et eventuelt tilbakefall manifestere seg innen ett år. Da vil en person som er sykdomsfri ett år etter avsluttet behandling kunne defineres som helbredet. Ved andre kreftsykdommer, som brystkreft, kan det komme tilbakefall mer enn 20 år etter primærbehandlingen (selv om det er meget sjelden).
Begrepet helbredelse (kurasjon) bør altså anvendes som et sannsynlighetsbegrep, dvs. sannsynligheten for å oppnå et gitt resultat for den enkelte kreftsykdom. Informasjonen til den enkelte pasient må med andre ord knyttes til sannsynlighetsbegrepet.
3.2.2.2 Remisjon
Remisjon betyr at svulsten er redusert i volum eller at symptomene fra sykdommen har avtatt. Begrepet graderes i komplett og partiell remisjon. Begrepet beskriver både subjektive symptomer og objektive tegn på sykdom, men har i utgangspunktet ikke noe med overlevelse å gjøre. Med andre ord er holdepunkter for tilbakegang i svulststørrelse eller bedring i symptomer ingen garanti for livsforlengelse eller helbredelse.
Komplett remisjon betyr at sykdommen ikke lar seg påvise med tradisjonelle diagnostiske metoder. Dette behøver ikke bety at pasienten er helbredet. Remisjon som begrep sier heller ikke noe om risiko for tilbakefall, men komplett remisjon etter en behandling er i praksis en forutsetning for helbredelse. Det er viktig å presisere at komplett remisjon ikke er synonymt med erklært frisk.
Partiell remisjon betyr en delvis tilbakegang av svulsten eller symptomene på sykdom. Det finnes klare internasjonalt aksepterte definisjoner (WHO) 3 for disse begrepene.
3.2.2.3 Palliasjon (lindring) – om livsforlengelse, symptomlindring og symptomforebygging
De såkalte overlevelseskurvene er en statistisk beskrivelse av utfallet av behandlingen der endepunktet er død. Det finnes mange fremstillingsformer. I prinsippet beskriver slike kurver oftest antallet i % som er i live av en gitt pasientpopulasjon (gruppe pasienter) i tiden etter (primær)behandlingen. Eksempel på slike overlevelseskurver gis på fig. 3.1.
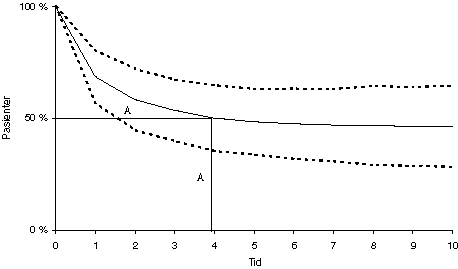
Figur 3.1 Overlevelseskurver
Fig 3.1 viser antall pasienter som er i live i tiden etter behandlingen. Tid fra behandlingsstart til 50 % er døde, kalles median overlevelse (merket med A). Eksempelet viser at kurven flater ut etter fem år. De som lever etter fem år kan defineres som helbredet i dette eksempelet. Den stiplede linjen angir usikkerheten knyttet til vurderingen (ofte kalt konfidensintervallet). Det beskriver kurvens statistiske usikkerhet. Det sanne resultatet vil ligge ett eller annet sted innenfor den stiplede linjen (se også pkt. 5.1).
Median overlevelse angir tiden fra behandlingsstart til 50 % av pasientene er døde. Det vil alltid være stor variasjon i tid mellom den første som dør og den siste som dør i en pasientpopulasjon. Det kan lett oppstå misforståelser hvis median-overlevelsen blir benyttet som informasjon om prognosen til den enkelte pasient.
For å prøve ut ny behandling må overlevelseskurven for gammel behandling sammenholdes mot en tilsvarende for ny behandling. For å bevise eventuelle forskjeller må et visst antall pasienter inngå i undersøkelsene, gruppene må i prinsippet være like (dvs. ha den samme fordeling av de prognostiske faktorene). En eventuell bedring av overlevelsen ved innføring av et annet behandlingsprinsipp kan oppgis som en forlengelse av median-overlevelsen eller som økning av 5-års overlevelse. Forskjellen mellom gammel og ny behandling må vurderes statistisk for å bedømme om forskjellen er reell eller om den er et resultat av tilfeldigheter. Det er tallrike eksempler på feilaktige konklusjoner fordi man baserer vurderingen på for få pasienter (for få pasienter gir stor usikkerhet, jfr. fig. 3.1).
Fig 3.2 illustrerer to forskjellige behandlingsresultater i forhold til standardbehandling A. Ved behandling C stabiliserer kurven seg ( flater ut) på et høyere nivå enn kurve A. Flere pasienter helbredes med behandling C. Ved behandling B stabiliseres kurven på samme nivå som kurve A, men resultatene viser en forlengelse av median overlevelse (se over). Det betyr at det samme antall blir helbredet, men pasientene lever gjennomsnittlig noe lenger før de dør. Hvis denne forskjellen er større enn tre måneder målt som median overlevelse, vil det ofte si at behandlingen er bedre enn den gamle, selv om man ikke helbreder flere pasienter. Dette er et svært vanlig resultat ved utprøving av nye cellegiftkurer. Det er utviklet spesielle statistiske metoder for å sammenligne slike kurver. Noen kaller dette en bananeffekt fordi de to kurvene (A og B i dette eksempelet) kan ligne på en banan.
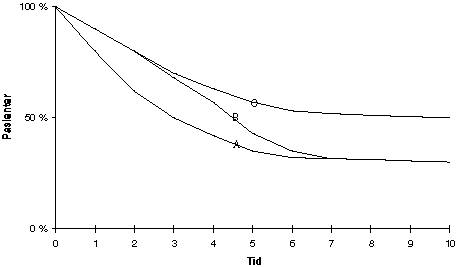
Figur 3.2 Behandling med regime A, B og C
Regime B viser en bananeffekt (se tekst) sammenliknet med regime A. Det er ingen forskjell i langtidsoverlevere, men en har oppnådd en viss livsforlengelse. Regime C illustrerer en økning i andelen langtidsoverlevere (flere er helbredet) i forhold til kurve A og B.
Symptomlindring
Symptomer som ofte ledsager kreft er smerter, kvalme, svimmelhet, angst, depresjon o.l. Symptomer som er subjektive opplevelser, er langt mer problematiske å omsette til målbare verdier og å tallfeste. Det er lettere med absolutte verdier som størrelsen på en svulst og tid fra f.eks. diagnosetidspunkt til død. I de senere år er det imidlertid utviklet ulike spørreskjema der pasienten skal angi sine symptomer langs en skala (f.eks. 1–6 eller 1–10). Alle som har vært kvalme, vet hva man snakker om, men det er meget vanskelig for en utenforstående å bedømme om kvalmen hos person X er sterkere eller svakere enn hos person Y. Det illustrerer igjen at vi må ha flere og mer systematiske registreringer for å kunne trekke slutninger om kvalmeregime A er mer virksomt enn kvalmeregime B. Tilsvarende utfordring gjelder for smerteopplevelse. Den subjektive smerteopplevelsen er meget sammensatt.
Det er pasientens egen opplevelse av smerte og den relative endring som følge av en behandling som er målet for symptomlindringen og som må danne basis for effektvurderingen. For å trekke slutninger som er overførbare til andre pasienter, kreves at smerteopplevelsen og bedringen av denne som følge av en behandling må omsettes i målbare verdier for å sammenligne smerteregimene.
Symptomforebygging
Svulster som vokser vil etter hvert fremkalle økende symptomer. Svært ofte kan vi forutse hvilke problemer som vil oppstå. Det kan være spredning av kreften til skjelettet. Symptomene kan i seg selv være bagatellmessige, men ubehandlet kan kreftsvulsten føre til svekkelse av en vektbærende knokkel og til brudd, dersom sykdommen ikke bringes under lokal kontroll. Lokal strålebehandling kan stoppe en lokal sykdomsprosess. En operasjon som stabiliserer (avstiver) en knokkel kan hindre senere brudd, og er m.a.o. en symptomforebyggende behandling.
Tilsvarende vet vi at en svulst som sitter i luftrøret, kan fremkalle alvorlig pustebesvær dersom sykdommens utvikling ikke stoppes. Svulster i luftveiene vokser ofte som innvendige polypper og kan etter hvert stenge for luftpassasjen. I disse tilfellene har vi kanskje ingen helbredende behandling å gi, men det kan være mulig å oppnå lokal sykdomskontroll helt eller delvis ved hjelp av lokalbehandling (strålebehandling og laserbehandling). Forebyggende symptomlindrende behandling tar sikte på å forhindre alvorlig pustebesvær, blødning, smerter, benbrudd, etc. Behandlingens målsetting er ikke nødvendigvis å forlenge livet (selv om det selvsagt er ønskelig hvis man har effektive metoder). Symptomforebyggende og symptomlindrende behandling behøver med andre ord ikke være mislykket selv om pasienten skulle dø relativt kort tid etter behandlingen. Det primære er at pasienten skal slippe å oppleve de mest smertefulle og ubehagelige symptomer.
Den palliative behandlingen kan være rettet mot svulstvevet (tumorrettet behandling) eller mot symptomopplevelsen. Strålebehandling og behandling med cellegift eller hormoner tar sikte på å påvirke selve grunnlidelsen eller kreftsykdommen, mens smertestillende medikamenter døyver smerteopplevelsen uten at den påvirker kreftsvulstens vekst. Det finnes en rekke eksempler på medikamenter som lindrer subjektive symptomer uten å influere på sykdomsforløpet. Et slikt eksempel er trykkavlastende medikamenter ved hjernesvulster. Økt hjernetrykk kan gi smerter, kvalme, lammelser, taleforstyrrelser, etc. Trykkavlastende medikamenter kan lindre disse symptomene for en viss tid, men de har ingen effekt på svulstens veksthastighet.
Valg av behandlingsstrategi kan være svært vanskelig. Skal man dempe symptomene eller forsøke å gi en behandling som reduserer årsaken til symptomene? For eksempel kan smerter som skyldes spredning til skjelettet enten lindres ved hjelp av smertedempende medikamenter eller ved strålebehandling. Sykdommens prognose vil være et viktig moment i valg av strategi, i tillegg til mulig effekt av den aktuelle behandlingen. Det sentrale er at man gjennom hele sykdomsprosessen må ha en definert målsetting for den palliative behandlingen. Valg av behandlingsalternativer kan sammenfattes i det som vi har definert som kunnskapsbasert praksis. (Kunnskap om tiltakenes effekt som skal tilpasses pasientens behov og ønsker.)
3.2.2.4 Overlevelse i kreftbehandlingen – noen vanlige begreper
Overlevelse (engelsk: survival) angis på tre ulike måter:
Observert ( crude) overlevelse er hvor stor del av pasientene som lever etter f.eks. fem år uavhengig av dødsårsak.
Forventet ( expected) overlevelse er overlevelsen i en befolkningsgruppe tilsvarende sammensatt som pasientgruppen mht. alder, kjønn og fødselsår, men uten den aktuelle sykdom.
Relativ ( corrected) overlevelse er forholdet mellom observert og forventet overlevelse for den aktuelle pasientgruppen. Begrepet belyser overlevelsen blant de som har en gitt sykdom, dvs. den delen av pasientene som ville vært i live etter f.eks. fem år hvis død av kreftsykdommen var den eneste dødsårsaken. Relativ overlevelse uttrykker derfor det samme som letalitet, case fatality. Kreftregisteret angir som regel overlevelse som relativ (årsaksspesifikk).
Mortalitet angir antall døde i en befolkning i løpet av en periode, f.eks. antall døde per 1000 personer i løpet av ett år. Angis bare dødsfall av en spesiell årsak, kalles det årsaksspesifikk mortalitet. Mortaliteten gis ofte for undergrupper av befolkningen mht. kjønn, alder, bosted etc.
Letalitet ( case fatality) uttrykker i hvor stor grad en sykdom fører til død. (Her inngår de som har fått sykdommen i nevneren. Dette i motsetning til mortalitet, hvor både syke og friske inngår i nevneren.) Letalitet er følgelig forholdet mellom antall døde av en bestemt sykdom i en bestemt periode og antall tilfeller diagnostisert av sykdommen i samme tidsrom. Begrepet anvendes relativt lite innen kreft.
Evaluering av overlevelse inneholder mange fallgruber, og det er viktig å være klar over dette når bl.a. lovende resultater presenteres: Tidlig-diagnose av en sykdom behøver ikke nødvendigvis å bedre leveutsiktene. Kanskje er det slik at vi oppnår å få kunnskap om sykdommen på et tidligere tidspunkt, slik at overlevelsen bare tilsynelatende forlenges. Dette kalles på engelsk lead time bias, og slike fenomener kan bare avsløres ved studier av store befolkningsgrupper.
Med statistisk signifikans menes at resultatet sannsynligvis ikke skyldes tilfeldigheter. (Forbeholdet i definisjonen er meget viktig å understreke: viktige avgjørelser kan ikke bygge på én undersøkelse som viser et statistisk signifikant resultat, men to påfølgende undersøkelser som har vist ... (se pkt. 8.1).
3.2.2.5 Overbehandling
Pasienter, og især pårørende til alvorlig syke kreftpasienter, sitter nok iblant med følelsen av at pasienten er blitt overbehandlet. En nærliggende forståelse av begrepet overbehandling kan være en behandling som pasienten ikke har nytte av. Vi kjenner alle eksempler på omfattende behandlingsopplegg som tilsynelatende har vært mislykket sett fra den enkelte pasients ståsted. De får en behandling som ikke gir den ønskede effekt, men snarere forverrer situasjonen på grunn av plagsomme bivirkninger. For den enkelte pasient har forgjeves behandling to sider:
Den ene er knyttet til intensjonsbegrepet (se pkt. 3.2.1). Intensjonen knyttes til muligheten for å oppnå effekt. Dersom muligheten for kurativ effekt er 10 %, vil bare én av ti oppnå behandlingens primære målsetting. De ni andre vil ikke oppnå resultatene som var intensjonen med behandlingen. Det kan tenkes at behandlingen har gitt andre positive aspekter (forlenget levetid eller symptomlindring), men for noen vil innsatsen fortone seg som mislykket. Det er et tankekors at taperne i verste fall bare oppnår ubehagelige bivirkninger. Vi vil ikke karakterisere et behandlingsopplegg som følger oppsatte kriterier og som har en definert målsetting som overbehandling, selv om vi vet at ikke alle oppnår den medisinske målsetting. Det blir en kalkulert risiko for å prøve den metoden som gir den største muligheten for å oppnå et bestemt mål. Et av medisinens store satsingsområder er å bedre seleksjonskriteriene for behandling. Det betyr å velge ut de pasienter som vil ha nytte av en gitt behandling, f.eks. hvilke brystkreftpasienter som har nytte av cellegiftbehandling etter operasjonen.
Det andre er tumorrettet behandling som gis uten dokumentasjon for effekt. Det må defineres som overbehandling både på gruppe- og individnivå. Det kan illustreres med cellegiftbehandling til pasienter med langtkommen kreft. Dersom behandlingen gis uten belegg for at hensikten kan innfris (dokumentert effekt), må det defineres som overbehandling. Motivet kan i utgangspunktet være å imøtekomme pasientens vilje (ønsker og håp). Det er ikke god praksis å anvende halmstrået som indikasjonsstilling for behandling. I lengden er ikke pasienten tjent med denne formen for trøst. Samfunnet kan heller ikke i en situasjon med begrensede ressurser prioritere behandling uten nytteeffekt.
Denne problemstillingen må ikke forveksles med en symptomorientert palliasjon. Her er effekten av den lindrende behandlingen ikke knyttet til svulstens vekst generelt. Slik behandling dreier seg om smertestillende, væsketilførsel, kvalmestillende, strålebehandling av spredning og avlastende kirurgiske inngrep. I denne situasjonen er grensen mellom behandling og overbehandling langt mindre skarp. Det lar seg ikke gjøre å gi faste normer. God klinisk praksis må baseres på skjønn og erfaring med utgangspunkt i pasientens situasjon. Her ligger utfordringen i en samhandling mellom 1.- og 2.-linjetjenesten. Erfaringsgrunnlaget, undersøkelsesmetodene og kompetansen er i første rekke knyttet til sykehusmedisinen, men den medisinske vurderingen og iverksettingen av tiltak er og bør være knyttet til primærhelsetjenesten (se pkt. 8.2).
3.2.3 Omsorg
Det er ikke alltid like klart hva som legges i omsorgsbegrepet. Det inngår ofte som det siste begrep i handlingskjeden: diagnostikk, behandling, pleie og omsorg. Begrepet benyttes også som en samlebetegnelse for alle medisinske funksjoner som er knyttet til en diagnosegruppe, f.eks. kreftomsorg4 , diabetesomsorg, eldreomsorg, etc. Vi velger følgende definisjon av begrepet:
Omsorg er i seg selv ingen helsetjeneste fordi den ikke kan sees som en selvstendig handling. Den beskriver heller formen helsetjenesten formidles på. Den utgjør kjernen i verdigrunnlaget og skal derfor være en felles basis for all behandling og pleie og all kontakt mellom helsearbeidere og pasienter og pårørende. Omsorg er et naturlig element i kvalitetssikringen av helsetjenesten. Alle profesjoner i helsetjenesten har både eiendomsrett og forpliktelser overfor omsorgsbegrepet.
God omsorg er ikke bare erfaringsbasert. God omsorg krever også kunnskap. Den kan og må læres, bl.a. fordi kommunikasjon er et viktig element i formidling av god omsorg. God omsorg er knyttet til pasientenes og de pårørendes opplevelser. Helsepersonellets håndtering av pasientens og de pårørendes opplevelser er kunnskapsbasert og berettiger både forskning og planmessig kunnskapsformidling til helsearbeidere. (Se også definisjon av kommunikasjon som er en helsetjeneste, både med og uten ord ( pkt. 3.2.4).)
3.2.4 Informasjon – kommunikasjon
Informasjon er en kontinuerlig prosess gjennom hele sykdomsperioden. Hensikten er å formidle og forklare de medisinske funn og mulige konsekvenser på en slik måte at de blir forstått og akseptert i den grad pasienten ønsker denne informasjonen. Så langt det er praktisk mulig må pasienten selv kunne bestemme tempoet i informasjonen. Med dagens meget knappe tilmålte tider i sykehus og på poliklinikker ligger ikke forholdene til rette for at rimelige kvalitetskrav skal kunne oppfylles.
Kommunikasjon representerer dialogen der pasienten er premissgiver. Informasjonen bør gis i en kommunikasjonsform, dvs. at helsearbeideren må registrere tilbakemeldinger og kontinuerlig justere sin informasjon etter premisser som gis av mottager.
Kommunikasjon kan gis i form av ord, men kommunikasjon kan også være tilstedeværelse og nærhet uten ord. Dette er en del av helsetjenesten, da det oppfyller et av pasientens behov. Også nærhet kan formidles med god eller mindre god omsorg.
Informasjon (som en kontinuerlig prosess) er den delen av helsetjenesten som eventuelt blir mest skadelidende ved innføring av stykkprisfinansiering.
En undersøkelse av Den Norske Kreftforenings Ungdomsgruppe viste at 13 % av pasientene fikk informasjon om at de var rammet av kreft pr. telefon. Generelt kan det ikke aksepteres at pasienter med alvorlig sykdom meddeles dette på denne måten (selv om det av og til kan være den eneste praktiske muligheten). I den samme undersøkelsen anga 42 % at de fikk for liten informasjon om sin diagnose. Vi vil anta at ungdom ikke blir underprioritert mht. informasjon sammenlignet med eldre pasientgrupper.
Pasientens og helsevesenets sykdomsoppfatning. Stemmer de overens?
Helsevesenets sykdomsforståelse er knyttet til data som kvantifiserer avvik i blodprøver, beskriver avvik i cellenes vekstform basert på mikroskopiske undersøkelser og at man er i stand til å følge sykdomsutviklingen ved røntgenundersøkelser. Pr. definisjon sitter helsevesenet med et fasitsvar og har en form for eiendomsrett over diagnosen.
Pasientens sykdomsfølelse og sykdomsoppfatning er ikke nødvendigvis i samsvar med dette fasitsvar. Symptomene (eller lidelsen) er helt og holdent pasientens eiendom. Man kan ha en diagnose uten symptomer (lidelse), men også symptomer (lidelse) uten diagnose. Diagnose og symptomer kan være sammenfallende, men er det ofte ikke.
Kommunikasjonen og dialogen er møteplassen mellom disse to virkelighetsoppfatningene. Antropologien kan bidra til at helsevesenet bedre forstår pasientens virkelighetsoppfatning. (Antropologens oppgave er å gripe fatt i begge parters virkelighetsoppfatning, men i dette tilfellet skal den ene part tjene den andre). Man må søke å forstå hva som skjer når to ulike virkelighetsoppfatninger møtes i en konkret situasjon (den medisinske behandlingsfasen). Dimensjonene er makt og avmakt, hvem eier sannheten og dermed premissene for handlingen?
3.2.5 Velferd, levekår og livskvalitet
Velferd er et overordnet begrep for en rekke dimensjoner som beskriver menneskets velbefinnende. Under denne svært uklare paraplyen har det vokst frem flere ulike forskningstradisjoner. To av disse er levekår og livskvalitet.
Levekår
Selve levekårsbegrepet henspiller på vilkår, dvs. tilgang til ressurser, slik som individenes fysiske og psykiske ressurser, kunnskaper, sosiale relasjoner, sysselsetting, økonomi, boforhold o.l. Det beskriver hvilke muligheter man har til å oppnå en gitt levestandard. Om man faktisk ønsker å bruke ressursene slik at velferden øker er opp til det enkelte individ. I tillegg til ressurser har levekårsforskningen også vært opptatt av i hvilken grad behovene blir tilfredsstilt og individets adgang til ulike arenaer, som jobb, skole og utdanning, etc.
Adgang til ulike arenaer er et viktig supplement til ressursperspektivet. Utdanning er f.eks. ikke et velferdsgode dersom man ikke får arbeid i forhold til sine kvalifikasjoner. Slik sett blir adgangen til et adekvat arbeidsmarked ( arbeidsarena) en viktig forutsetning for at utdanning skal fungere som en velferdsressurs. Dette er særlig aktuelt for unge pasienter som er rammet av kreft og som ennå ikke er etablert i et permanent arbeidsforhold. Vi har ingen oversikt over kreftpasientenes adgang til arbeidslivet, men vi har et bestemt inntrykk av at alvorlig sykdom ikke fremmer ens kandidatur. For arbeidsgiveren representerer det både et usikkerhetsmoment og en potensiell utgiftspost gjennom sykelønnsordningen (jfr. pkt. 5.2, 8.10 og 8.11 vedrørende å kartlegge spesielt de unge kreftpasientenes levekår med utgangspunkt i Rikstrygdeverkets og Kreftregisterets databaser).
Livskvalitet
Mens levekår utelukkende inngår i en samfunnsvitenskapelig tradisjon, er livskvalitet et tema både for samfunnsvitenskapelig og medisinsk forskning. Disse to tradisjonene har ulik tilnærming til livskvalitetsproblematikken. Den samfunnsvitenskapelige tilnærmingen ble utviklet som en reaksjon på åpenbare svakheter i levekårsforskningen, som er for materielt orientert og forbruksfiksert. I stedet fokuserer denne tradisjonen på individenes subjektive opplevelse av sin egen velferd og – til en viss grad – relasjonen mellom objektive livsvilkår, livstilfredsstillelse og psykisk velbefinnende.
Den helserelaterte livskvalitetstradisjonen er mer opptatt av pasienters livskvalitet, og har utviklet både subjektive og objektive mål på denne. Det vil si pasientenes subjektive og objektive opplevelser av sitt eget liv. (Levekårsforskningen bruker ofte fravær av sykdom som indikator på gode levekår.)
Siden utgangspunktet ofte er alvorlig syke menneskers livskvalitet, vil detaljeringsgraden med hensyn til livskvalitetsindikatorer være svært høy. I litteraturen er det utviklet egne livskvalitetsindikatorer for spesifikke sykdommer, som f.eks. ulike kreftformer, Parkinsons sykdom, astma, psykiatrisk sykdom, hudsykdommer, etc. Denne detaljeringsgraden skyldes ikke bare at sykdommene er forskjellige, men også at behandlingen varierer. Ofte er det like viktig å redusere belastninger av behandling som det er å redusere belastninger av selve sykdommen.
3.2.6 Behandlingsopplegg
3.2.6.1 Standardbehandling eller etablert behandling
Med standardbehandling eller etablert behandling mener vi den behandling som norske pasienter gis (bør gis, har krav på) og som har vist seg å være effektiv. Den må bygge på resultater fra vitenskapelige undersøkelser. Den etablerte behandling 5 kan nedfelles i handlingsprogrammer, guidelines eller vårdprogrammer (svensk). De er utarbeidet for å oppnå optimal behandlingseffekt med riktig ressursbruk. For kreftbehandling vil de ofte være spesifisert mht. til sykdommens histologiske (mikroskopiske) bilde, stadium (utbredelse), evt. pasientens alder og en rekke andre faktorer. Handlingsprogrammer innebærer ingen juridisk forpliktelse til å følge programmet, men de er ment som veiledende og relativt faste føringer for valg av terapi. Det finnes mange felles handlingsprogrammer i Norge, mange er utformet i nordisk samarbeid. Slike programmer må danne basis i et regionalt og nasjonalt samarbeid. Svært mange av behandlingsoppleggene for kreft krysser forvaltningsnivåene.
3.2.6.2 Utprøving i kreftbehandlingen – om kliniske forsøk og klinisk skjønn
Utprøving av ny behandling er inndelt i flere faser. Denne inndelingen har en fast struktur for medikamentell utprøving og følges alltid ved utprøving av nye behandlingsprinsipp, f.eks. cellegifter. I prinsippet skal utprøving av all ny teknologi følge den samme planen.
Fase I
På basis av dyreeksperimenter skal fase I kartlegge farmakologi og toksiske toleransegrenser ved ulike doseringsformer og doseintervaller. Man skal ikke primært kartlegge effekten av medikamentene på sykdommen, men prøve ut riktig dose for bruk i human medisin.
Fase II
På grunnlag av doseringsprogrammer fra fase I-undersøkelsene, skal effekten på ulike tumorgrupper kartlegges. Med effekt menes her oftest remisjon (se pkt. 3.2.2.2) eller reduksjon av svulstens størrelse. Den primære vitenskapelige målsettingen er å kartlegge hvilke diagnosegrupper som eventuelt kan være aktuelle for videre undersøkelser. Registrering av overlevelse på individnivå er av stor interesse, men dette vil som regel ikke være avgjørende for å føre medikamentet videre i utprøvingsprosessen. Det er etablert et europeisk nettverk for utprøving av nye medikamenter i fase II.
Fase III
Medikamenter som er funnet interessante for videre vurdering i fase II blir testet mot etablert behandling ved å sammenligne effekten på to like pasientgrupper. (Randomisering eller loddtrekning gjennomføres for å sikre at gruppene som sammenlignes blir så like som mulig.) Viktige effektmål for fase-III-studier er overlevelse, bivirkninger og livskvalitet. Kostnadsanalyser (kost-nytte-vurderinger) blir også mer vanlige.
Fase IV
Innføring av ny rutinebehandling er av noen kalt fase IV.
Pilotstudier innebærer at nye behandlingsprinsipp utprøves på et fåtall pasienter.
Alle kliniske forsøk skal godkjennes av den regionale etiske komité (REK), en uavhengig ekspertgruppe som skal gå igjennom forsøksprotokollene og godkjenne disse. Dersom medikamenter inngår i forsøket, skal disse godkjennes av Statens legemiddelkontroll (SLK). Pasienten skal gi skriftlig samtykke og har anledning til å trekke seg fra utprøvingen når som helst. Det er forbudt å drive klinisk utprøving uten at pasienten er informert og har gitt sitt samtykke.
Begrepet lovende behandling har ingen entydig betydning og er egnet til å skape misforståelser. Begrepet brukes i den offentlige debatt om enkelte behandlingsopplegg som fortsatt er under utprøving. Dersom en behandling er lovende, må det bety at den sannsynligvis er bedre enn den eksisterende. Da vil det være vanskelig eller galt å utsette innføringen av en slik behandling. Vi har inntrykk av at lovende behandling blir brukt der innledende undersøkelser har vist effekt, men før det er mulig å trekke noen slutninger om den er bedre enn det eksisterende behandlingstilbudet. Det er meget strenge etiske regler for kliniske forsøk. Derfor må man også velge ord og uttrykk med omhu, slik at pasientenes oppfatning av forsøket og hva de gir sin aksept til blir mest mulig i samsvar med realitetene. Begrepene utprøvende, avklarende, eksperimentell er mer dekkende før vi vet om det ene er bedre enn det andre. Begrepet lovende behandling bør derfor utgå.
Klinisk skjønn
I den daglige rutine og i møter med enkeltpasienter må vi ofte bruke vårt kliniske skjønn. Man har ingen standardprosedyrer for alle situasjoner. Handlingen er da basert på akkumulert erfaring fra lignende eller sammenlignbare tilfeller. Vi har lagt vekt på den kunnskapsbaserte behandling. Det betyr at vi vet (og har protokollert) hvordan vi skal behandle blodpropp, hjertesvikt, kvalme, smerter, depresjoner, etc. Pasientens problemer består imidlertid sjelden av rene diagnoser. Svært ofte er symptomene komplekst sammensatt og pasienten kan ha sterke ønsker som vi må ta hensyn til. For enkelte unge kreftpasienter vil det være av så stor betydning å bevare forplantningsevnen at de heller velger et behandlingsregime som er litt mindre sikkert enn standard behandling dersom muligheten for å få barn øker. I slike tilfeller må vi bruke vårt kliniske skjønn når vi gir råd.
Lang innarbeidet praksis og erfaring må i mange tilfeller aksepteres, selv om det ikke foreligger formell vitenskapelig dokumentasjon. Det kliniske skjønn og erfaringsoverføring anvendes på individnivå fordi det kliniske bildet av en pasient kan kreve en individuell vurdering og avvik fra den protokollerte prosedyre under visse omstendigheter. Det kliniske skjønn knyttes til individuell håndtering på basis av den kunnskap som er grunnlaget for den gruppebaserte protokollerte behandling. Det kliniske skjønn og erfaring er av spesielt stor verdi når det gjelder behov for akutt palliativ behandling, f.eks. operasjoner.
3.2.7 Om helhetlig og alternativ behandling
Uttrykket helhetlig behandling blir av noen brukt for å markere en viss misnøye med et somatisk behandlingstilbud der en mener at pasientens interesser i en videre forstand ikke blir ivaretatt. Begrepet er i seg selv upresist og dårlig definert. Budskapet man forsøker å formidle, kan likevel være svært betydningsfullt.
Helseprofesjonene legger vekt på å bedre behandlingstilbudet for dermed å bedre behandlingsresultatet. Behandlingens effektmål blir som regel definert ut fra tradisjonelle somatisk-medisinske kriterier som overlevelse, symptomlindring og symptomforebyggelse. Sykdommen kreft bunner i en fysiologisk prosess der symptomatologi og det medisinsk forløp av sykdommen gir patofysiologiske utslag. Den somatisk-medisinske behandling rettes mot disse prosessene.
En livstruende sykdom innvirker direkte og indirekte på pasientens psykiske tilstand, arbeidsevne, økonomiske forhold, familiære og sosiale forhold. Ringvirkningene er avhengige av flere faktorer, som ikke nødvendigvis behøver å være knyttet direkte til selve sykdommen, men som likevel blir en del av det totale sykdomsbildet. Helhetlig behandling må derfor oppfattes som noe som omfatter medisinsk behandling, pasientens sosiale forhold og økonomi, psykiske støtte og behandling, mestring og familierettet støtte og evt. terapi. Ernæring er også en viktig del av dette. Behandling som innvirker på pasientens psykiske helse lanseres også som elementer for å oppnå en somatisk effekt på sykdomsforløpet av kreftsykdommen.
Helhetlig kan ut fra denne tenkning inndeles i tre elementer. det somatisk medisinske, det som omfattes av levekår, som også inkluderer familiens infrastruktur, og det psykososiale, som også inkluderer de eksistensielle spørsmål.
At disse forhold er viktige elementer i behandlingen, er alle enige om. Hvem som skal ivareta de enkelte elementer og hvordan de skal ivaretas er gjenstand for uenighet. Det er urealistisk at helsevesenet skal påta seg rollen som forvalter av den totale helhet for alle pasientene. Det er heller ikke ønskelig. De fleste vil antagelig foretrekke å finne frem til løsninger og del-løsninger på egen hånd, eventuelt med hjelp fra den nærmeste familie og det nære støtteapparat (se pkt. 6.6). For pasientene er det viktig at de blir ivaretatt, eventuelt med hjelp fra helsevesenet i den grad de ikke er i stand til å klare dette selv. Helsevesenet må ha en form for diagnostisk sikkerhetsnett som fanger opp problemstillinger pasienten selv ikke er i stand til å løse. Hvis behovet melder seg, ønsker nok pasienten at hjelpen blir avstemt i forhold til behandlingsopplegget og at en ikke må gå fra instans til instans for å sette sammen elementene selv. I denne forbindelse kan det bemerkes at finansieringssystemene normalt ikke fanger opp denne problemstillingen. Effektivisering er knyttet – ofte ensidig – til de somatiske prosedyrene (jfr. pkt. 6.1 og 8.12.2 – den horisontale akse).
Alle enkeltelementer av det helhetlige som er skissert ovenfor, har en basis i norsk medisin og har et profesjonelt oppbygget apparat som er tiltenkt ansvaret for å formidle disse tjenestene. For å kunne tilby en helhet på en profesjonell måte, må tjenesten være kunnskapsbasert, men det forutsetter også empati. Hvis enkeltelementene blir for kompliserte, som f.eks. en dyp depresjon, må de – om nødvendig – bli tatt hånd om av egnede fagfolk som f.eks. et psykiatrisk team. Dette er bakgrunnen for det tverrfaglige behandlingstilbud som i varierende grad er tilgjengelig. Det må medgis at kontakten mellom de ulike profesjoner fungerer i varierende grad. Den viktigste grunnen til manglende samarbeid bunner nok i kapasitetsmangel.
Forståelse av helhetlig er i denne sammenheng begrenset til helsetjenestens ytelser og begrenses derfor til en naturvitenskapelig forståelse. I det offentlige helsevesen omfatter det samfunnsmedisin, trygderegler, det psykososiale og det som tradisjonelt ofte kalles pleie og omsorg. Mange pasienter vil oppfatte dette som en avgrensning av helhetsbegrepet. Man vil inkludere den private sektor og den folkelige sektor i helhetsbegrepet. Den private sektor består i egenomsorg, familiens og det sosiale nettverks behandlingserfaringer. Sykdom og symptomer diskuteres av familie og venner, og behandlingsalternativer blir vurdert. Den folkelige sektor inkluderer behandlingstilbud som har andre røtter enn det offentlige helsevesen (se pkt. 6.6). I pasientens øyne vil derfor helhetlig innebære valgmuligheter mellom disse tre hovedområdene (det offisielle, det private og det folkelige). Man kan forstå at det kan være vanskelig å bryte en århundrelang tradisjon i samfunn der folkemedisinen står sterkt (f.eks. i Østen). Den alternative behandling i Norge, derimot, har hatt ulike trender i årenes løp, og et gjennomløpende fast regime har ikke vært så fremtredende.
Alternativ behandling
Alternativ medisin er ikke et entydig begrep. Det er ikke riktig å skille den tradisjonelle skolemedisinen fra alternativ medisin. I praksis finnes det en stor gråsone. Det er heller ikke riktig å fremstille det som på folkemunne betegnes som alternativ medisin som én skole. I virkeligheten dreier det seg om en rekke avskygninger, fra ren sjarlataneri til grupper som viderefører den tradisjonelle folkemedisin og naturmedisin. Mange har gode etiske motiv for sitt engasjement. Noen ønsker å bidra med reelle alternativ til den vitenskapsbaserte medisin. I Norge rammes behandling av kreft og visse andre sykdommer av kvakksalverloven. En stor gruppe (antagelig de fleste) ønsker å fremstille sin virksomhet som et supplement til den tradisjonelle behandlingen og søker aksept for sin virksomhet innen de offisielle rammer. Argumenter for og mot kan ha en polemisk undertone som det naturlige mot det kunstige, anvendelse av giftige medikamenter som bryter ned kroppens immunforsvar o.l. Man møter den samme argumentasjon i alle vestlige land.
I angloamerikanske vitenskapelige miljøer brukes ofte begrepet unproven methods. I Norge vil betegnelsen udokumentert behandling være en beskrivende oversettelse. Striden mellom de to leirer står først og fremst mellom krav til dokumentasjon og vektlegging av det helhetlige. Man fremholder at den naturvitenskapelige metode ikke lar seg tilpasse de alternative metodene. De er i sin natur individtilpasset, dvs. at de ikke lar seg inndele i grupper, og derfor tilfredsstiller de ikke de basale kravene for vitenskapelig bevisførsel. Observasjon av enkeltindivider som grunnlag for bevis har medisinen forlatt fordi en enkelt hendelse ikke kan generaliseres. En ny behandlingsmetode kan ikke innføres som standardmetode basert på en håndfull observasjoner. Det biologiske mangfoldet tillater ikke generalisering fra én til alle.
Det må være mulig å definere et allmenngyldig krav: I pasientbehandling må en kunne definere og presisere hva man vil oppnå med tiltakene. Det bør da også være et rimelig krav å vite i hvilken grad behandlingen kan innfri dette (i dette kapitelet er det beskrevet som behandlingsintensjon). At en person som er i en desperat situasjon kan akseptere argumenter som for sikkerhets skyld og kan ikke skade, fritar ikke utøveren fra et ansvar for å angi sannsynligheten for hvilken nytte pasienten kan få av behandlingen.
Folkemedisin defineres som en samling av praksisformer, remedier og hjelperåd som danner et omfattende og usystematisert knippe av kunnskap i befolkningen som ofte er en integrert del av kulturen 6 .
3.2.7.1 Håpet som ressurs og som problem
Håpet er ønsket om en positiv utvikling for fremtiden og oppfattes av mange som en viktig drivkraft for å holde livsmotet oppe. Det er et sentralt begrep både for kreftpasienten og for familien. For mange har håpet også en religiøs-eksistensiell dimensjon.
Et håp er ikke en målbar størrelse, men en individuell opplevelse. For de fleste (alle?) er det knyttet til selvoppholdelsesdriften og et viktig element i en global livskvalitetsoppfatning. Motstykket til håp må i denne sammenheng være frykt og usikkerhet for fremtiden.
Et realistisk håp – helsevesenets oppfatning
Et realistisk håp for kreftpasienter må være knyttet til behandlingsindikasjonen. Dette tar utgangspunkt i hvilke effekter som kan oppnås gjennom behandlingen eller som følge av den naturlige sykdomsutviklingen (intensjonsbegrepet er omtalt i pkt. 3.2.1). Dersom en aksepterer en slik definisjon vil behandler få en form for råderett over pasientens håp. Behandler vil definere håpet ut fra en statistisk mulighet for en gitt positiv effekt av en behandling. Det er denne statistiske mulighet som er basis for den kunnskapsbaserte medisinens intensjonsbegrep. Et håp kan derfor være realistisk selv om det statistisk sett er meget små muligheter for at det blir innfridd.
Pasientens rett til å definere håp
Pasienter og pårørende gir ofte uttrykk for et håp som etter behandlers mening er urealistisk. Det kan bero på manglende informasjon eller feiltolkning av informasjon. Det kan også være pasientens blokkering eller fortrengning. I disse situasjoner må det stilles meget store krav til kommunikasjonen og informasjonen til pasienten. Pasienten må ha rett til å ha og beholde et annet utgangspunkt for sitt håp enn det som behandler til en hver tid måtte definere som realistisk. Pasienten må ha lov til å håpe på at ekspertene tar feil, at de biologiske prosesser kan forløpe annerledes enn det de statistiske metoder har fanget opp, eller pasienten har et eksistensielt fundert håp. Pasienten må altså ha rett til selv å definere premissene for sitt håp.
Denne situasjonen, som er en del av den daglige rutine, stiller helsepersonell overfor en stor utfordring. Kommunikasjon gis nå økende plass i undervisning av medisinerstudenter. Dagens helsepersonell bygger for en stor del på egen erfaring og menneskekunnskap. Det er ikke alltid godt nok. Det er igangsatt kommunikasjonskurs for etablert helsepersonell. Disse bør prioriteres.
Håp som behandlingsindikasjon
Helsetjenesten må basere seg på normer. Etter vår mening kan en ikke gi en behandling som ikke forventes å gi effekt i den hensikt å vedlikeholde et håp. Dersom man likevel gir behandling på disse indikasjoner, må det karakteriseres som overbehandling selv om det begrunnes med pasientens ønske. Vi velger å kalle dette udokumentert behandling selv om det gis innen den etablerte offentlige virksomhets rammer. En rekke eksempler fra den offentlige debatt om behandling i utlandet synes begrunnet med å gi pasienten et håp. Motivene er gode, men vi finner det like fullt galt å gi en behandling der erfaringsgrunnlaget for effekt mangler. I denne diskusjonen må en ikke forveksle etablert behandling med klinisk forskning (se pkt. 8.6 og 8.9.2).
Fotnoter
Hematolog (= spesialist i blodsykdommer), en indremedisinsk grenspesialitet.
WHO Technical Report Series, No 53, July 1952.
Fra Miller A.B., Cancer 1981.
Begrepet kreftomsorg anvendes ofte som det samlede behandlingstilbud. Dette er godt innarbeidet og blir derfor også benyttet i denne utredningen. Vi oppfatter dette som en praktisk måte å beskrive kreftrelatert forebygging, diagnostikk, behandling, pleie, kontroller, rehabilitering, etc.
Statens helsetilsyn Utredningsserie 2/96. Det er forslått noen generelle retningslinjer for å endre den etablerte behandlingen. Behandlingen er vist å være bedre enn tidligere etablert behandling i minst to randomiserte kliniske utprøvinger som tilfredsstiller konvensjonelle statistiske krav til bl.a. representativitet i utvalget av pasienter, signifikansnivå og teststyrke. Det bør ikke samtidig foreligge slike undersøkelser med motsatt konklusjon.
Den norske lægeforening, Alternativ medisin 1996.