4 Eksisterende biobanker, vitenskapelige muligheter og næringsutvikling
4.1 Innledning
Dette kapittelet er tredelt. Første del (pkt. 4.2 – 4.6) beskriver eksisterende samlinger av biologisk materiale, med fokus på historien og hensikten med samlingene slik de brukes i dag. Andre del (pkt. 4.7 – 4.15) gir en kort oversikt over utviklingen innen biologien med fokus på det som er og kan bli relevant for biobanker. I tillegg beskrives noen av de store genetiske befolkningsstudier som er satt i gang i løpet av de siste årene i kjølvannet av det humane genomprosjektet. Disse prosjektene reiser en rekke etiske, juridiske og politiske problemstillinger, og er til dels omstridte. Flere av dem representerer nye former for samarbeid mellom det offentlige og næringslivet, mellom forskere og investorer, og mellom befolkningen og forskere. Ny kunnskap og utviklingen innen biologi, informasjonsteknologi og genetisk epidemiologi, har sammen med behovet for store investeringer ført til betydelig næringsutvikling internasjonalt. I tredje del ( pkt. 4.16) av kapittelet vil utvalget drøfte mulighetene for næringsutvikling i tilknytning til biobanker.
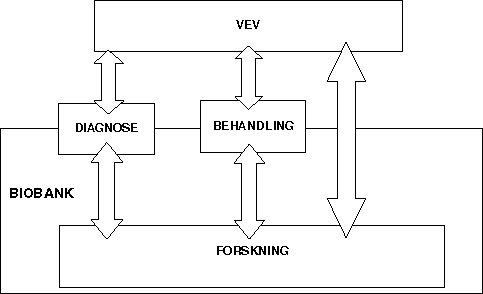
Figur 4-1 Figuren illustrerer hvordan humant biologisk materiale kan innsamles eller overføres til en forskningsbiobank. Enten via en diagnostisk- eller behandlingsbiobank, eller direkte fra avgiver til forskningsbiobanken. At pilene går begge veier illustrerer den utveksling eller tilbakeføring av helseopplysninger som i mange tilfeller vil kunne skje etter analyse / forskning på materialet.
4.2 Definisjoner
Som nevnt i kapittel 3 har utvalget valgt å dele biobankene inn i fire hovedkategorier, basert på hvilket formål banken har. Disse fire hovedkategoriene av biobanker kan betegnes som:
Diagnostiske biobanker
Behandlingsbiobanker
Forskningsbiobanker
Andre biobanker
Når man samler inn og oppbevarer humant biologisk materiale i forbindelse med medisinsk undersøkelse og behandling for å diagnostisere pasienters sykdom (herunder bruke materialet som redskap for å bestemme den videre behandling av en konkret pasient), oppretter man etter utvalgets definisjon en diagnostisk biobank. Med behandlingsbiobanker (eller terapeutiske biobanker) mener vi samlinger av humant biologisk materiale der vevet selv eller deler av det skal benyttes i behandling av en konkret pasient eller en nærmere angitt pasientgruppe. Når man samler og oppbevarer humant biologisk materiale for å utføre forskning oppretter man en forskningsbiobank. Dette gjelder uavhengig av om materialet er samlet inn direkte fra pasienter eller friske personer, eller om det kommer fra eksisterende samlinger i diagnostiske biobanker og behandlingsbiobanker. I kategorien andre biobanker hører blant annet samlinger som brukes til rettsmedisinske formål.
Biobanker kan være offentlige i den forstand at de er opprettet av og drives innenfor den offentlige helsetjenesten eller er knyttet til forskningsgrupper ved universitetene. Biobankene kan være private. Eksempler på dette er biobanker brukt i forskning og utvikling i farmasøytisk industri. Det finnes også biobanker som drives av private, men som hovedsakelig er finansiert av det offentlige. Eksempler på dette er biobanker ved private sykehus eller laboratorier som er finansiert av trygderefusjoner.
Materiale fra én kategori biobanker, kan brukes til andre formål enn det opprinnelige. Dette gjelder for eksempel vev som er samlet inn til diagnostikk eller behandling, og senere brukes til forskning. Den del av samlingen som brukes til forskning vil da skifte status fra å være en diagnostisk biobank til en forskningsbiobank. Dette er illustrert i figur 4.1.
Utvalget skal i det videre redegjøre nærmere for disse ulike kategoriene av biobanker, hva slags materiale som finnes i dem, og omfanget av bankene.
4.3 Diagnostiske biobanker
4.3.1 Innledning
Det som kjennetegner materialet i denne type biobanker, er at det er innhentet i forbindelse med undersøkelse og/eller behandling av en konkret pasient, og at den videre oppbevaring og bruk også har dette som et hovedformål. Selv om biobankene er gitt betegnelsen diagnostiske, er det viktig å være klar over at det med diagnostikk i denne sammenheng også siktes til den bruk som gjøres av materialet i den videre undersøkelse og behandling av den enkelte pasient. Dette kan for eksempel dreie seg om å stille ny diagnose, korrigere en diagnose, eller undersøke effekten av behandling.
4.3.2 Historikk
Uttak av biologisk materiale fra døde individer har tradisjonelt vært oppfattet som mer kontroversielt enn uttak fra levende. Obduksjoner (likåpninger) som innebærer uttak og granskning av døde personers indre organer og vev for å finne årsaken til sykdom og død, har historisk sett blitt møtt med stor motstand både blant geistlige og verdslige myndigheter. De første obduksjoner fant sted på 1200-tallet i Italia, for å finne årsaken til pest. På grunn av motstanden mot slike undersøkelser av det menneskelige legeme, fikk obduksjon som undervisnings- og undersøkelsesmetode først innpass ved de store medisinske læresteder i Europa på 1800-tallet.
Store deler at det materiale som i dag tas ut i forbindelse med obduksjoner, oppbevares for ettertiden. Obduksjonsmaterialet benyttes ikke bare som en kilde til å kartlegge konkrete menneskers sykdomsforløp og dødsårsak, men benyttes også i undervisning- og forskning, samt for fremstilling av medikamenter. Transplantasjonsloven gir sykehus og andre helseinstitusjoner adgang til å obdusere personer som dør i institusjon eller bringes død til institusjon, hvilket innebærer en adgang til uttak av biologisk materiale fra døde personer. Ved universitetenes anatomiske institutter finnes vev og organer som benyttes til forskning og undervisning. Obduksjonsmaterialet lagres systematisk ved sykehusenes patologiske avdelinger. Når det gjelder regelverket rundt obduksjoner vises det til pkt. 8.10 hvor transplantasjonsloven gjennomgås.
Både disseksjoner og obduksjoner har flere hundre års historie i Norge. Mer systematiske obduksjoner ble imidlertid først vanlig fra 1840-årene, hvor man etterhvert også gjorde mikroskopiske undersøkelser på ufargede snitt. Man lærte å støpe vev inn i parafin etter at det var blitt behandlet med formalin eller alkohol for å holde seg, slik at det var lett å skjære til mikroskopiske snitt. Fra 1850-årene kom ulike fargemetoder, og kunnskapen om å stille diagnoser i mikroskop ble systematisert. Til langt inn på 1900-tallet dominerte obduksjonspatologien, men etterhvert ble det økende mengde diagnostikk på prøver fra levende pasienter. Etter den andre verdenskrig oppstod cytologi som egen disiplin, hvor man laget utstryk av celleprøver direkte på mikroskopiske glass og fikserte og farget cellene.
Fra 1930-årene har alt diagnostisk materiale blitt systematisk arkivert. Det består av bøker med remisser fra hver enkelt pasient, hvor preparatet er beskrevet og diagnosene stilt i tillegg til at det blir gitt kortfattede kliniske opplysninger. Fra 1980-årene har datasystemer i stor grad overtatt denne delen av arkivet.
Preparatarkivene består av alle parafinblokker, alle fargete snitt og utstryk. Man kan derfor til enhver tid gå tilbake til de mikroskopiske snittene og utstrykene og foreta en ny vurdering. Det er mulig å ta av glasset og limet som dekker preparatet og farge cellene eller vevet på nytt. Man kan også lage nye mikroskopiske snitt fra parafinblokkene og farge dem med nye metoder. I tillegg kan det man skjærer ut fra parafinblokkene brukes til å trekke ut vevskomponenter og gjøre kjemiske og molekylærbiologiske analyser, for eksempel på genmateriale fra vevet.
Patologien har alltid hatt en viktig rolle som klinisk støttefunksjon, både for å stille diagnoser og karakterisere og forutsi forløpet av sykdommer. Denne funksjonen har nå et økende potensiale på grunn av nye metoder som er utviklet. De siste 10 årene har man i økende grad kunnet gjøre immunhistokjemiske analyser på mikroskopiske snitt, og i dag anvendes rutinemessig mange hundre ulike antistoffer til å påvise forskjellige vevskomponenter. Vi står nå overfor en tilsvarende utvikling når det gjelder genanalyser.
4.3.3 Bruk av patologisk materiale
I tillegg til den opprinnelige diagnostikk av pasientens sykdom, kan arkivert patologisk materiale som nevnt også fylle andre funksjoner, såkalte kliniske støttefunksjoner. I det videre skal noen av disse beskrives.
Fornyet vurdering av preparater
Dette skjer ofte i lys av det kliniske forløp av en sykdom eller nye opplysninger som kommer. Med jevne mellomrom blir også diagnoser revurdert og feildiagnoser rettet opp. Preparater blir også rutinemessig sendt til andre laboratorier når en pasient blir behandlet på et annet sykehus. I tillegg konsulterer man med jevne mellomrom eksperter både nasjonalt og internasjonalt når det gjelder vanskelige preparater.
Sammenlikning med nye prøver
Når det kommer nye prøver fra samme pasient, er det en fast regel å gå tilbake til tidligere preparater for å se på prøvene i en helhetlig sammenheng. Ofte vil man ha behov for en fullstendig gjennomgang av en pasients sykehistorie, da det kan samles opp tallrike prøver fra flere laboratorier. En slik gjennomgang kan ofte kaste et helt nytt lys over sykdommen både med henblikk på diagnose og forløp.
Kvalitetskontroll
Laboratoriene gjennomfører rutinemessig kvalitetskontroll der man går tilbake til forskjellige preparater, både som stikkprøver og ved systematisk gjennomgang av en bestemt type sykdom. Ofte fører ny kunnskap til at diagnostikken av bestemte sykdommer må revurderes, og da er en slik gjennomgang vanlig.
Metodeutvikling
Det foregår i dag en betydelig metodeutvikling både nasjonalt og internasjonalt når det gjelder diagnostikk innen histologi og cytologi. I slike tilfeller går man i arkivet og finner fram karakteristiske tilfeller som blir brukt som grunnlag for metodeutvikling.
Rediagnostikk med nye metoder
Dette har særlig blitt vanlig i de senere årene, hvor man med de nye metodene kan stille diagnoser som ikke var mulig for bare få år tilbake. Det er i dag mulig å karakterisere sykdommer biologisk, og ikke bare ut fra cellenes og vevenes forandrede utseende. Det dreier seg i hovedsak om følgende metodeområder:
Immunhistokjemi, hvor mange hundre ulike antistoffer brukes til fargereaksjoner hvorved man identifiserer forandret funksjon og sammensetning av de syke cellene.
In situ hybridisering, hvor man med molekylærbiologiske metoder og fargereaksjoner kan påvise forandrete gener og genprodukter direkte i utstryk og snitt.
Molekylærbiologiske metoder hvor man kan isolere både DNA og RNA og karakterisere sykdommer på gennivå. Dette gjelder både geners aktivitet og påvisning av strukturelle endringer (mutasjoner), f.eks. ved kreftsykdommer. Slike analyser kan i dag gjøres mer enn 50 år etter at prøven ble tatt til undersøkelse.
Forskning
Alle de ovennevnte metodene brukes i dag systematisk til forskning på patologisk materiale. Dette gir nye og verdifulle opplysninger om årsak, diagnostikk forløp og prognose ved ulike sykdommer. Med de nye metodene utgjør slikt arkivert materiale et økende potensiale for forskning.
Undervisning
Arkivert materiale blir også i stor utstrekning brukt til undervisning av medisinske studenter og annet helsepersonell, i tillegg til etter- og videreutdanning for leger. Ved å velge ut helt typiske tilfeller fra et stort samlemateriale, kan man bygge opp undervisningsmateriale av stor pedagogisk verdi. I tillegg kan eldre undervisningsmateriale bli løpende oppdatert.
Sammenfattende kan man si at oppbevaring og bruk av avgitte vevs- og celleprøver er en garanti for at pasienten får optimal behandling, både ved nåværende sykdom og i tilfelle at det opptrer fremtidige sykdommer. Samtidig kommer prøvene andre pasienter til gode, slik at materialet tjener fellesskapet i en større sammenheng. For det tredje tjener materialet til utvikling av diagnostikken og for det fjerde er materialet av uvurderlig betydning for utdanning av spesialister innen patologi, i tillegg til medisinske studenter og annet helsepersonell.
4.3.4 Omfang
De aller største samlingene av humant biologisk materiale finner vi ved de patologiske laboratoriene. Det er i alt 26 forskjellige laboratorier i Norge, hvorav 3 er private og de andre er offentlige knyttet til region- og sentralsykehus. De eldste samlingene finnes ved regionsykehusene. Systematisk lagring av mikroskopiske snitt og parafinblokker ble startet på Rikshospitalet i 1926, og ved det private Laboratorium for patologi som utgikk fra Rikshospitalet i 1932. Gades institutt i Bergen begynte å lagre snitt i 1929 og parafinblokker fra 1931, Det norske Radiumhospital i 1937, Regionsykehuset i Trondheim i 1939, Ullevål sykehus i 1940 og ved Regionsykehuset i Tromsø i 1972.
Fra 1970-årene skjedde det en betydelig utbygging av patologiske laboratorier ved sentralsykehusene, og omtrent samtidig ble cellediagnostikk startet opp med celleprøver direkte på glass. Slike celleprøver er i hovedsak underlivsprøver fra kvinner og celler fra oppspytt fra lungene. Når det gjelder vevsprøver som blir støpt inn i parafin, skåret og farget til mikroskopiske snitt, er disse tatt fra alle deler av kroppen både hos levende pasienter og fra obduksjoner av døde. Det har vært en fast skikk at alle prøver blir oppbevart for ettertiden. Eneste unntak er normale celleprøver, som en del laboratorier har kastet etter en viss tid.
I dag tas det ca. 340 000 vevsprøver (biopsier) og ca. 530 000 celleprøver (cytologiske prøver) hvert år. På grunn av rutinekontroller og masseundersøkelser fins det i dag lagret celleprøver fra praktisk talt hele den voksne kvinnelige befolkning i Norge. Grovt sett kan vi si at i løpet av en tiårsperiode vil det bli tatt minst en prøve av de aller fleste personer i Norge, og dette blir oppbevart for ettertiden.
På grunnlag av en rundspørring til alle de patologiske laboratoriene i Norge, har utvalget gjort et anslag over hvor mange prøver som er oppbevart pr. 1. januar 2000. 1 Antall parafinblokker (altså vevsprøver) er nærmere 19 millioner, og de tilsvarende mikroskopiske snittene er nærmere 12 millioner. Dette representerer prøver fra i alt 5,2 millioner pasienter over en 70 års periode. Tilsvarende er det lagret omtrent samme antall celleprøver, slik at vi kommer opp i drøyt 10 millioner pasienter over 4 - 5 generasjoner. Alt dette er rimelig godt arkivert sammen med diagnosekartotek og journal med beskrivelse av funnene. Prøvene representerer alle tenkelig sykdommer i samtlige organer i kroppen, alle aldersklasser fra fostre og nyfødte, til pasienter på godt over 100 år, samt normalt vev og celler fra alle organer.
Norge ligger i internasjonal klasse når det gjelder sykdomsregistre og epidemiologiske undersøkelser. I kombinasjon med materiale fra de patologisk anatomiske samlingene kan dette gi unike muligheter for forskning på normale biologiske prosesser og sykdommer gjennom et ¾-århundre.
Flere av laboratoriene har kapasitetsproblemer i forhold til lagring av den økende mengden prøver. I forbindelse med flyttingen av Rikshospitalet til nye lokaler på Gaustad i år 2000, ble alt det lagrede biologiske materialet på Avdeling for patologi, flyttet til et fjernlager. For dette laboratoriet alene, ble lagerplassen anslått til nærmere 3000 hyllemeter. Flere laboratorier har hatt uhell som har ført til tap av materiale, i tillegg til at noen har begynt å kaste gamle prøver. Det haster derfor å sette i verk retningslinjer som gjør at oppbevaring av prøver skjer på en enhetlig måte.
Flere laboratorier tar også imot ferskt vevsmateriale til analyse, blant annet immunologiske undersøkelser og spesielle forskningsformål, men dette tallet er forholdsvis lite. Den største samlingen er på Rettsmedisinsk institutt i Oslo, som oppgir å ha ca. 100 000 frosne prøver, mens de andre laboratoriene har lagret omtrent 25 000 prøver til sammen. Rettsmedisinsk institutt har også prøvemateriale som er tatt ut for rettsgenetisk undersøkelse med hjemmel i barneloven og straffeprosessloven.
Også blodprøver, eller produkter fra blodprøver, vil kunne finnes i diagnostiske biobanker. Omfanget av slikt materiale er imidlertid vesentlig mindre enn når det gjelder ovennevnte vevsprøver, idet blodprøver i stor grad destrueres etter at de nødvendige analyser er gjennomført.
4.3.5 Screening av nyfødte
En annen spesiell form for diagnostisk biobank vil man på sikt få på bakgrunn av den såkalte nyfødtscreeningen. I Norge har alle foreldre rett til å få sitt nyfødte barns blod testet for fenylketonuri (Føllings sykdom) og hypothyreose. Skriftlig informasjon om blodprøvene er tilgjengelig på fødeinstitusjonen. Det kreves ikke skriftlig samtykke. Oppslutningen om screeningprogrammet er nesten 100%. Dette betyr at det hvert år analyseres prøver fra ca. 60 000 barn, og det oppdages årlig 4 barn med fenylketonuri og 15-20 barn med hypothyreose. Kapillærblodprøve tas i 4. levedøgn og sendes til Pediatrisk forskningsinstitutt på Rikshospitalet der analysene blir utført. Blodprøvene blir avidentifisert før de sendes slik at laboratoriet bare benytter et screeningnummer ved analyse og tilbakemelding til fødeinstitusjonen. Blodprøvene kastes etter maksimalt 6 måneder.
I løpet av 2001/2002 vil imidlertid blodprøvene bli tatt og sendt på filterpapir. Dette gir mulighet for å oppbevare filterpapirprøvene i lang tid, og prøvene vil også være velegnet til forskning. Hvis forskning skal gjennomføres, legger man opp til at foreldrene skal få skriftlig informasjon om forskningsprosjektet, og at de deretter vil måtte avgi skriftlig samtykke til bruk av det biologiske materialet. Filterpapirprøver fra hele årskull vil kunne oppbevares og være utgangspunkt for omfattende forskningsprosjekt. Hvis alt tilsendt prøvemateriale blir oppbevart, vil etter hvert prøver fra nesten hele den norske befolkning være samlet i regi av Pediatrisk forskningsinstitutt på Rikshospitalet.
4.4 Behandlingsbiobanker
Behandlingsbiobanker er samlinger av humant biologisk materiale som skal brukes til behandling av en konkret pasient eller en nærmere angitt pasientgruppe. Vi sikter her til situasjoner der vevet selv er behandlingen. Det finnes en rekke ulike typer behandlingsbiobanker.
4.4.1 Blodbanker
Blodbankene er kanskje det mest kjente og typiske eksempel på behandlingsbiobanker. Blodtransfusjon har i Norge vært brukt i praktisk medisin siden midten av 1920-årene. Blodbankene kjennetegnes ved at den enkelte blodgiver ”donerer” sitt blod til banken, som deretter oppbevarer blodet til det er behov for å bruke det i behandling av andre pasienter.
Å gi blod er en altruistisk handling, der blodgiveren ikke får noe igjen for den gaven som blir gitt. De fleste blodbanker gir en symbolsk gave til blodgiveren, men det er ikke å anse for betaling som representerer den verdien blodet har. Norske blodgivere velges ut fra fastsatte kriterier med tanke på sikkerhet for blodgiverne og infeksjonssikring av blodproduktene. De fyller ut et skjema ved hver givning og underskriver dette. Underskriften er en samtykkeerklæring for å gi blod til behandling av pasienter. Noe blod blir tappet til tekniske formål (brukes i dyrkningsmedium for bakterier, til interne kvalitetskontroller etc.) og noe blir tappet til forskningsformål. I slike tilfeller gir giveren et særskilt samtykke til forskning.
Det finnes 65 blodbanker i Norge. Alle blodbankene er knyttet til sykehus i offentlig regi. Blod og blodprodukter er definert som legemidler. Blodbankene lager blodprodukter som brukes lokalt, og plasma som er et råstoff for videre bearbeidelse av legemiddelindustrien. Blodbankenes virksomhet er regulert av Retningslinjer for GMP (Good Manufacturing Practice) i blodbanker og Retningslinjer for Transfusjonstjenesten i Norge (Statens helsetilsyn). Statens helsetilsyn inspiserer blodbankene og utsteder tilvirkertillatelse.
Det tappes knapt 200 000 enheter blod i Norge hvert år. Det er et mål at helsetjenesten i Norge skal være selvforsynt med blodprodukter. Alle blodbanker framstiller konsentrat av røde blodceller. Produktene oppbevares inntil 35 dager ved 4°C. Alle blodbanker framstiller også blodplasma. Blodplasma blir frosset kort tid etter framstilling og sendes frosset til legemiddelindustrien. Virusinaktivert ferskfrosset plasma, immunglobulin til intravenøst bruk, albumin, faktor VIII og faktor IX, samt noen få andre spesialprodukter, framstilles fra norsk plasma og produktene leveres tilbake til blodbankene. Ferskfrosset plasma kan oppbevares frossent, de andre produktene oppbevares ved værelsestemperatur eller 4°C. De største blodbankene framstiller også blodplatekonsentrat. Blodplatekonsentratene er holdbare inntil 7 dager etter produksjon og oppbevares ved 22°C.
Det foregår kjøp og salg av blodprodukter mellom norske blodbanker. Prisen for blodproduktene ble tidligere fastlagt av Helsetilsynet, men er nå ikke regulert. Prisen for en enhet røde blodceller er for tiden ca. kr. 1100,-.
Ved hver blodgivning testes blodet for ulike vira (blant annet HIV). Det blir lagret en serumprøve fra hver blodgiver som oppbevares frosset i 2 år. Pålegget om oppbevaringen av giverprøve er kommet for å kunne re-teste tidligere prøver hos en giver som får en positiv virustest. Alle blodenheter som blir transfundert, loggføres på blodbanken og dokumenteres i pasientens journal. Det vil alltid være mulig å knytte blodgivers navn til transfusjon av en pasient. Dette er av vesentlig betydning for kvalitetskontroll.
4.4.2 Organbanker
En annen kategori av behandlingsbiobanker, kan man kalle organbanker. Det siktes her til samlinger av organer eller vev som senere brukes til transplantasjon. Når det gjelder hele organer slik som hjerter, nyrer og lunger, gis disse fra et menneske og direkte til et annet menneske. Teknisk er det her ikke snakk om å oppbevare organene i biobanker. Imidlertid skjer det også oppbevaring av vev som brukes i transplantasjon, og slikt vev kan oppbevares i biobanker.
Som nevnt har blodtransfusjon i Norge vært brukt i praktisk medisin siden midten av 1920-årene, og etter den andre verdenskrig har organ- og vevs-overføringer blitt tatt i bruk. Den eldste transplantasjonsform er overføring av hornhinne. Deretter fulgte utviklingen av hud-, ben- og åretransplantasjoner. Nyretransplantasjoner begynte man med noe senere, og det var denne transplantasjonsformen, samt hjertetransplantasjonene, som aktualiserte spørsmålet om lovgivning. 2
Rikshospitalet er det eneste sykehuset i Norge som utfører transplantasjoner av hjerte, lunger, nyrer, lever og bukspyttkjertler, og av stamceller (benmarg) fra frisk giver til pasient (såkalt allogen transplantasjon). Organer til transplantasjon blir hentet på 27 godkjente sykehus rundt om i landet. De pårørende blir alltid spurt om samtykke før donasjon. I år 2000 ble det til sammen utført 277 organtransplantasjoner og 48 allogene benmargstransplantasjoner. Av organtransplantasjonene var 206 nyretransplantasjoner, 25 hjerte-, 2 hjerte- og lunge-, 13 lunge-, 30 lever- og 8 bukspyttkjertler. Antallet nyretransplantasjoner var det høyeste noensinne. Ved utgangen av år 2000 sto 220 personer på venteliste for transplantasjoner, og av disse ventet 177 på nyrer. Ved omtrent 40 prosent av nyretransplantasjonene hentes organet fra en levende giver. Antallet transplantasjoner begrenses hovedsakelig av tilgangen på organer, men også sykehusets kapasitet er av betydning. 64 organer ble sendt ut av landet i 2000, og 15 av disse utsendelsene skyldtes kapasitetsproblemer. 3
Ved landets regionsykehus gjøres stamcelletransplantasjoner (pasienten gir celler til seg selv), brusktransplantasjoner, hudtransplantasjoner, hornhinnetransplantasjoner, og bentransplantasjoner.
4.4.3 Stamcellebanker
Ved universitetssykehusenes blodbanker og ved Det Norske Radiumhospital, høstes og lagres produkter som inneholder blodstamceller. Stamceller kjennetegnes ved at de i varierende grad kan gi opphav til ulike typer celler, jf. nærmere om dette under pkt. 4.8. Produktene høstes enten fra pasienten til eget bruk, eller fra frisk giver til en helt bestemt pasient. Cellene gis tilbake enten ferske eller tinte etter nedfrysing ved -130°C eller kaldere. Det høstes ofte flere stamceller enn det blir brukt, og frosne stamcelleprodukter kan oppbevares nærmest på ubestemt tid. Cellene kan bare brukes i behandling av den personen de er bestemt for. Stamcellene har stor verdi i forsknings- og utviklingsarbeid.
I dag brukes stamceller fra blodet til å gjenopprette benmargsfunksjonen etter høydose cellegiftbehandling av kreftpasienter. Cellene høstes oftest fra blodet. Pasienten får en dose cellegift som skal drepe kreftcellene, men som også dreper benmargscellene. Dette er en dødelig bivirkning for pasienten. Friske blodstamceller er derfor en forutsetning for at pasienten skal leve videre. Cellene kan komme fra en vevsforlikelig frisk giver eller fra pasienten selv. Åtte til ti dager etter tilførsel av blodstamceller, kan man påvise nye celler i pasientens blod.
Annen medisinsk bruk av stamceller er under utvikling og i framtiden kan kanskje alle typer organsvikt behandles med celler som er utviklet fra friske stamceller.
Hjernestamceller kan isoleres fra aborterte fostre og er i utlandet blitt brukt i behandlingen av pasienter med Parkinson’s sykdom. Bruskstamceller kan isoleres, dyrkes i laboratoriet og brukes ved brusktransplantasjoner. Disse cellene kan utvikles fra en type stamceller som også er utgangspunktet for ben-, muskel- og bindevevsceller. Hjertemuskelceller vil ha verdi i behandlingen av hjertesvikt, og leverstamceller vil være viktige i behandlingen ved leversvikt. Stamceller fra pasienten selv er det beste for å unngå vevsuforlikelighet som kan føre til at det nye vevet blir forkastet.
I tillegg til at stamceller kan brukes til å dyrke celler som er spesifikke for ulike typer vev, forsøker man å bruke dem i forbindelse med genterapi. Hvis man klarer å sette inn nye gener i f.eks. blod, vil alle cellene som utvikler seg fra stamcelleme inneholde det nye genet og produsere det ønskede genproduktet. Ofte trengs bare 2-3% av normalt nivå av et genprodukt for at pasienten kan få et normalt liv.
Blodstamcellene kan også brukes som utgangspunkt for immunterapi ved at blodstamceller utvikles til immunceller slik at pasientens eget immunapparat blir i stand til å bekjempe kreftsvulsten. Slik kan stamceller også komme til å bli brukt i kreftbehandling.
På sikt er det grunn til å tro at bruken av stamceller vil øke både i forskning og behandling. Man ser for seg at dette vil få stor betydning når det gjelder behandling av en rekke sykdommer. Bruk av stamceller i behandling vil medføre et behov for å opprette stamcellebanker. Slike behandlingsbanker kan ha to former. For det første slik at hvert enkelt individ har sitt eget ”innskudd” av egne stamceller. Tanken er da at man ved sykdom skal kunne bruke disse stamcellene til å dyrke frem erstatningsceller for skadede eller ødelagte celler. Den andre form for stamcellebank, kan være en bank med et stort antall ulike stamceller. Her ser man for seg at den enkelte pasient ved sykdom skal kunne henvende seg til banken for å få stamceller som er mest mulig vevsforlikelige.
Utvalget viser for øvrig til pkt. 4.8 hvor det redegjøres nærmere for stamceller, og pkt. 8.8 og pkt. 8.10 hvor det i forbindelse med redegjørelsen for henholdsvis bioteknologiloven og transplantasjonsloven er redegjort for lovverkets betydning for enkelte kilder til stamceller, og dermed også når det gjelder adgangen til innhenting, oppbevaring og bruk av stamceller.
4.4.4 Homograftbanker
Hjerteklaffer kan tas ut fra nylig avdøde, oppbevares ved lave temperaturer og brukes til pasienter som har behov for utskiftning av hjerteklaffer. Det er en tendens til å foretrekke hjerteklaffer fra avdøde personer, fremfor hjerteklaffer av kunstig materiale eller fra andre arter.
Når det gjelder nærmere om regelverket knyttet til innhenting og bruk, vises det til pkt. 8.10 om transplantasjonsloven.
4.4.5 Bruskcellebanker
Bruskceller kan tas ut fra en pasient, gjerne i forbindelse med kirurgiske inngrep, dyrkes i laboratoriet i 2 uker og gis tilbake til i pasienten enten som ferske celler eller etter nedfrysing og opptining.
Når det gjelder nærmere om regelverket rundt innhenting og bruk, vises det til pkt. 8.10 om transplantasjonsloven.
Det er grunn til å anta at praksis varierer når det gjelder informasjon til og samtykke fra pasienten, vedrørende den videre oppbevaring og bruk av slikt vev. Ved enkelte sykehus gis det skriftlig samtykke fra pasienten hvor han eller hun ”donerer” sitt vev til sykehuset for videre bruk i behandling og/eller forskning.
4.4.6 Beinbanker
Ved regionsykehusene oppbevares og brukes bein som er tatt ut i forbindelse med protesekirurgi (hofteledd, kneledd). Noen intakte knokler skaffes til veie ved donasjon fra avdøde. Dette benvevet oppbevares og benyttes ved ortopediske inngrep på andre pasienter der man har behov for erstatningsvev. Slikt vev vil danne nytt benvev hos pasienten.
Når det gjelder nærmere om regelverket rundt innhenting og bruk, vises det til pkt. 8.10 om transplantasjonsloven.
Også når det gjelder benvev, er det grunn til å anta at praksis varierer når det gjelder informasjon til og samtykke fra pasienten, vedrørende den videre oppbevaring og bruk. Helsetilsynet arbeider for tiden med retningslinjer for denne virksomheten.
4.4.7 Sædbanker, banker med befruktede egg
En annen kategori av behandlingsbiobanker består av egg- (befruktede) og sædcellebanker. Egg- og sædceller benyttes i forbindelse med kunstig befruktning som er regulert av bioteknologiloven. Som vi skal komme nærmere tilbake til, er det der fastsatt klare regler både når det gjelder innhenting, oppbevaring og bruk av henholdsvis egg- og sædceller, jf. om dette under pkt. 8.8.
4.5 Forskningsbiobanker
4.5.1 Innledning
Når man innhenter og oppbevarer humant biologisk materiale for å utføre forskning, oppretter man en forskningsbiobank. Dette gjelder enten materialet er samlet inn direkte til forskning, eller fra eksisterende samlinger i diagnostiske biobanker eller behandlingsbiobanker.
I Norge finnes det et stort antall forskningsbiobanker. De kan være opprettet i forbindelse med forskning på en spesifikk sykdom, et stort antall sykdommer, eller i forbindelse med forskning på biologiske prosesser generelt. I noen banker vil det være et svært lite antall prøver, for eksempel der hvor det gjelder forskning på sykdommer som bare forekommer hos et lite antall mennesker. På den annen side har vi de store befolkningsundersøkelsene hvor det er samlet inn biologisk materiale fra flere hundre tusen mennesker.
Forskningsprosjektene, - og dermed indirekte også innhenting, oppbevaring og bruk av materialet i biobanker, er anbefalt av de regionale komitéer for medisinsk forskningsetikk. Utover Datatilsynets godkjenning (konsesjon) av behandlingen av personopplysningene, finnes det ingen særskilt godkjenningsordning for forskningsbiobankene. Noen totaloversikt over antall prøver i slike biobanker i Norge finnes ikke, men det er snakk om et betydelig antall.
Materiale og lagringsform
Forskningsbiobankene kan bestå av frosset levedyktig materiale oppbevart i flytende nitrogen ved –196°C eller ikke-levedyktig materiale oppbevart ved –20°C eller lavere temperatur. Slike biobanker er oftest knyttet til en forskningsinstitusjon, men også nasjonale og internasjonale firmaer oppretter biobanker i forbindelse med forskning og legemiddelutprøving.
Cellelinjer er en annen lagringsform for vev i forskningsprosjekter. Celle- og vevskulturer er et viktig verktøy ved forskning, og celler kan holdes i live i mange år ved moderne, standardisert metodikk. Det fins en rekke cellelinjer, både fra kreftsvulster og normale celler hos mennesker. Noen av disse er dyrket opp på laboratorier lokalt, mens andre cellelinjer kjøpes internasjonalt. Cellelinjer som ikke brukes til eksperimenter, oppbevares gjerne som levende frosne celler i flytende nitrogen. Det finnes ikke noe enhetlig registreringssystem for hvilke cellelinjer som brukes i norske forskningslaboratorier. Vanligvis har hver cellelinje et kodenavn. Inntil nå har det neppe vært strengt gjennomført å innhente informert samtykke fra pasienten når materiale som er tatt ut ved operasjon eller til diagnostiske formål blir brukt til forskning på denne måten. Universitetsklinikkenes plikt til å drive forskning på pasienter har tidligere vært oppfattet som en adgang til å bruke vev i forskningen.
Klinisk forskning og grunnforskning
Universitetene driver klinisk forskning og grunnforskning der det samles inn vev. Det finnes ingen oversikt over biobanker i tilknytning til denne forskningen. Ved de medisinsk-genetiske avdelinger og laboratorier foregår det forskning i tillegg til klinisk virksomhet, og laboratoriene utfører også genetiske undersøkelser for andre forskningsprosjekter. Ved disse avdelingene / laboratoriene foreligger det således samlinger av humant biologisk materiale som benyttes i genetisk forskning.
Kliniske legemiddelutprøvinger
I forbindelse med kliniske legemiddelutprøvinger der norske sykehus eller forskningsenheter inngår i multisenter-studier nasjonalt eller internasjonalt, blir det opprettet biobanker. Legemiddelutprøvingene vurderes av de regionale komiteer for medisinsk forskningsetikk i Norge. Biobanker som er opprettet i forbindelse med legemiddelutprøving vil ofte være lokalisert i andre land.
Studier i andre land
Utvalget har ikke oversikt over studier som er organisert og finansiert i Norge, men hvor det samles inn humant biologisk materiale i andre land som så analyseres og lagres i Norge.
Befolkningsundersøkelser
Flere store befolkningsundersøkelser i Norge har opprettet biobanker. I de fleste studiene er materialet samlet inn til rene forskningsformål. Statens Helseundersøkelser (SHUS) har inntil nylig ikke oppfattet sine fylkesundersøkelser som forskning, men som en del av et helsetilbudet til befolkningen. SHUS har nå selv tatt initiativ til å endre dette.
Utvalget har ikke hatt som mål å gi en fullstendig oversikt over biobanker i Norge. Her skal vi kun beskrive noen av de største befolkningsundersøkelsene som inkluderer biobanker. Dette vil illustrere hvilket omfang materialet har. 4
4.5.2 Janusbanken
Janus-prosjektet ble opprettet i 1973, og finansieres av Den norske kreftforening. 5 Navnet henspiller på guden med to ansikter, og symboliserer i denne sammenheng mulighetene for både prospektive og retroprospektive studier med utgangspunkt i blodprøver (serum) fra personer der noen senere utvikler kreft.
Innsamlingen av blodprøver har pågått siden 1973, opphørte i 1991, for så å bli gjenopptatt i 1997. Janusbanken inneholder 600 000 serumprøver fra ca 300 000 norske givere. Ingen av dem hadde fått påvist kreft da prøven ble tatt. Siden 1973 og frem til 1997 har omkring 18 000 av deltagerne utviklet ulike former for kreft. Nedfrosset blodserum fra unge og gamle deltagere, samlet opptil 20 år før kreftdiagnose ble stilt er dermed tilgjengelig for kreftforskning.
Prøvene er hentet fra blodgivere og fra helseundersøkelser i de fleste fylkene i Norge. Den Norske Kreftforening eier Janusbanken, og den styres av en komite som består av to representanter fra Den Norske Kreftforening og fem representanter fra ulike forskningsmiljøer, blant annet Kreftregisteret og Statens helseundersøkelser. Janusbanken har konsesjon for å opprette personregister for innsamlede serumprøver, og det er Kreftregisteret som fører personregisteret.
Hovedformålet med Janusprosjektet er å søke i dette omfattende materialet etter kjemiske, biokjemiske, immunologiske eller andre forandringer som kan bidra til å påvise utvikling av kreft på et tidlig stadium, eller som kan utgjøre indikasjoner på forhøyet risiko for bestemte krefttyper. Janus-komiteen ønsker at det omfattende materialet utnyttes maksimalt i forskning om kreft.
Alle blod-donorer i Janusprosjektet gis et identifikasjonsnummer som automatisk kobles til Kreftregisterets datafil. Kreftregisteret har siden 1951 registrert alle nye tilfeller av kreft i Norge. Koblingen mellom en stor biobank og den informasjon som er tilgjengelig via Kreftregisteret, gjør forskningsmulighetene svært gode. Janusbanken kan også benyttes for andre forskningsformål enn kreft, for eksempel undersøkelse knyttet til forurensningsproblematikk, kosthold og annet. Det er imidlertid kreftforskningen som dominerer foreløpig.
4.5.3 CONOR
I 1994 startet prosjektet Cohort Norway (CONOR) innsamling av helse- og personopplysninger, samt biologisk materiale. Prosjektet er et samarbeid mellom de samfunnsmedisinske forskningsmiljøene i Norge, og skal etter planen omfatte ca. 200 000 personer. CONOR består av de regionale helseundersøkelsen i Tromsø (Tromsø IV), Nord-Trøndelag (HUNT), Hordaland (HUSK), Oslo (HUBRO) og Oppland og Hedmark (OPPHED).
Tromsø IV-undersøkelsen ble gjennomført i årene 1994 – 95. Konsesjonen for denne undersøkelsen ligger hos Universitetet i Tromsø. Det er samlet inn helseopplysninger og blodprøver fra 27 119 personer. Data med tilhørende biologisk materiale lagres lokalt. Det er frosset ned serum, men ikke fullblod.
HUNT ble gjennomført i perioden 1995 – 97. Konsesjonen for undersøkelsen ligger hos Statens helseundersøkelser (SHUS). Folkehelsa er nå ute av HUNT, og SHUS er behandlingsansvarlig, mens Norges Tekniske og Naturvitenskapelige Universitet (NTNU) er databehandler. Det er samlet inn helseopplysninger og blodprøver (frosset fullblod) fra 65 201 personer. Prøvene lagres på Innherred sykehus.
HUSK ble gjennomført i perioden 1997 – 99. Konsesjon for undersøkelsen ligger hos SHUS. Det er samlet inn helseopplysninger og blodprøver (frosset fullblod) fra ca 24 000 personer. Prøvene lagres ved Haukeland sykehus.
HUBRO blir gjennomført i perioden 2000 – 01, med sannsynlig slutt september 2001. Konsesjon for undersøkelsen ligger hos SHUS. Man antar at det vil bli samlet inn helseopplysninger og blodprøver (frosset fullblod) fra ca 24 000 personer. Prøvene lagres lokalt i samarbeid med Universitetet i Oslo.
OPPHED blir gjennomført i perioden 2000 – 01, med beregnet avslutning november 2001. Man antar at det vil bli samlet inn helseopplysninger og blodprøver (frosset fullblod) fra ca. 14 500 personer. Prøvene lagres i Oslo i samarbeid med Universitetet i Oslo.
I løpet av 2001 skal andre runde av CONOR settes i gang. Når det gjelder Tromsøundersøkelsen, vil det her bli samlet inn mellom 20 000 og 30 000 datasett med tilhørende biologisk materiale, denne gangen fullblod. SHUS vil ha konsesjon for undersøkelsen. Etter dette vil det også komme inn data til CONOR fra de øvrige helseundersøkelsene, spesielt fra nye årskull.
Det er laget en egen beskrivelse for hvordan, hvilke mengder og hvor det biologiske materialet er frosset ned. Som hovedregel er det innsamlet ca 7,5 ml blod fra hver deltager, hvorav 2,5 ml er reservert for CONOR. CONOR-andelen skal brukes til prosjekter som benytter seg av materiale fra mer enn en kilde i CONOR. Det resterende materialet kan brukes til lokale prosjekter. Uavhengig av om blodet skal brukes lokalt eller i CONOR, må SHUS som konsesjonsinnehaver godkjenne bruken.
Samarbeidet mellom de ulike helseundersøkelsene ledes av en styringsgruppe som er sammensatt av representanter fra universiteter og helseinstitusjoner, herunder Norges forskningsråd, Statens helseundersøkelser og Statens institutt for folkehelse. For hver av de regionale helseundersøkelsene er det opprettet en biobank som lagrer fullblod eller serum. Statens helseundersøkelser har konsesjon for alle de regionale helseundersøkelsene, med unntak av Tromsø-undersøkelsen.
De ulike delprosjekter har det til felles at man samler inn helse- og personopplysninger fra deltagerne og blodprøver som fryses ned med tanke på fremtidige forskningsformål. Det biologiske materialet koblet opp mot de innsamlede helse- og personopplysningene, eventuelt også koblet opp mot andre helseregistre eller andre registre, er attraktivt både for forskere og næringsliv. Det er foreløpig ikke innhentet samtykke til å utføre genetiske undersøkelser ved hjelp av blodprøvene i CONOR.
4.5.4 Mor og barn undersøkelsen
Prosjektet ”Den norske mor og barn undersøkelsen” ble vedtatt igangsatt i 1998 av Stortinget og drives av Statens institutt for folkehelse. Undersøkelsen er en studie av årsaker til sykdom hos mor og barn. Ideen er at 100 000 gravide skal rekrutteres i løpet av en 4 – års periode, og at det skal tas en blodprøve i svangerskapet og en etter fødsel. Prosjektet rekrutterer nå i tillegg fedre og regner med å samle blodprøver og helseopplysninger fra omtrent 80 000 fedre. Ved fødselen samles navleveneblod fra barnet. Ved hjelp av spørreskjema til mor og far samles det inn opplysninger om symptomer og plager, medikamentbruk, kosthold, rusmiddelbruk og andre livsstilsfaktorer, yrke, fritidsaktiviteter og sosiale faktorer. Blodprøvene fryses så ned, – henholdsvis fullblod og plasma, og skal utgjøre en kilde til forskning de neste 100 år med tanke på å finne årsaker til sykdom hos barn og voksne. Det er planlagt omtrent 100 ulike delprosjekter i tilknytning til Mor – barn undersøkelsen.
Et avledet prosjekt er en undersøkelse for å finne frem til miljøfaktorer som utløser type 1 diabetes hos personer med økt arvelig risiko. Omtrent 3 % av alle barn har en genkombinasjon som gjør at de har en risiko på omtrent 6 % for å utvikle type 1 diabetes før 15 års alder. På basis av informert skriftlig samtykke, skal det tas prøver av munnslimhinne i barnets første leveår, for deretter å foreta en genotyping og finne frem til de barna som har ”diabetesgenene”. Disse barn skal følges til de er 15 år, for å se om kostholdsfaktorer eller infeksjoner setter diabetesutviklingen i gang.
I en slik undersøkelse vil altså en prøve fra celler i munnen tatt i første leveår danne grunnlag for en årelang oppfølging fra forskeres side av barn med forhøyet (men relativt lav) risiko for diabetes. Som i andre kohortundersøkelser dreier det seg om å delta aktivt i forskningsprosjekter over lengre tid. I hvilken grad dette kan få konsekvenser for den enkeltes livskvalitet skal også undersøkes.
4.6 Biobanker i miljøovervåking
Biobanker har en bredere anvendelse enn genetisk forskning og utvikling, og kan blant annet brukes i miljøovervåkning. Et praktisk eksempel kan illustrere dette. Konsentrasjoner av bly, kadmium, sink, kopper og kvikksølv i en melketann reflekterer organismens opptak av disse elementene i perioden fra anlegg til felling. Ved å måle konsentrasjonen av disse elementene i felte melketenner fra mange barn på et bestemt sted, kan en få et utrykk for miljøforurensingen på dette stedet. Ved Anatomisk institutt i Bergen er det opprettet en biobank som består av mange tusen felte melketenner fra hele Norge og fra deler av andre land. På denne måten kan en drive miljøovervåking over lengre tidsperioder. Ved Anatomisk institutt i Bergen har man også undersøkt et gravmateriale fra Uvdal stavkirke i Buskerud. Materialet ble funnet under kirken og stammer fra middelalder og frem til 1804. Ved hjelp av dette materialet kan en få et inntrykk av naturlig nivå av disse stoffene fra ”førindustriell” tid.
4.7 Fra små celler til store tall
Cellen er grunnenheten i levende materie ved at den i prinsippet er i stand til selvstendig liv. En celle består av en kjerne som inneholder arvestoffet (DNA), og en omgivende del som kalles cytoplasma. Cytoplasma avgrenses mot omgivelsene av en cellemembran. Menneskekroppen er satt sammen av ca. 1013 celler, som kan grupperes i vev med spesialiserte funksjoner.
Komplett ”programvare” for prosessene som foregår inne i cellen finnes i cellekjernens DNA, fordelt på 23 par kromosomer. Alfabetet som benyttes i arvestoffets programmering, består av bare fire bokstaver: A, G, C, T som er forkortelser for de 4 kjemiske forbindelsene (basene) arvestoffet er bygget opp av, totalt ca. 3 milliarder baser. Instruksjonene fra DNA og ut i kroppens celler går via en midlertidig genkopi (RNA) som omsettes til proteiner i cellens cytoplasma. Et gen kan kode for flere proteiner eller for flere varianter av et protein. Dette kan være strukturelle proteiner eller mer spesialiserte proteiner som enzymer, hormoner eller reseptorer. Noen av proteinene vil binde seg til DNA og på den måten være med på å regulere hvilke gener som til en hver tid er aktive. Til tross for at alle celler i kroppen inneholder en komplett kopi av arvestoffet, vil bare et avgrenset utvalg gener være aktive i den enkelte celletype.
Den totale mengde opplysninger i menneskets genmateriale kalles genomet, den totale mengde opplysninger i RNA kalles transkriptomet (transkripsjon = overføring av genetisk informasjon), og samtlige proteiner som uttrykkes i organismen kalles med et samlenavn for proteomet.
Fordi koden og oppbyggingen i DNA, RNA og protein er komplementære, er alle tre komponentene uttrykk for samme informasjon. Har man identifisert en av disse komponentene, kan man derfor ved hjelp av databaser finne strukturen på de to andre komponentene. Den eksplosive økningen i kunnskap om cellenes struktur og funksjon skyldes denne kombinasjonen, og ikke bare en av tilnærmingsmåtene. Derfor har hverken molekylærbiologi eller proteinbiokjemi alene vært tilstrekkelig.
Det levende livet består i at hele celler fungerer, at gener i DNA kan avleses, at informasjonen fraktes ved hjelp av mRNA ut i cellens cytoplasma, og at dette fører til produksjon av proteiner og andre stoffer. En rekke proteiner vandrer tilbake til cellekjernen og modifiserer eller regulerer genene. Dermed oppstår et velregulert kretsløp. Når alt dette er på plass, og mellom 5 og 10 000 ulike kjemiske prosesser skjer ute i cellen, kan vi snakke om liv. DNA står imidlertid i en særstilling fordi det lager koden for alle cellens produkter.
I løpet av få år vil man ha gjennomført en komplett kartlegging av det humane genomet. Transkriptomet (RNA) er under kartlegging i de ulike celle- og vevstypene, og dessuten skjer det en rask utvikling i automatiserte metoder for å kartlegge proteiners struktur og funksjon, proteomet. Når man skal vurdere bruk av materialet i biobanker er det derfor viktig å ikke ha oppmerksomheten ensidig fokusert på DNA som grunnlag for livet, men mot alle de tre komponentene. Totalt utgjør den protein-kodende delen av genomet mindre enn 5 % av den totale mengden. Funksjonen til de resterende 95% av DNA vet man foreløpig lite om. Antallet gener som finnes i det humane genomet har lenge vært anslått til ca. 100 000, men dette tallet er blitt justert etter hvert. I dag tror man at antallet gener er nærmere 30 000.
4.8 Stamceller
Som nevnt under pkt. 4.4.3 kan en stamcelle gi opphav til andre celler og vev. Det er vanlig å skille mellom tre hovedtyper stamceller:
Totipotente stamceller: Kan gi opphav til alle slags celler og vev, inklusive morkake
Pluripotente stamceller: Kan gi opphav til alle slags celler og vev, men ikke morkake
Multipotente stamceller: Kan gi opphav til flere forskjellige celler og vev
En befruktet eggcelle vil gjennom de første celledelingene frem til det såkalte blastula-stadiet være totipotent. Disse cellene vil hver kunne gi opphav til et nytt individ. Etter at fosteranlegget er festet til livmorveggen dannes det et ytre cellelag som blir til morkake og fosterhinnen, og en indre masse av celler som blir til fosteret. Cellene i den indre massen defineres som pluripotente. De kan utvikles til alle kroppens vev, men kan ikke danne et nytt foster uten næring via en morkake. Etter hvert som cellene i fosteret spesialiserer seg mot forskjellige typer vev, får man et nytt nivå av stamceller. Disse kan gi opphav til flere typer celler og vev, og sies å være multipotente.
Stamceller i terapi
De mest potente av menneskets celler (totipotente) finnes som nevnt i blastocysten. Videre utvikling av fosteret er avhengig av at blastocysten fester seg i livmoren. Etter at den har festet seg i livmoren utvikles spesialiserte vev og cellene differensieres fra totipotens, via pluripotens og multipotens til det vi kaller endedifferensiering. Det vil si at cellene mister sin evne til å fungere i mange vev, men øker evnen til å utføre spesialiserte oppgaver. Alle kjerneholdige celler (med unntak av kjønnscellene) inneholder det samme arvematerialet. Det er imidlertid ikke de samme genene som er aktive i alle vev og nøkkelen til differensiering ligger sannsynligvis i hvilke gener som er aktive. Hvis vi kunne regulere genaktiviteten i en celle, kunne vi sannsynligvis også regulere graden av differensiering. Hvis arvematerialet i en eggcelle byttes ut med arvematerialet i en hvilken som helst vanlig celle og den manipulerte eggcellen deler seg, dannes en blastocyst med totipotente celler. Dette viser at det er omgivelsene rundt cellen som avgjør i hvilken retning differensieringen av cellen skal gå.
Fortsatt vet man lite om hvordan utviklingen og spesialiseringen hos stamceller er regulert. I takt med økende kunnskap om hvordan stamceller spesialiseres ut fra signalsubstanser i cellens omgivelser, vil en i større grad kunne ”styre” utviklingen i ønsket retning. På denne måten vil en kunne produsere spesialiserte celler og vev, kanskje en gang i fremtiden også hele organer. Dette åpner for helt nye muligheter når det gjelder å behandle alvorlige lidelser som for eksempel Parkinson, slag eller hjerteinfarkt.
Stamceller kan hentes fra tre prinsipielt ulike kilder: befruktede egg, aborterte foster og fødte individer. En fjerde kilde er ”kjernetransplanterte” eggceller. Med et mulig unntak av stamceller fra fødte individer, er alle de andre nevnte kildene til stamceller etisk omdiskuterte. Med den kunnskap man har i dag kan det synes som om totipotente/pluripotente stamceller fra aborterte foster og befruktede egg vil ha en bredere anvendelse enn multipotente stamceller fra fødte individer. Grunnen til dette er både at disse ofte vil være lettere å isolere, og de kan spesialiseres til et større antall ulike vev og organer. Nyere studier tyder imidlertid på at stamceller fra fødte individer kan ha et større potensiale enn tidligere antatt. Kanskje vil det derfor bli mulig å ”tilbakeprogrammere” stamceller som isoleres fra pasienten til et tilnærmet pluripotent nivå, for deretter å differensiere disse cellene slik at de utvikler seg til det vev eller organ som pasienten trenger.
Et sentralt problem innen transplantasjoner er avstøtningsreaksjoner som en følge av manglende vevsforlikelighet. Hvis stamcellene kan hentes fra den pasienten som trenger behandling, vil man unngå problemer med manglende vevsforlikelighet. Et alternativ er såkalt terapeutisk kloning. Denne metoden går ut på at DNA fjernes fra en ubefruktet eggcelle. Deretter setter man inn cellekjernen fra en kroppscelle hos pasienten. Ved hjelp av en elektrisk stimulering (puls) vil egget begynne å dele seg på samme måte som et befruktet egg. Stamceller fra et ”kjernetransplantert” egg vil kunne isoleres og brukes på samme måte som stamceller fra et egg som er befruktet på vanlig måte. Ved å benytte pasientens eget DNA til kjerneoverføring, kan en fremstille stamceller som siden kan spesialiseres til ulike vev og organer med pasientens egen vevstype. Slik kan man unngå de alvorlige problemer som oppstår ved forkastningsreaksjoner og bruk av immundempende medikamenter.
I USA finnes det allerede private selskaper som tilbyr foreldre å plassere navlestrengblod fra nyfødte i en biobank. Navlestrengsblodet inneholder stamceller med barnets egen vevstype som da kan brukes til behandling på et senere tidspunkt i livet.
4.9 Genetikk
Genene avgjør hva slags individ som kan utvikle seg fra en befruktet eggcelle. Selv om mer enn 99 % av DNA-sekvensen er felles for alle mennesker, vil variasjon i den resterende delen ha avgjørende betydning for en rekke egenskaper. Her ligger instruksjoner for synlige egenskaper som hudfarge, hårfarge og høyde. Enda viktigere er alle egenskapene som ikke kan sees med det blotte øye, slik som mottakelighet for sykdommer, respons på ulike medikamenter eller utvikling av allergi. Det er forskjeller i DNA som skiller mennesket fra andre arter.
Enkelte egenskaper har en enkel arvegang. I slike tilfeller kan et enkelt gen som er endret (mutasjon), føre til utvikling av en bestemt sykdom (for eksempel cystisk fibrose). Mulighetene for diagnostikk på DNA-nivå for slike sykdommer er allerede betydelig, og vil øke i årene som kommer. Det er beskrevet flere tusen monogene sykdommer, det vil si sykdommer som skyldes forandringer i et enkelt gen. De fleste monogene sykdommer er sjeldne. Tall fra England viser at ca. 20 av disse sykdommene står for 70-80% av de alvorlige genetiske sykdommene som er registrert i landet. En regner med at ca. 1 % av levende fødte har en monogen sykdom. Alvorlighetsgraden av sykdommene er svært forskjellig.
Når det gjelder såkalte polygene eller multifaktorielle sykdommer, er det samspillet mellom flere gener, eller mellom gener og miljøfaktorer, som er avgjørende for utvikling av sykdom. Dette er sykdommer som kan ramme store befolkningsgrupper, slik som enkelte former for kreft og hjerte- og karsykdommer. Ved å kartlegge det genetiske bidraget til slike vanlig forekommende sykdommer, har man muligheter til å forbedre metoder både innenfor forebygging, diagnostikk og behandling av disse sykdommene. Innen farmasøytisk industri legger man stor vekt på muligheten for å kunne tilpasse medikamenter til undergrupper av pasienter eller til den enkelte pasient, basert på kunnskap om pasientens genetiske disposisjoner. Forventningene til genetisk kartlegging av vanlige sykdommer og effekten av medikamenter (farmakogenetikk) har allerede ført til en betydelig industriell satsing.
4.10 Fra gen til sykdom
Sammenhengen mellom genetiske disposisjoner og sykdom er i de fleste tilfeller komplisert. Noen genetiske disposisjoner fører alltid til sykdom. Hvis et barn har arvet genet for Føllings-sykdom både fra mor og far, vil barnet utvikle mental retardasjon om det ikke behandles med diett. Hvis et barn har arvet genet for Huntingtons sykdom fra mor eller far vil det som voksen utvikle den alvorlige, dødelige sykdommen Huntingtons chorea, men det er fortsatt ikke mulig å forutsi med sikkerhet når sykdommen vil bryte ut. Våre forestillinger om genetiske sykdommer er fortsatt dominert av vår kunnskap om tilstander der sammenhengen mellom gen og sykdom er ganske enkel og i liten grad påvirket av miljøfaktorer eller samspill mellom flere gener. Hemokromatose er et eksempel på en tilstand der sammenhengen mellom gen og sykdom er komplisert. Hvis et barn har arvet genene som gjør at man disponerer for sykdommen hemokromatose, er det usikkert om sykdommen utvikler seg i det hele tatt, i hvilken alder den vil debutere, hvor alvorlig den vil arte seg, og hvilke symptomer og plager den vil gi. Hemokromatose fører til at jern avleires i indre organer. Dette kan lede til en rekke ulike sykdommer som leversvikt, hjertesvikt og økt risiko for kreft i leveren. Hemokromatose regnes som den mest utbredte genetiske sykdom vi har i Norge, men en genetisk test forteller forholdsvis lite om hvordan tilstanden vil utvikle seg for den enkelte. Slik er det med de fleste genetiske disposisjoner.
Gjennom familie- og befolkningsstudier har man for eksempel vist at genetisk disposisjon spiller en stor rolle for risikoen for å utvikle schizofreni. Likevel er det slik at begge søsken i et enegget tvillingpar utvikler lidelsen bare i ca 48% av tilfellene. Hvis sykdommen var genetisk forutbestemt ville man forvente at hvis den ene av tvillingene led av schizofreni, ville også den andre alltid utvikle lidelsen. Når det gjelder schizofreni ser det ut til at miljøfaktorer spiller like stor rolle som gener på befolkningsnivå. For enkeltindivider kan situasjonen imidlertid være en annen.
Tvilling-, adopsjon- og andre familiestudier kan fortelle oss i hvilken grad gener og miljø spiller en rolle for risikoen for sykdom. Imidlertid vet vi fremdeles oftest ikke hvilke gener eller hvilke miljøfaktorer det dreier seg om. Når kunnskapen om genene øker kan vi måle genetisk risiko og benytte denne kunnskapen til å forsøke å identifisere miljøfaktorer som leder til sykdom. Hvis det er slik at det bare er noen ytterst få mennesker med en meget sjelden genetisk variant som står i fare for å utvikle hjernesvulst som følge av mobiltelefonbruk, vil dette ikke kunne oppdages uten at man studerer personer med denne genetiske risikofaktoren spesielt. Tilsvarende gjelder for sjeldne legemiddelreaksjoner.
Forsøkene på å finne gener som spiller en rolle for komplekse sykdommer har ført til mange skuffelser, og fortsatt er det få gjennombrudd på dette området. Svært ofte har det vist seg at funn av gener, eller et område på et kromosom som viser sammenheng med en sykdom, ikke kan bekreftes i nye studier. Dette skyldes at det kan være vanskelig å samle tilstrekkelig mange pasienter med en sykdom, at det er vanskelig å vite hvordan sykdommen skal defineres, at visse undergrupper av pasienter kan være representert i større eller mindre grad enn i befolkningen som helhet, at det er vanskelig å velge riktig kontrollgruppe, og at opplysningene som samles inn gjennom intervjuer eller målinger er preget av hvorvidt individet har utviklet sykdommen. 6 Befolkningsstudier der man følger opp store grupper over tid er ofte den eneste måten å unngå slike feilkilder, eller å kunne vurdere feilkildene systematisk.
Ved sykdommer som er forårsaket av et gen i enkel eller dobbel dose er det forholdsvis enkelt å kartlegge og identifisere genene. For at det skal være enkelt å finne genet bør sykdommen være alvorlig, sjelden, opptre tidlig i livet, føre til samme sykdom hos alle som er bærere av genet, og miljøfaktorer bør ikke spille en rolle for hvorvidt sykdommen bryter ut. De fleste sykdommer er ikke slik. Vanlige folkesykdommer som hjerteinfarkt, slag, leddgikt, sukkersyke, depresjon eller Alzheimer, har i de fleste tilfeller flere årsaksfaktorer og er forbundet med et eller flere gener som ikke alltid kommer til uttrykk hos bærere av genene.
Utvalget har i tabell 4.1 gjort rede for en forskjeller mellom monogene og komplekse sykdommer.
Tabell 4.1 Skjematisk oversikt over forskjellen på monogene og komplekse sykdommer
| Monogene (et gen) sykdommer | Komplekse sykdommer (gener og miljø) | |
|---|---|---|
| Arvegang | Et gen med stor effekt | Et eller flere gener som sammen med tilfeldige eller spesifikke miljøfaktorer leder til sykdom |
| Miljøets betydning | Liten eller ingen | Oftest usikker, moderat til stor Spesifikk og/eller ikke spesifikk Miljøfaktorer kan være hovedårsak til sykdom |
| Debut alder | Tidlig | Alle aldre |
| Sykdom | En eller få | Usikkert, en eller flere |
| Alvorlighetsgrad | Alvorlig | Alle grader |
| Genfunksjon | Fører til sykdom | Kan ha både normale og positive funksjoner i tillegg til at det gir økt disposisjon for sykdom |
| Opphopning i familier | Sterk, følger kjente mønstre | Ofte opphopning, men ikke nødvendigvis Uklare mønstre |
| Muligheten for å identifisere genet med dagens statistiske og laboratoriemessige metoder | Meget stor | Liten |
| Aktuelle metoder for å identifisere genet | Koblingstudier i familier med sterk opphopning av sykdommen | Store befolkningsbaserte undersøkelser i kombinasjon med familiestudier. God oversikt over befolkningsstrukturen (homogen eller heterogen) |
| Biobanker | Ikke avgjørende, men nyttig | Stor betydning for å identifisere genetiske og miljømessige årsaker til sykdom |
Biobanker kan spille en vesentlig rolle for å komme videre i arbeidet med å finne årsaker til komplekse lidelser. Sammen med data fra befolkningsbaserte helseundersøkelser og fra helseregistrene, kan materialet i biobankene bli et viktig hjelpemiddel i slik forskning. Medisinsk fødselsregister samler opplysninger om alle fødsler i Norge, Dødsårsaksregisteret noterer alle dødsfall, og Kreftregisteret fører oversikt over alle tilfeller av kreft. I tillegg kommer opplysninger fra Folkeregisteret som gir mulighet for å se på slektskap, data fra andre sykdomsregistre, befolkningsundersøkelser, og undersøkelser om miljøfaktorer. Til sammen utgjør disse kildene til kunnskap en stor mulighet for å utvikle forskning om samspillet mellom gener og miljø.
4.11 Det humane genomprosjektet
Det humane genomprosjektet er grunnlaget for at vi nå har langt mer kunnskap om gener enn for 10-15 år siden. Prosjektet ble formelt startet i 1990, og er et internasjonalt forskersamarbeid i offentlig regi. Hensikten med prosjektet er å bestemme rekkefølgen av de ca. 3 milliarder basene som utgjør menneskets arvestoff (DNA), og på dette grunnlaget identifisere alle menneskets gener og deres varianter. Resultatene er tilgjengelige for alle via offentlig databaser og prosjektets forskere har forpliktet seg til å legge ut gener og basesekvenser innen 24 timer etter at de er kartlagt. Gjennom prosjektet skal det også utvikles nødvendig dataverktøy for bearbeiding av de enorme mengdene med informasjon som prosjektet produserer. Som et hjelpemiddel for å nå disse målene, har forskerne også bestemt den genetiske sammensetningen hos flere modellorganismer, slik som tarmbakterie, bananflue og mus. Et eget program er etablert for å utrede juridiske, etiske og sosiale spørsmål som prosjektet reiser (ELSI). Den opprinnelige tidsrammen var på 15 år, men på grunn av kontinuerlig teknologiutvikling, er tidsrammen kortet ned til 13 år. Etter at det private firmaet Celera i 1999 annonserte at de ville sekvensere genomet raskere enn det offentlige genomprosjektet, økte tempoet og investeringene i prosjektet voldsomt. I februar 2001 publiserte det humane genomprosjektet sine resultater i tidsskriftet Nature (International Human Genome Sequencing Consortium. Nature 2001; 409:860-922), og det private selskapet Celera publiserte samtidig sine resultater i tidsskriftet Science (Venter JC et al. Science 2001;291: 1304-1351). Selv om det gjenstår mye arbeid, representerer disse publikasjonene på mange måter det endelige resultatet av det humane genom prosjektet.
For å kunne identifisere hvilke gener eller kromosomområder som innvirker på de ulike egenskapene, er det viktig å kartlegge genetiske forskjeller mellom mennesker. En målsetning i den siste femårsplanen fra det humane genomprosjektet er derfor å kartlegge individuell variasjon i det humane genomet. Det er utviklet metoder for avdekke ulike typer av variasjon, den mest vanlige kalles ”single-nucleotide polymorphisms” (SNPs). Som navnet indikerer dreier dette seg om en en-base forskjell mellom to tilsvarende DNA-områder. En SNP forekommer ca. for hvert tusende basepar. Bruk av SNP’er er allerede et viktig verktøy for å identifisere gener som er assosiert med komplekse sykdommer eller effekter og bivirkninger av medikamenter. Slike sammenhenger er vanskelige å finne med konvensjonelle metoder for å identifisere gener, da hvert enkelt gen bare har en liten virkning på egenskapen. Det var et uttalt mål i det humane genomprosjektet at det skulle produseres et SNP kart som består av minst 100 000 SNP’er, men antallet offentlig tilgjengelige SNP’er er i skrivende stund allerede kommet opp i mer enn 1 million. Firmaet Celera har annonsert at deres database inneholder 2,8 mill SNP’er.
Synergi mellom bioteknologi og informasjonsteknologi
Gjennomføringen av det humane genomprosjektet hadde ikke vært mulig uten en parallell utvikling innenfor elektronisk databehandling. Genomprogrammet har utløst behov for dataløsninger på en rekke områder. I første omgang var det behov for utvikling av databaser som kunne håndtere store mengder sekvensinformasjon, både fra menneskets gener og fra andre organismer. Det er videre utviklet programvare for å kunne analysere og sammenligne store mengder sekvensinformasjon.
Dataverktøy har også vært et nøkkelord når det gjelder å øke kapasiteten og automatisere sekvenseringen. Avanserte robotsystemer er utviklet for å forenkle store deler av det tidkrevende forarbeidet som går forut for selve sekvenseringen. Sekvenseringsprosessen hvor baserekkefølgen i DNA skal leses ved en biokjemisk prosess og omformes til en ordinær bokstavtekst, er for lengst automatisert. Den tette koblingen mellom biokjemi og datateknologi kan best illustreres ved såkalte ”DNA-arrays” eller ”biobrikken”. Her tar man utgangspunkt i mikrobrikken som har vært avgjørende for utviklingen av dagens datamaskiner, og kobler flere tusen DNA-fragmenter til en brikke på ca. 1x1 cm. Ved hjelp av fluorescerende fargestoffer kan så en datamaskin analysere biokjemiske reaksjoner ved hvert enkelt DNA-fragment, når en biologisk prøve appliseres på brikken. Dette er en teknikk som kan benyttes for å undersøke om genene er ”skrudd på” slik at de uttrykker seg som DNA, RNA eller proteiner for flere tusen gener samtidig. Samme metodikk kan også benyttes for å påvise genetisk variasjon i et tilsvarende stort antall gener (for eksempel SNP’er).
4.12 Post genom tiden
Selv om den humane DNA sekvensen nå er tilgjengelig, gjenstår det en betydelig oppgave i å identifisere alle genene. Den største utfordringen er imidlertid å kartlegge funksjonen til hvert enkelt gen, samt å avdekke det nettverket som eksisterer mellom gener. Dette kalles funksjonell genomforskning. De store forskningsmiljøene i Norge har nylig gått sammen om å foreslå en ekstraordinær satsing på dette feltet gjennom det såkalte FUGE-prosjektet der de søker om ca. 300 millioner kroner årlig i fem til ti år (jf. pkt. 10.11.3). Selv om man foreløpig er i startfasen av den kunnskapsutviklingen som vil komme i kjølvannet av det humane genomprosjektet, må det understrekes at funksjonen for en rekke gener allerede er kjent og utnyttes i dagens medisin.
Kunnskap om de biokjemiske mekanismene som er involvert i sykdomsutvikling gir nye muligheter for forebygging og behandling. Sykdommer som i dag defineres ut fra kliniske kjennetegn, vil i større grad bli definert på grunnlag av de biokjemiske mekanismene som ligger bak sykdomsutviklingen. Fremtidige diagnoser vil derfor i større grad være basert på biokjemiske kjennetegn fremfor ytre kjennetegn. Resultatet blir mer presise diagnoser som kan stilles på et tidligere tidspunkt og behandles eller forebygges mer effektivt.
Farmakogenetikk er et område i rask utvikling. For et flertall av de vanligste legemidlene vil effekten være påvirket av genetiske komponenter. Farmasøytisk industri bruker derfor store summer på å identifisere gener eller genetiske profiler som er avgjørende for respons på ulike medikamenter. En del av befolkningen omsetter legemidler langsommere enn andre, og vil følgelig kunne få alvorlige bivirkninger ved vanlige doser. Ved å undersøke dette på forhånd kan man unngå at effektive legemidler som ikke ville blitt godkjent på grunn av bivirkninger, likevel kan benyttes når de kombineres med gentesting. Uttestingen av nye medikamenter blir også rimeligere hvis man bare inkluderer forsøkspersoner som man forventer vil respondere på det aktuelle medikament. Utvelgelse av de molekylære ”angrepspunktene” for nye medikamenter er en annen viktig del av den bioteknologiske forskningen innen farmasøytisk industri.
4.13 Befolkningsstudier
Interessen for samlinger med humant biologisk materiale øker. En vesentlig grunn til dette er at studier av store befolkningsgrupper kan gi kunnskap om hvordan gener leder til sykdom. I løpet av de siste fem årene er det tatt initiativ til flere omfattende forskningsprosjekter der man i privat eller offentlig regi samler helseopplysninger og biologiske prøver fra store grupper av mennesker for å studere genetiske faktorer ved sykdom. Målet er å forstå samspillet mellom gener og miljø, identifisere nye angrepspunkter for medikamenter, og utvikle bedre diagnostiske metoder og behandling. Utvalget har i pkt. 4.5 redegjort for noen av de største norske befolkningsstudiene som har samlinger med humant biologisk materiale.
Befolkningsstudier der man følger en gruppe mennesker over tid for å finne ut hvem som utvikler sykdom og hvem som forblir syke kalles kohort-studier. Kohort-studier er avgjørende for å få klarhet i årsaksforholdene. Epidemiologiske studier kan også fortelle hvordan sammenhengen mellom risikofaktorer og sykdom er i hele befolkningen, ikke bare blant de som allerede er syke. Befolkningsbaserte undersøkelser kan også bidra med et stort antall pasienter innen hver sykdomskategori. For å komme videre i kartleggingen av forholdet mellom gener og sykdom er det nødvendig med studier som omfatter store grupper av mennesker.
Et problem i befolkningsstudier er imidlertid at man ofte ikke er i stand til å skille mellom genetisk disponerte og genetisk beskyttede individer. Dette svekker mulighetene for å finne ut hvilke miljøfaktorer som spiller en rolle for sykdommen man studerer. Kunnskap om genetiske disposisjoner vil gi helt nye muligheter for å identifisere og studere spesifikke miljøfaktorer, og å skille mellom genetiske og miljømessige årsaker til sykdom. Samlinger av biologisk materiale er en viktig kilde til studier av genetisk disposisjon.
4.14 Genetiske befolkningsstudier
I løpet av de siste fem årene er det tatt initiativ til å opprette flere store biobanker og helsedatabaser med tanke på å gjennomføre genetiske befolkningsstudier i andre land. Biobanker med mulighet for genetiske analyser er en sentral del av alle disse studiene. Organisering og finansiering av prosjektene er dels offentlig og dels privat. Alle tar sikte på et samarbeid med legemiddelindustrien, men samarbeidsformene varierer sterkt. Produktene er kunnskap, publikasjoner, patenter, databaser som man kan abonnere på, oppbygging av informatikk-systemer for helsetjenesten og forskningsmiljøer, diagnostiske hjelpemidler, medikamenter og utprøving av legemidler. Foreløpig er det først og fremst utvikling av databaser og informatikk-systemer som ser ut til å være den salgbare varen.
Genetiske befolkningsstudier berører viktige problemstillinger omkring forholdet mellom offentlig og privat, informert samtykke, rettigheter og kommersialisering av forskningsresultater. I det videre skal utvalget presentere noen utenlandske prosjekter for å belyse ulike løsninger på disse problemstillingene.
4.14.1 UK Population Biomedical Collection
Våren 2000 presenterte det medisinske forskningsrådet i Storbritannia (Medical Research Council) og den selvstendige stiftelsen Wellcome Trust, med støtte fra helsedepartementet, en plan for hvordan de ønsker å bygge opp en stor nasjonal helseundersøkelse og biobank. 7 Det overordnede målet med studien er å finne årsaker til vanlige sykdommer som rammer voksne. Ekspertgruppen som har utarbeidet planene anbefaler en stor prospektiv (følger individer over tid) studie for å undersøke genetiske og miljømessige risikofaktorer, og samspillet mellom gener og miljø. Ønsket er å verve 500 000 deltagere i alderen 45 til 64 år, og deltagerne skal rekrutteres gjennom helsetjenesten. Kostnadene ved å følge opp deltagerne i fem år er beregnet til 31,5 millioner pund. Summen omfatter ikke genotyping av deltagerne. Ekspertgruppen mener at dette prosjektet i løpet av ti år vil kunne gi vesentlig informasjon om blant annet hjerte- og karsykdommer, kreft, reumatiske lidelser, og diabetes. Det vil i tillegg gi kunnskap om normal genetisk variasjon i befolkningen. På lengre sikt vil studien bidra til at man kan finne ut mer presist hvem som har høy risiko for ulike lidelser, utvikling av ny behandling og forebygging.
Prosjektet går under navnet The UK Population Biomedical Collection og fikk blant annet massiv økonomisk støtte fra den britiske regjeringen høsten 2000. Studien er i utgangspunktet offentlig finansiert og organisert. The UK Population Biomedical Collection vil ha et nært samarbeid med legemiddelindustrien, men hvilken form forholdet skal ta er ikke avklart. 8
En av begrunnelsene for prosjektet er at det vil være en enestående ressurs for å opprettholde og styrke den britiske legemiddelindustrien. Kunnskap om genetisk variasjon vil øke mulighetene for å tilpasse medikamentell behandling individuelt i større grad enn det som skjer i dag. Slik kan både sikkerheten og effektiviteten av medikamentell behandling økes.
Databasen skal anonymiseres, og det skal utvikles vitenskapelige kriterier for tilgang til data som er uavhengige av finansieringskilde. Avtaler med industrien skal være formaliserte og må spesifisere hvordan intellektuelle rettigheter (opphavsrett og patentering) skal håndteres.
Parallelt med planene for studien har det britiske forskningsrådet utviklet nye retningslinjer for biobanker og for behandling av personopplysninger i medisinsk forskning. 9 Forslaget til retningslinjer har vært ute til høring og tilgjengelig for kommentarer på internett inntil nylig, men er foreløpig ikke vedtatt. I forslaget inngår det at et informert samtykke fra deltagerne må åpne for uforutsett bruk innenfor visse grenser, at det skal etableres en etikk-komite som skal overvåke prosjektet, at man skal unngå at kommersielle aktører som ønsker tilgang til studien kan kjøpe seg enerett til kjerneressursene, og at man skal unngå at firmaer som søker patentering kan komme til å begrense den øvrige bruken av data eller biologiske prøver.
Dokumentet understreker at konsultasjon med befolkningen i form av offentlig debatt, samtaler med organisasjoner og enkeltpersoner er avgjørende for at prosjektet skal kunne gjennomføres. Studiens ledere pålegges et ansvar for å sørge for konsultasjon, samarbeid og forståelse i befolkningen for prosjektet, og for tilliten til medisinsk forskning. Dette arbeidet omfatter også utforming av selve studien, organisering og regelverk. Overhuset i det britiske parlamentet har gitt sterk støtte til prosjektet, og foreslår at det blir opprettet et selvstendig organ ,the Medical Data Panel, som skal sikre interessene til de individer som avgir opplysninger og vev til genetiske databaser. 10
4.14.2 deCODE genetics
Firmaet deCODE genetics etablerte seg på Island i 1996 for å gjennomføre genetiske befolkningsstudier. Ideen er å identifisere sykdomsgener, nye angrepspunkter for medikamenter, og diagnostika. Man ønsker videre å benytte informasjonsteknologiske hjelpemidler for å få kunnskap om helse og sykdom, og å bruke denne kunnskapen til å utvikle og selge produkter og tjenester til den internasjonale helsetjenesteindustrien. 11 Startkapitalen i 1996 var 12 millioner amerikanske dollar. Gjennom en avtale med det sveitsiske legemiddelfirmaet Hoffman LaRoche i 1998 fikk deCODE garantier om 200 millioner dollar knyttet til forskning på tolv vanlige sykdommer, og i forbindelse med børsnotering på NASDAQ sommeren 2000 ble det hentet inn ytterligere midler. Det er nå ca 500 personer ansatt i firmaet, hvorav mange er høyt utdannede islendinger som har flyttet tilbake til hjemlandet for å arbeide i deCODE. Selskapet har annonsert at de har lokalisert og identifisert gener som har betydning for flere vanlige sykdommer som slag, schizofreni og slitasjegikt, og de har søkt om flere patenter. Foreløpig har deCODE ikke publisert detaljer om sine genetiske funn i vitenskapelige tidsskrifter.
Forskningen benytter tre kilder til informasjon. Den ene er blodprøverfra pasienter og familiemedlemmer, den andre er data fra en nasjonal slektsdatabase, og den tredje er informasjon om sykdom og risikofaktorer fra helsetjenesten som skal samles i en sentral helsedatabase. deCODE har innhentet blodprøver av omkring 30 000 islendinger og har analysert deres arvestoff. Personer som deltar i undersøkelser i regi av deCODE gir skriftlig informert samtykke, og biobanken deCODE på denne måten bygger opp, reguleres av den islandske loven om biobanker som ble vedtatt i mai 2000 (jf. pkt. 9.2). Informasjon om slektskap mellom pasienter er fritt tilgjengelig gjennom den nasjonale slektsdatabasen. Denne informasjonen gjør kartleggingen av sammenhengen mellom gener og sykdom enklere.
I 1998 vedtok Alltinget på Island en lov om å etablere en sentral helsedatabase. deCODE fikk lisens til å bygge opp helsedatabasen i 2000, og har etter dette inngått samarbeidsavtaler med sykehus og primærhelsetjenesten. Den sentrale helsedatabasen skal bygges opp slik at det vil være mulig å koble helsedata med genetisk informasjon i biobanken og slektskapsdatabasen. Kobling kan bare skje etter godkjenning av hvert enkelt forskningsprosjekt i Den nasjonale bioetiske komite. Personer som gir blodprøver til biobanken kan velge mellom ulike former for samtykke. Deltageren kan velge mellom et samtykke som er begrenset til et spesifisert forskningsprosjekt, eller et mere generelt samtykke der deltageren tillater bruk av blodprøven i fremtidige studier som er godkjent av Den nasjonale etiske komiteen. Kobling av genetisk informasjon fra biobanken til informasjon i helsedatabasen vil kun finne sted etter at det er gitt samtykke til slik forskning i forbindelse med at blodprøvene blir tatt. All kobling skjer i Datatilsynet. Personidentifiserbare data er kryptert, og det er utviklet meget avanserte sikkerhetssystemer for å ivareta personvernet.
Lisensen fra myndighetene gir deCODE enerett til kommersiell utnyttelse av informasjonen i den sentrale helsedatabasen i 12 år.
Firmaet har ikke enerett til å samle biologiske prøver til biobanker i Island, og heller ikke enerett til forskning eller annen utnyttelse av data fra den sentrale helsedatabasen når denne er bygget opp. Andre forskere har rett til å søke om å bruke opplysninger fra helsedatabasen til annen forskning. Oppbyggingen og bruken av helsedata og av biobankene overvåkes nøye av en ekstern komite og Den nasjonale bioetiske komite, og reguleres av de nevnte lovene. Hvis deCODE ikke overholder loven kan firmaet straffes, og miste lisensen. Loven om helsedatabasen gir alle anledning til å avstå fra registrering og å trekke seg fra den sentrale helsedatabasen. Dette forutsetter imidlertid at den enkelte selv må gi beskjed om at han eller hun ikke ønsker å være med. Hittil har mer enn 8000 personer gitt beskjed om at de ikke ønsker å være registrert i databasen.
Det har vært en omfattende diskusjon om deCODE og loven om den sentrale helsedatabasen i Island og internasjonalt. Prosjektet skiller seg fra tradisjonell epidemiologisk forskning i Norden ved at det er et privat firma som bygger opp den sentrale helsedatabasen på lisens fra staten, i stedet for at staten setter oppdraget ut til et offentlig organ. I tillegg har det ikke vært tradisjon for at man kan trekke seg fra helseregistre i Norden, mens det har vært anledning til ikke å delta i forskningsprosjekter. I Norge er registrering i enkelte helseregistre obligatorisk. Dette gjelder blant annet fødsels- og dødsårsaksregisteret. Produktene deCODE tilbyr er foreløpig kunnskap om sykdomsgener, abonnement på databaser, og informatikksystemer.
4.14.3 Framingham Genomic Medicine
The Framingham Heart Study er en av de mest kjente befolkningsstudier internasjonalt. Studien har vært en viktig kilde til den kunnskapen vi nå har om årsakene til hjerte- og karsykdommer. Undersøkelsen startet i 1948 i byen Framingham utenfor Boston i USA. Framingham hadde den gang ca 25 000 innbyggere. I dag er det omkring 75 000 innbyggere. Den første gruppen ble fulgt med undersøkelser hvert andre til tredje år, etter hvert ble deres etterkommere inkludert. Nå er forskerne i ferd med å undersøke tredje generasjon. Planen er å følge opp de opprinnelige deltagerne og deres etterkommere.
Oppslutningen i befolkningen er nesten 100 prosent. Studien omfatter nå flere sykdommer, og genetiske analyser har vært utført i flere år. Studien er offentlig finansiert med midler fra National Institutes of Health, og den er offentlig organisert av forskere knyttet til forskningssenteret lokalt i Framingham og til Boston University.
Våren 2000 opprettet Boston University et kommersielt selskap med navnet Framingham Genomics Medicine. Planen var å utnytte data og biologiske prøver fra Framingham-studien. Boston University skulle eie 20 prosent av aksjene, resten skulle legges ut til investorer. Selskapet reiste 20 millioner dollar, men er nå nedlagt. Årsaken er sannsynligvis at Boston University ikke kom til enighet med National Institutes of Health om rettighetene, og at initiativtakerne ikke hadde tatt tilstrekkelig hensyn til befolkningen og forskerne i Framingham. 12
4.14.4 First Genetic Trust
Selskapet First Genetic Trust ble etablert i oktober 2000 med sikte på å forvalte biologisk materiale og tilhørende genetisk informasjon på en betryggende måte. 13 En av de viktigste hindringene for utvikling av farmakogenetikk og genetisk epidemiologi er bekymringen for personvernet. First Genetic Trust tar sikte på å løse dette problemet. Ideen er at enkeltpersoner skal kunne opprette konti i selskapet i form av innskudd av biologisk materiale. Disse vil inneholde personopplysninger, helseopplysninger og genetiske opplysninger. Kontoen eies av individet, men oppbevares og forvaltes av First Genetic Trust. Opplysningene skal krypteres og i genetiske studier skal informasjonen være anonym. Koden skal oppbevares av First Genetic Trust.
På oppdrag fra legemiddelindustrien, bioteknologiske selskaper og andre skal firmaet innhente nytt samtykke til ny bruk. I tillegg vil firmaet selv analysere DNA, både fordi de ønsker å ha den beste teknologien for slike analyser og fordi de mener dette øker datasikkerheten. IBM skal samarbeide med First Genetic Trust for å utvikle informasjonsteknologi og systemer for datasikkerhet.
Styreformann og direktør Arthur Holden er samtidig styreformann i det såkalte SNP Consortium som er en sammenslutning mellom elleve farmasøytiske firmaer, flere offentlige institusjoner med tilknytning til det humane genomprosjektet, IBM og Motorola. Legemiddelfirmaet Glaxo Smith Kline er meget positive til First Genetic Trust, og de to firmaene samarbeider om å finansiere en akademisk studie av de etiske aspektene ved denne typen organisering av genetisk forskning.
4.14.5 UmanGenomics
Selskapet UmanGenomics ble stiftet i 1999 i Umeå i Sverige. Målet for virksomheten er å identifisere sykdomsgener og derigjennom gi den farmasøytiske industrien et utgangspunkt for å utvikle nye medikamenter. Selskapet er 51% offentlig eid av fylkeskommunen og Universitetet i Umeå.
Utgangspunktet for virksomheten er en biobank som er bygget opp gjennom en stor lokal helseundersøkelse, Västerbottens Hälsoundersökningar, som har gått over 15 år. Den medisinske biobanken inneholder mer enn 61 000 prøver i tillegg til svar på spørreskjemaer og kliniske data som hentes inn fra helsetjenesten.
Avtalen med Universitetet og Västerbotten Läns Landsting sikrer UmanGenomics tilgang til data og blodprøver. UmanGenomics har eksklusiv rett til markedsføring av kunnskap som kommer ut av dette materialet. 14 Personer som inngår i undersøkelsene avgir skriftlig informert samtykke, og prøver og opplysninger som inngår i prosjektet er beskrevet som en donasjon. Deltagere kan velge mellom å gi samtykke til et spesifisert prosjekt eller å gi et generelt samtykke som tillater at blodprøven og data blir brukt i undersøkelser som er godkjent av en etisk komite. Det er mulig å trekke seg fra prosjektet når som helst. Parallelt med etableringen av UmanGenomics i 1999 utviklet den svenske legeforeningen etiske retningslinjer for biobanker, jf. nærmere om dette i pkt. 9.3.2.
4.14.6 Eesti Geenikeskus – Estonian Genome Project Foundation
The Estonian Genome Project Foundation er en statlig ikke-kommersiell organisasjon som skal eie databasen og biobanken Estland vil bygge opp for å styrke forskning og næringsutvikling i landet. 15 Prosjektet tar sikte på å kartlegge gener og studere samspillet mellom gener og miljø. Målet er å rekruttere 75% av landets 1,4 millioner innbyggere. Et pilotprosjekt som omfatter 10 000 mennesker er allerede i gang.
I motsetning til lignende prosjekter i andre land vil Estland gi tilgang til opplysningene i data- og biobanken til den enkelte. 16 Det er utformet utkast til en lov som skal regulere virksomheten, og det er etablert et firma som skal selge tilgang til informasjon. Analyse av DNA må i stor grad foregå i Estland fordi loven vil forby utførsel av DNA uten spesiell tillatelse fra det estiske Sosial- og Helsedepartementet.
Den estlandske stat inviterte høsten 2000 internasjonale investorer for å presentere prosjektet som er beregnet å koste mellom 100 og 150 millioner amerikanske dollar totalt. Det er sterk politisk støtte for prosjektet i Estland, og det har vært liten offentlig debatt eller motstand mot det.
4.14.7 Andre prosjekter
I tillegg til disse mest kjente prosjektene er det etablert mange mindre kjente genetiske befolkningsundersøkelser. Firmaet Gemini 17 fra Cambridge i England (nå USA) har etablert et prosjekt i den Canadiske provinsen Newfoundland og Labrador, som går under navnet Newfound Genomics. Det bor omkring 550.000 mennesker i provinsen.
Det australske selskapet Autogen har etablert et prosjekt på øya Tonga i Stillehavet spesielt med sikte på å finne gener som har betydning for overvekt, diabetes og hjerte- og karsykdom.
Selskapet Genomics Collaborative har gått sterkt ut internasjonalt for å få tilgang til befolkningsbasert helseinformasjon og blodprøver som de vil anonymisere og tilby til forskere og farmasøytisk industri. 18
I tillegg er det mange offentlig finansierte befolkningsundersøkelser som fokuserer stadig mer på genetiske risikofaktorer, med tanke på å identifisere både genetiske og miljømessige årsaker til sykdom. Dette gjelder for eksempel den danske og den norske Mor og Barn undersøkelsen, og det gjelder studier knyttet til tvillingregistre i Norden, USA, Australia, Storbritannia og Nederland.
4.15 Bør det etableres en norsk forskningsbiobank?
Utvalget foreslår opprettelse av et biobankregister og et nettverk for biobanker for å organisere og føre tilsyn med biobankvirksomheten i Norge bedre. Et overordnet spørsmål er om Norge bør legge forholdene til rette for å etablere en stor forskningsbiobank for å styrke genetisk epidemiologisk forskning og næringsutvikling, slik man har gjort blant annet i Storbritannia, Island og Estland. En stor norsk forskningsbiobank kan organiseres og finansieres privat eller offentlig, eller som et samarbeide mellom private og offentlige aktører. Biobankvirksomhet vil utgjøre bare en del av et slikt prosjekt. Utvalget har ikke tatt standpunkt til dette spørsmålet.
4.16 Næringsutvikling
4.16.1 Bakgrunn
I løpet av 1960-årene ble det klart at Norge hadde en svært verdifull ressurs i form av olje- og gassforekomstene i Nordsjøen. På den tiden hadde vi liten eller ingen kompetanse på olje- og gassutvinning, og avtaler med internasjonale selskaper for å komme i gang med leting og utvinning ble inngått. I denne fasen var det avgjørende å sikre nasjonal kontroll av virksomheten, og å bygge opp norsk kompetanse på området. I 1972 besluttet Stortinget å opprette Oljedirektoratet og Det norske statsoljeselskap a.s. (Statoil) for å ivareta henholdsvis forvaltningsfunksjonen og forretningsfunksjonen. I den tidlige fasen var det stor skepsis i befolkningen, blant annet på grunn av miljøtrusselen og sikkerheten for personellet ved installasjonene.
Uten å trekk denne parallellen for langt, er det noen av de samme utfordringene vi i dag står ovenfor i forhold til en forsvarlig næringsmessig utnytting av de norske biobankene. Biomedisinsk industri har et svært begrenset omfang i Norge. Som nasjon bruker Norge også relativt lite på forskning og utvikling sammenliknet med OECD-gjennomsnittet, 1,7 % av BNP mot OECD-gjennomsnittet på 2,3 %. Det er særlig liten forskningsaktivitet i de private bedriftene som forklarer den lave prosentsatsen for Norges vedkommende. En internasjonal evaluering av norsk biologisk forskning konkluderte nylig med at både omfang og kvalitet var vesentlig lavere enn i de fleste andre europeiske land. For å utnytte det potensialet for kunnskaps- og produktutvikling som ligger i våre biobanker, vil vi derfor være avhengige av kompetanse fra andre land. Samtidig ønsker vi at dette skal føre til etablering av sterke nasjonale miljøer, og at vi beholder nasjonal kontroll over biobankene. Befolkningens tillit og interesse er en avgjørende forutsetning for at vi i Norge skal kunne satse på medisinsk forskning og næringsutvikling basert på biobanker.
4.16.2 Privat medvirkning
Utviklingen innen molekylærgenetikk og annen bioteknologi har forandret både omfang og type informasjon som kan hentes ut fra biobanker. Utviklingen innen datateknologi har ført til at informasjon om enkeltprøver i biobankene kan systematiseres og sorteres i et helt annet omfang enn tidligere.
Fra å være et område hvor tilgangen på data har vært begrensningen, er det nå en overproduksjon av data i forhold til tilgjengelig programvare og kvalifisert personell til å analysere dataene (bioinformatikk). Med god tilgang på risikovillig kapital er det likevel mulig å kjøpe nødvendig teknologi til å gjennomføre omfattende genetiske studier. Gode forskningsmaterialer i form av informasjon om diagnoser og systematiserte biologiske prøver (biobanker) kan imidlertid være en reell begrensning. Dette er noe av bakgrunnen for at biobankene nå vies stor interesse både fra offentlige og private forskningsinstitusjoner.
Et viktig formål med regulering av biobanker er å legge til rette for at biobankene skal brukes til utvikling av produkter som kan gi bedre forebygging og behandling av sykdom. Gode helseregistre og systematiske samlinger av humant biologisk materiale gjør at forholdene i Norge ligger godt til rette for forskning og næringsutvikling innenfor dette området. Dette forutsetter at hensynet til personvern og etikk ivaretas på en betryggende måte.
Produktutvikling av denne typen er kapitalkrevende og skjer hovedsakelig i regi av biomedisinsk industri, som i tillegg til forsknings- og produksjonserfaring også har et utviklet markedsapparat. Majoriteten av de norske biobankene er i offentlig besittelse. For å oppnå en høy forskningsaktivitet og at forskningsresultatene raskt blir integrert i praktisk medisin, er en avhengig av betydelig privat medvirkning, ikke minst på forskningssiden. En videreutvikling og styrking av samarbeidet mellom næringsliv og forskning innen medisinsk bioteknologi kan bidra til å utvikle eksisterende bedrifter og til å få flere nyetableringer, samtidig som den medisinske kompetansen generelt øker.
Samarbeid mellom biobanker og forskningsinstitusjoner/biomedisinsk industri kan organiseres på forskjellige måter. Noen grunnleggende prinsipper bør likevel utgjøre en ytre ramme for slik organisering. Prinsippene gjelder primært bruk av biologisk materiale, men kan også ha relevans for data som er generert fra materialet.
4.16.3 Tilgang
Biomedisinske bedrifter som ønsker tilgang til biobankene vil ofte være internasjonale selskaper med høy kompetanse innen bl.a. forskning, produktutvikling, patenter, lisenser, produksjon, markedsføring og økonomi. På den måten vil de miljøene som besitter en biobank kunne bli tilført både verdifull kunnskap og finansiell styrke. Samtidig stiller dette store krav til de som skal forhandle på vegne av biobanken (-e) i en innledende fase. Det er derfor nødvendig å profesjonalisere denne funksjonen, slik at forhandlingene blir mest mulig likeverdige og reelle. Disposisjonsrettigheter og andre fullmakter knyttet til den aktuelle biobanken må være avklart før forhandlinger kan starte. Dersom den enkelte biobank ikke besitter slik kompetanse selv, bør det være mulig å la andre forhandle på vegne av biobanken. Da bruken av materialet også i en næringsmessig sammenheng vil være forskningspreget, må slike samarbeidsprosjekter forelegges de regionale forskningsetiske komiteer og Datatilsynet på vanlig måte.
Det kan være ønske om lokal forankring av et industrielt forskningsprosjekt, bl.a. fordi lokalsamfunnet hvor biobanken har sitt utspring ønsker å se resultater gjennom arbeidsplasser eller kompetanseoppbygging. Motivasjon for å avgi materiale til en biobank kan påvirkes av slike faktorer. Tilsvarende gjelder for pasientorganisasjoner som er involvert i prosjekter der personer med den aktuelle lidelsen avgir vev eller blod. Internasjonal biomedisinsk industri er ofte organisert med sentraliserte laboratorier, med en omfattende og kostbar instrumentpark. Det er derfor ikke realistisk at enhver slik samarbeidsavtale vil kunne føre til etablering av arbeidsplasser lokalt, men kanskje heller en styrking av eksisterende miljøer. Det er viktig at Norge som nasjon ikke ender opp som en ensidig råvareleverandør på dette feltet, men at våre biobanker benyttes aktivt for å tiltrekke og videreutvikle kunnskap og arbeidsplasser.
4.16.4 Samtykke
Informert samtykke bør ligge til grunn for næringsmessig utnyttelse av biobankene. I forhold til samtykkets bredde og varighet er det naturlig at de samme vilkår gjelder som ved annen bruk av biobanken. Utvalget viser i den forbindelse til kapittel 5 hvor de ulike samtykkeformer drøftes, samt også kapittel 6 hvor lovforslaget er inntatt.
4.16.5 Rettigheter
Det er mulig å gi private og offentlige aktører rett til næringsmessig utnyttelse av eksisterende biobankmateriale for tidsavgrensete perioder. Slik rett til næringsmessig utnytting av et materiale kan også selges. Dette skal imidlertid ikke være til hinder for at andre samtidig kan søke om å forske på andre problemstillinger innenfor det samme materialet.
Rettighetene til forskningsresultatene reguleres gjennom arbeidstageroppfinnelsesloven. Samtidig vil patentlovgivningen være aktuell for å sikre enerett til næringsmessig utnyttelse i næringsøyemed. Det er således forskjell på rettighetene knyttet til selve biobankmaterialet, rettighetene til forskningsresultatene og industriell utnyttelse av disse.
For fremtiden bør man klargjøre eventuell næringsmessig utnyttelse og samarbeid med industrien i forbindelse med at det blir opprettet en biobank. Den som er ansvarlig for biobanken kan søke om å få enerett til utnyttelse av materialet næringsmessig og forskningsmessig, og bør redegjøre for hvordan og i hvilken grad andre kan få tilgang til materialet for næringsmessige og/eller forskningsmessige formål.
Det er også viktig å sikre åpenhet og informasjon til de som har avgitt vev, til uavhengige kontrollorganer, og til det offentlige, om hva materialet benyttes til i næringsøyemed. Samtidig må man ta hensyn til at det kan være nødvendig med tidsavgrenset hemmelighold av spesifikke opplysninger for eksempel knyttet til patentsøknader, men dette bør etter utvalgets mening begrenses så mye som mulig.
4.16.6 Produkter
Biobankene kan bidra til næringsutvikling på ulike måter. På grunnlag av de produkter som bioteknologiske selskaper tilbyr i dag og den vitenskapelige utviklingen på feltet kan det gjøres følgende oppstilling, jf. tabell 4.2.
Tabell 4.2
| Type produkt | Beskrivelse og eksempler | Firmaer / institusjoner som tilbyr tilsvarende produkter |
|---|---|---|
| Råvarer | Samlinger av humant biologisk materiale selges som råvarer | Genomics Collaborative, Massachusets, USA, kjøper og selger blodprøver til genetiske analyser |
| Drift | Drift av biobanker settes ut på oppdrag fra myndighetene til kommersielle aktører | UmanGenomics, Sverige |
| Samtykke | Innhenting av informert spesifikt samtykke | First Genetic Trust, USA |
| Sikkerhetssystemer | Kryptering, kobling til andre data | First Genetic Trust, USA |
| Laboratorievirksomhet | DNA analyser, andre analyser for helsetjenesten, forskningsinstitusjoner og industrien | First Genetic Trust |
| Tjenester for enkeltpersoner | Forvaltning av samtykke, bruk av vev til forskning og produktutvikling, opplysninger til den enkelte om analyseresultater, innskudd av stamceller til eget bruk | |
| Forskning | Forskningsresultater: for eksempel validering av angrepspunkter for medikamenter, analyse av behandlingsresultater ved ulike former for kreftbehandling, helsetjenesteforskning, påvisning av sammenheng mellom et gen og en vanlig sykdom | deCODE, Island manGenomics, Sverige |
| Diagnostika | Utvikling av diagnostika : for eksempel test for brystkreftgenene BRCA1 og BRCA2 | Myriad genetics, USA deCODE, Island |
| Terapi | Behandling: for eksempel blodprodukter i blodbankene, dyrket vev fra stamcellebanker Legemidler | |
| Patenter | Patenter: for eksempel beskrivelse av et gen som er avgjørende for omsetning av legemidler | |
| Databaser | Abonnement på ”kurerte” (velpleide, brukervennlige, oppdaterte) databaser: for eksempel ekspresjonsanalyse av brystkreftceller I befolkningsbasert materiale | GeneLogic, USA Celera, USA deCODE, Island |
| Programvare | deCODE, Island | |
| Legemiddelutprøvninger | Kliniske utprøvinger av legemidler | |
| Eksperimenter | Eksperimentelle studier av legemiddelomsetning, effekt og bivirkninger | GlaxoSmithKline |
Utvalget mener at en eventuell lov om biobanker skal legge til rette for at Norge på en etisk forsvarlig måte kan utvikle kompetanse og infrastruktur slik at biobankene kan utvikle næringsvirksomhet basert på avanserte foredlede produkter, og ikke som råvarer (det vil si salg av samlingene som sådan). Regelverket må gi mulighet for næringsmessig bruk av biobanker, noe som også vil stimulere forskning og produktutvikling.
4.16.7 Modeller for næringsutvikling
Næringsmessig utvikling av biobanker kan organiseres på flere måter. Forvaltningsmodellen innebærer at et offentlig sykehus, laboratorium eller forskningsinstitusjon selv tar hånd om den næringsmessige utviklingen, for eksempel gjennom selskaper som Medinnova og lignende institusjoner. For industrien har det med denne modellen vært et problem at disposisjonsretten og ansvarsforholdene innen forskningsinstitusjoner og prosjekter ikke er klare nok, og at det ikke finnes tilstrekkelig forhandlingsstyrke eller erfaringer fra forhandlinger. Selskapsmodellen gir ofte større organisatorisk frihet og bedre muligheter for å få inn kapital til nye prosjekter. Ved denne modellen vil også disposisjonsrett og ansvarsforhold være mer avklart. Etter utvalgets vurdering bør den offentlige kontrollen skje gjennom lovverk, etiske komiteer og eventuelt egne tilsynsmyndigheter, ikke gjennom eierskap til biobanken. Dette utelukker ikke offentlig eierskap, men eierskapet bør ikke være den avgjørende kontrollmekanisme.
Gjennomgangen av internasjonale prosjekter innen genetiske befolkningsstudier i pkt. 4.14 gir eksempler på hvordan biobankvirksomhet organiseres.
Kunder
Kjøpere av produkter basert på biobankvirksomhet kan være offentlige eller private forskningsinstitusjoner, helsemyndigheter, industrien, pasientorganisasjoner eller enkeltpersoner. Kundene kan være fra Norge, fra andre land eller internasjonale firmaer eller organisasjoner.
Lokal, nasjonal og internasjonal virksomhet
Utvalget mener at humant biologisk materiale samlet i biobanker bør brukes til diagnostikk, behandling og forskning som stimulerer forskning og næringsutvikling i Norge og samtidig fremmer internasjonalt samarbeid. Samlinger av humant biologisk materiale skal derfor ikke selges som sådan, men private bedrifter eller offentlige institusjoner kan få tillatelse til å forvalte eller utnytte biobanker næringsmessig og forskningsmessig. Utvalget legger til grunn at etablering av en biobank basert på materialet fra norske innbyggere skal være underlagt norske regler og at virksomheten skal foregå i Norge. Videre forutsettes det at også forskning på biobankmateriale i utgangspunktet skal skje i Norge. Likevel vil det være unntak fra dette, for eksempel i forbindelse med internasjonale samarbeidsprosjekter og i prosjekter der det er mest hensiktsmessig at analyser og behandling av vevet skjer ved spesialiserte laboratorier i utlandet.
Fotnoter
Tallene må tas med et visst forbehold idet enkelte laboratorier ikke har besvart utvalgets spørreskjema. De langt fleste har besvart, men for flere av dem gjelder at det ikke har vært mulig å gi fullt ut eksakte tall. Dette skyldes blant annet at spesielt når det gjelder gammelt materiale hvor registreringen dels er manuell, har det av kapasitetsmessige grunner ikke vært mulig å foreta en fullstendig telling. Flere av laboratoriene har derfor måttet operere med anslagsvise tall for deler av materialet.
Det var særlig da den sørafrikanske legen Bernards to første hjertetransplantasjoner ved årsskiftet 1967-68 ble kjent for verden, at den offentlige og politiske debatt om transplantasjoner skjøt fart.
Opplysningene er hentet fra en nyhetsartikkel publisert på Rikshospitalets nettsider (www.rikshospitalet.no) 17. januar 2001.
For en mer detaljert og omfattende gjennomgang vises til ”Rapport fra arbeidsgruppe oppnevnt av Sosial- og helsedepartementet for å utrede behovet for fremtidige befolkningsrettede helseundersøkelser” som ble avgitt 29. juni 2000.
Presentasjonen av Janusbanken bygger i stor grad på Jellum, Egil m.fl.: ”Use of the Janus serum bank in cancer research” inntatt i Human biobanks – ethical and social issues (ed. Sorsa og Eyfjord), NORD 1997:9 s. 43-53.
For eksempel er det sannsynlig at mødre med misdannede barn husker bedre maten de spiste og hvilke medisiner de tok under svangerskapet enn de som har født barn uten misdannelser, kvinner med brystkreft husker sin p-pille biografi bedre enn de som ikke har utviklet brystkreft osv.
Meade T. et al. Medical Research Council /Wellcome Trust. Trust Expert Working Group on UK Population Biomedical Collections. Final Report: March 2000
www.wellcome.ac.uk/en/1/biovenpop.html
Medical Research Council Human Tissue and Biological Samples for use in Research. Report of the Medical Research Council Working Group to develop Operational and Ethical Guidelines. Published November 1999.
Ferriman A. House of Lords supports first UK genetic database. BMJ 2001;322:755 (31 March).
www.decode.com Getz L. Norrøn arv på New York-børsen. Tidsskrift for Den Norske Lægeforening 1998; 118:3666-9
Brown P. Framingham data not for sale. Nature Medicine 7;2:137, February 2001, Holmen J: Rapport fra besøk hos Framingham Heart Study, Mars 2001.
Hodge J. First Genetic Trust banks on genes. Nature Biotechnology 2000;18:1236
www.umangenomics.com
www.genomics.ee
Frank L. Population genetics: Estonia prepares for National DNA database. Science 290; 5489: 31 (Oct 6 2000). Frank L. Give and take – Estonia’s new model for a national gene bank. GNN 09.10.00
www.gemini-genomics.com
www.DNArepository.com