Del 2
Medisinsk og helsefaglig forskning
3 Hva kjennetegner god forskning?
3.1 God forskning – god helse
Helsevesenet skal forebygge, diagnostisere og behandle sykdom og legge forholdene til rette for helsebringende atferd i befolkningen. For å løse disse oppgavene er vi avhengige av kunnskap om sykdommers forekomst og årsaker, om hvordan vi kan påvise sykdom, og om hvordan sykdom kan behandles eller forebygges. Dessuten er det behov for å vite hvordan vi skal leve for å oppnå best mulig helse. Medisinsk og helsefaglig forskning gir oss denne kunnskapen.
Uten forskning hadde vi ikke kunnet behandle infeksjonssykdommer. Vi hadde ikke kjent sammenhengen mellom røyking og lungekreft, og vi hadde ikke kunnet påvise HIV-smitte, følge epidemiens utvikling eller opplyse om risikoatferd. Avanserte røntgenundersøkelser (slik som MR – magnetisk resonanstomografi), hjertetransplantasjoner og insulinpumper hadde fremdeles tilhørt fremtidsvisjonene. Men årsaken til en rekke sykdommer er fremdeles ukjent, og i mange tilfeller der vi kjenner årsaken, finnes det ikke god diagnostikk eller behandling. Mange behandlingsformer er ikke godt nok dokumentert: Redder behandling av rusmisbrukere liv? Hvor lang er den gjennomsnittlige levetiden etter vanlige kirurgiske inngrep, og hva skjer med pasientenes livskvalitet? Kan vi gi legemidler til barn, selv om disse bare har vært testet på voksne?
Medisinsk og helsefaglig forskning er viktig og nødvendig. God forskning er avhengig av god organisering, et hensiktsmessig regelverk, og et tilstrekkelig økonomisk fundament. God forskning fremmer god helse.
3.2 Kjennetegn ved forskningen
Forskning er produksjon av ny forståelse av virkeligheten gjennom bearbeidelse av fakta. Forskning er god i den grad den gir enkle utsagn med mest mulig generell gyldighet. Dette skal ingen ringere enn Albert Einstein (1879 – 1955) ha uttalt. Men det finnes ingen allmenngyldig definisjon på forskning. Derfor er det hensiktsmessig å se på hva som kjennetegner forskningen, og hvilke krav vi stiller til nyttig forskning. I kapittel 5 kommer vi nærmere inn på definisjonen av medisinsk og helsefaglig forskning, og hvordan vi kan avgrense forskning mot annen virksomhet. Vi vil også diskutere nærmere hvilke typer forskning som faller inn under utvalgets mandat.
3.2.1 Kreativ og systematisk
Forskning er kreativ virksomhet som utføres systematisk for å oppnå økt kunnskap. 1 Forskningen kjennetegnes altså av to motstridende egenskaper som samtidig utfyller hverandre: Forskeren må ha ideer, men hun eller han oppnår resultater først gjennom systematiske undersøkelser for å bekrefte eller avkrefte en hypotese, eller kartlegge en struktur.
Kreativitet forutsetter en viss grad av frihet. Samtidig er vitenskapen, som andre samfunnsområder, underlagt styring gjennom begrensinger og prioriteringer. Restriksjoner som er så omfattende at de begrenser forskningens mulighet til å utvikle resultater, kan hemme god forskning. For sterk styring kan hindre den frie forskningen og muligheten for tilfeldige, men viktige oppdagelser.
Vitenskapshistorien er full av eksempler på at tilfeldige funn har ført til resultater av avgjørende betydning for menneskeheten. Sir Alexander Flemings (1881 – 1955) oppdagelse av penicillin er blant de mest kjente: En dag i 1928 ryddet han laboratoriebenken og kom over noen skåler med bakterier som hadde stått fremme i flere uker. Det var mugg på en av skålene, og rundt denne muggen var det ingen vekst av stafylokokker. Muggsoppen tilhørte penicillin-familien. Fleming publiserte disse funnene i 1929, men først etter utbruddet av andre verdenskrig klarte man å utvikle penicillin til klinisk bruk.
3.2.2 Uavhengig, ærlig og fullstendig
Vi kan aldri forutsi resultatene av et forskningsprosjekt - da ville det ikke vært forskning. Likevel vil oppdragsgiveren (det være seg legemiddelindustri, helsemyndigheter eller andre) eller forskeren selv, av og til forvente eller ønske et bestemt resultat. Det kan dreie seg om troen på at et legemiddel er bedre enn et annet, eller at et bestemt tiltak har helsefremmende effekt. Resultatet kan ha økonomisk eller politisk betydning for flere av de impliserte. Et kjennetegn ved forskning er at slike forventninger ikke skal påvirke hvordan undersøkelser gjennomføres. Samfunnet forventer dessuten at forskeren offentliggjør resultatene fullstendig og uavhengig av utfallet. En slik ærlighet og åpenhet forutsetter at forskningen (og forskerne) ikke kan påvirkes av finansieringskilden, oppdragsgiveren eller andre som kan ha interesse av hva resultatene blir.
Å la være å snakke usant er en del av allmennmoralen. Men ærlighetskravet i vitenskapelige sammenhenger er strengere, skriver filosofen Knut Erik Tranøy 2 : ”Når du legger frem data og argumenter i en sak, skal alt med, også det som taler mot din egen tese… Dette kan gjøre det berettiget å bruke et litt gammeldags ord som ”sanndru”: det passer på den som søker og elsker sannheten.” Uavhengighet, ærlighet og fullstendighet er fundamentale verdier i all forskning. Forskningen skal ikke skjule, fordreie eller forfalske resultater. Helsemyndigheter og andre som har behov for/ønsker om det, skal ha rett til innsyn i forskningen, og publikum skal kunne stole på at viktige resultater blir offentliggjort.
3.2.3 Publisering og formidling
Resultatene av forskningen må formidles videre fra produsentene (forskerne) til brukerne (helsepersonell, pasienter, publikum etc.). For ethvert vitenskapelig arbeid gjelder at det først oppnår betydning når resultatene er publisert. Resultater av medisinsk og helsefaglig forskning publiseres vanligvis som artikler i vitenskapelige tidsskrifter. I de fleste slike tidsskrifter vurderer personer med gode kunnskaper om det aktuelle fagområdet, manuskriptene før eventuell publisering. Slik fagfelle-vurdering (referee-vurdering) sikrer at innholdet er av god nok kvalitet, og at forskerne har fulgt gjeldende retningslinjer for god forskningsskikk. Antall artikler og i hvilke tidsskrifter disse er publisert, veier tungt når forskere skal ansettes eller søke midler til videre forskning. Publisering er derfor både i samfunnets og i forskerens interesser.
Vitenskapelige tidsskrifter leses i første rekke av forskerne selv, dernest av helsepersonell. For at resultatene skal nå samfunnet for øvrig, må forskerne formidle resultatene også til andre organer (for eksempel media eller helsemyndigheter). Forskningsformidling er en forpliktelse for universiteter og høyskoler på linje med forskning og undervisning. Det er behov for at forskere holder populariserte foredrag for pasientgrupper, skriver lærebøker og deltar aktivt i samfunnsdebatten.
De siste årene har vi sett en økt satsing på organisert oppsummering og videreformidling av norsk og internasjonal forskning. Dette har blant annet resultert i opprettelsen av Nasjonalt kunnskapssenter for helsetjenesten. 3 Slik oppsummerende og formidlende virksomhet skal sørge for at kvalitetssikret og dokumentert kunnskap kommer alle til gode.
3.3 Hovedkrav til forskningen
Over har vi skissert noen grunnleggende egenskaper ved forskningen som kan brukes til å skille denne fra andre virksomheter. Men selv om forskningen er kreativ, systematisk og fullstendig, og formidles videre, sier ikke dette nødvendigvis noe om hvorvidt forskningen er god. Det er vanlig å operere med tre krav til god forskning: Den skal ha høy kvalitet , den skal være tilstrekkelig original , og den skal være relevant .
3.3.1 Kvalitet
Forskning av høy kvalitet forutsetter gode og akseptable metoder. Forskningens kvalitet bestemmes av om studiens oppbygning kan belyse spørsmålstillinger og hypoteser - innenfor etiske akseptable rammer.
Eksperimentet er det designet som tradisjonelt er blitt betraktet som ”gullstandard” for medisinsk forskning. Grunnen er at et eksperimentelt design gjør det mulig å trekke slutninger om årsaks- og virkningsforhold. Når mennesker skal delta i eksperimenter, benyttes som regel randomiserte, kontrollerte forsøk. Randomisert vil si at fordelingen til ulike grupper skjer tilfeldig (for eksempel der en gruppe får legemiddel A og en annen legemiddel B). Kontrollert vil si at man holder kontroll over alle forhold bortsett fra det man ønsker å studere. Ofte er det ikke mulig å gjennomføre et slikt eksperiment: Vi kan tenke oss at vi ønsker å få et sikkert svar på om røyking forårsaker lungekreft. Det ’beste’ ville være å la et stort antall personer røyke 30 sigaretter om dagen i 30 år, og sammenlikne disse med en gruppe som ikke får lov til å røyke. Dette er selvsagt etisk helt uholdbart.
Forskerne må derfor ofte lete etter modeller som kan erstatte eksperimenter der mennesker deltar. I stedet for å tvinge noen til å røyke, må vi sammenlikne dem som allerede røyker med dem som ikke gjør det, og forsøke å justere for effekten av andre forskjeller mellom gruppene. Eller vi kan erstatte mennesker med dyr. I vår tid aksepterer vi større helserisiko og mer lidelse for dyr enn for mennesker, men også dyreforsøk krever at forskeren følger retningslinjer for hva som er akseptabelt.
Innen medisinsk og helsefaglig forskning gjennomføres i økende grad forskning av kvalitativ karakter, enten som supplement til eller som alternativ til kvantitativ forskning. 4 Metodisk mangfold innen medisin og helsefag reflekterer fagenes bredde og ulike typer av problemstillinger som krever ulike tilnærminger. Kvalitativ forskning har andre metodiske krav både med hensyn til utvalgsstørrelse og analyse og tolkning av data. Men samtidig er det viktig å presisere at kravet til metodekvalitet er like sterkt innen kvalitativ forskning. Mens det innen kvantitativ forskning kreves store og representative utvalg for å kunne finne statistisk signifikante resultater som kan generaliseres, er det i kvalitativ forskning viktig å tilstrebe et strategisk utvalg som vil kunne belyse fenomenet som studeres på best mulig måte. Her er ikke antallet viktigst, men informantenes egenskaper i forhold til problemstillingen som ønskes belyst. Målet er heller ikke å kunne generalisere resultatene i tradisjonell forstand, men å få en større forståelse for individuelle uttrykk sett i en bestemt sammenheng.
Innenfor grunnforskningen kan det være nødvendig å utvikle nye metoder for å studere for eksempel oppbygningen av et bestemt protein, eller hvordan et virus infiserer en celle. Metoden kan i slike tilfeller være et like viktig vitenskapelig fremskritt som det metoden er utviklet for å studere.
3.3.2 Originalitet
Forskningens formål er å frembringe ny kunnskap. Det betyr ikke at ethvert forskningsprosjekt må ta utgangspunkt i et spørsmål eller en hypotese som ikke er testet tidligere. Tvert imot må de samme problemstillingene gjerne undersøkes flere ganger, fordi vi må kunne bekrefte resultatene i flere studier for å være sikre på at det som kommer frem er ”sant”. Dette kommer an på forskningens art. Det er for eksempel ikke nødvendig å kartlegge aminosyresekvensene av et bestemt enzym flere ganger. Derimot er det behov for å undersøke forekomsten av brystkreft og eventuelle risikofaktorer i flere befolkningsgrupper, eller i den samme gruppen flere ganger, for å kartlegge sammenhengen mellom miljøfaktorer og brystkreft.
Det er heller ingen motsetning mellom å være original, og å utfordre eksisterende oppfatninger om hva som er ”sant” eller ”riktig”. Tvert imot – dette er en av forskningens viktigste oppgaver. Det finnes mange eksempler på at forskere har snudd opp ned på det vi har betraktet som etablert kunnskap.
Før lærte alle medisinstudenter at magesår skyldtes overproduksjon av syre som følge av blant annet høyt psykisk stress. Lærdommen ble befestet av at legemidler som reduserte syreproduksjonen i magen midlertidig kunne kurere sykdommen. I 1979 oppdaget den australske legen Robin Warren at nesten alle pasienter med magesår hadde en spesiell bakterie i magesekken. Bakterien har senere fått navnet Helicobacter pylorii. Behandling med antibiotika kunne, i motsetning til syrehemmende behandling, helbrede pasientene. I dag får alle pasienter med magesår slik antibiotikabehandling. 5
3.3.3 Relevans
I utgangspunktet er all ny viten interessant, fordi den tilfredsstiller menneskenes grunnleggende nysgjerrighet. Derfor kan det være vanskelig å si hva som bestemmer forskningens relevans. Det er for eksempel ikke alltid irrelevant å forske på utryddede sykdommer. Forskere arbeider fremdeles med kopper, som ble utryddet for over 20 år siden, fordi sykdommen representerer en terrortrussel. Noen vil hevde at resultatene bør ha en viss praktisk nytte, men dette avhenger igjen av hvilken type forskning vi snakker om. I mange tilfeller vil det ikke være mulig å avgjøre på forhånd om forskningen er relevant. For sterke krav til relevans kan derfor også virke hemmende på forskningen.
Selv om det er vanskelig å gi eksempler på irrelevant forskning, vil økonomiske forhold, sykdommers utbredelse eller risiko, og finansieringskildenes interesser gi føringer for hvilken forskning samfunnet rent faktisk prioriterer, og som vi dermed betrakter som mest relevant. Helseforetakene og universitetene utarbeider strategier der de gir kriterier for hva som er relevant forskning for å kunne prioritere blant prosjekter med tilstrekkelig kvalitet.
4 Hva er medisinsk og helsefaglig forskning?
4.1 Hovedinndeling av medisinsk og helsefaglig forskning
4.1.1 Valg av begreper
Utvalget har forsøkt å finne frem til systematiske og gode definisjoner og inndelinger av medisinsk og helsefaglig forskning. Dette har vist seg å være vanskelig. Ulike publikasjoner benytter ulike definisjoner og avgrensinger.
Forskning deles ofte inn i grunnforskning og anvendt forskning . Hovedskillet mellom de to går ved formålet: Anvendt forskning er rettet mot bestemte praktiske mål eller anvendelser, mens grunnforskningen observerer fenomener eller fakta uten sikte på spesiell bruk. Tidligere skilte man skarpt mellom disse typene forskning: Fremskrittene kunne beskrives i en lineær modell som startet med grunnforskning og sluttet med anvendt forskning og produktutvikling. I dag er denne delingen mindre meningsfylt: For det første går prosessene raskere enn før. Tiden fra et resultat av grunnforskningen foreligger til det får en anvendelse kan være så kort, at det nesten kan sees på som en sammenhengende prosess. Dessuten må forskere som arbeider med anvendt forskning ofte gå tilbake til grunnforskningen for å kunne løse problemer underveis. 6
I denne sammenhengen har utvalget bestemt seg for en tredeling som vi mener er mer hensiktsmessig. Den består av grunnforskning, klinisk forskning og epidemiologisk forskning. Disse beskrives først. Så følger en inndeling av forskningen i forhold til finansiering og binding mellom oppdragsgiver og utøver (oppdragsforskning versus den ”frie” forskningen). På bakgrunn av utvalgets mandat har vi i siste avsnitt delt inn forskningen etter i hvilken grad den involverer mennesker, humant materiale eller personopplysinger. I kapittel 5 vil vi gå nærmere inn på de vanskelige grenseoppgangene mellom forskning og nærliggende virksomhet, slik som produktutvikling og kvalitetskontroll.
4.2 Grunnforskning, klinisk forskning og epidemiologisk forskning
4.2.1 Grunnforskning
Grunnforskning kan betegnes som teoretisk eller eksperimentell virksomhet som primært utføres for å skaffe til veie ny kunnskap om det underliggende grunnlaget for fenomener og observerbare fakta, uten direkte sikte på spesiell anvendelse eller bruk. 7 Innen medisin og helsefag beskriver grunnforskningen som regel biologiske strukturer og studerer de cellulære og molekylære prosessene ved sykdom: Eksempelvis er det ikke bare nyttig å finne ut hvordan HIV-viruset er bygget opp. Grunnforskningen ser også på hvilke inngangsporter viruset bruker for å infisere en celle, og hvilke konsekvenser infeksjonen har.
Grunnforskningen omfatter ikke alltid bruk av menneskelig materiale. Det er heller ikke alltid slik at målsettingen med grunnforskning er direkte knyttet til helse. På lengre sikt frembringer likevel grunnforskningen nye metoder til bruk i diagnostikk og behandling av sykdom.
Et ion er et ladet atom eller molekyl, for eksempel kalsium (Ca2+) eller kalium (K+). Alle våre kroppsceller er utrustet med kanaler som regulerer transporten av slike ioner inn og ut av cellene. Ulike celletyper, slik som nerve- og hjertemuskelceller, regulerer ionetransporten på forskjellig måte. Reguleringen er helt nødvendig for at kroppen skal fungere normalt, og mange typer sykdommer skyldes en defekt i reguleringen av ionetransporten.
Kunnskap om ionekanaler og transport av ioner er utviklet på grunnlag av oppfinnelser av tyske forskere fra Göttingen og Heidelberg. Disse laget på 1970-tallet instrumenter for å studere strømmen av ioner gjennom de enkelte kanalene i celleveggen. Forskerne benyttet glassrør som var en tusendels millimeter tynne. De festet rørene rundt en enkelt kanal og registerte strømmen av ioner gjennom kanalen som små elektriske signaler.
Denne teknikken har gjort det mulig å utvikle legemidler som påvirker én bestemt ionekanal. Ett eksempel er kalsiumkanal-blokkere som blokkerer kalsiumstrømmen i hjertemuskelceller. Slike ”kalsiumblokkere” brukes til å senke blodtrykket og motvirke rytmeforstyrrelser hos pasienter med høyt blodtrykk eller hjerterytmeforstyrrelser.
Eksempelet er hentet fra Forskningsrådets hefte ” Fra grunnforskning til bedre helse – 22 eksempler på at grunnforskning lønner seg” . Heftet inneholder mange illustrerende eksempler på hvordan resultater fra grunnforskningen benyttes til å utvikle diagnostiske verktøy og legemidler. Dette gjelder ikke bare medisinsk grunnforskning: For eksempel bygger magnetisk resonans-undersøkelser (”MR-bilder”) på studier av atomkjernens magnetiske egenskaper. Studiene gav forskerne Felix Bloch (1905 – 83) og Edward Purcell (1912 – 97) Nobelprisen i fysikk allerede i 1952.
Utvikling av metoder innenfor samfunnsrettet medisinsk og helsefaglig forskning hører også inn under grunnforskningen, slik som dataverktøy og informasjonssystemer. Et eksempel er bioinformatikk , et tverrfaglig felt som kombinerer kunnskaper fra matematikk, statistikk og informatikk, og som er nødvendig for å nyttiggjøre seg informasjon knyttet til kartleggingen av det humane genomet.
Nettopp forskningen knyttet til gener har fått en prioritert plass innen medisinsk grunnforskning i løpet av de siste årene. Gjennom programmet ”Funksjonell genomforskning (FUGE)” er det opprettet en nasjonal plan for å gi dette fagområdet et løft (http://forskningsradet.ravn.no/fag/andre/fuge). FUGE inkluderer forskning på gener, genomer (en organismes totale genmasse) og genprodukter (hovedsakelig proteiner). FUGE inkluderer altså både grunnforskning og genetisk epidemiologi. FUGEs årlige budsjett for 2003 - 2007 er 150 millioner kroner.
Universitetene har hovedansvaret for grunnforskningen. Denne typen forskning tar oftest ikke sikte på å utvikle et bestemt produkt eller resultat, og er derfor vanskelig å finansiere gjennom private kilder. I Norge og mange andre land er grunnforskningen helt avhengig av offentlig finansiering.
4.2.2 Klinisk forskning
Uttrykket ”klinisk forskning” brukes vanligvis om alle typer planlagte studier som utføres på mennesker. Det er uklare grenser mellom hva som er klinisk forskning og hva som er epidemiologi. Dette gjelder for eksempel studier av mindre pasientgrupper for å avdekke årsaken til en tilstand eller en komplikasjon. Uttrykket klinisk forskning blir ofte brukt synonymt med intervensjonsstudier , altså forsøk der deltakerne utsettes for en påvirkning. Studier som beskriver forekomst og risikofaktorer for sykdom og leter etter årsakssammenhenger har vi klassifisert som epidemiologisk forskning.
Intervensjonsstudier innebærer, slik navnet tilsier, at det foretas en ”intervensjon”. Det vil si at deltakeren (eller en andel av deltakerne) for eksempel får et bestemt legemiddel, gjennomgår et operativt inngrep eller følger en oppsatt diett. Forskeren observerer deltakeren og samler inn data som kan styrke eller svekke en på forhånd fastsatt hypotese om intervensjonens effekt.
Klinisk kontrollerte studier er en forutsetning for å ta i bruk nye legemidler. Som regel er legemidlet først prøvd ut på dyr, på friske forsøkspersoner og i mindre pasientgrupper. Deretter deltar en større gruppe pasienter i såkalte blindede, placebo-kontrollerte studier, der én gruppe pasienter får virksomt legemiddel og den andre gruppen et uvirksomt stoff (placebo). I slike tilfeller er det bare den gruppen som får aktiv medisin som utsettes for en egentlig intervensjon. Imidlertid vil verken pasientene eller forskerne på forhånd vite hvilke deltakere som får hvilken type medisin (studien er blindet). Alle som deltar i en slik studie må derfor være villige til å utsette seg for en påvirkning.
Hensikten med klinisk kontrollerte studier er som regel å avgjøre hvilken behandling som er best egnet for pasienter med en bestemt diagnose. Resultater fra et utvalg benyttes til å trekke konklusjoner om nåværende og fremtidige pasienter, og derfor er kvaliteten på studien avhengig av at utvalget som er med er representativt for de pasientene som senere kan få behandling. Utvalget er imidlertid ofte for snevert: Pasienter med tilleggssykdommer eller pasientene som er sterkere affisert av sykdommen enn gjennomsnittspasienten utelukkes fra deltakelse i studien. Deltakere kan også ekskluderes på grunn av kjønn eller etnisk bakgruppe. Derfor må vi følge opp resultatene fra klinisk kontrollerte studier etter at et medikament er godkjent. Slik oppfølging inkluderer ”fase IV-studier”, der pasienter som får medikamentet, registreres og følges med tanke på virkninger og bivirkninger. I Norge er registrering av alvorlige og/eller uventete bivirkninger av legemidler lovbestemt. Registrering av bivirkninger regnes ikke som forskning, mens fase IV-studier befinner seg i en vanskelig gråsone mellom forskning og kvalitetssikring (se kapittel 5).
Men kliniske studier omfatter også annet enn intervensjonsstudier. Det utføres en rekke beskrivende undersøkelser i klinisk sammenheng. Med dette menes studier hvor forsøksdeltakerne ikke utsettes for en spesiell påvirkning, men der forskeren ønsker å få frem pasientens selvrapportering om ulike forhold, i form av spørreskjemaer eller intervjuer. Eksempler kan være kartlegging av mestring og livskvalitet eller rapportering av tilfredshet eller bivirkninger knyttet til en bestemt type behandling.
4.2.3 Epidemiologisk forskning 8
Epidemiologisk forskning omfatter studier av sykdommers karakter og forekomst (deskriptiv epidemiologi) og søken etter årsaker (analytisk epidemiologi). Noen vil mene at epidemiologisk forskning avgrenser seg mot klinisk forskning ved at man vanligvis ikke driver aktiv intervensjon i epidemiologiske undersøkelser. Begrepene er imidlertid ikke entydige, og det er derfor viktigere å beskrive de undersøkelser som utføres og den metode som benyttes, enn å sette merkelapper på forskningen.
De vanligste metodene innen epidemiologi er kasus-kontrollundersøkelser og kohorte-studier. Ved kasus-kontrollundersøkelser studeres en gruppe individer som har en bestemt diagnose eller definert tilstand, og sammenliknes med en tilsvarende gruppe som ikke har sykdommen. Ved å kartlegge fortiden forsøker forskeren å finne særtrekk hos de syke (for eksempel i oppvekst, miljø, diett og lignende) som kan forklare hvorfor akkurat disse har utviklet denne sykdommen. Ved kohorte-studier tar forskeren utgangspunkt i en bestemt gruppe og følger dem fremover i tiden. Det kan være friske mennesker (for eksempel barn som er født et bestemt år eller en bestemt yrkesgruppe) eller pasienter (for eksempel alle med leddgikt bosatt i Tromsø). Deltakerne følges, ofte i mange år, for å se hvem som utvikler en sykdom eller hvordan det går med pasientgruppen. Det at man følger en gruppe over tid, gjør at vi kaller studien for prospektiv, i motsetning til retrospektive studier der man ser på forhistorien. En tredje metode er tverrsnittsundersøkelser som kartlegger situasjonen på et bestemt tidspunkt og kan gi informasjon om ulikhet i sykdomsforekomst, risikofaktorer etc. mellom befolkningsgrupper (for eksempel røykevaner i ulike sosialgrupper eller gjennomsnittlig kroppsvekt i forskjellige fylker).
Epidemiologisk forskning omfatter ofte store grupper og strekker seg over lang tid. Datainnsamlingen kan omfatte opplysninger om den enkelte som personopplysninger, resultat av medisinske tester og biologiske prøver. De siste årene har genetisk informasjon blitt en sentral del av epidemiologiske data. Mye av helsepolitikken planlegges og utformes på grunnlag av epidemiologisk kunnskap. Det er derfor viktig at slike studier holder god kvalitet, og at befolkningen har tillit til denne typen forskningsvirksomhet.
I våre nordiske naboland har de allerede mange års erfaring med at epidemiologisk forskning med utgangspunkt i pasientregistre og databaser gir viktige resultater. Danmark regnes som et foregangsland innen epidemiologi: Ved hjelp av data fra det danske fødselsregisteret og ulike pasientregistre, har danske forskere blant annet kunnet tilbakevise hypoteser om sammenhenger mellom vaksinering av barn og senere utvikling av autisme og diabetes. 910 I Sverige har et sentralt pasientregister gjort det mulig å vise at forekomsten av hjerteinfarkt er kraftig redusert i løpet av de siste årene, og at nye kirurgiske metoder redder 3 000 av disse pasientene hvert år. 11 Heftet ”Hälsodata redder liv och förbättrar livskvalitet” gir eksempler på hvordan registerforskning i Sverige har gitt forskningsresultater innen ulike helseområder. Forfatterne beskriver metodene ved registerforskning, og diskuterer sine erfaringer med bruk av helseregistre. 12
I Norge har vi landsomfattende registre for ulike undergrupper av pasienter (Kreftregisteret, Fødselsregisteret), men vi mangler et personentydig pasientregister som kan brukes til forskning.
4.3 Oppdragsforskning versus den ”frie” forskningen
Medisinsk og helsefaglig forskning kan også klassifiseres ut i fra forholdet mellom utøveren og finansieringskilden. Ved ”oppdragsforskning” forstår man forskning der det er særlige bindinger mellom forskeren og arbeidsgiver eller finansieringskilden. I rapporten Oppdragsforskning: åpenhet, kvalitet, etterrettelighet 13 definerer forfatterne oppdragsforskning ved hjelp av fire kriterier: Prosjektet finansieres av eksterne kilder (oppdragsgiver), det er oppdragsgiver som bestemmer problemstillingen, oppdragsgiver har potensiell nytte av resultatene og oppdragsgiver får overført visse bruksrettigheter til resultatene etter at prosjektet er avsluttet.
Det er altså flere elementer som må være til stede for at et prosjekt skal kunne karakteriseres som oppdragsforskning. Også mye av den frie forskningen er finansiert av eksterne kilder, og de som finansierer forskningen kan ha interesse av resultatene.
Prosjektet settes vanligvis i gang ved at oppdragsgiveren definerer en problemstilling de ønsker svar på og finner en forskergruppe som ønsker å ta oppdraget. Selve prosjektbeskrivelsen, det vil si hvordan spørsmålet eller hypotesen skal kunne besvares, utformes vanligvis av forskeren selv. Internasjonale legemiddelutprøvinger representerer et viktig unntak fra dette. Da er det som regel legemiddelfirmaet selv som utarbeider prosjektbeskrivelsen. Ideelt sett står forskeren fritt mens han eller hun utøver prosjektet, og resultatet publiseres uavhengig av utfallet i et tidsskrift basert på fagfellevurdering, dvs faglig gjennomgang og gransking av artikkelen av utenforstående eksperter. Ikke alle forskningsoppdrag egner seg imidlertid for denne formen for publisering. I noen tilfeller ”offentliggjøres” resultatene i interne rapporter eller i tidsskrifter som ikke er basert på fagfellevurdering.
Oppdragsforskning er nødvendig for næringsutvikling og industri, men stiller særlige krav til åpenhet og tillit. Kan man ”kjøpe en forsker og bestille de resultatene man ønsker”? I rapporten konkluderer NEM med at oppdragsforskning i Norge ikke går på akkord med åpenhetsprinsippet, men at mange forskere som arbeider med oppdragsforskning er bekymret. Rapporten peker på at oppdragsforskning bare kan eksistere sammen med en sterk og uavhengig, fri forskning.
4.4 Forskning som involverer mennesker, humant biologisk materiale eller helseopplysninger
Ikke all medisinsk og helsefaglig forskning involverer mennesker. Dersom vi definerer medisinsk og helsefaglig forskning ut i fra formålet, inngår ikke bare forskning på mennesker, men også blant annet dyreeksperimenter, grunnforskning på celler fra andre organismer og helseøkonomisk forskning. Men det er først og fremst ønsket om å beskytte mennesker (forskningsdeltakere: kvinner, menn eller barn) mot fysisk og psykisk skade, samt integritetskrenkelser for øvrig, som legitimerer rettslig regulering av forskning. Det kan derfor være hensiktsmessig å betrakte alle typer medisinsk og helsefaglig forskning som involverer mennesker, direkte eller indirekte, separat.
Når pasienter eller friske personer deltar i medisinsk og helsefaglig forskning, kan dette skje på flere prinsipielt ulike måter: For det første har vi undersøkelser som direkte involverer mennesker. Det vanligste er intervensjonsstudier, der deltakerne blir utsatt for en direkte påvirkning av forskeren. Slik påvirkning kan variere fra minimal (for eksempel en samtale) til betydelig (for eksempel et kirurgisk inngrep). For det andre har vi forskning som dreier seg om studier av biologisk materiale fra mennesker. Den tredje og siste gruppen dreier seg om undersøkelser som benytter individuelle helseopplysninger (for eksempel registerstudier).
Ved intervensjonsstudier må regelverket sikre at deltakeren ikke utsettes for urimelig belastning eller skade. Ved forskning på personopplysninger og biologisk materiale er det først og fremst personvernet (vernet mot integritetskrenkelser) som må sikres.
4.4.1 Intervensjonsstudier
Intervensjonsstudier omhandler alle studier der deltakerne utsettes for en eller annen påvirkning (se også avsnitt 4.2). Slike studier stiller særlige krav til pasientens sikkerhet, som må veies mot den potensielle nytteeffekten. Risikoen som deltakeren utsettes for varierer: Det er store forskjeller mellom å følge en bestemt diett for eventuelt å redusere innholdet av fettstoffer i blodet, og å motta en ny type behandling mot kreft. I begge tilfellene må likevel risikoen veies opp mot nytten. De færreste av oss vil ha vondt av å spise mindre fett og sukker i en periode. På den annen side er den potensielle nytteeffekten av en radikal behandling mot alvorlig kreftsykdom stor, slik at både forsker og pasient er villige til å løpe større risiko. I studier der man undersøker effekten av en ny behandling mot lungekreft (for eksempel høye doser med cellegift kombinert med stamceller fra eget blod), kan valget stå mellom to behandlinger som begge medfører stor risiko.
4.4.2 Forskning på humant biologisk materiale
Medisinsk og helsefaglig forskning benytter ofte materiale fra mennesker uten at disse personene utsettes for noen direkte påvirkning. Deltakeren gir da tillatelse til bruk av humant biologisk materiale (blod, urin eller celleprøver) til senere analyser.
I biobankloven er humant biologisk materiale er definert som organer, deler av organer, celler og vev og bestanddeler av slikt materiale fra levende og døde mennesker, jf. § 2. Slike prøver oppbevares i samlinger som etter lovens definisjon er biobanker.
I forbindelse med befolkningsundersøkelsene i Norge er det opprettet store lagre av biologiske prøver, vesentlig blod- eller serumprøver. Vår største forskningsbiobank heter Janus-banken og administreres av Kreftregisteret. I 2001 inneholdt Janus-banken ca. 600 000 serumprøver fra ca 300 000 givere. I tillegg til biobankene fra befolkningsundersøkelser, har Norge omfattende samlinger av annet biologisk materiale som er lagret ved ulike helseinstitusjoner.
Formålet med en biologisk prøve vil kunne endre seg etter at prøven er avlagt. Biobanker representerer derfor en særlig utfordring når det gjelder lovgivning og regulering, og spesielt når det gjelder samtykke.
4.4.3 Helseopplysninger
I helseregisterloven § 2 nr. 1 defineres helseopplysninger som ”taushetsbelagte opplysninger i henhold til helsepersonelloven § 21 og andre opplysninger og vurderinger om helseforhold eller av betydning for helseforhold, som kan knyttes til en enkeltperson.” Slike opplysninger som er anonymisert og som ikke kan knyttes til en enkeltperson, faller utenfor definisjonen, og er ikke helseopplysninger i rettslig forstand. Helseopplysninger inkluderer objektive data som for eksempel høyde, vekt, medikamentbruk, tidligere sykdommer (inkludert sykdommer hos slektninger) og familiesituasjon, og mer subjektive utsagn som for eksempel opplevd helsetilstand og dens påvirkning på dagliglivets aktiviteter. Kvinner vil ofte etterlate seg flere og mer sensitive helseopplysninger enn menn, for eksempel ved helsekontroller.
Opplysninger om pasienter kan være innhentet via direkte kontakt (intervju), eller være samlet inn fra pasientenes journaler, ved hjelp av spørreskjema som besvares per post eller liknende. De fleste personer vil oppfatte opplysninger om egen helsetilstand som sensitive, noe avhengig av opplysningenes art. De fleste oppfatter sannsynligvis informasjon om psykisk helse eller alkoholmisbruk som mer sensitiv enn opplysninger om høyde og vekt. Opplysninger om reproduktiv helse vil kunne være spesielt sensitive for kvinner.
5 Begrepet medisinsk og helsefaglig forskning
5.1 Definisjonen av medisinsk og helsefaglig forskning?
Det finnes ingen allmenngyldig definisjon på hva som inngår i begrepet medisinsk og helsefaglig forskning. Grensene mot andre former for medisinsk og helsefaglig virksomhet som ikke er forskning, er delvis uavklarte.
Utvalget skal vurdere reguleringen av medisinsk og helsefaglig forskning som involverer mennesker, humant biologisk materiale og helseopplysninger (se avsnitt 4.4). Vi har derfor forsøkt å finne frem til en hensiktsmessig definisjon av medisinsk og helsefaglig forskning for å presisere hva det er utvalget skal se på. Definisjonen blir senere brukt i utvalgets utkast til lov, jf. del VI.
5.2 Eksisterende definisjoner
Medisinsk og helsefaglig forskning beskrives ofte av institusjoner som ansetter og utdanner medisinske forskere (universiteter, høgskoler og helsetjenesten), i institusjoner som bevilger penger til medisinsk forskning (Norges forskningsråd, Den Norske Kreftforening) og i politiske sammenhenger (departementer, fagforeninger). Kreftforeningen har for eksempel valgt å definere medisinsk forskning ut i fra hvilken relevans forskningen har for kreftsykdommer. I tillegg omfatter definisjonen et verktøy for å rangere forskningsprosjektene etter kvalitet, slik at foreningen kan benytte definisjonen for å bevilge penger til de beste prosjektene. Universitetssykehuset i Nord-Norge (UNN) legger på sin side hovedvekten på definisjon av klinisk forskning, og skriver at ”pasientnær klinisk forskning er forskning som gir grunnlag for direkte forbedringer i diagnostikk, behandling og pleie, og en kostnadseffektiv utnyttelse av helsetjenestens ressurser”. Rikshospitalet har en bred definisjon; ”forskning er virksomhet av original karakter som utføres med vitenskapelig metodikk for å skaffe til veie ny kunnskap”.
5.3 Utvalgets definisjon
Medisinsk og helsefaglig forskning kjennetegnes både ved utøver, metodevalg og bruk av materiale. En helsetjeneste er definert ved at den utøves av helsepersonell. Kan vi bruke samme avgrensing for å definere medisinsk og helsefaglig forskning? De forrige kapitlene har vist at dette ikke er hensiktsmessig, fordi også personer med annen yrkesbakgrunn arbeider med denne typen forskning. Vi har vist at medisinsk og helsefaglig forskning benytter mange ulike metoder (mange av disse brukes også innen annen forskning, for eksempel i humanistiske og naturvitenskapelige fag). Det er mulig å definere medisinsk og helsefaglig forskning ut i fra materialbruk (mennesker, humant materiale eller helseopplysninger), men også dette vil utelukke store deler av den forskningen som i dag oppfattes som medisinsk og helsefaglig. Vi mener derfor at det er mest hensiktmessig å definere medisinsk og helsefaglig forskning ut i fra formålet: Målsettingen for medisinsk og helsefaglig forskning er som regel å opparbeide helsefremmende kunnskap, dvs. kunnskap om årsaker, utbredelse, forebygging, diagnostikk og behandling av sykdom og om hvordan vi kan fremme god helse.
Utvalget mener at det er behov for en vid definisjon av medisinsk og helsefaglig forskning. Denne vil også dekke områder som i dag ikke er definert som forskning, blant annet deler av det som kalles kvalitetsforbedring og utprøvende behandling.
Utvalgets definisjon:
Medisinsk og helsefaglig forskning er virksomhet som utføres med vitenskapelig metodikk for å skaffe til veie ny kunnskap om helse og sykdom.
5.4 Avgrensing av forskning mot andre virksomheter
I mange tilfeller er det vanskelig å avgjøre hvorvidt et prosjekt eller et tiltak faller inn under en slik definisjon. Vi har derfor valgt å beskrive nærmere noen av de virksomhetene som grenser mot forskning. Dersom det er tvil om hvordan et prosjekt eller tiltak skal klassifiseres, er utvalgets mening at prosjektet bør følge de retningslinjer og lover som gjelder for forskning og få prosjektet vurdert av den regionale komité for medisinsk forskningsetikk.
5.4.1 Forskning og ordinær klinisk virksomhet
Med helsehjelp menes i helsepersonelloven ”enhver handling som har forebyggende, diagnostisk, behandlende, helsebevarende eller rehabiliterende mål og som utføres av helsepersonell”. Medisinsk behandling eller helsehjelp har som hovedformål å ta vare på den enkelte pasient. Forskningens hovedformål er derimot (under hensyn til deltakerne) å bringe frem ny kunnskap.
Det er ikke alltid enkelt å bestemme om et tiltak eller et prosjekt er helsehjelp eller forskning. Vi kan for eksempel se på befolkningsundersøkelser som er iverksatt for å identifisere markører eller risikofaktorer for en eller flere bestemte sykdommer (de regionale helseundersøkelsene). Statens helseundersøkelser (SHUS) gjennomførte på 1980- og 1990-tallet fylkesvise undersøkelser av befolkningen for å avdekke risikofaktorer for hjerte- og karsykdom. Da disse undersøkelsene startet opp, ble de betraktet som et helsetilbud. De fremmøtte ble ikke bedt om samtykke og måtte vanligvis betale egenandel. På den andre siden fikk deltakerne alltid, med mindre de reserverte seg, tilbakemelding om resultatene av undersøkelsene.
Denne typen helseundersøkelser er nå avsluttet, eller videreført i form av rene epidemiologiske studier. I den grad det kan sies at vi i dag har etablert kombinerte helsetilbud og epidemiologiske forskningsprosjekt, er antakelig brystkreftprogrammet (mammografiprogrammet) i regi av Kreftregisteret det mest nærliggende eksempelet. Også screening for kreft i livmorhalsen, ultralydscreening av gravide og screening for Føllings sykdom er eksempler på helsetilbud der data fra undersøkelsene blir brukt eller kan brukes i forskning. 14
Det er grader av overlapping mellom forskning og klinisk virksomhet. Helseundersøkelsene, og sannsynligvis brystkreftprogrammet, er gode eksempler på at et prosjekt kan ha begge betegnelsene. Dette bør ikke være noe problem dersom alle hensiktene med prosjektet eller tiltaket kommer klart frem, og alle hensyn ivaretas. Men det er viktig at klinisk virksomhet som også er forskning, i tillegg til å følge kravene til forsvarlig klinisk virksomhet, oppfyller kravene til forsvarlig forskning.
5.4.2 Forskning versus utprøvende behandling
Etablert behandling forutsetter i prinsippet at behandlingsmetoden er tilfredsstillende dokumentert. Utprøvende behandling dreier seg om behandling som ikke er tilstrekkelig dokumentert og som heller ikke iverksettes under de betingelser som gjelder for klinisk kontrollerte studier.
Det er vanskelig å skille mellom forskning og utprøvende behandling. I boken ”Medisinsk etikk” 15 diskuterer Knut Ruyter skillelinjer mellom utprøvende behandling og forskning. For det første kan vi skille mellom eksperimentell behandling som gis til en enkelt pasient (da er det behandling), og behandling som gis til flere pasienter (da blir det på et tidspunkt forskning). For det andre er primærmålet forskjellig: Behandling har alltid som viktigste formål å bedre pasientens helse. Forskningens primærformål er derimot å skaffe ny kunnskap. Men selv med slike kriterier til hjelp, vil det alltid være situasjoner der det ikke lar seg gjøre å definere et tiltak med sikkerhet.
En betydelig del av den etablerte behandlingen har heller ikke i dag tilfredsstillende forskningsgrunnlag, men den hviler i alle fall på omfattende og dokumentert klinisk erfaring. Det finnes ingen oversikt over utprøvende behandling eller tiltak som iverksettes på eget initiativ av enkeltbehandlere eller institusjoner, og som ikke defineres som forskning.
Kunnskapsbasert medisin har som mål å sikre at helsetjenestene bygger på forskningsbasert kunnskap. Men det er i dag ikke et krav om at all medisinsk og helsefaglig virksomhet skal være kunnskapsbasert, og på mange områder finnes ikke den nødvendige kunnskapen eller oppsummeringer av den kunnskapen vi har. Utprøvende behandling har som formål å avklare behandlingsnytte av nye behandlingsmetoder i forhold til etablert behandling. Utvalget mener derfor at utprøvende behandling i størst mulig grad bør dokumenteres og defineres som forskning.
5.4.3 Forskning, kvalitetsforbedring og metodeutvikling
Mens utprøvende behandling ligger i forkant av etablert behandling, utføres oftest kvalitetsforbedring i etterkant. Også her er grenseoppgangen til forskning vanskelig.
Kvalitetsarbeid som har som formål å finne frem til ny kunnskap, bør i denne sammenhengen betraktes som forskning. Det bør derfor stilles samme krav til kvalitetsarbeid som til aktiviteter som tradisjonelt defineres som forskning.
Dersom en sykehusavdeling tar i bruk et nytt medikament mot leddgikt, vil dette sannsynligvis være forhåndsgodkjent gjennom kliniske studier. Likevel kan avdelingen ønske å undersøke hvilken effekt medikamentet har på ”deres” pasienter, blant annet fordi deltakerne i legemiddelutprøvinger ofte ikke er representative for hele spekteret av pasienter. Universitetssykehuset i Nord-Norge kan for eksempel ønske å se på hvilken effekt medikamentet har på pasienter med samisk bakgrunn. Dersom en slik undersøkelse gjennomføres med på forhånd bestemte endepunkter (for eksempel telling av hovne ledd og måling av betennelsesmarkører i blodet), pasientene undersøkes systematisk og resultatene offentliggjøres, er dette å regne som forskning.
Medisinsk og helsefaglig forskning kan, i enkelte tilfeller, bidra eller føre til utvikling av nye produkter. Ikke all produktutvikling kan regnes som forskning. Små endringer i eksisterende metoder er ikke forskning (det mangler hypotese og det inngår ikke bruk av forskningsmetoder). Validering (undersøkelser av gyldigheten) av en laboratoriemetode er som oftest ikke forskning, og løpende kvalitetskontroll av en rutinemetode er heller ikke forskning. Grensegangen mellom hva som faller innenfor og hva som faller utenfor forskningsbegrepet er uklar, og tvilstilfeller må vurderes enkeltvis av aktuelt myndighetsorgan. Hva slags materiale som benyttes ved kvalitetssikring og metodeutvikling, om materialet er anonymisert eller ikke, vil kunne være avgjørende for om en aktivitet bør regnes som forskning eller ikke. Dette belyses nærmere i en drøfting av hva slags virksomhet som faller innenfor det området som utvalget anbefaler regulert i ny lov, dvs. kapittel 24.3, spesielt kapittel 24.3.3 som omhandler humant biologisk materiale.
Mye av det tekniske og metodemessige utviklingsarbeidet som foregår både i sykehuslaboratorier og i industribedrifter, retter seg mer mot å fremskaffe ny kunnskap om reagenser, målemetoder og tekniske prosesser enn om å frembringe ny kunnskap om helse eller sykdom. To eksempler kan illustrere slik virksomhet som det ikke er naturlig å regne som medisinsk og helsefaglig forskning:
Prostataspesifikt antigen (PSA) er et stoff som finnes i øket konsentrasjon i blodet om prostatakreftceller har spredd seg til vev utenfor prostatakjertelen. Et sykehuslaboratorium hadde i flere år målt prostataspesifikt antigen i blodprøver ved hjelp av en radioaktiv målemetode. I forbindelse med en foreslått investering i nytt analyseutstyr til laboratoriet hvor man kunne erstatte de radioaktive målemetodene med utstyr som bruker ikke-radioaktive reagenser, ønsket man å undersøke den diagnostiske verdien av de nye reagensene sammenlignet med de eldre radioaktive metodene. I en periode på to måneder ble alle blodprøver som ble tatt for analyse ved hjelp av den etablerte radioaktive målemetoden, også undersøkt ved hjelp av den nye ikke-radioaktive målemetoden.
Ved hjelp av denne metodesammenligningen kunne man vise at den nye ikke-radioaktive målemetoden ga like pålitelige resultater som den etablerte radioaktive målemetoden. Metodeundersøkelsen ga ingen ny kunnskap om sykdom og helse, og faller utenfor utvalgets definisjon på medisinsk og helsefaglig forskning. Den ga imidlertid ny kunnskap om de tekniske målemetodene som var til disposisjon. Denne kunnskapen fikk konsekvenser for investeringen i nytt analyseutstyr, og en rask strålehygienisk gevinst ble også oppnådd.
Fra midten av 1980-årene ble det erkjent og akseptert at måling av konsentrasjonen av druesukker bundet til hemoglobin i blodprøver (glykosylert hemoglobin) er den beste kjemiske undersøkelsesmetoden for å følge med i sykdomsutviklingen hos diabetikere. Det ble utviklet meget gode laboratoriemetoder for slike målinger. Mange leger og pasienter mente at slike analysesvar burde bli tilgjengelige for pasientene samtidig med at pasientene var til konsultasjon hos sin lege, for å ta stilling til justering av diett og medikamenter. Det ble derfor utviklet et nytt apparat til bruk på legekontoret, slik at man allerede ved konsultasjonen kunne få resultatet av måling av druesukker bundet til hemoglobin. Industribedriften samarbeidet med et sykehus for å sikre en korrekt kalibrering, nøyaktighet og presisjon av den nye metoden og de nye produktene. Blodprøver som laboratoriet ved sykehuset mottok til analyse, ble videresendt i anonymisert form til bedriften. Industribedriften fikk opplyst at blodprøvene var fra diabetikere og hvilket resultat analysen ved sykehuset hadde gitt, men pasientenes identitet ble holdt skjult for industribedriften.
Denne metode- og produktutvikling hadde ikke som mål å oppnå øket kunnskap om helse og sykdom, og faller utenfor utvalgets definisjon av medisinsk og helsefaglig forskning. En kjemisk målemetode ble imidlertid tilgjengelig for legekontorer, og norsk diagnostisk industri fikk utviklet et godt produkt for anvendelse i norsk helsetjeneste og eksport til utlandet.
5.4.4 Forskning versus markedsføring
Når medisinske produkter skal markedsføres, presenterer produsenten resultatene av de undersøkelsene som er foretatt for å dokumentere produktets effekt. Som tidligere nevnt, stilles det strenge krav til dokumentasjon for at et medisinsk og helsefaglig produkt kan registreres og tas i alminnelig bruk. Denne dokumentasjonen må være gjennomført etter vitenskapelige metoder.
Det kan være problematisk å skille mellom forskning og markedsføring. For det første kan tolkningen av resultatene, slik de fremsettes i markedsføringen, være lite forenlige med vitenskapelige ”sannheter”. Enkeltstudier kan tillegges ufortjent oppmerksomhet i forbindelse med reklame. Det er også grunn til å anta at ikke all dokumentasjon som er fremskaffet offentliggjøres, slik at denne typen forskning kan komme i konflikt med fullstendighetsidealet.
Et eksempel kan være forsøk med registrerte legemidler der hovedhensikten like mye er å gjøre preparatet kjent blant helsepersonell og pasienter som å undersøke preparatets virkning. Såkalte fase IV-studier, dvs. undersøkelser av legemidler som har markedsføringstillatelse og allerede er i salg, kan i blant ha preg av markedsføring. Det kan være vanskelig å vurdere om dette er en så viktig bakgrunn for prosjektet at det overskygger andre formål med studien. I den utstrekning slike undersøkelser er faglig berettiget og etisk akseptable, omfattes undersøkelsene uansett av de regler og reguleringer som gjelder for medisinsk og helsefaglig forskning.
6 Medisinsk og helsefaglig forskning i Norge
6.1 Organisering
6.1.1 Hvor foregår forskningen?
Norsk medisinsk og helsefaglig forskning foregår vanligvis i tre sektorer; universiteter og høgskoler, forskningsinstitutter (for eksempel Nasjonalt folkehelseinstitutt) og næringslivet. Forskning er i tillegg lovpålagt for sykehus, slik at disse kommer inn som en fjerde sektor for medisinsk og helsefaglig forskning. 16 Etter at den nye helse-reformen trådte i kraft, har Stortinget vedtatt at forskning skal være en selvstendig oppgave ved hvert av de fem regionale helseforetakene. Helseforetakene skal samarbeide med universiteter og høyskoler gjennom egne organer for å sikre en hensiktsmessig fordeling av forskningsoppgavene.
Det er vanskelig å beregne hvor stor andel av forskningen som foregår ved de ulike institusjonene. Sett i forhold til andre forskningsområder er universitets- og høyskolesektoren stor og instituttsektoren liten (til sammen 10% av universitets- og høyskolesektoren). Næringslivets andel er vanskelig å anslå, fordi denne sektoren ikke gir opplysninger om hvordan utgiftene fordeler seg på fagområder. Foreløpig vet vi heller ikke nøyaktig hvor stor del av forskningen helseforetakene vil stå for. I 2004 fikk helseforetakene til sammen 370 millioner kroner øremerket til dette formålet, men flere helseforetak ønsker å bruke mer. For eksempel brukte Helse Øst og Helse Midt-Norge begge 1% av rammebevilgningene til forskning i 2004.
Finansieringen av forskningen er fordelt på enda flere aktører. Selv om en forsker formelt er ansatt ved et universitet eller en institusjon, kan lønns- og driftsmidler komme fra andre kilder. Norges forskningsråd finansierer omkring 8% av medisinsk og helsefaglig forskning. Det er en vanlig oppfatning at næringslivet finansierer en større del av den medisinske og helsefaglige forskningen enn det som er vanlig for andre områder. Slik er det ikke. Derimot bidrar private stiftelser og organisasjoner med betydelige midler, med Den Norske Kreftforening og stiftelsen Helse og Rehabilitering som eksempler på de største aktørene. I tillegg kommer finansiering fra kilder i utlandet og internasjonale organisasjoner, slik som EU og National institutes of health (NIH) i USA. I 2001 ble 1,5% av den medisinsk og helsefaglige forskningen ved universiteter og høyskoler finansiert fra slike organisasjoner (Fig 6.1.).
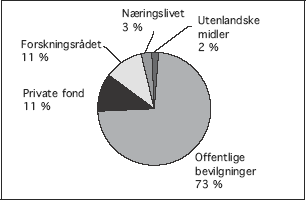
Figur 6.1 Finansiering av medisinsk og helsefaglig forskning i universitets- og høyskolesektoren i 2001. I tillegg kommer instituttsektoren og den andelen medisinsk og helsefaglig forskning som næringslivet utfører i egen regi.
6.1.2 Yrkesbakgrunn
I kapittel 5 har vi forklart hvordan vi har valgt å definere medisinsk og helsefaglig forskning ut i fra formålet med forskningen, og ikke ut i fra forskernes fagbakgrunn. Det betyr at utøverne av denne typen forskning kan ha høyst forskjellig bakgrunn og at mange ikke vil falle inn under helsepersonelloven. I tillegg til sykepleiere, fysioterapeuter, leger, tannleger, farmasøyter, veterinærer og andre med helsefaglig utdanning, er det særlig samfunnsvitere og realister som arbeider med medisinsk og helsefaglig forskning. I 2001 utgjorde legene 42% av de fast vitenskapelig ansatte i fagområdet medisin. 17 De siste 15-20 årene har denne andelen gått betydelig ned til fordel for personer med annen yrkesbakgrunn.
Andelen kvinner som avlegger doktorgrad er økende, og har i løpet av de siste årene ligget rundt 40%, men foreløpig er det få kvinner i de høyere akademiske stillingene: I 2001 var bare 14% av professor I-stillinger innen medisin- og helsefag ved universiteter og høyskoler i Norge besatt av kvinner.
6.1.3 Forskerutdanningen
Helsinki-deklarasjonen sier at medisinsk forskning skal utøves av kvalifisert personell, men det finnes ikke noe lovverk som sikrer at utøverne av medisinsk og helsefaglig forskning har særlige kvalifikasjoner. De siste tiårene har vi imidlertid fått en formalisering av forskerutdanningen. Dessuten forlanger instanser som finansierer forskningen som regel at prosjektansvarlig skal ha lang erfaring og/eller formell kompetanse.
Innen medisinsk og helsefaglig forskning – som på andre forskningsområder – representerer doktorgraden en formalisert forskerkompetanse. I Norge gjennomgår omkring 150 personer doktorgradsprøven innen medisin og helsefag hvert år. Avhandlingen er som regel basert på publikasjoner i tidsskrifter med fagfellevurderinger (i motsetning til monografier som er det vanlige innen for eksempel humanistiske fag). Tidligere var det tilstrekkelig å publisere et visst antall artikler for så å sammenfatte disse i en konklusjon. Etter at universitetene innførte doktorgrads utdanningen på 1990-tallet, må kandidatene også gjennomgå et bestemt antall kurs og avlegge kursprøver. Etikk og vitenskapsteori utgjør en obligatorisk del av disse kursene. Det gjør derimot ikke rettslære og helseforskningsrett.
6.1.4 Arbeidsforhold
Mange forskere er ikke fast ansatt, men arbeider med et prosjekt for et visst tidsrom. Innenfor universitetsmiljøet betegnes disse rekrutterings- eller doktorgradsstipendiater. Etter avlagt doktorgrad kan en forsker søke om nye stipender (postdoktorstipender). En slik stilling har oftest en varighet på tre eller fire år, og gir søkeren mulighet til å kvalifisere seg for en fast stilling. Faste stillinger krever som regel lang erfaring. For å være professorkompetent må en forsker ha en vitenskapelig produksjon som tilsvarer omkring tre doktorgrader.
Sykehuspersonale som arbeider med forskning over lengre perioder kan kombinere dette med klinisk pasientrettet virksomhet. Slike kombinasjoner (for eksempel professor II-stillinger eller fordypningsstillinger innen en medisinsk spesialitet) kan oppleves som nyttig fordi forskeren arbeider nærmere den ”kliniske virkeligheten”. Samtidig er det nettopp disse personene som oftest opplever at forskningsarbeidet skyves til side til fordel for andre oppgaver. I en undersøkelse av forholdene ved universitetssykehusene, oppgav 30% av de deltidsansatte forskerne at de gjorde minst to tredeler av forskningsarbeidet utenom den ordinære arbeidstiden. 18
Medisinsk og helsefaglig forskning er vanligvis organisert i grupper, ledet av en eller flere personer med fast stilling og høy kompetanse. Arbeidet preges av konkurranse. Kvaliteten og omfanget av den vitenskapelige produksjonen veier tungt både når det gjelder faste ansettelser og for å finansiere videre arbeid (driftsmidler og penger til å lønne stipendiater). En slik konkurranse kan fremme god forskning gjennom å øke innsatsen til den enkelte. På den annen side kan konkurranse hindre nyttig teamarbeid og kanskje fremme uredelighet. Det siste skjerper kravene til en hensiktsmessig regulering av forskningen.
6.1.5 Disposisjons- og eiendomsrett
Resultater fra medisinsk og helsefaglig forskning kan styrke næringsutviklingen gjennom å utvikle diagnostiske verktøy, medikamenter og instrumenter som kan produseres og selges. Dette kan skje tilfeldig ved at forskere kommer frem til resultater som det senere viser seg kan utnyttes til å utvikle salgbare produkter, eller organisert gjennom målrettet forskning i bedrifter som utvikler medisinsk utstyr eller legemidler.
Et typisk norsk eksempel er de såkalte Ugelstadkulene: Sent på 1970-tallet beregnet professor John Ugelstad (1921 – 97) ved Norges Tekniske Høgskole (NTH) hvordan det var mulig å produsere bitte små, helt identiske (monodisperse) plastkuler. Disse plastkulene kunne magnetiseres, og det var mulig å festes ulike molekyler til kulenes overflate. I dag benyttes Ugelstadkulene til en rekke formål innen medisinsk forskning og behandling, og regnes som NTNUs største kommersielle suksess gjennom tidene.
Det kan være ulike oppfatninger av hvem som skal ha rettigheten til et patent, eller hvordan et økonomisk utbytte skal deles. Forskeren er interessert i et visst eierskap til sine produkter. Den enkelte forskers plikter og rettigheter bør være avklart i forhold til arbeidsgiver. Det bør legges til rette for en effektiv utnyttelse av forskningsresultater med potensial for kommersialisering, og utbyttet bør deles på en måte som oppleves som rettferdig også for forskeren. 19
6.2 Norge i verden
6.2.1 Ressurser
I Norge er det Norsk institutt for studier av forskning og utdanning (NIFU) 20 og Norges forskningsråd (NFR) 21 som har ansvaret for forskningsstatistikken. Det tar lang tid å beregne hvor store økonomiske ressurser som benyttes til forskning i et land, særlig dersom man skal se på de ulike faggruppene. Derfor finnes ikke beregninger fra årene etter 2001 tilgjengelige når denne utredningen skrives.
I 2001 gikk 24,5 milliarder kroner til alt forskning og utviklingsarbeid i Norge, mot 20,3 milliarder i 1999. 22 De siste estimatene for 2002 tyder på en ytterligere økning (totalt 25,4 milliarder kroner). Målt som andel av bruttonasjonalproduktet (BNP) utgjorde dette 1,6 % i 2001. Andre nordiske land hadde en høyere BNP-andel det året: Sverige 4,3 %, Finland 3,4 %, Island 3,1 % og Danmark 2,4 %. Gjennomsnittet for OECD og EU i 2001 var henholdsvis 2,3 og 1,9 %.
Det er flere grunner til at Norge bruker mindre penger på forskning enn land det er naturlig å sammenlikne seg med. For det første gjør oljeinntektene at Norge har et høyt BNP. For det andre er næringslivets andel av forskningen relativt sett lav. Omtrent halvparten av utgiftene til norsk forskning kommer fra næringslivet, mot ca. 70% i Sverige og Finland.
Fagområdet medisin stod for 18% av driftsutgiftene til all forskning utført i offentlig sektor i 2001. Som angitt tidligere er det vanskelig å beregne nøyaktig hvor stor del av den medisinsk og helsefaglige forskningen som næringslivet utfører, fordi denne sektoren ikke gir informasjon om hvordan utgiftene fordeler seg på fagområder 23 .
Norge er et land med gode forutsetninger for å drive medisinsk og helsefaglig forskning. Vi har god økonomi, et høyt utdanningsnivå og en stabil og homogen befolkning. Likevel bruker Norge altså mindre penger og ressurser på forskning i forhold til land det er naturlig å sammenlikne seg med. Eksempelvis bruker Sverige mer enn dobbelt så mye penger som Norge målt i kroner per innbygger.
6.2.2 Vitenskapelig produksjon
Den enkleste måten å måle vitenskapelig produksjon på, er å telle antall publiserte artikler og å beregne siteringsindeksen (hvor ofte andre forskere referer til norske publikasjoner). Siteringsindeksen anses som en indikator på kvaliteten av den forskningen som utføres.
I perioden 1998-2002 var omkring 0,55% av alle medisinske artikler som ble publisert i verden, norske. 24 Innen klinisk medisin var tilsvarende tall 0,7%. Norge har en større vitenskapelig produksjon i forhold til folketallet enn verdensgjennomsnittet, men vi ligger relativt lavt sammenliknet med resten av OECD-landene. Blant de nordiske landene produserer svenske forskere flest artikler ”per hode”, mens Norge ligger lavest.
Det har vært en tendens til at artikler med norske førsteforfattere er blitt sitert sjeldnere enn artikler fra de øvrige nordiske landene. Ferske data tyder på at dette er i ferd med å endre seg, og den relative siteringsfrekvens for Norge ligger nå på linje med Sverige og Finland, men bak Danmark. 25 Siteringsindeksen varierer mellom ulike fagfelt.
6.2.3 Ekstern evaluering
Norges forskningsråd gjennomførte i 2004 en ekstern og uavhengig evaluering av medisinsk og helsefaglig forskning. Selv om de ulike institusjonene og faggruppene kom ulikt ut, var forfatterne bak rapporten enige om tiltak som kan føre til en styrking av norsk forskning 26 :
Økte bevilgninger til forskning og et bedre system for å beskrive økonomi og finansieringskilder.
Bedre infrastruktur i forskningen, med spesiell vekt på større enheter, programbasert forskning, økt samarbeid mellom klinisk forskning og grunnforskning, og mer internasjonalt samarbeid
Bedre ”belønning” av forskere som oppnår gode resultater
Større satsing på forskningsområder der Norge har særskilte muligheter
Mer vekt på publisering i internasjonale tidsskrifter og på publikasjonenes kvalitet når man vurderer forskernes kompetanse
I denne rapporten ble ikke reguleringer spesifikt nevnt som et problem eller hinder for medisinsk og helsefaglig forskning i Norge.
6.3 Forskning i endring – fremtidige utfordringer
6.3.1 Profesjonalisering
Kravet om et kunnskapsbasert helsevesen vil øke i fremtiden. Det vil ikke bli godtatt å innføre nye metoder eller ny teknologi uten at det er vitenskapelig belegg for at disse virker, og uten at effekten følges opp over tid. Da vil også ressursene som brukes til forskning øke, og dermed kravene til forskningens effektivitet og nytteverdi.
Utviklingen av medisinsk og helsefaglig forskning kan sammenliknes med den industrielle revolusjon: Forskningen har beveget seg fra enkeltmannsforetak og hjemmeproduksjon til større, regulerte enheter. I løpet av de siste årene har vi sett en økt satsing på programbasert forskning og på forskning som skal føre til produktutvikling og kommersialisering. For eksempel gikk 60% av Forskningsrådets utgifter til området Medisin og helse i 2001 til programmer og strategiske satsinger. Enkelte forskningsmiljøer har uttrykt bekymring for at slik satsing på kommersiell og anvendt forskning kan fortrenge grunnforskningen. Universitetene har tradisjonelt vært den frie grunnforskningens bastion, men nå presses også disse institusjonene i stigende grad til å dokumentere nytte og relevans av sin forskning. 27
6.3.2 Teknologisk utvikling
Den teknologiske utviklingen går raskt, og gjør det umulig å ”spå” hvilke muligheter medisinsk og helsefaglig forskning vil få i fremtiden.
Det kanskje beste eksempelet på hvor raskt utvikingen går, finnes innen genteknologien: Ved genetiske undersøkelser i forbindelse med kreftforskning, var det tidligere bare mulig å påvise skader, måle aktiviteten eller bestemme kopitall til ett og ett gen om gangen. Dette er en meget tidkrevende prosess. Mange gener kjenner vi ikke funksjonen til, slik at det ikke er mulig på forhånd å tenke seg at en defekt i akkurat dette genet kan ha sammenheng med kreftutvikling. Mikromatriseteknologien har gjort at man kan undersøke flere titusener av gener samtidig, og dermed å lage ”molekylære portretter” av brystkreft, føflekkreft og flere andre kreftformer. Det er ikke lenger nødvendig å ”gjette” hvilke gener som vil være mest relevante før forskeren gjennomfører analysene. 28
Et annet eksempel på hvor raskt utviklingen går finner vi ved det humane genom-prosjektet: Da kartleggingen av den menneskelige genmassen begynte så smått i 1990, regnet forskerne med at det ville ta minst 15 år å fullføre. Prosjektet ble erklært avsluttet våren 2003 - to år tidligere enn planlagt. Et lite norsk firma arbeider nå med en metode for å kartlegge enkeltmenneskers arvemateriale i løpet av få dager.
Så langt kan det se ut som om interessen for forskningsetikk og regulering har økt i takt med den teknologiske utviklingen. Vi husker den verdensomspennende diskusjonen omkring kloning av mennesker og dyr etter at sauen Dolly ble klonet i 1997, noe som resulterte i lover som forbyr kloning av mennesker. Det er ikke mulig å forutsi fremtidens teknologiske utvikling, men høyst sannsynlig vil den gå like raskt. Fremtidens forskere vil utvikle metoder som vi i dag ikke har mulighet til å forestille oss – eller til å regulere. På grunn av den raske utviklingen er det vanskelig å ha detaljerte regler for bruken av ulike metoder, og det er umulig å lage slike regler for fremtidens metoder som langt på vei er ukjente. Desto viktigere er det å ha noen grunnleggende prinsipper som kan fungere som veivisere i møte med den teknologiske utviklingen. Som samfunn og fellesskap er det aktiviteter og virksomheter vi ikke ønsker – selv om de skulle være teknologisk mulige. En aktiv, åpen debatt om slike spørsmål utover fagmiljøene er avgjørende for denne grensesettingen.
6.3.3 Internasjonalisering
Forutsetningene for god helse er knyttet til internasjonale forhold. Det har blitt enklere og vanligere å reise mellom ulike land og verdensdeler, noe som fører til raskere spredning av smittsomme sykdommer. Både nasjonale hensyn og solidaritet med andre befolkningsgrupper krever at land med god økonomi og høyt utdanningsnivå deltar i sykdomsovervåking og i forskningsprosjekter som omhandler internasjonal helse. Det er ønskelig og rimelig at slik forskning prioriteres.
Bekjempelsen av SARS-epidemien i 2003 er et eksempel på vellykket internasjonalt samarbeid. Rask innsats av forskere gjorde det mulig å identifisere og karakterisere viruset som forårsaker sykdommen. På et tidlig tidspunkt hadde vi mulighet for å diagnostisere sykdommen, og å innføre effektive tiltak for å forhindre videre spredning. Dette begrenset epidemien slik at den var over i løpet av kort tid.
Den samme utviklingen har gjort det lettere for norske forskere å samarbeide med utenlandske miljøer. Vi kan måle hvor ofte norske forskere samarbeider med utlandet ved å se på hvor ofte artikler har forfattere fra flere land. Gjennom de siste 20 årene har det vært en sterk økning i andelen av slike publikasjoner der førsteforfatteren er norsk. 29 I perioden 1998-2002 hadde omkring 40% av alle artikler innen klinisk medisin minst én utenlandsk medforfatter, oftest fra Sverige eller USA.
Internasjonalt samarbeid er nødvendig for å videreutvikle norske forskeres kompetanse. Vi er et lite land, og mange forskere spesialiserer seg på små felt der det er umulig å finne kolleger som arbeider med de samme problemstillingene uten å krysse landegrenser. Internasjonalisering av forskningen er viktig for forskningens kvalitet. Norsk forskning har ved flere anledninger vært kritisert for manglende samarbeid med andre land. 30
Internasjonalt samarbeid krever nye reguleringsformer. Det er behov for å kunne kontrollere informasjonen som gis, og det trengs retningslinjer for transport av data og biologisk materiale over landegrenser.
7 Reguleringsbehovet
7.1 Samfunnets behov for forskning
I kapittel 3 har vi beskrevet hovedkravene til medisinsk og helsefaglig forskning, og hva som kjennetegner denne typen forskning i forhold til andre virksomheter. Kravene gjenspeiler i hovedtrekk samfunnets forventninger til forskningen: Den skal være relevant for samfunnets behov, den skal ha tilstrekkelig kvalitet, og den skal være etisk forsvarlig. Eksempelet under illustrerer hvordan samfunnet har nytte av forskning av god kvalitet, og potensiell skade av det motsatte:
I dag vaksineres de fleste barn i Norge mot alvorlige barnesykdommer. Utviklingen av vaksiner har kommet samtidig med en økt forekomst, eller økt diagnostisering, av autisme hos barn. For få år siden ble det fremsatt en hypotese om en årsakssammenheng mellom MMR-vaksinen (mot meslinger, kusma og røde hunder) og autisme. Dette førte blant annet til oppslag i aviser og fjernsyn, der foreldre med autistiske barn stod frem og advarte mot vaksinen. Andelen norske barn som ble vaksinert sank, og faren for sykdomsutbrudd økte.
Senere har flere studier fra Danmark og Storbritannia vist at det ikke er noen sammenheng mellom MMR-vaksine og autisme. Samtidig viser det seg at den første undersøkelsen var metodisk uholdbar, og at forskerne mottok penger fra en rettshjelpsorganisasjon som hadde til hensikt å kreve erstatning for foreldre med autistiske barn. Det er fortsatt uenighet om sammenhengen mellom MMR-vaksine og autsime, men store epidemiologiske studier har svekket de opprinnelige hypotesene om en sammenheng kraftig. Dersom forskere og helsemyndigheter ikke hadde avsatt penger og tid til å gjennomføre store og krevende studier, kunne vi risikert en fortsatt ubegrunnet nedgang i vaksinasjonen og øket forekomst av kusma, meslinger og røde hunder.
Samfunnets interesser kan komme i konflikt med det enkelte individs interesser. Det gjelder først og fremst den enkelte forskningsdeltakers interesser, men også den enkelte forskers interesser.
Historisk finnes en rekke eksempler på at samfunnets interesser har gått foran enkeltindividets interesser innen medisinsk og helsefaglig forskning. Ifølge Helsinki-deklarasjonen skal imidlertid hensynet til enkeltpersonen, eller deltakeren, alltid settes først. Det er derfor grunn til å se nærmere på enkeltindividenes motivasjoner for å være deltakere i medisinsk og helsefaglig forskning.
7.2 Deltakernes behov for beskyttelse
7.2.1 Deltakernes motivasjon
Medisinsk og helsefaglig forskning styrker vår mulighet til å forebygge, diagnostisere og behandle sykdom. Derfor vil forskningen på sikt også komme den enkelte forskningsdeltaker til gode. Som regel er ikke dette tilstrekkelig for å delta. Hva som gjør at en person sier seg villig til å være med i en studie, varierer etter bakgrunn og formål.
Alvorlig syke kreftpasienter kan ønske å delta i en studie selv om denne kan påføre vedkommende store ulemper, dersom dette oppveies av en mulig helsegevinst i form av økt sjanse for å overleve eller forbedret livskvalitet. Deltakere i befolkningsundersøkelser kan på sin side ha forventninger om å få avdekket disposisjon for sykdom (for eksempel høye kolesterolverdier), eller bare få en gratis ”helsesjekk”. Andre deltar ut i fra en kollektiv solidaritetstanke. Åpenhet omkring medisinsk forskning og en positiv holdning til slik virksomhet fra helsemyndigheter og samfunnet for øvrig bidrar til at pasienten får tillit til forskningen og forståelse for nødvendigheten av å delta.
7.2.2 Informasjonsbehovet
Deltakere i medisinsk og helsefaglig forskning har behov for å bli informert om hva deltakelsen innebærer på en forståelig måte. Slik informasjon ligger i det informerte samtykket (se kapittel 27). De vil i tillegg ha behov for svar på konkrete spørsmål underveis, enten fra forskeren selv eller fra nære medarbeidere. Dette gjelder også observasjonsstudier. Det vil for eksempel være nødvendig å informere deltakeren om en bestemt måling vil følges opp av tiltak, eller om disse bare registreres. En person som deltar i en studie der man måler kolesterolverdien i blodet, må få vite om han eller hun blir informert dersom verdiene er for høye, og hvorvidt slike funn etterfølges av rådgivning og eventuell behandling. Men i noen tilfeller vil det være umulig å gi nøyaktig informasjon om hva deltakelse innebærer: Dersom deltakeren avgir biologisk materiale som skal lagres i mange år, kan det være vanskelig å ha full oversikt over hvilke analyser som skal gjøres i fremtiden.
Intervensjonsstudier krever spesiell informasjon til deltakeren. Ved slike studier må deltakeren beskyttes mot skade i forbindelse med testing av nye former for behandling og/eller diagnostiske inngrep. Vedkommende må føle seg trygg på at utilsiktede virkninger registreres og formidles til deltakeren, og at forsøket eventuelt avbrytes. Disse spørsmålene drøftes grundigere i utredningens del V.
7.3 Forskernes behov for beskyttelse
Når forskningsetikk og regulering av medisinsk og helsefaglig forskning diskuteres, er det først og fremst beskyttelsen av den enkelte forskningsdeltaker som står i sentrum. Etiske og juridiske normer fremstår derfor ofte som en avveining mellom deltakernes beskyttelsesbehov og samfunnets kunnskapsbehov. Den enkelte forskers interesser og behov for beskyttelse vil i en slik sammenheng av åpenbare grunner være underordnet.
Den enkelte forskers ideelle og beskyttelsesverdige interesser utsettes imidlertid for stadig sterkere press. Det er ikke bare på grunn av økt reguleringsintensitet, men kanskje vel så mye på grunn av kommersielle interesser og økt institusjonalisering.
Forskningsfrihet er et begrep med et uklart innhold i et rettslig perspektiv, og delvis i et etisk perspektiv. Forskningsfrihet kan defineres som forskeres rett til fri og uavhengig søken etter kunnskap. Rettslig sett kan forskningsfriheten utledes fra den alminnelige tanke-, handle- og ytringsfriheten. Forskningsfriheten innebærer da at det ikke må legges unødvendige hindringer i veien for forskningen. Forskningsfrihet og reguleringer står tilsynelatende i et motsetningsforhold til hverandre. Men ideelt sett skal reguleringer fremme god forskning ved å legge forholdene til rette for en sunn forskningsfrihet. Det kan i den forbindelse spørres om forskningsfriheten bør sikres ved hjelp av reguleringer. Hva skal i tilfelle forskningsfriheten sikres mot?
Utvalget mener det er viktig å sikre forskeres tilgang til egne data og rett til å publisere sine funn uavhengig av oppdragsgivere og finansieringskilder. Utvalget har også vært oppmerksomme på forskeres opphavsrett, patentrett, eiendoms-/disposisjonsrett og andre mer privatrettslige forhold.
7.4 Noen etiske aspekter ved medisinsk og helsefaglig forskning
Forskning stiller særlige krav til etisk bevissthet hos dem som utøver virksomheten. Dette gjelder i særlig grad medisinsk og helsefaglig forskning. Forskningsetikk berører vanskelige etiske spørsmål. Når oppstår et liv? Hvilke belastinger skal enkeltmennesket akseptere til nytte for fellesskapet? Utviklingen av medisinsk forskningsetikk, regulering og lovgivning er omtalt i detalj i kapittel 9 og kapittel 10. Her ønsker vi bare å peke på noen hovedtrekk innen medisinsk og helsefaglig forskningsetikk.
Samfunnet er avhengig av at forskeren orienterer seg om mulige etiske problemstillinger i forbindelse med forskningsprosjektet, og om hvordan disse står i forhold til den aktuelle reguleringen. Dessverre viser det seg at reglene ikke alltid overholdes 31 . Dette kan skyldes slurv fra forskernes side, eller at regelverket er for komplisert. På den annen side kjenner vi ingen tilfeller fra Norge i nyere tid der det har forekommet alvorlig misbruk av data fra forskningsprosjekter. I 2001 ble det nedsatt en kommisjon på bakgrunn av konkrete påstander om at utsatte menneskegrupper i Norge hadde vært utsatt for uetisk medisinsk forskning med LSD, elektroder og radioaktive stråler, uten deltakernes samtykke, i perioden 1945-1975. Kommisjonens utredning ble avgitt i desember 2003, 32 og konklusjonen var klar: Ikke på noen av de områdene som ble undersøkt, kunne påstandene om uetiske forsøk bekreftes.
Forskningsetikk dreier seg i første rekke om å unngå å påføre deltakerne skade eller unødvendige belastninger, og å beskytte personvernet. Etiske avveininger avgjør som oftest om et prosjekt kan gjennomføres eller ikke. Men problemet kan også være omvendt: Noen vil mene at det er uetisk å hindre forskning som kan ha viktige helseeffekter enten det dreier seg om å hindre spesielle forskningsprosjekter, generell underfinansiering eller unødvendige reguleringer. Det kan også være vanskelig å forholde seg til resultater fra forskningsprosjekter i utlandet, under betingelser som ikke er akseptert i Norge. Skal vi anvende slike resultater til å behandle norske pasienter? Det kan for eksempel være vanskelig og uetisk å holde behandling tilbake dersom den er vist å være bedre enn de alternativene som brukes i dag.
Medisinsk og helsefaglig forskningsetikk favner altså langt bredere enn spørsmål omkring skade og personvern. Forskeres uavhengighet er et spørsmål med klare etiske aspekter. Det samme gjelder forskningens kvalitet: Det er uetisk å be personer delta i forskningsprosjekter der forarbeidet ikke er godt nok, slik at det på forhånd er gitt at studien ikke vil kunne bidra til å belyse den aktuelle problemstillingen.
Etikk handler om etisk bevissthet hos alle grupper, individets ansvar for fellesskapet og avveininger mellom den enkeltes belastninger og samfunnets beste. Dagens etiske retningslinjer er i stor grad utarbeidet med tanke på klinisk og terapeutisk forskning, og ikke epidemiologisk forskning. 33 Reglene sier at en deltaker ikke skal utsettes for større risiko enn den sykdommen medfører. Hva da med friske deltakere i medisinsk og helsefaglig forskning? Skal disse ikke akseptere noe annet enn null-risiko? De aller fleste ”inngrep” innebærer i hvert fall en teoretisk risiko, for eksempel en røntgenundersøkelse (som gir en viss strålebelastning) eller det å avlegge en blodprøve (som medfører en minimal, men likevel reell, fare for komplikasjoner). Bør man likevel delta, og akseptere en meget liten risiko, selv om ”gevinsten” tilfaller andre?
7.5 Prioriteringer
Ressurser som brukes til forskning er – som alle andre ressurser i samfunnet – begrenset. Vi må velge om disse midlene skal brukes til å lete etter årsakene til hjerteinfarkt eller demens, prøve ut nye behandlinger for bryst- eller lungekreft, eller om vi skal lete etter oppgavene til gener med ukjent funksjon.
Vanlige diagnoser har ofte sterke pasientgrupper som er pådrivere for forskning, mens sjeldne diagnoser kanskje mangler slike påvirkningsorganer. Faktisk kan dødeligheten av en sykdom også påvirke forskningsinnsatsen – i negativ forstand: Lungekreft og brystkreft er hyppig forekommende, alvorlige sykdommer. Pasienter med lungekreft lever kortere, og er derfor til enhver tid en mindre gruppe enn pasienter med brystkreft. Hvem skal tale deres sak? Og hva med alle de sjeldne tilstandene? Mange diagnoser er sjeldne, men til sammen har mange mennesker en sjelden diagnose. Skal vi forske mindre på de tilstandene som rammer færre?
Det finnes mange motiver for å gjennomføre et forskningsprosjekt. På samme måte vil prioriteringen styres av flere forhold enn den potensielle helsegevinsten. Vil noen ønske å publisere resultatene? Hvilke økonomiske interesser ligger bak? Utviklingen innen medisinsk og helsefaglig forskning går mot en sterkere styring og økt internasjonalt samarbeid (jf kapittel 6). Det første har blant annet ført til mer forskning på sykdommer som rammer tradisjonelt svakere stilte grupper, for eksempel typiske ”kvinnesykdommer” som leddgikt og beinskjørhet. Norges forskningsråd og andre aktører satser på forskningsprogrammer, og prøver på den måten å styre forskningen slik at områder som til enhver tid anses som viktige, prioriteres.
7.6 Hvorfor regulere medisinsk og helsefaglig forskning?
Utvalget er av den oppfatning at god forskning er en grunnleggende positiv og nyttig virksomhet. Samfunnet er derfor tjent med at det legges til rette for god forskning. Dette krever tilstrekkelige ressurser og hensiktsmessige virkemidler i styringen av denne aktiviteten. Reguleringer er et sentralt virkemiddel i så måte.
Det er åpenbare grunner til at medisinsk forskning som involverer mennesker, reguleres. Reguleringer skal verne om menneskeverdet, og ta tilbørlig hensyn til forskningsdeltakeres, samfunnets, forskningens, forskernes, industriens og andres særlige interesser. Disse interessene settes ofte opp mot hverandre, men er langt på vei sammenfallende. Forskningsfrihet og reguleringer står heller ikke nødvendigvis i et motsetningsforhold til hverandre. Ideelt sett skal reguleringer fremme god forskning. 34
I det følgende går utvalget først gjennom gjeldende reguleringer i del III for å se om de er hensiktsmessige slik de er, noe utvalget konkluderer med at de ikke er i kapittel 20. I del IV drøftes en del prinsipielle forhold, og i del V drøftes utvalgets forslag til tiltak som skal sikre klar og hensiktsmessig regulering av medisinsk og helsefaglig forskning. I Del VI presenteres utvalgets forslag til lov om medisinsk og helsefaglig forskning med kommentarer til de enkelte bestemmelser.
Fotnoter
Frascati-manualen, se kapittel 5
Tranøy (1986).
http://www.kunnskapssenteret.no
Kvalitativ betegner det som har med egenskaper eller kjennetegn å gjøre, kvantitativ betegner det som har med mengde eller antall å gjøre.
Norges forskningsråd (2001).
Norges forskningsråd (2001).
Definisjonen er hentet fra Norsk institutt for studier av forskning og utdanning (NIFU) og brukes også av OECD.
Deler av dette avsnittet er hentet fra Den nasjonale forskningsetiske komité for medisin (NEM). Medisinsk epidemiologi og forskningsetikk. NEM (2004).
Madsen et al (2002).
Hviid et al (2004).
Rosen et al (2000).
Socialstyrelsens Epidemiologiske Centrum (2002)
NEM (2003).
NEM (2004).
Ruyter (2000).
Spesialisthelsetjenesteloven (§ 3-8)
Norsk institutt for forskning og utdanning, personlig meddelelse
Sundnes & Mørland (1997)
Se også del 15.4 Arbeidstakeroppfinnelsesloven og kommersialisering av forskningsresultater
http://www.nifu.no
http://www.forskningsradet.no
Norges forskningsråd (2003).
Personlig meddelelse, Norges forskningsråd
Aksnes (2003).
Aksnes (2004).
Norges forskningsråd (2004).
Forskning.no (2004 )
Forus et al (2001).
Aksnes (2003).
Se avsnitt 6.2.3
Datatilsynet (2004).
NOU 2003:33
NEM (2004).
Se del IV hvor dette er nærmere drøftet.