Del 5
Likeverdig og rask tilgang til effektive legemidler
18 Sikre tilgang til legemidler

Figur 18.1
Målet om likeverdig og rask tilgang til effektive legemidler, jf. kapittel 2.3 kan deles i to. For det første må legemidlene faktisk være tilgjengelig på det norske markedet, og kunne distribueres til pasienter i hele landet. Dette drøftes i dette kapitlet. For det andre må det foreligge en finansieringsordning som sikrer at pasienter får likeverdig tilgang til effektive legemidler uavhengig av betalingsevne. Dette drøftes i kapittel 19. Målsetningen om rask tilgang ivaretas delvis gjennom Norges deltakelse i det europeiske legemiddelsamarbeidet. Dette sikrer at legemidler får markedsføringstillatelse i Norge gjennom de samme godkjenningsprosedyrene som resten av EØS. Videre er det viktig at behandlingen av refusjonssaker og nye metoder i spesialisthelsetjenesten ikke medfører unødvendige forsinkelser i pasientenes tilgang til legemidler.
Tilgangen til legemidler ivaretas av forsyningskjeden. Denne består av produsenter/leverandører, grossister og apotek, samt andre utsalgssteder, se kapittel 4. Myndighetene kan ikke pålegge industrien å markedsføre legemidler i Norge. Norge er et relativt lite marked, og det er betydelige kostnader med å markedsføre legemidler. I kapittel 18.1 omtales legemidler med markedsføringstillatelse i Norge, og tilgang til legemidler som ikke har markedsføringstillatelse. I kapittel 18.2 omtales apotek og andre utsalgssteder. Tiltak for enklere tilgang på legemidler vurderes i kapittel 18.3. Leveringssikkerhet i tilfeller der den ordinære forsyningskjeden kan oppleve sviktsituasjoner er omhandlet i kapittel 18.4. Forfalskede legemidler representerer en trussel mot folkehelsen. Dette er omtalt i kapittel 18.5.
18.1 Tilgangen på legemidler i Norge
18.1.1 Legemidler med markedsføringstillatelse i Norge
Til sammen inneholder godkjente legemidler noe over 1500 virkestoff. I 2014 ble det registrert 57 nye, mens det ble avregistrert 27 virkestoff. Alle de nye virkestoffene ble gitt markedsføringstillatelse i sentral prosedyre. Ved utgangen av 2014 var det 2276 ulike legemiddelnavn i Norge.
Antall legemidler på markedet i Norge øker årlig. Virkestoffene og legemiddelnavnene er fordelt på omlag 15 000 markedsføringstillatelser. Dette skyldes at ulike styrker, legemiddelpakninger og pakningsstørrelser har hver sin markedsføringstillatelse.
Ikke alle legemidler som godkjennes i sentral prosedyre og i samarbeidsprosedyrene, ender opp med at legemidlene plasseres på markedet i Norge. Dette kan skyldes at legemidlene ikke benyttes i Norge, eller fordi markedet er så lite at produsenten ikke markedsfører det her. Tilgangen til de legemidlene som benyttes i Norge vurderes likevel å være god.
18.1.2 Ordningen med spesielt godkjenningsfritak
Legemidler skal ha markedsføringstillatelse før de selges. Helsepersonell skal som hovedregel forskrive legemidler som har markedsføringstillatelse i Norge. Dette sikrer:
at myndighetene har vurdert at legemidlene har et positivt nytte-/risikoforhold når de brukes i samsvar med den godkjente preparatomtalen
like konkurransevilkår for industrien ved at ikke godkjente legemidler ikke omsettes i konkurranse med godkjente legemidler
at legemidlene som forskrives er prisregulert (dette er ikke tilfellet for legemidler uten markedsføringstillatelse)
Det er ikke alltid pasienten kan benytte legemidler med markedsføringstillatelse. Dette kan skyldes at det ikke finnes godkjente legemidler i Norge som har effekt mot tilstanden som skal behandles, eller at pasienten av andre årsaker ikke kan bruke godkjente legemidler.
Ordningen med spesielt godkjenningsfritak gjør det mulig å bruke legemidler som ikke er godkjent i Norge. Ordningen er basert på en unntaksadgang i legemiddeldirektivet1. Legemidler uten markedsføringstillatelse kan bare benyttes der legemiddel med markedsføringstillatelse ikke dekker det medisinske behovet. Forskriver må derfor i søknaden om godkjenningsfritak, gi en medisinsk begrunnelse for hvorfor et markedsført produkt ikke kan benyttes.
Legemidler som har markedsføringstillatelse i EØS-området, USA eller i et land der kravene til legemidler er på nivå med kravene i Norge, er tilgjengelige gjennom en såkalt notifikasjonsordning2. Det samme gjelder for biologiske legemidler som er oppført på egen liste fastsatt av Statens legemiddelverk. For øvrige legemidler må legen sende en søknad til Legemiddelverket om godkjenningsfritak, og søknaden må godkjennes før legemidlet kan utleveres til pasienten. Det er lagt til rette for elektronisk søknad om godkjenningsfritak i e-reseptløsningen.
Legemiddelverket har nylig kartlagt hvilke legemidler som utleveres på grunnlag av godkjenningsfritak, og det medisinske behovet for å benytte disse.
De fleste legemidlene som forskrives anses å ha et godt begrunnet medisinsk behov.
Noen legemidler forskrives på grunn av en mangelsituasjon som følge av at legemidler med markedsføringstillatelse ikke kan leveres.
Det er også en viss forskrivning på godkjenningsfritak av stoffer som regnes som legemidler, men der det ikke finnes produkter med markedsføringstillatelse.
Basert på den kartleggingen som er foretatt, vurderer departementet at bruken av godkjenningsfritak i Norge samsvarer med de overordnede prinsippene om at ordningen kun skal benyttes der det er et reelt medisinsk behov, hvor legemiddel med markedsføringstillatelse ikke kan benyttes. Det anses derfor ikke å være behov for tiltak.
18.1.3 Compassionate use
I noen tilfeller kan et legemiddelfirma tilby og finansiere bruk av et legemiddel som ikke har markedsføringstillatelse til en gruppe pasienter (compassionate use). Statens legemiddelverk skal godkjenne bruken før oppstart. Forutsetningene er at legemidlet tilbys pasienter med kroniske, livstruende eller alvorlig invalidiserende sykdommer, som ikke kan inkluderes i kliniske studier og som ikke har nytte av behandling med legemidler som har markedsføringstillatelse. Videre forutsettes det at det finnes tilstrekkelig dokumentasjon på legemidlets sikkerhet og effekt, og at produsenten har sendt inn søknad om markedsføringstillatelse og/eller har pågående kliniske studier på legemidlet. Siden 2010 har Legemiddelverket mottatt 13 søknader om Compassionate use. Helse- og omsorgsdepartementet vil gjøre ordningen bedre kjent for pasienter og helsepersonell, eksempelvis gjennom portalen helsenorge.no.
18.2 Apotek og andre utsalgssteder
Apotek skal sikre forsvarlig utlevering av legemidler til sluttbrukere. Dette fremgår av apoteklovens formålsbestemmelse. Videre skal apotek medvirke til riktig legemiddelbruk i befolkningen og til god tilgjengelighet til legemidler og farmasøytiske tjenester i alle deler av landet. Apotekene er en viktig kanal for informasjon til pasienter om riktig bruk av legemidler, regelverk for refusjon, egenandeler og generisk bytte. Apotekpersonalet veileder om bruk av reseptfrie legemidler og henviser ved behov til lege eller annet helsepersonell. Ved ekspedering av legemidler på resept gjør apoteket en vurdering av resepten for å fange opp eventuelle feil og sikre at legemidlene utleveres i tråd med legens forskrivning. Apotekenes rolle for å sikre god kvalitet i legemiddelbehandlingen omtales nærmere i kapittel 7.1.4.
18.2.1 Organisering av apotek i Norge
Før apotekloven fra 2001 var alle apotek, unntatt de offentlige sykehusapotekene, eid av enkeltpersoner og organisert som enkeltmannsforetak. Siden 2001 har det skjedd en omfattende etablering av kjeder med tilhørende grossister. Tre store kjeder dominerer i dag markedet.
Tabell 18.1 Oversikt over apotek
År Per 1. januar | Boots Norge AS, heleide | Apotek 1, heleide | Vitusapotek, heleide | Sykehusapotek | Selvstendige apotek og deleide kjedeapotek | Sum |
|---|---|---|---|---|---|---|
2001 | - | - | - | 28 | 369 | 397 |
2002 | 66 | 77 | 91 | 28 | 199 | 461 |
2003 | 89 | 130 | 100 | 30 | 153 | 502 |
2004 | 109 | 155 | 106 | 30 | 120 | 520 |
2005 | 114 | 168 | 113 | 30 | 110 | 535 |
2006 | 120 | 180 | 120 | 31 | 103 | 554 |
2007 | 127 | 185 | 132 | 31 | 98 | 573 |
2008 | 137 | 202 | 149 | 33 | 92 | 613 |
2009 | 138 | 215 | 163 | 33 | 87 | 636 |
2010 | 144 | 226 | 168 | 33 | 91 | 662 |
2011 | 146 | 236 | 172 | 33 | 95 | 682 |
2012 | 147 | 243 | 179 | 32 | 106 | 707 |
2013 | 147 | 252 | 190 | 32 | 117 | 738 |
2014 | 150 | 263 | 195 | 32 | 127 | 767 |
2015 | 151 | 282 | 210 | 32 | 125 | 800 |
Kilde: Apotekforeningen
1. januar 2015 var det 18 frittstående apotek i Norge, som ikke var tilknyttet noen av de tre apotekkjedene. Etter apotekloven kreves det konsesjon både for eierskap (apotekkonsesjon) og drift av apotek (driftskonsesjon). For å drive et apotek kreves det i utgangspunktet utdanning som master i farmasi (provisorfarmasøyt). Et filialapotek er et apotek under samme driftskonsesjon som et hovedapotek. Et filialapotek kan ledes av en reseptarfarmasøyt (bachelor i farmasi). Per 3. desember 2014 var det 71 filialapotek i Norge3.
Boks 18.1 Apotekkonsesjon
Apotekloven § 2-3 innebærer at tilvirkere av legemidler og personer med rekvireringsrett for legemidler ikke kan gis apotekkonsesjon. Denne eierbegrensningsregelen skal hindre uheldig innflytelse på apotekenes legemiddelomsetning. Med dagens situasjon der store internasjonale aktører eier de fleste apotekene, kan det være krevende å forvalte dette regelverket. Statens legemiddelverk har foreslått å oppheve regelen om at tilvirker ikke kan eie apotek. Legemiddelverket mener bestemmelsen ikke er nødvendig for oppnåelsen av legemiddel- og konkurransepolitiske målsetninger. Departementet vil vurdere om det bør fremmes forslag til endringer i apotekloven. I denne vurderingen må det tas hensyn til at forbrukernes tillit til apoteknæringen som en objektiv og uavhengig faghandel for legemidler må opprettholdes, og at apotek skal sikre tilgjengelighet til alle legemidler og farmasøytiske tjenester.
Sykehusapotek er et apotek med lokaler i et sykehus, og som har legemiddelforsyning til sykehuset som sin primæroppgave. De fleste sykehusapotekene er eid av de regionale helseforetakene. To sykehusapotek er eid av ideelle stiftelser.
Medisinutsalg
I områder uten apotek, kan det etableres medisinutsalg. Medisinutsalg er et separat utleveringssted for legemidler underlagt et lokalt apotek. Medisinutsalg er ofte lokalisert i en dagligvarebutikk. Mange medisinutsalg har også en avtale med apotek som innebærer at utsalget leverer ut pakker med reseptpliktige legemidler til pasienter, etter at reseptene er ekspedert fra apoteket. Det er nesten 1000 medisinutsalg i Norge.
18.2.2 Tilsyn med apotek
Statens legemiddelverk foretar tilsyn med drift av apotek. Statens helsetilsyn fører tilsyn med helsepersonell etter helsepersonelloven. De to etatene samarbeider om tilsynet med apotek.
Legemiddelverkets tilsyn skal avdekke ulovlig markedsføring, tilvirkning og salg, og gir myndighetene kunnskap som er viktig for å forvalte og videreutvikle regelverket på området.
Legemiddelverket har årlig tilsyn med om lag 40 apotek. Inspeksjonene har vært rettet mot ulike typer apotek. I tillegg er noen tilsyn initiert etter bekymringsmeldinger fra publikum, fylkeslege, apotekansatte mv.
De aller fleste apotek setter i verk tiltak for å rette påpekte avvik etter tilsyn. Tilsynene blir ikke avsluttet før apoteket har dokumentert overfor Legemiddelverket at alle avvik er fulgt opp. Om apotek ikke følger opp påpekte avvik, har Legemiddelverket sanksjonsmuligheter.
18.2.3 Apotekproduksjon
Det er behov for legemidler som ikke er tilgjengelig fra legemiddelindustrien. Det gjelder legemidler som ikke produseres av industrien pga. lav etterspørsel (f.eks. erstattet av mer moderne legemidler), legemidler som trengs i andre styrker eller legemiddelformer enn det industrien tilvirker (f.eks. barnestyrker) eller at markedet midlertidig er gått tom for viktige legemidler (f.eks. morfin injeksjon i 2014). Apotekets leveringsplikt er ikke begrenset til det som kan skaffes fra industrien/grossist. Så sant det er praktisk mulig, plikter apotek å fremstille slike legemidler eller få andre apotek til å fremstille legemidlet for seg. Disse legemidlene går under fellesbetegnelsen «apotekfremstilt» selv om det meste av produksjonen foregår hos firmaer som har spesialisert seg på å produsere legemidler på oppdrag fra apotek. Det er ingen myndighetsgodkjenning av disse legemidlene. Det stilles kvalitetskrav, mens sikkerhet og effekt må vurderes av den som rekvirerer eventuelt i samarbeid med apoteket.
I dag utgjør apotekfremstilte legemidler under 1 pst. av legemiddelomsetningen i Norge. Tidligere hadde alle apotek adgang til å tilvirke legemidler. Men på 1960-tallet ble apotekproduksjonen «industrialisert» ved at bransjen sentraliserte produksjonen av de mest brukte legemidlene. Norges Apotekerforening (NAF) påtok seg produktansvaret for disse legemidlene. Disse legemidlene kalles derfor NAF-preparater og produseres i den såkalte serviceproduksjonsordningen. Det er i dag 110 ulike legemidler i den ordningen. I tillegg til NAF-preparater, er det etterspørsel etter noen hundre andre apotekfremstilte legemidler. De fleste apotek ivaretar leveringsplikten for disse legemidlene gjennom avtale med et apotek som har produksjonsfasiliteter, mens noen apotek, bl.a. sykehusapotekene, i stor grad fremstiller legemidlene selv. Det finnes ingen oversikt over antall apotekfremstilte legemidler, men et grovt anslag tilsier i overkant av 1 million pakninger per år, hvorav de fleste er NAF-preparater.
Myndighetene er opptatt av at rekvirenter og apotekansatte må være klar over forskjellen på industrifremstilt og apotekfremstilt legemiddel, og at apotekfremstilte legemidler ikke skal tilbys i konkurranse med godkjente legemidler (legemidler som har markedsføringstillatelse). Det er f.eks. ikke adgang til å reklamere for apotekfremstilte legemidler.
Det kan være vanskelig for både rekvirenter og apotekansatte å ha dette prinsipielt viktige skillet klart for seg når apotekproduksjonen er sentralisert, når apotekfremstilte produkter tildeles varenummer og kan skaffes gjennom grossist.
Statens legemiddelverk vurderer nå behovet å stramme inn praksis for å tydeliggjøre skillet mellom industrifremstilte og apotekfremstilte legemidler. Samtidig erkjennes det at apotekproduksjon er helt nødvendig for å ivareta medisinske behov, og enkelte av disse legemidlene inngår også i myndighetenes beredskapslister. Legemiddelverket vurderer også hvorvidt disse legemidlene bør ha en form for myndighetsgodkjenning.
18.2.4 Apotekdekningen
Apotekene sikrer befolkningen tilgang til legemidler i hele landet. Apotek har plikt til å forhandle alle legemidler som er tillatt solgt i landet, og har lagerplikt for legemidler som jevnlig rekvireres. Apotekenes leveringsplikt innebærer at de om nødvendig må produsere de legemidlene som ikke er tilgjengelige fra legemiddelindustrien.
Ved behandlingen av St.meld. nr. 18 (2004–2005) Rett kurs mot riktigere legemiddelbruk sluttet Stortinget seg til at legemiddelforsyningen fungerte tilfredsstillende. 1. januar 2005 var det 535 apotek i Norge. Ti år senere har dette tallet økt til 800, jf. tabell 18.1 i kapittel 18.2.1. Mange nye apotek er etablert i sentrale strøk, men apotekdekningen er bedret også i distriktene. Helse- og omsorgsdepartementet ser derfor ikke grunn til å innføre nye tiltak for å stimulere til etablering av flere apotek.
18.2.5 Apotekøkonomi
Apotekene hadde i 2014 en totalomsetning på over 28,2 mrd. kroner inkludert merverdiavgift, en vekst på 9,0 pst. sammenliknet med 2013. De foregående årene var veksten betydelig lavere. Den høye veksten i 2014 kan i stor grad tilskrives økt omsetning av reseptpliktige legemidler. Dette skyldes i hovedsak at svak krone har gitt høyere maksimalpriser i prisrevideringen, jf. kapittel 16.1.
Gjennomsnittlig omsetning per apotek var om lag 36 mill. kroner. Legemidlenes andel av totalomsetningen har gått ned etter 2004. I 2014 utgjorde legemidler 75,8 pst. av apotekenes totale omsetning, mot 83,5 pst. i 2004.
Dersom sykehusapotekene holdes utenfor, var gjennomsnittlig omsetning per apotek 29,5 mill. kroner, og legemidlenes andel av omsetning var 72,2 pst. (reseptpliktige legemidler 62,2 pst. og reseptfrie legemidler 9,9 pst). Apotek har en vesentlig lavere margin på salg av reseptpliktige legemidler enn andre varer. I 2014 bidro salg av reseptpliktige legemidler til 41,2 pst. av primærapotekenes samlede bruttofortjeneste, mens reseptfrie legemidler og andre varer4 bidro med hhv. 18,8 pst. og 40,0 pst. Apotekenes avanse på salg av legemidler er omtalt i kapittel 16.3.
Statens legemiddelverk innhenter årlig regnskapstall fra alle apotek i landet. I 2013 utgjorde driftsresultatet 3,3 pst. av driftsinntektene, mot 6,2 pst. i 2012 og 3,4 pst. i 2011. 30 pst. av primærapotekene hadde negativt driftsresultat i 2013, mot 16 pst. i 2012 og 25 pst. i 2011. Apotek i sentrale strøk er overrepresentert blant apotekene som drives med negativt driftsresultat. Apotek som er eid av en apotekkjede, får regnskapsført en andel av kjedenes felles overheadkostnader. I følge Legemiddelverkets apotekstatistikk er prinsippene for håndtering av varekostnadene endret hos noen apotekkjeder de siste årene. Dette har gitt store resultatutslag, uten at det er mulig å vurdere om det økonomiske grunnlaget for apotekene i realiteten er endret. For å få et fullstendig bilde av økonomien i næringen, må de økonomiske resultatene i de tilhørende selskapene (holdingselskap, kjede og grossist) inkluderes. Nøkkeltallene viser en stabil økonomisk utvikling de siste årene.
Tabell 18.1 viser at det over lang tid har vært en betydelig økning i antall apotek. Siden 2005 har det vært en årlig nettotilvekst på mellom 20 og 40 apotek. I samme periode har det vært en relativt beskjeden vekst i omsetning fra apotek, og legemidlers andel av omsetning har gått ned. Målt i definerte døgndoser har salget av legemidler fra apotek økt gjennomsnittlig med vel 2 pst. per år siden 2010. Antall pakninger solgt fra apotek har i samme periode vært tilnærmet konstant. Økt etterspørsel etter apotektjenester kan altså ikke forklare denne store veksten.
18.2.6 Forsendelse av legemidler fra apotek – internettapotek
Apotekforskriften § 41 annet ledd sier at apotek ikke kan sende reseptpliktige legemidler utenfor apotekets naturlige geografiske kundeområde. Dagens løsninger for nettapotek i Norge er derfor primært begrenset til salg av reseptfrie legemidler og såkalte handelsvarer.
Departementet ønsker å endre regelverket for å åpne for etablering av nettapotek i Norge. Bruk av nettapotek skal skje under betryggende forhold, og må reguleres slik at pasientene sikres god informasjon og at forsendelsen er sikker. Departementet vil sende forslaget på alminnelig høring. Etablering av nettapotek i kombinasjon med løsningen for elektroniske resepter, vil gi befolkningen enda bedre tilgang til trygge og effektive legemidler.
18.2.7 Legemidler utenom apotek (LUA)
LUA-ordningen ble innført i 2003 og tillater at enkelte reseptfrie legemidler kan selges for eksempel i dagligvarebutikker, kiosker og bensinstasjoner. Ordningen skal bedre tilgjengeligheten til velkjente reseptfrie legemidler og gi priskonkurranse mellom apotek og andre utsalgssteder.
Legemiddelverket har det overordnede ansvaret for ordningen og bestemmer hvilke legemidler som kan omsettes. De gjennomgår årlig listen over hva som kan omsettes utenom apotek (LUA-listen).
Det er nedsatt en referansegruppe for LUA-ordningen som består av representanter fra Apotekforeningen, Forbrukerrådet, Konkurransetilsynet, Legemiddelindustriforeningen, Norges Colonialgrossisters forbund, Norges Farmaceutiske Forening og Legemiddelverket. Gruppen skal bidra til å styrke Legemiddelverkets forvaltning av LUA-ordningen, og være et diskusjonsforum for videreutvikling av ordningen.
Legemidler som selges utenom apotek må oppfylle visse krav:
Legemidlene og deres bruksområder skal være godt kjent i befolkningen.
Den enkelte forbruker skal ha tilstrekkelig mulighet til selv å diagnostisere symptomer og tilstand og vurdere behov for behandling, sikkerhet og effekt.
Informasjon om bruk og sikkerhet må være lett tilgjengelig på pakningen og i pakningsvedlegget, og opplysningene må være tilstrekkelige for sikker bruk.
Legemidlets kontraindikasjoner (når legemidlet ikke må brukes) må ikke være for omfattende eller kompliserte.
Det tas også hensyn til faren for overforbruk eller misbruk av det enkelte legemidlet. Ved kjøp av legemidler utenom apotek er det en aldersgrense på 18 år. Personalet i LUA-utsalg har ikke anledning til å gi kunder råd om valg av legemiddel eller informasjon om legemidlenes egenskaper og bruk.
Mattilsynet fører tilsyn med om utsalgsstedene overholder regelverket. I 2014 gjennomførte Mattilsynet 815 tilsyn med LUA-utsalg. Til sammenligning ble det gjennomført 776 tilsyn i 2013.
De to vanligste avvikene er mangelfullt internkontrollsystem og at utsalget ikke har det minimumsutvalget av legemidler som kreves. I 2014 ble 16 utsalg ilagt midlertidig omsetningsforbud av Mattilsynet, men ingen fikk ilagt endelig omsetningsforbud. Dette indikerer at alvorlige avvik fra regelverket er sjeldne.
Det finnes ingen samlet og oppdatert oversikt over antall virksomheter som omsetter legemidler utenom apotek. I 2010 registrerte grossistene salg av legemidler til 6365 virksomheter/utsalg.
Boks 18.2 Paracetamoltabletter fjernes fra LUA i Sverige
De svenske legemiddelmyndighetene har besluttet å stoppe salget av paracetamoltabletter i butikk, blant annet fordi det har vært en økning i antall henvendelser om paracetamolforgiftninger til Giftinformationscentralen i Sverige. Forbudet gjelder fra 1. november 2015.
Totalt forbruk av paracetamol i Norge har økt betydelig de siste årene. Dette skyldes økt forskrivning på resept. Bruken av reseptfri paracetamol har vært uendret eller litt fallende de siste ti årene. Legemiddelverket anbefaler paracetamol som førstevalg. Det er derfor et mål å øke bruken av paracetamol på bekostning av andre smertestillende legemidler, blant annet NSAIDs (ibuprofen, naproksen og diklofenak mv.).
Salget av reseptfri paracetamol har vært stabilt etter 2003, men halvparten av all reseptfri paracetamol selges nå utenom apotek.
Det er ikke vist at salg av paracetamol i butikk fører til flere alvorlige forgiftninger eller dødsfall. Med dagens kunnskap mener Legemiddelverket at det ikke er grunnlag for å gjennomføre ytterligere restriksjoner på salget i Norge. Legemiddelverket deler derfor ikke svenske myndigheters vurdering.
18.3 Enklere tilgang til legemidler
18.3.1 Rekvireringsrett for legemidler
Helsepersonelloven § 11 slår fast at bare leger og tannleger kan rekvirere reseptbelagte legemidler til mennesker. I tillegg har noen grupper helsepersonell en begrenset rekvireringsrett, jf. omtale i kapittel 4.3.
Under influensapandemien i 2009, ble det fastsatt forskrift som ga farmasøyter i apotek midlertidig rett til å rekvirere antiviralia. Econ Pöyry evaluerte ordningen på oppdrag fra Helsedirektoratet. Econ Pöyry konkluderte med at målet om økt tilgjengelighet ble nådd og at den svært raske implementeringen var vellykket. Hvorvidt farmasøytrekvirering er et egnet virkemiddel for permanent bruk, må i følge Pöyry vurderes for ett og ett legemiddel.
Erfaring fra utlandet
Farmasøyter har i dag rett til forskrivning i noen få land. I Storbritannia, Australia og New Zealand har man et system med Pharmacist Only Medicines. Legemidler som inngår i dette systemet er kategorisert mellom reseptfrie og reseptpliktige. Pasienter kan få ekspedert disse legemidlene av farmasøyt uten resept. Farmasøytene må forsikre seg om at pasienten oppfyller forhåndsdefinerte kriterier, og gi standardisert informasjon om hvordan legemidlene skal brukes. Sundhedsstyrelsen i Danmark har nylig fått i oppdrag å utrede om det kan lages rammer for farmasøytutlevering av legemidler uten resept fra lege.
England og Canada har innført farmasøytforskrivning. I England har man et system med to kategorier forskrivere. Independent prescribers er helsepersonell, som er ansvarlige for å bedømme helsesituasjonen til pasienten og gjøre kliniske beslutninger om hvordan pasienten skal behandles. Supplementary prescribers er ansvarlige for å følge opp behandlingen etter at helsesituasjon er vurdert og behandlingsplan utarbeidet. Supplementary prescribers kan forskrive hvilket som helst legemiddel så lenge det dekkes av deres kompetanse, og av behandlingsplanen. Farmasøyter kan virke som supplementary prescribers etter opplæring og independent prescribers etter gjennomført akkreditert opplæringsprogram.
18.3.2 Farmasøytutlevering
Forskrift om rekvirering og utlevering av legemidler fra apotek pålegger apoteket å sørge for at kunden har tilstrekkelige opplysninger om legemidlene til at de kan brukes riktig, og å opplyse om mulige skadelige effekter. For legemidler som omfattes av LUA-ordningen, har Legemiddelverket vurdert at behovet for slik veiledning i apotek ikke er nødvendig. Farmasøytutlevering innebærer at enkelte reseptfrie legemidler bare kan utleveres fra farmasøyt i apotek. Farmasøytutlevering kan være aktuelt for enkelte reseptfrie legemidler der det er særlig behov for å informere kunden om legemidlets effekt, bivirkninger, bruksmåte eller lignende.
Legemiddelverket har fått i oppdrag å vurdere om det finnes reseptpliktige legemidler som kan gjøres reseptfrie med krav om utlevering av farmasøyt.
Om det finnes reseptfrie legemidler som bare bør utleveres etter særskilt informasjon fra apotek (farmasøyt).
En foreløpig tilbakemelding fra Legemiddelverket tyder på at dette kan være tilfelle. Regjeringen vil derfor utrede en ordning med farmasøytutlevering i apotek.
18.3.3 Farmasøytrekvirering
Farmasøytrekvirering innebærer at farmasøyter som jobber i apotek får anledning til å forskrive legemidler, som i den midlertidige ordningen med farmasøytrekvirering av antiviralia (Tamiflu) under pandemien i 2009. Helsedirektoratet har vurdert hvilke legemidler som kan være aktuelle for farmasøytrekvirering, og har konkludert med at kun et begrenset antall legemidler er egnet. Dette gjelder legemiddelbehandling der pasientens diagnose i stor grad er gitt og hvor det i liten grad kreves klinisk vurdering av lege.
Gevinsten ved farmasøytrekvirering vil i hovedsak være at befolkningen får enklere tilgang til enkelte legemidler og kan muligens frigjøre ressurser hos fastlegen. Farmasøytrekvirering kan også gi bedre utnyttelse av farmasøytisk kompetanse.
Innføring av farmasøytrekvirering vil by på en rekke utfordringer av økonomisk, juridisk og praktisk art.
Rollen som både beslutter og selger er uheldig og bryter med prinsippene i apotekloven.
Dersom det innføres rekvireringsrett for farmasøyter, må apotekloven § 2-3 endres.
Bestemmelsen innebærer at personer med rekvireringsrett for legemidler ikke kan få apotekkonsesjon.
Legemiddelverket og Helsedirektoratet vil få økt ressursbehov knyttet til saksbehandling og forvaltning av ordningen.
For apotekene vil ordningen føre til mer tidkrevende ekspedisjoner som vil gi et økonomisk tap dersom det ikke innføres en takst for arbeidet.
Farmasøytrekvirering vil forutsette journalføring ut over kravene til apotekjournal i apotekloven.
Det vil være utfordringer knyttet til hvordan slike resepter skal håndteres i e-reseptordningen, og det må avgjøres om farmasøyter skal kunne rekvirere legemidler på blåresept.
Det må også vurderes om alle farmasøyter skal få rekvireringsrett, eller om det bør innføres en form for sertifisering for å kunne få rekvireringsrett.
Det vil være nødvendig med et visst volum for å få på plass gode rutiner for håndtering og journalføring i apotek. Dette er også viktig for å få en ordning som blir godt håndtert og er kjent og forstått blant publikum. Den foreløpige kartleggingen som Helsedirektoratet har gjennomført, viser at farmasøytrekvirering bare vil være aktuelt for et lite antall legemidler.
Regjeringen mener at på nåværende tidspunkt er farmasøytutlevering en mer hensiktsmessig løsning enn farmasøytrekvirering.
I Meld. St. 26 (2014–2015) Fremtidens primærhelsetjeneste – nærhet og helhet har regjeringen signalisert at den vil utrede om utvalgte grupper skal gis utvidede rettigheter til å forskrive legemidler, medisinsk forbruksmateriell og næringsmidler på blå resept og på sikt vurdere om flere grupper skal få rett til å henvise til andre tjenesteytere. Dette forslaget åpner for å utrede forskrivningsrett også for farmasøyter, og departementet mener det i denne sammenheng kan være hensiktsmessig å vurdere forskrivningsrett for farmasøyter som jobber med klinisk farmasi på sykehus eller i primærhelsetjenesten.
18.3.4 Fornye resepter – utvidet varighet for resepter
Farmasøytrekvirering ville kunne omfatte rett til å fornye enkelte resepter. Resepter er som hovedregel gyldige i ett år, mens resepter på prevensjonsmidler er gyldige i tre år. Helsedirektoratet og Statens legemiddelverk har fått i oppdrag å vurdere behovet for endringer i forskrift om utlevering av legemidler fra apotek. Helse- og omsorgsdepartementet vil i denne sammenheng vurdere å endre bestemmelsene om resepters gyldighetstid, og ses i sammenheng med det pågående arbeidet på e-helse området. Det kan være aktuelt å gi noen resepter varighet utover ett år, mens andre resepter av faglige grunner bør ha kortere gyldighet. Resepter kan ha gyldighet «inntil videre» eller «inntil endring meldes eller legemidlet seponeres». Det bør også legges til rette for «vent-og-se resept». Dette er spesielt relevant for antibiotikaresepter. En mer fleksibel bestemmelse om resepters gyldighetstid vil redusere behovet for legebesøk der den eneste hensikten er å fornye resepter. Dette vil også redusere behovet for å gi farmasøyter mulighet til å fornye resepter.
18.4 Leverings- og forsyningssikkerhet
Befolkningen må sikres tilgang til viktige legemidler. Utgangspunktet for dette er en stabil og sikker legemiddelforsyning i normalsituasjonen. Samtidig må vi ha en beredskap for ulykker, katastrofer og kriser, og beredskap for situasjoner med langvarig forsyningssvikt for enkeltlegemidler.
Legemiddelforsyningen fungerer i hovedsak godt i Norge. De siste årene har det likevel vært et økende antall tilfeller med leveringssvikt. Det er ressurskrevende for helsetjenesten å måtte endre behandlingen i en mangelsituasjon, men dette representerer normalt ikke et medisinsk problem for pasientene. De vanligste årsakene til mangelsituasjoner er produksjonsproblemer, at legemidlet blir trukket fra markedet, eller at etterspørselen øker så mye at det ikke kan leveres nok. Mangel på legemidler er et økende internasjonalt problem. For å møte denne utviklingen er det viktig med et europeisk samarbeid.
De fleste mangelsituasjoner blir håndtert ved å ta i bruk pakninger beregnet for andre land, eller ved å bruke andre legemidler med tilsvarende virkning. Ved leveransesvikt kan Statens legemiddelverk gi tillatelse til å selge legemidler uten norsk markedsføringstillatelse.
Nasjonal produksjonskompetanse og produksjonsanlegg for legemidler kan redusere sårbarheten ved leveringssvikt. Et eksempel på dette er nasjonal produksjon av morfinpreparater. Det har i perioden 2013 til 2015 vært redusert tilgang på noen industrifremstilte morfinpreparater. I denne situasjonen har forsyningen til det norske markedet blitt dekket av apotekenes serviceproduksjonsordning. Departementet har bedt Helsedirektoratet vurdere om det bør gjennomføres konkrete tiltak for å sikre nødvendig produksjonskapasitet i Norge.
Ved apotekproduksjon i forbindelse med langvarig forsyningssvikt av legemidler, kan det være en utfordring at restlagre av erstatningslegemidlet ikke kan omsettes når forsyningssvikten er over. Apotekforeningen har foreslått at det industrifremstilte legemidlet i slike situasjoner settes i karantene til beredskapspreparatet er solgt ut. Dette tilsvarer en midlertidig tilbaketrekning eller suspensjon av legemidlets markedsføringstillatelse som ikke er i overensstemmelse med EUs legemiddeldirektiv. Departementet har bedt Helsedirektoratet, i samarbeid med de berørte aktører, vurdere alternative tiltak, for å redusere risikoen for restlagre ved beredskapsproduksjon av legemidler.
Legemiddelfirmaene har ingen plikt til å levere legemidler, men de skal informere Statens legemiddelverk om alle tilfeller av avbrudd i legemiddelforsyningen. Industrien har en åpenbar økonomisk interesse i å forsyne markedet. Grossistene har leveringsplikt til alle apotek for de legemidler de fører innen 24 timer. I områder med vanskelige kommunikasjonsforhold er kravet levering innen 48 timer. Apotek har plikt til å forhandle alle legemidler som er tillatt solgt i landet.
Legemiddelberedskapen hviler på grunnleggende beredskapsprinsipper om ansvar, nærhet og likhet. Dette innebærer at ansvaret for beredskap og håndtering av ekstraordinære hendelser i størst mulig grad skal ligge hos den som organiserer tjenestene i normalsituasjonen.
I Norge har Helsedirektoratet forvaltet beredskapslagre for legemidler både for spesialist- og primærhelsetjenesten. Det er verken praktisk eller økonomisk mulig å ha legemiddellagre i Norge som kan dekke opp for legemiddelmangel i alle tenkelige situasjoner. Beredskapsløsningene har vært fragmentert, og det har manglet en overordnet plan for å sikre at sammensetningen av lagrene er basert på oppdaterte, faglige vurderinger. Helsedirektoratet har derfor nylig kartlagt hvilke legemidler det er et særlig behov for å ha i beredskap.
I tråd med beredskapsprinsippene fikk de regionale helseforetakene i 2014 i oppdrag å ta over beredskapssikringen av legemidler som benyttes i spesialisthelsetjenesten fra 1. januar 2015. Samtidig ble det nasjonale lageret, som ble forvaltet av Helsedirektoratet avviklet. De regionale helseforetakene fikk også i oppdrag å beskrive utfordringer og strategier for nasjonal legemiddelberedskap for spesialisthelsetjenesten i en rapport til Helse- og omsorgsdepartementet innen 1. juli 2015.
Helsedirektoratet har forlenget avtalen med Norsk Medisinaldepot om beredskapslager av legemidler for primærhelsetjenesten ut 2015. Helsedirektoratet har anbefalt at denne ordningen avvikles og erstattes av et krav til legemiddelgrossistene om legemiddelberedskap. Statens legemiddelverk har fått i oppdrag å utrede hvordan beredskapssikring av legemidler for primærhelsetjenesten kan ivaretas, og hvordan dette kan forankres i aktuelt regelverk. Departementet vil følge opp Legemiddelverkets utredning med sikte på implementering fra 1. januar 2016.
Folkehelseinstituttet har ansvar for vaksineforsyning, og har beredskapsansvar for vaksiner, immunglobuliner og sera i henhold til smittevernloven.
Helse- og omsorgsdepartementet fremmet høsten 2012 stortingsmeldingen Meld. St. 16 (2012–2013) Beredskap mot pandemisk influensa, hvor det ble gjort rede for erfaringene etter influensapandemien i 2009/2010, hvordan disse erfaringene er fulgt opp og de viktigste prinsippene for en revidert beredskapsplan mot pandemisk influensa. Regjeringen vedtok i oktober 2014 en ny nasjonal beredskapsplan mot pandemisk influensa. Beredskapsplanen fastsetter ansvar, og fordeler oppgaver for planlegging og håndteringen på en rekke instanser, både i og utenfor helsetjenesten.
Folkehelseinstituttet har etter anbudskonkurranse inngått avtaler med GlaxoSmithKline AS og Novartis Norge AS om reservasjon av produksjonskapasitet, og innkjøp av vaksine til fullvaksinering av hele Norges befolkning i tilfelle av en influensapandemi. Utløsning av avtalen er avhengig av at WHO erklærer en pandemi. Kontraktene, som har en varighet på fire år, forplikter produsentene til å levere en prosentandel av sin ukentlige produksjon til Norge i løpet av en gitt tidsperiode
Mange aktører har oppgaver innenfor legemiddelberedskapen. På myndighetssiden har Helsedirektoratet, Statens legemiddelverk og Nasjonalt folkehelseinstitutt oppgaver og ansvar. I forsyningskjeden er det kommersielle aktører som legemiddelprodusenter, grossister og apotek. Endelig skal legemidler forskrives og brukes i helsetjenesten. En sikker og trygg legemiddelforsyning forutsetter et godt samspill og dialog mellom alle disse aktørene. Situasjoner med forsyningssvikt krever ofte bruk av alternative legemidler, og dette vil ofte innebære nye prosedyrer og rutiner. Helsetjenesten har etterlyst tidligere varsling og tettere dialog med myndighetsorganer for å kunne håndtere slike saker på en mer effektiv måte. Helsedirektoratet etablerte i 2014 derfor en legemiddelberedskapskomité for å bidra til økt samarbeid og bedre dialog mellom de ulike aktørene.
18.5 Forfalskninger
Det har de senere årene vært en alarmerende økning av antallet forfalskede legemidler i EU. Også innovative og livreddende legemidler er forfalsket og kanalisert gjennom den ordinære distribusjonskjeden.
I tillegg er salg av forfalskede legemidler et stort problem ved omsetning gjennom salgskanaler uten godkjenning fra myndighetene. Legemiddelmyndighetene har de senere år advart mot å kjøpe legemidler via internett, siden risikoen for å kjøpe forfalskede eller ulovlige legemidler er stor. Slike produkter kan være virkningsløse, fordi de ikke inneholder det aktive virkestoffet. I verste fall kan de være skadelige. WHO har antydet at ved kjøp av legemidler på internett fra ikke godkjente selgere, er mer enn 50 pst. av legemidlene forfalsket eller ulovlige.
Direktiv 2011/62/EU skal forhindre at falske legemidler kommer inn i den legale omsetningskjeden og selges i apotek. Direktivet er tatt inn i EØS-avtalen og gjennomført i norsk rett ved endringer i legemiddelloven med tilhørende forskrifter. Stortinget er tidligere orientert om direktivet i Prop. 168 L (2012–2013) om endringer i legemiddelloven (tiltak mot falske legemidler). Etter forslag i dette dokumentet vedtok Stortinget hjemmel i legemiddelloven for å beslaglegge og destruere legemidler som er importert ulovlig av private, uten å involvere politi- og påtalemyndigheten.
Arbeid med å kartlegge og forhindre eksport og import av forfalskede legemidler har pågått under WHO siden 1988. Problemet har imidlertid stadig økt i denne perioden. En arbeidsgruppe under WHO anbefalte i 2011 at verdens helseforsamling oppretter en medlemsstatsmekanisme som skal bidra i arbeidet med å bekjempe falske legemidler. Det presiseres i forslaget at hensynet til handel og beskyttelse av immaterielle rettigheter ikke skal vurderes under denne mekanismen. Formålet med mekanismen er å bidra til å beskytte folkehelsen. Første møte i medlemsstatsmekanismen ble avholdt høsten 2012. Arbeidet pågår fortsatt, og er krevende fordi landene har ulike interesser. USA og EU har en særlig interesse i å beskytte egen industri mot kopilegemidler som produseres i strid med patentrettigheter, mens utviklingsland med stor produksjon av kopilegemidler ser dette som et hinder for egen industri. Dette skyldes særlig at land med stor produksjon av generiske legemidler har sterke interesser i å obstruere prosessen, fordi de ønsker å beskytte sin nasjonale legemiddelindustri. Også manglende finansiering av mekanismen gjør det vanskelig å gjennomføre arbeidet.
Europarådets ministerkomité vedtok 8. desember 2010 en konvensjon om forfalskninger av legemidler og lignende handlinger som medfører fare for folkehelsen. Partene skal kriminalisere forfalskninger av legemidler og medisinsk utstyr, beskytte rettighetene til ofrene for slike lovbrudd og fremme nasjonalt og internasjonalt samarbeid. Mange av reglene i konvensjonen følger allerede av norsk rett gjennom bestemmelser i blant annet legemiddelloven og straffeloven.
Med forfalsket vare tenkes det normalt på at et produkt utgir seg for å være et ekte legemiddel. Som forfalsket legemiddel inkluderes også i utgangspunktet slike legemidler med forfalsket eller ukjent historikk. Legemidlets kvalitet forutsetter kontroll med oppbevaringsbetingelsene. Bare unntaksvis kan brukeren selv oppdage at et legemiddel er ødelagt f.eks. pga oppbevaring ved feil temperatur. EU stiller strenge krav til kontroll med hvem man kjøper legemidler fra.
De siste årene har det vært avdekket flere tilfeller der ekte legemidler har kommet på avveie og deretter er kommet tilbake i den legale distribusjonskjeden for legemidler. Disse partiene er trukket tilbake fra markedet.
I Italia har det vært flere tyverier av legemidler fra sykehus og lastebiler. Mange av disse legemidlene har dukket opp igjen i ulike land etter parallellimport av de italienske pakningene.
I Romania kjøpte en grossist legemidler fra et apotek. Det er ikke adgang til dette, men mange av produktene ble solgt videre til andre land, og to partier ble levert til Norge.
Det er eksempler på at dyre legemidler, eller emballasjen til dyre legemidler gjenbrukes. Det gjelder bl.a. brystkreftmedisinen Herceptin hvor man i Finland oppdaget at noen pakninger ikke inneholdt tørrstoff, men bare rester av den væsken som lages til på sykehuset rett før bruk. Sykehusavfall kan være kilden til disse forfalskede legemidlene. I ettertid er eksemplene blitt flere, og flere land er involvert. Norge har så langt ikke vært berørt av dette.
Eksemplene viser at det er viktig å overvåke grossistleddet i hele EØS-området. Vedtakelsen av direktiv 201/62/EU bidrar til at overvåkningen er blitt skjerpet.
19 Likeverdig tilgang – finansiering av legemidler
Offentlig finansiering av legemidler er i dag tredelt.
De regionale helseforetakene dekker utgifter til legemidler som brukes under sykehusopphold og ved polikliniske behandling.
Kommunene har ansvar for utgifter til legemidler i kommunale institusjoner.
Folketrygden yter stønad til legemidler som brukes utenfor sykehus og kommunale institusjoner.
I 2014 var totalomsetningen av legemidler med markedsføringstillatelse 14,8 mrd. kroner (AIP – apotekenes innkjøpspris), inkludert 1,0 mrd. kroner for veterinære midler. Dette tilsvarer rundt 22,3 mrd. kroner i utsalgspris (AUP). Omsetningen av legemidler til humant bruk økte med 8,9 pst. fra 2013 til 20145. Økningen skyldes blant annet endringer i valutakursen, som har ført til økte priser ved de årlige maksimalprisrevurderingene. Nye legemidler til behandling av hepatitt C og ulike kreftformer, og nye blodfortynnende legemidler bidrar også til veksten.
I perioden 2006–2008 ble finansieringsansvaret for flere biologiske legemidler (TNF-hemmere og MS-legemidler) flyttet fra folketrygden til de regionale helseforetakene. I 2014 ble også finansieringsansvaret for enkelte kreftlegemidler overført helseforetakene.
Omsetningen av legemidler på blåresept var totalt 10,7 mrd. kroner6 i 2014. Folketrygdens andel, inkludert egenandeler dekket over frikortordningen, var 9,7 mrd. kroner, mens pasientenes egenandelsbetaling utgjorde 1,0 mrd. kroner.
Folketrygden dekker også enkelte legemiddelutgifter over bidragsordningen: Jenter i alderen 16–19 år får helt eller delvis dekning for utgifter til hormonelle antikonsepsjonsmidler, i 2014 for 24 mill. kroner. Utgifter til infertilitetsbehandling blir også delvis dekket, og folketrygdens utgifter var 24 mill. kroner i 2014. Det gis også bidrag til en del legemidler forskrevet på hvit resept, totalt 23 mill. kroner i 2014.
Sykehusene hadde i 2014 samlede legemiddelutgifter på 5,4 mrd. kroner7. 3,2 mrd. kroner var knyttet til ordresalg, mens utgiftene til legemidler på h-resept var 2,0 mrd. kroner.
Det finnes ikke god statistikk over kommunenes utgifter til legemidler som brukes i sykehjem. Tall fra Apotekforeningen8 for 2014 viser at sykehjem, andre helseinstitusjoner, legekontor og tannlegekontor til sammen bestilte legemidler fra primærapotek for 619 mill. kroner (inkl. reseptfrie legemidler). Det aller meste av dette gikk til sykehjem.
Legemidler forskrevet på hvit resept dekkes i hovedsak av pasienten selv. Omsetningen på hvit resept var 2,9 mrd. kroner i 20149. Reseptfrie legemidler ble solgt for 2,1 mrd. kroner i AUP fra apotek (ekskl. ordresalg), og for rundt 330 mill. kroner (innkjøpspris) gjennom LUA-ordningen. Ovennevnte tall er hentet fra ulike kilder og kan ikke summeres.
Figur 19.1 viser omsetningen av legemidler i Norge fra 2006 til 2014, oppgitt i nominelle kroner. Den øverste linjen er estimert totalomsetning, beregnet ut fra AIP-omsetning innrapportert fra grossistene til Folkehelseinstituttet. Veterinære legemidler inngår ikke i figuren. Folketrygdens utgifter (rød søyle) omfatter blåreseptordningen §§ 2, 3 og 4, og er inkludert egenandeler dekket av frikortordningen. Sykehusenes utgifter (grønn søyle) omfatter ordresalg og legemidler forskrevet på h-resept. Differansen mellom søylene og totalomsetning er omsetning av legemidler på hvit resept, reseptfrie legemidler og egenandeler på blå resept, samt ordresalg til sykehjem/legekontor mv.
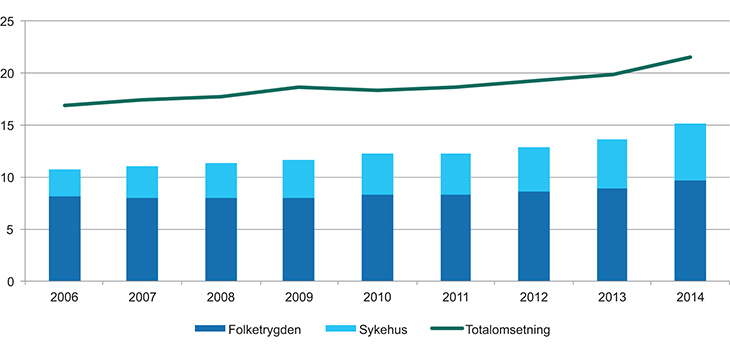
Figur 19.1 Legemiddelomsetning i milliarder kroner (AUP), 2006–2014
Kilde: Grossistbasert legemiddelstatistikk Nasjonalt folkehelseinstitutt, Helsedirektoratet, Sykehusapotekenes legemiddelstatistikk
19.1 Folketrygdens finansieringsordninger
Etter folketrygdloven kapittel 5 gis hel eller delvis kompensasjon for nødvendige utgifter til helsetjenester ved sykdom, skade mv., jf. formålsbestemmelsen i § 5-1.
Stønad til viktige legemidler ytes etter § 5-14. Det er et vilkår at det er behov for langvarig bruk av legemidlet, og legemidlet må være forskrevet av lege til bruk utenom sykehus. Utfyllende regler er gitt i blåreseptforskriften.
Etter folketrygdloven § 5-14 og tilhørende forskrift kan det gis stønad på blå resept for legemidler etter tre ulike ordninger; forhåndsgodkjent refusjon (§ 2), individuell refusjon (§ 3) og stønad til legemidler ved smittsomme sykdommer (§ 4).
For legemidler mv. på blå resept betaler pasienten en egenandel på 38 pst. av reseptbeløpet, men ikke mer enn 520 kroner per resept. Egenandeler etter folketrygdloven § 5-14 inngår i egenandelstak 1. Dette innebærer at egenandeler som overstiger 2185 kroner (tak for 2015) i løpet av et år, refunderes av folketrygden.
19.1.1 Folketrygdens utgifter til legemidler
Forhåndsgodkjent refusjon (blåreseptforskriften § 2) er hovedordningen innenfor blåresept, med nærmere 2,3 mill. unike brukere og samlet refusjon (inkludert egenandel dekket av frikort) på 7,1 mrd. kroner i 2014. Trygdens utgifter til individuell stønad etter § 3 var 1,9 mrd. kroner, til i underkant av 110 000 unike brukere. Legemidler ved smittsomme sykdommer ble omsatt for 672 mill. kroner etter § 4, til rundt 35 000 brukere.
Folketrygdens utgifter til legemidler over blåreseptordningen har økt fra 8,6 mrd. kroner i 2004 til 9,7 mrd. kroner i 2014, en nominell økning på 13 pst. I perioden 2006–2008 ble finansieringsansvaret for flere biologiske legemidler (TNF-hemmere og MS-legemidler) flyttet fra folketrygden til de regionale helseforetakene. I 2008 ble også flere legemidler flyttet fra bidragsordningen til blåreseptordningen. Korrigert for disse overføringene var utgiftene på blåresept stabile fra 2004 til 2008. Automatisk frikort ble innført i 2010 og dette førte til en utgiftsvekst ved at flere fikk dekket egenandeler over frikorttaket. De økte utgiftene i perioden 2012–2014 skyldes blant annet nye legemidler til behandling av hepatitt C, MS, kreft og forebygging av blodpropp. I 2014 ble finansieringsansvaret for enkelte kreftlegemidler overført til helseforetakene.
Målt i definerte døgndoser (DDD) har forbruket av legemidler på blå resept økt med 42 pst. fra 1,2 mrd. DDD i 2004 til 1,7 mrd. DDD i 2014. Grunnen til dette er vekst i antall innbyggere og i forbruk per innbygger.
19.1.2 Forhåndsgodkjent refusjon – blåreseptforskriften § 2
I henhold til blåreseptforskriften § 2 ytes det stønad for legemidler som er oppført på refusjonslisten. Forutsetningen er at legemidlet er forskrevet i samsvar med vilkår og begrensninger som fremgår av refusjonslisten.
Det er som hovedregel legemiddelfirmaet (innehaver av legemidlets markedsføringstillatelse) som søker om forhåndsgodkjent refusjon.
Statens legemiddelverk vurderer søknadene etter reglene i legemiddelforskriften kapittel 14. I 2014 behandlet Legemiddelverket 102 søknader om forhåndsgodkjent refusjon, hvorav 96 fikk innvilget forhåndsgodkjent refusjon eller utvidede refusjonsvilkår. 98 pst. av søknadene ble behandlet innen fristen på 180 dager.
38 av refusjonssøknadene gjaldt nye virkestoff, ny indikasjon eller ny formulering. I 37 av disse sakene var kravene til kostnadseffektivitet oppfylt, og legemidlene fikk innvilget forhåndsgodkjent refusjon. I flere av sakene ble refusjonsprisen forhandlet ned, eller refusjon ble gitt med tilhørende refusjonsvilkår, for å sikre kostnadseffektiv bruk.
Fem av de 37 innvilgede refusjonssøknadene var opprinnelig oversendt departementet på grunn av budsjettmessige konsekvenser. Alle disse legemidlene fikk innvilget forhåndsgodkjent refusjon fra 1. januar 2015, i forbindelse med at bagatellgrensen ble hevet fra 5 til 25 mill. kroner.
Legemidlene som fikk innvilget forhåndsgodkjent refusjon behandler forskjellige sykdommer, som diabetes, KOLS, brystkreft, lungekreft, hjertesvikt, håndeksem, ADHD og schizofreni.
Behandling av alvorlige sykdommer
Et legemiddel kan bare få forhåndsgodkjent refusjon dersom det skal brukes til behandling av alvorlige sykdommer, eller av risikofaktorer som med høy sannsynlighet vil medføre eller forverre alvorlig sykdom.
I kongelig resolusjon av 6. juni 2003 er det presisert at forebyggende tiltak faller utenfor ordlyden i folketrygdloven § 5-1. Dette betyr at legemidler til forebygging av sykdom hos friske personer ikke kan dekkes på blå resept. Samtidig er det presisert at risikofaktorer som med høy sannsynlighet vil medføre eller forverre alvorlig sykdom, bør oppfattes som en sykelig tilstand som omfattes av blåreseptordningens formål. Dette innebærer at legemidler som behandler slike risikofaktorer, og dermed kan forhindre alvorlig sykdom eller forverring av alvorlig sykdom, kan tas opp på refusjonslisten. Eksempler på dette er behandling av høyt blodtrykk og kolesterolsenkende behandling.
Gjentatt behandling over en langvarig periode
Legemidler kan bare innvilges forhåndsgodkjent refusjon dersom den aktuelle sykdommen (eller risikofaktoren) medfører behov for langvarig behandling.
Kravet til langvarig behandling er gjennom fast forvaltningspraksis presisert til at det er behov for bruk av ett eller flere legemidler i minst tre måneder i løpet av ett år for samme sykdom. Tremånedersperioden trenger ikke være sammenhengende. I kongelig resolusjon av 6. juni 2003 er det presisert at det er tilstrekkelig at det er en risiko for langvarig behandling. Dette åpner for å refundere legemidler som erstatter eller forhindrer langvarig behandling.
Tilfeller der kronisk sykdom gjør det påkrevd å ha legemidlet i beredskap store deler av året oppfyller også kravet til langvarig medikamentell behandling, for eksempel legemidler mot allergisjokk.
Godt dokumentert og klinisk relevant virkning
Legemidlet skal ha en godt dokumentert og klinisk relevant virkning i en definert pasientgruppe, og det må dokumenteres at den kliniske effekten er relevant for norske forhold. Legemidlet må som hovedregel ha markedsføringstillatelse for den indikasjonen det søkes refusjon for. Enkelte unntak fra dette fremkommer av regelverket. Refusjon kan også gis for et snevrere bruksområde enn den godkjente indikasjonen.
Kostnadseffektivitet
Kostnadene ved bruk av legemidlet skal stå i et rimelig forhold til gevinsten ved behandlingen, og til kostnadene forbundet med alternativ behandling. Den som søker om forhåndsgodkjent refusjon, må dokumentere at legemidlet er kostnadseffektivt. Dette gjøres vanligvis gjennom en legemiddeløkonomisk analyse som inngår i refusjonssøknaden. Statens legemiddelverk har fastsatt retningslinjer for legemiddeløkonomiske analyser.
I analysen sammenliknes kostnader og helseeffekter ved det nye legemidlet med de mest aktuelle alternativene i norsk sammenheng. Effektdata hentes fra kliniske studier. I analysen inngår kostnaden ved selve legemidlet, men også andre kostnader knyttet til behandling og oppfølging, som kontroll hos lege og sykehusinnleggelse. Andre konsekvenser for samfunnet, slik som gevinster ved at en frisk pasient kan være lenger i arbeid, kan også vurderes.
19.1.3 Bagatellgrensen
Statens legemiddelverk kan innvilge forhåndsgodkjent refusjon for legemidler, dersom utgiften for folketrygden ikke overstiger en viss kostnadsgrense. Dette omtales gjerne som bagatellgrensen. Fram til 2015 var denne grensen på fem millioner kroner i året og hadde vært uendret siden 2003. Beløpet beregnes ut fra legemidlets antatte salg fem år etter tidspunktet for refusjonsvedtaket. Dersom kostnadene overstiger bagatellgrensen, må Legemiddelverket sende sin tilrådning til departementet, og refusjon av legemidlet må godkjennes av Stortinget.
Regjeringen foreslo i forslag til Statsbudsjett for 2015 å heve bagatellgrensen til 25 millioner kroner, fordi den lave grensen hindret rask finansiering av nye og effektive legemidler. Stortinget vedtok regjeringens forslag. Flere legemidler kan nå innføres uten at de må godkjennes av Stortinget, og pasientene vil få raskere tilgang til nye og effektive legemidler.
Totalt ble ni legemidler, hvorav fem legemidler der søknaden ble oversendt i løpet av 2014, innvilget forhåndsgodkjent refusjon ved hevingen av bagatellgrensen. Av disse var syv til behandling av diabetes type 2.
19.1.4 Legemiddelforskriften § 14-14
Legemiddelforskriften § 14-14 omtaler legemidler som ikke kan innvilges forhåndsgodkjent refusjon:
«Et legemiddel kan ikke innvilges forhåndsgodkjent refusjon, dersom det hovedsakelig skal benyttes i behandlingen av:
Rusavhengighet
Nikotinavhengighet
Naturlig håravfall eller
Erektil dysfunksjon
Dersom Statens legemiddelverk mottar søknad om refusjon for et legemiddel som omfattes av første ledd, skal saken sendes til departementet, som vurderer behovet for utredning av en særskilt refusjonsordning. Departementet kan i forbindelse med sin vurdering be Statens legemiddelverk om å utrede legemidlets refusjonsverdighet etter bestemmelsene i § 14-31.»
Det gis i dag ikke individuell stønad til slike legemidler. Legemidler til bruk ved røykeavvenning og perorale legemidler til bruk ved erektil dysfunksjon (ereksjonssvikt) er også unntatt dekning fra bidragsordningen, men det gis bidrag til injeksjonspreparater brukt ved erektil dysfunksjon og til legemidler for behandling av rusavhengighet.
Legemiddelforskriften § 14-14 ble fastsatt fordi man ikke betraktet disse tilstandene som sykdom etter folketrygdloven. Regjeringen ønsker ikke en særskilt refusjonsordning for disse legemidlene. Eventuell offentlig støtte til legemidler som i dag er omfattet av § 14-14, bør innføres ved forskriftsendring som gir legemiddelindustrien mulighet til å søke om opptak på forhåndsgodkjent refusjon.
Legemiddelverket vil da vurdere om kriteriene for refusjon er oppfylt. Dette innebærer vurdering av om tilstanden er alvorlig, om det er behov for langvarig bruk, om det finnes dokumentasjon som er relevant for norske forhold og om behandlingen er kostnadseffektiv.
Regjeringen mener at refusjon for utgifter til behandling av rusavhengighet, utover det som dekkes gjennom LAR-tiltak, bør vurderes på samme måte som annen forebyggende behandling som i dag dekkes gjennom blåreseptordningen. I kgl.res. av 6. juni 2003 er forebyggende behandling omtalt slik:
«Folketrygdloven § 5-1 bestemmer at formålet med stønad etter kapitlet er å gi kompensasjon for «nødvendige utgifter til helsetjenester ved sykdom, skade, lyte, familieplanlegging, svangerskap, fødsel og svangerskapsavbrudd». Forebyggende behandling er ikke nevnt, og kan derfor etter ordlyden ikke benyttes til forebygging av sykdom hos friske personer.
Dette legges også til grunn i forskriften. Legemidlet må være ment brukt til behandling av «alvorlige sykdommer eller av risikofaktorer som med høy sannsynligvis vil medføre ellet forverre alvorlig sykdom». Alvorlige risikofaktorer bør i refusjonssammenheng oppfattes som en sykelig tilstand som omfattes av blåreseptordningens formål. I disse tilfellene vil legemidler beregnet for forebygging av sykdom og forhindring av tilbakefall (behandling av risikofaktorene) kunne opptas i blåreseptordningen.»
Det gis i dag refusjon for legemidler til behandling av risikofaktorer som høyt blodtrykk og høyt kolesterol. Rusavhengighet kan vurderes som en risikofaktor på lik linje, og kanskje mer alvorlig, enn risikofaktorer som i dag kan behandles med legemidler på blå resept.
En behandlingskur med vareniklin på 12 uker koster om lag 2200 kr, eller 26 kr per dag. Til sammenlikning bruker en gjennomsnittsrøyker om lag 50 kroner per dag på tobakk, noe som tilsvarer vel 18 000 kr i året. Det vil derfor være sterke privatøkonomiske argumenter for å slutte å røyke for å finansiere behandlingen. Regjeringen vil derfor ikke prioritere refusjon for legemidler til behandling av nikotinavhengighet på nåværende tidspunkt.
Legemiddelverk utredet i 2007 spørsmålet om refusjon for legemidler til behandling av erektil dysfunksjon. Legemiddelverket konkluderte med at erektil dysfunksjon kan være en alvorlig lidelse, som ut fra rene alvorlighetsbetraktninger naturlig hører hjemme i blåreseptordningen. Legemiddelverket mente også at refusjon av perorale legemidler som for eksempel sildenafil kan være kostnadseffektiv behandling for visse pasientgrupper, for eksempel i tilfeller der erektil dysfunksjon er en følgesykdom av annen alvorlig sykdom. Erektil dysfunksjon kan ofte være en følge av sykdommer som diabetes, multippel sklerose, ryggmargsskade og prostatakreft. Legemiddelverket konkluderer videre med at det er urimelig å gi bidrag til injeksjon og uretralstift, men ikke tabletter, slik tilfellet er i dag.
Regjeringen vil foreslå at legemiddelforskriften § 14-14 første ledd bokstav a (rusavhengighet) og bokstav d (erektil dysfunksjon) oppheves, og forslag om forskriftsendring sendes på høring i løpet av høsten 2015.
19.1.5 Individuell refusjon – blåreseptforskriften § 3
Blåreseptforskriften § 3 gir hjemmel for at det kan ytes refusjon til legemidler, dersom kriteriene for forhåndsgodkjent refusjon ikke er oppfylt. Refusjon etter denne bestemmelsen ytes etter individuell søknad til HELFO.
Det kan ytes individuell stønad for legemidler for sykdommer som inngår i den forhåndsgodkjente ordningen (§3 første ledd bokstav a) og for sjeldne tilstander (§3 første ledd bokstav b).
Det er fastsatt rundskriv, som gir utfyllende bestemmelser til forskriften.
Sjeldne sykdommer og tilstander er definert som diagnoser med en forekomst på mindre enn 1 per 10 000 innbyggere, som tilsvarer færre enn 500 personer i Norge. Dersom sykdommens alvorlighetsgrad er å anse som sjelden likestilles dette med sjelden sykdom.
Også ved individuell refusjon stilles det krav om langvarig bruk.
Dokumentert effekt
Det må foreligge vitenskapelig dokumentasjon som viser at legemidlet det søkes om har effekt ved den aktuelle diagnosen.
Kravet til dokumentasjon av effekt er oppfylt for legemidler som har markedsføringstillatelse i Norge eller EØS, når legemidlet skal brukes innenfor godkjent indikasjon. Det samme gjelder for legemidler som er anbefalt benyttet i offentlige nasjonale behandlingsretningslinjer for den aktuelle tilstanden. I andre tilfeller må det foreligge publisert, vitenskapelig dokumentasjon av effekt ved den aktuelle lidelsen.
Krav til instituering av behandling
Søknad om individuell refusjon fremmes vanligvis av lege på vegne av pasienten. Hovedregelen er at behandlingen skal være instituert (satt i gang) av spesialist i sykdommens medisinske fagfelt eller tilsvarende sykehusavdeling. I juli 2014 ble det åpnet for at spesialist i allmennmedisin kan instituere behandlingen ved en del tilstander som vanligvis behandles i primærhelsetjenesten, for eksempel astma, KOLS, diabetes type 2, høyt blodtrykk og høyt kolesterol. Regjeringen ønsker å oppheve det generelle institueringskravet, og dette er nærmere omtalt under overskriften krav om spesialistvurdering ved stønad etter individuell søknad.
Refusjon for preparater som ikke er oppført i refusjonslisten for den aktuelle refusjonskoden – særlige grunner
Etter blåreseptforskriften § 3 første ledd bokstav a kan det ytes refusjon for legemidler etter individuell søknad, for bruk som er dekket av en refusjonskode, dersom det foreligger særlige grunner. Dette er en sikkerhetsventil for pasienter som av medisinske grunner ikke kan behandles med forhåndsgodkjent legemiddel. For at den individuelle ordningen ikke skal undergrave ordningen med forhåndsgodkjent refusjon, er det krav om at et eller flere forhåndsgodkjente legemidler som hovedregel skal være forsøkt først.
Som særlige grunner regnes i dag at forhåndsgodkjente legemidler ikke har gitt tilstrekkelig effekt eller har medført bivirkninger som gjør det uakseptabelt å fortsette behandlingen, eller at pasienten har en annen alvorlig lidelse, annen tilstand eller bruker andre legemidler, som utelukker bruk av forhåndsgodkjente legemidler.
Ved søknad om refusjon for legemidler som ikke er markedsført, stilles det krav til at også relevante markedsførte legemidler er forsøkt først.
Ved søknad om refusjon der det ikke finnes relevant forhåndsgodkjent behandling, kan det innvilges stønad basert på dokumentert effekt.
Høring om forslag til endringer i regelverket
Dagens regelverk for individuell stønad gjør at enkelte pasienter med alvorlig sykdom faller utenfor dekningsområdet til blåreseptordningen. Et forslag til nytt regelverk for individuell refusjon til legemidler ble sendt på høring i oktober 2013. Hovedformålet med den foreslåtte endringen var å sikre at pasienter som i dag faller utenfor refusjonsordningene skal få dekket utgifter til legemidler på linje med andre pasienter med alvorlig sykdom. I høringen ble det foreslått å innføre fire grunnvilkår for individuell refusjon knyttet til sykdommens alvorlighet, legemidlets effektdokumentasjon, behandlingens kostnadseffektivitet og behandlingens varighet, og å oppheve skillet mellom dagens § 3 første ledd bokstav a og bokstav b.
De foreslåtte endringene berører temaer som vil være sentrale i stortingsmeldingen om prioritering som Regjeringen vil legge fram i 2016. Eventuelle endringer i regelverket for individuell refusjon for legemidler vil bli vurdert i forbindelse med stortingsmeldingen om prioritering.
Spesialistkrav ved individuell refusjon til vanedannende legemidler ved kroniske, sterke smerter
Fra 2008 er det gitt individuell refusjon etter § 3 for vanedannende smertestillende legemidler til pasienter med kroniske, sterke smerter med betydelig redusert livskvalitet og funksjonsevne. Tidligere ble det stilt krav om at relevant spesialist måtte starte behandlingen og utforme søknaden om refusjon.
Helsedirektoratets behandlingsveileder for bruk av opioider ved langvarige ikke-kreftrelaterte smerter (opioidveilederen) fra 2014 anbefaler at det bør være én ansvarlig lege som forskriver vanedannende legemidler. Normalt er det fastlegen som følger opp pasienten over tid. Fastlegen bør derfor ha ansvaret for søknad og forskrivning av vanedannende legemidler.
Helse- og omsorgsdepartementet har vedtatt at det skal fastsettes nye vilkår for individuell refusjon, i tråd med anbefalingene i opioidveilederen. Søknad for lave opioiddoser ved avklarte smertetilstander skal komme fra pasientens fastlege. Ved behov for høye doser og/eller dersom det foreligger en uavklart smertetilstand, bør pasienten vurderes av spesialist ved en tverrfaglig smerteklinikk, og søknad om refusjon må i disse tilfellene komme fra lege ved smerteklinikk.
Endringene åpner også for vedtak uten tidsbegrensning ved andregangssøknad, og universelle vedtak som gjelder alle markedsførte opioider inntil en øvre mengde. De nye vilkårene gir en enklere og mindre byråkratisk refusjonsordning både for pasienter, leger og HELFO. Samtidig plasseres ansvaret for behandling og oppfølging hos fastlegen.
Krav om spesialistvurdering ved stønad etter individuell søknad
Et av grunnvilkårene for å få stønad til legemidler etter individuell søknad er at behandlingen er instituert av spesialist i sykdommens medisinske fagfelt eller tilsvarende sykehusavdeling. Bakgrunnen for dette kravet er at behandling med et legemiddel som ikke er forhåndsgodkjent for den aktuelle diagnosen, fraviker fra det som er vurdert som kostnadseffektiv behandling. I disse tilfellene har det vært ønskelig at en spesialist kvalitetssikrer at behandlingen er hensiktsmessig. Videre er kravet begrunnet i et ønske om å ha en generell terskel for forskrivning av legemidler uten forhåndsgodkjent refusjon, for å ha kontroll med bruken av legemidlet og begrense utgiftene, jf. St.meld. nr. 18 (2004–2005) Rett kurs mot riktigere legemiddelbruk.
Institueringskravet innebærer at en spesialist eller lege ved sykehusavdeling må starte behandlingen, eller vurdere at pasienten bør behandles med det aktuelle legemidlet. Søknaden om individuell stønad kan likevel i noen tilfeller utformes av pasientens fastlege eller annen behandlende lege. Det må da fremgå av søknaden hvem som har instituert behandlingen. I praksis godtas også telefonkonsultasjon med spesialist som instituering. For enkelte legemidler er det gitt et generelt unntak fra institueringskravet, blant annet for visse allergimidler. Fra juli 2014 er også spesialist i allmennmedisin regnet som relevant spesialist for enkelte behandlingsområder. Eksempler på dette er behandling av høyt blodtrykk, høyt kolesterol, osteoporose, diabetes og allergi.
Helselovgivningen har bestemmelser som skal sikre at pasienter blir behandlet av kvalifisert personell, og i den del av helsetjenesten som er mest hensiktsmessig. Dagens regler for individuell stønad fører til et stort antall henvisninger til spesialisthelsetjenesten som er formelt, men ikke faglig begrunnet. Henvisningene oppleves som unødvendige og belastende for både avsender og mottaker, og praksisen er i strid med intensjonene i helsepersonellovens § 4 og § 6 og føringer i samhandlingsreformen.
Åpningen for at også spesialist i allmennmedisin kan instituere behandlingen for visse behandlingsområder, gjør ordningen noe enklere. Samtidig kan det føre til forskjellsbehandling av pasienter siden bare drøyt halvparten av alle landets fastleger er spesialist i allmennmedisin.
Dagens institueringskrav er uhensiktsmessig, og strider mot prinsippet om at behandling skal følge behandlingsnivået, og ikke belaste spesialisthelsetjenesten unødvendig. Regjeringen vil derfor oppheve kravet om spesialistinstituering som et generelt vilkår. Dette innebærer i utgangspunktet at alle leger får samme rett til å instituere og søke individuell refusjon for utgifter til legemidler. Vanlige regler for forsvarlighet og samhandling avgjør når en lege må søke råd hos en annen lege/spesialist.
På noen behandlingsområder er det likevel naturlig at spesialisthelsetjenesten har det overordnede ansvar for igangsetting, og i enkelte tilfeller også oppfølging av behandling. I slike tilfeller kan Helsedirektoratet, eller det organ Helsedirektoratet bestemmer, avgjøre at det skal stilles krav om at kun enkelte spesialistgrupper kan instituere behandling og søke om individuell refusjon. Kreftbehandling, behandling med orphan drugs og behandling av sjeldne sykdommer kan være områder som krever spesifikk kompetanse. Spesialistvilkåret kan også være aktuelt å opprettholde for behandling med legemidler utenfor godkjent indikasjon.
Bortfall av det generelle kravet til spesialistinstituering vil bidra til å redusere den unødvendige belastningen på spesialisthelsetjenesten, og vil være en forenkling for allmennleger og pasienter.
19.1.6 Avvikle ordningen med Forskningsblå
Hovedregel for blåreseptordningen er at det kun kan gis refusjon til legemidler med dokumentert sikkerhet og effekt. Legemidler som brukes i kliniske studier, omfattes derfor i utgangspunktet ikke av ordningen.
Forskningsblå er en ordning der utgifter til legemidler i kliniske studier kan finansieres over blåreseptordningen. Gjennom ordningen finansieres bruk utenfor legemidlets godkjente refusjonsområde. Ordningen synes å ha et opphav i Rikstrygdeverkets rundskriv til folketrygdloven § 5-14, men formålet med innføring av ordningen er uklart. Helsedirektoratet har mottatt to til tre søknader årlig. Det er kun legemiddelkostnadene som dekkes via Forskningsblå. Andre kostnader i forbindelse med gjennomføring av studien må dekkes på annen måte. De budsjettmessige konsekvensene har vært under en million kroner per år.
Ordningen med Forskningsblå er lite kjent og lite benyttet. Den kan føre til at studier som ikke vinner fram i de ordinære finansieringsordningene, likevel sikrer seg offentlig finansiering. Siden legemidlene forskrives på blå resept, og pasienten selv henter ut legemidlet på apotek, kan ordningen bare benyttes ved studier som ikke er blindet. Slike studier har ofte lavere forskningskvalitet enn blindede studier. Helse- og omsorgsdepartementet kan ikke se tungtveiende grunner til å videreføre ordningen, og foreslår at Forskningsblå avvikles.
19.1.7 Blåreseptforskriften § 4 – legemidler ved smittsomme sykdommer
Folketrygden yter refusjon etter blåreseptforskriften § 4 til legemidler ved allmennfarlige smittsomme sykdommer til den som oppholder seg i Norge, selv om vedkommende ikke er medlem i folketrygden. Pasienten betaler ikke egenandel, og det kan forskrives legemidler uten markedsføringstillatelse. Ved endring av blåreseptforskriften fastsatt 1. november 2014, ble det innført krav om medlemskap i folketrygden for stønad til legemidler ved hepatitt C-infeksjon.
Det ytes stønad til antiinfektive legemidler mv. etter blåreseptforskriften § 4 nr. 2 og § 4a, og til vaksiner, immunglobuliner og immunsera etter blåreseptforskriften § 4 nr. 3.Forskriften angir refusjonskriterier for enkelte legemiddelgrupper, og inneholder også vilkår både for forskrivning, stønad og utlevering til enkelte grupper.
Blåreseptforskriften § 4 er hjemlet i smittevernloven. I tillegg til hensynet til å behandle den enkelte pasient som er smittet med en allmennfarlig smittsom sykdom, er begrunnelsen for en egen bestemmelse for disse legemidlene, at behandling er viktig også for å hindre videre smitte. Det er ingen egenandeler for legemidler som blir forskrevet etter § 4, fordi økonomiske forhold ikke bør hindre noen i å gjennomføre en behandling som hindrer spredning av allmennfarlige smittsomme sykdommer i befolkningen. Ved behandling av hepatitt C-infeksjon og HIV-infeksjon, som i dag dekkes etter § 4, er hovedformålet å behandle den enkelte pasient. Hepatitt C forekommer hovedsakelig hos personer som injiserer rusmidler, og smitteutbredelsen i denne gruppen er stor. Det er primært pasienter som har utviklet skade på leveren som tilbys behandling. Departementet har gitt Nasjonalt folkehelseinstitutt i oppdrag å utarbeide et forslag til nasjonal strategi for arbeidet mot virale leverbetennelser (hepatitt).
Gjeldende prioriteringskriterier er ikke lagt til grunn for stønad etter blåreseptforskriften § 4, men det er innført krav om kostnadseffektivitet for legemidler til behandling av hepatitt C.
Flere forhold ved dagens ordning gjør det vanskelig å lage god statistikk, og kontrollere om forskrivninger etter § 4 er i tråd med regelverket:
Legemidler er regulert på overordnet ATC kode (ikke på legemiddel- eller virkestoffnivå).
Det fremgår ikke av resepten hvilken smittsom sykdom som behandles.
En lege kan forskrive HIV-legemidler til seg selv for å sikre brukers anonymitet.
Det er i dag fastsatt særskilte krav for utlevering av visse legemidler til behandling av tuberkulose. Midlene skal kun leveres fra sykehusapotek, og det skal sendes særskilt melding om utlevering til FHI. Denne meldingen gir sjelden tilleggsinformasjon ut over det som allerede er registrert i tuberkuloseregisteret.
Regjeringen foreslår at dagens finansieringsordninger for vaksiner bør gjennomgås, jf. kapittel 19.6. En revisjon av blåreseptforskriften § 4 bør inkluderes i dette arbeidet. I revisjonen bør formålet for stønad avklares. Videre bør det utredes om legemidler for behandling av allmennfarlige smittsomme sykdommer kan behandles på lik linje med andre legemidler i blåreseptordningen, bl.a. slik at de samme krav til effekt og kostnadseffektivitet legges til grunn. Hensynet til smittevern må da tillegges vekt ved vurdering av kostnadseffektivitet.
19.1.8 Bidragsordningen – folketrygdloven § 5-22
Etter folketrygdloven § 5-22 kan folketrygden yte bidrag til dekning av utgifter til helsetjenester når utgiftene ikke ellers dekkes etter folketrygdloven eller annen lovgivning.
Det kan ytes bidrag for reseptpliktige, markedsførte legemidler, som ikke dekkes over blåreseptordningen. Bidragsordningen fungerer som et sikkerhetsnett for pasienter som ikke får legemidler på blå resept. Ordningen stiller ingen krav til vurdering av effekt eller kostnader for å få innvilget bidrag, utover at legemidlet er reseptpliktig, markedsført i Norge og kjøpt på norsk apotek.
Gjennom ordningen gis det også bidrag til legemidler ved infertilitetsbehandling og til prevensjonsmidler for kvinner mellom 16 og 20 år. I tillegg ytes bidrag for reseptfrie legemidler (kremer, salver og oljer mv.) til behandling av kroniske og alvorlige sår og fistler og hudlidelser. Bidragsformålet epidermolysis bullosa (en hudsykdom) ble fra 1. januar 2015 flyttet fra bidragsordningen til blåreseptordningen.
19.2 Kommunal finansiering av legemidler
Dagens finansierings- og brukerbetalingsordninger for kommunale helse- og omsorgstjenester er ulike avhengig av om tjenestemottakeren bor i eget hjem eller i institusjon. Tjenester i hjemmet eller i institusjon er i hovedsak finansiert gjennom kommunenes frie inntekter og ved brukerbetaling. Staten finansierer imidlertid bostøtte, hjelpemidler og deler av legemidler og legetjenester for brukere utenfor institusjon. Kommunene har finansieringsansvar for utgifter til legemidler for personer bosatt i kommunale institusjoner og boliger med heldøgns omsorgstjenester.
Personer som mottar tjenester i eget hjem (inkl. omsorgsboliger) betaler for den enkelte tjeneste de mottar, mens en beboer i institusjon betaler en fast andel av sin inntekt for et helhetlig tilbud. Dagens regelverk kan føre til at brukere betaler ulikt for de samme tjenestene avhengig av om kommunen tilbyr plass i institusjon, eller om tjenestene gis i egen bolig.
Da Stortinget behandlet Meld. St. 29 (2012–2013) Morgendagens omsorg ble det gitt tilslutning til å utrede finansiering og egenbetaling for ulike boformer. Målet er et regelverk som er rettferdig, forutsigbart og enkelt å forstå for både brukere, pårørende og kommunene. Videre bør regelverket sikre at kommunene vurderer og planlegger sitt kapasitetsbehov ut fra hva befolkningen faktisk trenger og hva som er samfunnsøkonomisk fornuftig.
Utredningsarbeidet skal ses i sammenheng med punktet i regjeringsplattformen om å innføre en statlig driftstilskuddsordning, for å hindre skjevfordeling mellom omsorgsboliger og sykehjem, samt sikre raskere utbygging av flere sykehjemsplasser.
Legemidler kan gi en uforutsigbar utgift for kommunene. Dette kan inntre når pasienter som bruker nye og kostbare legemidler får behov for heldøgns pleie- og omsorgstjenester. Noen av de mest kostbare legemidlene brukes ved behandling av sjeldne, arvelig sykdommer som har høyere forekomst i enkelte lokalsamfunn.
Nye, kostbare og spesialiserte legemidler kan administreres utenfor sykehus både på grunn av enklere administrasjonsformer og økt kompetanse i kommunene. Nye legemidler har gjort at flere pasientgrupper forventes å leve like lenge som normalbefolkningen. Disse pasientgruppene kan etter hvert få behov for heldøgns pleie- og omsorgstjenester.
19.3 Finansiering av legemidler på sykehus
19.3.1 Finansiering av helseforetakene
Det følger av spesialisthelsetjenesteloven § 2-1 at staten har det overordnede ansvaret for at befolkningen får nødvendige spesialisthelsetjenester. Dette innebærer at staten skal gi de regionale helseforetakene rammebetingelser som gjør det mulig å overholde det sørge-for-ansvaret de er pålagt. En sentral målsetting med statens eierskap av de regionale helseforetakene er å sikre helhetlig styring av spesialisthelsetjenesten og god ressursutnyttelse for å drifte og videreutvikle gode spesialisthelsetjenester til befolkningen.
I 2015 overførte staten om lag 130 mrd. kroner til de regionale helseforetakene. Finansiering av de regionale helseforetakene er i hovedsak todelt og består av basisbevilgning og aktivitetsbasert finansiering (ISF og polikliniske refusjoner). I tillegg kommer bevilgninger til avtalespesialister, private laboratorier og røntgeninstitutt. Finansieringsordningenes viktigste formål er å understøtte sørge-for-ansvaret til de regionale helseforetakene. Finansieringen av spesialisthelsetjenesten foregår i flere trinn. Staten overfører midler til de regionale helseforetakene, som fordeler inntekter til egne eide helseforetak, og til private aktører i samsvar med sørge-for-ansvaret.
19.3.2 Basisbevilgningen
I 2015 utgjør basisbevilgningen 96 mrd. kroner. Bevilgningen er en grunnfinansiering for å sette de regionale helseforetakene i stand til å utføre sin virksomhet i tråd med helseforetaksloven, øvrig regelverk og politiske beslutninger. Basisbevilgningene skal også finansiere investeringer. Fordelingen av basisbevilgningen mellom de fire regionale helseforetakene bestemmes blant annet av antall innbyggere i regionen, alderssammensetning, ulike sosioøkonomiske kriterier og kostnadsdata.
19.3.3 Innsatsstyrt finansiering
Innsatsstyrt finansiering er den største av de aktivitetsbaserte ordningene og utgjør om lag 30 mrd. kroner i 2015. Gjennom den innsatsstyrte finansieringen gjøres deler av budsjettet til de regionale helseforetakene avhengig av hvor mange, og hva slags pasienter som får behandling. Formålet med ordningen er å legge til rette for at aktiviteten gjennomføres på en mest mulig kostnadseffektiv måte. Dersom aktiviteten blir mindre enn forutsatt, vil tilskuddene til de regionale helseforetakene bli lavere. Dersom aktiviteten blir høyere enn forutsatt, vil tilskuddene til de regionale helseforetakene bli høyere. Høyere aktivitet enn forutsatt, blir bare kompensert gjennom innsatsstyrt finansiering (ISF). Refusjonene gjennom ISF er i gjennomsnitt ment å dekke deler av kostnadene ved økt behandlingskapasitet. Resten må dekkes av basisbevilgningen til de regionale helseforetakene. Aktivitetsbasert finansiering stimulerer til å kartlegge kostnader og identifisere og fjerne flaskehalser som hindrer kostnadseffektiv pasientbehandling. ISF-satsen dekker 50 pst. av enhetsprisen.
Utgifter til legemidler som de regionale helseforetakene har finansieringsansvar for, må dekkes gjennom det ordinære inntektssystemet til helseforetakene (basis og ISF).
Legemiddelkostnader for innlagte pasienter fordeles til den enkelte diagnoserelaterte gruppe (DRG) etter liggetid, mens kostnader for poliklinisk legemiddelbehandling i større grad baseres på informasjon om legemidler som faktisk er blitt brukt. Det finnes for eksempel DRG-er for poliklinisk legemiddelbehandling av kreft, multippel sklerose (MS), inflammatoriske tarmlidelser, inflammatoriske leddlidelser og alvorlig psoriasis. Både konsultasjonskostnad og legemiddelkostnad teller med.
ISF omfatter også behandling med utvalgte legemidler som pasienten administrerer selv, for eksempel ved kreft, MS og alvorlige psoriasis.
19.3.4 Legemiddelinnkjøpssamarbeidet
For legemidler som finansieres av de regionale helseforetakene er det inngått et legemiddelinnkjøpssamarbeid (LIS). Formålet med legemiddelinnkjøpssamarbeidet er å legge grunnlag for avtaler om kjøp og levering av legemidler og andre apotekvarer etter oppdrag fra helseforetak og dermed redusere kostnader for disse produktene. Virksomheten finansieres ved en årlig avgift som betales av de regionale helseforetakene.
Utviklingen i markedene og i sykehusene krever en stadig mer spesialisert innkjøps- og forhandlingskompetanse. Dette gjør at kompetansebehovet er annerledes og mer spisset enn det har vært tidligere. De regionale helseforetakene har fått i oppdrag å legge fram en plan for etablering av et felles eid foretak for samordning av innkjøp der dagens enheter og ressurser på innkjøpsområdet, herunder helseforetakenes innkjøpsservice AS (HINAS) og LIS, skal inngå. En nasjonal innkjøpsfunksjon kan dra fordel av en samlet kompetansebase hvor det kan gis rom for økt spesialisering, bruke beste praksis og utvikle standardiserte prosesser og dermed bli en enda bedre støttefunksjon for kjernevirksomheten i sykehusene. Dette arbeidet må sees i sammenheng med foretaksmøtet for 2013 der de regionale helseforetakene ble bedt om å vurdere LIS rolle i nasjonalt system for innføring av nye metoder i spesialisthelsetjenesten. I organiseringen og utviklingen av en nasjonal innkjøpsfunksjon bør det inngå en vurdering om LIS i sine anbud skal ta hensyn til andre kriterier enn dagens tildelingskriterier, jf. kapittel 16.7.
Det vises til nærmere omtale av Nasjonalt system for innføring av nye metoder under kapittel 19.4.
19.4 Nasjonalt system for innføring av nye metoder i spesialisthelsetjenesten
Et nytt system for innføring av nye og kostnadskrevende metoder i spesialisthelsetjenesten er beskrevet i Meld. St. 16 (2010–2011) nasjonal helse- og omsorgsplan (2011–2015) og i Meld. St. 10 (2012–2013) God kvalitet – trygge tjenester.
Systemet ble etablert i 2012 og lansert i januar 2013. Det er opprettet et sekretariat i Helsedirektoratet, en nasjonal arbeidsgruppe med alle de sentrale aktørene, en referansegruppe med representanter fra brukere og industrien, samt Bestillerforum RHF. Beslutningsforum for nye metoder ble etablert i mai 2014.
Formålet med systemet er å øke kvalitet og pasientsikkerhet i behandlingstilbudet ved å bidra til at pasienter så raskt som mulig får tilgang til nye, virkningsfulle metoder og at behandlingsmetoder som er ineffektive eller skadelige ikke brukes. For legemidler som har markedsføringstillatelse og dermed har et dokumentert positivt nytte-/risikoforhold, vil systemet bidra til å fremme en økonomisk og medisinsk riktig bruk av legemidlene i spesialisthelsetjenesten.
Systemet tar i bruk internasjonalt anerkjente standarder for metodevurdering (Health Technology Assessment – HTA) som sikrer at beslutningene er basert på et best mulig faglig kunnskapsgrunnlag. Metodevurdering er en systematisk oppsummering og vurdering av tilgjengelig vitenskapelig litteratur. Vurderingene kan omfatte medisinsk utstyr og apparatur til forebygging, utredning/diagnostikk, behandling og oppfølging av prosedyrer, legemidler, pleie, samt organisering av tjenesten og andre intervensjoner.
19.4.1 Struktur
Systemet bygger på prinsippene om åpenhet og transparens og implementeres og utvikles innenfor dagens styringsstrukturer og lovverk.
Implementering av systemet er et langsiktig utviklingsarbeid, som stiller store krav til koordinering mellom de involverte aktører. Samtidig er det behov for samhandling med brukere og pasientorganisasjoner, primærhelsetjeneste, andre berørte etater, universitetene, innovasjons- og forskningsmiljøer og produsenter av ny teknologi, samt legemiddelindustrien.
Figur 19.2 Lokale og nasjonale prosesser
Systemet tar utgangspunkt i det ansvaret aktørene har i dag. På lokalt nivå er det helseforetakene med støtte fra de regionale helseforetakene, som har ansvar for at det gjennomføres metodevurderinger. Beslutninger i de regionale helseforetakene vil basere seg på nasjonale hurtige metodevurderinger utført av Nasjonalt kunnskapssenter for helsetjenesten (for medisinsk utstyr, prosedyrer m.m.) og Statens legemiddelverk (for legemidler). Kunnskapssenteret utfører fullstendige metodevurderinger innenfor alle metodekategorier. Fullstendige metodevurderinger brukes der det er aktuelt å sammenlikne flere ulike behandlingsalternativer, og tar utgangspunkt i hele behandlingsområder fremfor enkelprodukter. Etter bestilling fra RHFene skal det gjøres en systematisk metodevurdering for legemidler som finansieres av helseforetak/sykehus. Vurderingen skal være basert på gjeldende prioriteringskriterier og behandles i Beslutningsforum for nye metoder.
De regionale helseforetakene, Nasjonalt kunnskapssenter for helsetjenesten, Statens legemiddelverk, Helsedirektoratet, Statens Strålevern, LIS og HINAS samarbeider om å implementere og utvikle systemet i spesialisthelsetjenesten, og deltar i en nasjonal arbeidsgruppe. Helse- og omsorgsdepartementet er observatør, og Helsedirektoratet har sekretariatsfunksjonen.
De regionale helseforetakene har ansvar for å sørge for at befolkningen i de respektive regionene tilbys spesialisthelsetjenester. Både ansvaret for å gi pasientene et forsvarlig tilbud, og ansvaret for å styre egne helseforetak, innebærer at de regionale helseforetakene kan gi helseforetakene føringer om prioritering av ressurser og behandlingsmetoder. Slik kan de regionale helseforetakene ivareta det overordnede ansvaret for en forsvarlig spesialisthelsetjeneste, gi pasienter tilgang til nye og virkningsfulle metoder og hindre at behandlingsmetoder som er ineffektive eller skadelige blir tatt i bruk.
De fire regionale helseforetakene beslutter samlet om en aktuell metode skal tas i bruk eller ikke i hele landet etter en gjennomført nasjonal metodevurdering, jf. kapittel 19.4.3 under Beslutninger.
Bestillerforum RHF møtes månedlig for å gå igjennom innkomne forslag til metodevurderinger. De beslutter hvilke metodevurderinger som bør gjøres på nasjonalt nivå, og gir deretter Kunnskapssenteret eller Legemiddelverk i oppdrag å gjennomføre metodevurderingene. Bestillerforum RHF består av fagdirektørene i de fire regionale helseforetakene og to representanter fra Helsedirektoratet. Kunnskapssenteret, Legemiddelverket og Statens strålevern har observatørstatus.
Referansegruppen er et forum for tilbakemeldinger og innspill, som kan bidra til å kvalitetssikre, videreutvikle og evaluere systemet. Referansegruppen består av representanter fra pasient- og brukerorganisasjoner, profesjonsforeninger, universitets- forskningsmiljøer, helse- og omsorgstjenesten, primærhelsetjenesten, industrien og produsenter/leverandører av metoder.
19.4.2 Prinsipper og overordnede føringer
Det er et mål at alle prosesser, prosedyrer, forløp, dokumenter og strukturer i systemet er offentlig tilgjengelige på systemets hjemmeside www.nyemetoder.no. Dette skal bidra til bedre oversikt over metoder i systemet, mer transparente prosesser, god dialog i utviklingsarbeid og forutsigbarhet for hele helsetjenesten inkludert alle involverte aktører. Hjemmesiden ble lansert i februar 2015.
I enkelte tilfeller har legemiddelindustrien krevet at fremforhandlede rabatter holdes hemmelig. Hemmelighold rundt priser er blant årsakene til at Beslutningsforum for nye metoder i mange tilfeller har lukkede møter. Beslutningsforum inkluderer en representant fra de regionale brukerutvalgene som observatør med talerett i forumets møter.
Innspill til systemet fra medisinske fagmiljøer er en viktig forutsetning for å sikre god faglig forståelse ved vurdering og innføring av nye metoder. I løpet av det første driftsåret ble det etablert et panel med eksperter innenfor en rekke fagområder. Det er også viktig å inkludere pasientenes synspunkter i denne delen av vurderingsprosessen. For å høyne kvaliteten, og for å gi metodevurderingene legitimitet i tjenesten, er det viktig at ekspertenes og pasientens rolle tydeliggjøres og forsterkes i arbeidet med metodevurderingene. Fagmiljøene vil på sikt også spille en viktig rolle i metodevarslingsfunksjonen i systemet.
Det er i statsbudsjettene for 2013, 2014 og 2015 bevilget midler til å styrke metodevurderingskapasiteten både i Statens Legemiddelverk og Nasjonalt kunnskapssenter for helsetjenesten.
19.4.3 Systemets hovedfaser
Systemet kan deles inn i fire hovedfaser, jf. figur 19.3. Alle fasene i systemet er under utvikling og implementeres gradvis. Det vil være hensiktsmessig å evaluere systemet når alle trinnene er implementert og utprøvd. Systemet for nye metoder er under utvikling og evalueres og forbedres fortløpende i dialog med aktørene, pasientorganisasjoner, fagmiljøer og industrien. Departementet vil i forbindelse med arbeidet med prioriteringsmeldingen vurdere ev. endringer i systemet, herunder behovet for ev. unntaksordninger.
Figur 19.3 Hovedfaser i nasjonalt system for innføring av nye metoder
I det følgende beskrives de tiltakene som er gjennomført eller er under implementering, med særlig vekt på legemiddelområdet.
Forslag, metodevarsling og vurdering
Alle kan sende inn forslag om at det bør utføres en metodevurdering på nasjonalt nivå for metoder som er relevante for spesialisthelsetjenesten. For legemidler skal metodevurderingene alltid gjøres på nasjonalt nivå. Frem til desember 2014 kom det inn 72 forslag om nasjonal metodevurdering. 55 av de 72 forslagene gjaldt legemidler. Bestillerforum RHF ga oppdrag om hurtig metodevurdering i de fleste tilfellene, og det er bestilt fullstendig metodevurdering av tre terapeutiske legemiddelområder for å sammenligne behandlingsalternativene.
Et metodevarsel er en norsk omtale av en ny og potensielt viktig metode. Metodevarslingsfunksjonen skal sikre at nye og viktige metoder blir identifisert og prioritert for metodevurdering så tidlig som mulig. Departementet har gitt Nasjonalt kunnskapssenter for helsetjenesten i oppdrag å lede og utvikle arbeidet med implementering av varslingssystemet. Prosjektplanen ble ferdig utarbeidet høsten 2014, og de første metodevarslene ble pilotert i desember 2014. Metodevarslingssystemet er nå i sin første pilotfase i 2015 og skal evalueres etter ett års drift.
Metodevarsler utarbeides av Kunnskapssenteret i samarbeid Legemiddelverket. Det er anslått at det vil bli utarbeidet om lag 10–15 metodevarsler per måned. Når metoden har kommet så langt i utviklingen at det er aktuelt å gjennomføre en metodevurdering, vil den bli meldt inn til Bestillerforum RHF som et forslag til metodevurdering. Det er et mål at metodevarslingsfunksjonen skal forkorte systemets responstid til nye metoder, slik at de kan bli tatt i bruk raskere.
Det er stilt krav om at utredningsenhetene maksimalt skal bruke 180 dager for å gjennomføre en hurtig metodevurdering. Fristen gjelder fra de har mottatt dokumentasjon fra leverandørene.
For å sikre best mulig beslutningsgrunnlag, får leverandørene anledning til å kommentere gjennomførte metodevurderinger og helseøkonomiske rapporter. Eventuelle kommentarer fra leverandørene publiseres med saksdokumentene. Det vil bli vurdert om dette i fremtiden også skal gjelde innspill fra andre aktører.
Beslutninger
Når det foreligger en metodevurdering, fatter Beslutningsforum for nye metoder en felles beslutning for de regionale helseforetakene om metoden skal tas i bruk som standardbehandling i hele landet eller ikke. Beslutningsforum består av de administrerende direktørene i de fire regionale helseforetakene, og ble etablert etter et styrevedtak av de regionale helseforetakene.
Beslutningsforum har bestemt at beslutningene som tas skal basere seg på de gjeldende prioriteringskriterier i helsetjenesten. Beslutningsforum møtes månedlig, og beslutningene er offentlige. Helsedirektoratet har ansvar for at beslutningene kommer inn i nasjonale faglige retningslinjer og krefthandlingsprogrammer.
Beslutningsforum har besluttet at nye metoder som er til metodevurdering ikke skal tas i bruk. Dette sikrer lik behandling av pasienter, uavhengig av hvor de får behandling, eller hvem som er behandlende lege og følger prinsippet om én dør inn for legemidler til ordinær klinisk bruk. Beslutningsforum har likevel åpnet for at det kan gjøres unntak fra dette, dersom alle fagdirektørene i de regionale helseforetakene godkjenner tidligere bruk. Et slikt unntak ble gjort for å gi midlertidig adgang til å utføre autolog stamcelletransplantasjon mot MS i Helse Bergen HF i påvente av at denne metoden er vurdert og beslutning tatt.
De regionale helseforetakene skal gjennomføre forhandlinger med leverandører i forbindelse med metodevurderinger. Beslutningsforum RHF har uttalt at de vil gjennomføre en evaluering av forhandlingsstrukturen, og se nærmere på gjennomføringen av fremtidige forhandlinger som grunnlag for å skape et godt rammeverk for inngåelse av avtaler med leverandørene, og for å effektivisere forhandlingsprosessene. Systemet for innføring av nye metoder må sees i sammenheng med oppdraget til de regionale helseforetakene gitt i foretaksprotokollen januar 2015 om å etablere en nasjonal innkjøpsorganisasjon.
Implementering
Helsedirektoratet arbeider med å utvikle tiltak for å evaluere og monitorere bruken, etterlevelsen og effekten av nye metoder. I tillegg vil evalueringer og bruk av kvalitetsregistre være viktige redskaper i implementeringen av systemet. Systemet vil også kunne fange opp når det er behov for bedre kunnskapsgrunnlag før en endelig beslutning fattes, eller der det er ønskelig med oppfølgingsstudier etter at metoden er tatt i bruk, jf. omtale i del VI. Foreligger det nye eller bedre data, f.eks gjennom fase IV-studier, kan det gjennomføres re-evalueringer av metodevurderingene, jf. kapittel 22.
19.4.4 Internasjonalt samarbeid
Det er etablert et internasjonalt samarbeid om samarbeidsplattformer og nettverk for systematisk introduksjon av legemidler og teknologi generelt, Health Technology Assessment (HTA), retningslinjearbeid mv. Aktørene i det nasjonale systemet deltar i dette arbeidet. Et av nettverkene som omfatter alle medlemsland i EU, Norge og Island har utarbeidet en felles europeisk strategi som skal bidra til en mer konsistent bruk av HTA og optimalisere bruken av ressurser ved å unngå at samme metodevurdering gjøres flere ganger.
WHO har understreket betydningen av HTA i globalt perspektiv gjennom resolusjonen «Health intervention and technology assessment in support of universal health coverage» som ble vedtatt på World Health Assembly 24. mai i 2014. Resolusjonen viser til The World Health Report 2010, som indikerer at så mye som 40 pst. av ressursinnsatsen på helse er ineffektiv, og at det er et stort behov for å styrke en rasjonell bruk av helseteknologier.
19.4.5 Fremtidige utviklingstiltak
Basert på erfaringene i systemet er det behov for utvikling innenfor utvalgte områder:
Transparens, åpenhet og brukermedvirking.
Avklaring av rammer og kapasitet.
Systematisk og forutsigbar seleksjon av metoder for metodevurdering.
Koordinere det nasjonale systemet med innkjøpsprosesser og -organer i de regionale helseforetak.
Systematisk bruk av fagmiljøer og pasienter i metodevurderingene.
Systematisk evaluering av nye og eksisterende metoder.
Bruk av metodevurderinger som allerede er gjort i andre land slik at duplisering unngås.
19.5 Fordeling av finansieringsansvar mellom folketrygden og de regionale helseforetakene
Finansiering av legemidler er i dag delt mellom de regionale helseforetakene, kommunene og folketrygden. Som hovedregel har de regionale helseforetakene ansvar for utgifter til legemidler som brukes i forbindelse med sykehusopphold og poliklinisk behandling. Kommunene har ansvar for utgifter til legemidler i kommunale institusjoner, og folketrygden yter stønad til legemidler som brukes utenfor sykehus og kommunale institusjoner.
Boks 19.1 Prinsipper for overføring av finansieringsansvar
Følgende prinsipper har ligget til grunn for Stortingets beslutninger om overføringer av finansieringsansvaret for legemidler fra folketrygd til sykehus, jf. blant annet Prop. 1 S (2013–2014):
Mulighet for forbruksvridning: Ulike finansieringsordninger kan føre til at legemiddelvalg baserer seg på økonomiske og ikke medisinske hensyn.
Riktigere prioritering: Sykehuslegene har ofte de beste forutsetningene for å foreta en riktig prioritering av hva slags behandling pasientene skal få innenfor sitt ansvarsområde.
Manglende priskonkurranse: Det er mulig å oppnå priskonkurranse mellom medisinsk likeverdige legemidler gjennom f.eks. anbud i sykehusene.
I de senere årene er det gjort unntak fra hovedregelen om at folketrygden dekker legemidler som brukes utenfor institusjon, ved at enkelte legemidler som hentes ut på apotek av den enkelte pasient finansieres av sykehus. I 2006 vedtok Stortinget å overføre finansieringsansvaret for legemiddelgruppen TNF-hemmere fra folketrygden til de regionale helseforetakene. Dette er en gruppe biologiske legemidler, som benyttes i behandlingen av visse revmatiske sykdommer. I 2008 ble legemidler til behandling av Multippel sklerose overført til de regionale helseforetakene, og i 2014 ble finansieringsansvaret for enkelte kreftlegemidler overført fra folketrygden til de regionale helseforetakene.
Disse legemidlene forskrives av sykehusleger, eller privatpraktiserende spesialister, som helseforetakene har inngått avtaler med. Pasientene henter ut legemidlet på apotek. Helsedirektoratet vurderer nye legemidler innenfor disse områdene, og om disse representerer alternativer til legemidler som allerede er finansiert av sykehusene. Helsedirektoratet fatter beslutning om finansieringsansvaret for disse nye legemidlene skal legges til helseforetakene.
Boks 19.2 H-reseptordningen
H-reseptordningen ble opprettet for legemidler som pasienten kan administrerte selv, men hvor utgiftene likevel skal dekkes av de regionale helseforetakene.
H-reseptordningen bygger på en løsning med direkte oppgjør mellom apotek og helseforetak (HF). Pasienten får en h-resept og kan hente ut legemidlet på det apotek han ønsker. Per i dag er oppgjørsordningen mellom apotek og HF i all hovedsak papirbasert (resepter og fakturaer). På bakgrunn av mottatte fakturaopplysninger foretar helseforetakene enkelte stikkprøvebaserte kontroller før utbetaling til apotek.
Departementet sendte i desember 2014 forslag til forskrift om helseforetaksfinansierte legemidler til bruk utenfor sykehus på høring. Formålet med forskriften er å legge til rette for oppfølging av legenes rekvirering og riktig økonomisk oppgjør mellom apotek og helseforetak. Forskriften skal regulere rekvirering og utlevering av h-reseptlegemidler, og behandling av helseopplysninger i forbindelse med det økonomiske oppgjøret. De regionale helseforetakene forbereder en elektronisk oppgjørsløsning for h-resept og planlegger et pilotprosjekt i løpet av 2015.
Det er krevende å finne entydige kriterier for fordeling av finansieringsansvar for legemidler mellom folketrygden og de regionale helseforetakene. Medisinsk teknologi og behandling er i stadig endring. Dette medfører at det ofte oppstår gråsoner når det gjelder hvor ansvaret bør plasseres, og at grensene for hvor ansvaret bør plasseres kan endres over tid.
Regjeringen vil arbeide videre med å definere kriterier for overføring av finansieringsansvar for legemidler fra folketrygden til helseforetakene i de tilfeller hvor det er utfordringer ved delt finansieringsansvar. Regjeringen åpner for at overføring av finansieringsansvaret for enkeltlegemidler eller grupper av legemidler kan være hensiktsmessig selv om ikke alle de tre hensynene (jf. boks 19.1) gjør seg gjeldende. Dette vil kunne være aktuelt når det er klart at både initiering, evaluering og avslutning av pasientens legemiddelbehandling gjøres av lege i spesialisthelsetjenesten, og det er konkurranse mellom flere legemidler innenfor terapiområdet. Eventuelle forslag om overføring av finansieringsansvar for legemiddelgrupper vil bli behandlet i de årlige statsbudsjettene og dermed lagt fram for Stortinget.
19.6 Vaksiner
19.6.1 Gjeldende system for dekning av utgifter til vaksiner
Vaksiner i barnevaksinasjonsprogrammet dekkes i dag av det offentlige etter forskrift om nasjonalt vaksinasjonsprogram. Folkehelseinstituttet gir faglige retningslinjer for gjennomføring av det nasjonale vaksinasjonsprogrammet, hvilke vaksiner som bør inngå i programmet og målgrupper for vaksinasjon. Folkehelseinstituttet kjøper inn vaksinene etter en anbudskonkurranse og distribuerer disse gratis til kommunene. Vaksinene tilbys gratis, som regel gjennom helsestasjons- og skolehelsetjenesten.
Forskrift om nasjonalt vaksinasjonsprogram omfatter også vaksine mot sesonginfluensa (og pandemisk influensa). Vaksinene tilbys årlig til alle personer med økt risiko for komplikasjoner i forbindelse med influensa. Folkehelseinstituttet definerer risikogruppene, kjøper inn vaksinen etter en anbudskonkurranse og selger deretter disse til selvkost til kommunene. Kommunen organiserer vaksinasjonene slik den finner det mest hensiktsmessig for å oppnå høyest mulig vaksinasjonsdekning. Kommunen kan ta betalt for slike vaksinasjoner. Vaksinasjoner gjennomføres enten i kommunal regi på helsestasjonene, som et massevaksinasjonsprogram eller av fastlegen som også kan ta betalt for denne tjenesten.
I henhold til blåreseptforskriften § 4 nr.1 yter folketrygden stønad til legemidler ved smittsomme sykdommer til den som oppholder seg i Norge, selv om vedkommende ikke er medlem i folketrygden. Det ytes blant annet stønad til vaksiner etter blåreseptforskriftens § 4 nr. 3. Forskriften inneholder en tabell som viser hvilke vaksiner mv. som refunderes ved ulike sykdommer og indikasjoner. For hepatitt A og hepatitt B henvises det under indikasjon til retningslinjer fra Helse- og omsorgsdepartementet. Vaksinene skal i henhold til forskriften rekvireres fra Folkehelseinstituttet som skal vurdere om indikasjonen er i tråd med vilkårene i forskriften. Vaksiner på blå resept kjøpes ikke inn på anbud på grunn av lite volum, og fordi det ofte bare er en leverandør. Disse vaksinene utleveres av Folkehelseinstituttet og sendes kostnadsfritt til helsepersonellet som skal sette vaksinen.
Regelverket åpner også for refusjon av vaksiner etter de alminnelige bestemmelsene i blåreseptforskriften §§ 2 og 3. Forutsetningen er da at hver enkelt pasient oppfyller kravet om alvorlig sykdom eller risiko for alvorlig sykdom. Vaksiner som skal benyttes av store befolkningsgrupper vil normalt ikke oppfylle dette vilkåret. Reisevaksiner dekkes ikke av det offentlige.
Nærmere om barnevaksinasjonsprogrammet
Smittevernloven fastslår at departementet skal fastlegge et nasjonalt program for vaksinering mot smittsomme sykdommer. Barnevaksinasjonsprogrammet reguleres gjennom forskrift om nasjonalt vaksinasjonsprogram. Programmet tilbys alle barn i førskole- og grunnskolealder og gjennomføres i helsestasjons- og skolehelsetjenesten.
Det norske barnevaksinasjonsprogrammet ble opprettet i 1952 og anbefaler i dag vaksiner mot 11 forskjellige sykdommer: difteri, stivkrampe, kikhoste, poliomyelitt, infeksjon med Haemophilus influenzae type b (Hib), pneumokokksykdom, meslinger, kusma, røde hunder, humant papillomavirus (HPV) og rotavirussykdom. I tillegg tilbys vaksine mot tuberkulose (BCG) og hepatitt B til barn i risikogrupper.
For å kunne tilby et faglig forsvarlig barnevaksinasjonsprogram, foreligger det systemer for å overvåke vaksinasjonsdekning, forekomst av uønskede hendelser (bivirkninger) etter vaksinasjon og effekt av vaksinasjon. Dette oppnås gjennom:
SYSVAK-registeret er et landsomfattende elektronisk vaksinasjonsregister som inneholder oversikt over vaksinasjonsstatus hos den enkelte og over vaksinasjonsdekningen i landet.
Bivirkninger av vaksinene følges opp i SYSVAK-registeret og bivirkningsregisteret, gjennom et samarbeid mellom Folkehelseinstituttet og Statens legemiddelverk.
Effekten av vaksinene som inngår i barnevaksinasjonsprogrammet overvåkes i dag ved å stille sammen data fra SYSVAK-registeret og MSIS (Det nasjonale meldingssystemet for smittsomme sykdommer).
Sammen med internasjonale data gir dette et solid kunnskapsgrunnlag for informasjonsarbeidet som er knyttet til barnevaksinasjonsprogrammet. Det er viktig å gjøre denne kunnskapen tilgjengelig for foreldrene slik at de kan ta informerte valg og for å bevare tilliten til programmet.
Figur 19.4 MMR-vaksine i ulike aldersgrupper
Kilde: Nasjonalt vaksinasjonsregister SYSVAK
Figur 19.5 HPV-vaksine 16 åringer fullvaksinert
Kilde: Nasjonalt vaksinasjonsregister SYSVAK
I Norge har vi høy oppslutning om barnevaksinasjonsprogrammet, og det arbeides kontinuerlig med å opprettholde dette10. Gjennomgang av den nasjonale vaksinasjonsdekningen i 2014 (SYSVAK-registeret), viser at de aller fleste barn og unge i Norge får de vaksinene som er anbefalt i barnevaksinasjonsprogrammet. Særlig vaksinasjonsdekningen mot meslinger, kusma og røde hunder (MMR) har holdt seg stabilt høy. 31. desember 2014 var 94 pst. av landets 2-åringer, 95 pst. av landets 9-åringer og 94 pst. av landets 16-åringer fullvaksinerte mot meslinger, kusma og røde hunder. Vaksinen med lavest dekning er vaksine mot humant papillomavirus (HPV) som ble introdusert som tilbud til alle jenter i 7. klasse fra og med skoleåret 2009/2010 (jenter født i 1997). SYSVAK-registeret for 2014 viser en økning i andelen 16 år gamle jenter som er fullvaksinert mot HPV-infeksjon på 9 prosentpoeng sammenliknet med året før. Fortsatt ligger dekningen imidlertid under 80 pst.
En av suksessfaktorene for vaksinasjonsdekningen/barnevaksinasjonsprogrammet er det personlige møtet mellom helsesøster og foreldre. Der blir det gitt tilpasset informasjon og foreldrene kan stille spørsmål og diskutere eventuelle bekymringer og skepsis.
19.6.2 Vurderingen av nye vaksiner
Folkehelseinstituttet skal i henhold til smittevernloven overvåke den epidemiologiske situasjonen og gi råd til myndighetene om smittsomme sykdommer, smittevern og valg av smitteverntiltak. I henhold til forskrift om nasjonalt vaksinasjonsprogram gir FHI faglige retningslinjer for gjennomføring av det nasjonale vaksinasjonsprogrammet, herunder hvilke vaksiner som bør inngå i programmet og målgrupper for vaksinasjon. Det kan imidlertid oppleves som uklart hvilke vaksiner som anbefales og hvilke vaksiner som betales av det offentlige, og det forventes flere terapeutiske vaksiner i årene fremover. Kriterier for når vaksiner skal dekkes etter blåreseptforskriften og når de skal inn i nasjonalt vaksinasjonsprogram, bør derfor gjennomgås. Videre er det ikke avgjort hvilken bestemmelse i blåreseptforskriften som skal brukes ved eventuell refusjon til nye terapeutiske vaksiner. Regjeringen skal gjennomgå dagens finansieringsordninger for vaksiner.
Dersom en ny vaksine skal vurderes innført i barnevaksinasjonsprogrammet, etablerer Folkehelseinstituttet en arbeidsgruppe med interne og eksterne deltagere. Arbeidsgruppen utarbeider en rapport som oversendes Helse- og omsorgsdepartementet. Helseøkonomiske vurderinger omfattes vanligvis ikke av arbeidsgruppens mandat og utføres vanligvis av eksterne institusjoner som Kunnskapssenteret. Rådet for kvalitet og prioritering skal delta i vurderingen av befolkningsrettede tiltak som screening og vaksiner. Helse- og omsorgsdepartementet tar stilling til anbefalingen og fremmer eventuelt forslag til Stortinget om hvorvidt vaksinen bør inkluderes i barnevaksinasjonsprogrammet. Dersom det er aktuelt å fjerne en vaksine fra programmet, eller å endre hvilke grupper som skal få tilbud om en vaksine som allerede er i programmet, blir dette behandlet på tilsvarende måte.
Dagens system er godt, men har noen mangler:
Det mangler en mekanisme for å vurdere nye vaksinebehov, herunder et system for tidlig identifisering av potensielle vaksinekandidater (horizon scanning).
Det mangler en langsiktig plan for kontinuerlig oppdatering av nasjonalt vaksinasjonsprogram.
Regjeringen vil utrede etableringen av et mer robust system for å vurdere innføring av vaksiner i offentlig regi. Dette må ses i sammenheng med system for nye metoder i spesialisthelsetjenesten og system for vurdering av legemidler på blå resept.
19.6.3 Vaksinasjon gjennom livet – et vaksinasjonsprogram for voksne
Det finnes i dag ikke et systematisk program for vaksinasjon av befolkningen utover barnevaksinasjonsprogrammet, med unntak av tilbud om sesonginfluensavaksine til eldre og spesielle målgrupper. Unge voksne med behov for vaksinasjon er en vanskelig gruppe å nå. Grunnvaksinasjon i voksen alder er aktuelt både for innvandrergrupper og etnisk norske.
Ved å følge suksessen til barnevaksinasjonsprogrammet, og opprette et voksenvaksinasjonsprogram, vil anbefalinger som retter seg spesielt mot voksne lettere la seg gjennomføre. Eksempler kan være meningokokkvaksinasjon av ungdom, HPV vaksinasjon av unge kvinner og tilbud om vaksine mot influensa og røde hunder til gravide. På samme måte kan anbefalinger som retter seg spesielt mot eldre, være lettere å gjennomføre innenfor et voksenvaksinasjonsprogram, f.eks. vaksinasjon mot pneumokokksykdom, sesonginfluensa og herpes zoster.
Regjeringen vil utrede opprettelse av et vaksinasjonsprogram for voksne tilsvarende barnevaksinasjonsprogrammet. Innretning og prioriteringer bør utredes nærmere.
Boks 19.3 Regjeringen vil, for å sikre likeverdig og rask tilgang til effektive legemidler:
Utrede en ordning med farmasøytutlevering i apotek.
Foreslå at legemiddelforskriften § 14-14 første ledd bokstav a (rusavhengighet) og bokstav d (erektil dysfunksjon) oppheves, og forslag om forskriftsendring sendes på høring ila høsten 2015.
Oppheve det generelle vilkåret om spesialistinstituering for søknader om individuell stønad.
Avvikle ordningen med Forskningsblå.
Revidere blåreseptforskriften § 4.
Arbeide videre med å definere kriterier for overføring av finansieringsansvar for legemidler fra folketrygden til helseforetakene i de tilfeller hvor det er utfordringer ved delt finansieringsansvar.
Åpne for at enkeltlegemidler eller legemiddelgrupper som spesialisthelsetjenesten har det medisinskfaglige ansvaret for, etter en særskilt vurdering kan overføres fra folketrygden til de regionale helseforetakene selv om ikke alle kriterier for overføring er oppfylt.
Gjennomgå dagens finansieringsordninger for vaksiner.
Utrede etableringen av et mer robust system for å vurdere innføring av vaksiner i offentlig regi.
Utrede opprettelsen av et vaksinasjonsprogram for voksne tilsvarende barnevaksinasjonsprogrammet.
Fotnoter
Artikkel 5, direktiv 2001/83/EF.
Legemiddelforskriften § 2-5 første ledd.
www.apotek.no.
Herunder salg av medisinsk forbruksmateriell og næringsmidler som refunderes av folketrygden.
Grossistbasert legemiddelstatistikk, Nasjonalt folkehelseinstitutt.
Helsedirektoratet.
Sykehusenes Legemiddelstatistikk.
Apotek og legemidler 2015, Apotekforeningen.
Reseptregisteret, Nasjonalt folkehelseinstitutt.
http://www.fhi.no/artikler/?id=84900