Målområde 1: Likeverdig tilgang til persontilpasset medisin hvor pasientbehandling, systematisk kunnskapsbygging og forskning er integrert
Målområdet skal møte utfordringene knyttet til ulikheter i tilgangen til persontilpasset medisin, og at persontilpasset medisin utfordrer grenseflaten mellom forskning og klinisk rutine. Det er behov for mer kunnskap om både forebygging, diagnostikk, behandling og oppfølging, og at særlig den kommunale helse- og omsorgstjenesten er rigget for å ta i bruk de mulighetene persontilpasset medisin gir.
Persontilpasset medisin i forebygging av sykdom
Potensialet for forebyggende tiltak innenfor persontilpasset medisin oppfattes av mange aktører som stort, både på befolknings- og individnivå, selv om det gjenstår mye forskning på området. Sammen med annen biologisk informasjon, kan kunnskap om arvelige genvarianter som kan gi økt risiko for sykdom, brukes for å gjøre mer presise valg om forebyggende tiltak, tidlig oppdagelse og behandling. Det forventes økende kunnskap om kost-nytte effekter av forebyggende helsetiltak basert på genetisk informasjon og andre biologiske forhold de kommende årene.
Vi har i Norge flere screeningprogrammer hvor hensikten er å systematisk undersøke friske mennesker for å oppdage sykdom, eller forstadier til sykdom. Eksempler på dette er den nasjonale nyfødtscreeningen, og screening for brystkreft, livmorhalskreft og tykktarmskreft hos voksne.
Nyfødtscreeningen er et befolkningsrettet screeningprogram for kjente arvelige sykdommer hvor det finnes behandling og der det er viktig å komme i gang med behandling før symptomer inntreffer. Gitt utviklingstempoet i relaterte fagområder er det viktig at nyfødtscreeningen raskt kan utvides med nye bruksområder når relevante behandlinger besluttes innført i spesialisthelsetjenesten. Det er en forutsetning for inklusjon av nye sykdommer i nyfødtscreeningen at den spesifikke sykdomsundersøkelsen kan redusere eller forebygge helseskade hos barnet. Det er behov for å utrede et mer dynamisk system for inkludering av nye sykdommer i nyfødtscreeningen.24
Boks 3 Nyfødtscreeningen
Alle nyfødte i Norge blir i dag undersøkt for 26 sjeldne sykdommer som det er viktig å starte behandling for så snart som mulig. Dette gjelder to endokrinologiske sykdommer, 21 metabolske sykdommer, alvorlig kombinert immunsvikt eller andre alvorlige T-celle defekter, cystisk fibrose og spinal muskelatrofi. Det tas en blodprøve fra hælen på det nyfødte barnet. Prøvesvarene kan brukes til helsehjelp til barnet, til kvalitetskontroll og til metodeutvikling. Restene av blodprøven lagres avidentifisert i Nyfødtscreeningens biobank ved Oslo universitetssykehus HF.
Med unntak av nyfødtscreeningen gjennomføres ikke generelle befolkningsrettede screeningprogrammer for arvelige sykdommer. Ved arvelig kreftsykdom med skadelige varianter i BRCA1 og BRCA2 genene, tilbys andre kvinner i familien under 60 år genetisk undersøkelse og informasjon, ofte med bistand fra den kommunale helse- og omsorgstjenesten. Genetisk undersøkelse tilbys også ofte til barn og unge voksne med tidlig innsettende, eller særlig alvorlige sykdomstilstander innenfor flere fagområder, for eksempel ved immunsvikt, hjerterytmeforstyrrelser, lungefibrose eller inflammatorisk tarmsykdom.
I mange tilfeller finnes ikke spesifikk behandling for enkeltgensykdommer, det vil si der en sykdom kan relateres til en variant i enkeltgener, noe som begrenser verdien av systematisk screening av familiemedlemmer. Et unntakseksempel er arvelig høyt kolesterolinnhold i blodet, familiær hyperkolesterolemi. Å oppdage familiær hyperkolesterolemi tidlig har store helsefordeler da risikoen for å utvikle hjertesykdom reduseres betydelig med tidlig behandling. Familierettet screening for familiær hyperkolesterolemi anses å være modent for implementering i helsetjenesten og er nevnt i EUs fjerde helseprogram (EU4Health) sin «Best Practice Portal».
For de fleste mer vanlige sykdomstilstander, inkludert folkesykdommer som overvekt og type 2 diabetes, er den genetiske disposisjonen sammensatt, med bidrag fra flere titalls og ofte hundrevis av gener. Det gjør oppfølging basert på genetiske undersøkelser vanskelig. I slike tilfeller kan det argumenteres for nytten av såkalte «polygene risikoscorer». Rutinemessig bruk av polygene risikoscorer i helsetjenesten er uavklart, selv om kommersielle aktører lenge har tilbudt slike undersøkelser. Det forventes at polygene risikoscorer kan bidra til bedre risikoklassifisering av personer der forebyggende helsetiltak, som for eksempel kostholdsråd eller medikamentell behandling, er aktuelt. Det kan også være muligheter for målrettede screeningprogrammer basert på dette, men det vitenskapelige grunnlaget for slike undersøkelser er foreløpig usikkert. Det er ikke avklart om disse undersøkelser anses som prediktive genetiske undersøkelser i bioteknologilovens forstand.
Et særtrekk ved polygene, multifaktorielle sykdommer er at bidraget til sykdomsdisposisjonen fra hvert enkelt gen er svært lite, ofte øker risikoen for sykdom marginalt for hver enkelt genvariant. Det betyr at store studiepopulasjoner kreves for å finne sammenhengene. Samspillet mellom genetikk og miljøfaktorer er også relativt sett viktigere enn for enkeltgensykdommer. Kunnskap om langtidseffekten av slike genetiske varianter og miljøpåvirkning for individet, inkludert mikrobene på kroppsoverflatene og i tarmen, vil kunne danne basis for forebyggende tiltak innenfor persontilpasset medisin for mange store sykdomsgrupper, men mye forskning gjenstår.
I Norge er det over tid investert i store populasjonsbaserte kohorter med biomateriale, genetisk kartlegging og innhenting av spørreskjemadata og registerkoblinger. Eksempler på slike befolkningsundersøkelser er Den norske mor, far og barn-undersøkelsen (MoBa), Helseundersøkelsen Trøndelag – HUNT, Cohort of Norway (CONOR) og Tromsøundersøkelsen. Disse er svært verdifulle for forskning koplet med andre helse- og personopplysninger.
Boks 4 Den norske mor, far og barn-undersøkelsen (MoBa)
Den norske mor, far og barn-undersøkelsen (MoBa) følger 95 000 mødre, 75 000 fedre og 114 500 barn og ungdommer. Deltakerne og påvirkninger følges i et livsløpsperspektiv, og starter allerede når mor er gravid. Formålet med MoBa er å finne årsaker til sykdommer slik at disse bedre kan forebygges og behandles. Forskere ser på hvilken betydning miljøgifter, infeksjoner, kosthold, arbeidsbelastninger, arv eller andre faktorer har for helse og sykdom over tid. Både biologiske prøver og svar på spørreskjemaer er samlet inn fra deltakere. Resultatene fra MoBa forventes å gi helsetjenesten bedre muligheter til å forebygge sykdom enn det vi kan i dag. MoBa driftes av Folkehelseinstituttet, og er velegnet til forskning om persontilpasset forebygging og behandling.
Boks 5 Helseundersøkelsen i Trøndelag (HUNT)
Helseundersøkelsen i Trøndelag (HUNT) er Norges største samling av helseopplysninger om en befolkning. Data er framskaffet gjennom fire befolkningsundersøkelser, og til sammen har 250 000 trøndere samtykket til at avidentifiserte helseopplysninger kan gjøres tilgjengelig for godkjente forskningsprosjekter. Dette gjør HUNT til en betydningsfull samling av helsedata og biologisk materiale, også i internasjonal sammenheng.
Kombinasjonen av data fra befolkningsundersøkelser og biologisk materiale gir forskere mulighet til å studere samspillet mellom genetisk variasjon, livsstil og miljøpåvirkning. Dette kan gi ny kunnskap om sykdom og helse. Data fra en totalbefolkning og et geografisk område gir helt unike muligheter til å studere helse og sosiale forhold i en befolkning, og deltakerne kommer fra forskjellige regioner, kommuner og bostedskretser.

Foto: Geir Mogen
Godt samarbeid mellom aktørene som drifter disse kohortene, med innspill fra forskningsmiljøer i kliniske og laboratoriemedisinske fag, er nødvendig. For å gjennomføre forskningen må kohortene kobles til nasjonale registre over sykdom, vaksinering og legemiddelbruk. Dette vil styrke kunnskapen om persontilpasset medisin i et folkehelseperspektiv, og kan gi en koordinert overføring av kunnskap til klinisk praksis.
Diagnostikk og behandling
Omfanget av persontilpasset medisin i spesialisthelsetjenesten er økende. Fagområdene kreft, infeksjonsmedisin og sjeldne, arvelige sykdommer ble prioritert i forrige strategiperiode og involverte aktører vil fortsatt ha ledende roller for utvikling av feltet i Norge. Oppfølging av sjeldenstrategien pågår, og regjeringen vil lage en ny kreftplan som blant annet vil sette ambisjoner for kapasitet til å utføre genetiske undersøkelser tidligere i behandlingsforløpet for personer med kreft. De diagnostiske fagmiljøene innenfor medisinsk genetikk og molekylær patologi beskriver økt aktivitet knyttet til kartlegging av biologiske faktorer ved hjelp av genetiske undersøkelser av materiale fra kreftsvulster. Dagens muligheter for kartlegging av virusvarianter og antibiotikaresistens bygger på utviklingen i første strategiperiode.
Med økt modenhet i flere fagfelt får persontilpasset medisin imidlertid nå en bredere relevans. Innenfor de store folkesykdommene, som psykiske lidelser, kan for eksempel persontilpasset medisin spille en rolle i utvikling av genetiske markører for optimal legemiddelbruk hos den enkelte pasient. Innenfor radiologi er nukleærmedisin og billedanalyse ved hjelp av kunstig intelligens i vekst. Helsenæringen har hatt persontilpasset medisin som et innsatsområde over flere år, og forventer en utvidelse til flere terapiområder, blant annet i form av gen- og celleterapi. Etableringen av nasjonale og regionale nettverk, samarbeid og infrastrukturer har gitt bedret tilgang til avansert diagnostikk. Sentralt er Nasjonalt kompetansenettverk innenfor persontilpasset medisin (NorPreM) 25, Nasjonal infrastruktur for presisjonsdiagnostikk på kreftområdet (InPreD), arbeidet med Nasjonalt genomsenter og andre mer generiske forskningsinfrastrukturer.26 NorPreM bidrar blant annet til å fremme bedre og mer ensartet diagnostikk, behandling og oppfølging av pasienter og til å sikre likeverdig tilgang til diagnostiske tjenester nasjonalt gjennom standardisering og harmonisering i samarbeid med Helsedirektoratet. Dette er strukturer som videreføres og søkes videreutviklet med denne strategien, og som også bør favne nye teknologiområder som radiologi og nukleærmedisin.
Boks 6 InPred
InPreD er en nasjonal infrastruktur for presisjonsdiagnostikk som ble etablert i 2020, på oppdrag fra Helse- og omsorgsdepartementet. Infrastrukturen bidrar til at personer med avansert form for kreft kan få tilgang til molekylær kreftdiagnostikk uavhengig av bosted. InPreD bidrar til å identifisere pasienter som er aktuelle for inklusjon i kliniske utprøvninger eller for godkjent persontilpasset behandling. Målet er at det skal være tilgjengelig diagnostikk ved alle universitetssykehus i landet. Helseforetakene gis refusjon for analysen.

Boks 7 Positronemisjonstomografi (PET)
PET er bildediagnostikk som viser hvordan radioaktive legemidler (PET-radiofarmaka) fordeler seg i kroppen. Det utvikles stadig nye PET-radiofarmaka som gjør oss i stand til å avdekke sykdom mer presist og mer spesifikt. Teranostikk er et behandlingskonsept hvor den bildegivende radioaktiviteten ved PET erstattes med en radioaktiv «sprengladning» som medfører celledød. Ett eksempel på PET og tilhørende teranostikk er PET-avbildning med 68Ga-PSMA, som fester seg til PSMA-reseptorer som utrykkes på kreftceller fra prostata, med påfølgende behandling med 177Lu-PSMA hvor 177Lu er en radioaktiv «sprengladning» og medfører celledød til de celler som avbildes ved PET.
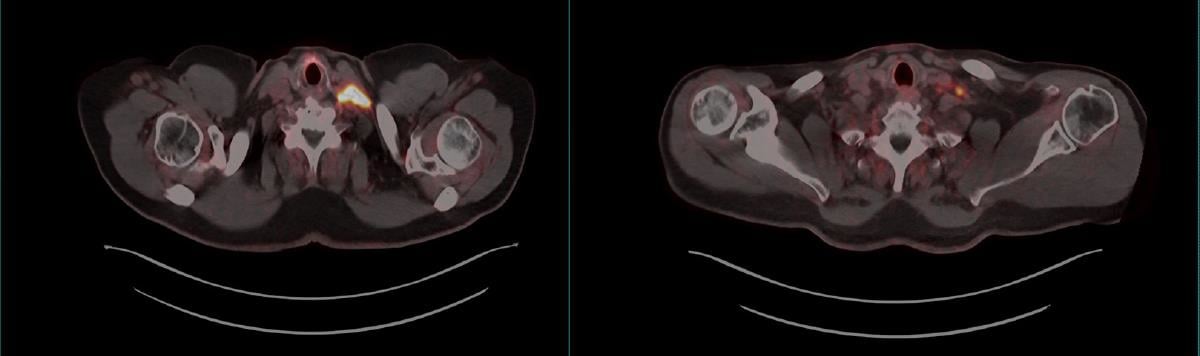
PET-avbildning med 68Ga-PSMA avdekker prostatakreft. Venstre bilde: Lysende område i halsregion hvor 68Ga-PSMA har bundet seg til PSMA-reseptorer på kreftceller fra metastaserende prostatekreft. Høyre bilde: Pasienten har gjennomgått teranostisk behandling (177Lu-PSMA) og ny PET-avbildning viser at tumor er betydelig redusert.
Kilde: Universitetssykehuset Nord-Norge HF
I dag tilgjengeliggjøres nye metoder til diagnostikk og behandling gjennom ulike systemer, avhengig av dokumentasjonsgrunnlaget for metodene og fase i utviklingsløpet. Utprøvende behandling er metoder som ikke har tilstrekkelig dokumentasjon av effekt og sikkerhet til at de kan inngå som en del av det ordinære behandlingstilbudet og skal som hovedregel gis gjennom kliniske studier.27 Legemidler som har markedsføringstillatelse vil kunne innføres i det ordinære tilbudet i spesialisthelsetjenesten etter vurdering i system for Nye metoder.
Kliniske studier og forskning
Pasienter har ingen juridisk rett til utprøvende behandling gjennom en klinisk studie, men har krav på forsvarlig helsehjelp. Integrasjon av klinisk forskning i pasientbehandlingen er et faglig og politisk ønske, jf. Nasjonal handlingsplan for kliniske studier 2021-2025. En slik integrasjon forutsetter blant annet etablering av en kultur i tjenestene der man i økende grad ser på pasientmøter som potensielle kilder til kunnskapsgenerering. Dette perspektivet er særlig relevant for persontilpasset medisin. Dette krever ressurser både i form av personell, utstyr og støttefunksjoner. Det bør legges til rette for tilgang til utstyr og bedre organisering av tverrgående aktivitet i tjenestene. Oppfølging av den nasjonale handlingsplanen for kliniske studier vil bidra til dette.
Innenfor persontilpasset medisin står utvelgelse til kliniske studier og etablerte behandlingstiltak basert på nye diagnostiske metoder sentralt, enten det er basert på genetiske markører, eller storskala helsedata og kunstig intelligens. Det forventes en økning i forskning på mer komplekse biomarkører (inkludert bruk av kunstig intelligens) og ulike former for funksjonell testing, for eksempel testing av immunfunksjon og testing av kreftceller tatt fra en svulst for å vurdere respons på ulike legemidler, som grunnlag for persontilpasset behandling.
Deltakelse i forskning krever informert samtykke. Økt bruk av genetisk informasjon innenfor persontilpasset medisin reiser etiske problemstillinger til hva et samtykke innebærer. Rekkevidden av relevante analyser, som utilsiktede funn ved helgenomsekvensering og identifiserbarhet ved kunstig intelligens, stiller store krav til kompetanse både hos den som informerer og den som mottar informasjonen. En nasjonal, helhetlig løsning for digitale samtykker i forskningsprosjekter har som mål å gjøre det enklere for pasienter å inngå og trekke tilbake et samtykke, og å få innsyn i prosjektene de deltar i. For forskeren skal løsningen bidra til en bedre oversikt og enklere administrering av samtykker. Løsningen omfatter både videreutvikling av samtykkeløsningen på helsenorge.no og en harmonisert administrasjonsløsning for forskere. Helse- og omsorgsdepartementet vil bidra til å opprettholde fremdriften i arbeidet i dialog med de regionale helseforetakene, Norsk helsenett SF og Direktoratet for e-helse.
I Nasjonal handlingsplan for kliniske studier omtales behovet for å ruste Norge for fremtidens kliniske studier og persontilpasset medisin. Persontilpasset medisin utfordrer kvalitetsnormene for klinisk forskning, som tradisjonelt har vært basert på randomiserte studier i store pasientpopulasjoner. Økt samhandling nasjonalt og internasjonalt vil derfor være nødvendig for å sikre studier og registerdata av tilstrekkelig størrelse og kvalitet. Utviklingen stiller krav til blant annet dynamisk samtykkehåndtering på tvers av studiesentra, jf. omtale av digital samtykkeløsning over. For å legge til rette for at pasienter kan delta i kliniske studier utenfor Norge, fortrinnsvis Norden og andre europeiske land, vil Helse- og omsorgsdepartementet be de regionale helseforetakene i 2023 om å etablere en felles praksis for inklusjon av pasienter i kliniske studier utenfor Norge.
Det ses en økning i omfanget av såkalte komplekse studier.28 Ved planlegging av slike studier bør Statens Legemiddelverk konsulteres tidlig i prosjektfasen for rådgivning vedrørende regulatorisk strategi og studiedesign. For å øke etatens kapasitet til å gi god og effektiv regulatorisk veiledning og vurdering nasjonalt, vil regjeringen fra 2023 styrke saksbehandlings- og rådgivningskapasiteten i Statens legemiddelverk.
Boks 8 Ekspansjonskohorter i IMPRESS-Norway
IMPRESS-Norway tilbyr personer med kreft med spredning uten etablerte behandlingsalternativer, utprøvende behandling basert på molekylære forandringer i kreftsvulstene. De regionale helseforetakene besluttet i 2022 å overta deler av finansieringsansvaret for studiemedisinen i studiens ekspansjonskohorter hos personer med stabil sykdom eller som har redusert sykdomsbyrde under pågående behandling. Studien inngår som et sentralt element i de regionale helseforetakenes satsning på persontilpasset medisin.
Virkelighetsdata har flere bruksområder innenfor persontilpasset medisin. Registerbaserte studier som benytter seg av virkelighetsdata fra registre kan være aktuelt i både spesialisthelsetjenesten og den kommunale helse- og omsorgstjenesten. Slike studier brukes blant annet til langtidsoppfølging av effekt og sikkerhet, karakterisering og kvantifisering av sjeldne bivirkninger og unntaksvis for kontekstualisering av behandlingseffekter fra ukontrollerte studier.
Genteknologi og genterapi har økende relevans for flere fagdisipliner og samfunnsområder. Genteknologiutvalget skal drøfte og belyse risikobilder, etiske dilemmaer og veivalg og danne et oppdatert kunnskapsgrunnlag for politikkutforming. Genteknologiutvalget vil levere sin rapport juni 2023. Regjeringen vil vurdere hvordan denne rapporten kan følges opp, blant annet sørge for at anvendelse av regelverket legger godt til rette for flere kliniske studier på området.
Boks 9 Gen- og celleterapi
Enkelte gen- og celleterapier faller inn under persontilpasset behandling og er ventet å øke i omfang. Metodene er fortsatt umodne for innføring som etablert behandlingstilbud, og det er kun et lite antall behandlinger på markedet. Norge har imidlertid gode fagmiljøer på dette området, blant annet er det gjennom Forskningsrådet tildelt 155 mill. kroner til et nytt Senter for fremragende forskning for persontilpasset immunterapi ved Oslo universitetssykehus HF. Det nye senteret skal utvikle celleterapi med mål om å kurere flere former for kreft, og dermed behandle flere pasienter.
Foto: Oslo universitetssykehus HF
Dersom utprøvende, persontilpasset behandling gis utenfor en klinisk studie bør effekten av behandlingen dokumenteres systematisk.29 Videre utvikling av strukturert pasientjournal kan gjøre det lettere å finne personer med samme type medisinske problemstilling, og eventuelt også samme type utprøvende behandling, på tvers av helseforetak. Dette kan igjen bidra til bedre oversikt og legge til rette for kunnskapsgenerering for utprøvende behandling gitt utenfor kliniske studier.
Et punkt i Handlingsplanen for forskning og innovasjon innenfor persontilpasset medisin var krav om at søknader om forskningsfinansiering av kliniske studier skulle inkludere og redegjøre for bruk av eksplorative markører for stratifisering og persontilpasning.30 Dette bidrar til implementering av persontilpasset medisin og bør videreføres i utlysninger fra sentrale aktører som Forskningsrådet og de regionale helseforetakene. Et bredere markørbegrep som også inkluderer maskinlæring og kunstig intelligens bør legges til grunn der det er relevant.
Persontilpasset medisin stiller økte krav til samarbeid mellom helsetjenesten og helsenæringen, særlig knyttet til legemiddelutvikling og kliniske studier. Innenfor radiologi, er utstyrsleverandører drivere for utvikling av billedanalyse gjennom kunstig intelligens, og i laboratoriefagene er metodeutvikling og innovasjon sentralt. Fleksible rammer som både kan stimulere til et samarbeid, og samtidig legge føringer for finansiering, datasikkerhet og interessekonflikter vil hjelpe aktørene. På kreftfeltet er Norge ledende på offentlig-privat samarbeid, noe som kan fungere som inspirasjon for andre fagområder.31 Et forpliktende partnerskap mellom helsenæringen og spesialisthelsetjenesten, NorTrials, skal bidra til at flere industrifinansierte kliniske studier legges til Norge.
Regjeringen prioriterer forskning og innovasjon på persontilpasset medisin i ny Langtidsplan for forskning og høyere utdanning (2023–2032). For å bidra til en optimal utnyttelse av ressursene på feltet forutsettes det at aktørene som lyser ut forskningsmidler vurderer ytterligere samarbeid om satsinger på forskning og innovasjon på feltet. Utlysningene bør koordineres mot lignende satsninger internasjonalt, særlig inn mot Horisont Europa som i større grad enn tidligere forventer et samarbeid med blant annet næringsliv, akademia, tjenesten og innbyggere.
Etablert behandling og system for Nye metoder
Nye behandlingsmetoder med tilstrekkelig dokumentert effekt og sikkerhet kan tilbys i spesialisthelsetjenesten etter behandling i system for nye metoder (Nye metoder).32 Systemet skal sikre pasienter i spesialisthelsetjenesten likeverdig tilgang på nye metoder som er trygge, av god kvalitet og kostnadseffektive. Nye metoder må videreutvikles for å kunne håndtere et økende omfang av metoder som er relevante for persontilpasset medisin, inkludert økt grad av kompleksitet i analyser og vurderinger knyttet til små studiepopulasjoner.
En tilnærming har vært å håndtere usikkerheten ved at et legemiddel innføres midlertidig i påvente av ny forskningsbasert kunnskap. I en rapport fra de regionale helseforetakene beskrives utfordingsbildet og det foreslås tiltak for å styrke rammene for midlertidig innføring og revurdering gjennom Nye metoder.33De regionale helseforetakene innførte i juni 2020 et rammeverk for alternative prisavtaler34 med helsenæringen som kan brukes etter bestemte kriterier til å innføre metodene midlertidig. Med resultatbaserte avtaler er det for eksempel mulig å stille krav om at antagelser om effekt som lå til grunn for innføring, skal etterprøves eller revurderes på et senere tidspunkt. Resultatbaserte avtaler kan bidra til å håndtere utfordringene ved å vurdere effekten av legemiddelet også i et helseøkonomisk perspektiv. Nye metoder har tatt i bruk slike avtaler i flere saker. For å bidra til en overgang mellom identifiserte kunnskapsbehov i Nye metoder og oppstart av kliniske behandlingsstudier, er det etablert en kobling til Nasjonalt program for klinisk behandlingsforskning i spesialisthelsetjenesten, KLINBEFORSK.
Som oppfølging av evalueringen av Nye metoder skal de regionale helseforetakene utarbeide et strategidokument for videreutviklingen av systemet.35 De regionale helseforetakene skal blant annet skissere fremtidige utfordringer og tiltak for å tilrettelegge for bedre håndtering av persontilpasset medisin i systemet.
Innen persontilpasset medisin knyttes ofte diagnostiske tester og utstyr til målrettet behandling i form av «companion diagnostics». Det er Folkehelseinstituttet som på bestilling fra Bestillerforum i Nye metoder gjennomfører metodevurderinger av diagnostiske tester. Samtidig har Statens legemiddelverk ansvar for å metodevurdere de tilhørende legemidlene. Som ledd i utviklingsarbeidet i Nye metoder utreder Folkehelseinstituttet ulike tilnærmingsmåter og viktige veivalg for utforming og gjennomføring av metodevurderinger av denne type diagnostiske tester på kreftområdet.
Det forventes et stort antall markedsførte produkter innen persontilpasset medisin i årene fremover, noe som utfordrer kapasiteten hos metodevurderingsinstansene. Det arbeides derfor med effektivisering og videreutvikling av metodevurderingsarbeidet i Statens Legemiddelverk og Folkehelseinstituttet. Regjeringen vil fra 2023 styrke kapasitet, kompetanse og internasjonalt samarbeid om metodevurderinger i etatene.
Boks 10 Europeisk regelverk om metodevurderinger
EU vedtok i desember 2021 et nytt regelverk om medisinske metodevurderinger (Health Technology Assessments – HTA).36 Det tas sikte på at det skal få anvendelse i Norge fra januar 2025, samtidig som i EU. Regelverket omfatter legemidler med nye virkestoffer eller innenfor nye terapiområder som får markedsføringstillatelse gjennom den sentrale godkjenningsprosedyren for legemidler, samt visse typer medisinsk utstyr med høy risiko. Regelverket legger opp til felleseuropeiske vurderinger av relativ klinisk effekt. I tillegg etablerer regelverket grunnlaget for frivillige samarbeid mellom medlemslandene om vitenskapelig rådgivning hvor utviklere av legemidler eller medisinsk utstyr kan søke råd fra HTA-myndigheter med hensyn til krav til dokumentasjon og data og identifisering av ny teknologi slik at disse på et tidlig stadium kan inkluderes i det felles samarbeidet.
For å bidra til likeverdig tilgang til metoder som er under vurdering, har regjeringen gitt i oppdrag til de regionale helseforetakene å gjennomgå unntaksordningen i Nye metoder.37 Gjennomgangen skal også vurdere grenseflaten mellom unntaksordningen og ordninger for tilgang til utprøvende behandling.
I Nye metoder foretas det prioriteringer som setter rammene for hvilke metoder klinikerne har til rådighet for pasienter som er vurdert å ha rett til nødvendig helsehjelp. Systemet gjør ikke konkrete vurderinger av sykdomstilstanden til enkeltpersoner, noe som kan være relevant for persontilpasset medisin. Helse- og omsorgsdepartementet vil revidere rundskriv I-4-2019 om «Rett til nødvendig helsehjelp fra spesialisthelsetjenesten og forholdet til forsvarlighetskravet mm.» med sikte på å bidra til større klarhet og sikre enhetlig forståelse og praktisering av regelverket og persontilpasset medisin må også vurderes i dette arbeidet.38
Flere enkeltsaker innenfor persontilpasset medisin har illustrert at vi trenger en god og åpen dialog om prioriteringsutfordringene knyttet til innføringen av relevante metoder. Regjeringen vil legge frem en ny prioriteringsmelding som blant annet vurderer persontilpasset medisin og sikrer åpenhet og etterprøvbarhet rundt prioriteringer i helsetjenesten.
Diagnostikk i den kommunale helse- og omsorgstjenesten
Allmennlegetjenestene i kommunene har ofte inngående kjennskap til enkeltpersoners sykdomshistorikk og familiære forhold, og fastlegene har alltid tilbudt medisinske tiltak tilpasset individet. Persontilpasset medisin kan imidlertid gi fastlegene nye verktøy og tester til bruk i dette arbeidet. Fastlegene har også viktige roller knyttet til likeverdig henvisning og oppfølging av personer som mottar persontilpasset medisin i rammen av spesialisthelsetjenesten.
Nye verktøy og tester utfordrer kapasitet og kompetanse i den kommunale helse- og omsorgstjenesten. Effektivt samarbeid med spesialisthelsetjenesten kan bidra til å løse dette, for eksempel gjennom videre utvikling av såkalt «refleks-testing», der laboratorier i spesialisthelsetjenesten selv utfører utvidet, spesialisert diagnostikk (på «refleks») basert på funn i enkle prøver. Prinsippet er ikke nytt, og benyttes for eksempel innenfor infeksjonsmedisin for bestemmelse av antibiotikaresistens. Et annet eksempel er laboratorienes utvelgelse av prøver til genomsekvensering av koronavirus ved positiv PCR-prøve og mistanke om nye varianter. Refleks-testing med tilhørende råd om oppfølging, bør fungere som modell for innføring av spesialdiagnostikk i den kommunale helse- og omsorgstjenesten. Det kan bidra til å unngå unødvendige forsinkelser ved ny prøve og merarbeid i den kommunale helse- og omsorgstjenesten.
Kunstig intelligens basert på informasjon i individets journal, eller som beslutningsstøtte med for eksempel behandlingsforslag basert på prøvesvar eller bilder tatt i den kommunale helse- og omsorgstjenesten, forventes å spille en rolle på sikt. Foreløpig mangler det vitenskapelig evidens for implementering av avansert beslutningsstøtte. Kunstig intelligens og avanserte algoritmer er imidlertid viktige områder for videre forskning.
Boks 11 Forskningssenter for presis diabetesdiagnose
I Bergen er det etablert et forskningssenter for presis diabetesdiagnose (PRESIS-DIA), et samarbeid mellom Universitetet i Bergen og Helse Bergen HF. Målene er å finne nye årsaker til diabetes og mekanismer involvert i sykdomsutviklingen, en bedre klassifikasjon av diabetes, og hvordan presjonsmedisinen kan bedre diagnostikk og behandling. Det er etablert en diagnostikk- og behandlingsenhet for PRESIS-DIA på Haukeland universitetssykehus HF der bruk av digitale plattformer gjør diagnostikk og behandling mulig, uten at pasientene trenger å reise fra sitt hjemsted. Et utstrakt samarbeid med lokale, behandlende leger inngår. Sentralt for forskningsdelen av PRESIS-DIA er tilgang på sykdomsregistre og biobanker.
Farmakogenetikk
Farmakogenetikk er vitenskapen om hvordan genetiske faktorer påvirker effekt og bivirkningsprofil for legemidler. Koordinering og samordning av kompetanse innenfor farmakogenetikk vil gi en mer ensartet implementering og praksis. Slik koordinering av aktører kan gjøres etter modell av eller i regi av det nasjonale kompetansenettverket for persontilpasset medisin, NorPreM.
Farmakogenetisk informasjon er i liten grad tilgjengelig i dagens systemer for rekvirering og utlevering av legemidler. I dag får både rekvirerende lege og utleverende apotek interaksjonsvarsler dersom det rekvireres et legemiddel som påvirker effekten av et annet legemiddel, mens informasjon om genetiske forhold som kan påvirke effekt og bivirkninger må innhentes i det enkelte tilfelle.
Det pågår prosesser som vil bidra til at svar på farmakogenetiske undersøkelser finnes strukturert og tilgjengelig for kunnskaps- og beslutningsstøtte, blant annet gjennom Program digital samhandling (PDS)39. Diakonhjemmet sykehus har i samarbeid med Direktorat for e-helse utarbeidet en løsning for å få lagt inn prøvesvaret i kjernejournal for framtidig bruk.
Løpende oppdatert kunnskap om farmakogenetiske faktorer knyttet til nye og etablerte legemidler må gjøres tilgjengelig for helsepersonell. De europeiske legemiddelmyndighetene etterstreber å inkludere slik informasjon i preparatomtalen der den er tilgjengelig og informasjonen vurderes som relevant og tilstrekkelig vitenskapelig dokumtert.
Boks 12 Farmakogenetikk – fra forskningsfront til fastlegeverktøy
Senter for psykofarmakologi ved Diakonhjemmet sykehus har i løpet av de siste 20 årene utviklet og innført farmakogenetiske analyser for presisjonsdosering av psykofarmaka. Årlig genotypes nå 10 000 prøver ved avdelingen, og antallet øker hvert år.
De genetiske undersøkelsene bidrar til økt treffsikkerhet i valg av legemiddel og dose til den enkelte pasient. Analysesvaret kan gjenbrukes gjennom hele livet og benyttes på tvers av ulike terapiområder. Informasjon fra en analyse utført i dag for persontilpasning av depresjonsbehandling, kan gjenbrukes dersom personen for eksempel får et hjerteinfarkt i framtiden og skal behandles med medikamenter som brytes ned av samme enzymsystem.
Den kliniske implementeringen er utfordrende. Senteret har vektlagt individuell fortolkning av prøvesvar, slik at den kliniske nytteverdien blir så stor som mulig. Samlokalisering av farmakogenetikk og legemiddelanalyser, i et sterkt tverrfaglig miljø med nærhet til de kliniske avdelingene, har vært viktig for å oppnå både forskningsresultater og fagutvikling.
Oppfølging av pasienter
Den kommunale helse- og omsorgstjenesten har en rolle i oppfølging av behandling igangsatt i spesialisthelsetjenesten. Langtidsoppfølging i den kommunale helse- og omsorgstjenesten gir mulighet for datafangst av virkelighetsdata til registre. Løsninger som muliggjør slik datafangst for kunnskapsbygging bør i størst mulig grad automatiseres for å unngå økt rapporteringsbyrde for fastleger og andre aktører i den kommunale helse- og omsorgstjenesten.
Digital hjemmeoppfølging ble omtalt blant annet i Nasjonal helse- og sykehusplan (2020–2023), som hadde det utadvendte sykehus som målbilde. Ved at nødvendig medisinsk utstyr flyttes til pasienten, kan den enkelte pasienten utføre målinger av for eksempel blodtrykk, puls og temperatur hjemme. Denne informasjonen overføres til sykehusets eller de kommunale helse- og omsorgstjenestens systemer, hvor helsepersonell følger opp målingene som gjøres av pasientene. I tillegg til målinger, gir løsningene mulighet til å sende bilder og annen skriftlig kommunikasjon digitalt. Dette er løsninger som delvis er basert på kunstig intelligens. Økt bruk av digital hjemmeoppfølging kan generere store mengder data som kan være nyttige for persontilpasning av helsetjenester, og samtidig bidra til kunnskapsbygging omkring langtidseffekter og bivirkninger av medisinske tiltak.
Nasjonalt samarbeid og tverrfaglighet
Skal målet om en mest mulig likeverdig tilgang til persontilpasset medisin nås, er det behov for samarbeid på tvers av tradisjonelle skillelinjer, for funksjonsdeling mellom eksempelvis større og mindre sykehus, og mellom sektorene. Samarbeid er også sentralt for å få en mest mulig effektiv utnyttelse av kostbar infrastruktur og knapphet på personellressurser. Nye former for tjenesteorganisering og forløpstenkning kan bli aktuelt, og bør følges av forskning.
Tilbud om persontilpasset medisin er basert på tverrfaglighet og teamarbeid. Organiseringen av tverrfaglig samarbeid i helseforetakene bør fortløpende og proaktivt oppdateres, og nye møtearenaer for å diskutere diagnostikk knyttet til persontilpasset medisin bør vurderes. På systemnivå, bør verktøy, løsninger og kompetanse utvikles med mål om å understøtte behov for samarbeid og samhandling på tvers av fagprofesjoner, sektorer og nivåer.
CONNECT-partnerskapet er et eksempel på nye former for multidisiplinær samhandling som finnes på kreftområdet. Innenfor rammen av den nasjonale infrastrukturen for presisjonsdiagnostikk (InPreD) er det også innført et nasjonalt «molekylært multidisiplinært team møte» på tvers av helseforetakene der onkologer, patologer, genetikere og bioinformatikere er representert. Liknende tverrfaglig, nasjonal og offentlig-privat samhandling kan være aktuell for innfasing av persontilpasset medisin på andre fagområder eller i andre deler av tjenesten. Som del av oppfølgingen av strategien bør slike nye samarbeidsmodeller evalueres, og innsikten brukes som grunnlag for hvilke kriterier som bør ligge til grunn for lignende samhandling innenfor nye fag- og terapiområder.
Internasjonalt samarbeid
Internasjonalt samarbeid er sentralt innenfor persontilpasset medisin, både når det gjelder forskning og tjenesteutvikling. Per i dag skjer godkjenning av kliniske studier og markedsføringstillatelser i all hovedsak gjennom et europeisk samarbeid, der Norge deltar via EØS avtalen. Fra 2025 trer også det europeiske samarbeidet for metodevurdering (HTA) i kraft.40
Deltakelse i European Reference Networks (ERN) gir tilgang til kompetanse og bistand til utredning, diagnostisering og behandling av flere tilstander for norske fagmiljøer, inkludert sjeldne, arvelige lidelser. Norge økte sin deltakelse betydelig i siste utlysningsrunde fra EU-kommisjonen, og deltar foreløpig i 17 av de 24 referansenettverkene. Det er et uttalt mål at norske fagmiljøer på sikt bør delta i og være representert i alle de referansenettverkene som er etablert. For å støtte integrasjon av europeiske referansenettverk i nasjonale helsesystemer er det etablert et myndighetssamarbeid i ulike europeiske land (Joint Action). Norge deltar i dette arbeidet under ledelse av Helse Sør-Øst RHF.
Europeisk forskningsfinansiering har et sterkt fokus på persontilpasset medisin gjennom Horisont Europa som omfatter et eget partnerskap for persontilpasset medisin, European Partnership for Personalised Medicine (EP PerMed) og et partnerskap med næringslivet, Innovative Health Initiative (IHI) i EUs rammeprogram for forskning og innovasjon, Horisont Europa. Norge gjør det godt i det europeiske forsknings- og innovasjonssamarbeidet innenfor helse, men det er viktig med fortsatt innsats for å opprettholde og styrke den norske deltakelsen. Slik deltakelse gir tilgang til faglige nettverk og bidrar til at norske pasienter tidlig får tilgang til ny, lovende diagnostikk og behandling.
Tiltak relatert til målområde 1
- Regjeringen vil utrede et mer dynamisk system for vurdering og inkludering av nye sykdommer i nyfødtscreeningen.
- Hovedansvar: Helsedirektoratet
- Saksbehandling og veiledning for kliniske studier innenfor persontilpasset medisin skal videreutvikles.
- Hovedansvar: Statens legemiddelverk
- Søknader om forskningsfinansiering av kliniske studier skal inkludere og redegjøre for bruk av eksplorative markører for stratifisering og persontilpasning.
- Hovedansvar: Forskningsrådet og de regionale helseforetakene
- Helsedirektoratet skal vurdere behovet for anbefalinger knyttet til farmakogenetiske analyser, spesielt for å møte behov i den kommunale helse- og omsorgstjenesten.
- Hovedansvar: Helsedirektoratet
- Arbeidet med metodevurdering, veiledning og internasjonalt samarbeid i Statens legemiddelverk og Folkehelseinstituttet skal effektiviseres og videreutvikles.
- Hovedansvar: Statens Legemiddelverk, Folkehelseinstituttet
- Regjeringen vil legge frem en ny prioriteringsmelding som blant annet vurderer persontilpasset medisin og sikrer åpenhet og etterprøvbarhet rundt prioriteringer i helsetjenesten.
- Hovedansvar: Helse- og omsorgsdepartementet