9 Strategier for folketrygdens fremtidige refusjon av legemiddelutgifter
9.1 INNLEDNING
Helsetjenesten og helsetjenestepolitikken er gjenstand for kontinuerlig debatt. I 1970-årene var «pengene ingen hindring», politikerne ville at terskelen for å oppsøke helsetjenesten skulle være lav. Samfunnet tok seg råd til å dekke folks behov for, og delvis også etterspørsel etter, helsetjenester. Tilgjengeligheten skulle være god og prisene lave. Etter hvert ble det slått fast at det ikke var økonomisk mulig å innfri alle de muligheter den medisinsk-teknologiske utvikling kunne gi, og det ble et hovedspørsmål i den helsepolitiske debatt hvordan en innen alle områder av helsevesenet kunne arbeide effektivt. På den måten ønsket en at det skulle være mulig å sikre at ressursene ble prioritert til områder der behovet var størst. Det kom bl.a. forslag om nivådifferensiering, regionalisering, og at pasienter skulle behandles på laveste effektive omsorgsnivå. Også på legemiddelområdet har det i de senere år vært diskusjon om hvordan ressursene kan brukes så effektivt som mulig. I internasjonal sammenheng er ikke Norge noe høykostnadsland for legemidler, men myndighetene har vært bekymret over at veksten i legemiddelkostnadene som i andre land har vært større enn på andre områder av helsevesenet. I en situasjon med økende ubalanse mellom hva det er mulig å tilby over offentlige budsjetter, og hva pasienter, helsepersonell og legemiddelindustri vil forvente at samfunnet betaler, blir prioriteringsspørsmålet stadig viktigere. Offentlige utgifter på legemiddelområdet må vurderes i relasjon til bruk av ressurser på andre områder av helsevesenet.
I dette kapitlet drøftes aktuelle strategier og virkemidler for hvordan myndighetene kan sikre en best mulig utnyttelse av ressursene til legemidler finansiert av folketrygden. Kapitlet skal gi svar på de problemstillinger som er presentert i tidligere kapitler. I kapittel 7 har utvalget bl.a. pekt på problemet med at en i dag mangler presise prioriteringskriterier og insentiver til å bruke ressurser på en effektiv måte. I kapittel 8 er det vist at disse problemene vil aksentueres i årene fremover. Hvordan utformer man best strategier for styring av fremtidens legemiddelforbruk? Størsteparten av forskrivningen av legemidler i allmennpraksis skjer gjennom blåreseptordningen. Det er derfor viktig å utforme strategier for blåreseptordningen som tar utgangspunkt i de faktorer som bestemmer legenes faktiske forskrivninger. Ved siden av tiltak som påvirker legene, har utvalget særlig lagt vekt på å drøfte hvilke krav som må stilles til den statlige legemiddelforvaltning i forbindelse med opptak av nye medisiner på blå resept. Utvalget har ikke sett det som sin oppgave å utarbeide detaljerte lovforslag.
9.2 HOVEDPRINSIPPER FOR UTFORMING AV REFUSJONSORDNINGEN
I Norge er det lagt vekt på at helsetjenesten skal være heldekkende, dvs. at det offentlige skal ha et overordnet ansvar for at hele befolkningen får et faglig godt helsetilbud. Solidaritetstanken står sterkt, og vil fremdeles stå sterkt i det norske samfunn. Det må bety at refusjonsordninger for legemidler bør spille en viktig rolle i fremtidens helsepolitikk, og at refusjon av utgifter til viktige legemidler må være en viktig del av det norske samfunns velferdstilbud. Likhetsprinsippet skal være en grunnpilar i fordelingen av helseressurser, og legemidler skal være en viktig del av et slikt heldekkende helsetilbud.
9.2.1 Legemiddelpolitiske avveininger
Når en skal utvikle mer konkrete mål for refusjonsordningene, må en ta standpunkt til avveininger mellom forskjellige kryssende hensyn. En må vurdere hvordan ordningene virker i forhold til ulike mål og ulike aktører. Utvalget vil spesielt trekke frem følgende hensyn:
Fra brukerens og pasientens synspunkt er det viktig å få effektive medisiner til lavest mulige kostnader, slik at økonomisk evne ikke blir avgjørende for forbruket. Spesielt er dette viktig for pasientgrupper med alvorlige, langvarige lidelser.
Fra et samfunnsøkonomisk synspunkt er det viktig å holde kontroll med veksten i forbruket av fellesskapets ressurser. Veksten i våre petroleumsinntekter vil flate ut, og samfunnet står overfor en stor økonomisk oppgave med å finansiere fremtidens eldrebølge. Dette betyr at alle offentlige utgifter må holdes innenfor stramme rammer. Pasienter med mindre alvorlige lidelser må trolig i økende grad måtte akseptere å betale for medisiner av egne penger.
Fra legenes synspunkt er bruken av legemidler et viktig virkemiddel i behandlingen av mange lidelser. De ser på blåreseptordningen som et lett tilgjengelig redskap, men som er lett å tøye fordi paragrafene i lovverket gjør det mulig med fleksible tolkninger. Størstedelen av pasientens legemiddelregning sendes direkte til en offentlig tredjepart.
Fra distribusjonsleddenes synspunkt er refusjonsordningene viktige fordi de påvirker omsetningsleddenes inntekter, bl.a. på grunnlag av prosentvise marginer og påslag. Grossister og apotek gjør legemidler tilgjengelige for folk, og skal sørge for kvalitet og sikkerhet i leveringen. Distribusjonsleddene må både møte krav om bedriftsøkonomisk lønnsomhet, og bidra til å oppfylle legemiddelpolitiske målsettinger.
Fra den farmasøytiske industris synspunkt påvirker gode refusjonsordninger muligheten for å utvikle nye og ofte mer effektive preparater, som isolert betraktet kan være omkostningsdrivende, fordi de faller dyrere i bruk både for pasient og samfunn. Fra et samfunnsperspektiv vil på lengre sikt enkelte medisiner være viktige for å møte fremtidens store helseproblemer, mens økt bruk av andre medisiner, f.eks. «for-sikkerhets-skyld-medisinering», kan føre friske mennesker inn i en pasientrolle.
Hvordan kan man utforme en mest mulig konsistent refusjonspolitikk som avveier disse hensynene? Det er to ytterpunkter:
Myndighetene kan unnlate å ta i bruk virkemidler for å begrense kostnadsveksten, eller unnlate å prioritere helseressursene i forhold til bestemte mål. Det vil bety at legemiddelutgiftene vil fortsette å stige, og en er ikke garantert at veksten i utgiftene vil gå til de områder der behovet er størst. Siden politikerne må forholde seg til en total budsjettramme for nysatsinger i helsevesenet, må en fortsatt sterk vekst i legemiddelbudsjettet vurderes i forhold til andre viktige satsingsområder, bl.a. innenfor sykehussektoren og psykiatrien.
Samfunnet kan redusere fellesskapets innsats, og overlate en større del av finansieringen til individene selv, ved eksempelvis å heve egenandeler, å behovsprøve støtte ut fra inntekts- og formuesforhold, å være mer tilbakeholden med refusjon av utgifter til beste medisin, å bare yte støtte til billigste preparat, eller definere støtteberettigede sykdomsgrupper smalere enn i dag.
Utvalget mener at det er behov for en helhetlig og langsiktig refusjonspolitikk der en balanserer pasientenes behov for subsidierte medisiner og myndighetenes behov for å holde kostnadene under kontroll. Målet må være at de samlede ressurser brukes så effektivt som mulig i relasjon til de helse- og legemiddelpolitiske målene myndighetene stiller opp. Det er viktig å se de samlede helseressurser under ett, og ha som mål at en skal få best mulig kvalitet og kostnadseffektiv bruk ut av disse ressursene. Noen nye legemidler som vil komme i årene fremover, vil kunne bidra til økt levetid og økt livskvalitet. Andre medisintilbud vil kunne føre til at ressurser tas vekk fra deler av helsetjenesten der de gjør større nytte. Den store utfordringen er derfor å utforme en refusjonspolitikk som gjør det mulig å trekke inn de totale helseøkonomiske forhold når en skal ta stilling til om nye medikamenter skal tas inn eller ut av blåreseptordningen.
9.2.2 Målaspekter ved refusjonsordningene
Når en skal utforme refusjonsordningene mer i detalj er det spesielt viktig at legemidlene må finne sin plass innenfor den samlede helsetjeneste, jf. tidligere kapitler. Bruk av legemidler må vurderes og styres på linje med andre helsetjenester, slik at en får en best mulig utnyttelse av de samlede ressurser. Ideelt sett burde det utvikles nasjonale strategier for hvordan de store helseproblemer bør møtes. Innenfor disse strategiene burde det stilles opp mål for hvilken rolle ulike tiltak, herunder legemiddelbruk, skal spille. Utvalget er kjent med at en slik strategi er under utarbeidelse på kreftområdet. Utvalget vil anbefale at det lages slike strategier også på andre områder.
Legemidler utvikles av en forskningsintensiv internasjonal legemiddelindustri. Når refusjonsordningene skal utformes må en derfor ta hensyn til at måten ordningene er utformet på, utgjør en viktig rammebetingelse for legemiddelindustrien. Avveiningen mellom helse- og næringspolitiske spørsmål har ikke vært en del av utvalgets mandat, og utvalget ser det derfor ikke som sin oppgave å utvikle mer presise mål for den næringsmessige legemiddelpolitikken.
Utvalget mener at det bør gis prioritet til legemidler til bruk mot alvorlige sykdommer, der legemidler har god effekt og er kostnadseffektive. Tilbudet må dimensjoneres til fordel for behandling der intensjonen primært er bekjempelse eller lindring av sykdom, eller forebygging hos høyrisikoindivider. På denne bakgrunn mener utvalget at refusjonsordningen for legemidler skal:
Sikre mest mulig lik og enkel tilgang til effektive legemidler for små og store pasientgrupper med dokumenterte behov for medikamentell behandling
Gi samfunnet verdier for pengene, dvs. at fellesskapet skal refundere utgifter til legemidler som gir sikker helsegevinst for pasienten, og har god effekt i forhold til kostnadene. Det er viktig at kostnadsstyringen er god slik at en sikrer best mulig utnyttelse av ressursene
Stimulere til ansvarlig og kostnadsbevisst forskrivning og bruk av legemidler hos lege og pasient
Medvirke til at individer med moderat og lav risiko for fremtidig sykdom, og hvor behandlingseffekten på individnivå er liten og/eller usikker, tar et størst mulig eget ansvar for helsen sin. Det offentlige har først og fremst forpliktelser overfor pasienter med alvorlig sykdom eller høy risiko for sykdom, hvor det finnes effektive legemidler.
Så langt mulig reflektere kunnskaper om gevinster og kostnader ved bruk av legemidler, basert på helseøkonomiske undersøkelser.
Være enkel å administrere og forstå for legemiddelpolitikkens ulike aktører
Gi myndighetene anledning til å fjerne medikamenter hvor det dokumenteres at nytten ikke står i forhold til kostnadene
Utvalgets medlem, Skancke, kan ikke uten videre slutte seg til første strekpunkt ovenfor. Dette er nærmere begrunnet i egen merknad til utvalgets forslag 6, kapittel 9.8.
9.2.3 Styringsprinsipper
Hvordan realiserer en best disse intensjonene? For å få det til må myndighetene være bevisst i utformingen av de mange spillereglene som bestemmer tilpasningen til de forskjellige aktørene i det legemiddelpolitiske spillet som tidligere er beskrevet bl.a. i kapittel 3 og 7. Gjennom styringssystemer skal man både sikre nødvendig kontroll og gi insentiver slik at beslutningstakerne tar hensyn både til kostnader og nytte ved alternative anvendelser av ressuser. På alle samfunnsområder er det en omfattende debatt om hvilke styringsordninger en skal bruke. Grovt sett kan en skille mellom tre hovedtyper av styringsmidler:
De offentlig institusjonelle styringsmidler
De markedsøkonomiske styringsmidler
De profesjonell-verdibaserte styringsmidler
På legemiddelområdet bruker en i dag en kombinasjon av alle disse tre virkemidlene.
Institusjonell styring
Det er bygget opp et omfattende offentlig hierarkisk system som gjennom lover og forskrifter regulerer hvilke rettigheter pasientene har, og hvilke plikter offentlige myndigheter og profesjonene har. De viktigste aktørene i den hierarkiske organisasjonen er Stortinget, regjeringen, Sosial- og helsedepartementet, Rikstrygdeverket, Statens legemiddelkontroll og Statens helsetilsyn. Stortinget har det overordnede ansvaret, men har også tatt enkeltbeslutninger på dette området, f.eks. gjennom å vedta 100 millioner kroner til subsidiering av migrenemidlet Imigran, og sosialkomiteen har i sin innstilling om den såkalte Helsemeldingen (Innst. S. nr. 165 (1994-95)) vedtatt følgende forslag:
«Stortinget ber regjeringen medvirke til at relevant medisin med effekt mot benskjørhet blir tilvist på blå resept.»
I forbindelse med budsjettbehandlingen for 1997 ble følgende vedtatt:
«Stortinget ber Regjeringen fra 1. april 1997 oppta følgende nye legemidler mot osteoporose på blå resept: Fosamax og Didronate.»
Utvalget har i kapittel 7 pekt på enkelte svakheter og uklare grenser i dagens forvaltningsapparat på refusjonsområdet. Et viktig styringsmiddel i den fremtidige refusjonspolitikk må være å etablere en mer profesjonell statlig organisasjon som med basis i definerte og eksplisitte prioriteringskriterier kan styre ressursbruken på legemiddelområdet.
Styring gjennom økonomisk evaluering av legemidler
Økonomisk evaluering av legemidler er en viktig styringsmetode, jf. kapittel 4. Økonomisk evaluering av helsetiltak er basert på ulike metoder som er under utvikling. Fagområdet er relativt nytt i Norge. Det består imidlertid av viktige verktøy som kan brukes på ulike områder, også i tilknytning til refusjonsspørsmål, når en produsent søker Rikstrygdeverket om at et nytt legemiddel skal kunne forskrives på blå resept. I den situasjonen kan legemiddeløkonomiske undersøkelser gi et delgrunnlag for å bestemme:
Om et produkt skal refunderes eller ikke
Hvilke pasientgrupper som skal få refundert utgiftene
Hvilke leger som skal kunne forskrive bestemte legemidler på blå resept
Hvilke refusjonspriser legemidlene skal ha
Legemiddeløkonomi kan også brukes dersom det er aktuelt å fjerne et legemiddel fra blåreseptlisten, eller stramme inn forskrivningsvilkårene. Å basere «refusjonsprisen» i sterkere grad på helseøkonomiske betraktninger gjør det mulig å fastsette priser som reflekterer den samfunnsmessige nytte og de samfunnsmessige kostnader ved legemidlet. Men en økonomisk analyse kan aldri alene bestemme den optimale pris på et legemiddel. Den kan derimot gi et godt utgangspunkt for å anslå om medisinske gevinster står i et rimelig forhold til prisen. Økt bruk av økonomisk evaluering kan være et viktig virkemiddel for å redusere tilfeldigheter, effekten av lobbyisme og at ressurser brukes på områder hvor nytten er liten i forhold til kostnadene.
Australia er trolig det landet som har gått lengst på dette området. Det australske helsedepartementet har iverksatt en omfattende og komplisert ordning med krav om økonomisk evaluering av legemidler. Refusjonsberettigelse og pris for nye legemidler avhenger av resultatet av disse evalueringene. Hver refusjonssøknad er vedlagt en omfattende dokumentasjon inklusive en australsk økonomisk analyse. Søknadene blir etter innstilling fra departementet behandlet i to ulike komiteer (Pharmaceutical Benefit Advisory Committee (PBAC) og The Economics Sub-Committee of the PBAC). Den første komiteen fatter bindende vedtak som i praksis ikke overprøves av departementet eller regjeringen. Departementet alene bruker ca. 4 årsverk pr. år i saksforberedelse. I tillegg gjøres en betydelig arbeidsinnsats i The Economics Sub-Committee som skal ha minst tre medlemmer med helseøkonomisk kompetanse.
Markedsøkonomisk styring
Fordelen med offentlig institusjonell styring er at man sikrer politisk kontroll. På den annen side er det en svakhet ved denne kontrollen at den ikke representerer noen positive insentiver til å bruke ressurser på en effektiv måte ute i helsevesenet. Tankegangen med markedsøkonomiske styringsmidler er å styre aktører mer bevisst gjennom økonomiske insitamenter. På flere og flere områder brukes det økonomiske insentiver for å påvirke aktørene, også i helsepolitikken. Økonomiske virkemidler forutsettes å virke ved at aktørene har egeninteresse av å opptre på en måte som er fordelaktig for dem selv. Det er en omfattende debatt om hvor langt en kan gå i å bruke markedsinsentiver i helsevesenet, men som beskrevet i kapittel 8 er det også på legemiddelområdet et økende press for å fremme rasjonell ressursbruk og holde utgiftene under kontroll. Det er derfor et viktig legemiddelpolitisk spørsmål hvor langt en kan gå i å bruke økonomiske insitamenter for å styre legemiddelpolitikkens aktører. Blant annet er det spørsmål om en kan bruke egenandeler og terapeutiske referanseprissystemer, dvs. at det ytes et fast refusjonstilskudd til alle legemidler innen en terapeutisk gruppe, uansett pris på det enkelte legemiddel.
Profesjonell, verdibasert styring
Gjennom den profesjonell-verdibaserte styringen styrer en gjennom faglige kollegiale nettverk. På et område som helsetjenesten må det alltid være en sterk kollegial nettverksstyring fordi tjenestene tilbys av en av samfunnets mest spesialiserte yrkesgrupper, nemlig legene. Professor i helseadministrasjon Ole Berg uttrykker dette slik (Berg 1995):
«Både byråkratiske og markedsbaserte styringsmåter ovenfra og nedenfra har betydelige svakheter i denne sektoren. Byråkratiet forstår ikke denne profesjonen. Markedet, pasientene, gjør det heller ikke. Begge er faglig ukyndige og den helsemessige produksjon har et semilukket preg. Bare leger, om noen, kan kontrollere leger. Medisinen forplikter seg til kollegial styring, til pasientenes og samfunnets beste. Samtidig ligger det en uuttalt konflikt i bunnen. Profesjonen vet at dersom den ikke holder seg etisk til den smale sti, og holder seg faglig langt fremme, går det ikke lang tid før tilliten er tapt, og da går det galt.»
Ikke minst på legemiddelområdet er det således viktig å bevisst påvirke legene til å være rasjonelle i sin forskrivning. Legene må balansere mellom pasientenes øyeblikkelige behov, hensynet til samfunnets ressurser, og ha en kritisk tilnærming til legemiddelindustriens markedsføring.
9.3 KRITERIER FOR AT LEGEMIDLER SKAL KOMME PÅ BLÅ RESEPT
Det kommer stadig nye legemidler på markedet som både legemiddelindustrien, helsepersonellet og pasientene ønsker at helsevesenet skal ta i bruk. Den demografiske utvikling fører bl.a. til økt andel eldre. Helsevesenet får mer krevende kunder som stiller større krav til helsetjenestens ulike tilbud. Det skjer en dynamisk medisinsk-teknologisk utvikling med utvikling av nye diagnostiske og terapeutiske metoder, og tilbud av nye legemidler. Tilbudene er ofte meget kostbare, fordi enhetsprisen kan være svært høy, og/eller fordi målgruppen kan være stor. Helsevesenet vil derfor stå overfor stadig flere vanskelige valg vedrørende hvilke medisiner og teknologier som skal tas i bruk. Til nå har det i liten grad vært nedfelt eksplisitte prioriteringsprinsipper for hvordan myndighetene skal vurdere om et legemiddel skal finansieres av det offentlige eller ikke, med unntak av kravet om at det skal dreie seg om langvarig sykdom.
Hvordan ressurser bør prioriteres, er i stor grad et normativt spørsmål. Oppfatninger vil avhenge av hvilket sett av normer og hvilket verdigrunnlag som den enkelte bygger på. Likevel hører en ofte utsagn om optimal prioritering uten at forslagsstilleren bekjentgjør sitt verdigrunnlag. Det overordnede mål for prioritering i det norske helsevesenet er likhet. I henhold til St. meld. nr. 50 (1993-94) Samarbeid og styring, bør tilbudet være like tilgjengelig, relevant og faglig godt for alle uavhengig av kjønn, seksuell legning, etnisk bakgrunn, religiøs tilknytning, sosial status eller bosted. Et prioriteringssystem hvor myndigheter og politikere tar utgangspunkt i spesielle karakteristika ved pasientgruppen som alder, kjønn eller en spesiell diagnose etc. bryter mot dette likhetsprinsippet. Skal målet om likhet ivaretas er det behov for mer overordnede prioriteringskriterier som er uavhengige av hvem pasientene er. Hvilke kriterier bør norske myndigheter legge vekt på når legemiddelressursene skal fordeles? I mange land har det gradvis vokst frem en forståelse for betydningen av å ha prinsipper for å prioritere. Disse prinsippene formuleres i en viss grad forskjellig i ulike land, men de preges først og fremst av en betydelig overlapping, jf. kapittel 5. Utvalget vil spesielt trekke frem det arbeid som er gjort i Nederland, med utviklingen av en prioriteringsil (Dunning-silen) med fire filtre som brukes til å vurdere hvorvidt forskjellige diagnose-behandling-kombinasjoner skal finansieres av det offentlige. Dunning-silen er ikke utviklet spesielt med henblikk på legemidler. Den kan imidlertid tenkes å ha en funksjon i refusjonsspørsmål, særlig som pedagogisk prinsipp. Utvalget foreslår at en erstatter Dunning-utvalgets prioriteringsprinsipper med «norske» prioriteringsprinsipper, dvs. stiller krav om tilstandens alvorlighet, legemidlets effekt, legemidlets kostnadseffektivitetog behandlingsintensjonen. En slik prioriteringssil innebærer at man tester relevante diagnose-legemiddel-kombinasjoner mot disse fire vilkårene.
9.3.1 Alvorlighet og effekt
Hvordan skal en definere alvorlighetskriteriet i en norsk prioriteringssil? Et utgangspunkt kan være St. meld. 50 (1993-94) Samarbeid og styring. Her fremholdes det at alvorlighet i det minste rommer tre dimensjoner, hvorav den første er knyttet til pasientens fremtidige tilstand, og de to siste er knyttet til pasientens tilstand i dag. Alvorlighet må vurderes ut fra: (1) Risiko for død, invaliditet eller store plager ved manglende behandling eller hvis behandling utsettes, (2) grad av psykiske og fysiske plager, f.eks. angst, smerte, og (3) grad av fysisk, psykisk og sosial funksjonshemming, uttrykt i evnen til å klare seg i dagliglivet. For eksempel vil bekymring, angst eller depresjon som i vesentlig grad går utover livskvaliteten, kunne gi sosial og psykisk funksjonshemming.
Alvorlighet bestemmes på forskjellige nivåer i forskjellige situasjoner:
| Helsepolitisk (Makronivå) | Sykdommen er i seg selv alltid alvorlig, f.eks. AIDS |
| I en pasientgruppe (Mesonivå) | Medisinske forhold som differensierer mellom de alvorlig og mindre alvorlig syke, f.eks. alvorlige og lette depresjoner, kraftig forhøyet og lett forhøyet blodtrykk osv. |
| Hos den enkelte pasient (Mikronivå) | Individuelle forhold ved pasienten som gjør at sykdommen er alvorlig for ham eller henne, f.eks. andre sykdommer, alder, sosiale forhold |
Bedre dokumentasjon av faktiske helsegevinster
Kravet til dokumentasjon av behandlingseffekt er med rette blitt skjerpet gjennom årene. Det er i dag liten faglig uenighet om at en bør kreve dokumentasjon mht. effekt både på livskvalitet (herunder plager og symptomer) og på levealder der dette er aktuelt. Det er ikke tilfredsstillende hvis det bare finnes dokumentasjon på såkalte myke endepunkter (surrogatendepunkter) som: blodtrykk, kolesterol, bentetthet, etc. I helseøkonomiske analyser er det nødvendig at nytten av helsetiltak beskrives i form av faktiske helsegevinster, som leveår vunnet, unngåtte beinbrudd osv. Legemiddeløkonomiske studier basert på myke endepunkter, hvor sammenhengen med den faktiske helsegevinst ikke er grundig dokumentert, må tolkes med varsomhet. En del medikamenter som for lenge siden ble registret og til dels satt på blåreseptlisten, mangler fullgod dokumentasjon etter dagens kvalitetskrav.
I mange land er det et systematisk arbeid med sikte på å utvikle mest mulig helhetlige systemer for nyttevurdering av medisinsk praksis. Det er bl.a. i løpet av de siste 10-15 årene etablert sentre som kan initiere, kvalitetssikre og implementere medisinske teknologivurderinger. Fordi evaluering av medisinske forskningsresultater kan utføres i internasjonal regi og for å unngå dobbeltarbeid, har man til en viss grad forsøkt å oppfordre til internasjonal koordinering. Mest kjent er det internasjonale Cochrane-samarbeidet hvor forskere, klinikere og brukere over hele verden har gått sammen om å lage en database med systematiske oversikter over effekt av alle typer intervensjoner som brukes i helsetjenesten. Det er en stor utfordring, som det ikke har vært mulig for oss å utrede, hvordan en mer konkret bør utvikle en mer «evidence-based medicine». Utvalget regner med at forslaget om å lage et helhetlig system for kontinuerlig vurdering av medisinsk teknologi i Norge, bl.a. i form av et nasjonalt senter med et overordnet ansvar (Rapport fra arbeidsgruppe oppnevnt av Sosial- og helsedepartementet, avgitt 28. juni 1996), vil danne et viktig grunnlag for hvordan en bør gå videre på dette området.
Men også effekt må bedømmes på ulike nivåer, jf. figur 9.1. Det er forskjell på effekt på en standardisert pasientgruppe og effekt på enkeltindivider. Det er forskjell på beregnet og faktisk oppnådd helseeffekt. Statistisk beregnet medisinsk nytte må kontinuerlig følges opp med registrering av den faktiske nytte for pasientene, som skjematisk illustrert på figuren under. På engelsk har man ulike ord for «effekt»: «efficacy», «effectiveness» og «efficiency». Ettersom vi på norsk bare bruker ett ord (effekt), er det ekstra viktig at vi er enige i innholdet i begrepene.
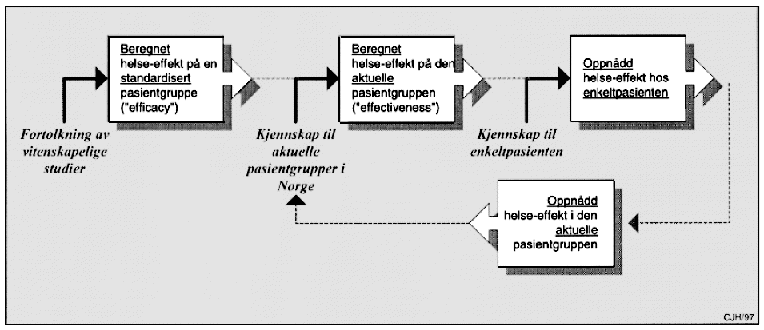
Figur 9.1 Effekt på ulike nivåer
Forholdet mellom alvorlighet og effekt
Ovenfor er det forklart hvordan legemidler som er aktuelle for offentlig refusjon kan vurderes ut fra hvordan de scorer på fire overordnede prioriteringskriterier. Ofte trekkes alvorlighet og effekt frem som de viktigste av disse. Hvilken sammenheng bør det være mellom disse to kriteriene når det gjelder prioritering? Er det nødvendig at bare ett av disse kriteriene er oppfylt, eller bør begge være det? Hvilke konsekvenser bør dette ha for utformingen av blåreseptordningen? Utvalget gir her en prinsipiell drøfting av denne problemstillingen.
Hver for seg er kriteriene alvorlighet og effekt nødvendige, men ikke tilstrekkelige, for at en helsetjeneste eller et legemiddel skal prioriteres høyt. At en tilstand er alvorlig, betyr ikke at samfunnet uten videre bør bruke ressurser på ethvert tiltak som kan settes inn. For at et tiltak skal gis høy prioritet må det i tillegg ha god effekt. Tiltak uten effekt reduserer ikke alvorligheten ved tilstanden, og gir ikke pasienten den ønskede, og kanskje forespeilede, forbedring i livskvalitet. Ineffektive tiltak har også konsekvenser for andre enn den gruppen de er rettet mot. Pasienter med andre alvorlige sykdommer vil ikke få den behandling de trenger dersom ressursene er bundet opp på andre områder.
Tilsvarende er det ikke tilstrekkelig å vurdere ønskeligheten av at et legemiddel skal refunderes utelukkende på bakgrunn av dets effekt. Med andre ord kan et medikament ha god effekt, uten at det nødvendigvis bør prioriteres høyt. Dette kan begrunnes med at samfunnet har et spesielt ansvar for dem med mest alvorlig sykdom. Noen sykdommer/tilstander er mindre alvorlige enn andre. Innenfor en begrenset ressursramme kan en- hver ressursbruk på disse, uansett hvor god effekten er, bety at en trekker ressurser vekk fra dem med mer alvorlig sykdom.
Figur 9.2 viser ytterpunktene i forholdet mellom alvorlighet og effekt. I virkeligheten vil en ikke alltid kunne klassifisere legemidler etter en slik tabell. For eksempel vil en ofte ha usikker kunnskap om hvor effektivt et legemiddel er. En sykdoms alvorlighet vil også kunne variere. Tabellen viser imidlertid prinsippet om at alvorlighet og effekt, hver for seg er nødvendige, men ikke tilstrekkelige, kriterier i refusjonsspørsmål.
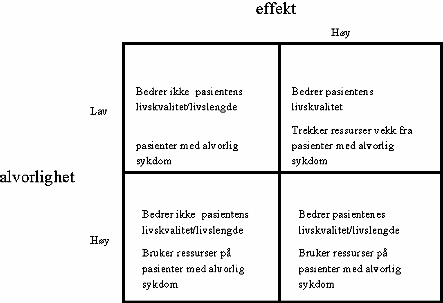
Figur 9.2 Ytterpunkter i forholdet mellom alvorlighet og effekt
I prinsippet er det mulig å tenke seg en refusjonsordning basert på en liste med legemidler, oppført ved generisk navn (dvs. navnet på den kjemiske substansen, og ikke merkenavnet), men uten at en stiller eksplisitte krav til sykdommens alvorlighetsgrad. I en slik situasjon vil det ofte være vanskelig å sette krav om at legemidlet har høy effekt, fordi dette betinges av hvilken sykdom det brukes på. Et slikt prinsipp vil kunne gi forbruk av legemidler i alle kategoriene (rutene) i figur 9.2. Men er et slikt forbruk ønskelig? Bruk av offentlige ressurser på legemidler med lav effekt på tilstander av lav alvorlighetsgrad (som i rute A) vil i liten grad bedre pasientenes livskvalitet eller livslengde, samtidig som det trekker ressurser vekk fra pasienter med mer alvorlig sykdom. Dersom offentlige ressurser brukes på legemidler med høy effekt, men mot tilstander med lav alvorlighetsgrad (som i rute B) vil det bedre pasientens livskvalitet, men trekke ressurser vekk fra pasienter med alvorlig sykdom. Og endelig, dersom en bruker offentlige ressurser på legemidler med lav effekt på sykdommer av høy alvorlighetsgrad, oppnår man ikke hensikten med behandling, å bedre livskvalitet eller livslengden for pasienten. På den annen side kan det argumenteres for en slik medikamentbasert refusjonsliste ut fra at ingen pasienter vil falle utenfor som følge av at de ikke oppfyller kravene til alvorlighet eller ikke har den aktuelle diagnose. En vil dermed unngå tolkninger og fristelsen til tøying av regelverket i forhold til intensjonene.
En kunne også, i hvert fall i teorien, tenke seg en refusjonsordning basert på en liste av mer eller mindre alvorlige sykdommer som samfunnet ønsket å prioritere, f.eks. benskjørhet, psykiske lidelser, kreft, neonatal omsorg etc. Men uten at en stilte eksplisitte krav til de aktuelle legemidlenes effekt ville dette kunne gi forbruk både i kategori C og D i figur 9.2. For eksempel ville det offentlige kunne finansiere legemidler med lav effekt til bruk mot tilstander av høy alvorlighetsgrad. En ville da bruke ressursene på pasienter med alvorlig sykdom, men uten av disse fikk sin livskvalitet eller livslengde forbedret. Også dette representerer en form for sløsing, da andre pasienter med alvorlig sykdom i stedet kunne fått effektiv behandling.
9.3.2 Kostnadseffektivitet
Et legemiddels kostnadseffektivitet avhenger av hvorvidt det kan avhjelpe et helseproblem på en mindre kostnadskrevende måte enn andre tiltak. Hvorvidt et legemiddel er kostnadseffektivt er i stor grad et normativt spørsmål, men eksplisitte analyser og vurderinger av kostnader og medisinske konsekvenser kan klargjøre premissene for refusjon.
Hovedbetingelsen for å få en effektiv ressursbruk er at det foreligger best mulig data både om nytte og kostnader ved ulike helsetjenester. Både når statlige myndigheter skal ta standpunkt til om nye medisiner skal komme inn på eller fjernes fra blåreseptlisten, og i en viss grad også når legene skal treffe beslutninger om behandling av den enkelte pasient, trenger de helseøkonomiske data. Det er spesielt viktig å legge forholdene til rette for at det utvikles produsentuavhengig informasjon om medisinske nyttevirkninger slik det er beskrevet ovenfor og i kapitlene 5 og 6.
Medisin og helseøkonomi
Helsevesenet er i dag i liten grad organisert med sikte på at medisinske beslutninger skal være basert på kostnads-nytte-analyser, jf. kapittel 4. Spesialkompetansen om et legemiddels medisinske nytte finnes i dag først og fremst hos de leger som har ansvaret for å treffe de kliniske beslutninger angående forskrivning til enkeltpasienter, og hos legemiddelindustrien. Legemiddeløkonomiske analyser vil kunne utgjøre viktig produktinformasjon for legene i deres rolle som portvakt til helsetjenestens ressurser. Blant annet kan slike analyser danne grunnlag for legemiddelkomiteenes arbeid i sykehus, og for utarbeidelse av behandlingsveiledninger. Spesielt er det viktig at leger i fremtredende stillinger og med faglige posisjoner har kunnskaper og informasjon om kostnadseffektiviteten ved alternative behandlingsformer på eget fagfelt. Spesialavdelingenes fagpersoner er, eller bør i hvert fall være, trendsettende for primærhelsetjenestens atferd på sine spesialområder. Spesialistene henter sin kunnskap gjennom fagtidsskrifter og deltakelse i nasjonale og internasjonale konferanser, ofte finansiert av legemiddelindustrien. Det foreligger i dag liten oversikt over hvor stor økonomisk innsats legemiddelindustrien bidrar med i det medisinske miljø. Det dreier seg dels om forsknings- og utviklingsmidler og dels om markedsføring. Det er liten tvil om at det beløp industrien satser på informasjon er mangedobbelt av hva samfunnet stiller til disposisjon til produsentuavhengig informasjon og etterutdanning. Det må derfor være en viktig oppgave for samfunnet å trappe opp sitt ansvar med å fremskaffe produsentuavhengige opplysninger om de enkelte legemidlenes kostnader og nytte med sikte på at denne informasjonen kan brukes i legenes kliniske hverdag.
Innsamling av medisinske grunnlagsdata til legemiddeløkonomiske analyser
Den store utfordringen ved bruk av data i legemiddeløkonomiske analyser er hvordan grunnlagsdataene om kostnader og effekt skal innhentes. En mulighet er å utføre datainnsamlingene retrospektivt på grunnlag av en enkelt kontrollert klinisk utprøving, eller ved hjelp av metaanalyser av et antall slike studier. Ofte anses det imidlertid som hensiktsmessig å utføre datainnsamlingen prospektivt, dvs. parallelt med de kontrollerte kliniske utprøvingene. Datainnsamlingen starter gjerne i fase tre av de kliniske utprøvingene. Verken retrospektive eller prospektive studier i fase tre er uproblematiske når det gjelder innsamling av data til legemiddeløkonomiske analyser. Det kan knytte seg problemer til at kliniske studier ikke alltid er representative for senere klinisk praksis ellers i helsevesenet, av og til kort oppfølgingstid og for små populasjoner. Et annet problem kan være at man i enkelte kliniske studier sammenligner et nytt legemiddel med placebo. Dette gir begrenset informasjon om effekten av et nytt legemiddel i forhold til alternative behandlingsformer. Enkelte av problemene kan reduseres dersom det legges større vekt på utforming og tilpasning av de kliniske utprøvingene, datainnsamlingen og tolkningen av resultatene. Problemene må imidlertid ikke undervurderes. Kvaliteten på legemiddeløkonomiske undersøkelser vil selvsagt aldri være bedre enn kvaliteten på de medisinske grunnlagsdataene.
Retningslinjer for økonomisk evaluering av legemidler
Norske myndigheter bør i langt større grad ta i bruk legemiddeløkonomiske undersøkelser når det skal treffes beslutninger om hvorvidt utgifter til nye legemidler skal refunderes av det offentlige. Vi har i kapittel 7 belyst at den legemiddeløkonomiske enheten ved Statens legemiddelkontroll ikke er trukket godt nok inn i arbeidet rundt beslutninger om opptak eller fjerning av legemidler på blå resept, og at det heller ikke er utarbeidet retningslinjer for hvordan slike studier skal gjøres eller tolkes. I flere og flere land er det utarbeidet slike. Spesielt i Australia og Canada er en kommet langt, jf. vedlegg 2. Det bør også i Norge utarbeides retningslinjer for hvordan legemiddeløkonomiske analyser bør gjennomføres. Rent tentativt bør følgende spørsmål så langt som mulig redegjøres for i en søknad om refusjonsberettigelse for et legemiddel.
Boks 9.1 Hovedelementer i økonomisk evaluering av legemidler
1. Problemstilling og formål
Hvilke spørsmål tar studien opp? Hvem skal undersøkelsen gjennomføres for, og hva skal beslutningstakeren bruke den til? Hvilke pasientgrupper omfattes av undersøkelsen, og hva er den aktuelle indikasjon?
2. Valg av perspektiv
Undersøkelsen bør legge til grunn et samfunnsmessig perspektiv, dvs. at ideelt sett skal alle kostnader og resultater for de ulike aktører i samfunnet registreres. I praksis er dette vanskelig, men det er viktig å gi en detaljert beskrivelse av kostnader og resultater for ulike beslutningstakere (pasienter, helsemyndigheter, leverandører av helsetjenester og refusjonsmyndigheter).
3. Valg av referansealternativ
For å beregne kostnadseffektiviteten ved et nytt legemiddel må det sammenlignes med eksisterende medisinsk praksis, dvs. et referansealternativ som enten kan være et annet legemiddel eller et ikke-medikamentelt alternativ. Dersom referansealternativet er et legemiddel, kan rimeligste, mest brukte eller mest effektive alternativ brukes. Valg av referansealternativ bør begrunnes. I de fleste tilfeller vil det mest brukte alternativ være av størst verdi for helsemyndighetene.
4. Beskrivelse av alternativene
Relevante egenskaper ved de medisinske terapier som undersøkes må beskrives og rapporteres. I den grad det er hensiktsmessig kan man bruke operasjonsanalytiske modeller som beslutningstrær, Markow-kjeder, flytdiagrammer for å modellere alternativenes rolle i sykdomsprosessen.
5. Valg av metode
Rapporten bør ta utgangspunkt i én av følgende metoder: cost-minimisation-metoden, cost-effectiveness-metoden, cost-utility-metoden eller cost-benefit-metoden. Cost-of-illness-metoden kan brukes, men ikke alene. Valg av metode bør begrunnes. For tiden er de to førstnevnte metoder de mest benyttede. De er både de lettest målbare og forståelige, og det er også de som brukes mest både i Canada og Australia.
6. Datainnsamling
Undersøkelsen bør gi en redegjørelse for hvordan de medisinske data er samlet inn, og hvorfor denne metoden er benyttet (prospektivt, retrospektivt, i eller utenfor en vitenskapelig kontrollert klinisk undersøkelse). Det må klart fremgå om data er innsamlet i andre land.
7. Resultater
Undersøkelsen bør vise hvilke resultater som oppnås med det ene alternativet i forhold til det andre. Sammenligning med andre studier må gjøres med forsiktighet.
8. Kostnader
Alle relevante kostnader skal innsamles og presenteres i undersøkelsen. Indirekte kostnader kan tas med i undersøkelsen, men skal rapporteres for seg.
9. Sensitivitetsananlyse
Undersøkelsen bør inneholde en sensitivitetsanalyse. Dette er nødvendig for å vise hvor robuste konklusjonene er med hensyn til bestemte forutsetninger. Kostnader og resultater bør presenteres både i diskontert og udiskontert form.
10. Konsekvenser av analysen
En bør drøfte hvilke praktiske konsekvenser analysen bør få. Dette avhenger av hvem som skal bruke den, refusjonsmyndighetene, spesialistforeninger, forskningsmiljøer m.fl. Dessuten påvirkes analysens verdi av kvaliteten på bl.a. grunnlagsdataene, holdbarheten av sentrale forutsetninger osv.
Ambisjonene i bruken av slike analyser bør gradvis øke. Det er trolig vanskelig allerede i dag å legge seg på f.eks. Australias nivå. Hvis Norge skulle innføre en ordning tilsvarende den australske, ville det neppe innebære vesentlig mindre arbeidsbyrde enn i Australia, fordi antall medikamenter vil være omtrent det samme. Ordningen ville årlig kreve anslagsvis 10-20 årsverk av fagfolk med helseøkonomisk kompetanse. Det er for tiden ikke mulig å tilfredstille et slikt arbeidskraftbehov selv om all norsk kompetanse på området ble satt inn. På lengre sikt må en derimot arbeide for at det blir rekruttert tilstrekkelig antall kvalifiserte legemiddeløkonomer til det offentlige.
Hvem bør utføre analysene?
Et viktig spørsmål er hvem som bør utføre de økonomiske analysene. På den ene siden hevdes det at produsentenes nære kjennskap til det aktuelle legemiddel burde tilsi at produsentene selv gjennomførte analysene. Motforestillinger til en slik løsning går på at produsentene har økonomisk interesse av å fremstille egne produkter som kostnadseffektive, selv om de i virkeligheten ikke er det. Praksis viser også at legemiddeløkonomiske undersøkelser som er finansiert av produsenten, sjelden eller aldri konkluderer med at et nytt produkt ikke er kostnadseffektivt. Et offentlig evalueringsorgan med forskningskompetanse på lik linje med produsenten vil kunne motvirke den mulige betydning av produsentens egeninteresse gjennom selvstendig vurdering av konklusjonene. Informasjonen i undersøkelsene vil således kunne være til nytte i refusjonsspørsmål uavhengig av hvilken konklusjon som trekkes om kostnadseffektivitet, blant annet fordi legemiddeløkonomiske undersøkelser ideelt sett bør inneholde en strukturert og systematisk identifisering av kostnader og konsekvenser ved alternative terapivalg. Dette er ikke en rutinemessig del av den nåværende prosedyre for å avgjøre refusjonsspørsmål.
En annen mulighet er at eksterne forskningsinstitusjoner, eller myndighetene selv, gjennomfører undersøkelsene. I likhet med produsentene vil imidlertid eksterne forskningsinstitusjoner kunne ha økonomisk egeninteresse av å overdrive kostnadseffektivitet, f.eks. med tanke på opprettholdelse av finansiering og tildeling av fremtidige evalueringsoppdrag. En kontrakt mellom forskningsinstitusjonen og produsenten, inngått på forhånd, vil trolig kunne redusere denne muligheten noe. Det er utarbeidet forslag til hvordan kontrakter mellom produsenter og forskningsinstitusjoner skal utarbeides for å unngå rapporteringsskjevheter i produsentsponsede legemiddeløkonomiske evalueringer (Hillmann et al. NEJM 1991). En internasjonal tendens er at produsentene selv utfører analysene, men at undersøkelsene evalueres av et offentlig oppnevnt panel med uavhengig forskerkompetanse.
9.3.3 Behandlingsintensjon
Med behandlingsintensjon mener en hvorvidt hensikten med behandling er sykdomsbekjempelse, forebygging eller fremme av helse slik begrepene er nærmere definert i kapittel 4. Det kan argumenteres for at behandlingsintensjon er en del av alvorlighetsbegrepet. Når det allikevel er relevant som selvstendig kriterium, skyldes det at individene ofte selv har muligheten til å ta et større ansvar for forebygging og helsefremme enn for bekjempelse eller lindring av etablert sykdom. Dette kan ha konsekvenser for hvordan et tilbud bør dimensjoneres.
9.3.4 Praktisk anvendelse av prioriteringskriteriene
Hvordan kan en prioriteringssil med fire kriterier brukes i praksis når en legemiddelprodusent sender inn søknad om at et nytt legemiddel skal kunne forskrives på blå resept? Myndighetene må da vurdere hvordan den aktuelle legemiddel-diagnose-kombinasjon scorer på hvert av de fire kriteriene.
I første omgang unntar man fra refusjon legemidler til bruk mot tilstander som ubehandlet ikke vil medføre alvorlige konsekvenser for pasientene
I den andre silen fjernes legemidler hvor dokumentasjonen av behandlingseffekt er overveiende mangelfull
Den tredje silen luker vekk legemidler hvor kostnadene står i misforhold til den medisinske verdien, eventuelt hvor et medisinsk behandlingmål kan oppnås gjennom rimeligere og lett tilgjengelige medikamentelle eller ikke-medikamentelle alternativer
Til slutt unntar en, eller begrenser refusjonene for, legemidler hvor behandlingsintensjonen for eksempel kan være «for-sikkerhets-skyld» behandling av pasienter med lav eller moderat risiko for en fremtidig lidelse, og legemidler i grenselandet mellom forebygging og fremme av helse.
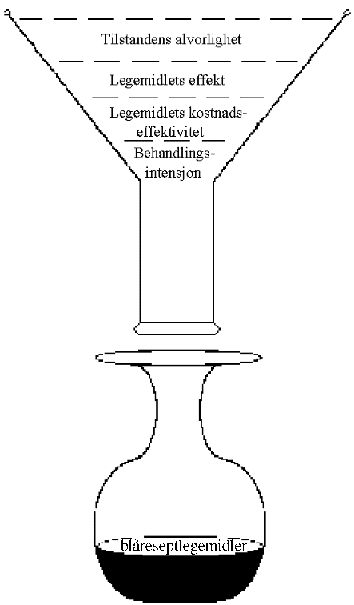
Figur 9.3 En norsk prioriteringssil
Utvalget mener at de samme prioriteringskriteriene må gjelde for legemidler som for alle andre helsetjenester, dvs. at tilstandens alvorlighet, legemidlets effekt og kostnadseffektivitet, og behandlingsintensjonen skal tillegges vekt.
Det overordnede mål for prioritering er likhet, dvs. at nødvendige legemidler ved alvorlig sykdom skal være tilgjengelige uansett betalingsevne og bosted. Dette betyr at alle sykdommer og legemidler i utgangspunktet skal kunne ha den samme mulighet til å bli vurdert mot prioriteringskriteriene. Et prioriteringssystem hvor myndighetene, i motsetning til det system vi her har foreslått, f.eks. tar utgangspunkt i spesielle karakteristika ved pasientgruppen som alder, kjønn, eller en spesiell diagnose etc., bryter mot dette likhetsprinsippet. Skal målet om likhet oppfylles, er det behov for mer overordnede prioriteringskriterier som er uavhengige av hvem pasientene er. De fire kriteriene vi har skissert er, i hvert fall langt på vei, slike kriterier.
Konsekvenser for utformingen av dagens blåreseptordning
Blåreseptordningen er basert på en liste over sykdommer og en korresponderende liste med legemidler. De sykdommer som inngår i listen er eller kan være alvorlige. Ved enkelte tilstander som opptrer med ulik alvorlighetsgrad kreves det at det dreier seg om sykdomav alvorlig og langvarig karakter (f.eks. pkt. 18, psykiske lidelser av alvorlig og langvarig karakter, og pkt. 31, svære hudlidelser og andre tilfeller av langvarige og utbredte tilfeller av eksem). Likeledes må effekten av legemidlene være vitenskapelig dokumentert. Som hovedregel er det et minimumskrav at den indikasjon det ytes refusjon for skal være godkjent av Statens legemiddelkontroll. Gjennom ordningens oppbygging, med implisitte krav både til alvorlighet og effekt, ønsker man å unngå bruk av offentlige ressurser på ineffektive og lavt prioriterte tiltak, som i rutene A, B og C i figur 9.2. Ordningen er utformet med ønske om at det offentlige skal bruke ressurser på legemidler som bedrer pasientenes livskvalitet og livslengde, og at offentlige ressurser skal kanaliseres til pasienter med alvorlig sykdom (som i rute D), jf. også kapittel 7 og vedlegg 1. Et tilsvarende resonnement kan gjøres for å argumentere for at kostnadseffektivitet, i tillegg til alvorlighet og effekt, må være et sentralt prioriteringsprinsipp. De respektive sykdomspunktene og preparatbeskrivelsene i dagens blåreseptordning er tildels upresist definert. Når et legemiddel tilfredsstiller kravene til sykdomspunkt og preparatbeskrivelse, er det ikke uttrykkelig hjemmelsgrunnlag i blåreseptforskriften for å avslå refusjon, selv om preparatet vil kunne føre til betydelige merutgifter for trygden. For å sikre at refusjoner til legemidler tildeles i henhold til overordnede prioriteringer og politiske avveininger, bør blåreseptforskriften ha uttrykkelig hjemmel til å kunne unnta bestemte legemidler fra refusjon etter § 9, selv om legemidlet for øvrig omfattes av en av sykdoms- og preparatbeskrivelsene i § 9. Det antas at blåreseptforskriften etter en fortolkning også i dag hjemler dette dersom det er saklig begrunnet, men det er ønskelig med uttrykkelig hjemmel. Alternativt må preparatkategoriene i blåreseptlisten presiseres på bakgrunn av legemidlenes aktive virkestoff.
Utvalget mener at prinsippet for utformingen av dagens blåreseptliste, hvor både sykdomspunkt og medikament listes opp i en såkalt positiv liste, fortsatt må gjelde. Dette ivaretar bl.a. implementeringen av prioriteringsbeslutninger basert på at en tilstands alvorlighet og legemidlets effekt skal tillegges vekt. Å basere listen enten kun på sykdommer, eller kun på legemidler, kan bryte med et slikt prinsipp.
Case: Behandling av osteoporose
Osteoporose er definert som en sykdom med redusert beinmasse og forandringer i benvevets mikroarkitektur. Dette fører til redusert knokkelstyrke og økt risiko for beinbrudd. At osteoporose kan medvirke til alvorlige beinbrudd betyr derimot ikke at samfunnet uten videre bør bruke ressurser på ethvert legemiddel som kan settes inn mot tilstanden. For at et medikament skal kunne gis høy prioritet, må det også ha god dokumentert effekt på slike brudd og være kostnadseffektivt, også i forhold til ikke-medikamentelle alternativer. Behandling og eventuell forebygging bør neppe fokusere ensidig på medikamentelle alternativer. En arbeidsgruppe opprettet av Statens ernæringsråd i 1995 trakk bl.a. konklusjonen om at det er behov for ulike tiltak for å redusere den høye forekomsten av osteoporotiske beinbrudd i Norge. Foruten tiltak rettet mot høyrisikoindivider, vil en korreksjon av uheldige livsstilsfaktorer som har sammenheng med lårhalsbrudd og lav beinmasse (ugunstig kosthold, lav fysisk aktivitet, alkoholmisbruk, røyking) sannsynligvis kunne redusere forekomst av osteoporotiske brudd på sikt. Ernæringsprogrammer i sykehjem og førstelinjetjenesten, opptreningsprogrammer og bedre informasjon om risikofaktorer og forebyggende tiltak vil kunne bidra til en slik korreksjon. Det er også viktig å være oppmerksom på at osteoporose bare representerer en av to årsaker til beinbrudd. Den andre årsaken er fall, dvs. fysisk traume mot knokler. Tiltak mot fall vil ventelig ha en effekt på forekomsten av brudd selv om dette er lite dokumentert. I Danmark er det vist at såkalte hofteputer gir en høy beskyttelse mot lårhalsbrudd hos dem som er villige til å bruke dem.
Når man vurderer om helsevesenet skal iverksette tiltak mot osteoporose, herunder refundere utgifter til legemidler, er således hovedspørsmålet om tiltakets kostnader står i et rimelig forhold til de helsegevinster pasientgruppen oppnår. En eventuell nasjonal strategi mot beinskjørhet burde stille opp mål for hvilken plass ulike tiltak skal ha, og hvordan tiltakene skal dimensjoneres med sikte på rasjonell fordeling av kostnadene på de ulike innsatsfaktorer. Utvalget vil påpeke at man ikke oppfatter den terapeutiske situasjon ved osteoporose som noe særtilfelle. Lignende betraktninger vil være aktuelle for andre hyppig forekommende kroniske tilstander.
Retningslinjer på de ulike sykdomsområdene
Det er vel og bra med overordnede prioriteringsprinsipper for hvordan knappe helseressurser skal fordeles. Skal prioriteringene gjennomføres i praksis, må de imidlertid oversettes til den kliniske hverdag slik at fagfolkene følger dem opp i dag-til-dag forskrivningen. Som omtalt i kapittel 5 er en hovedbetingelse for å få et kriteriebasert prioriteringssystem til å fungere, at det er mest mulig enighet om hvordan begrepene mer konkret defineres, også på klinisk nivå. I Sverige skiller en f.eks. mellom retningslinjer for prioriteringer på politisk-administrativt nivå og prioritering på klinisk nivå.
Utvalget mener derfor at det bør lages veiledninger for hva en skal legge i prioriteringsprinsippene på de forskjellige sykdomsområdene, jf. kapittel 5 og kapittel 6. Det er selvsagt en vanskelig oppgave å utvikle slike råd og retningslinjer. Det krever inngående kjennskap til hvert enkelt medisinsk felt. På den annen side vil mange av begrepene og innholdet i disse være felles. Når kriteriene skal brukes på de forskjellige områdene er det svært viktig at det stilles opp mål for behandlingseffekt, hva standardbehandlingen skal være, retningslinjer for utøving av klinisk skjønn, hvordan behandlingseffekt dokumenteres og hva behandlingsintensjonen skal være.
9.4 INSITAMENTER I REFUSJONSPOLITIKKEN
Legemiddelforbruk kan påvirkes på tre måter. Det offentlige kan styre forbruket direkte gjennom lover og offentlige institusjoner, eller det kan skje en indirekte påvirkning gjennom de økonomiske rammebetingelser og i en mer bevisst verdimessig påvirkning av legemiddelpolitikkens ulike aktører: Pasienter, leger, grossister, apotek, sykehus, innkjøpsorganisasjoner og legemiddelbedrifter. Bruken av legemiddeløkonomiske metoder og prioriteringskriterier, slik det er beskrevet i foregående kapittel, er et virkemiddel for å få til best mulig offentlig institusjonell politisk styring. Slik styring bør suppleres både med systematisk verdimessig påvirkning, og økonomiske insentiver så langt det er mulig å få til. Det er et viktig legemiddelpolitisk spørsmål i hvilken grad en kan utforme refusjonsordningene, slik at de i sterkere grad stimulerer til at individer med lav eller moderat risiko for fremtidig sykdom, og hvor behandlingseffekten på individnivå er liten eller usikker, tar et størst mulig ansvar for egen helse. Det er også spørsmål om hvordan myndighetene kan forhandle om prisen på nye legemidler uten at det får uholdbare konsekvenser for tilbudet til pasientene. Internasjonalt er det en omfattende diskusjon om hva slags insentiver som bør brukes overfor leger og pasienter.
9.4.1 Økonomiske insitamenter overfor pasientene
Økonomiske insitamenter kan benyttes for å oppnå bestemte politiske mål. I refusjonspolitikken kan en f.eks. yte refusjon av utgifter til legemidler i større eller mindre grad, eller holde legemidler helt utenfor refusjonsordningen. På den måten kan økonomiske insitamenter stimulere både til økt og redusert bruk av legemidler. Hvorvidt et økonomisk insitament er godt eller dårlig, avhenger av i hvilken grad det bidrar til å oppfylle bestemte målsettinger.
Som vist i kapittel 4 har det alltid vært innslag av økonomiske insitamenter i det norske helsevesenet. Det er en løpende debatt om, og i hvilken grad, helsetjenestens brukere bør pålegges egenandeler for å avlaste skattefinansieringen av helsevesenet, og for å frigjøre ressurser til prioriterte formål. Samtidig er det bred enighet om at egenbetalingen ikke må være så høy at pasienter med svak betalingsevne ikke får tilgang til de helsetjenestene de har behov for.
Hensikten med bruk av egenandeler kan være å påvirke etterspørselen, ved at «unødvendig» forbruk ikke etterspørres eller at visse tjenester velges fremfor andre. Når det gjelder legemidler, vil slike virkninger i all hovedsak være indirekte, idet det i praksis er legen som ut- fra faglige vurderinger fastlegger behandlingen. Men der det foreligger flere alternativer, kan legens valg til en viss grad tenkes å påvirkes av hensynet til pasientens økonomi. F.eks. kan den prosentvise egenandelen for legemidler stimulere til bruk av startpakninger for å prøve ut om et legemiddel er det riktige for pasienten.
Hensiktsmessigheten av egenandeler diskuteres også internasjonalt. Det meste av forskningen på dette området er gjort i USA. Det finnes lite empirisk forskning på hvordan egenandeler virker i norsk helsevesen. De resultater man har kan derfor vanskelig benyttes for norske forhold, ettersom det amerikanske finansieringssystemet for helsetjenester har en svært ulik utforming i forhold til det norske. Det er allikevel klart at legemidler i likhet med andre helsegoder som oftest er et nødvendighetsgode, dvs. at etterspørselen og forbruket i relativt liten grad påvirkes av variasjonen i egenandelene.
Den helseøkonomiske litteratur gir imidlertid ingen entydig støtte til bruk av egenandeler. For eksempel har canadieren Bob Evans drøftet bruken av egenandeler under overskriften «Why bad ideas keep coming back?» (Evans et al. 1993). Evans argumenterer mot at omfattende bruk av egenandeler ligger i fordelingseffektene, dvs. at de rammer de fattigste og sykeste hardest. Den gevinst en kan oppnå i økt effektivitet kan komme i misforhold til det en taper i uheldig fordeling. Skal en utforme egenandeler, må en derfor være svært bevisst hvordan de antas å virke. I noen tilfeller er fordelingsproblemet mindre relevant, f.eks. hvis en pasient kan velge mellom to helsetjenester som er likeverdige, eller nesten likeverdige.
Økonomisk likestilling av pasienter
Økonomiske insitamenter kan både bidra til å øke og redusere bruken av legemidler. På hvilke områder kan det være ønskelig å øke bruken av legemidler? Utvalget mener at det offentlige først og fremst har forpliktelser overfor pasienter med alvorlig sykdom, hvor det finnes effektive legemidler som er kostnadseffektive. Samtidig er det viktig å holde fast ved likhetsprinsippet. Som tidligere nevnt er det i dagens forskrift et vilkår for refusjon at en sykdom har gått inn i en langvarig fase, og at legen har overbevist seg om at det er behov for langvarigmedikasjon. For en del alvorlige sykdommer er imidlertid kortvarigmedikamentell behandling eneste effektive og sikre behandlingsalternativ. Slike legemidler kan være kostbare, og må i dag betales av den enkelte. Det lar seg i dag vanskelig begrunne hvorfor langvarighet bør være det overordnede prioriteringsprinsipp for hvem som skal få dekket sine legemiddelutgifter av det offentlige. Med basis i de prioriteringsprinsipper som utvalget mener bør være sentrale i dag, kan det argumenteres for at folketrygden i fremtiden også bør dekke utgifter til kostbar kortvarig medikamentell behandling av alvorlige lidelser.
Pasienter som har behov for behandlingsalternativer som sjelden er aktuelle, kan i dag få refusjon kun for utgifter til kostbare legemidler. For pasienter med sjeldne sykdommer som har gått over i en langvarig fase, eller med sykdommer som varer hele livet, kan de samlede utgiftene til rimelige legemidler bli store i lengden. Kravet om at legemidlene skal være kostbare gjelder ikke i forbindelse med behandling av mer alminnelige sykdommer, jf. blåreseptforskriftens §1 og § 9. Denne praksis kan komme i konflikt med kravet om likhet og likebehandling ved at pasienter med sjeldne diagnoser ikke i samme grad som pasienter med vanlige diagnoser får dekket sine utgifter. Det kan derfor argumenteres for at pasienter som må søke om dekning av legemiddelutgifter etter forskriftens § 2, også kan få dekket utgifter til rimelige legemidler.
Lik egenandel for alle
Alders- og uførepensjonister har lenge hatt lavere egenandel for legemidler på blå resept enn andre pasienter. Det samme gjelder barn under 16 år. Fra 1991 er barn under 7 år fritatt for egenandeler i helsetjenesten. Differensieringen av egenandelen etter alder og pensjonsstatus er en særordning for legemidler på blå resept. Heller ikke utgiftstaket for egenandeler i frikortordningen, som i 1997 er på 1 290 kroner, er differensiert etter disse kriteriene, men barnefamiliene er tilgodesett ved at barns egenandeler kan summeres sammen med den ene av foreldrenes.
Alders- og uførepensjonistene har som gruppe hatt en god inntektsutvikling, og dette vil fortsette i årene fremover. Både blant pensjonistene og i den øvrige befolkningen varierer inntektsforholdene mye, og enkelte, f.eks. blant minstepensjonister og enslige mødre, har en svak økonomi. Derfor er det viktig at det tas hensyn til dette ved fastsetting av nivået både på de enkelte egenandelene og for den samlede egenandelsordningen.
Formålet med å innføre prosentvis egenandel for legemidler var å stimulere til nøkternhet i forskrivningen av legemidler. For at ikke utlegget ved den enkelte ekspedisjon skulle kunne bli så høyt at det ville skape problemer for enkelte pasienter, er det fastsatt maksimumsbeløp pr. resept. Både dette maksimumsbeløpet og det samlede utgiftstaket for egenandeler begrenser virkeområdet for den prosentvise egenandelen.
Etter utvalgets oppfatning gir frikortordningen meget god skjerming mot en urimelig samlet egenandelsbelastning, og utvalget kan vanskelig se at det i dagens situasjon er noen grunn til å særbehandle pensjonister når det gjelder egenandelen på blå resept. Når det gjelder nivået på dagens egenandeler, anser utvalget at det nåværende maksimumsbeløpet på 330 kroner er i høyeste laget, både som enkeltutlegg og sett i forhold til egenandelstaket på 1 290 kroner. Taket nås med fire slike egenandeler i løpet av et år, mens det f.eks. trengs 15 allmennlegekonsultasjoner. Egenandelen på inntil 110 kroner gir på den andre siden så liten differensiering av egenandelen, at det gir små insentivvirkninger i forhold til en nøktern forskrivningspraksis.
På denne bakgrunn vil utvalget foreslå at det innføres en felles egenandel på 20 eller 25 pst, med et maksimumsbeløp pr. resept på 200-250 kroner. Dette vil også gi om lag samme provenyeffekt som dagens egenandeler. Det foreslås ingen endring i forhold til de grupper som er fritatt fra egenandeler i dag.
Utvalgets medlem, Skancke, er uenig i utvalgets vurderinger vedrørende nåværende maksimumsbeløp pr. resept og det foreslåtte nivået for en felles egenandel. Det vises til egen merknad til forslag 12 under utvalgets anbefalinger, kapittel 9.8.
Differensiert refusjon etter nytte-kostnadsforhold
Egenandelen for legemidler som omfattes av blåreseptordningen er i hovedsak den samme for alle sykdommer og legemidler, dvs. enten 12 eller 36 pst. avhengig av pasientens alder og pensjonsstatus. For allmennfarlige smittsomme sykdommer oppført i forskriftens § 4, for barn under 7 år og ved yrkesskade er det ikke krav om egenandel.
Det er i dag altså tre ulike refusjonssatser for legemidler på blå resept. Forutsatt at ordningen forenkles gjennom innføring av en felles egenandelssats for alle pasientgrupper som foreslått i forrige avsnitt, kunne det eventuelt vurderes å innføre en differensiering av egenandelen mellom ulike legemidler i stedet. Innføring av en ny refusjonsklasse hvor pasienten betaler 50 pst av reseptbeløpet for legemidler som scorer dårlig på de fire prioriteringskriteriene som er beskrevet i kapittel 9.3, ville gi lavere utgifter for trygden. Samtidig gis pasienter og leger større insentiver til å velge kostnadseffektive legemidler. Hvis et legemiddel gir liten medisinsk gevinst i forhold til kostnadene, kan det synes rimelig at pasienten selv dekker en større del av merkostnadene. Samtidig kan en slik ordning gi muligheter for trygden til å dekke utgifter til flere legemidler enn i dag. Mer differensierte kategorier for refusjon vil øke myndighetenes forhandlingsstyrke i forbindelse med prisforhandlinger.
Det danske refusjonssystemet er bygget opp etter liknende prinsipper. Her refunderes utgiftene etter tre forskjellige egenandelssatser, henholdsvis ingen egenandel, 25 pst og 50 pst. Satsene avhenger av sykdommens alvorlighetsgrad og legemidlets sikkerhet og terapeutiske effekt.
Hensiktsmessigheten av en slik endring i den norske refusjonsordningen kan imidlertid synes tvilsom. Hvis det finnes alternative legemidler som scorer høyt på prioriteringskriteriene, bør et legemiddel som scorer lavt heller utelukkes fra refusjon, slik det er foreslått i kapittel 9.3. Hvis det ikke finnes alternativer og legemidlet derfor tas opp i refusjonsordningen, selv om det ikke er så effektivt som ønskelig, bør ikke de pasientene som har nytte av legemidlet straffes med en høyere egenandel enn andre pasienter. Det ville heller ikke være enkelt å utforme klare kriterier for å skille mellom de ulike refusjonsklassene, og for leger og pasienter ville ordningen bli langt mer uoversiktlig. Hensynet til enkelhet og forståelighet for pasientene er et viktig hensyn ved enhver refusjonsordning. Både ved opptak av nye legemidler og i den daglige administrasjon ville ordningen også bli mer komplisert og arbeidskrevende.
Terapeutisk referanseprissystem
Bruk av referanseprissystemer innebærer at det for nærmere definerte legemiddelgrupper beregnes en pris som utgjør en øvre grense for refusjon. Legen står fritt til å forskrive legemidler som er dyrere enn denne referanseprisen, men det overskytende beløpet, referansepristillegget, må da betales av pasienten i tillegg til egenandelen. I 1993 ble det i Norge innført en slik ordning for synonyme preparater.
På enkelte områder kan det være mulig å gruppere legemidler i kategorier hvor legemidlene ikke er synonyme, men terapeutisk sammenlignbare. Det innebærer at pasienten skal ha sammenlignbar medisinsk nytte av alternative behandlingsopplegg. Legemidlenes virkestoffer kan derimot være forskjellige. Referanseprissystemer basert på terapeutisk sammenlignbarhet er omstridt, og det er omfattende debatt både nasjonalt og internasjonalt om konsekvensene av slike begrensninger av refusjonene. I Norge har regjeringen tidligere foreslått en slik utvidelse av grunnlaget for beregning av referansepriser, og at også patenterte legemidler skulle omfattes av systemet. Et flertall på Stortinget gikk i 1994 mot forslaget med den begrunnelsen at terapeutiske referansepriser bl.a. undergraver ordningen med patentbeskyttelse av legemidler.
En ordning med referansepriser har både positive og negative sider. Lægeforeningen og Legemiddelindustriforeningen går mot utvidelser av referanseprissystemene. Det er bl.a. fremført argumenter om at referanseprissystemer kan bidra til nye sosiale skiller, ved at det er de ressurssterke som får tilgang på de beste legemidlene om en innfører slike ordninger. Mange frykter at lege-pasientforholdet vil svekkes dersom pasienten ikke gis anledning til å få legemidler forskrevet etter vanlige prinsipper for refusjon. Argumentene fra industrien går på at referanseprissystemer undergraver patentrettighetene, og dermed gjør det vanskeligere å utvikle nye medisiner. Argumentene fra de statlige myndigheter for utvidet bruk av referanseprissystemer, har vært at trygden ikke bør belastes utover det som er nødvendig for en gitt medisinsk effekt. Det fremholdes også at patentordningenes funksjon er å beskytte mot kopiering, ikke å skjerme det enkelte patenterte produkt fra konkurranse på pris og kvalitet.
De fleste kostnadsbesparende tiltak har negative sider og spørsmålet er hvilke tiltak som, alle forhold tatt i betraktning, er mest hensiktsmessig. Et terapeutisk referanseprissystem kan utformes på mange måter. Nøkkelen er hvor smalt eller bredt en definerer legemiddelgruppene som kan gi samme rett til refusjon. Smale definisjoner reduserer muligheten for å ramme såkalte «truly innovative drugs», dvs. nye legemidler med stor medisinsk verdi og med få medisinsk sammenlignbare alternativer. Eksempel på et slikt legemiddel er migrenemidlet Imigran. I et system med referansepriser vil produsentene, stilt overfor en situasjon med redusert refusjon i forhold til godkjent maksimal salgspris, ha to mulige hovedstrategier. Den ene vil være å senke prisen til referanseprisnivået for å få en størst mulig del av blåreseptomsetningen. Den andre hovedstrategien vil være å opprettholde den høye prisen, og satse på at merkelojalitet og preparatets gode effekt gjør at markedsandelen opprettholdes. I dette tilfellet må brukeren betale mellomlegget mellom referansepris og den pris preparatet har. Hvis etterspørselen etter legemidlet er lite prisfølsom, vil produsenten ikke tape stort av inntekter ved å ha høy pris og la brukeren betale mellomlegget.
I Norge foreligger det erfaringer med det generiske referanseprissystemet fra 1993. Dette systemet omfatter kun generiske legemidler, dvs. legemidler som inneholder samme kjemiske substans (virkestoff) i samme styrke og legemiddelform, og som er funnet medisinsk likeverdig. Preparatene har utgått patent, er produsert av forskjellige legemiddelprodusenter, og har forskjellige navn og pakning. Innføringen av systemet skjerpet priskonkurransen på generiske legemidler, slik at de fleste produsentene valgte å senke prisen til referanseprisnivå. Hensikten med dette var at pasientene ikke skulle belastes med referansepristillegget, og dermed kanskje bli flyttet over på konkurrerende preparater. Tilsvarende konkurranse vil trolig inntreffe ved innføring av et utvidet referanseprissystem. Produsenter som ikke senker prisen til referanseprisnivå vil kunne tape markedsandeler, fordi opprettholdt pris vil belaste pasientene med ekstra referansepristillegg.
I debatten rundt referanseprissystemer refereres det også ofte til andre land. Blant annet har det i Tyskland fra 1989, i forbindelse med reformen Gesundheits-strukturgesetz, og i Nederland (Geneesmiddelen Vergoedingssystem - GVS) siden 1992, vært referanseprissystemer som baserer seg på prinsippet om terapeutisk sammenlignbarhet. I disse systemene inngår også legemidler med gyldig patent. I Tyskland er legemidler med patent registrert etter 31.12.95 unntatt fra ordningen.
Land med stor farmasøytisk industri har større insentiver til å unnta patenterte legemidler fra referanseprissystemet enn land med stor import. Med unntak av ett firma, er norsk legemiddelindustri liten i verdensmålestokk. Målt i verdi var over 85 pst av legemidlene omsatt i Norge i 1995 produsert av utenlandske legemiddelselskaper. Legemidlene selges av de internasjonale legemiddelselskapenes salgsorganisasjoner i Norge, og størstedelen av salgsinntektene kommer gjerne til beskatning i det landet morselskapet hører hjemme. Den internasjonale legemiddelindustrien er en av verdens mest lønnsomme bransjer.
Selv om det er argumenter mot referanseprissystemer, mener utvalget at behovet for virkemidler for riktig dimensjonering av ressursbruken på legemidler er så viktig at en bør utrede mulighetene for bruk av terapeutiske referanseprissystemer. Er det praktisk mulig å lage slike systemer? Hva vinner en eventuelt i kostnadsbesparelser sammenlignet med de ulemper Lægeforeningen og Legemiddelindustrien har pekt på? Hvilke områder kan i så fall være aktuelle? En viktig betingelse for å få et terapeutisk referanseprissystem til å fungere er at det så langt det er mulig bygger på faglig konsensus. Det vil si at den beste medisinsk-faglige kompetansen har vært benyttet i utformingen.
9.4.2 Økonomiske insentiver overfor legene
Legene har en dobbel funksjon overfor samfunnet. Deres primære oppgave er å være pasientens advokat, dvs. å stille diagnose og gi anbefalinger om behandling. På den annen side har også legene et ansvar for hvordan de samlede ressurser forbrukes. Gradvis er legen blitt seg mer bevisst dette ansvaret, jf. at det både i legeloven og i de etiske regler for leger, vedtatt av Lægeforeningen i 1994, er slått fast at legene «skal ta tilbørlig hensyn til samfunnets økonomi».
Det er tidligere vist at en i andre land har introdusert økonomiske insentivsystemer for å begrense veksten i forbruket av legemidler. Både i England, Tyskland og Nederland er det innført rammebudsjetter for leger for å stimulere dem til å vurdere sin forskrivning både med henblikk på medisinsk effekt og pasientens nytte av legemidlet. Et viktig element i disse systemene er at det er innført ordninger med tilbakemelding til de forskrivende leger i håp om at de skal forskrive mer rasjonelt. Det foreligger lite dokumentasjon av effektene av slike ordninger. En dansk undersøkelse viste imidlertid at allmennleger som fikk slike tilbakemeldinger, ikke økte sin forskrivningsmengde i en seks-måneders periode, mens legemiddelkostnadene økte med 3,5 pst i kontrollgruppen. Tyske myndigheter har oppnådd store innsparinger i offentlige legemiddelbudsjetter gjennom faste nasjonale budsjetter for legenes forskrivning. Utgangspunktet for det samlede legemiddelbudsjettet var forskrivningskostnadene for 1991 som ble satt som tak for kostnadene i 1993. Taket har vært på tilsvarende nivå i de påfølgende år. Dersom det oppstår budsjettoverskridelser, må disse dekkes av legene og deres organisasjoner opp til et visst nivå. Ytterligere overskridelser dekkes av den farmasøytiske industri. Tilsvarende er det i England en ordning hvor leger i store gruppepraksiser (minst 7 000 pasienter) får tildelt et budsjett innenfor hvilket de kan kjøpe legemidler og elektive (planlagte) sykehustjenester på pasientenes vegne. Målsettingen er at legene skal vurdere kostnader mer kritisk i forhold til helsenytte når de diagnostiserer og behandler. Hvis legene ikke bruker opp hele det tildelte budsjettet, kan de bruke deler av overskuddet til innkjøp av utstyr, men ikke til egen inntekt. En evaluering av reformen indikerer at ordningen med legemiddelbudsjetter har hatt effekt på legemiddelutgiftene. I 1992-93 var den gjennomsnittlige veksten i forskrivning av reseptpliktige legemidler 12 pst, mens veksten i forskrivning fra leger med budsjett var 8 pst.
Erfaringene fra land som har satset på slike markedseksperimenter er ikke entydig positive. En tendens er at det blir for stor fokusering på kostnadene i forhold til kvaliteten. Som nevnt i kapittel 8 er det økende interesse for å introdusere slike økonomiske styringsmidler i helsepolitikken, men utvalget har ikke sett det som sin oppgave å komme med tilrådinger i dette vanskelige politiske spørsmål.
Det kan allikevel være noe å lære fra de utenlandske erfaringer hvor leger får et spesielt ansvar knyttet til en bestemt pasientpopulasjon. Primærhelsetjenesten er fundamentet i norsk helsevesen. Hver nordmann går til lege fire ganger i året, og det skjer årlig 12-16 millioner konsultasjoner. Primærlegenes forskrivningspraksis er derfor svært viktig for om samfunnet får en riktig forskrivning av legemidler. En mulig forbedring er å innføre en ordning med fast lege. Med en slik ordning vil en få et system der den enkelte lege får et eget ansvar for legemiddelforskrivning overfor en bestemt gruppe pasienter. Dermed vil det også være mulig i større grad å unngå f.eks. uheldig dobbelforskrivning av legemidler, og sikre at legemiddelterapi ses i sammenheng med de øvrige helsetjenester pasienten mottar.
9.4.3 Økonomiske insentiver overfor omsetningsleddene
Legemidler er både en innsatsfaktorer i helsetjenesten, et industriprodukt som utvikles av en internasjonal forsknings- og kapitalintensiv legemiddelindustri, og et handelsprodukt som må distribueres gjennom et distribusjonssystem. For å høste produktivitetsgevinster, og for å tilby pasientene gode legemidler til lavest mulige priser, må de ulike aktører i legemiddelmarkedets verdiskapingskjede ses i sammenheng. Det må lages spilleregler for forskning, utvikling, produksjon, distribusjon, markedsføring og prisfastsetting av legemidler. Det er en omfattende diskusjon om hvordan legemiddelomsetningen best kan organiseres. Internasjonalt har det i de senere år vokst frem helt nye former for omsetning av legemidler som avviker mye fra den modell en har i Norge.
Det er nedsatt et eget utvalg som arbeider med disse spørsmålene. Utvalget har derfor ikke sett det som sin oppgave å vurdere hvordan man kan øke effektiviten på dette området. Utvalget vil imidlertid trekke frem noen forhold som kan føre til effektivisering av anskaffelses- og innkjøpsprosedyrer for legemidler finansiert av folketrygden.
Nye anskaffelseskonsepter for folketrygden
Fylkeskommunene har gjennom et eget innkjøpssamarbeid, LIS (Legemiddel Innkjøp Samarbeid), oppnådd store prisreduksjoner på legemidler til bruk i sykehus. Dette skjedde i forbindelse med at det fra 1. januar 1995 ble åpnet for at sykehusene kunne kjøpe legemidler, direkte fra grossist. Tilsvarende har innkjøpsorganisasjoner for helsetjenester i andre land, kanskje først og fremst i USA, oppnådd betydelige rabatter fra leverandørene.
Også for legemidler omfattet av folketrygdens refusjonsordning kan det være mulig å utvikle nye anskaffelseskonsepter. For eksempel kan myndighetene forsøke å inngå avtaler om totalpris for hele det forventede forbruk av et trygdefinansiert preparat, eventuelt med muligheter for justering på bakgrunn av faktisk salg.
Parallellimport av legemidler
Parallellimport av legemidler til Norge innebærer at et preparat som allerede har norsk markedsføringstillatelse importeres fra et land innenfor EØS-området med lavere prisnivå. Den som importerer preparatet, parallellimportøren, selger da produktet på det norske markedet i konkurranse med den samme produsentens direkteimporterte preparat og dennes salgsorganisasjon i landet. Parallellimport har møtt sterk motstand fra industrihold. Denne formen for internasjonal samhandel har imidlertid grunnlag i Roma-traktaten. Som omtalt i kapittel 6 anser EU at «Nasjonale regler eller praksis som begrenser import av farmasøytiske produkter, eller er i stand til å gjøre det, er bare i overenstemmelse med Romatraktaten i den grad de er nødvendige for å beskytte innbyggernes liv og helse». Det er lagt visse restriksjoner på adgang til parallellhandel med medlemsland med utilstrekkelige patentordninger.
Generisk substitusjon
Generisk substitusjon vil si at apoteket i samråd med pasienten kan utlevere et preparat som er synonymt med det preparatet som er forskrevet av legen på resepten. Synonyme preparater er preparater som inneholder samme kjemiske substans (virkestoff) i samme styrke og legemiddelform, og som av myndighetene er funnet medisinsk likeverdige. Et generisk preparat er synonymt med det originale. Preparatene er produsert av forskjellige legemiddelprodusenter og har forskjellige navn og pakning. Preparatenes utseende og smak kan også være forskjellig, men den terapeutiske effekten for pasienten er den samme. Synonympreparater er i mange tilfeller rimeligere enn originalpreparatet. Det stilles samme krav til kvalitet, sikkerhet og effekt for alle synonyme preparater. Generisk substitusjon er aktuelt av følgende årsaker:
Å gi kunden god service hvis det aktuelle preparatet ikke kan leveres (fra apoteket, grossisten eller produsenten). Hvis apoteket ikke har på lager det preparatmerket som legen har forskrevet, kan bruk av generiske/parallellimporterte preparater medvirke til at pasienten kan få et annet preparat og derfor ikke trenger å komme tilbake til apoteket for å hente legemidlet senere.
Å etterkomme pasientens ønske om billigere preparat eller et annet preparat av andre grunner (kjenner et preparat, foretrekker det samme). Generiske preparater er i mange tilfeller billigere enn de originale. Innføring av generisk substitusjon vil således kunne føre til lavere legemiddelutgifter for den enkelte pasient og for folketrygden.
Å gjøre det mulig for apotekene å rasjonalisere sitt lagerhold ved at apoteket kan ekspedere et annet synonymt preparat i stedet for det som legen har forskrevet. Antall godkjente preparater øker som følge av EØS-avtalen. Mange av de nye preparatene vil være generiske/synonyme preparater. I denne situasjonen vil generisk substitusjon gjøre det mulig å yte service uten å øke lagerkostnadene urimelig.
I Sverige, Danmark og Finland bestemmer legen om det skal kunne foretas generisk substitusjon eller ikke for den enkelte pasient. Det gjøres enten ved at a) legen gir sitt samtykke til generisk substitusjon ved å skrive G på resepten (Danmark) eller b) legen gir sitt samtykke ved at han/hun ikke har reservert seg på resepten (Sverige). Apoteket har da anledning til å foreta generisk substitusjon. Begge ordningene er arbeidskrevende for apotek og lege ved at apoteket må informere legen om bytte av preparat og legen må føre det inn i sin journal. I de nordiske landene er ordningen relativt lite brukt.
I forbindelse med revideringen av Forskrift om rekvirering og utlevering av legemidler fra apotek, er det blitt lagt inn en bestemmelse om at apotekpersonalet har plikt til å informere pasienten om pris der det foreligger billigere synonyme preparater. Det vil i denne sammenheng bli lettere for pasienten, apoteket og legen dersom apoteket også har rett til å foreta generisk substitusjon.
I St.prp. nr.1 1995-96 varslet Sosial- og helsedepartementet at det er behov for en nærmere vurdering av de medisinske, økonomiske, juridiske og praktiske sider ved å innføre et slikt system. En eventuell innføring av generisk substitusjon vil kreve en lovendring.
Forholdet mellom legemiddelbruk i og utenfor institusjon
De ulike vilkår for bruk av legemidler i og utenfor institusjon kan være problematisk, jf. kapittel 7. Sykehusene har ansvaret for all legemiddelbruk under sykehusopphold, og pasientene har i dag ikke anledning til å bruke innkjøpt blåreseptmedisin under opphold i sykehus, eventuelt ved korttids/avlastningsopphold i sykehjem. Dette kan virke upraktisk, bl.a. fordi det enkelte ganger må kjøpes inn legemidler som ikke inngår i sykehusavdelingens ordinære legemiddelutvalg. Etter få dagers bruk vil resten av pakningen ofte måtte kasseres. Denne praksis bør kunne mykes noe opp.
9.5 IKKE-ØKONOMISKE INSITAMENTER OVERFOR LEGEMIDDELPOLITIKKENS AKTØRER
Legene, både i primærhelsetjenesten og i sykehusene, er de som har størst innflytelse på hva som egentlig forbrukes av legemidler. Det er legene som til syvende og sist også avgjør hvilke nye medisiner som tas i bruk i behandlingen, og hvor stort omfang bruken får. Det er derfor viktig å forstå hvilke motiver og insentiver som styrer legenes atferd hvis myndighetene vil påvirke legenes beslutninger med hensyn til forskrivningen.
Terapiveiledninger
Legenes atferd bestemmes av mange forhold, hvorav den viktigste må antas å være hva legen mener er korrekt medisinsk praksis. Det er særlig gjennom de normer og verdier som preger både grunn- og etterutdanning av legene en kan påvirke legenes atferd. Ønsker myndighetene å påvirke legene, er retningslinjer, eller terapiveiledninger, et viktig virkemiddel. Slike retningslinjer er til en viss grad i bruk i dag, både i Norge og andre land. Det er ubalanse mellom produsentenes markedsføringsaktiviteter (reklame, kurs, møter, legebesøk mv.) og den offentlige innsats med hensyn til produsentuavhengig legemiddelinformasjon, etterutdanning for helsepersonell og bevisstgjøring av leger i forhold til egen forskrivningspraksis.
Andre land har mer omfattende erfaringer med bruken av myndighetsforankrede terapiveiledninger. I Frankrike som har høye legemiddelkostnader, er det innført ca. 150 ulike retningslinjer, og legene kan få bøter for grove brudd på retningslinjene. Det foreligger ingen fullstendig evaluering av systemet, men det er visse indikasjoner på at legemiddelbruken har falt. Hele 75 pst av de franske legene følger retningslinjene (Bloor K. British Medical Journal 1996). I USA har man sendt produsentuavhengige konsulenter til leger for å informere om legemiddelbruk, og man kunne i randomiserte studier påvise en endring i legenes praksis. Også i Tyskland og New Zealand arbeides det med å innføre terapiveiledninger.
Myndighetene har et ansvar for at legene, så langt det er mulig, har best mulige opplysninger både om kostnader og nytte av bruken av legemidler. Forskningen gir ikke et entydig bilde av sammenhengene mellom utformingen av ikke-økonomiske insitamenter, refusjonsordninger og legenes atferd. Legene har for liten trening i sin grunn- og videreutdanning i å vurdere vitenskapelig dokumentasjon av behandlingseffekt og risikoreduksjon.
Statens legemiddelkontroll driver i dag veilednings- og informasjonsvirksomhet overfor helsevesenet om riktig bruk av legemidler. For å frembringe større kunnskap om den medisinske effekten av ulike behandlingsalternativer og -strategier, utreder Statens legemiddelkontroll alternative terapiformer innenfor forskjellige medisinske disipliner. Arbeidet skjer i samarbeid med norsk medisinsk ekspertise og legemiddelkontrollen i Sverige, og gjennomføres bl.a. gjennom terapiverksteder. Målsettingen er å utarbeide tilrådinger for terapiveiledninger på de utvalgte arbeidsområdene. I 1994 ble det avviklet 6 seminarer hvor konklusjonene er utgitt i bokform. Målsettingen er en utvidelse med syv terapiområder pr. år. Dette arbeidet må intensiveres, og det må i så stor grad som mulig også inneholde økonomiske data.
Regionale legemiddelsentre (RELIS)
Større tilgang på problemorientert produsentuavhengig legemiddelinformasjon vil bedre balansen i forhold til industriens produktorienterte informasjon. Særlig viktig er dette i primærhelsetjenesten der hoveddelen (ca. 80 prosent) av legemidlene brukes, og der tilgangen til produsentuavhengig kompetanse om aktuelle og ofte kompliserte legemiddelspørsmål ofte er, eller oppfattes som vanskelig tilgjengelig av f.eks. allmennpraktikere.
Regionale sentre for legemiddelinformasjon (RELIS), som er under oppbygging, skal ved formidling av produsentuavhengig informasjon og gjennom aktivt samarbeid med helsepersonell i regionen, øke bevisstgjøringen om legemidler og bidra til faglig forsvarlig og rasjonell legemiddelbruk til beste for den enkelte og samfunnet. RELIS kan bidra til å fremme kunnskapsbasert, rasjonell og kostnadseffektiv bruk av legemidler, herunder bidra til å fremme lojalitet til intensjonene i refusjonsordningen for legemidler. Ved å involvere fagkompetanse i regionen kan retningslinjer og anbefalinger tilrettelegges på en mer brukernær måte ut fra innsikt i lokale forhold. Dette kan også medvirke til at anbefalinger utarbeidet sentralt, får større gjennomslagskraft i ulike deler av helsetjenesten i en region, og til at problemstillinger av nasjonal art og interesse kan kanaliseres tilbake til sentrale legemiddelmyndigheter.
Produsentuavhengige edb-baserte sykdomshåndteringsmoduler
Edb-baserte sykdomshåndteringsmoduler er kliniske beslutningsstøttesystemer som leder legen gjennom en diagnostisk sjekkliste som kan ende opp med en terapianbefaling. Modulene kan også kobles til pasientsystemer. Hensikten er å bedre legenes mulighet til faglig oppdatering, og gi påminnelser og råd om forskrivninger til pasienter i de aktuelle pasientkategorier. En rekke store legemiddelprodusenter utvikler nå slike kliniske beslutningsstøttesystemer. Til tross for den overbevisende logikken ved tilnærmingen til systemene, må de også anses som markedsføringstiltak som skal bidra til at selskapets legemidler blir brukt fremfor generiske preparater, parallellimporterte legemidler eller konkurrentenes produkter.
Også i offentlige regi vil det være mulig å utvikle slike sykdomshåndteringsmoduler. De bør i så fall baseres på produsentuavhengig informasjon. Det programmeringstekniske kan eventuelt gjøres av private leverandører. Det er viktig at slike kliniske beslutningsstøttesystemer ikke bare fokuserer på medikamentell behandling.
Legemiddelstatistikk
For å gjennomføre legemiddelpolitikkens mål er det behov for bedre statistikksystemer på flere områder. Staten har bl.a. behov for bedre legemiddelstatistikk i forbindelse med:
Utforming og oppfølging av refusjonsordningen på legemiddelområdet (f.eks. effekt av egenandelsendringer, forskrivningsrestriksjoner, nye legemidler m.m.), spesielt kostnadsutviklingen
Tilsyn og kontroll med legers forskrivning, herunder narkotiske og vanedanende legemidler (A- og B-preparater)
Brukerrettet informasjon og veiledning, herunder også legers mulighet for selvevaluering og kollegabasert læring gjennom sammenholdelse med andre legers forskrivning
Dagens statistikkmateriale, jf. kapittel 3, er lite detaljert og presist. Statistikk kan i prinsippet tenkes innhentet enten på grossist- eller detaljistnivå. Utvalget anser det som mindre aktuelt å fortsatt basere seg på grossistsalg som viktigste statistikkgrunnlag, fordi den ikke gir tilstrekkelig informasjon i forhold til flere av de problemstillinger som er skissert ovenfor. En reseptbasert statistikk anses mer hensiktsmessig. Apotek registrerer allerede i dag all reseptinformasjon ved ekspedering. Opplysningene lagres i apotekenes edb-system, og oppbevares i inntil 1 år. Det vesentligste av opplysninger til reseptbasert statistikk finnes derfor allerede tilgjengelig i det enkelte apotek i dag, men utnyttes minimalt.
Statistikk er et viktig verktøy for at legene skal kunne foreta selvevaluering av egen forskrivning. Statistikk over legenes forskrivning kan også stimulere til kollegabasert læring gjennom sammenholdelse med andre legers forskrivning. I England er det innført et system med indikativ forskrivning. Systemet går ut på at det utarbeides standarder for hva som forventes å være et gjennomsnittlig utgiftsnivå for legemiddelforskrivningen. Legene blir holdt månedlig oppdatert over sine egne forskrivninger og hvorvidt forbruket er innenfor de forventede rammer. Forskrivnings- og kostnadsanalyser gir ytterligere informasjon, og gjør det mulig å informere allmennpraktikere om hvilke legemidler de har forskrevet, og de samlede kostnadene. Ordningen fungerer som en veiledning for legene, og de blir ikke holdt økonomisk ansvarlige for eventuelle overskridelser av det indikative forskrivningsvolumet. Statistikk vil også gi en kontrollmulighet i forhold til at intensjonene og kravene i blåreseptforskriften oppfylles. Utviklingen av nye datasystemer gjør det mulig i langt større grad å kontrollere om legenes forskrivninger skjer på en hensiktsmessig måte. Utviklingen på dette området må ivareta hensynet til personvernet.
Tiltak for å stimulere til rasjonelt uttak og bruk av legemidler
Som det ble pekt på i kapittel 7 er det et problem at svært mye av den medisin som skrives ut på trygdens regning ikke blir benyttet. Dette er ikke bare kostbart. Store legemiddellagre kan også være uheldig ut fra et medisinsk synspunkt, med manglende oversikt, dårlig etterlevelse av doseringsinstrukser og muligheten for sammenblanding preparatene imellom .
En pasient kan i dag ta ut legemidler på blå resept for inntil tre måneders forbruk. Dersom legen ved behandlingsstart har forskrevet nok av et legemiddel til tre måneders forbruk, og hele kvantumet tas ut ved oppstart av behandling, vil det bety en vesentlig kassasjon dersom pasienten allikevel ikke kan bruke legemidlet, f.eks. pga. bivirkninger. Bruk av startpakningerinnebærer at legen forskriver et begrenset kvantum legemiddel ved første gangs uttak. Dersom det viser seg at pasienten ikke tåler legemidlet, eller av andre årsaker ikke får bruk for medisinen, unngår en dermed at større mengder legemidler må kasseres. Med dagens egenandelsordning er det økonomisk lønnsomt også for pasienten om overforskrivning unngås. Utvalget foreslår at legene pålegges å forskrive mindre startpakninger ved igangsetting av langvarig behandling. Det bør stilles krav om at legemiddelprodusentene skal levere startpakninger.
Med dosedispensering menes at pasienten får utlevert nøyaktig det antall tabletter som vedkommende trenger i den angitte periode. Det egner seg særlig godt for pasienter som har problemer med å holde styr på når de skal bruke sine legemidler og hvor mye. Det har hittil vært brukt i en viss utstrekning i hjemmesykepleien. Det koster å pakke dosene manuelt eller maskinelt. Besparelser vil i første rekke kunne skje gjennom redusert svinn, og ved å lette administreringen av legemidler til pasientene. Den største gevinsten vil imidlertid være på behandlingskvaliteten. Sjansen for at legemidler blir brukt til riktig tid og i riktig dose vil øke, særlig for pasienter som tar mange legemidler daglig. Dosedispensering foregår nå på mer eller mindre permanent basis i flere steder i landet. Utgiftene til dosedispensering bør dekkes av refusjonsordningen.
Tiltak for å informere lege og pasient om rettighetene og begrensningene i refusjonsordningene
I kapittel 7 ble det vist at viktig informasjon om dagens refusjonsordninger er spredt i forskjellige skriv til de lokale trygdekontor. Fra legenes og pasientenes perspektiv fremstår deler av systemet som svært uoversiktlig, særlig med tanke på hvilke regler som gjelder for søknader etter unntaksbestemmelsene. Bidragsordningen er dessuten lite kjent. Leger og pasienter synes på den annen side å være godt kjent med hvilke bestemmelser som gjelder for legemidler listet i § 9, og som omfatter størstedelen av tilbudet. Det er imidlertid i liten grad utarbeidet informasjonsmateriale som er spesielt tilrettelagt for legenes og pasientenes behov. Slike bruker- og forskriverbrosjyrer kunne gi verdifull informasjon om hvilke rettigheter og begrensninger som ligger i ordningene. De kunne eventuelt distribueres gjennom apotek og helsestasjoner. Det er også nødvendig at legene har mulighet til å holde seg oppdatert om legemiddelpriser gjennom edb-baserte prisregistre. Det er også behov for å bedre informasjonsrutinene fra Rikstrygdeverket til apotek.
Sammenfattende vurdering
Legenes atferd bestemmes først og fremst av hva legene mener er korrekt medisinsk praksis. Det er ubalanse mellom produsentenes markedsføringsaktiviteter (reklame, kurs, møter, legebesøk mv.) og den offenlige innsats med hensyn til produsentuavhengig legemiddelinformasjon, etterutdanning for helsepersonell og bevisstgjøring av leger i forhold til egen forskrivningspraksis. For å få et rasjonelt legemiddelforbruk må derfor myndighetene bevisst prøve å påvirke legenes forskrivning. Dette kan skje på grunnlag av terapiveiledninger utarbeidet av produsentuavhengig ekspertise. Det har i flere år pågått et slikt arbeid i regi av Statens legemiddelkontroll. Det er imidlertid viktig at resultatene av dette arbeidet når ut til legene i klinisk praksis. For å få dette til kan det være nødvendig å utvikle terapiveilednings-konsepter som i sterkere grad enn i dag markedsfører produsentuavhengige terapiveiledninger i konkurranse med legemiddelindustriens egen informasjon og markedsføring. Et aktuelt tiltak kan være at myndighetene bidrar til utvikling av produsentuavhengige edb-baserte kliniske beslutningsstøttesystemer.
Statistikk er et annet viktig virkemiddel for myndigheter og leger. Fra myndighetenes perspektiv er det viktig å kunne følge med i at refusjonsordningene virker etter sin hensikt, og for legene kan det være av verdi å skaffe seg systematisk oversikt over egen forskrivning. Derfor er det viktig at statistikken er reseptbasert. De statistiske rådata over reseptforskrivningen eksisterer allerede i dag på apotekene og på trygdekontorene. Brukermedvirkning og kollegabasert læring bør være utgangspunktet for et slikt tiltak på statistikksiden.
For å unngå unødig store uttak av legemidler, store hjemmelagre, mulighetene for kassasjon, sammenblanding av legemidler og feilbruk, er det mulig å innføre krav om at legene ved oppstart av behandling skal forskrive startpakninger. Bruk av startpakninger kan være aktuelt inntil behandlingen er etablert, og legen har forsikret seg om at pasienten tåler legemidlet. Dosedispensering er et annet viktig virkemiddel som kan medvirke til rasjonell forskrivning og bruk av legemidler. Det er av sentral betydning at leger og pasienter er godt kjent med hvordan refusjonsordningene på legemiddelområdet fungerer. Informasjonstiltak overfor forskrivere og forbrukere av legemidler kan bidra til dette. Det er også behov for å bedre informasjonsrutinene fra Rikstrygdeverket til apotek.
9.6 DEN FREMTIDIGE ORGANISERING AV DEN STATLIGE FORVALTNING AV REFUSJONSORDNINGENE FOR LEGEMIDLER
I kapittel 7 går det frem at oppgavefordeling og ansvarsforhold i forbindelse med forvaltningen av blåreseptordningen fremstår som uklar. Legemiddeløkonomiske analyser er ikke trukket godt nok inn i prosessen, det skjer en viss overlapping i saksutredningen mellom statlige aktører, muligheten for rådgivning fra eksterne fagmiljøer utnyttes ikke systematisk nok og ansvaret for prisforhandlinger er ikke forankret. Hvordan kan den statlige forvaltningen på området best organisere sitt arbeid? Uansett valg av løsning vil visse sentrale oppgaver måtte ivaretas på en måte som sikrer god flyt i saksgangen og som ikke hindres av barrierer i forvaltningen.
Søknader og henvendelser om utvidelser eller endringer i refusjonsordningen kan i dag deles i to kategorier:
Søknader som ikke krever forskriftsendring, og ikke påregnes å medføre betydelige merutgifter for folketrygden. Dette omfatter i første rekke synonympreparater.
Søknader som krever forskriftsendring, og/eller antas å medføre betydelige merutgifter for folketrygden.
Søknader i kategori 1 håndteres i dag internt i Rikstrygdeverket. Disse utgjør flest i antall. Søknader i kategori 2 oversendes Sosial- og helsedepartementet for avgjørelse. Uansett valg av organisatorisk løsning for saksutredningen vil viktige oppgaver være:
(1) Mottak og vurdering av søknader fra legemiddelindustrien om refusjon av utgifter til nye legemidler, eventuelt forespørsler om endringer av gjeldende blåreseptforskrift
Vurderingen av søknadene i kategori 2 innebærer en utredning av medisinske og helseøkonomiske spørsmål. Blant annet vil det være nødvendig med en omfattende medisinsk redegjørelse for det aktuelle legemidlets effekt og bruksområde, og dets plass i forhold til andre behandlingsmuligheter. Det må også foretas en vurdering av kostnader og helsegevinster. Spesielt er det viktig at de budsjettmessige konsekvenser av oppføring i blåreseptforskriften er klarlagt før en tilråding oversendes departementet. Vurderingen må bygge på den dokumentasjon som ligger til grunn for markedsføringstillatelsen, og innhentede uttalelser fra eksterne fagmiljøer, jf. kapittel 9.7.
Den utredende instans må være ansvarlig for å utarbeide et bakgrunnsmateriale som legges frem for en rådgivende blåreseptnemnd, og ha ansvaret for fremdriften i nemndas arbeid. Blåreseptnemnda må ha medisinsk og økonomisk kompetanse, og de to øvrige statlige etater på legemiddelområdet må være representert. En viktig oppgave er også å foreta prisvurderinger og gjennomføre prisforhandlinger med legemiddelprodusentene for de legemidler som forslås oppført i blåreseptordningen. Refusjonsspørsmålet må fremmes med en klar tilråding til departementet. Ved positiv tilråding må denne følges av forslag til utforming av forskriften. Det må herunder utarbeides eventuelle merknader og nærmere vilkår for forskrivning, f.eks. krav til spesialistkompetanse, spesielle rekvireringsvilkår, diagnostikk og medisinske vilkår. Vedtak i departementet må gjøres kjent for søkeren.
(2) Departementets behandling av tilrådingen omfatter politisk og budsjettmessig avklaring
Deretter fatter departementet et vedtak om eventuelle endringer i forskriftene. Departementets avgjørelse meddeles den utredende instans.
(3) Iverksetting av vedtak
Forskriftsendringen må formidles til brukerne, dvs. trygdekontorer, leger og apotek. Administrasjon av forskriftene innebærer også behandling av søknader om refusjon etter unntaksbestemmelsene i blåreseptforskriftens § 2 og 10.2.
(4) Evaluering og kontroll av beslutninger om refusjon
Slike evalueringer kan gjøres på flere nivåer, bl.a. utgiftsutviklingen i forhold til prognosene, og om den faktiske bruk står i forhold til myndighetenes intensjoner
Utvalget har vurdert ulike organisasjonsmodeller, men har blitt stående med to forslag som begge kan ivareta de sentrale arbeidsoppgavene som er skissert. I modell 1 har man forsøkt å samle alle arbeidsoppgavene hos en instans, mens modell 2 er mer prosessorientert. Begge alternativer forutsetter opprettelsen av en blåreseptnemnd som har samme funksjon og sammensetning i begge modeller.
Modell 1
Modell 1 forutsetter at Rikstrygdeverket har et eksklusivt helhetsansvar for forvaltningen av folketrygdens refusjonsordning for legemidler. Det innebærer bl.a. at søknader om opptak av nye legemider på blå resept skal rettes til Rikstrygdeverket som står som ansvarlig utredningsinstans gjennom hele saksutredningsfasen. Rikstrygdeverket innhenter i nødvendig utstrekning analyser og vurderinger fra eksterne fagmiljøer. Den kunnskap som Statens legemiddelkontroll har ervervet gjennom vurderingen av spørsmålet om markedsføringstillatelser må gjøres tilgjengelig for Rikstrygdeverket, om nødvendig med samtykke fra legemiddelprodusenten. Rikstrygdeverkets helhetsansvar innebærer også ansvar for å gjennomføre prisforhandlinger med industrien i forbindelse med spørsmålet om opptak av legemidler i refusjonsordningen. Endelig innebærer dette helhetsansvaret iverksettingen av vedtak om refusjon, administrasjon av unntaksordningene etter forskriftenes § 2 og 10.2, og informasjon om hele blåreseptordningen. Også evaluering av og kontroll med refusjonsordningen henhører under Rikstrygdeverkets ansvar.
Alternativet innebærer at den kompetanse som Rikstrygdeverket i dag besitter innenfor medisin, jus, økonomi, epidemiologi, statistikk og farmasi må styrkes. Det må skje en vesentlig kapasitetsutvidelse gjennom ressurstilførsel. Modell 1 er skissert i figur 9.4.
Figur 9.4 Modell 1: Rikstrygdeverket som utredende instans
Argumenter for modell 1
I en argumentasjon av modell 1 som den mest hensiktsmessige kan en legge vekt på følgende forhold:
Blåreseptordningen er hjemlet i folketrygdloven og finansiert gjennom folketrygden. Trygdeetaten har et lovpålagt ansvar for folketrygdens administrasjon, og har også et hovedansvar i forvaltningen av refusjonsordningen for legemidler. Rikstrygdeverket har instruksjonsmyndighet overfor de lokale trygdekontorene. Ansvaret omfatter også kontroll med at ordningen virker etter sin hensikt og oppfølging av eventuelle avvik. Sosial- og helsedepartementet har instruksjonsrett overfor Rikstrygdeverket.
Modell 1 innebærer at samme instans har det forvaltningsmessige ansvar både for saksutredning og administrasjon av folketrygden på legemiddelfeltet. Ved at totalansvaret for saksutredningen legges til Rikstrygdeverket, reduseres uklarhetene i de forvaltningsmessige ansvarsforhold. Rikstrygdeverket har som sentraladministrasjon for folketrygden også ansvaret for sykepleieartikler etter blåreseptforskriftens § 3, og for bidragsordningen for legemidler og behandlingsutstyr etter folketrygdloven § 2-13. Det påligger dessuten Rikstrygdeverket å behandle et betydelig antall søknader om refusjon etter blåreseptforskriftens unntaksbestemmelser (1200-1300 saker i året). Ordningene må ses i sammenheng. Vedtak om refusjon etter disse bestemmelsene skal også gjøres kjent overfor de lokale trygdekontorer.
Rikstrygdeverket kan, om etaten tilføres nødvendige ressurser, få den nødvendige kompetanse på områder som regelanvendelse, prisforhandlinger med industrien, budsjettarbeid, innhenting av statistikk og bruk av trygde- og legemiddeløkonomiske analyser. Det er en viktig forutsetning for en slik modell at Rikstrygdeverket utvikler arbeidet knyttet til forvaltningen av refusjonsordningen i tråd med den kommersielle og medisinske utvikling på legemiddelområdet. Det er her behov for et omfattende arbeid for å utvikle trygdens tilsyn med hvordan refusjonsordningen virker og praktiseres, og det må utvikles en organisasjon som kan utvikle nye anskaffelseskonsepter og foreta prisforhandlinger med industrien.
Modell 1 innebærer at de respektive statlige legemiddelmyndigheter trekkes inn i prosessen rundt opptak av nye legemidler på blå resept etter behov. Dette bidrar til bred belysning av refusjonsspørsmålet fra ulike myndighetshold. En sikrer også utnyttelse av spesialkompetanse ved Statens legemiddelkontroll, bl.a. ervervet i forbindelse med godkjenning og utstedelse av markedsføringstillatelse.
Alternativet forutsetter større personellresursser enn det Rikstrygdeverkets Sykebehandlingskontor i dag har til rådighet på dette området, og vil således kreve en viss ressursstilførsel. Det kan være aktuelt å overføre ressursene fra Seksjon for legemiddeløkonomi ved Statens legemiddelkontroll til Rikstrygdeverket.
En egen blåreseptnemnd vil kunne fungere som et formelt samhandlingsorgan mellom forvaltningsmyndighetene og de kliniske miljøer og legge til rette for generell kompetanseoppbygging i Rikstrygdeverket. Et slikt utvalg vil også gjøre det mulig å trekke veksler på kompetanse utenfor den statlige legemiddelforvaltning.
Rikstrygdeverket er i besittelse av en betydelig generell kompetanse i prisforhandlinger med industrien. Rikstrygdeverkets Prisforhandlingskontor har i dag ansvaret for prisforhandlinger på områder som sykepleieartikler, ortopediske hjelpemidler, høreapparater, tekniske hjelpemidler, biler og luftambulansetransport. Denne kompetansen vil utnyttes dersom også ansvaret for prisforhandlinger for legemidler på blå resept legges til Rikstrygdeverket. Rikstrygdeverket vil også kunne bruke denne kompetansen til, der det viser seg mulig, å utvikle nye anskaffelseskonsepter. Ved modell 1 vil det være et klart skille mellom det myndighetsorgan som sørger for godkjenning og utstedelse av markedsføringstillatelse for legemidler, og det myndighetsorgan som har hovedansvaret for hvilke legemidler som kommer på blå resept. I forhold til de krav EU stiller, er det mye som taler for at ansvaret for godkjenning og utstedelse av markedsføringstillatelse for legemidler, og ansvaret for beslutninger om refusjonsberettigelse av legemidler bør være atskilt. Modell 1 krever ingen lovendring.
Modell 2
Modell 2 er basert på at Statens legemiddelkontroll mottar søknader fra legemiddelindustrien om opptak av nye legemidler på blå resept, og at hele ansvaret for saksforberedelse overfor departementet ligger her. Derimot er det forutsatt at ansvaret for selve forvaltningen av ordningen, ansvaret for spørsmålet om refusjon av utgifter til sykepleieartikler og annet behandlingsutstyr, samt behandlingen av søknader etter blåreseptforskriftens unntaksbestemmelser også i denne modellen skal ligge i Rikstrygdeverket. Denne modellen innebærer derfor et skille av ansvaret for saksforberedelsen i refusjonsspørsmål frem til vedtak på den ene siden og selve forvaltningen av blåreseptordningen på den andre.
Etter at søknad er mottatt skal Statens legemiddelkontroll utarbeide et bakgrunnsmateriale basert på tilgjengelig informasjon av medisinsk og helseøkonomisk karakter, herunder dokumentasjon fra produsent. Dette bakgrunnsmaterialet med forslag til tilråding legges så frem for den rådgivende blåreseptnemda etter samme mønster som i foregående modell. Basert på behandlingen i nemnda bearbeides materialet i Statens legemiddelkontroll og oversendes så departementet med Statens legemiddelkontrolls tilråding. Det er forutsatt at SLK har avklart prisspørsmålet ved eventuell refusjon før saken oversendes departementet. Etter avklaring i departementet vil Rikstrygdeverket ha ansvaret for eventuell iverksetting. Det videre forløpet vil være som i modell 1.
Modell 2 rendyrker således selve opptaksprosessen og innebærer en utbygging av den brede legemiddelkompetansen Statens legemiddelkontroll må besitte. Rikstrygdeverket tillegges fortsatt de byråkratiske kontrollrutiner og oppfølging av bruken på individnivå. . Modell 2 er skissert i figur 9.5.
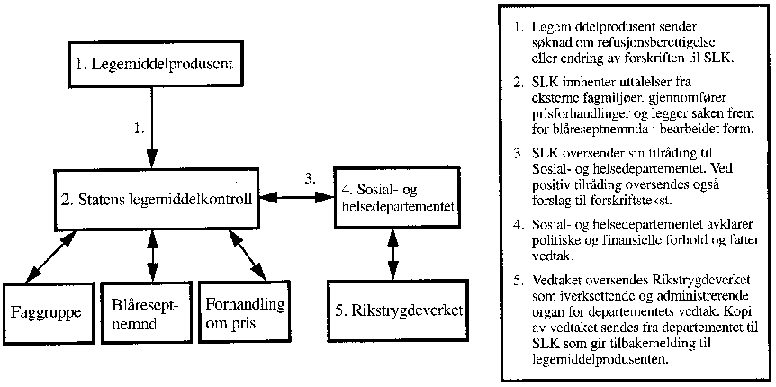
Figur 9.5 Modell 2: Statens legemiddelkontroll som utredende instans
Argumenter for modell 2
I en argumentasjon av modell 2 som den mest hensiktsmessige kan en legge vekt på følgende forhold:
Et hovedhensyn som ligger bak modell 2 er at den fremtidige legemiddelforvaltningen må inneha kompetanse til å kunne benytte legemiddeløkonomiske undersøkelser, og derved bidra til at refusjonsordningen ivaretar de fire opplistede kriteriene.
Statens legemiddelkontrolls ansvar i dag er å ivareta forbrukernes og helsepersonellets behov for effektive og sikre legemidler og gi informasjoner om riktig bruk av legemidler. For å fylle disse oppgavene har Statens legemiddelkontroll en bred medisinsk og farmakologisk kunnskap om sykdom og legemidler. Dette danner en god basis for den videre kompetanseoppbyggingen som vil være nødvendig, særlig gjelder dette styrking av helseøkonomisk kompetanse. Sykdommens alvorlighetsgrad, dens forløp med ny medikamentell behandling kontra ingen behandling eller dagens behandling, potensiell pasientpopulasjon samt behandlingskostnader danner grunnlaget for legemiddeløkonomiske analyser. Slike analyser er nødvendige for å kunne vurdere i et samfunnsperspektiv hvorvidt et legemiddel skal tas opp på blå resept eller ikke, og således sikre en mer effektiv anvendelse av offentlige ressurser innen helsesektoren.
Ved søknad om markedsføringstillatelse må Statens legemiddelkontroll vurdere innsendt dokumentasjon og innhente ekspertuttalelser om det aktuelle legemidlet. På bakgrunn av disse opplysningene foretas en vurdering og konklusjon, og dette vil danne grunnlag for den endelige beslutningen. Den helseøkonomiske vurderingen som må foretas i blåreseptspørsmål bygger i vesentlig grad på de samme opplysningene som ved markedsføringsspørsmålet, samt den akkumulerte tilsvarende kunnskap om andre legemidler innen samme terapiområde, en kunnskap som bare finnes ved Statens legemiddelkontroll.
På denne måten kan Statens legemiddelkontroll forvalte ansvaret for å gi tilrådinger til departementet om utvelgelse til blåreseptlisten som ledd i den brede legemiddelkompetansen denne instansen må besitte. Rikstrygdeverket kan for sin del utvikle de juridiske og kontrollmessige sider som de ellers utøver i en rekke sammenhenger.
EUs regelverk og Norges tilpasning til dette gjennom EØS-avtalen, fordrer et klart skille mellom markedsføringsgodkjennelse og prisfastsetting på den ene siden, og opptak av preparater i refusjonsordningen på den annen. Det bør være fullt mulig å sikre at et slikt skille finner sted gjennom å legge de ulike vurderinger til separate organer innenfor Statens legemiddelkontroll.
Konklusjon
Utvalget anser begge modeller som praktiserbare, og registrerer at det er argumenter for begge to. Det er ulik oppfatning i utvalget om hvor ressurskrevende de to modellene vil være, og det er også ulik oppfatning om hvilken modell som er mest hensiktsmessig som organisatorisk løsning. Utvalget vil derfor ikke komme med noen tilråding om valg av modell.
Utvalgets medlem, Haug, vil peke på at hensikten med en blåreseptnemnd er å veie nytten ved medikamenter fra ulike områder mot hverandre. Det vil altså dreie seg om prioritering mellom ulike pasientgrupper. Representanter for brukerne, altså pasientene, bør derfor være representert.
9.7 ET HELSETJENESTEBASERT RÅDGIVNINGS- OG OPPFØLGINGSAPPARAT I FORBINDELSE MED OPPTAK OG BRUK AV LEGEMIDLER I REFUSJONSORDNINGEN
9.7.1 Medisinsk kompetanse som grunnlag for legemiddeløkonomiske undersøkelser
En spesielt viktig oppgave for det statlige organet som skal utrede refusjonssøknader, er å foreta legemiddeløkonomiske beregninger. I den forbindelse er det spesielt viktig at beregningene baseres på den beste tilgjengelige økonomiske og medisinske ekspertise. Spørsmålet er hvordan organet skal sikre seg denne kompetansen. I en viss grad må det bygge opp kompetanse selv, og i en viss grad må det etableres samarbeid med ledende faglige miljøer og med de ansvarlige organisatoriske enheter på kommune- og fylkesnivå. I den grad helseregionene får økt sitt ansvar, blir det viktig å etablere relasjoner mellom det regionale nivå og den statlige enheten. Det er et nært faglig fellesskap mellom de ulike helsetjenester i en region, både mellom sykehusene og innen primærhelsetjenesten.
Det er flere mulige måter å organisere rådgivningsprosessen som skal ligge til grunn for myndighetenes beslutninger om refusjon. Et vesentlig poeng blir å legge til rette for rådgivning som er mer forpliktende enn dagens system, der den medisinske ekspertisen som gir råd og anbefalinger ikke har ansvar for implementering og oppfølging. Dette kan gjøres ved at helseregionene får ansvar for å tillegge bestemte fagstillinger det faglige ansvar for å gi råd til helsemyndighetene, sikre gjennomføringen og oppfølgingen, samt delta ved revurderinger og revisjoner.
9.7.2 Hva slags medisinske vurderinger må gjøres?
Det er et velordnet system for godkjenning av legemidler i Norge. Dette forvaltes av Statens legemiddelkontroll. Vurderingene gjøres av en rekke fast ansatte fagfolk, og det brukes et nettverk av rundt 100 eksterne konsulenter, oftest spesialister på det aktuelle området, i forbindelse med søknadsbehandlingen. Godkjenning skjer på grunnlag av kvalitet, sikkerhet og effekt og etter råd fra Spesialitetsnemnda.
Når et legemiddel er godkjent, kan produsenten søke om at et preparat gis rett til refusjon for en viss diagnose eller tilstand. Denne vurderingen bør skje på grunnlag av de fire prioriteringskriteriene: tilstandens alvorlighet, legemidlets effekt, legemidlets kostnadseffektivitet og behandlingsintensjonen.
Mens Norge etter ikrafttreden av EØS-avtalen har relativt lite spillerom i forhold til hvilke legemidler som i praksis må gis markedsføringstillatelse, er nasjonal beslutningsmyndighet i forhold til refusjon suveren så lenge regelverket ikke gir fortrinn til nasjonal industri.
Å prioritere eller velge ut de preparatene som skal gis refusjon, blant alle de som har markedsføringstillatelse, krever en annen type prosess enn den selve godkjenningen bygger på, nettopp fordi det er andre kriterier som legges til grunn. Denne prosessen er for det enkelte preparat like viktig, kanskje viktigere, enn selve godkjenningsordningen, både fordi omsetningen i vesentlig grad avhenger av om produktet gis refusjon, og fordi nye legemidler ofte er svært kostbare og vil kunne medføre store kostnader for det offentlige.
9.7.3 Hvordan kan blåreseptordningen følges bedre opp?
Hvert år er det bare få nye preparater av noen størrelsesorden som tas opp i ordningen. Utfordringen er følgelig minst like stor med hensyn til den løpende oppfølging av ordningen, for å påse at den brukes i tråd med intensjonene.
Beslutning om at et bestemt preparat tas opp i refusjonsordningen medfører ikke at preparatet alltid kan forskrives på blå resept. Krav til forskrivning på blå resept fremgår av forskriftstekst eller merknader, og omfatter tilstander hvor prioriteringskriteriene er oppfylt. For eksempel kan antidepressiva ha effekt ved en rekke tilstander (milde, moderate og alvorlige depresjoner, postmenopausalt syndrom, fibromyalgi, for tidlig sædutløsning), mens det offentlige bare bør betale for den delen av bruken hvor prioriteringskriteriene er oppfylt. I dag gjelder dette ved alvorlig og langvarig depresjon. Imidlertid skjer praktisk talt all forskrivning av antidepressiva på blå resept. Det samme gjelder andre legemidler hvor det er flere bruksområder eller grader av alvorlighet, og hvor intensjonen har vært at refusjonsordningen bare skulle dekke en del av bruken, for eksempel kolesterolsenkende legemidler.
Av de preparatene som kan forskrives på blå resept, utgjør denne delen av salget i de fleste tilfelle mellom 95 og 100 pst av totalsalget. Et riktigere nivå ut fra intensjonene med ordningen ville kanskje være 85 pst, svarende til en kostnadsreduksjon på minst 350 millioner kroner. Trolig kan dagens praksis dels forklares med at:
legene som skal bruke ordningen ikke er trukket inn i beslutningene og dermed ikke alltid finner samsvar mellom regelverk og virkelighet
retningslinjene for forskrivning på blå resept er uklare og kan tolkes til fordel for pasienten
det er ubalanse mellom produsentenes markedsføringsaktiviteter (reklame, kurs, møter, legebesøk mv.) og den offentlige innsats med hensyn til produsentuavhengig legemiddelinformasjon, etterutdanning for helsepersonell og bevisstgjøring av leger i forhold til egen forskrivningspraksis
det har vært nedlagt lite ressurser i god informasjon om refusjonsordningen og intensjonene med den til leger, pasienter og apotek
det har vært lite systematisk oppfølging av ordningen
For å oppnå en refusjonsordning hvor bare de legemidler og diagnoser hvor prioriteringskriteriene er oppfylt tas opp i ordningen og hvor de aktuelle legemidlene brukes i tråd med forutsetningene, er det derfor nødvendig med en bedre forankring av ordningen i helsetjenesten, og tiltak på flere områder:
Det må etableres en opptaksordning som sikrer en rettferdig praktisering av prioriteringskriteriene for den enkelte søker (produsent), og hvor helsetjenesten får innflytelse på prioriteringene
For viktige legemiddelgrupper og indikasjoner må prioriteringskriteriene oversettes i forhold til den kliniske hverdag gjennom utvikling av klare retningslinjer for forskrivning på blå resept, som reflekteres i den enkelte leges forskrivningspraksis og dokumenteres i journal
Det må etableres et konstruktivt tilsyn med at refusjonsordningen fungerer etter intensjonene, bl.a. basert på reseptstatistikk
Offentlig innsats med hensyn til produsentuavhengig informasjon, etterutdanning mv. om riktig bruk av legemidler må styrkes, og det må etableres et system for tilbakemelding til den enkelte lege om sin forskrivning
Disse fire hovedtiltakene må samtidig ses som en læringssløyfe, som både bidrar positivt til beslutningsprosessen og til at refusjonsordningen etterleves. Figur 9.6 viser skjematisk sammenhengen mellom den statlige beslutningsprosessen, oppfølging og forvaltning og klinisk praksis.
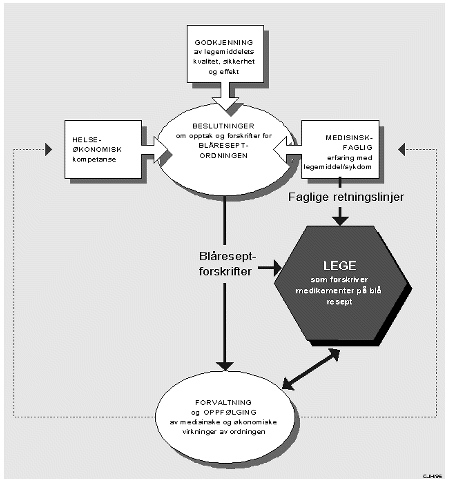
Figur 9.6 Sammenhengen mellom den statlige beslutningsprosessen, oppfølging, forvaltning og klinisk praksis
Som det fremgår i avsnitt 9.6 foreslås det etablert en blåreseptnemnd (som en parallell til Spesialitetsnemnda). Utvalget vil også foreslå at det på viktige områder etableres faggrupper med forankring ikke minst i primærhelsetjenesten, som en parallell til de eksperter som brukes i forbindelse med godgjenning av legemidler.
Et godt samarbeid mellom faggruppene og myndighetene vil sikre en god flyt av informasjon og erfaringer gjennom systemet, styrke refusjonsordningens legitimitet og tilrettelegge for økt ansvarliggjøring av legene i forhold til refusjonsordningens intensjoner.
9.7.4 Etablering av faggrupper på viktige terapiområder
For å oppnå en god forankring av refusjonsordningen, og ansvarliggjøring av den enkelte lege, mener utvalget at det bør etableres faggrupper for viktige terapiområder. Utvalget foreslår at det i første omgang etableres grupper på områdene hjerte-kar, astma-allergi, nevrologi inkl. migrene, psykiatri inkl. depresjoner og muskler og skjelett inkl. osteoporose. Disse faggruppene vil dekke en betydelig del av dagens blåreseptomsetning.
Faggruppene bør få i mandat å konkretisere hva en skal legge i begrepene alvorlighet, effekt, kostnadseffektivitet og behandlingsintensjon for ulike diagnose- eller sykdomsgrupper, samt hvordan dette skal dokumenteres i behandlingen for den enkelte pasient. Dette skal konkretiseres gjennom utarbeidelse av faglige retningslinjer for forskrivning, med utgangspunkt i dokumentasjon, kunnskap og innsikt i klinisk virkelighet. Som en del av dette arbeidet skal gruppene innenfor sine områder vurdere om det er behov for å revidere nåværende diagnoseliste, dvs. om noen av de indikasjonene og legemiddelgruppene som er oppført i dagens blåreseptordning ikke bør høre inn under ordningen, og/eller om krav til forskrivning bør presiseres. Retningslinjene må utformes slik at de danner grunnlag for den enkelte leges dokumentasjon av begrunnelse for forskrivning for trygdens regning, og for behov for opptrapping av behandling. Så langt mulig bør retningslinjene gi konkrete anvisninger om registrering av diagnose- og effektparametere.
Faggruppene skal også så langt mulig bistå myndighetene i å estimere hvilke kostnader trygden må påregne, eventuelt hvilken innsparing som bør kunne påregnes, forutsatt at retningslinjene følges.
For mange preparater i blåreseptordningen vil f.eks. grad av alvorlighet avgjøre om preparatet skal forskrives på blå eller hvit resept, eller om det er aktuelt med en trinnvis opptrapping av behandling (f.eks. bruk av «nye og dyrere» medisiner ved hypertensjon). For å ivareta kravet om kostnadseffektiv forskrivning bør retningslinjene på større terapiområder, f.eks. behandling av høyt blodtrykk og kolesterol, astma og depresjoner, derfor utformes som en «behandlingstrapp» («step-wise approach») med diagnostiske krav for hvert trappetrinn. Dette vil både indikere hvor grensen mellom forskrivning på «hvit» og «blå» resept går, og gi veiledning f.eks. for når legene bør starte behandlingen med rimelige og veldokumenterte legemidler, og hvilke krav som bør være oppfylt før en velger mer avansert og ofte dyrere behandling. Opptrapping av behandling bør så langt som mulig skje på grunnlag av objektive kriterier for økt alvorlighet (blodtrykksverdi, mål for lungekapasitet mv.).
Retningslinjene må være hjemlet i forskrift for refusjonsordningen, fordi tilsyn med ordningen må baseres på myndighetskrav. Retningslinjer vil i ulik grad kunne være konkrete, fordi sykdomstilstander varierer i karakter. Det må også i situasjoner hvor retningslinjene er konkrete, være et rimelig rom for klinisk skjønn i forhold til den enkelte pasient. Plikt for den enkelte lege til å føre en tilfredsstillende journal vil være sentralt.
9.7.5 Faggruppenes rolle ved opptak av nye preparater
I forbindelse med opptak av nye legemidler i refusjonsordningen, bør faggruppene konsulteres på bakgrunn av myndighetenes forslag til vedtak og begrunnelser for dette, og faggruppenes råd bør inngå i den foreslåtte blåreseptnemndas beslutningsgrunnlag. Faggruppene skal bidra til at det finnes retningslinjer for forskrivning når vedtaket settes i kraft.
9.7.6 Oppnevning og sammensetning av faggruppene
Det foreslås at faggruppene oppnevnes av det myndighetsorgan som tillegges ansvar for behandlingen av refusjonssøknader. Gruppene bør representere brukerne og ha 8-10 medlemmer med erfaring eller kompetanse fra denne type problemstillinger, fra bl.a. områdene spesialisthelsetjeneste, primærhelsetjeneste, farmasi og økonomi. Sammensetningen må også sikre forankring i tilknytning til ulike helseregioner og de regionale sentre for produsentuavhengig legemiddelinformasjon (RELIS). En mulighet som bør vurderes er om RELIS kan være sekretariat for faggruppene. Det må skje en trinnvis opptrapping av disse gruppene. En bør trolig starte med hjerte-karfeltet som et pilotprosjekt og etter hvert ta sikte på å få etablert grupper på de 4-5 viktigste terapiområdene, jf. 9.7.4. Ut fra erfaringer med hvordan systemet fungerer, bør en lage et mer permanent system for oppnevning og virkemåte. De økonomiske sider ved gruppenes virksomhet har vi kort referert i kapittel 10.
Utvalgets medlem, Hagen, vil understreke at det er vesentlig at det skapes personlig kontinuitet i rådgivningsprosessen gjennom flere år for at slik rådgivning skal fungere godt. Dette betinger at legens arbeidsgiver og legen selv avsetter faste deler av legens arbeidstid til funksjonen. Det må være en del av vedkommendes stillingsinstruks. Funksjonen må være tredelt: (1) rådgivning i forhold til eksisterende praksis og nye legemidler, (2) bistand i forhold til gjennomføring av vedtak, og (3) bistand med revurdering når erfaring er høstet. Å delta bare i rådgivningsfunksjonen er for lite forpliktende.
9.7.7 Myndighetenes rolle i tilsyn og oppfølging av refusjonsordningen
Tilsyn med refusjonsordningen er et myndighetsansvar. En forutsetning for å få til en reell oppfølging er at det foreligger reseptbasert statistikk, jf. kapittel 9.5, som tillater analyser på relevante nivåer, ned til den enkelte forskriver. Statistikken må omfatte all reseptmedisin, slik at blåreseptforskrivning kan ses i sammenheng med annen forskrivning.
Statens helsetilsyn og fylkeslegene er tillagt tilsynet med all helsetjeneste og alt helsepersonell gjennom Lov om statlig tilsyn med helsetjenesten. Lov om leger hjemler tilsyn med leger ut fra krav om faglig forsvarlighet, inklusiv forskrivning av legemidler, regelverkskrav, herunder forskrifter som gjelder refusjonsordningen, og økonomiske krav, herunder at trygden ikke påføres unødige utgifter. Rikstrygdeverkets kontrollansvar er hjemlet i trygdelovgivningen.
Tilsynet med refusjonsordningen må baseres på myndighetskrav. I tilsynet med refusjonsordningen må de vilkår eller retningslinjer som er fastsatt for at legemidler skal kunne forskrives på blå resept, legges til grunn. Retningslinjer for forskrivning må derfor enten inngå direkte i forskrift for refusjonsordningen eller være hjemlet i forskriften.
For å kunne føre tilsyn med refusjonsordningen må tilsynet omfatte legemiddelforskrivning både på blå og hvit resept. Tilsyn bør i all hovedsak, som i dag, skje uten kobling til den enkelte forskriver annet enn som anonymt individ, og skje gjennom generell tilbakemelding om hovedtrekk og utviklingstendenser i forskrivningsmønstre. Overordnet tilsyn skal i første rekke bidra konstruktivt til at refusjonsordningen som sådan fungerer etter intensjonene, gjennom oppfølging og erfaringsformidling. Å legge til rette for løpende tilbakemelding til den enkelte lege om egen forskrivning, må anses som en del av tilsynsoppgaven.
Overordnet tilsyn med legemiddelforskrivning kan avdekke forskrivningsmønstre som avviker fra det forventede. Det bør etableres et system for å undersøke og følge opp avvik av en viss størrelsesorden. Tilsynsmyndighetene kan her trekke nytte av et samarbeid med de foreslåtte faggruppene. Slik avviksoppfølging kan sannsynliggjøre behov for individtilsyn overfor grupper av forskrivere eller enkeltleger. Tilsyn med enkeltleger må skje på en velbegrunnet og forutsigbar måte. Pasienters krav på personvern må ivaretas ved tilsyn med enkeltleger.
Utvalget mener at når det gjelder bestemte vilkår for å forskrive på blå resept, bør det også være et system for kontroll med om fastsatte vilkår blir overholdt. Utvalget viser til at trygdeetaten har etablert et edb-basert system for kontroll med legers takstbruk, og foreslår at et lignende system vurderes innført med sikte på kontroll av legers forskrivning på blå resept.
9.7.8 Faggruppenes rolle i vedlikehold og oppfølging
Faggruppene bør også bistå myndighetene i arbeidet med vedlikehold og oppfølging av ordningen på faglig grunnlag. Det finnes grunnlagsdata fra representative, løpende reseptundersøkelser, som viser dagens fordeling mellom forskrivning på blå og hvit resept for ulike legemidler/legemiddelgrupper. Data om reseptforskrivning fra det nasjonale reseptstatistikkregisteret kan vise avvik i omfang av forskrivning i forhold til det som var forventet ved riktig bruk av retningslinjene. Avvik kan f.eks. skyldes feil i forutsetningene for retningslinjene, uklarheter eller manglende etterlevelse fra legenes side. Faggruppene bør kunne si noe om sannsynlige grunner til avvik, og foreslå tiltak som kan iverksettes av eller i samarbeid med myndighetene i forhold til dette, f.eks. endring i retningslinjene eller informasjon til legene. Om nødvendig kan avvik føres tilbake til den enkelte lege.
9.7.9 Oppfølging og implementering av refusjonsordningen på lokalt nivå
Det er viktig å være klar over at å sende ut skriftlig informasjon, som f.eks. retningslinjer, generelt ikke er noen garanti for at det faktisk skjer endringer. Særlig fordi nåværende ordning i liten grad har vært fulgt opp, og det nærmest er blitt vane at det som kan skrives på blå resept, skrives på blå resept, vil det være nødvendig å aktivisere legene på lokalt nivå for å oppnå ønsket endring av forskrivningspraksis.
Det bør derfor med utgangspunkt i retningslinjer og statistikk etableres et system med tilbakemelding til den enkelte lege om egen reseptforskrivning. Tilbakemeldingen må oppleves som nyttig. Effekt av tilbakemelding som eneste virkemiddel, er trolig begrenset. Større effekt kan trolig oppnås ved at leger, f.eks. i samarbeid med det lokale apotek, tar for seg forskrivningen på ulike områder med utgangspunkt i deres egen forskrivning. Slik aktivitet er forsøkt i Norge, bl.a. gjennom prosjektet «Apotek-lege-informasjonssamarbeid» (ALIS). Konseptet bygger på såkalt «kollegabasert læring», en lite ressurskrevende metode som egner seg for løpende oppdatering og kvalitetssikring av eget arbeid, og som har vist meget lovende resultater. Regionalt kan en tenke seg at RELIS, som også er representert i faggruppene, i samarbeid med den lokale etterutdanningen tilrettelegger for slik aktivitet - f.eks. gjennom utarbeidelse av standard pedagogisk grunnlagsmateriell (hovedpoeng i retningslinjer, hvordan bruke og tolke statistikken, eksempler, referanser).
Utvalget foreslår at det i tilknytning til faggruppenes arbeid gjennomføres et forsøksprosjekt med aktiv bevisstgjøring av leger om regelverket og implementering av retningslinjer på ett eller to hovedområder. Forsøksprosjektet skal gi informasjon om hvor langt det er mulig å påvirke legenes og pasientenes atferd ved klarere prioriteringsprinsipper og bruk av tilbakemelding om egen reseptforskrivning.
9.7.10 Oppfølging av helseeffekt
Data som nedtegnes i journal på bakgrunn av retningslinjer for forskrivning på blå resept, vil også gi et unikt grunnlagsmateriale for oppfølging av effekt i klinisk praksis, i motsetning til i kontrollerte kliniske studier med selekterte pasienter. Fra journal kan det i anonymisert form hentes ut registrerte kriterier for diagnose, samt indikatorer for effekt, inkl. livskvalitet, ved behandlingsstart og målt endring. Det er i gang et prosjekt (SATS), som tar for seg bruk av indikatorer i journaler i kvalitetsarbeid i allmennpraksis.
En oppfølging av om effekten av behandling med ulike legemidler kan observeres gjennom vanlig klinisk dokumentasjon vil være nyttig både i sin alminnelighet og for refusjonsmyndigheter. Utvalget mener likevel at slik effektvurdering faller utenfor refusjonsordningens løpende oppfølgingsansvar, og heller bør skje f.eks. i regi av det foreslåtte senteret for medisinsk teknologivurdering. Personvern må ivaretas nøye i slik forskning.
Utvalgets medlem, Frøyshov, kan ikke slutte seg til forslaget om at det etableres faggrupper for viktige terapiområder som en del av blåreseptordningen. Det forslås et stort landsdekkende nettverk av leger, farmasøyter og økonomer som skal ha som definert oppgave å gi råd til blåreseptnemnda og som også skal ha tilsyn med at blåreseptforskriften følges i den enkelte leges hverdag. Det landsdekkende nettverk er således tiltenkt 2 oppgaver, både råd om opptak og tilsyn med bruken. Etter min vurdering er det ikke behov for et slikt nettverk, da begge oppgaver kan løses ved allerede eksisterende organ.
Ad opptak av legemidler
Statens legemiddelkontroll avholder, sammen med det svenske Läkemedelsverket, årlig 6-7 terapiverksteder hvor man tar opp sykdomsområder som er særlig aktuelle i den medisinske debatt, blant annet når det utvikles nye behandlingsmuligheter/nye legemidler. Til disse verksteder samles allmennleger, spesialister innen det aktuelle fagfelt og økonomer fra begge land og utarbeider retningslinjer for hvilke terapivalg som anses best ved de ulike stadier av sykdommen. De helseøkonomiske konsekvenser utredes for de ulike alternativ.
Andre muligheter for nivådifferensiering av sykdommer kan finnes hos kommunalt organiserte behandlingsutvalg (e.g. Oslo komm. cancerutvalg), behandlingsutvalg i regi av landsdekkende organisasjoner o.l., i tillegg til Den norske lægeforenings spesialforeninger. De foreliggende alternativ anses tilstrekkelige i tillegg til den kunnskap det utredende organ og blåreseptnemnda må besitte.
Ad oppfølging av blåreseptordningen
Det er her to dimensjoner, den kontrollerende oppfølging og den læringsprosess man ønsker å initiere. Rikstrygdeverket administrerer blåreseptforskriften og det er deres ansvar at den følges. Trygdeetaten kan få datatilgang til alle blåresepter som ekspederes på apotek, og har gjennom dette en oppfølgings- og kontrollmulighet overfor både grupper av leger og enkeltleger dersom ikke forskriften følges. Statens helsetilsyn har tilsynsmyndighet med den enkelte leges virksomhet, at denne holder faglig mål. Dette kontrollaspekt gjelder all legevirksomhet, herunder utstedelse av både blå og hvite resepter. Dette tilsynet er således ikke spesielt knyttet til blåreseptordningen og kan ikke overtas av en eventuell faggruppe.
Ad læringsprosessen
Lokale legemøter i ulike sammensetninger, apotek - lege - informasjonsarbeid og lignende grupperinger utøver i dag en utbredt aktivitet som gir læring på faglig grunnlag. I slike fora kan både det administrative apparat og helsetilsynet få tilgang for å gi opplæring og informasjon.
Ad gjennomgang av eksisterende blåreseptliste
Blåreseptnemnda, sammen med den etat som har ansvaret for saksutredningen overfor departementet, må ha ansvar for en gjennomgang av den eksisterende blåreseptliste. De må også ha ansvar for en kontinuerlig vurdering av listens innhold, og eventuelt foreslå endringer når det kommer nye behandlingsmuligheter som gir større helseøkonomisk gevinst enn de alternativ som står på listen.
Utvalgets medlem, Frøyshov, viser til egen merknad til forslag 2 under utvalgets anbefalinger, kapittel 9.8.
9.8 UTVALGETS HOVEDANBEFALINGER
I utvalgets mandat heter det at utvalget skal gi sin tilråding om eventuelle behov for endringer i dagens ordning. Endringene skal både bøte på de problemene som er identifisert med dagens ordninger og møte fremtidens krav. Størsteparten av forskrivningen av legemidler i allmennpraksis skjer gjennom blåreseptordningen. Derfor må utformingen av tiltak i størst mulig grad være innrettet mot å bedre forskrivningen i sin alminnelighet, herunder spesielle bestemmelser knyttet til refusjon. Utfordringen er å finne den rette kombinasjon mellom bruken av faglig kunnskap, lover, forskrifter og retningslinjer, finansieringsordninger, statistikk- og informasjonssystemer, og verdimessig påvirkning av legemiddelpolitikkens aktører.
I Norge har en hatt tradisjon for sterk offentlig institusjonell styring. Utvalget mener at dette hovedprinsippet bør videreføres. Erfaringen med markedseksperimentene i Tyskland, England og USA er ikke entydig positive med hensyn til å få kvalitetsmessig god bruk av helsetjenester. I disse land har politikken i for sterk grad fokusert på å holde kostnadene nede, på bekostning av å få en faglig riktig bruk av ressursene. Skal en få til en faglig riktig bruk av ressursene, må den offentlige institusjonelle styringen bygge på klare prioriteringskriterier som både de statlige organer og forskriverne kan arbeide etter.
Utvalget mener at det er behov både for nye overordnede prioriteringskriterier, og en klarere ansvarsfordeling mellom de ulike statlige aktører. Dessuten er det behov for at styringen skjer med utgangspunkt i kunnskaper basert på analyser av nytte og kostnader ved bruken av legemidler og alternative tiltak. Det må skapes en kultur på legemiddelområdet for at legemiddelfirmaene foretar legemiddeløkonomiske analyser, at de fremste fagfolk bidrar med medisinsk-faglige råd om hvordan legemidler egentlig virker på våre store helseproblemer, og at dag-til-dag forskrivningen skjer med utgangspunkt i disse anbefalingene. For å få dette til er det behov for å etablere faglige råd med ansvar for å bygge bro mellom de statlige overordnede myndigheter og helsevesenets kliniske hverdag. Egenandeler rammer de fattigste og sykeste hardest, og utvalget mener derfor at det er store begrensninger i et slikt virkemiddel. Det er i dag ulike egenandeler i blåreseptordningen. Utvalget mener at like egenandeler for alle aldersgrupper vil gjøre ordningen mer oversiktlig.
I den foregående delen av kapittel 9 har vi redegjort for utvalgets strategier for hva vi mener bør skje på disse hovedområder av refusjonspolitikken. I den siste delen av dette kapitlet legger vi frem våre 14 hovedanbefalinger for hva som bør prioriteres av offentlige tiltak på refusjonsområdet. Anbefalingene er i stor grad enstemmige, men enkelte av medlemmen har reservasjoner mot enkelte forslag. Utvalgets medlem, Frøyshov, har en særmerknad til anbefaling 2. Utvalgets medlem, Haug, har en særmerknad til anbefaling 4. Utvalgets medlem, Skancke, har en særmerknad til anbefaling 7 og 13. Utvalgets medlemmer, Cameron og Heimdal, har en særmerknad til anbefaling 8.
1. Overordnede prioriteringskriterier ved opptak av nye legemidler på blå resept
Utvalget foreslår at nedenstående kriterier må vurderes ved stillingstaken til om et legemiddel skal finansieres av det offentlige.
Sykdommens alvorlighet
Legemidlets effekt
Legemidlets kostnadseffektivitet
Behandlingens intensjon
I dag er hovedkravet for å få refusjon av utgifter til legemidler at en sykdom har gått inn i en langvarig fase og at det er behov for langvarig medikasjon. For pasienter med sjeldne diagnoser er det også et krav om at behandlingen skal være kostbar. Utvalget mener at ovenstående fire kriterier bedre vil ivareta kravene til likhet og lik rett til behandling enn dagens hovedkrav. Når en legemiddelprodusent søker myndighetene om refusjonsberettigelse for et nytt produkt, må myndighetene vurdere refusjonsspørsmålet ut fra hvordan det aktuelle legemiddel scorer på hvert enkelt av de fire kriteriene. Bruken av ovenstående kriterier forutsetter at en opprettholder dagens system hvor både sykdom og preparatkategori oppføres i en egen liste som utløser rett for pasientene til refusjon, dvs. en såkalt positiv liste.
2. Etablering av faggrupper på viktige terapiområder
Utvalget foreslår at det på utvalgte terapiområder etableres faggrupper. Disse gruppene skal oversette de generelle prioriteringsprinsippene til den kliniske hverdag. For å få dette til må en konkretisere hva en skal legge i begrepene alvorlighet, effekt, kostnadseffektivitet og behandlingsintensjon for ulike diagnose- eller sykdomsgrupper, og belyse hvordan dette skal dokumenteres i behandlingen av den enkelte pasient. På bakgrunn av disse vurderingene skal gruppene innenfor sine områder vurdere om det er behov for å revidere nåværende diagnoseliste, dvs. om noen av de indikasjonene og legemiddelgruppene som er oppført i dagens blåreseptordning ikke bør høre inn under ordningen og om forskrivningsvilkår bør presiseres. Retningslinjene må utformes slik at den enkelte lege kan bruke dem som utgangspunkt for sin forskrivning for trygdens regning. Faggruppene skal også så langt det er mulig bistå myndighetene i å anslå de økonomiske konsekvenser for trygden under forutsetning av at retningslinjene følges. Gruppene bør oppnevnes av det myndighetsorgan som tillegges ansvaret for behandlingen av refusjonssøknadene. De bør representere brukerne og ha 8-10 medlemmer bl.a. fra spesialisthelsetjenesten, primærhelsetjenesten, farmasi og økonomi. Gruppene bør etableres trinnvis. I første omgang bør det etableres en gruppe på hjerte-karområdet.
Utvalgets medlem, Frøyshov, viser til særmerknad til kap. 9.7 og uttaler: Det er riktigere å bygge på de organ og grupperinger som er i arbeid i dag enn å bygge opp et nytt og ressurskrevende, landsdekkende nettverk som gis oppgaver som allerede ivaretas av andre offentlige myndigheter og faglige grupperinger. Myndighetenes behov for å utrede begrepene om alvorlighet, effekt og kostnadseffektivitet ved ulike sykdomstilstander og behandlingsalternativ dekkes i dag på en del områder og kan utvides.
3. Klargjøring av ansvaret for saksforberedelse i refusjonsspørsmål
Utvalget har vurdert to alternativer for hvilken statlig instans som skal være ansvarlig for å motta og vurdere søknader fra legemiddelprodusenter om opptak av nye legemidler i blåreseptordningen, eventuelt vurdere forespørsler om endringer av dagens blåreseptforskrift.
Modell 1 forutsetter at Rikstrygdeverket har et eksklusivt helhetsansvar for forvaltningen av folketrygdens refusjonsordning for legemidler. Modell 2 er basert på at Statens legemiddelkontroll mottar søknader fra legemiddelindustrien om opptak av nye legemidler på blå resept, og at hele ansvaret for saksforberedelsen overfor Sosial- og helsedepartementet ligger hos Statens legemiddelkontroll. Utvalget anser begge modeller som praktiserbare. En viktig oppgave for den utredende statlige instansen blir å foreta prisvurderinger og gjennomføre prisforhandlinger med legemiddelprodusentene for de legemidler som foreslås oppført i blåreseptordningen. Vurderingen av søknadene skal innebære en utredning av medisinske og helseøkonomiske spørsmål. Den utredende instans må være ansvarlig for å utarbeide et bakgrunnsmateriale som legges frem for en rådgivende blåreseptnemnd, og ha ansvaret for fremdriften i nemndas arbeid. Blåreseptnemnda må bl.a. ha medisinsk og økonomisk kompetanse, og representasjon fra de statlige aktører på legemiddelområdet. Uansett valg av modell vil det være Rikstrygdeverket som har ansvar for iverksetting av vedtaket og at det gjøres kjent overfor leger, apotek og trygdekontor.
4. Iverksetting av et konstruktivt system for oppfølging, tilsyn og kontroll
Utvalget foreslår at det lages et systematisk kontrollopplegg som sikrer at intensjonene i blåreseptordningen fungerer i tråd med både faglige og økonomiske hensyn. For å få dette til må det etableres to hovedtyper av tiltak.
1. Det må etableres en reseptbasert legemiddelstatistikk som gir et mer detaljert bilde av forskrivningen av legemidler enn det myndighetene i dag har tilgjengelig. Det bør opprettes en sentral database for legemiddelforbruk og forskrivning, hvor statlige myndigheter kan hente ut informasjon om egenandeler, forskrivende lege, forskrivningsvolumer, endring i forskrivningsmønster, virkningen av statlige reguleringer mv. I dag er det for vanskelig for den enkelte lege å skaffe seg systematisk informasjon og oversikt over egen forskrivning, og det blir vanskelig å få til selvevaluering og kollegabasert læring. Myndighetene og Lægeforeningen må med utgangspunkt i den reseptbaserte statistikken utvikle bevisstheten om riktig forskrivning. I den forbindelse må ivaretakelse av personvernhensyn vurderes nøye.
2. Myndighetene må trappe opp sitt arbeid for å sikre tilsyn med legemiddelforskrivningen slik at den tilfredsstiller både økonomiske og faglige krav. Statens helsetilsyn må i samarbeid med fylkeslegene ha et ansvar for å sikre rasjonell legemiddelforskrivning på linje med det tilsyn som utøves for andre helsetjenester. Det er en spesielt viktig oppgave å påse at det oppnås like rettigheter og tilgjengelighet i forhold til refusjonsordningen for enkeltpasienter, og at den enkelte får den behandling forskriftene åpner for. Tilsvarende må Rikstrygdeverket ha et ansvar for å utvikle kontrollordninger for å sikre at forskrivningen skjer i samsvar med de krav som er stilt i blåreseptforskriften.
Utvalgets medlem, Haug, vil peke på at hovedhensikten med et slikt system må være å gi forskriverne konstruktiv tilbakemelding med tanke på å utvikle riktigere forskrivningspraksis.
5. Utvikling av edb-baserte sykdomshåndteringsmoduler
Myndighetene må utvikle edb-baserte sykdomshåndteringsmoduler, basert på produsentuavhengig informasjon. Edb-baserte sykdomshåndteringsmoduler er kliniske beslutningsstøttesystemer som leder legen gjennom en diagnostisk sjekkliste som kan ende opp med en terapianbefaling. En rekke store legemiddelprodusenter utvikler nå slike kliniske beslutningsstøttesystemer. Utvalget mener at myndighetene i langt sterkere grad må ta ansvar for å utvikle slik informasjon, gjerne i samarbeid med legemiddelindustrien. Dette arbeidet må ta utgangspunkt i det arbeid Statens legemiddelkontroll gjør med terapiverksteder i dag, og den erfaring Norges forskningsråd har med bruken av konsensuskonferanser for å påvirke klinikernes beslutninger.
6. Krav til produsentene om legemiddeløkonomiske analyser
Utvalget foreslår at produsentene må begrunne søknader om refusjonsberettigelse for nye legemidler gjennom legemiddeløkonomiske evalueringer, der en sammenligner nytte og kostnader ved det legemidlet det søkes refusjon for, med andre aktuelle alternativer. Undersøkelsene må gjøres med utgangspunkt i et sett av veiledende retningslinjer, utarbeidet av myndighetene. Retningslinjene må ta utgangspunkt i internasjonal litteratur og erfaring på området. Kravet om gjennomføring av legemiddeløkonomiske studier må innføres gradvis i takt med at det bygges opp faglig kompetanse på området legemiddeløkonomi.
7. Utvidelser av retten til refusjon
Utvalget foreslår at folketrygden skal dekke utgifter til kostbare legemidler til kortvarig behandling av alvorlig sykdom. Det bør opprettes en egen paragraf i forskriften med en tilhørende liste over slike sykdommer og korresponderende legemidler. Pasienter med sjeldne diagnoser bør få samme mulighet til å få sine utgifter dekket som pasienter med alminnelige sykdommer.
Utvalgets medlem, Skancke, kan ikke slutte seg til utvalgets forslag om utvidelse av retten til refusjon, både når det gjelder svekkelse av varighetskriteriet og refusjon for pasienter med sjeldne diagnoser med behov for rimelige legemidler (forskriftens § 2). Flertallets forslag er i stor grad en følge av et likhetsprinsipp som presenteres som det overordnede målet for prioritering i det norske helsevesenet. Likhetsprinsippet som er lagt til grunn må forstås som at alle pasienter og pasientgrupper i utgangspunktet skal ha den samme mulighet til å få sine helseutgifter dekket av fellesskapet. Dette medlemmet kan ikke se at dette skal ha vært eller bør være det overordnede målet for prioriteringer i helsevesenet. Prioritering innebærer å forskjellsbehandle ulike tilfeller, men i bl.a. det norske helsevesenet under forutsetning av at pasienter med samme sykdom eller lidelse har samme tilgang til tjenester og legemidler uavhengig av bosted, inntekt m.v. De avgrensningene som er foretatt i gjeldende blåreseptordning er uttrykk for en slik ønsket prioritering. Likebehandling av egenbetaling for medisiner mellom kortvarige, enkeltstående tilfeller og kronisk sykdom er utilrådelig som prinsipp for ressursbruk. Likebehandling mellom billige medisiner, er som skjermingsprinsipp svakt begrunnet.
Flertallets forslag innebærer en utvidelse av dagens blåreseptordning og således økte utgifter innenfor denne. Dette medlemmet kan ikke se at verken effektivitets- eller fordelingshensyn kan begrunne en slik utvidelse. De berørte pasientene vil også uten refusjon benytte disse legemidlene, og uten at de over tid får noen merkbar økonomisk belastning. Refusjon på blå resept bør fortsatt forbeholdes pasienter som har behov for langvarig medikasjon, og i henhold til en spesifisert liste over sykdom/legemidler. Som i dagens ordning vil en fortsatt kunne behandle individuelle tilfeller særskilt.
8. Innføring av generisk substitusjon
Utvalget foreslår at det åpnes for generisk substitusjon av legemidler i apotek i samråd med pasienten. Legene må gi aktivt beskjed på resepten dersom det ikke skal tillates generisk substitusjon. Tilsvarende må legen aktivt gi beskjed på resepten dersom det ikke skal benyttes parallellimporterte legemidler. Innføring av generisk substitusjon vil etter utvalgets mening gjøre det lettere for pasientene å få utlevert rimeligste synonyme eller parallellimporterte preparat. Det vil også forenkle utleveringsprosedyren i de tilfeller apoteket er utsolgt for et bestemt synonympreparat.
Utvalgets medlemmer, Cameron og Heimdal, vil peke på at generisk substitusjon ikke vil innebære økonomiske gevinster av betydning for refusjonsordningene og således ikke er et særlig relevant virkemiddel vurdert ut fra innsparingshensyn. Nå det gjelder forholdet til pasientene, innebærer generisk substitusjon at disse derigjennom føres inn i en juridisk gråsone med hensyn til den beskyttelse de har gjennom produktansvarslovgivningen. Denne lovgivningen pålegger produsenten et klart ansvar gitt at forskrivende lege er ansvarlig for preparatvalg og at apoteket gjøres ansvarlig for utlevering av det forskrevne preparat i henhold til legens instrukser. Fravikes denne ansvarskjeden, kan det reises tvil om produktansvarslovens anvendelse. Derigjennom risikeres også at pasientens lovfestede beskyttelse forringes.
9. Brukerrettet informasjon
Utvalget foreslår at Rikstrygdeverket må utvikle brukerrettet informasjon til pasient, lege og apotek om hvilke rettigheter og begrensninger som ligger i blåreseptordningen og bidragsordningen, og hvilke prosedyrer som gjelder for søknader etter unntaksbestemmelsene. Det er også nødvendig at legene har mulighet til å holde seg oppdatert om legemiddelpriser gjennom edb-baserte prisregistre. Rikstrygdeverket bør bl.a. vurdere om det bør etableres et nyhetsblad om blåreseptordningen til utlevering på apotek og trygdekontorer.
10. Krav om forskrivning av startpakninger
Utvalget foreslår at det innføres krav om forskrivning av startpakninger ved oppstart av langvarig behandling. Startpakninger bør være mindre enn ordinære pakninger, slik at legen kan forsikre seg om at pasienten tåler legemidlet, før det skrives ut større kvantum. Det bør stilles krav om at legemiddelprodusentene skal levere startpakninger.
11. Forholdet mellom legemidler i og utenfor institusjon
Utvalget foreslår at det gis anledning til at det i sykehusavdeling hvor pasienten er innlagt, eventuelt ved korttids-/avlastningsopphold i sykehjem, kan brukes av pasientens blåreseptinnkjøpte legemidler de første dagene dersom avdelingen ikke har det aktuelle legemiddel for hånden.
12. Utredning av terapeutisk referanseprisystem
Utvalget foreslår at mulighetene for å innføre et terapeutisk referanseprissystem for ulike grupper av legemidler utredes. Terapeutiske referansepriser kan være en metode for å få en kostnadseffektiv bruk av legemidler. Legitimiteten av et terapeutisk referanseprissystem vil avhenge av kvaliteten på de medisinsk-faglige vurderinger som legges til grunn for refusjon. Det er derfor viktig at man trekker på den beste medisinsk-faglige kompetansen på de terapiområdene som velges.
13. Innføring av like egenandeler
Utvalget foreslår at det innføres den samme prosentvise egenandel til legemidler på blå resept for alle. Høy alder tilsier ikke isolert sett at man har et større behov for å få dekket sine legemiddelutgifter enn andre grupper som bruker mye legemidler. Innføring av lik egenandel for alle, f.eks. på 20 eller 25 pst, vil gjøre egenandelssystemet enklere og mer oversiktlig ved at alder fjernes som kriterium for refusjonsgrad. Kostnadstaket pr. resept bør i så fall være på ca. 200-250 kroner. Hensynet til storforbrukere av legemidler vil fortsatt være ivaretatt gjennom skjermingsordningen, som sikrer alle gratis legemidler når egenandelene overskrider en viss grense. Det foreslås ingen endring i forhold til de grupper som er fritatt fra egenandeler i dag.
Utvalgets medlem, Skancke, slutter seg til utvalgets forslag om at det innføres samme prosentvise egenandel til legemidler for alle (barn 0-7 år fortsatt unntatt). Alderpensjonistene representerer en stadig mer velstående gruppe og høy alder bør ikke lenger tilsi lavere egenandel. Dette medlemmet kan imidlertid ikke se at redusert egenandel for personer under 67 år er noe riktig signal å gi, og vil derfor foreslå at den fellesegenandelen settes lik 36 pst. og maksimalt 330 kroner pr. resept.
14. Bruk av dosedispensering
Utvalget foreslår at refusjonsordningen må bidra til dekning av utgifter til dosedispensering. Dosedispensering innebærer at pasienten får utlevert nøyaktig det antall tabletter som vedkommende trenger i den angitte periode. Det egner seg særlig godt for pasienter som har problemer med å holde styr på når de skal bruke sine legemidler og hvor mye. Besparelser vil i første rekke kunne skje gjennom redusert svinn, og ved å lette administreringen av legemidler til pasientene.