3 Legemiddelpolitikken og folketrygdens godtgjørelse av utgifter til legemidler
3.1 INNLEDNING
Offentlig subsidiering av utgifter til legemidler skal dekke viktige helse- og velferdspolitiske mål. Ved at legemidler subsidieres blir legemidlene tilgjengelige ved behov, og tilgangen gjøres uavhengig av brukernes betalingsevne, bosted og sosiale status. Refusjonsordninger er et velferdsgode og en rettighet for pasienten, og skal også bidra til riktig legemiddelforbruk i befolkningen. Det offentlige subsidierer forbruk av legemidler gjennom flere ordninger. Enkelte av disse omfatter legemidler spesielt, mens andre er mer generelle bestemmelser som dekker legemidler og andre tjenester. Den eldste stønadsordningen er retten til full godtgjørelse av utgifter til legemidler ved yrkesskade, jf. nå folketrygdloven § 2-7. Den mest omfattende er ordningen med godtgjørelse av utgifter til viktigere legemidler etter folketrygdloven § 2-5, den såkalte blåreseptordningen. Ca. 80 pst av reseptforskrivningen utenfor institusjon dekkes av blåreseptordningen.
Formålet med dette kapitlet er å beskrive legemiddelpolitikkens hovedaktører og å gjøre rede for hovedtrekkene ved dagens refusjonsordninger. Hva var de viktigste hensynene da ordningene ble innført, og gjelder disse fortsatt? Hvordan kommer legemidler inn på ordningen med blå resept? Hva slags rolle og ansvar har legemiddelpolitikkens ulike aktører i denne opptaksprosessen? Kapitlet gir også en oversikt over hvordan de norske ordningene skiller seg fra tilsvarende ordninger i andre land. I tre vedlegg er det gitt mer omfattende oversikter både av den historiske utviklingen, pris- og refusjonssystemer i andre land, og av kostnadsutviklingen i folketrygdens utgifter.
3.2 LEGEMIDDELPOLITIKKENS AKTØRER
En rekke aktører er opptatt av legemiddelpolitikken og vilkårene for offentlig refusjon av utgifter til legemidler. Brukerne er først og fremst pasientene som ønsker effektive legemidler til lavest mulig pris for dem selv, og legene som forskriver dem. Et karakteristisk trekk ved pasientene er at de har liten mulighet til å vurdere legemidlenes kvalitet og deres effekt. Legene, særlig i primærhelsetjenesten, opptrer derfor ofte som markedsadvokater for pasienten. Helsepersonell ser på legemidler som ett blant flere tiltak for å møte pasientenes behov. Bruk av legemidler kan i mange tilfeller være eneste adekvate behandling, eller de kan komplementere ikke-medikamentelle tiltak. De kan også redusere behovet for andre helsetjenester, f.eks. enkelte kirurgiske inngrep. Produsentene er nasjonale, internasjonale eller multinasjonale selskaper med private eiere og eierinteresser. Legemiddelbransjen er utpreget internasjonal, og utenlandske produsenter står for 85 pst av legemiddelomsetningen i Norge. På dette punkt skiller legemidler seg fra resten av helsetjenesten som i hovedsak produseres innenlands. Mer enn 90 pst av nye produkter utvikles gjennom legemiddelfirmaenes egne forsknings- og utviklingsaktiviteter. Distribusjon av legemidler skjer gjennom grossister og apotek. Apotekene har ansvar for sikker ekspedisjon av legemidler til den enkelte pasient, og bidrar til riktig og forsvarlig legemiddelbruk bl.a. gjennom informasjon.
Myndighetene har stor innvirkning på rammebetingelsene både for brukerne og produsentene. Legemiddelmarkedet er sterkt regulert. Grafisk kan en illustrere legemiddelpolitikkens ulike aktører ved figur 3.1.
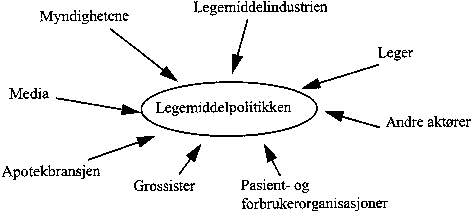
Figur 3.1 Legemiddelpolitikkens aktører
3.2.1 Myndighetene
I forhold til mange andre markeder skiller legemiddelmarkedet seg ut med omfattende offentlig styring av hvilke legemidler som blir tillatt solgt, legemiddelpriser, refusjonsordninger.
Når myndighetene griper inn i et marked er det gjerne ut fra den oppfatning at en regulert løsning er mer i samfunnets interesser enn løsninger som det frie marked genererer. Offentlig inngripen på legemiddelmarkedet begrunnes særlig med hensynet til at man vil ha garanti for at alle legemidler som kommer på markedet har tilfredsstillende kvalitet, sikkerhet og effekt. Hvert av disse vilkårene vurderes derfor nøye før et legemiddel blir formelt godkjent. Før et legemiddel kan markedsføres må preparatets navn, pakningsstørrelse, teknisk utstyr, emballasje, merking, pakningsvedlegg og preparatomtale være godkjent. I tillegg til målsettingen om å sikre kvalitet, sikkerhet og effekt, er et viktig motiv for offentlig inngripen i markedet at man vil sikre brukerne rimelig tilgjengelighet til legemidler. Dette skjer både gjennom offentlig regulering av distribusjons- og omsetningskanaler og gjennom offentlige refusjonsordninger. Ansvaret for gjennomføringen av legemiddelpolitikken er fordelt på forskjellige offentlige institusjoner og instanser.
Sosial- og helsedepartementet
Sosial- og helsedepartementet er den overordnede instans for landets legemiddelpolitikk, og er således ansvarlig for gjennomføringen av den samlede politikken på området. Statens legemiddelkontroll, Statens helsetilsyn og Rikstrygdeverket er alle underlagt Sosial- og helsedepartementet. Departementets oppgaver knytter seg bl.a. til de budsjettmessige og politiske sider ved refusjonsordningene, og til vedtak om refusjon. Departementets trygdeavdeling har ansvaret for regelverket, mens helseavdelingen har det faglige og økonomiske ansvaret for trygdens tilskuddsordninger til legemidler. Sosial- og helsedepartementet er klageinstans for vedtak fattet av Rikstrygdeverket, Statens legemiddelkontroll og Statens helsetilsyn.
Rikstrygdeverket
Rikstrygdeverket har et lovbestemt ansvar for folketrygdens refusjonsordning for legemidler og sykepleieartikler. Ansvaret innebærer bl.a:
Forberedelse og iverksetting av endringsforslag i folketrygdloven og forskrifter for godtgjørelse av utgifter til viktigere legemidler
Utredning, vurdering og rådgivning overfor departementet med hensyn til hvilke legemidler og sykepleieartikler som bør refunderes på blå resept
Administrasjon av unntaksbestemmelsene (§ 2 og § 10 annet ledd) om refusjon for legemidler som ikke er tatt opp i preparatlisten til § 9
Prisforhandlinger om sykepleieartikler
Kontroll med at refusjonsordningene praktiseres i samsvar med regelverket
Fastsettelse av retningslinjer for bidrag til legemidler mv. etter folketrygdloven § 2-13
Informasjon om stønadsordningene
Statistikk
Budsjettmessig oppfølging av utgifter til nye og dyre legemidler
Statens legemiddelkontroll
Statens legemiddelkontroll (SLK) har ansvaret for godkjenning av legemidler med henblikk på deres kvalitet, sikkerhet og effekt, og å utstede markedsføringstillatelse for legemidler og andre nærmere angitte stoffer og produkter. Det tilligger også institusjonen å klassifisere hva som er legemidler. I forbindelse med godkjenningen fastsettes utleveringsbestemmelser og forskrivningsregler. SLKs ansvar omfatter også medisinsk og kvalitetsmessig overvåking av legemidler som er godkjent, tilsyn med legemiddelreklame, og fastsettelse av maksimal utsalgspris for reseptbelagte legemidler. Formidling av produsentuavhengig produktinformasjon om nye legemidler og av ny viten om kjente legemidler, samt informasjon om riktig og rasjonell bruk av legemidler er andre prioriterte oppgaver. I forbindelse med refusjonsspørsmål har SLK en seksjon for legemiddeløkonomi som skal bidra med:
kartlegging av trygdens merkostnader ved stillingtaken til utgiftsrefusjon for nye legemidler
gjennomføring av helseøkonomiske analyser i forhold til alternativ behandling
forvaltning av prisforskriften ved fastsettelse av maksimal apotekinnkjøpspris på legemidler
initiering av faglige konsensuskonferanser om bruk av legemidler
løpende kontroll med utgifter til nye legemidler
Statens helsetilsyn
Statens helsetilsyn har det sentrale tilsynsansvaret for hele produksjons- og distribusjonskjeden for legemidler. Kjeden omfatter bl.a. produksjonsbedrifter, grossister, import- og eksportvirksomhet, apotek og eventuelt andre som gis tillatelse til omsetning av legemidler. Statens helsetilsyn og fylkeslegene er tillagt faglig tilsyn med all helsetjeneste og alt helsepersonell, herunder hvordan legemidler brukes som helsetjeneste. Tilsynsansvaret omfatter også legers forskrivning av legemidler og håndtering av legemidler i institusjon. I refusjonssammenheng er Statens helsetilsyns oppgaver å vurdere rettferdighets- og tilgjengelighetsaspekter for pasienter, og å gi råd til Sosial- og helsedepartementet på forespørsel. Et spesielt ansvar ligger i tilsynet med narkotiske og vanedannende legemidler (henholdsvis A- og B-preparater).
3.2.2 Legemiddelindustrien
Legemiddelindustrien er en sammensatt bransje som spenner fra høyteknologiske og forskningsbaserte selskaper, til bedrifter som baserer seg på fremstilling av legemidler med utløpt patent (synonympreparater/generika). Bransjen er svært internasjonal. I Norge er et førtitalls norske og utenlandske legemiddelbedrifter organisert i Legemiddelindustriforeningen, som er farmasøytisk industris bransjeforening. Myndighetenes refusjonspolitikk er en sentral rammebetingelse for legemiddelbedriftene. Det samme gjelder prosedyrer for godkjenning av legemidler, vilkår for utstedelse av markedsføringstillatelse, bestemmelser om prisfastsettelse, patentregler og reklamebestemmelser.
Legemiddelindustrien genererer både kostnader og inntekter for samfunnet. På den ene siden betaler samfunnet store summer for nye legemidler. På den andre siden kan land med stor farmasøytisk industri høste inntektene av farmasøytisk industris virksomhet gjennom skatter, avgifter og arbeidsplasser. Legemiddelindustrien står for en omfattende aktivitet når det gjelder faglig oppdatering av norske leger, bl.a. i form av kurs og seminarer. Enkelte produsenter tar også i bruk ny informasjonsteknologi, bl.a. såkalte edb-baserte diagnoseverktøy. Dette er egne dataprogrammer som skal være et verktøy for leger til å stille riktige diagnoser. Både informasjons- og etterutdanningsvirksomhet er en del av bedriftenes markedsføringsstrategier.
3.2.3 Legemiddelimportører og grossister
Parallellimport av legemidler ble tillatt i Norge fra 1. januar 1994, og for legemidler med gyldig patent fra 1. januar 1995. Med EØS-avtalen mistet det statlige aksjeselskapet Norsk Medisinaldepot AS (NMD) sin enerett til innførsel og engrosomsetning av legemidler. I løpet av 1995 og 1996 er det fire parallellimportører som har fått godkjent preparater ved Statens legemiddelkontroll. I 1995 ble det gitt 220 markedsføringstillatelser for parallellimporterte preparater og ca. 100 preparater er markedsført.
Fra 1. november 1995 har det vært tre grossistforetak på det norske markedet. Disse er Norsk Medisinaldepot AS, Holtung AS og Ada. Grossistene må som hovedregel føre det utvalg av legemidler som etterspørres i det norske markedet, og kunne levere hvor som helst i landet innen 24 timer. Med EØS-avtalen ble det også tillatt for firmaer med tilvirkertillatelse innen EØS-området å opptre som grossister for egne produkter.
Norsk Medisinaldepot har historisk sett hatt en viktig helsepolitisk funksjon. De viktigste helsepolitiske målsettinger for NMDs virksomhet var å sikre forsyningene av legemidler på landsbasis. I tillegg har selskapet utført visse forvaltningsoppgaver for myndighetene. Ved omdannelsen av NMD til statlig aksjeselskap fra 1. januar 1993, ble funksjonene i hovedsak videreført, men organisert og finansiert på en annen måte.
3.2.4 Apotek
Lovverket gir apotekene enerett til salg av legemidler til publikum, og omsetningen skjer både gjennom private apotek og offentlige sykehusapotek. Apotekenes enerett omfatter både reseptfrie og reseptpliktige legemidler. Eneretten er ikke berørt av EØS-avtalen. Apotek er enten privat eid eller eid av fylkeskommuner eller staten (fylkeskommunale og statlige sykehusapotek), og det kreves bevilling fra Statens helsetilsyn for å drive apotek.
Et apotek har som sin hovedoppgave å yte farmasøytiske tjenester til brukerne (helseinstitusjoner, helsepersonell og enkeltpersoner), samt å bidra til at hele befolkningen har tilgang på legemidler. Apotekene deltar i det generelle helseopplysnings- og servicearbeidet, og skal medvirke til rasjonell bruk av legemidler. Apotekene har leveringsplikt for alle legemidler på det norske markedet. Dersom apoteket ikke har et legemiddel som er forskrevet på resept, skal det skaffes til veie så raskt som mulig. Apotekene utfører et betydelig arbeid i forbindelse med kontroll og administrasjon av blåreseptordningen.
3.2.5 Legene
Legen har en sentral rolle i legemiddelmarkedet. Retten til å forskrive legemidler til mennesker er i hovedsak forbeholdt legestanden. Ettersom pasientene ofte har begrenset kunnskap om sin sykdom og hvilke behandlingstiltak som er aktuelle, opptrer legen som rådgiver, og i praksis ofte beslutningstaker for pasienten. Valg av legemiddel skjer således etter en medisinsk-faglig vurdering og er i hovedsak overordnet pasientenes egne vurderinger. Legen må også vurdere om kriterier knyttet til folketrygdens refusjon av utgifter til legemidler er oppfylt før det forskrives på blå resept.
Leger i Norge er ofte godt orientert om nyheter og fremskritt på legemiddelområdet, dels gjennom etterutdanning, tidsskrifter og kolleger, og dels gjennom legemiddelindustriens markedsføringsaktiviteter. Nye behandlingsprinsipper og legemidler tas ofte raskt i bruk etter at de er kommet på markedet. Allmennpraktikerne står for størsteparten av legemiddelforskrivningen i primærhelsetjenesten.
Nye legemidler er betydelig dyrere enn eldre. Undersøkelser indikerer at leger har lite kunnskap om relative prisforskjeller mellom behandlingsalternativer. Samtidig har legene plikt til å påse at de ikke påfører folketrygden og pasientene unødvendige kostnader, jf. legeloven § 29.
3.2.6 Pasient- og forbrukerorganisasjoner
Pasientens behov for legemidler oppstår som regel ved sykdom eller når helsen er truet eller utsatt. I dagens samfunn er pasienter bedre organisert enn før, bl.a. gjennom pasientorganisasjoner. Pasientorganisasjonene spiller en viktig rolle i forbindelse med informasjons-, opplærings- og veiledningstiltak overfor sine medlemmer. De kan også opptre som pasientenes talerør overfor myndighetene, bl.a. i spørsmål om fordelingen av offentlige helsekroner, og er således også en viktig pressgruppe.
Pasientorganisasjoner og legemiddelbedrifter kan ha sammenfallende interesser når det gjelder refusjon av utgifter til legemidler, og det har forekommet at pasientorganisasjoner har vært opprettet med støtte av legemiddelbedrifter. I de senere år har har allianser mellom pasientgrupper og legemiddelindustri bidratt til at nye sykdomsgrupper/legemidler blir refundert over folketrygdens budsjett, f.eks. medikamentell behandling for kolesterol og migrene.
3.2.7 Media og lobbyorganisasjoner
Media bidrar vesentlig til at legemiddelspørsmål ofte står høyt på den politiske dagsorden. At et legemiddel får stor mediaoppmerksomhet kan bidra til at det skapes urealistiske forventninger om behandlingseffekt, og krav om at utgiftene skal refunderes av det offentlige. I de senere år har også enkelte andre former for opinionspåvirkning vært i bruk på legemiddelfeltet, særlig bruken av firmaer som har spesialisert seg på samfunnskontakt og lobbyvirksomhet. Firmaene arbeider bl.a. for å få media og politikere til å fatte interesse for spesielle pasientgrupper og legemidler, for f.eks. å skape press for å få spesielle medikamenter tatt opp på blåreseptlisten. Firmaene arbeider på oppdrag av de enkelte legemiddelselskapene.
3.2.8 Tredjepartsfinansiering og legemidlenes markedstriangel
Refusjonsordningene på legemiddelfeltet finansieres av folketrygden, og fungerer som en slags forsikringsordning som dekker store deler av enkeltindividenes utgifter til legemidler. En slik forsikringsordning kalles ofte tredjepartsfinansiering.
I ordinære markeder er det vanligvis to hovedtyper av aktører; produsenter og konsumenter. Produsentene leverer varer og tjenester, og konsumentene betaler for bruk av disse varene og tjenestene til produsentene. Behov for legemidler inntreffer imidlertid ofte tilfeldig, og utgiftene ved sykdom vil lett kunne bli større enn den enkelte kan bære. Refusjonsordningene er offentlige velferdsordninger som bl.a. innebærer at en tredje part, folketrygden, sikrer den enkelte nødvendig tilgang til legemidler. Det er i hovedsak legene som foretar valg av legemidler på pasientens vegne. Figuren nedenfor kalles legemidlenes markedstriangel, og illustrerer forholdet mellom konsumentene (pasienter), leverandørene, offentlige myndigheter og legene.
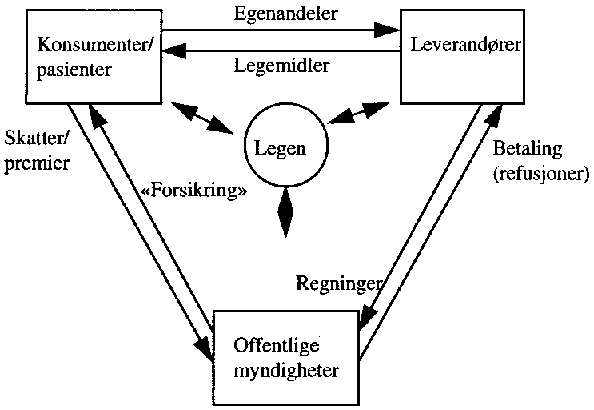
Figur 3.2 Tredjepartsfinansiering og legemidlenes markedstriangel
Tredjepartsfinansieringen reduserer pasientenes og legenes insentiver til sparsommelig bruk av offentlige legemiddelressurser. Det er i første rekke den tredje aktøren, folketrygden, som blir belastet med de økonomiske konsekvensene av legens og brukerens valg med hensyn til legemiddel. Når en tredjepart uten innflytelse på forbruket står for finansieringen, vil en generelt kunne forvente økt etterspørsel etter den aktuelle tjenesten. Hensikten med innføring av prosentvis egenbetaling, krav til forskrivning av billigste synonympreparat og referanseprissystemet, var bl.a. å stimulere til større prisbevissthet hos pasienter og leger.
Sykehus må kjøpe inn legemidler innenfor budsjettrammer gitt av sykehuseier, oftest fylkeskommunen eller staten, gjerne etter råd og retningslinjer fra en legemiddelkomité. Fylkeskommunene, med unntak av Sogn- og Fjordane og Oslo, har fra 1995 inngått et treårig prøveprosjekt med samarbeid om innkjøp av legemidler til sykehus, Legemiddel Innkjøp Samarbeid (LIS). Samarbeidet har ført til innsparinger i sykehusenes legemiddelbudsjetter.
3.3 FOLKETRYGDENS FORSKJELLIGE STØNADSORDNINGER - ET HISTORISK PERSPEKTIV
Folketrygden har forskjellige stønadsordninger som skal sikre befolkningen mulighet for medikamentell behandling ved sykdom gjennom refusjon for utgiftene til legemidler.
Den eldste av disse er retten til full godtgjørelse av utgifter til legemidler ved yrkesskade, jf. nå folketrygdloven § 2-7.
Den mest omfattende er ordningen med godtgjørelse av utgifter til viktigere legemidler etter loven § 2-5 - den såkalte «blåreseptordningen».
Videre foreligger det adgang til å yte bidrag til legemidler etter retningslinjer fastsatt av Rikstrygdeverket i medhold av folketrygdloven § 2-13, den såkalte «bidragsordningen».
Endelig har det frem til 1996 vært adgang til å yte grunnstønad etter § 8-2 bokstav a, til den som på grunn av varig sykdom, skade eller lyte har ekstrautgifter til medisiner som ikke dekkes pliktmessig etter § 2-5. Denne muligheten har nå falt bort.
Det er forskjellige målsettinger og prinsipper som ligger bak de ulike ordningene. Prinsippene ble fastsatt da ordningene ble innført og gjelder i hovedsak uendret selv om det selvsagt har skjedd en utvikling og blitt gjort endringer og modifikasjoner i takt med den generelle samfunnsutvikling.
I 1997 er det 44 år siden det ble inntatt allmenne bestemmelser i trygdelovgivningen om pliktmessig dekning av utgifter til livsviktige legemidler ved behov for langvarig legemiddelbehandling. Ordningen trådte i kraft høsten 1953, og besto i en prosentvis refusjon av utgifter utover et minstebeløp. Som hovedregel måtte behandlingen være instituert på sykehus eller av spesialist. Tidligere var det bare visse yrkesbetingede sykdommer som ga rett til trygdemessig dekning av legemiddelutgifter (i kraft fra 1911). Forut for lovgivningen i 1953 hadde det imidlertid vokst frem en del skjønnsmessige bidragsordninger. I tiden etter har det funnet sted hyppige regelendringer og justeringer, men ingen grunnleggende endring av systemet.
Forutsatt at visse betingelser for en sykdoms alvorlighetsgrad og varighet var oppfylt, gjaldt det fra sommeren 1960 og ut 1980 at trygden dekket utgiftene til legemidlene omfattet av ordningen fullt ut. I 1966 ble reglene som begrenset adgangen til å instituere refusjonsberettiget behandling oppmyket slik at ikke-spesialister fikk hånd om en langt større del av forskrivningen. Omtrent på samme tid ble også billigere preparater inntatt på listen. Det offentlige overtok på denne måten så godt som alle utgifter til viktig medikasjon for en stor gruppe langvarige lidelser.
I takt med den generelle velstandsutvikling som fant sted etter den annen verdenskrig, hadde det oppstått en rekke forskjellige ordninger for sosiale goder som f.eks. offentlige pensjoner og forsikringsordninger. Et ønske om samordning av administrasjon og finansiering av de ulike ordningene førte til innføring av folketrygdloven i 1966. Syketrygdloven ble inkorporert i lov om folketrygd i 1971.
Fra 1981 ble det igjen innført et begrenset privatøkonomisk delansvar for legemidler med en fast egenandel for voksne. Barn og pensjonister ble unntatt i første omgang, men fra 1984 ble det innført halv egenandel for disse. I 1984 ble ordningen med et felles årlig utgiftstak for egenandeler innført. Hensikten var å skjerme storforbrukerne av bl.a. legemidler mot for høye totalutgifter til visse helsetjenester. Fra 1989 ble det innført prosentvis egenandel på legemidler refundert av folketrygden. Fra 1991 ble det innført en bestemmelse i forskriftene som oppfordret legen til å forskrive det billigste synonympreparat dersom ikke tungtveiende grunner tilsier noe annet. I 1992 ble oppfordringen erstattet med et påbud til legen om å forskrive billigste synonympreparat. I 1993 ble det innført et referanseprissystem for synonyme legemidler. Dette innebar at trygden ga den samme refusjon for alle legemidler i samme synonyme gruppe, uavhengig av legemidlets pris.
Nedenfor følger en kort oversikt over den historiske utviklingen knyttet til viktige årstall. Det vises til vedlegg I for en mer fullstendig historisk beskrivelse av fremveksten av våre offentlige refusjonsordninger for legemidler.
1911: Lov om sykeforsikring, hvor ellers kredssykekassen skulle yte de legemidler som var nødvendig for å behandle yrkesskader. Det ble for øvrig ikke gitt pliktmessig godtgjørelse for utgifter til legemidler utenfor sykehus.
1927: Spørsmål om å innføre pliktmessig ytelse for godtgjørelse av utgifter til medisin er for første gang drøftet i Innstilling II av 1927 fra den departementale sykeforsikringskomite.
1935: Sosiallovskomiteen drøftet i Innstilling VI av 1935 spørsmålet om å innføre pliktmessig ytelse av utgifter til medisin. Et flertall av medlemmene mener trygdekassene bør kunne pålegges å refundere livsviktig medisin, som f.eks. insulin og leverpreparater.
1939: Sosialkomiteens innstilling med forslag til ny lov om syketrygd ble oversendt Sosialdepartementet, men ble ikke fremmet for Stortinget.
1952: Genèvekonvensjon nr. 102 av 1952, hvor det fremgår at utgifter til viktige medisiner hører med til minimumsfordringene til en syketrygd.
1953: Ot.prp. nr. 56 av 1953 ang. endringer i lov om syketrygd av 6. juni 1935. Det fremgår her at Rikstrygdeverket ikke mente det burde innføres godtgjørelse for all medisin, men ordningen begrenses til å omfatte livsviktige og kostbare medisiner ved nærmere angitte sykdommer.Lovendring blir så fattet 17. juli 1953. Endringen innebærer at trygdekassen, jf. syketrygdloven § 13, annet ledd B, skal yte bidrag til livsviktige legemidler (særskilt liste) i forbindelse med behandling av nærmere angitte kroniske sykdommer (35 diagnoser).Sykekassene hadde før dette ingen plikt til å dekke utgiftene til medisiner med unntak for i forbindelse med yrkesskade. De hadde imidlertid adgang til å gjøre det, og flere hadde fond som de brukte til å dekke 50 pst av utgiftene til livsviktige medisiner (videreført som del av bidragsordningen, jf. folketrygdloven § 2-13).
1955: I Ot.prp. nr. 52 av 1955 fremgår det at man er i tvil om «livsviktige legemidler» er det rette begrepet. Spørsmålet er drøftet utførlig.
1956: Ny syketrygdlov ble vedtatt 2. mars 1956. Etter lovens § 31 punkt 4 lød det nå: «viktigere legemidler etter liste, regler og takster som fastsettes av departementet». Ordningen videreføres for øvrig.
1960: Fra 1. juli 1960 ble det fastsatt nye forskrifter i medhold av syketrygdloven av 1956 (blåreseptordningen).
1961: Adgang til å yte stønad til dem som hadde ekstrautgifter pga. uførhet etter lov om uføretrygd.
1966: Folketrygdloven vedtas.
1971: Refusjonsordningene inkorporeres i Folketrygden. Dette var en teknisk inkorporering som ikke tok sikte på materiellrettslige endringer i refusjonsordningene for legemidler.
1981: Innføring av fast egenandel for voksne for refusjonsberettigede preparater. Med unntak for barn og pensjonister. Innføring av ordningen med tildeling av frikort (skjermingsordningen) når samlede egenandeler for visse helsetjenester overstiger et fastsatt beløp.
1984: Innføring av fast men lavere egenandel også for barn og pensjonister.
1989: Innføring av prosentvis egenandel.
1991: Det ble innført en bestemmelse i forskriftene som oppfordret legen til å forskrive det billigste synonympreparat dersom ikke tungtveiende grunner tilsier noe annet. Barn under 7 år ble fritatt for egenandeler i helsetjenesten.
1992: Oppfordringen fra 1991 ble erstattet med et påbud til legen om å forskrive billigste synonympreparat.
1993: Innføring av et referanseprissystem.
3.4 DAGENS STØNADSORDNINGER FOR LEGEMIDLER I NORGE
Folketrygdens refusjonsordninger for legemidler er hjemlet i kapittel 2 i folketrygdloven. I det følgende beskrives innholdet i folketrygdens ulike stønadsordninger.
3.4.1 Folketrygdloven § 2-5 - «Blåreseptordningen»
I henhold til Forskrifter om godtgjørelse av utgifter til viktigere legemidler, fastsatt med hjemmel i folketrygdloven § 2-5 nr. 3 bokstav a, ytes godtgjørelser av utgifter til viktigere legemidler ved behandling av nærmere angitte sykdommer. I det følgende omtales hovedtrekkene ved forskriften.
Forskriftens § 1 - hovedregelen for refusjon
Folketrygden yter godtgjørelse for utgifter til enkle preparater som inngår i de medikamentgrupper som er nevnt i forbindelse med den enkelte sykdom i listen i § 9. Det ytes også godtgjørelse for utgifter til sammensatte preparater, hvis disse bare inneholder medikamenter som er nevnt i samband med vedkommende sykdom. Ved de sykdommer som er nevnt i § 9, jf. § 2, ytes godtgjørelse bare hvis det er på det rene at sykdommen er gått inn i en langvarig fase og legen har overbevist seg om at det er behov for langvarig medikasjon.
Utgifter til viktigere legemidler refunderes ved behandling av nærmere angitte sykdommer, jf. omtale av sykdoms- og preparatlisten nedenfor. Hovedregelen for å få refusjon finnes i forskriftens § 1. Her stilles krav om at sykdommen er gått inn i en langvarig fase og legen har overbevist seg om at det er behov for langvarig medikasjon. Med langvarig forstås i praksis at pasienten må ha behov for medikamentell behandling i minst 3 måneder i løpet av et år, enten sammenhengende eller i form av gjentatte, korte kurer for den samme sykdommen. Dette kan være særlig aktuelt ved stadig residiverende infeksjoner eller ved sykdommer hvor plagene varierer over tid.
Kortvarig behandling gir ikke rett til refusjon, selv om det dreier seg om meget kostbare legemidler. Det er gjort unntak for legemidler til bruk mot en del smittsomme sykdommer.
Reseptfrie legemidler og handelsvarer refunderes som hovedregel ikke. Forskriften omfatter heller ikke homøopatpreparater, vanedannende legemidler (unntatt ved organisk hjernelidelse/epilepsi) eller legemidler som brukes diagnostisk. Legemidler gitt i sykehus eller sykehuspoliklinikk eller sykehjem/aldershjem dekkes av institusjonen.
Blå resepter etter § 9 skal skrives ut av lege, og kan ekspederes ved apotek uten forhåndsgodkjenning fra trygdekontoret.
Forskriftens § 9 - sykdoms- og preparatlisten
De sykdommer som omfattes av blåreseptordningen er listet opp i forskriftens § 9. Listen omfatter i dag 40 kroniske sykdommer eller sykdomsgrupper, og de preparatgrupper som er refusjonsberettiget ved den enkelte sykdom. Refusjonsberettigelse for det enkelte legemiddel avhenger av at det står oppført på en særskilt preparatliste utarbeidet av Rikstrygdeverket, og som distribueres til apotek og trygdekontor. Preparatlisten ajourføres etter hvert som nye preparater godkjennes for refusjon eller tidligere oppførte preparater går ut. Revisjon av listen skjer fire ganger i året. Som hovedregel blir det bare ført opp reseptpliktige legemidler med markedsføringstillatelse i Norge. Normalt må preparatene være godkjent av Statens legemiddelkontroll for den indikasjonen (sykdommen) de står oppført ved. Listen i § 9 inneholder også merknader dersom det stilles spesielle krav til forskrivning, slik det er vist i tabell 3.1.
Tabell 3.1
| Sykdommer | Preparater | Merknader | |
| 20. | Rheumatismus acutus eller endo-, myo-, peri- og pancarditis lenta, septica | a) Penicillinpreparater | |
| b) Andre antibiotica | Til litra b. | ||
| Behandlingen bør være instituert i sykehus, i sykehusklinikk eller av spesialist i vedkommende disiplin. |
De fleste legemidler som er omfattet av forskriftens § 9 kan skrives ut av allmennpraktikere. Dersom det i forskriftenes merknadsfelt står at behandlingen bør være instituert av spesialist er dette en veiledning til legen og ikke et vilkår for forskrivning. Dersom det står at behandlingen skal være instituert ved spesialavdeling i sykehus eller av spesialist i vedkommende disiplin, er merknaden å betrakte som et forskrivningskrav.
Forskriftens § 2 - legemidler som ikke er oppført i preparatlisten (§ 9)
Det kan også unntaksvis ytes godtgjørelse for utgifter til kostbare medikamenter som brukes til behandling av kroniske sykdommer som ikke er nevnt i § 9, hvis medikamentet må brukes gjennom lang tid. Behandlingen bør være instituert på spesialavdeling i sykehus eller spesialklinikk for, eller av spesialist i vedkommende sykdom, og bør fortsette under kontroll av vedkommende som har instituert behandlingen eller av en annen spesialist i vedkommende disiplin. Godtgjørelse etter denne bestemmelsen må i hvert enkelt tilfelle godkjennes av Rikstrygdeverket eller den som Rikstrygdeverket gir fullmakt.
For legemidler ved kronisk sykdom som ikke omfattes av diagnoselisten i § 9, vil det unntaksvis kunne ytes refusjon etter § 2. Bestemmelsen er fortolket slik at det må dreie seg om en sjelden sykdom eller om et behandlingsalternativ som sjelden er aktuelt. Det er også et vilkår at det dreier seg om kostbare medikamenter som må brukes gjennom lang tid.
Godtgjørelse etter § 2 må i hvert enkelt tilfelle godkjennes av Rikstrygdeverket eller den som Rikstrygdeverket gir fullmakt. Rikstrygdeverket har overlatt godkjenningsmyndigheten til trygdekontorene for nærmere bestemte legemidler ved spesifiserte sykdommer (for tiden 37 diagnoser). Dette er i hovedsak alvorlige, kroniske sykdommer hvor diagnose er stilt i spesialavdeling i sykehus, og hvor behandling skjer i samråd med vedkommende spesialavdeling. Legemiddel som søkes refundert, har ofte markedsføringstillatelse under en annen indikasjon, eller tatt inn på godkjenningsfritak. For at utgiftene til et slikt legemiddel skal godkjennes refundert , kreves at legemidlets effekt ved vedkommende sykdom er dokumentert.
Forskriftens § 10.2 - legemidler som ikke er oppført i preparatlisten
Rikstrygdeverket kan når særlige grunner taler for det, godkjenne at det ytes godtgjørelse for utgifter til legemidler som ikke er oppført i preparatlisten ved en av de diagnoser som er nevnt i § 9.
Rikstrygdeverket kan i medhold av § 10 annet ledd, når særlige grunner taler for det, godkjenne at det ytes godtgjørelse for utgifter til et legemiddel som ikke er oppført i preparatlisten ved en av de diagnoser som er nevnt i § 9. Dette vil vanligvis bare bli gitt dersom det dreier seg om en livstruende eller kronisk sykdom som har gått inn i en alvorlig fase, og hvor de opplistede preparater ikke gir tilfredstillende effekt eller har uakseptable bivirkninger.
Ved refusjon for legemidler etter § 10 annet ledd vil det alltid bli stilt krav om at legemidlet er forskrevet av spesialist eller behandlingen instituert av spesialist. Det dreier seg vanligvis om et legemiddel som er tatt inn på godkjenningsfritak, eller preparater som er godkjent markedsført på annen indikasjon. For at utgiftene til et slikt legemiddel skal godkjennes refundert , kreves at legemidlets effekt ved vedkommende sykdom er dokumentert.
Forskriftens § 4 - allmennfarlige smittsomme sykdommer
I 1996 ble det innført hjemmel i forskriftens § 4 til å yte full godtgjørelse fra folketrygden til legemidler ved allmennfarlige smittsomme sykdommer. Ordningen gjelder den som oppholder seg i Norge, selv om vedkommende ikke er medlem i folketrygden.
Hvilke sykdommer og hvilke legemidler dette gjelder og hvilke indikasjoner som i tilfelle må være oppfylt, er listet opp i § 4. Det ytes også godtgjørelse for utgifter til antiinfektive legemidler og for bestemte vaksiner, immunoglobuliner og immunsera. Vaksinene rekvireres og utleveres fra Statens Institutt for folkehelse som foretar vurderingen av om indikasjonen i det enkelte tilfelle er oppfylt.
Forskriftens § 7 pkt. 2 - pasientenes egenandeler
Legemiddelbrukere som har fått forskrevet et legemiddel på blå resept betaler en egenandel selv, jf. forskriftens § 7. Det skal kun betales én egenandel pr. resept. Det regnes som én resept dersom legen under en og samme konsultasjon skriver ut flere resepter, eventuelt for flere sykdommer, til samme pasient.
Den trygdede skal betale en egenandel på 36 prosent av reseptbeløpet, men ikke mer enn 330 kroner pr. resept. Barn under 7 år skal ikke betale egenandel. Barn mellom 7 og 16 år og personer som har fylt 67 år eller mottar uførepensjon etter folketrygdloven kapittel 8, skal betale en egenandel på 12 prosent av reseptbeløpet, men ikke mer enn 110 kroner pr. resept. Ved reitererte resepter skal det betales ny egenandel etter utlevering av et kvantum svarende til tre måneders forbruk av legemidlet. Dersom det er foreskrevet et preparat som har en pris som overstiger referanseprisen, beregnes egenandelen av referanseprisen. Det overskytende beløp betales av den trygdede, men medregnes ikke under utgiftstaket for egenandeler.
Forskriftens § 7 pkt. 1 - referansepris
Dersom det finnes flere preparater innenfor de enkelte legemiddelgrupper med samme virkestoff og som regnes som medisinsk likeverdige, plikter legen å forskrive billigste synonympreparat dersom ikke tungtveiende medisinske grunner tilsier noe annet.
For slike synonympreparater kan det fastsettes en egen referansepris som er det maksimale beløp som folketrygden kan godtgjøre. Referanseprisen fastsettes med utgangspunkt i prisen på billigste synonympreparat i gruppen tillagt 5 pst. Egenandelen beregnes av referanseprisen slik at pasienten i tillegg til den fastsatte egenandel må betale differansen mellom referanseprisen og prisen for det forskrevne synonympreparat selv.
3.4.2 Andre sentrale bestemmelser i blåreseptforskriften
Forskriftens § 3 - sykepleieartikler
I tillegg til folketrygdens ytelser til viktigere legemidler, inneholder blåreseptforskriftens § 3 bestemmelser om sykepleieartikler som dekkes av folketrygden. Det kan ytes godtgjørelse for utstyr i forbindelse med en rekke ulike sykdommer, men de dominerende gruppene er diabetes (sukkersyke), stomi (utlagt tarm) og inkontinens (urinlekkasje). Folketrygdens ytelser til sykepleieartikler er ikke omfattet av mandatet, og utvalget har ikke vurdert denne stønadsordningen.
3.4.3 Folketrygdloven § 2-7 - Full godtgjørelse av utgifter til legemidler ved yrkesskade
Under sykdom som skyldes yrkesskade som går inn under kapittel 11, ytes godtgjørelse etter bestemmelsene i § 2-2, 2-3 og 2-5, likevel slik at det ytes full godtgjørelse for utgifter til legehjelp, fysikalsk behandling, forbindingssaker og medisiner og for utgifter til hensiktsmessige hjelpemidler som kan bøte på følgene av skaden . . .
Etter folketrygdloven § 2-7 ytes full godtgjørelse for legemidler under sykdom som skyldes yrkesskade. Det må godtgjøres at det er årsakssammenheng mellom yrkesskaden/yrkessykdommen og behandlingsbehovet, dvs. at yrkesskaden/yrkessykdommen skal være den mest sannsynlige eller den mest nærliggende årsak til behandlingsbehovet.
I henhold til gjeldende retningslinjer er det en forutsetning at det dreier seg om legemidler som er reseptpliktige og har markedsføringstillatelse. For søvnfremkallende, beroligende og smertestillende legemidler som er vanedannende, må behandlingen være instituert av relevant spesialist eller sykehusavdeling, og faren for avhengighet må være bedømt som helt underordnet.
Spørsmål om refusjon for legemidler ved yrkesskade avgjøres av trygdekontorene. Legemidler ved yrkesskade kontoføres ikke på egen konto i trygdekontorenes regnskap.
3.4.4 Folketrygdloven § 2-13 - Bidragsordningen
Allerede før 1953, da ordningen med pliktmessig stønad til legemidler ble innført, hadde flere trygdekasser på frivillig basis ytt bidrag til livsviktige medisiner. Denne ordningen var hjemlet i syketrygdloven § 37. Ordningen gikk ut på at trygdekassens overskudd skulle avsettes til et reservefond dersom årsregnskapet viste større inntekt enn utgift. Fondet kunne etter nærmere retningslinjer fastsatt av Rikstrygdeverket anvendes til øyemed som står i forbindelse med sykepleien, således til ytelse av tannbehandling, medisin, opprettelse av eller støtte for sykehus, føde,- tuberkulose- eller rekonvalesenthjem og lignende, samt til sykdomsforebyggende arbeid. Ordningen ble videreført som et supplement til den pliktmessige refusjonsordning og er nå hjemlet i § 2-13 i folketrygdloven.
Det kan ytes bidrag til formål som står i samband med sykebehandling, til tannbehandling og til proteser og lignende som ikke dekkes etter § 2-5 nr. 3 bokstav d.
Til legemidler, som ikke dekkes pliktmessig etter forskrifter om godtgjørelse av viktigere legemidler, kan det etter folketrygdloven § 2-13, bevilges økonomisk bidrag med 2/3 av de utgifter som overstiger 600 kroner pr. kalenderår. Det stilles ikke krav til sykdommens varighet, og utgifter til flere legemidler kan ses under ett. Trygdedes økonomi skal, etter gjeldende praksis, ikke vurderes før eventuell tildeling av bidrag. Det kan ytes bidrag til dekning av legemidler når følgende hovedvilkår er oppfylt:
Legemidlet har markedsføringstillatelse
Legemidlet er reseptpliktig
Legemidlet er brukt på relevant indikasjon
Pasienten må betale legemidlet på apoteket og søke trygdekontoret om bidrag på grunnlag av spesifiserte kvitteringer. Pasientens andel av legemiddelutgiftene teller ikke med under det totale beregningsgrunnlaget for tildeling av frikort. I Rikstrygdeverkets generelle retningslinjer er det presisert at bidrag ikke er noen pliktmessig ytelse, at det er et begrenset beløp som er stilt til rådighet for bidragsformål, at det er en forutsetning at bidragsrammen ikke skal overskrides, og at Rikstrygdeverket er pålagt å se til at så ikke skjer og om nødvendig tilpasse retningslinjene slik at rammen strekker til.
Unntaksvis kostnadsfrihet
For pasienter med kreft og immunsvikt ytes bidrag til full dekning av utgifter til avførende, beroligende, hostestillende, kvalmestillende, smertelindrende og søvnfremkallende legemidler. Disse midlene kan da utleveres gratis fra apotek. Apoteket sender regningen direkte til trygdekontoret.
3.4.5 Refusjon av egenbetaling - frikortordningen
Fra 1. april 1984 ble det innført en ordning med et felles årlig utgiftstak for egenandeler til legemidler forskrevet på blå resept, legehjelp, psykologhjelp og reiser som trygden betaler for.
Hensikten var å skjerme storforbrukere av helsetjenester mot for høye totalutgifter til egenandeler. Egenbetaling ved de tjenester som inngår i ordningen kvitteres på et spesielt kort utstedt av Rikstrygdeverket. Når samlet egenbetaling fra årets begynnelse når egenandelstaket, innløses kvitteringskortet i et frikort, og brukere belastes ikke egenandeler ut kalenderåret. For barn under 16 år beregnes utgiftene samlet for alle søsken og en av foreldrene. Egenandelstaket er satt til 1 290 kroner for 1997. I perioden 1990-1995 økte refusjonene av egenandeler til legemidler etter denne ordningen fra 28,8 til 141 millioner kroner.
3.4.6 Andre ordninger
Skattemessig fradrag
Personer med usedvanlig store sykdomsutgifter kan få ekstra skattemessig særfradrag etter bestemmelsene i skatteloven § 77 nr. 4. Utgiftene må være dekket av skatteyteren selv ved egne midler, normalt av skattepliktig inntekt (og ikke grunn- eller hjelpestønad). Denne særfradragsordningen er foreslått avviklet i Velferdsmeldingen (St.meld. nr. 35 (1994-95)).
Grunnstønad
I henhold til lov om uføretrygd fra 1961 kunne det tidligere ytes stønad til den som på grunn av uførhet hadde ekstrautgifter av betydning. Etter folketrygdloven § 8-2 bokstav a foreligger imidlertid rett til grunnstønad hvis en trygdet på grunn av varig sykdom, skade eller lyte har ekstrautgifter av betydning. Grunnstønad ytes etter fem satser som fastsettes av Stortinget. Utgifter til medisin var en av de utgiftsposter som alene eller sammen med andre ekstrautgifter kunne gi rett til grunnstønad dersom beløpsgrensen var oppfylt.
Allerede i 1972 fremhevet Rikstrygdeverket overfor Sosialdepartementet at ordningen med grunnstønad til dekning av medisinutgifter hadde uheldige sider i praksis. Det ble fremhevet at grunnstønad i utgangspunktet er en varig ytelse, mens legemidler bør dekkes etter system som bygger på en individuell og løpende vurdering av det medisinske behovet for ytelsen og dokumentasjon av faktiske utgifter. Det forhold at det var hjemmel for å kompensere utgifter til legemidler som ikke dekkes gjennom blåreseptordningen, både med grunnstønad og med bidrag, ble ansett som lite rasjonelt. Vurderingstemaet for de to ytelsene var stort sett sammenfallende slik at mange pasienter og medikamenter ble omfattet av begge ordninger. Med virkning fra 1. januar 1996 ble forskriftene om ytelse av grunnstønad og hjelpestønad endret slik at det uttrykkelig fremgår at utgifter til legemidler ikke gir rett til grunnstønad.
Legemidler til bruk i sykehus og øvrige institusjoner
Medisiner som brukes av inneliggende sykehuspasienter finansieres i sin helhet over sykehusets ordinære rammer. Dette gjelder i prinsippet også for dagpasienter hvor legemidler som brukes ved sykehuset til behandlingen av pasienten for den sykdom som er årsak til sykehusbehandlingen, skal dekkes over sykehusets budsjett. Har pasienten i tillegg andre kroniske sykdommer dekkes disse på blå resept. Ved infertilitetsbehandling skal takstene sykehuset mottar, dekke forbruk av prosedyrerelaterte medikamenter rett før, under, og rett etter at inngrepet er utført. Ansvaret for finansieringen av medisiner som brukes av beboere i fylkeskommunale eller kommunale insitusjoner ligger hos institusjoneieren.
Pasienter som behandles poliklinisk omfattes av blåreseptordningen. For visse «dagpasienter» skal takstene sykehusene mottar, dekke forbruk av prosedyrerelaterte medikamenter rett før, under og rett etter at inngrepet er utført. Medikamenter som må brukes en viss tid før eller etter inngrepet, men kortere tid enn tre måneder, forskrives på hvit resept og dekkes av pasientene selv. Ansvaret for finansieringen av medisiner som brukes av beboere i fylkeskommunale eller kommunale institusjoner ligger hos institusjonseieren.
3.5 HVORDAN KOMMER LEGEMIDLER PÅ BLÅ RESEPT?
Legemiddelindustrien utvikler stadig nye legemidler. Enkelte av disse representerer store vitenskapelige gjennombrudd basert på helt ny kunnskap. Andre nyvinninger kan være av mer praktisk medisinsk art, som f.eks. modifiseringer av legemidler som medfører færre bivirkninger eller utvikling av nye administrasjonsformer som gir større brukervennlighet. Slike fremskritt kan føre til omfattende utvidelser av bruksområder og brukergrupper, og være av vesentlig medisinsk og økonomisk betydning. Størsteparten av de legemidlene som kommer på markedet tilfører imidlertid lite nytt. Hvilket omfang bruken av et nytt legemiddel får, bestemmes i stor grad av hvorvidt det offentlige er villig til å betale for det på vegne av pasientene.
Ved stillingstaken til refusjonsberettigelse vurderes nye legemidler nøye. Oppføring av nye sykdomsgrupper eller legemiddelkategorier på listen i § 9 i forskrifter om godtgjørelse av utgifter til viktigere legemidler, krever at Sosial- og helsedepartementet endrer forskriften etter at det bl.a. er sikret budsjettmessig inndekning for det nye tilbudet. Forskriftsendringer bygger på tilrådinger fra Statens legemiddelkontroll, Rikstrygdeverket og Statens helsetilsyn. For en stor del av sakene innhentes i tillegg uttalelser fra ekstern ekspertise. For legemidler som utfyller et allerede eksisterende tilbud, f.eks. synonympreparater, er prosessen mindre omfattende. Ansvarsforholdene mellom de ulike statlige aktørere på legemiddelfeltet har i de senere år gjennomgått endringer, spesielt med tanke på hvilket myndighetsorgan som står for saksutredningen.
Rikstrygdeverket og opprettelsen av Samordningsutvalget
Rikstrygdeverket har som sentraladministrasjon for folketrygden et lovbestemt ansvar for anvendelsen av forskriftene for godtgjørelse av utgifter til legemidler på blå resept, og de øvrige refusjonsordninger for utgifter til legemidler. I St.prp. nr.1 (1988-89) uttalte Sosialdepartementet at en som ledd i arbeidet med å begrense veksten i trygdens utgifter til legemidler, ville innføre nye godkjenningsprosedyrer for opptak av legemidler i blåreseptordningen. Som et ledd i dette arbeidet ga Sosialdepartementet i 1989 Rikstrygdeverket i oppdrag å etablere et utvalg som skulle samordne statens kompetanse på legemiddelområdet, det såkalte Samordningsutvalg. Utvalget var sammensatt av representanter fra Rikstrygdeverket, Helsedirektoratet, Statens legemiddelkontroll og Norsk Medisinaldepot. Det hadde en rådgivende funksjon og hadde således ikke vedtaksmyndighet. På sikt var utvalget tiltenkt følgende oppgaver:
Foreta helseøkonomiske vurderinger om hvorvidt legemidler bør omfattes av trygdens refusjonsordning eller ikke.
Kartlegge trygdens merutgifter ved opptak av nye legemidler på blå resept.
Foreta prisvurderinger og gjennomføre prisforhandlinger med legemiddelprodusenten for viktigere legemider som er aktuelle for blå resept.
Rikstrygdeverket hadde et sekretariatsansvar for utvalget, med ansvar for møteinnkalling, møteforberedelser og fremleggelse av saker som utvalget skulle drøfte. Før Samordningsutvalget startet opp sin virksomhet foretok Rikstrygdeverket en gjennomgang av gjeldende praksis for godkjennelse av refusjon, og nye retningslinjer ble utarbeidet. Disse ble sendt på høring til Helsedirektoratet, Den norske lægeforening, Trygdemedisinsk forening og Institutt for farmakoterapi. Retningslinjene innebar en innstramming av rutiner og praksis for godkjennelse etter blåreseptforskriften § 2 og § 10.2. Departementets godkjennelse forelå i januar 1991.
Samordningsutvalgets arbeid
Samordningsutvalget mottok og drøftet alle søknader fra legemiddelprodusenter eller andre interessenter om opptak av nye preparater i preparatlisten. Dersom opptak av et preparat ble antatt å ville medføre betydelige merutgifter for folketrygden, ble helseøkonomiske analyser fra relevante fagmiljøer innhentet. Dette gjaldt bl.a. legemidlene Mevacor, Miacalcic, Imigran, Fontex og Proscar. Analysene ble brukt som supplement til de rent medisinsk-faglige uttalelser som ble innhentet til utvalgets arbeid. Etter drøftinger ble skriftlig tilråding om refusjonsspørsmålet utarbeidet, og oversendt Sosial- og helsedepartementet for politisk og budsjettmessig klarering. Legemidler som ikke medførte materielle utvidelser av trygdens eksisterende tilbud, eller som ikke ville medføre store merutgifter, kunne etter vurdering i Samordningsutvalget og vedtak i Rikstrygdeverket føres opp i preparatlisten uten nærmere godkjenning fra overordnet myndighet. Det pålå Rikstrygdeverket å informere avsender av refusjonssøknaden om hvilket vedtak som var fattet.
Prisforhandlinger
En av Samordningsutvalgets tiltenkte oppgaver var å foreta prisvurderinger og gjennomføre prisforhandlinger med legemiddelprodusentene for de legemidler som var aktuelle for opptak i blåreseptordningen. Spørsmålet om hvilken instans som skulle føre prisforhandlinger med legemiddelprodusentene ble drøftet. Det ble tatt opp med departementet, men ble ikke avklart mens Samordningsutvalget var i funksjon.
Overvåking av utgiftsutviklingen
Samordningstvalget overvåket utgiftsutviklingen etter innføringen av referanseprissystemet og øvrige konsekvenser av ordningen. Arbeidet med etablering av et statistikksystem i samarbeid med Norges Apotekerforening/NAF-Data ble startet opp.
Innhenting av medisinske tilrådinger og informasjon
Beslutninger om oppføring av legemidler i blåreseptordningen var i høy grad basert på medisinsk informasjon og medisinske avveininger, selv om også økonomiske forhold ble tillagt vesentlig vekt. Det ble oppfattet som et problem for Samordningsutvalgets funksjon at Statens legemiddelkontroll avslo å gi Rikstrygdeverket/Samordningsutvalget tilgang til utredningsprotokollen som ligger til grunn for Spesialitetsnemndas medisinske vurderinger rundt vedtak om markedsføringstillatelse for nye legemidler. Avslag ble gitt med henvisning til taushetsplikt i relasjon til produsentenes produktopplysninger. Leverandørene fant på sin side ikke å kunne utlevere utredningsprotokollene uten etter samtykke fra Statens legemiddelkontroll, da den ble oppfattet som Statens legemiddelkontrolls eiendom. Rikstrygdeverket tok spørsmålet opp med departementet uten at det ble funnet en løsning på det. Utover den kunnskap og ekspertise som Samordningsutvalget var representert med internt, innhentet Rikstrygdeverket medisinske uttalelser fra eksterne fagmiljøer etter behov.
Rikstrygdeverkets sekretariatsfunksjon
Til innhenting av utredninger og konsulentuttalelser hadde Rikstrygdeverket en midlertidig engasjementsbevilling til rådighet. At det ikke ble stilt permanente ressurser til rådighet gjorde det således vanskelig å bygge opp et permanent sekretariat som kunne ivareta driften av Samordningsutvalgets oppgaver, herunder knytte til seg helseøkonomisk ekspertise. En viss kompetanseoppbygging på dette felt var allikevel under utvikling både hos Rikstrygdeverket og hos medlemmene av Samordningsutvalget.
Nedleggelse av Samordningsutvalget
I sammenheng med opprettelsen av en Seksjon for legemiddeløkonomi ved Statens legemiddelkontroll, i forbindelse med revidert nasjonalbudsjett 1994, ga Rikstrygdeverket i brev til departementet uttrykk for at det anså Samordningsutvalget for oppløst i og med at en vesentlig del av utvalgets mandat var tillagt en annen institusjon. Samordningsutvalget var i funksjon frem til 1995.
Opprettelsen av Seksjon for legemiddeløkonomi ved Statens legemiddelkontroll
I revidert nasjonalbudsjett 1994 varslet regjeringen at myndighetene ville styrke innsatsen knyttet til legemiddeløkonomiske og samfunnsøkonomiske vurderinger ved spørsmål om opptak av nye legemidler på blå resept, herunder foreta særskilte prisforhandlinger. Det ble i St.prp. nr.1 (1994-95) foreslått opprettet 4 nye stillinger til nødvendig kompetanseoppbygging i statsforvaltningen. 3 av stillingene ble lagt til en nyopprettet seksjon for legemidddeløkonomi ved Statens legemiddelkontroll. 1 stilling ble lagt til Sosial- og helsedepartementet og øremerket prisforhandlinger med industrien i forbindelse med opptak av nye legemidler på blå resept. Seksjon for legemiddeløkonomi kom i operativ drift i 1996.
Overgangsperioden høst 1994 - sommer 1996
Samordningsutvalget la ned sin virksomhet ved utgangen av 1994. Seksjon for legemiddeløkonomi kom i drift i løpet av våren 1996, og var fullt bemannet i juni 1996. Arbeidet med opptak av nye legemidler i blåreseptordningen var fra høsten 1994 til sommeren 1996 preget av skifte mellom to systemer, noe som bl.a. innebar at Sosial- og helsedepartementet tok en mer sentral rolle enn da Samordningsutvalget var i funksjon. Etter at Seksjon for legemiddeløkonomi kom i operativ drift, ble Sosial- og helsedepartementets rolle i saksutredningsprosessen igjen redusert.
Dagens organisatoriske og forvaltningsmessige praksis
Rikstrygdeverkets Sykebehandlingskontor behandler årlig 1200-1300 enkeltsøknader, og ca. 200 ankesaker angående legemidler. Enkeltsøknadene gjelder i hovedsak refusjon av utgifter til legemidler til bruk mot sykdommer som ikke er oppført i blåreseptforskriftens § 9, og legemidler som ikke står oppført i den ordinære listen av preparater som hører inn under § 9. I tillegg kommer søknader om opptak av nye legemidler i blåreseptordningen og utarbeidelse av retningslinjer, budsjettarbeid mv. Rikstrygdeverket disponerer i dag vel tre årsverk til forvaltningen av legemiddelområdet, herav 2 1/2 årsverk i Sykebehandlingskontoret (farmasøyter), knapt 1/2 årsverk i Overlegekontoret, og i underkant av 1/4 årsverk i Helseøkonomikontoret (budsjett, statistikk).
Rikstrygdeverket har også ansvar for behandling av søknader om opptak av nye legemidler i refusjonsordningen. Når legemiddelbedrifter, leger, pasientorganisasjoner etc., søker om refusjonsberettigelse for nye legemidler, må Rikstrygdeverket:
Vurdere hvorvidt vilkårene for refusjon er oppfylt i forhold til gjeldende forskrifter
Eventuelt utarbeide tekst og nomenklatur til endring i forskrift, f.eks. et nytt sykdomspunkt eller preparatgruppe
Utarbeide eventuelle merknader og nærmere vilkår for forskrivning til det enkelte sykdomspunkt eller preparatgruppe, f.eks. krav til spesialistkompetanse, spesielle rekvireringsvilkår, diagnostikk eller medisinske vilkår
Kartlegge de budsjettmessige konsekvenser for folketrygden
Kartlegge samfunns- og helseøkonomiske kostnader og konsekvenser
Søknader behandles i første omgang i Rikstrygdeverket, hvor det utarbeides en betenkning om refusjonsspørsmålet. Denne omfatter både medisinske og økonomiske forhold knyttet til eventuell trygderefusjon, samt den faktiske utformingen av forskriftene.
Som en del av grunnlagsarbeidet innhentes en vurdering fra Statens legemiddelkontroll. I denne vurderingen gis en omfattende medisinsk redegjørelse for det aktuelle legemidlets effekt og indikasjonsområde, og dets plass i forhold til andre behandlingsalternativer. Det foretas også en vurdering av helseøkonomiske aspekter og hvilke budsjettmessige konsekvenser eventuell refusjon vil ha for trygden. Rikstrygdeverket oversender deretter en samlet vurdering til Sosial- og helsedepartementet. Departementet forelegger Rikstrygdeverkets uttalelse for Statens helsetilsyn, og foretar en endelig og samlet vurdering. Det avholdes også jevnlige arbeids- og koordineringsmøter mellom de respektive legemiddelmyndigheter, hvor refusjonsspørsmålene drøftes. Dersom en refusjonssøknad vil medføre store økonomiske konsekvenser, klareres de budsjettmessige sider mellom Sosial- og helsedepartementet og Finansdepartementet. Viktige endringer godkjennes på politisk nivå. Bestemmelsen lyder slik:
Prisforhandlinger i forbindelse med refusjon av utgifter til nye legemidler
Før et legemiddel kan markedsføres på det norske marked må prisen være godkjent av Statens legemiddelkontroll. Det er som regel den prisen Statens legemiddelkontroll har godkjent, som legges til grunn i refusjonssøknader. I henhold til § 6 i forskrift om prisfastsettelse av legemidler kan myndighetene kreve prisforhandlinger ved opptak av nye legemidler på refusjonslisten:
«Ved stillingstaken til pris på legemidler som kan være aktuelle for opptak i offentlig refusjonsordning, kan Sosial- og helsedepartementet eller den det bemyndiger kreve forhandlinger med produsent om fastsettelse av pris på produsentnivå.»
Det har i liten grad vært gjennomført prisforhandlinger i forbindelse med refusjonsspørsmål. Etter at et produkt er ført opp på listen under § 9, har det heller ikke vært ført nye prisforhandlinger dersom nye og bedre produkter kommer på markedet.
Konsekvenser av EØS-avtalen for norsk refusjonspolitikk
Offentlig refusjonsordning for legemidler er det enkelte lands eget anliggende. Selv om offentlig refusjon av legemidler skal reguleres av nasjonalt fastsatte regelverk, ønsker EU på sikt en frivillig tilnærming av reglene slik at spriket ikke blir for stort mellom medlemslandene. Dette skal bl.a. skje gjennom informasjonsutveksling, f.eks. i transparency-komiteen, eller i Pharmaceutical Committee. Det som er avgjørende for EU er at det ikke etableres handelshindringer eller at innenlandsk legemiddelindustri i EU/EØS-området favoriseres.
Transparency-direktivet
EUs rådsdirektiv av 21. desember 1988 om innsyn i prisbestemmelsene for legemidler til mennesker og slike legemidlers opptak i de nasjonale syketrygdordninger (transparency-direktivet), stiller opp noen formkrav til ordningenes forutsigbarhet, åpenhet og kontrollerbarhet i saksbehandlingen, og tidsfrister for denne. Myndighetenes vurderinger ved stillingstaken til refusjon skal være forutberegnelige og industrien skal sikres et visst innsyn i saksbehandlingen. Det skal m.a.o. gis offentlig adgang til innsyn i nasjonale prisordninger, herunder hvordan de virker i enkeltsaker og de kriterier de bygger på for alle aktørene i medlemsstatenes legemiddelmarked. Direktivet skal hindre begunstigelse av innenlandske produsenter på bekostning av utenlandske.
Krav til myndighetene i refusjonsspørsmål faller inn under direktivets artikkel 6. Hovedtrekkene her er at:
Refusjonssøknader skal avgjøres innen visse frister (90 dager).
Medlemsstatene skal offentliggjøre i en egnet publikasjon og oversende Kommisjonen de kriterier vedkommende myndighet skal legge til grunn når de vedtar om legemidler skal føres opp i blåreseptlisten eller ikke.
Vedtak om å nekte opptak i refusjonsordningen skal inneholde en begrunnelse basert på objektive og kontrollerbare kriterier.
90-dagers fristen er en frist for et begrunnet svar, ikke en frist for endelig avgjørelse. Svaret kan f.eks. være at man avventer utfallet av flere kliniske undersøkelser, at staten selv vil utvikle en nærmere helseøkonomisk analyse, at man vil be produsenten utføre en slik, at man vil ha en bedre kartlegging av eventuelle bivirkninger, eller trenger lenger tid for å innhente sakkyndige råd, eventuelt fra flere hold. Et begrunnet svar vil også kunne være at man må avvente Stortingets budsjettbehandling, i tilfeller hvor refusjonsberettigelse kan ha betydelige budsjettkonsekvenser.
Forutsigbarhet og kontrollerbarhet
Transparency-direktivet innebærer ingen begrensning i muligheten for offentlige myndigheter til å dra nytte av priskonkurranse for legemidler som er refusjonsberettiget. Tvert imot er det et mål for EU-kommisjonen å få økt konkurranse og lavere legemiddelpriser. Vedtak om å ta opp et legemiddel i en offentlig refusjonsordning er en avgjørelse som når som helst med en rimelig frist kan trekkes tilbake. Dette vil kunne gjøres f.eks. om det kommer et rimeligere preparat på markedet som er likeverdig eller bedre enn eksisterende alternativer. Refusjonsberettigelse må også kunne trekkes tilbake dersom behandlingseffekten etter en viss tid viser seg være mindre enn opprinnelig antatt, eller dersom bivirkningene viser seg å være hyppigere eller mer alvorlige enn antatt.
Forutsigbarheten og kontrollerbarheten må ligge i at staten opptrer likt overfor alle produsenter, og ikke gir positiv særbehandling til innenlandsk legemiddelindustri. Slik vil et påregnelig system kunne bli utviklet gjennom praksis. Når staten ønsker å inngå forhandlinger om pris før opptak i blåreseptordningen, må dette gjelde alle og ikke bare noen produsenter. Eventuelt må det være kjente kriterier for hvilke legemidler som skal omfattes av prisforhandlinger. Det samme må gjelde eventuelle krav om helseøkonomiske vurderinger, og vedtak om å trekke tilbake refusjon på områder hvor det kommer bedre eller rimeligere behandlingsalternativer.
Forutsigbarheten og påregneligheten kan tas vare på ved at staten konsekvent er en våken og aktiv part overfor produsenter med en klar og konsekvent vilje til ikke å belaste de offentlige legemiddelbudsjetter mer enn nødvendig for en fullgod behandling av den enkelte sykdomsgruppe. Kontrollerbarheten oppnås ved at staten alltid gir klare og etterprøvbare begrunnelser for sine vedtak om eventuell trygderefusjon for legemidler.
3.6 PRIS- OG REFUSJONSSYSTEMER I ANDRE LAND
Det eksisterer en rekke ulike systemer og ordninger for refusjon av utgifter til legemidler i de europeiske landene og verden for øvrig. Det europeiske helsevesen omfatter både refusjonsordninger hvor staten og det offentlige spiller en dominerende rolle, og mer markedsbaserte systemer som kan omfatte en lang rekke forsikringsinstitusjoner og leverandører av helsetjenester. Viktige skillelinjer mellom systemene kan f.eks. gå på hvorvidt forsikringsdekning er avhengig av privat innbetalte forsikringspremier eller om forsikringene er av mer universiell karakter, dvs. at den dekker alle og finansieres gjennom fellesskapets innbetaling av skatter og avgifter. Mens refusjonsordningene i de skandinaviske landene i hovedsak er basert på et sterkt offentlig initiativ, finner man mer markedsbaserte og private ordninger i enkelte sentral-europeiske land og USA.
I de nordiske landene har de overordnede målene i refusjonspolitikken i stor grad vært sammenfallende. Blant annet har en ønsket å redusere de økonomiske hindrene for medikamentell behandling ved alvorlig sykdom, og å lette den økonomiske byrden for pasienter med store behov for legemidler. De nordiske refusjonsordningene er imidlertid bygd opp over forskjellige prinsipper. Dette kan skyldes at ordningene har blitt til over tid, og at en på ulike tidspunkter har ønsket å vektlegge forskjellige målsettinger i refusjons- og legemiddelpolitikken. Tilstedeværelsen av en sterk forskningsbasert industri, særlig i Sverige og Danmark, kan også ha medvirket til forskjeller i landenes refusjonssystemer. I alle de nordiske landene har det vært arbeidet for å kunne dimensjonere bruken av offentlige utgifter til legemidler i forhold til andre tiltak. I den senere tid har det bl.a. pågått et omfattende reformarbeid i Sverige. Dette er nærmere beskrevet i vedlegg 2.
Negative og positive lister
En viktig forskjell mellom refusjonspolitikken i ulike land er om alle legemidler i utgangspunktet er refusjonsberettiget, eller om de i utgangspunktet ikke er det. Prinsippene er basert på bruk av såkalte negative eller positive lister. En negativ liste inneholder legemidler som eksplisitt er unntatt fra refusjonsordningen, mens en postiv liste omfatter legemidler hvor myndighetene eksplisitt har bestemt at utgiftene skal dekkes av det offentlige.
Nederland, Tyskland og Storbritannia er blant de land som bl.a. bruker negative lister. Reseptbelagte medisiner er i utgangspunktet refusjonsberettiget, bortsett fra spesifikke legemidler eller legemiddelgrupper som er unntatt refusjon. Danmark, Finland og Australia har i likhet med Norge et system med positive lister, der kun preparater som står oppført blir refundert. I Sverige har det vært en kombinasjon av disse to prinsippene. De fleste legemidler er refusjonsberettiget dersom de ikke er eksplisitt unntatt. I tillegg finnes det en liste over sykdommer som gir rett til full refusjon.
Egenandeler
I alle land kreves det en form for egenbetaling for legemidler. Egenandelene fastsettes på ulik måte. I enkelte land er de faste, mens andre bruker prosentvise satser. Alternativt kan egenandeler variere med pakningsstørrelsen. I Danmark har en differensierte egenandeler for legemidler i forskjellige kategorier. For storforbrukere er det som regel etablerte skjermingsordninger, og enkelte legemidler, f.eks. insulin mot diabetes, er helt unntatt egenandelskravet. Kravene for å komme inn under skjermingsordningene er etter norske forhold høye.
Prisfastsettelse på refusjonsberettigede legemidler
Legemidler som omfattes av de refusjonsordningene som er omtalt i vedlegg 2 er enten direkte eller indirekte underlagt en form for priskontroll. I Finland er det i utgangspunktet fri prisfastsetting, men det må forhandlinger til dersom preparatet skal omfattes av refusjonsberettigelse. Tilsvarende har det i Sverige vært en forutsetning for refusjon, at Riksförsäkringsverket har godkjent prisen. I de landene hvor refusjonsordningene inneholder et referanseprissystem (Sverige, Danmark, Tyskland og Nederland) brukes priskontrollen for de legemidlene om omfattes av systemet, mer indirekte, ved at det fastsettes referansepriser, dvs. fast refusjonstilskudd for legemidler i samme gruppe. I Storbritannia påvirkes pris på originale legemidler som betales av National Health Service gjennom regulering av bedriftenes fortjenester. Dette foregår gjennom det unike britiske prisreguleringssystemet, Prescription Pricing and Reimbursement System (PPRS). Generiske legemidler gis pris ut fra en egen liste, som kan sammenlignes med et referanseprissystem for synonyme, generiske legemidler.
Legemiddeløkonomi
I Norge har bruk av legemiddeløkonomiske analyser i flere år vært en integrert del av beslutningsunderlaget ved stillingstaken til oppføring av legemidler på blå resept, men bruken er i liten grad systematisert. Få land har institusjonalisert slike analyser. I Australia ble legemiddeløkonomiske undersøkelser obligatoriske ved søknad om refusjon av nye legemidler i 1993. Provinsen Ontario i Canada fulgte like etter. Initiativet ble raskt fulgt opp på føderalt canadisk nivå. I Storbritannia har legemiddelindustrien og helsemyndighetene i fellesskap utarbeidet et sett med veiledende retningslinjer for hvordan legemiddeløkonomiske evalueringer bør gjennomføres. Det er ingen krav til gjennomføring av slike studier, og er ikke gitt noen forankring hos sentrale legemiddelmyndigheter. De engelske retningslinjene har først og fremst relevans i forhold til påstander om kostnadseffektivitet i forbindelse med markedsføringsformål i industrien.
I vedlegg 2 gis en mer detaljert oversikt over refusjonsordningene i en del andre land. De landene som er valgt er Sverige, Danmark, Finland, Tyskland, Storbritannia, Nederland og Australia. Landene har i likhet med Norge helsetjenester som i stor grad er heldekkende, dvs. tilbudene omfatter alle. Samtidig viser de en del særtrekk ved ulike refusjonssystemer. Presentasjonen av Australia er f.eks. tatt med for å vise hvordan legemiddeløkonomiske evalueringer kan integreres som en del av den statlige forvaltningen på legemiddelområdet. I tabell 3.2 skisseres kort hovedtrekkene ved disse refusjonsordningene.
Tabell 3.2 Pris- og refusjonssystemer i utvalgte land
| Land | Prisfastsettelse | Refusjonssystem, og annet |
| Norge | Priskontroll på reseptpliktige legemidler, fri prising på reseptfrie | Positivliste, generisk referanseprissystem, prosentvis egenandel opp til gitt maks beløp pr. resept, årlig egenandelstak |
| Danmark | Delvis fri prisfastsettelse. Priser påvirkes gjennom referanseprissystemet | Ulike prosentvise refusjonssatser for forskjellige legemiddelkategorier (positive lister), generisk referanseprissystem, prosentvise egenandeler (ulike prosentsatser), egenandelstak pr. år |
| Finland | Fri prisfastsettelse, men forhandlinger med myndighetene dersom preparatet skal inn i refusjonsordningen | Ulike prosentvise refusjonssatser for forskjellige legemidler (positive lister), egenandeler (varierende ut fra hvilken refusjonsgruppe legemiddel som refunderes) |
| Sverige | Fri prisfastsettelse, men forhandlinger med myndighetene dersom preparatet skal inn i refusjonsordningen | Reseptpliktige preparater som hovedregel refusjonsberettiget, positiv liste, egen liste med legemidler som dekkes fullt ut, generisk referanseprissystem, egenandeler opp til visst beløp avhengig av antall preparater på resepten, egenandelstak pr. år, nytt system under innføring |
| Tyskland | Delvis fri prisfastsettelse. Priser påvirkes gjennom referanseprissystemet | Negativ liste, terapeutisk referanseprissystem, årlige legemiddelbudsjetter, egenandeler avhengig av pakningsstørrelse |
| Storbritannia | Fri prisfastsettelse, men begrenset av profittkontroll | Negativ liste, faste egenandeler pr. produkt uavhengig av pris, legepraksiser med faste ramme-budsjetter, indikative forskrivningsprogram |
| Nederland | Delvis fri prisfastsettelse. Priser påvirkes gjennom referanseprissystemet | Terapeutisk referanseprissystem. Ingen egenandeler utover eventuelt referansepristillegg, dvs. den pris som overstiger referanseprisen |
| Australia | Positiv liste. Krav om innlevering av legemiddeløkonomiske analyser ved søknad om refusjonsrett for nye produkter |
3.7 FORBRUK OG FINANSIERING AV LEGEMIDLER I NORGE OG ANDRE LAND
Utgiftene til legemidler i Norge finansieres i dag både av staten, sykehusene, kommunene og privathusholdningene. Størstedelen av forbruket finansieres av staten ved at folketrygden dekker utgifter til legemidler forskrevet på blå resept og bidrag til andre legemiddelutgifter etter folketrygdloven § 2-13. Pasienter med store egenandelsutgifter til en del sentrale helsetjenester, herunder legemidler på blå resept, får også sine egenandeler dekket når summen av betalte egenandeler når et visst beløp. Ressurser til Rikstrygdeverkets dekning av legemiddelutgifter blir tildelt over statsbudsjettet. Statens andel av det samlede legemiddelforbruk i Norge var i 1988 på 45 pst. Denne andelen hadde steget til 51 pst i 1995, jf. figur 3.3.
Sykehusene finansierer legemidler gjennom tildeling av midler fra fylkeskommunene eller staten i form av rammebudsjetter. Legemiddelutgiftene i sykehus utgjorde ca. 15,5 pst av de totale legemiddelutgifter i 1995. Legemiddelutgiftene ved kommunale syke- og aldershjem dekkes av kommunen. Rikstrygdeverkets andel av de samlede legemiddelutgifter har i de senere år økt gradvis, mens sykehusenes andel av totalen har gått ned. Dette har trolig sammenheng med at legemiddelforskrivere utenfor institusjon ikke er underlagt de samme budsjettmessige restriksjoner som sykehus, bedre overvåking gjennom legemiddelkomiteer, og at sykehusene har effektivisert sine innkjøp. Pasientenes andel er relativt stabil, men har vært svakt avtakende. Privathusholdningene betalte i 1995 ca. 33 prosent av de samlede legemiddelutgiftene. 5 pst av totalomsetningen er egenandeler til legemidler på blå resept. Privates andel omfatter også utgifter til reseptfrie legemidler, reseptpliktige legemidler på hvit resept og veterinærpreparater, slik det er vist i kakediagrammet i figuren nedenfor.
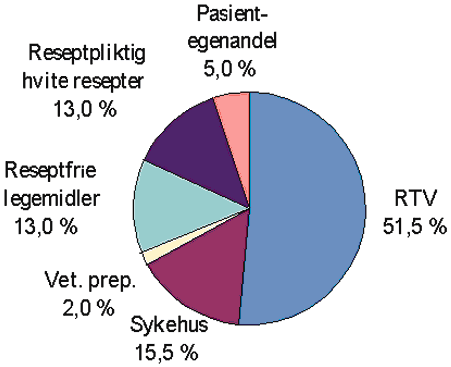
Figur 3.3 Fordeling av legemiddelsalget i 1995. Totalt: 7 577 mill kr.
Kilde: Legemiddelindustriforeningen
Utviklingen i folketrygdens utgifter til legemidler i de senere år
Folketrygdens utgifter til legemidler på blå resept var i 1995 på 3 665 millioner kroner, utgiftene til legemidler hvor det etter søknad ytes bidrag med 2/3 av beløpet, var på 78 millioner kroner, og utgiftene til frikortsordningen utgjorde 141 millioner kroner.
Blåreseptordningen er således den mest omfattende offentlige refusjonsordningen. I perioden 1990-1995 var det en nominell årlig utgiftsvekst på i gjennomsnitt 11,3 pst, eller en realvekst på 8 pst. En rekke tiltak har blitt gjennomført for å bremse utgiftsveksten i ordningen. I 1992 ble f.eks. egenandelen for legemidler hevet fra 20 til 30 pst for personer mellom 16 og 67 år unntatt uførepensjonister, og i 1993 ble det innført et referanseprissystem for synonyme legemidler. Det finnes lite dokumentasjon på effekten av de ulike innsparingstiltakene. Endringer som skyldes andre forhold, f.eks. endret forskrivningspraksis og nye terapianbefalinger, bidrar dessuten til å gjøre bildet mer komplekst. Tallene viser at det er sterk utgiftsdynamikk i ordningen til tross for tiltakene. Denne veksten er ikke et nytt fenomen. Helt siden innføringen av ordningen i 1954 har det vært en sterk økning. Det er tre hovedårsaker til veksten i legemiddelomsetningen; (1) generell prisstigning på legemidler, (2) økt legemiddelforbruk målt i doser, og (3) overgang til nye og dyrere medikamenter. Den viktigste faktoren har vært, og er, overgangen til nye og dyrere legemidler.
Legemidlenes andel av ressursene til helsevesenet er økende. Mens veksten i de offentlige utgiftene til helsevesenet ligger på linje med veksten i bruttonasjonalprodukt, har veksten i offentlige legemiddelutgifter vært vesentlig kraftigere. Utviklingen siden 1988 går frem av figur 3.4.
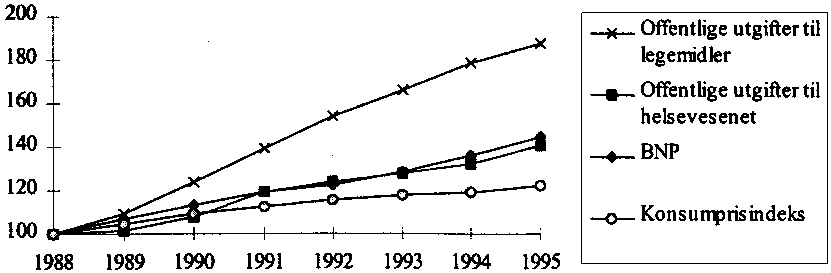
Figur 3.4 Vekst i offentlige utgifter til legemidler (sykehus og RTV), offentlige utgifter til helsevesenet, bruttonasjonalproduktet, og konsumprisindeksen. Indeks, 1988 = 100.
Kilde: Legemiddelindustriforeningen
Det er neppe grunnlag for å si at det norske legemiddelforbruket er høyt i internasjonal målestokk, verken når det gjelder forbruket målt i doser eller forbruket i kroner pr. innbygger. I vedlegg 3 er det vist at Norge ligger lavere enn våre nordiske naboer når det gjelder legemiddelforbruket i fire viktige legemiddelgrupper. Forbruket pr. innbygger målt i kroner er også lavere enn gjennomsnittet i Europa. På bakgrunn av en prissammenligning foretatt av det svenske Apotekbolaget, er det imidlertid vist at prisnivået på legemidler i Norge er høyere enn i en del andre EU-land. I vedlegg 3 gis en mer utførlig beskrivelse av finansiering, forbruk og prisnivå på det norske legemiddelmarkedet.
3.8 STATISTIKK
Pålitelig og tilgjengelig statistikk er et viktig virkemiddel for at både helsemyndigheter, legene og omsetningsleddene skal bruke ressurser på en effektiv måte. Uten planlegging er det vanskelig å ha et overordnet tilsyn med legemiddelforbruket i helsetjenesten, og planleggingsdata er svært viktige for at de forskjellige aktører i det sentrale forvaltningsapparatet skal klare sin oppgave.
Norge har vært et foregangsland når det gjelder innsamling av legemiddelstatistikk. Systemer for klassifikasjon av legemidler (ATC-systemet) og måling av legemiddelforbruk (definerte døgndoser) vedlikeholdes og videreutvikles i dag ved et WHO-senter ved Norsk Medisinaldepot (WHO Collaborating Centre for Drug Statistics Methodology), finansiert av norske helsemyndigheter. Denne metodologien ligger bl.a. bak det datamaterialet som er lagt frem i vedleggene.
Allerede tidlig på 60-tallet ble det utarbeidet oversikt over forbruket av ulike legemiddelgrupper på bakgrunn av NMDs salg til apotek. Norge var det første land i verden som utga offentlig legemiddelstatistikk. Publikasjonen Legemiddelforbruket i Norge er utgitt regelmessig siden 1977. Fra 1969 laget Norsk Medisinaldepot også legemiddelstatistikk for de fleste av landets sykehus, basert på leveranser fra apotek til den enkelte avdeling/post.
Dagens ordinære legemiddelstatistikk er i hovedsak generert på grossistnivå. I tillegg til den ordinære legemiddelstatistikken utarbeides det statstikk ut fra enkelte aktørers behov. NMD utarbeider på vegne av Statens helsetilsyn en spesiell statistikk over forbruk av narkotiske midler, basert på resepter fra leger og rekvisisjoner fra helseinstitusjoner. NMD og International Medical Statistics (IMS) samarbeider om Norsk reseptstatistikk, en utvalgsstatistikk som bl.a. gir visse pasientorienterte tilleggsopplysninger. Denne er primært utformet på bakgrunn av legemiddelindustriens behov. Norges Apotekerforening samkjører regelmessig reseptdata fra 22 apotek. Disse kan bl.a. gi en viss informasjon om kostnadsfordeling mellom kunde og folketrygden for blå resepter.
Grossiststatistikk
Den ordinære legemiddelstatistikken i Norge har til nå vært basert på NMDs salg av legemidler til apotek og sykehus, dvs. salg av legemidler på grossistnivå. Med en statlig grossist har dette gitt en oversiktlig situasjon. Statistikk over salg av legemidler og legemiddelgrupper (ATC, DDD, kroner) fra grossist, inkludert fylkesvis fordeling, publiseres årlig i publikasjonen Legemiddelforbruket i Norge. Situasjonen er nå endret ved at det har kommet til flere grossister.
Leverandørstatistikk
NMD har også utarbeidet, eller levert grunnlaget for leverandørorientert statistikk. Farmastat/Norsk legemiddelstatistikk AS utarbeider Norwegian Drug Market, som selges til den farmasøytiske industrien.
Ettersom grossistenes innkjøpspris og apotekenes utsalgspris for alle legemidler har vært regulert (GIP frem til 1.1.95), og grossistavansen med én aktør har vært oversiktlig, har det også vært forholdsvis enkelt å lage prisindekser m.m.
Reseptstatistikk
I 1990 ble Norsk reseptstatistikk etablert. Norsk reseptstatistikk er et samarbeid mellom NMD og International Medical Statistics (IMS). Dette har gitt en viss systematisk kunnskap om legemiddelforskrivning basert på resepter. Reseptstatistikken baserer seg på at et utvalg på ca. 200-300 fører alle sine pasientkontakter i løpet av en uke (også der det ikke skrives resept) på spesielle blanketter. Disse registreres og bearbeides i utlandet til rapporter etter IMSs standardprogrammer som er utviklet ut fra legemiddelindustriens behov. IMS produserer Medical Index Norway basert på materialet. Denne selges til den farmasøytiske industri i Norge, og gir nyttig informasjon bl.a. for markedsføring av legemidler. Legen betales for arbeidet. 70 pst av legene som kontaktes takker nei til å delta. Derfor er det uklart hvor representativ statistikken er. For mindre vanlige diagnoser og legemidler er utvalget for lite. Utdrag av opplysninger fra Norsk reseptstatistikk offentliggjøres i publikasjonen Legemiddelforbruket i Norge.
Sykehusstatistikk
Siden 1969 har NMD tilbudt sykehus å databehandle legemiddelleveranser fra leverende apotek til avdelinger og poster. Mange sykehus lager nå sin egen statistikk. Det finnes ikke offentlig tilgjengelig sammenlignbar statistikk over legemiddelbruk i landets sykehus/sykehusavdelinger.
Narkotikastatistikk
Norsk Medisinaldepot registrerer og databehandler apotekenes salg av narkotiske legemidler til enkeltpersoner og helseinstitusjoner. Det utarbeides rapporter som bare er tilgjengelige gjennom Statens helsetilsyn. Rapportene inneholder opplysninger om pasient og forskriver, og benyttes i tilsynet med bruken av narkotika i Norge.
Apotekstatistikk
De fleste apotek har i dag datasystemer som gjør at de i praksis har oversikt over alt salg av legemidler på resept, med enkle opplysninger knyttet til hver reseptlinje. Opplysningene ligger på dataregistre i mellom 6 og 12 måneder. Datasystemene er hovedsakelig utviklet for administrative formål i tilknytning til reseptekspedisjon og oppgjør med trygdekontoret. Hovedsystemet i NAF-i-Nett er utarbeidet av NAF-data som er en del av Norges Apotekerforening (NAF). På grunnlag av data fra 22 apotek lages estimater over nasjonalt salg, f.eks. legemidler på blå resept og egenandeler. Apotekene er valgt ut for å gi et representativt bilde av norske apotek, og omfattet 7,3 pst av omsetningen i apotekvesenet i 1993.
Rikstrygdeverket
Rikstrygdeverkets datagrunnlag er samleregninger fra apotek gjennom landets trygdekontorer, samt statistiske estimater over salget. Disse er innhentet av Norges Apotekerforening. I tillegg har det vært gjort enkelte spesielle tellinger. Fullstendige opplysninger om blåresepter finnes som nevnt i datasystemene på hvert enkelt apotek, og manuelt i trygdekontorene, men disse har hittil i liten grad vært utnyttet systematisk.
3.9 OPPSUMMERING
Blåreseptordningen er et viktig virkemiddel i den offentlige legemiddelpolitikken. Ved at legemidler subsidieres blir legemidlene tilgjengelige ved behov og tilgangen gjøres uavhengig av brukernes betalingsevne, bosted og sosiale status. Refusjonsordninger er et velferdsgode og en rettighet for pasienten, og skal også bidra til riktig legemiddelforbruk i befolkningen. Ordningen med offentlig pliktmessig dekning av utgifter til livsviktige legemidler ble innført høsten 1953. Tidligere var det bare visse yrkesbetingede sykdommer som ga rett til trygdemessig dekning av legemiddelutgifter, men forut for lovgivningen i 1953 hadde det vokst frem en del skjønnsmessige bidragsordninger.
Selv om det er gjennomført en rekke endringer og modifikasjoner i stønadsordningene siden de ble innført, er de materielle endringene små, og de målsettinger og prinsipper som lå til grunn for de opprinnelige stønadsordningene gjelder i hovedsak fortsatt. Hovedprinsippet er at trygden skal yte bidrag til utvalgte legemidler, oppført på en særskilt liste, i forbindelse med behandling av nærmere angitte kroniske sykdommer.
En rekke aktører har innflytelse på utformingen av refusjonspolitikken. På myndighetssiden inngår Sosial- og helsedepartementet, Rikstrygdeverket, Statens legemiddelkontroll og Statens helsetilsyn. Andre sentrale aktører er legemiddelbedrifter, legemiddelomsetningsleddene, pasienter og deres organisasjoner, media og legene. Det er myndighetenes hovedoppgave å utforme spillereglene slik at legemiddelpolitiske mål nås. Myndighetene bruker ulike typer virkemidler:
Lover, forskrifter og retningslinjer
Finanseringsordninger
Statistikk- og informasjonssystemer
Stønadsordningene er kanskje myndighetenes viktigste virkemiddel. De viktigste egenskaper ved dagens stønadsordninger er illustrert i tabell 3.3.
Tabell 3.3
| Ordning | Hjemmel | Saksgang | Krav |
| Blåreseptordning: | |||
| Hovedregel for refusjon | Folketrygdloven § 2-5 nr. 3a, jf. Forskrift om godtgjørelse av viktigere legemidler § 1 og 9 | Legen skriver ut resept Pasienten betaler egenandel på apoteket Apoteket får refusjon fra trygdekontoret | sykdommen har gått inn i en langvarig fase behov for langvarig medikasjon sykdomspunkt i § 9 preparatet oppført på medikamentlisten godkjent indikasjon |
| Unntak - sjelden sykdom | Folketrygdloven § 2-5 nr. 3a. jf. Forskrift om godtgjørelse av viktigere legemidler § 2 | Individuell søknad til trygdekontor Egenandel og refusjon som etter hovedregel | sjelden sykdom sjeldent behandlingsalternativ behov for langvarig bruk av legemidlet kostbart preparat godkjent indikasjon, godkjent på annen indikasjon, eller dokumentert effekt av legemiddel inntatt på godkjenningsfritak |
| Unntak - særlige grunner | Folketrygdloven § 2-5 nr. 3a jf. Forskrift om godtgjørelse av viktigere legemidler § 10, annet ledd | Individuell søknad til trygdekontor Egenandel og refusjon som etter hovedregel | sykdomspunkt i § 9 uteblitt effekt av andre legemidler på listen nye legemidler hvor det er ønskelig med kontroll |
| Bidragsordningen | Folketrygdloven § 2-13 | Individuell søknad til trygdekontor Bidrag til pasienten på grunnlag av pasientens samlede utgifter | Legemidlet har markedsføringstillatelse Legemidlet er reseptpliktig Legemidlet er brukt på relevant indikasjon |