4 Introduksjon til genteknologiområdet
4.1 Bakgrunn
Genteknologi er en samlebetegnelse på en lang rekke teknikker som i hovedsak brukes for å endre arvematerialet i organismer. Teknologien for å kunne endre gener og egenskaper til organismer bygger på kunnskap om celler, arvemateriale, gener og egenskaper.
Genteknologi benyttes på mange ulike områder, blant annet til utvikling av nye medisinske behandlinger inkludert vaksiner, innen landbruks- og matproduksjon som et supplement eller alternativ til tradisjonell avl både på planter og dyr, og industrielt til framstilling av ulike biokjemiske produkter. I 1973 ble den første genmodifiserte organismen laget i laboratoriet. Det var en bakterie som hadde fått overført et gen fra en annen bakterie. Det første genmodifiserte dyret, en mus, ble framstilt i 1981. Genmodifiserte planter kom så to år senere. Det første kommersielle produktet framstilt ved hjelp av genteknologi, var insulin til behandling av sukkersyke, som ble produsert i genmodifiserte bakterier, innesluttet i laboratorier. Slik genteknologisk insulinproduksjon erstattet fra 1982 tidligere praksis med å rense ut insulin fra bukspyttkjertelen fra gris og ku, som på det tidspunktet var i ferd med å bli mangelvare. Den første matplanten som ble dyrket kommersielt, kom på markedet i 1994, en tomat med forlenget holdbarhet.
Spesielt det siste tiåret har teknologien vært i en rivende utvikling, blant annet som en følge av oppdagelsen av CRISPR, et enzymkompleks isolert fra bakterier som fra naturens side brukes til å kutte opp og uskadeliggjøre infiserende virus-DNA. De tekniske mulighetene for å foreta endringer i arvematerialet, kan nå spenne fra å endre den minste byggesteinen i arvestoffet til å bygge om eller syntetisere deler av eller hele arvestoffet, samt flytte arvestoff mellom arter. Genteknologi er også blitt lettere tilgjengelig, enklere i bruk og langt rimeligere enn tidligere. Det ligger fortsatt viktige begrensninger i mulighetsrommet, men det er allerede stort og utvides hele tiden. Kommersiell bruk av GMO er i dag i stor grad beskyttet av patenter. Spørsmål knyttet til immaterielle rettigheter og nye genomteknikker er omtalt nærmere i kapittel 7 og kapittel 11.
Genteknologi kan brukes til å utvikle nyttige og gode produkter og løsninger. Fra teknologiens spede start var det lite kunnskap og stor usikkerhet om risiko, og derfor bred enighet om at det var behov for å regulere bruken, med særlig fokus på å forebygge skade. Vurdering av risiko ved framstilling og bruk av genmodifiserte organismer er derfor et helt sentralt element i alt genteknologiregelverk. Bruk av genteknologi reiser dessuten noen viktige etiske spørsmål, se kapittel 9.
I den første delen av dette kapittelet vil vi beskrive sentrale deler av genteknologiens fundament. I den andre delen vil vi gå mer detaljert inn på selve teknologiene, utviklingen av disse, hvilke verktøy som eksisterer, hvordan de virker, samt gi eksempler på bruk. I siste del av dette kapittelet kommer vi også litt nærmere inn på sentrale elementer i reguleringen av genteknologi.
4.1.1 Celle- og molekylærbiologisk kunnskap som bakteppe
Tanken om at grunnleggende livsprosesser er felles for alle organismer, uavhengig av om det dreier seg om bakterier, planter eller dyr, fikk gradvis fotfeste på 1800-tallet. Helt fram til midten av forrige århundre var det imidlertid uklart om DNA eller proteinene representerte arvemolekylene i cellene. Den vanlige oppfatningen var at genene måtte være proteiner, siden proteiner er så mangfoldige og forskjellige og nukleinsyrer har så lite variasjon i sin oppbygning. I 1944 slo imidlertid den amerikanske biokjemikeren Oswald Avery fast at arvestoffet i bakterier faktisk er DNA. Hvordan enkle nukleinsyremolekyler kunne romme så mye genetisk informasjon, var en gåte helt fram til den detaljerte strukturen til DNA ble kjent. I de foregående hundre årene var det gjort en rekke naturvitenskapelige oppdagelser som hadde banet vei.
Ett av de største vitenskapelige gjennombruddene noensinne, var da Charles Darwin lanserte evolusjonsteorien i 1859. I boka The origin of species by means of natural selection, hevdet Darwin at alle arter nedstammer fra mer primitive livsformer og at alt levende er i kontinuerlig forandring. Darwin mente at utviklingen av arter er et resultat av en utvelgelsesprosess over tid. Med utgangspunkt i naturlig variasjon hos en art, er det i første rekke individene som er godt tilpasset og best egnet i det aktuelle miljøet (best fitness) som overlever og overfører sine nedarvede egenskaper til neste generasjon. Darwin hevdet at disse prinsippene også gjaldt menneskers utvikling, noe som falt mange tungt for brystet. Dette ble oppfattet som et angrep på religion og selve skapelsesberetningen, noe som bidro til at det tok tid før Darwins lære ble akseptert, også i vitenskapelige kretser (Hviid Nielsen et al. 2000).
Omtrent samtidig med Darwin ble det gjort banebrytende observasjoner i en klosterhage i Brno, som nå ligger i Tsjekkia. Den østerrikske munken Gregor Mendel begynte i 1850-årene å krysse erteplanter. Mendel tok utgangspunkt i erteplanter som hele tiden ga enten gule eller grønne erter ved selvbestøvning. Når han så krysset gul erteplante med grønn erteplante, ble alle frøene gule. Disse gule frøene ga igjen planter som ved ny selvbestøvning i sin tur hele tiden ga gule og grønne erter, i forholdet 3:1. Mendel observerte også andre egenskaper til erteplanter og avdekket hvordan bestemte trekk kan fordele seg på en fortutsigbar måte og nedarves i avkommet. Mendel hadde avdekket allmenngyldige arvelover. I 1865 ble resultatene hans lansert, men samtiden tok ikke oppdagelsen inn over seg. Arbeidet fikk først betydning etter at det ble gjenoppdaget i vitenskapelige kretser rundt år 1900.
Det var den danske botanikeren Wilhelm Johannsen som i 1909 ga navn til de arvbare karakterene som Mendel hadde oppdaget. Han kalte dem gener. Johannsen introduserte også begrepene fenotype, hvordan en organisme ser ut og opptrer i et gitt miljø, og genotype, den samlede genetiske informasjonen – alle genene – til en organisme.
Den nye genetiske læren vant gradvis terreng og slo rot innenfor biologisk og medisinsk forskning, også i Norge (Hviid Nielsen et al. 2000). Av de første som gjorde plantestudier basert på mendelske prinsipper var Werner Hosewinckel Christie (1877–1927). Han forsket på kornsorter, poteter og erter på Hjellum, en statlig forsøksstasjon ved Hamar.
Som medisinerstudent tilbragte Kristine Bonnevie (1872–1948) mye tid på Zoologisk laboratorium i den midtre, ærverdige bygningen til universitetet, i sentrum av Kristiania. Bonnevie ble aldri lege, men i stedet biolog. I 1912 ble hun oppnevnt som Norges første kvinnelige professor i zoologi. I tiltredelsesforelesningen refererte Bonnevie til de mendelske arvelovene. Gjennom studiereiser til flere av verdens ledende cytologer (celleforskere), kunne Bonnevie kople sin forskning innenfor eksperimentell biologi med studier av celler, kromosomer og arvelighet. I 1916 etablerte hun et eget institutt for arvelighetsforskning.
En viktig kraft i miljøet rundt professor Bonnevie var Otto Lous Mohr (1886–1967), som også var tidlig ute med genetiske studier, først i gresshopper fanget ved universitetets forskningsstasjon i Drøbak, senere i bananflue. Etter avlagt doktorgrad i 1917 fikk Lous Mohr arbeide et år ved den absolutte forskningsfronten på feltet, i Thomas Hunt Morgans «fluerom» og laboratorium ved Columbia-universitetet i New York. Morgan fikk senere nobelprisen i medisin (etter forslag fra Lous Mohr), for å ha vist at hvite øyne hos hannbananfluer ikke de normale røde, skyldes et mutert gen på kjønnskromosom X. Morgans lærebok i genetikk fra 1915, The Mechanism of Mendelian Heredity, ble omtalt som en milepæl da den kom, og sammenliknet med andre naturvitenskapelige gjennombrudd, på linje med dem Newton og Galilei hadde stått for, flere hundreår tidligere.
Morgan klekket ikke bare ut bananfluer, men også briljante studenter. En av dem, Joseph Muller, fikk også nobelprisen. Muller skulle vise sammenhengen mellom omfanget av mutasjonene som oppstår i kromosomene og doseringen av radioaktiv stråling.
Nøkkelen til å forstå hvordan genene fungerte, lå i DNA-molekylets struktur. Kristine Bonnevie hadde allerede i 1908 publisert et arbeid som antydet at kromosomene var spiralformet. Da det ble kjent at DNA var arvemolekylet på 1940-tallet, startet et intenst kappløp for å beskrive oppbyggingen i nærmere detalj. Arbeidet til kjemikeren Rosalind Franklin, og hennes røntgenkrystallografi av DNA-molekylet, var avgjørende for å forstå dobbelheliksstrukturen til DNA-molekylet. En annen viktig tidligere oppdagelse ble gjort av den amerikanske biokjemikeren Erwin Chargaff, som kunne demonstrere at i alle DNA-prøver, uansett fra hvilken organisme, så er mengden av basen adenosin lik thymin og cytosin lik guanin (se fig. 4.1). Æren for oppdagelsen tilfalt til slutt amerikaneren James Watson sammen med engelskmannen Francis Crick i 1953. Publikasjonen deres på én side i tidsskriftet Nature 25. april er kanskje det viktigste naturvitenskapelige arbeidet i det 20. århundre. Den norske forskeren Sven Furberg (1920-1983) er også av dem som er sitert i Watson-Crick-publikasjonen fra 1953. Han hadde vist at det flate sukkermolekylet i DNA stod loddrett på det flate basemolekylet i hvert nukleotid (Brøgger 1975).
Watson og Crick hadde beskrevet DNA-molekylet som en dobbelttrådet spiral (heliks), der vridningen er et resultat av de kjemiske byggestenene i molekylet. I kjølvannet fulgte også forklaringen på hvordan DNA-molekylet kan kopieres før celledelinger og hvordan den genetiske koden virker. Innledningsvis i artikkelen sier Watson og Crick: This structure has novel features which are of considerable biological interest. Her hadde virkelig forskerne sine ord i behold. Med DNA-strukturen som utgangspunkt, forstod man nemlig raskt hvordan DNA-molekyler kunne romme så mye informasjon. Kun fire bokstaver i alfabetet gir selv med korte DNA-sekvenser enorme variasjonsmuligheter. En ti baser lang sekvens har over en million ulike kombinasjoner (410), og et gens størrelse er gjerne fra noen hundre baser og opp til flere hundre tusen baser langt.
4.1.2 Oppbygning av arvematerialet
I hver eneste celle er det deoksyribonukleinsyre (DNA) som inneholder oppskriftene til hvordan organismene skal se ut og oppføre seg. På DNA ligger genene på rekke og rad. Hvert gen er en arbeidstegning for en struktur i cellen og har sin bestemte plass på DNA-tråden. En typisk bakterie kan ha 2500 gener, vi mennesker har ti ganger så mange. Alt arvematerialet, alt DNA-et i en organisme, kalles genomet. Mer enn 98 % av det humane genomet er derimot ikke gener og har andre funksjoner. Gener reguleres og uttrykkes ulikt i ulike celler og vev, se figur 4.3 i kapittel 4.1.4.
En DNA-tråd i en celle kan pakkes tett sammen ved hjelp av proteiner, denne strukturen kalles et kromosom. Arvematerialet i en organisme er organisert i ett eller flere kromosomer. Antall kromosomer i en celle vil avhenge av hvilken art vi snakker om.
Bakterier, arkebakterier og virus har ikke cellekjerne, de har ett kromosom og er såkalt haploide1. Alle planter, dyr, sopp og andre livsformer har kromosomer lokalisert i en cellekjerne, de er eukaryote. hvor kromosomene som utgangspunkt forekommer i par. Mennesker har for eksempel 23 kromosompar, totalt 46 kromosomer i hver celle. Av disse er 23 arvet fra mor og 23 arvet fra far, fra hver sin haploide kjønnscelle. De fleste dyr har, som mennesker, ett par av hvert kromosom. Disse er såkalt diploide1 arter. Mange planter, og en del andre organismer inkludert noen dyr har flere enn to kromosompar. Slike arter kalles polyploide1. Hvor mange kopier som finnes av et kromosom, kan være av stor betydning for mulighetene for å oppnå en gitt genetisk endring av egenskap.
Forklaringen på hvorfor DNA kan romme så mye informasjon, ligger i molekylets oppbygning. DNA ser ut, som tidligere nevnt, som lange vindeltrapper med stigetrinn (se figur 4.1). DNA-molekylet har to tråder som korresponderer og er bundet sammen kjemisk, men strukturelt går de motsatt vei av hverandre (de er antiparallelle). Byggesteinene i DNA-molekylet kalles nukleotider. Vangene i vindeltrappen består kun av ensartede sukker- og fosfatmolekyler. I stigetrinnene finner vi de fire ulike nitrogenbasene adenin, cytosin, guanin og thymin (A, C, G og T). T er alltid kjemisk bundet til A på den andre tråden, mens C alltid er i kjemisk parring med G. Det er rekkefølgen på disse fire bokstavene som gir variasjon og utgjør den genetiske koden hos alle levende organismer. For at informasjonen i DNA skal kunne oversettes til instruksjoner i cellen må det leses og oversettes. Første ledd i slike prosesser er alltid avlesing og kopiering til et enkelttrådet molekyl som kalles ribonukleinsyre (RNA), hvor nukleotiden T er erstattet med uracil (U). RNA finnes i mange ulike former som igjen har ulike funksjoner. Et gen gir opphav til ett eller flere2 budbringermolekyl (mRNA), og tre og tre baser i mRNA inngår i hver sine kodon, som igjen korresponderer til én og én aminosyre. Det finnes 43 = 64 kombinasjoner av kodoner. Ett av disse er universell start, som koder for aminosyren metionin, og tre av dem er universelle kodoner som signaliserer stopp i proteinsyntesen. De øvrige koder for spesifikke aminosyrer. Fordi det normalt kun er 20 aminosyrer som benyttes i proteinsyntese, er det noen aminosyrer som kodes av flere enn ett kodon. Hvert kodon har også et spesifikt transfer RNA (tRNA), og antall forekomster av de ulike tRNA varierer mellom arter og kan derfor også påvirke hvor godt eller dårlig avkoding av et gen vil fungere i en eventuell annen organisme.
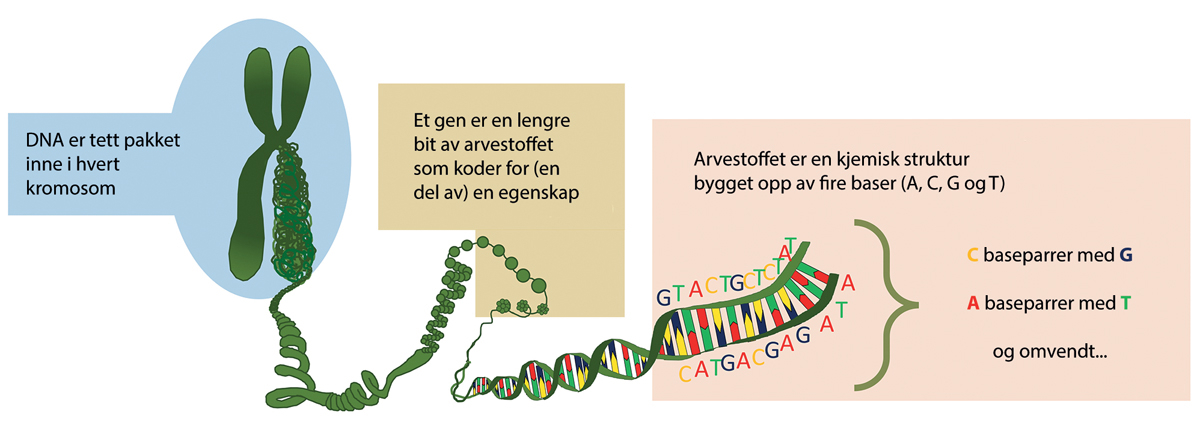
Figur 4.1 Arvestoffets oppbygning er kompleks, og inneholder utgangspunktet for de funksjonelle egenskapene til en organisme, kodet i gener. På detaljnivå er arvestoffet bygget opp av fire baser, og det er den spesifikke rekkefølgen av baser i et gen som utgjør koden (hvilken egenskap genet bidrar til å gi organismen).
Figur: Arne Holst-Jensen
Proteinsyntesen i cellene oversetter et gen til proteiner ved å bygge kjeder av aminosyrer på grunnlag av et mRNA som er en enkelttrådet kopi av det aktuelle genet.
4.1.3 Overføring av genetisk materiale via arv
Hva som arves fra en generasjon til en annen, er avhengig av hvordan DNA-et i cellene fordeles når cellene skal dele seg. Type formering, ukjønnet (også kalt vegetativt, ved at et individ kopierer sitt eget arvemateriale), eller kjønnet formering, bestemmer også hvordan arvematerialet nedarves.
Generelt er ukjønnet formering mindre utbredt i dyr, men det er relativt vanlig i planter. Knoppskyting er en form for ukjønnet formering i planter, en celledannelse der den nye cellen vokser ut som en knopp fra morcellen og etter hvert snøres av. Dette nye individet er genetisk identisk med morcellen, det vi kaller en klon. Knoppskyting er ikke vanlig bare i planter, men også i sopp, og i nesledyr (polyppdyr, f.eks. maneter og koralldyr). Sopp er eukaryote organismer og kan ha både vegetativ og kjønnet formering.
Kjønnet formering krever to foreldre med ulikt kjønn, hvor kjønnsceller bringer arvemateriale fra hver forelder videre til avkommet. Ved vanlig celledeling (mitose) slik det foregår i mesteparten av kroppen, og ved vekst, dannes to identiske datterceller med likt genetisk materiale. Men i kjønnscellene, ved meiosen, er det et poeng at arvematerialet blandes, og på en tilfeldig måte (rekombinasjon av DNA i meiose I), slik at avkommet har forskjellige kombinasjoner av arvemateriale sammenlignet med foreldregenerasjonen3. Slik strukturell variasjon i tillegg til nye mutasjoner i arvematerialet, kan gi opphav til nye kombinasjoner av egenskaper som kan være nyttige for arten. Å sikre genetisk variasjon er viktig for at arten skal ha mulighet til å tilpasse seg nye leveområder og utvikle seg.
Fordi det er kjønnscellene som gir opphav til neste generasjon, er det i disse cellene endringer i DNA-et må være til stede for at de skal kunne arves, eller nedarves, som også gjerne brukes som begrep. Dersom endringer i DNA-et kun er til stede i kroppens somatiske celler (alle andre celler bortsett fra kjønnscellene), vil ikke disse arves ved kjønnet reproduksjon.
4.1.4 Koblingen mellom gener, egenskaper og miljø
Alt liv på jorda består av celler. De ulike strukturene i cellene er hovedsakelig bygd opp av proteiner. Proteinene er aminosyrer koblet etter hverandre i kjeder (peptider). Måten disse folder seg på og danner ulike romlige strukturer, noe som igjen er bestemmende for proteinenes egenskaper, er avhengig av de kjemiske bindingene mellom aminosyrene og faktorer som temperatur, trykk og surhetsgrad i omgivelsene. Ved å variere typen aminosyre og rekkefølgen av dem, kan det i teorien dannes et uendelig antall ulike proteiner. Det er også proteiner som styrer de fleste biokjemiske prosessene inne i cellene. Disse proteinene kalles enzymer.
Sammenhengen mellom gener og de faktiske egenskapene hos en organisme er kompleks, og påvirkes av situasjonen som den enkelte celle eller organisme befinner seg i. En velfungerende organisme må respondere på ytre stimuli. Celler må også «vite» hvor i en sammensatt (flercellet) organisme de befinner seg slik at de kan skru av og på de riktige genene. Denne reguleringen styres delvis av små signaler på det dobbelttrådete DNA-et (metyleringer) men også av ulike andre signalsystemer, blant annet påvirkes de ofte av mengden av genets sluttprodukt.
Når et gen er aktivt (skrudd på) blir det laget en enkelttrådet kopi av genet, i form av et mRNA. Dette budbærer-RNA (mRNA, messenger-RNA) oversettes videre til kjeder av aminosyrer som gjennom spesifikke tredimensjonale foldinger danner funksjonelle proteiner. Proteinene er i sin tur vesentlige for at de riktige kjemiske prosessene i cellene, og dermed egenskapene, skal komme til uttrykk (figur 4.2). Observerbare egenskaper kalles fenotypiske. Ofte skyldes en observert egenskap samspillet mellom flere gener, eller et gen kan påvirke flere ulike egenskaper (figur 4.3). Det er også mange steg i veien fra DNA til protein som kan reguleres på forskjellige vis.
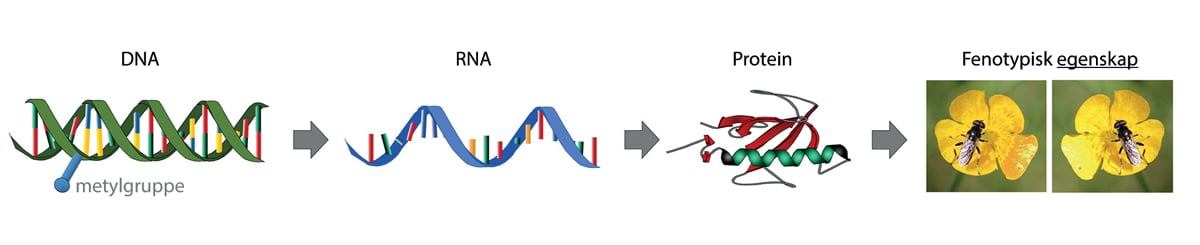
Figur 4.2 Fra DNA og gen til egenskap i organismen. I cellene avleses DNA til RNA, som ligner, men strukturelt er noe forskjellig fra DNA. En bestemt type av RNA (mRNA) avleses og oversettes videre til aminosyrekjeder som danner proteiner gjennom komplekse koblinger, og proteinene er alene eller flere sammen, ansvarlige for de funksjonelle (fenotypiske) egenskapene til organismen. På DNA-molekylet sitter det også metylgrupper, og også andre kjemiske komponenter, som kan påvirke uttrykket og effekten av et gen. Disse mønstrene kan endres ved hjelp av genteknologi, men generelt er de dynamiske og påvirkes i stor grad av miljøfaktorer (både kjente og ukjente).
Figur: Arne Holst-Jensen
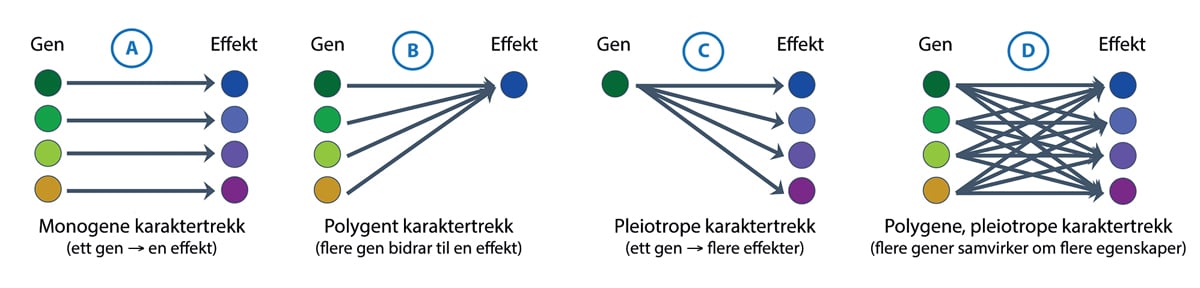
Figur 4.3 En genetisk kodet funksjonell egenskap i en organisme påvirkes i noen tilfeller av et enkelt gen (monogen effekt), og i andre av flere gener (polygen effekt). På samme måte kan et gen i noen tilfeller påvirke bare en kjent egenskap og i andre tilfeller flere egenskaper. Kunnskap om dette samspillet er en viktig del av vurderingsgrunnlaget for helse- og miljørisikovurderinger.
Figur: Arne Holst-Jensen
Epigenetiske forandringer (epigen = utenpå gen) er modifikasjoner av det genetiske materialet som kan endre genuttrykk uten å endre den genetiske koden selv. Slike naturlige modifikasjoner til genomet, inkluderer «kjemiske merker» lagt til DNA eller til proteinene som hjelper til med å organisere og pakke DNA i kjernen. Den viktigste funksjonen til epigenetikk er å kontrollere genuttrykk, celledifferensiering og utvikling. Ved å legge til eller fjerne epigenetiske (kjemiske) signaler på DNA og de tilknyttede proteinene, vil cellen endre genenes aktivitetsnivå. Slike gener både aktiveres og nedreguleres eller undertrykkes, noe som kan endre celledifferensiering og funksjoner. Epigenetiske endringer for å slå gener av og på skjer hele tiden som respons på endringer i organismens miljø. Epigenetiske modifikasjoner spiller også en kritisk rolle i å opprettholde stabilitet i genomet og beskytte genomet mot skade eller mutasjon. I tillegg kan epigenetiske endringer påvirkes av miljøfaktorer som kosthold, stress og eksponering for giftstoffer. Noen studier viser at visse epigenetiske merker kan gå i arv, blant annet i planter. Arvelighet av epigenetiske merker er et omdiskutert tema, spesielt i dyr (Fitz-James & Cavalli 2022).
Det er i hovedsak tre epigenetiske mekanismer; (1) metylering av DNA, (2) ulike kjemiske grupper (f.eks. metyl eller acetyl) som festes til, eller fjernes fra DNA, proteiner (histoner) som DNA-tråden er viklet rundt, og (3) små, ikke-kodende RNA-tråder (referert til som RNAi, omtalt i avsnitt 4.3.3 nedenfor). Alle disse mekanismene bidrar til å regulere uttrykk av gener (altså om genet er aktivt eller ikke), men også å regulere andre DNA-elementer i genomet. Både DNA-metylering og RNAi kan i hovedsak sies å redusere genuttrykk, mens modifisering av histonproteiner både kan regulere gener opp og ned, avhengig av typen kjemisk gruppe (type histonmodifisering) som festes eller fjernes. Epigenetiske endringer i DNA kan ikke, i motsetning til mutasjoner, påvises ved bruk av standardisert DNA-sekvensering.
4.1.5 Mutasjoner
Mutasjoner er varige endringer i DNA-et til en organisme. Disse skjer i alle organismer, og kan enten oppstå spontant som følge av feil i cellenes egne funksjoner ved kopiering av DNA-et ved celledeling, eller som en følge av ytre påvirkning, for eksempel stråling, kjemikalier eller genteknologi.
Hos organismer med kjønnet reproduksjon vil mutasjoner i kjønnsceller være arvbare. I arter med klonal reproduksjon, som de fleste mikroorganismer, men også mange planter og noen dyr, kan det også være andre celler enn kjønnscellene som kan gi opphav til nye individer. Mutasjoner, og særlig de som er arvbare, er sammen med ulike forhold i miljøet en av drivkreftene i evolusjonen.
Det finnes ulike typer mutasjoner av arvematerialet og effekten av disse vil altså variere ut ifra hvor de skjer i genomet og miljøet til organismen. De minste mutasjonene er punktmutasjoner, hvor ett enkelt basepar endres til ett annet. Slike mutasjoner kan blant annet gi opphav til endrede aminosyresekvenser i et protein, dersom en slik mutasjon skjer i et aktivt gen. De kan også føre til at det oppstår et stoppkodon slik at genet ikke blir funksjonelt (knock-out).
En annen type mutasjoner er såkalte innsettinger og slettinger (delesjoner), som sammen er kjent som «indels» (insertions and deletions). Slike indels varierer i lengde fra ett basepar, til lengre sekvenser og deler av kromosomer. Mutasjoner kan også føre til større endringer som flytting av gener mellom kromosomer (translokasjon), og større kromosombrudd. Hvis slike mutasjoner oppstår i et aktivt gen, leder det ofte til tap av genfunksjon.
Effekten av mutasjoner for organismen kan være positiv, nøytral eller skadelig, avhengig av type mutasjon og hvor mutasjonen opptrer. Enkelte mutasjoner kan ha positiv effekt, slik som en mutasjon som gir mennesker resistens mot hiv-smitte, men de aller fleste ikke-nøytrale mutasjoner er vist å være skadelige for organismen. For eksempel kan en punktmutasjon i et gen som styrer celledeling, gi opphav til kreftceller. Celler har omfattende apparater for DNA-reparasjon og korrekturlesing, og skal slik holde DNA-et intakt og sørge for at cellenes funksjon opprettholdes over tid. Mutasjonsraten i celler vil aldri være lik null, ettersom kostnaden for det biologiske systemet vil være for stor over tid til å reparere og korrekturlese alt DNA i alle celler til enhver tid (Loewe & Hill 2010).
Forskere har studert mutasjoner og brukt cellens DNA reparasjonssystemer for å studere sammenhengen mellom gener og organismenes egenskaper. Blant annet fant man på 1920-tallet at røntgenstråler var i stand til å utløse fenotypeforandringer hos bananflue. En rekke metoder blomstret deretter opp for å introdusere slike fenotypiske endringer. Disse metodene kan gjerne deles inn basert på type mutagen4; fysiske mutagener (stråling), kjemiske mutagener (bruk av ulike kjemikalier) og biologiske mutagener (som det å forårsake mutasjoner ved hjelp av virus). Slike mutageneseteknikker (genese = å skape; mutagenese = skape mutasjoner) kan introdusere tusenvis av mutasjoner samtidig. Flere av disse vil ha liten effekt, mens noen vil ha utslagsgivende effekt og endre fenotype eller fitness for de muterte organismene.
I kjente plante- og dyremodellorganismer slik som vårskrinneblom (Arabidopsis thaliana), bananflue (Drosophila melanogaster) og sebrafisk (Danio rerio) har man ved å mutere genomene og deretter studere hvilke fenotyper som har oppstått, også i mange tilfeller klart å finne ut hvilket (eller hvilke) gen(er) som fører til en gitt egenskap. Dette er forskning som har foregått i stor skala siden midten av 1980-tallet. Basert på denne, og liknende forskning, kjenner vi nå funksjonen til mange gener og proteiner i disse organismene.
I mus har det siden begynnelsen av 1980-tallet vært mulig å lage målrettede endringer i gener via en metode som på engelsk kalles homology-directed repair (HDR). Denne teknikken baserer seg på en type DNA-reparasjonsmekanisme som kalles homolog rekombinasjon, der DNA-sekvenser med mutasjoner byttes ut med sekvensen som ligger på det tilsvarende andre (homologe) kromosomet. Metoden baserer seg på å erstatte et normalt gen med et defekt gen i stamceller, og gjennom videre avl lage mus som mangler det spesifikke genet, som altså er «slått ut». Ved hjelp av denne metoden kjenner vi nå funksjonen til en stor andel av pattedyrenes, inkludert menneskets, proteiner.
4.2 Fra klassisk avl til genmodifiserte organismer
4.2.1 Klassisk avl
I tusenvis av år har mennesker gjennom avlsarbeid endret planter og dyr ut fra et ønske om å få mer og bedre mat og dyr som fungerer bedre for ulike formål. Slik avl er avhengig av at det har oppstått tilfeldige endringer i genomet (mutasjoner) til planten eller dyret, og at mennesker kan selektere for ulike arvbare egenskaper. Etter hvert har ny kunnskap og vitenskap knyttet til planteforedling og dyreavl, samt teknologisk utvikling, gitt muligheter for å øke frekvensen av mutasjoner, tempoet og presisjonen i foredlingsarbeidet. Avl og foredling baserer seg på å gjøre utvalg i tilgjengelig genetisk variasjon. Dersom en ønsket genetisk egenskap ikke finnes i et avlsmateriale, har man lang tradisjon for å frembringe en variant av den ønskede egenskapen ved bruk av mer eller mindre teknologiske løsninger. Noen av disse teknologiske løsningene defineres i dag som genteknologiske, mens andre faller utenfor denne definisjonen. Konvensjonell mutagenese er for eksempel definert som en genteknologi i EUs utsettingsdirektiv, men samme sted definert som unntatt fra regulering. I den norske genteknologiloven er konvensjonell mutagenese ikke definert som genteknologi.
4.2.2 Konvensjonelle mutageneseteknikker
Konvensjonell mutagenese har siden 1920-tallet vært en vanlig avlsmetode på verdensbasis, særlig i planter, men har også blitt benyttet i dyr, inkludert fisk (National Research Council 2004). Her kan det brukes kjemikalier eller for eksempel stråling for å lage genetiske forandringer i form av tusenvis av ukjente og tilfeldige mutasjoner i arvematerialet til organismen. Denne typen teknologi induserer et stort antall tilfeldige mutasjoner spredt ut over genomet. Slik mutagenese har både vært benyttet for å skape tilfeldige nye egenskaper og for å få fram en spesifikk ønsket egenskap. Utfordringen ved å finne fram til et individ med de ønskede mutasjonene/egenskapen som man kan avle videre på, ligger både i faktisk å identifisere dette individet, men også å forsøke å unngå at det parallelt følger med en rekke mer eller mindre uønskede og negative egenskaper. Først etter mange generasjoner med kryssingsarbeid for å redusere andelen uønskede mutasjoner kan man forvente å ha utviklet et ønsket produkt med de(n) ønskede mutasjonen(e). I praksis vil det ferdige produktet fortsatt ha et stort antall slike utilsiktede mutasjoner når man bruker konvensjonell mutagenese i avl.
I en database driftet av FAO sammen med IAEA Center of Nuclear Techniques in Food and Agriculture5, er det samlet i overkant av 3200 plantesortlinjer som har blitt utviklet ved bruk av konvensjonell mutagenese. Før mer avanserte genteknologiske metoder kom mot slutten av 1900-tallet, var dette den mest brukte metoden for å oppnå større genetisk variasjon i et sortsmateriale. Noen eksempler på plantesorter som er utviklet gjennom konvensjonell mutagenese, inkluderer bygg, ris, soyabønner, hvete og ulike frukter og grønnsaker. Konvensjonell mutagenese har gjennom årene i stor grad blitt erstattet av nyere foredlingsteknikker.
4.2.3 Etablerte metoder for genmodifisering
Etablerte metoder for genmodifisering baserer seg på å overføre funksjonelle gener med ønskede egenskaper til en mottakerorganismes genom. Slike funksjonelle gener kan bestå av elementer fra en hvilken som helst art, og vil som regel inkludere minst tre elementer: en promotor, et kodende gen og en terminator. Promotoren er med på å bestemme når og hvor i organismen genet skal være aktivt, og terminatoren virker som et stoppsignal i genomet. Det kodende genet er den delen som faktisk oversettes for å bli (en del av) et protein. Hvis minst ett av elementene kommer fra en art som mottakerorganismen ikke kan krysses med naturlig, snakker vi om et transgen. Dersom hele det funksjonelle genet er fra en donor som mottakerorganismen kunne vært krysset med, snakker vi om et cisgen. Dersom elementer er plukket fra ulike kryssbare arter, og satt sammen i en ny genkonstruksjon, kalles dette et intragen. Det er de transgene organismene som først og fremst finnes på markedet i dag.
Slik genmodifisering ble i sin tid mulig på grunn av såkalt rekombinant DNA-teknologi som ble utviklet på 1970-tallet, kun noen tiår etter at man hadde funnet ut at DNA-molekylet var arvematerialet i organismer, og bærer av gener. Denne teknikken består både av metoder for å isolere rent DNA fra både mikroorganismer, planter og dyr, og enzymer som klipper i DNA-et (restriksjonsenzymer) og kan lime DNA-biter sammen igjen (ligase-enzymer). Med disse teknikkene kunne man med ett isolere DNA fra ulike kilder, klippe ut forskjellige biter av DNA-et og lime sammen igjen til helt nye gener, eller hente hele gener og sette dem inn igjen i annen genetisk bakgrunn enn den de kom fra.
Et eksempel på en transgen plante i kommersiell bruk er en maisplante som har fått satt inn et gen bestående av en promotor fra blomkålmosaikkvirus (CaMV), terminator (T-nos) fra jordbakgerien Agrobacterium tumefaciens, sammen med en kodende gensekvens fra bakterien Bacillus thuringiensis (f.eks. et modifisert cry-gen).
Slik genmodifisering er avhengig av å flytte det aktuelle genet inn i mottakercellen på en eller annen måte. I planter er det to teknikker som i all hovedsak har vært benyttet til dette: genkanon og overføring via et transformasjonssystem som finnes naturlig i jordbakterien A. tumefaciens. Ved bruk av genkanon, skytes små metallpartikler som er dekket med den ønskede genkonstruksjonen inn i cellekjernen hvor konstruksjonen (DNA-et) potensielt integreres i kromosomalt DNA. Cellen utvikler seg deretter til en ny plante som kan formeres videre. Velger man å genmodifisere ved hjelp av Agrobacterium, utnytter man denne bakteriens naturlige evne til å infisere planter og overføre eget genmateriale til mottakerplantens genom. Først modifiserer man da bakteriens Ti-plasmid, slik at det inneholder den ønskede genkonstruksjonen. Planten blir da i neste steg genmodifisert ved at plasmidet integrerer i plantens genom.
Den vanligste transgene teknologien som brukes i dyr, er injeksjon av fremmed DNA inn i kjernen til et befruktet egg. Denne teknikken har blitt brukt til å skape genmodifiserte dyr, blant annet en rekke mus, rotter, griser og kyr. Ved bruk av denne metoden integreres fremmed DNA i genomet til det utviklende embryoet, og det resulterende dyret vil bære transgenet i alle sine celler. Andre transgene teknologier som brukes i dyr, inkluderer retroviral-mediert genoverføring, transposon-teknologer og embryonisk stamcellebasert HDR-teknologier for geninnsetting.
Brukes disse etablerte genmodifiseringsteknikkene, kan man ikke styre hvor genet havner eller antall kopier av genet som settes inn, og for forekomsten av utilsiktede endringer i genomet. Det er seleksjon i etterkant av et transformasjonsforsøk som avgjør hvilke tilfeldige innsettingspunkter som blir avlet på videre. I polyploide organismer, som mange planter, fisk og amfibier, finnes det gjerne flere funksjonelle kopier av hvert gen, noe som gjør genomet mer tolerant for slike mutasjoner (Singer et al. 2021).
4.3 Genomredigering og nye teknikker
4.3.1 Genredigering
Konvensjonelle mutageneseteknikker introduserer mange mutasjoner på tilfeldige steder i genomet, mens man ved de eldre genmodifiseringsteknikkene setter inn genetiske konstruksjoner på tilfeldige steder i genomet til mottakerorganismen. I det siste tiåret har genteknologiområdet blitt revolusjonert av nye genomredigeringsteknikker som gjør det mulig å gjøre endringer på forhåndsbestemte steder i DNA-et. Man kan dermed endre eller slå ut et helt spesifikt gen i en plante, dyr eller mikroorganisme, eller sette inn et nytt gen på en helt spesifikk plass i genomet. Nye begreper for å forstå disse teknikkene opp mot de konvensjonelle, etablerte teknikkene, har gitt dem navn som «målrettet mutagenese», som motpart til «tilfeldig mutagenese», som skjer ved konvensjonelle mutageneseteknikker. «Nye genomteknikker» (NGT) eller «nye avlsteknikker» (engelsk: new breeding techniques, NBT) blir også brukt. Begrepene brukes og forstås ulikt i ulike deler av litteraturen. Flere av de nye genredigeringsteknikkene brukes ikke bare for å gjøre små genomendringer, men kan også benyttes for innsetting av store genkonstruksjoner, som ved konvensjonell genmodifisering.
En av de første teknologiene som tillot målrettede mutasjoner, var basert på bruk av korte oligonukleotider (RNA eller enkeltrådet DNA på omkring 20-100 baser) som inneholdt en gensekvens med ønsket mutasjon i det genet man ville endre. Denne teknikken, kalt ODM (Oligo Directed Mutagenesis), aktiverer cellens reparasjonssystem ved innføring av oligonukleotidsekvensen i celler. Forskningsresultater på dette ble publisert allerede på slutten av 1980-tallet (Sauer et al. 2016, Moerschell et al. 1988). Med oligonukleotiden som templat for reparasjon, oppstår den ønskede mutasjonen i noen av cellene. ODM-teknikken kan også brukes til å lage stopp i gener slik at det genet taper funksjon, eller endrer genuttrykket. ODM-teknologi fungerer med en lavere effektivitet enn andre genomredigeringsteknikker utviklet senere.
Oppdagelsen av at man kunne bruke lokasjonsspesifikke restriksjonsenzymer (SDN) eller «målrettede DNA-klippeenzymer» for å klippe i DNA, har revolusjonert mulighetene for å gjøre endringer i genomet uten å tilføre DNA fra andre organismer. Klippeenzymene gjenkjenner spesifikke sekvenser i DNA-et og klipper DNA-tråden på målstedet i arvematerialet. Dette setter i gang cellens DNA reparasjonssystem, noe som fører til endringer på forutbestemte steder i organismens eget DNA (inne i cellen). Kjente SDN-enzymer er Zinc Finger Nuclease (ZFN), TALENS og Cas9.
CRISPR/Cas9 er den mest kjente målrettede NGT-genteknologien og det var oppdagelsen av denne (Jinek et al. 2012) som gjorde at Jennifer A. Doudna og Emmanuelle Charpentier fikk nobelprisen i 2020 for utviklingen av en metode for genredigering. Metoden er en videreføring av et naturlig forsvarssystem som bakerier har mot virus, der CRISPR (Clustered Regularly Interspaced Short Palindromic Repeats) er en del av minnet i bakteriers immunforsvar. CRISPR koder for et RNA som kalles guide RNA (gRNA).
I teknologien kombineres Cas9-enzymet med et DNA-bindende RNA-molekyl (gRNA) som klipper i DNA tråden der gRNA binder i genomet. Ved klipping av DNA, er det to reparasjonsmekanismer som kan aktiveres i cellen: «non-homologous end joining (NHEJ)» eller «homology-directed repair» (HDR). Teknologien fungerer godt for å kutte på ønsket sted i de fleste planter, dyr og mikroorganismer den er blitt testet ut i.
NHEJ er reparasjonsmekanismen som celler vanligvis bruker for å reparere DNA-brudd. Når Cas9-enzymet kutter DNA-et, blir endene gjenkjent av cellens reparasjonsmaskineri. NHEJ gjenforener deretter de to løse endene av DNA-et, noe som oftest resulterer i sletting eller innsetting av nukleotider. Denne reparasjonsprosessen kan brukes til å forstyrre spesifikke gener ved å introdusere endringer i DNA-tråden, som endrer leserammen i genet og forhindrer produksjonen av funksjonelt protein. Metoden har blant annet blitt brukt i laks for å lage albino fisk (Edvardsen et al. 2014). Albino-laks er ikke et avlsmål i seg selv, men en enkel metode å bruke ved metodeutvikling (som den nevnte studien), siden man bare trenger å analysere de fisk som mangler pigment for mutasjoner. Både i denne og i mange andre studier, har man sett at slik målrettet mutagenese veldig effektivt muterer det tiltenkte genet. Imidlertid får man mange typer av mutasjoner på målstedet i første generasjon, såkalt mosaikke organismer. Dette er et eksempel på bruk av SDN-1 teknikk.
For å få organismer som er mindre mosaikke og har mer av den ønskede endringen, kan man i genredigerte organismer bruke korte oligonukleotidsekvenser i kombinasjon med CRISPR/Cas9. Dette innebærer bruk av et kort, syntetisk DNA-molekyl, kalt et oligonukleotid (20-100 baser), som er designet for å introdusere en spesifikk endring i DNA-sekvensen på målstedet. Slik oligonukleotid-dirigert mutagenese (ODN) i kombinasjon med andre målrettede mutageneseteknikker kan brukes til å introdusere små endringer, for eksempel enkeltnukleotid-substitusjoner eller små innsettinger eller slettinger, og kan være mer effektivt enn HDR i noen tilfeller. Dette kan brukes for å få organismer som er mindre mosaikke, eller bare har en ønsket baseforandring, slik det har blitt gjort i laks for det samme albinogenet (Straume et al. 2020). Dette er et eksempel på bruk av SDN-2 teknikk.
En tredje metode er målrettede kutt i DNA og med innsetting av større DNA-molekyler, for eksempel hele gener. Ved HDR brukes for eksempel et helt gen i kombinasjon med kortere sekvenser som er homologe til målstedet. Donor-DNA kan designes for å introdusere spesifikke endringer i DNA-sekvensen, for eksempel ved å sette inn et cis- eller transgen. HDR er imidlertid mindre effektivt enn NHEJ og krever at cellen er i en spesiell fase av cellesyklusen, og begrenser dermed bruken for visse applikasjoner. Dette er et eksempel på bruk av SDN-3 teknikk.
Med genredigeringsteknikker som CRISPR/Cas9, kan man på en enklere måte i forhold til tidligere teknologi oppnå de genetiske endringene man ønsker i de fleste arter. Det er ulike måter å få CRISPR/Cas9-systemet inn i cellen avhengig av art og organismetype. Man kan på ulike vis føre inn Cas9 i cellene, enten som DNA, RNA eller protein, og man kan benytte de samme metodene som i etablerte genmodifiseringsteknikker til overføring. Som oftest trenger man heller ikke å screene gjennom et stort antall individer for å identifisere om noen har en ønsket genotype. Dette er fordi teknikken jevnt over har så høy effektivitet, i motsetning til tidligere teknologier. Ved bruk av slik målrettet teknologi kan man derfor med større hyppighet oppnå ønsket resultat på kortere tid og med mindre ressursbruk, for eksempel færre forsøksdyr. Dette gjelder i de tilfeller genetikken er kjent for organismen og egenskapen kan oppnås med noen få endringer. De fleste avlsmål i planter og dyr reguleres av flere gener og egenskaper, kalt multigene egenskaper, noe som representerer en vesentlig begrensning i mange tilfeller.
Ved målrettet mutagenese kuttes DNA-molekylet på et punkt der et spesifikt sekvensmotiv er til stede i genomet, og dette induserer så en mutasjon. Mange studier har vist at de utilsiktede genetiske endringene som oppstår i eller utenfor det aktuelle genet er sjeldne sammenlignet med de som oppstår med konvensjonell mutagenese (EFSA 2021, Singer et al. 2021). Ideelt sett bør målsekvensen til gRNA bare binde til ønsket plass i genomet. Hvis gRNA har affinitet andre steder, kan det oppstå kutt i DNA tråden på steder som ikke var tiltenkt i genomet (off-target), noe som igjen kan gi delesjoner, innsetting eller omrokkering av DNA. Ved bruk av målrettet mutagenese vil man derfor kunne forvente at off-target mutasjoner fremfor alt skjer i DNA-sekvenser som er svært like dem som ønskes endret. Man kan på forhånd undersøke spesifisiteten til gRNA «in silico» mot sekvensen av hele genomet, og etter bruk sjekke om organismen har fått off-target endringer i lignende DNA-sekvenser.
Alt i alt har CRISPR/Cas9-systemet revolusjonert genteknologiområdet. Dens målretting og evne til å indusere spesifikke genetiske endringer i alle arter, har gjort det til et kraftig verktøy for å studere genfunksjon og innføre målrettede endringer. Teknikken har også mange mulige anvendelser innen medisin, landbruk og industri.
I det drøye tiåret som CRISPR-teknikken har vært i aktiv bruk, har teknologien stadig gått fremover og det finnes nå flere typer klippe-enzym og muligheter for base-endringer basert på utvikling av rekombinante nuklease-enzymer. Det utvikles stadig nye metodevarianter av CRISPR som gir en enda mer fleksibel og variert verktøykasse for genredigering. For eksempel kan man med baseredigering (base edititng) bytte ut enkeltbaser uten å kutte i DNA-et (Rees & Liu 2018). En annen variant, «Prime editing», gjør det mulig å skrive inn ny genetisk kode direkte i kuttstedet i DNA-et (Anzalone et al. 2019).
4.3.2 Cisgene og intragene modifiseringer
Tidlig på 2000-tallet ble det foreslått av planteforedlingsforskere å skille mellom transgene organismer og organismer som har fått overført hele gener fra nært beslektede arter (Nielsen 2003). For planter ville grensen da gå for arter som var kryssbare ved konvensjonell foredling. Dersom et gen er hentet fra en slik kryssbar slektning, kalles det et cisgen. Cisgen modifisering involverer bruk av gener som allerede er til stede i målorganismens genom, eller nært beslektede organismer.
Senere ble det også foreslått at intragen modifisering ble skilt ut som en egen gruppe. Intragener er deler av gener (som promotor eller andre genelementer), eller nye, sammenføyde gener fra kryssbare arter, som overføres til en kryssbar art (Rommens 2007).
Både cisgene og intragene organismer er dermed typer genmodifiserte organismer, men de skiller seg fra transgene organismer i opphavet til det genetiske materialet som settes inn i organismens genom.
Cisgener og intragener kan overføres til mottakerorganismen enten ved tilfeldig innsetting som ved de «gamle» genmodifiseringsteknikkene, eller målrettet. I sistnevnte tilfelle brukes genredigeringsverktøy som CRISPR til å styre og målrette genene til et bestemt sted i genomet, såkalte «trygge havner» (safe harbours) – plasseringer i genomet der man vet at de innsatte genene virker og ikke gir noen identifisert risiko for mottakerorganismen. Dette i motsetning til klassiske genmodifiseringsteknikker, hvor genet blir satt inn et tilfeldig sted i genomet.
Cisgenese og intragenese har mange potensielle bruksområder innen landbruk, medisin og industri.
4.3.3 Genteknikker for midlertidige endringer
Selv om genteknologisk induserte endringer av organismer i all hovedsak er arvelige, kan genteknologi også benyttes til å oppnå midlertidige og ikke-arvelige genetiske forandringer. Eksempler på dette er bruk av vaksiner (dyr), surrogati (dyr) og poding (planter) samt RNAi (i dyr og planter). Sistnevnte kan være korte RNA-biter (siRNA, short interfering RNA) som skal «slå ut» eller hindre uttrykket av et gen og dermed produksjonen av et protein. siRNA kan da for eksempel brukes som spray som sprøytes på planter for å drepe skadeinsekter. Det er verdt å nevne at RNAi-mekanismen også kan være selve hensikten med å lage en transgen organisme. Da koder ikke det innsatte genet for et protein, men for korte RNA-biter som skal virke regulerende på genuttrykk. Dette hører da ikke til kategorien midlertidige endringer, men permanent genmodifisering.
Epigenetiske mekanismer kan benyttes i genteknologiske metoder, og særlig RNAi har blitt brukt det siste tiåret. Hovedprinsippet for RNAi er å utnytte at komplementære RNA-tråder kan binde seg til hverandre. Man konstruerer en korresponderende RNA-tråd til det genet man ønsker å slå av eller regulere ned, og overfører denne RNA-tråden til organismen/cellekulturen. RNAi-mekanismer vil da sørge for at denne overførte RNA-tråden binder seg til det mRNA-et (produktet av genet) man ønsker å inaktivere, og resultatet er at mindre mRNA er tilgjengelig for proteinsyntese.
RNAi-maskineriet består av mange varianter av biokjemiske reaksjonsveier som alle fører til reduksjon av genuttrykk, som en mekanisme for å beskytte organismen mot uønskede DNA-sekvenser6. Slike uønskede DNA-sekvenser kan være virus eller transposoner som er DNA-sekvenser som kan forflytte seg på egen hånd i genomet. Mange proteiner er involvert i RNAi, og planter, sopp og de fleste dyr har en eller flere varianter av RNAi-reaksjonsveier (Waldron et al. 2018).
I landbrukssammenheng har teknikker basert på RNAi blitt utviklet for bekjempelse av skadedyr, som et alternativ til kjemiske insektmidler som kan drepe ikke-målorganismer. Konseptet går ut på at planten uttrykker små RNA-tråder, og når insektene spiser planten, vil inntak av de små RNA-trådene føre til at et essensielt gen blir slått av eller regulert ned, og dette fører til at insektet/skadedyret dør (Baum et al. 2007).
Fordi RNA-trådene som uttrykkes i planten kan binde til insektets eget RNA, er denne metoden ment å være spesifikk for spesifikke skadedyr. Noen eksempler på utfordringer med disse metodene er off-target effekter av RNA-trådene i skadedyret eller i ikke-målorganismer, forskjeller i effektivitet av RNAi-metoder blant ulike skadedyr, kostnaden ved metoden, og usikkerhet om hvor lenge slike små RNA-tråder, som er behandlet for å gjøres mer stabile (Nitnavare et al. 2021, Mamta & Rajam 2017), kan bli værende i miljøet.
Epigenetiske modifiseringer, i hovedsak RNAi og vaksiner, er eksempler på midlertidige forandringer og baserer seg på at tilførte molekyler som kun er til stede i en kort periode induserer biokjemiske og/eller immunologiske responser i organismen. Varigheten av disse responsene, som framstår som en endring av fenotype, kan være kort eller lang, men vil være midlertidig og ikke arvelig.
Surrogati og poding er eksempler på at man fysisk kombinerer to individer hvor den ene er endret med bruk av genteknologi mens den andre ikke er det. Surrogati brukes blant annet i fisk (Jin et al. 2021). Da settes kjønnsceller inn i gonaden til en steril surrogatfisk, de transplanterte cellene får et nytt hjem og kan utvikles til modne kjønnsceller inne i fisken. Avkommet til surrogaten blir genetisk avkom av de transplanterte cellene. Ved hjelp av slik teknologi kan man for eksempel lage enkjønnete avkom «all-female» eller multiplisere og videre konservere genetisk variasjon på en effektiv måte. En plantestamme kan være genmodifisert, men produsere frukt på en podet kvist som ikke har noen genetisk endret sammensetning. I begge tilfeller produseres avkom seksuelt, men uten arvelige endringer som har genteknologisk opphav.
4.4 Syntetisk biologi
Hva som skal omfattes av begrepet syntetisk biologi, er det delte meninger om. Partslandene under Konvensjonen om biologisk mangfold har valgt å omtale syntetisk biologi som en videreutvikling og ny dimensjon innenfor bioteknologien som kombinerer naturvitenskap, teknologi og ingeniørkunst og som legger til rette for og akselererer vår forståelse, design, redesign, produksjon og/eller modifisering av genetisk materiale, levende organismer og biologiske systemer (CBD 2015).
Syntetisk biologi er et begrep som med ett fikk nytt innhold i 2010. Et forskningsinstitutt i USA, ledet av Craig Venter, hadde da klart å sette sammen ulike syntetiske DNA-biter til et helt bakteriekromosom. De syntetiserte DNA-bitene var laget på bakgrunn av kjent sekvensinformasjon. Det sammenhengende DNA-molekylet bestod av rundt 1 million basepar. Kromosomet ble plassert i en bakteriecelle der arvematerialet på forhånd var fjernet. Den nye bakterien, levde, delte seg og ble kalt Synthia. På pressekonferansen i 2010 omtalte Craig Venter Synthia som den første levende organismen hvis forelder var en datamaskin.
Det å skape «nytt liv» i laboratoriet, eller kopiere liv, slik Craig Venters gruppe gjorde, er så langt en slags ekstremvariant. Langt de fleste andre prosjektene og tilnærmingene som de siste årene også har fått merkelappen syntetisk biologi, er snarere eksempler på bruk av videreutviklede genteknologiske metoder.
Syntetisk biologi trekker veksler på den stadig voksende kunnskapen vår om genomer og gensekvenser, og det faktum at det nå er mulig å framstille (syntetisere) DNA og RNA i laboratoriet, raskt og rimelig. Forskerne kan designe gener som naturen selv ikke har prøvd ut tidligere (i denne utredningen foreslått kalt novogener). Denne muligheten til å designe og framstille biologiske systemer mer fra grunnen av, gjør det mulig å modifisere for eksempel bakterier, gjærceller og alger til å danne nye produksjonsplattformer for ulike stoffer som biodrivstoff, kjemikalier, enzymer og antibiotika. Flere gener satt sammen til en enhet kan eksempelvis tilsvare flere trinn i en biokjemisk reaksjonsvei og være en «funksjonspakke» som kan settes inn i flere ulike organismer for å introdusere den ønskede egenskapen. Dette prinsippet om å se på gener og grupper av gener som en type «biobricks» som kan flyttes rundt, er et kjennetegn ved syntetisk biologi.
Det er et marked for syntese av gener. Forskere kan designe og angi en baserekkefølge i DNA eller RNA, firmaer syntetiserer så disse basert på arbeidstegningene og sender DNA- og RNA-molekyler (gener) tilbake. Dette har økt tempoet i forskningen betraktelig. CRISPR og genredigeringsteknologi vil være viktig i fremstillingen av syntetiske organismer med hensyn på målspesifikk innsetting og endring av gener i en bestemt rekkefølge eller organisering i genomet. Tidligere måtte man gjennom mer tidkrevende prosesser i laboratoriet med kloning og oppformering av gener for å oppnå de samme effektene.
Et ferskt eksempel på en tilnærmingsmåte basert på syntetisk biologi på enkleste nivå, er framstillingen av koronavaksiner. Da genomet til viruset SARS-CoV-2 var ferdig sekvensert, kunne forskerne velge ut gener, eller deler av gener, som de kunne bruke som utgangspunkt for mRNA-vaksiner. Ettersom kostnaden var blitt såpass lav, kunne forskerne heller bestille dataskreddersydde, syntetiserte nukleotidseksvenser, fremfor å oppkonsentrere DNA-sekvensene i bakterieceller før videre utvikling av vaksinene. Utprøvingen av vaksiner kunne da foregå parallelt i alle verdenshjørner.
Innenfor farmasøytisk industri har syntetisk biologi fått en sentral posisjon i produktutvikling. Ikke bare kan genmodifiserte mikroorganismer produsere de ønskede proteinene og metabolittene, men det er også mulig å framstille ulike komponenter uten å gå veien om en produserende celle, ved såkalte celle-frie produksjonssystemer. Medikamenter som er tilpasset hver pasients unike genetiske sammensetning, det som kalles persontilpasset medisin, kan gi oss viktige behandlingsmessige framskritt i årene som kommer. Syntetisk biologi har også medført økt skepsis og uro knyttet til genteknologi, knyttet til muligheten for å utvikle farlige bakterier og virus som biologiske våpen.
Det er ikke alltid mulig å forutsi hvilke egenskaper en ny sammenstilling av gener vil føre med seg. Genene virker i et samspill og nye kombinasjoner av disse sammen med en gitt miljøpåvirkning kan også gi resultater og effekter (se figur 4.3) som ikke er så lett å forutsi. Hvorvidt eksisterende prosedyrer og systemer for risikovurdering av klassiske GMO-er også kan benyttes for mer avanserte GMO-er som er utviklet ved hjelp av syntetisk biologi, blir diskutert mer i kapittel 8.
4.5 Gendrivere
Gendrivere gir oss muligheten til å overstyre naturens arvelover i organismer med kjønnet formering. Dette betyr at vi kan sikre at et bestemt gen eller en genkonstruksjon nedarves i alle avkom i neste generasjon ved hjelp av en molekylær kjedereaksjon med en programmert genmodifisering. Med hjelp av genredigeringsteknologien CRISPR kan man sette gener for hele CRISPR-enzymkomplekset inn i arvestoffet sammen med en ønsket genvariant. Dette vil resultere i at CRISPR-systemet også kutter og setter inn tilsvarende gen på kromosomet som er arvet fra den andre forelderen når det dannes kjønnsceller. Som et resultat vil begge versjonene av genet i et individ være av den ønskede varianten. Den vil i tillegg bli nedarvet og spredd til alle genkopiene i alle avkom i neste generasjon. Og slik fortsetter kjedereaksjonen videre, generasjon for generasjon.
Praktisk sett betyr dette en overstyring av arvelovene og at en egenskap spres til og tilfaller alle individene i en populasjon på rekordtid. Man kan med slik teknologi potensielt utrydde en hel art. Et eksempel på dette er en potensiell styrt kollaps av malariamyggbestander, som det nå forskes mye på. Hvis et gen for hunnsterilitet overføres med nær 100 % effektivitet til neste generasjon, vil myggpopulasjonen i teorien og kanskje også i praksis kollapse etter noen generasjoner (se figur 4.4).
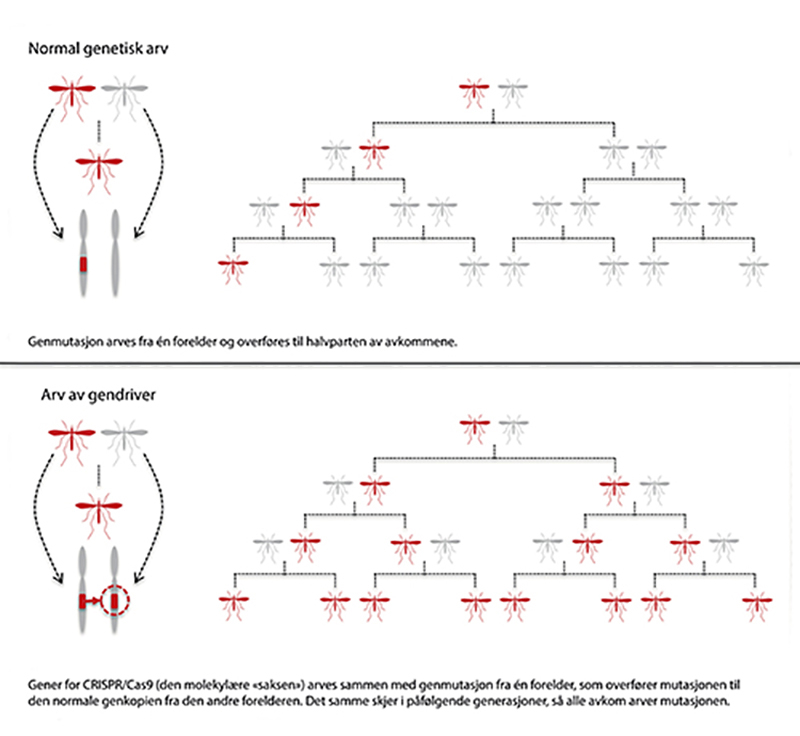
Figur 4.4 Ved bruk av gendriver overstyres arvelovene. Nær alle individer i en populasjon kan få ønsket egenskap etter noen generasjoner (figur gjengitt med tillatelse fra Bioteknologirådet).
Hensikten med dette er å begrense malariasmitte og sykdom, som jo er et høyverdig mål. Det er likevel mye debatt rundt hvilke økologiske konsekvenser gendriverorganismer kan ha, og hvordan man best mulig kan risikovurdere strategier og organismer før de eventuelt kan bli godkjent for utsetting i naturen. Et hjelpemiddel i denne sammenheng er matematisk modellering, som kan bidra med informative scenarier og synliggjøre kunnskapshull. Slike modeller kan imidlertid bare i begrenset grad forutsi de økologiske konsekvensene av gendriverorganismer i naturlige økosystemer (Hindar et al. 2020).
Det er også mulig å se for seg andre, mindre inngripende former for gendrivere, for eksempel løsninger som bare vil spre seg med avtagende effektivitet og dermed vil være midlertidig til stede i en populasjon. Prinsippet med gendrivere åpner helt nye muligheter for å gripe inn i økosystemer og endre forholdet mellom populasjoner og arter. CRISPR-baserte gendrivere kan kun brukes i organismer med seksuell formering. Dette utelukker dermed bruken i mikroorganismer som bakterier og virus, men omfatter altså likevel de fleste planter og dyr. Gendriver-teknologien utfordrer både etablerte metoder for å vurdere risiko og eksisterende regelverk, samt at den reiser vanskelige etiske problemstillinger. I mange tilfeller kan mulige gevinster være åpenbare, men hva er de samlede konsekvensene av å overstyre evolusjonen og påvirke komplekse økosystemer? Utvalget har i begrenset grad diskutert gendriverteknologi og medfølgende problemstillinger, men enkelte muligheter og begrensninger blir nærmere beskrevet i kapittel 7.7.
4.6 Regulering, risikovurdering og bærekraft, samfunnsnytte og etikk
4.6.1 Utvikling av genteknologiregelverket – da og nå
GMO-regelverk rundt om i verden har gjennom historien blitt til i et samspill mellom teknologiutvikling, politikk og samfunnsverdier. Parallelt med at kunnskapen om gener og tilknyttede egenskaper vokste raskt på slutten av forrige århundre, ble det også utviklet kunnskap om hvordan gener kunne flyttes mellom ulike typer av organismer (transgenese). Både forskere innen disse fagfeltene og samfunnet rundt, så potensialet i at man kunne skape helt nye organismer samtidig som man også vurderte at det kunne medføre helse- og eller miljørisiko.
En felles kjerne i genteknologiregelverkene som ble utviklet i ulike land var at risiko for helse og miljø skulle vurderes. Man ønsket å sikre seg at risiko var neglisjerbar eller akseptabel sett i forhold til nytteverdien. I Norge vedtok man dagens genteknologilov i 1993. Det var en av de første genteknologilovene i verden, og den inkluderte tre særnorske kriterier utover helse og miljø som skulle inngå i vurderinger før eventuell godkjenning. Disse tre kriteriene var bærekraft, samfunnsnytte og etikk.
Norge har vært tilknyttet EUs GMO-regelverk gjennom EØS-avtalen siden tidlig på 1990-tallet. Dagens GMO-direktiver ble vedtatt i 2001 (utsettingsdirektivet) og i 2009 (innesluttet bruk av genmodifiserte mikroorganismer). I tillegg fikk man i EU et eget regelverk for godkjenning av søknader om genmodifisert mat og fôr i 2003. Norge har så langt ikke implementert EUs mat- og fôrregelverk på GMO-området.
I 2003, og med en oppdatering i 2010, fastsatte EU-kommisjonen retningslinjer for at det enkelte land nasjonalt kunne bestemme tiltak for dyrking av godkjente genmodifiserte planter for å forhindre utilsiktet innblanding av GMO i avlinger av konvensjonelle og økologiske sorter som dyrkes i nærheten, såkalte sameksistenstiltak.
På tilsvarende måte som i dag (eksemplifisert ved dette utvalgets mandat), vurderte man før genteknologiloven kom i 1993 hva som skulle falle innenfor og utenfor GMO-regelverket av spesifikke teknikker som endrer arvematerialet i organismer. Føre-var prinsippet var ledende i utformingen av regelverket den gang. Dagens diskusjon er blant annet preget av at nye teknikker gir oss et mye større spenn i hvilke genomendringer som er mulige, fra de helt minimale, til det å kunne konstruere hele, funkjonelle genomer fra bunnen av.
4.6.2 Prosessen i EU og andre land
Spørsmålet om hvorvidt nye, målrettede mutagenesemetoder kunne unntas fra godkjenning etter GMO-regelverket på samme måte som konvensjonelle mutagenesemetoder, ble rettet til EU-domstolen i 2016, gjennom et fransk initiativ. I sin dom i 2018 (C-528/16) baserte domstolen seg på en fortolkning av regelverkets GMO-definisjon sammenholdt med unntakene for konvensjonell mutagense, og la til grunn at føre-var-prinsippet og forhåndsvurdering av risiko er sentrale prinsipper. Domstolen fant at nye teknikker ikke kunne unntas regelverket og påpekte at bruk av målrettet mutagenese (genredigering) ikke har samme «lange historie i trygg bruk» («long safety record») som konvensjonelle mutageneseteknikker, i henhold til direktivets ordlyd.
I ettertid ble Kommisjonen bedt om å utrede konsekvenser av EU-domstolens avgjørelse, og konklusjonen av utredningen ble at det skal utarbeides et forslag til ny rettsakt for planter fremkommet ved genredigering og cisgenese. I denne sammenheng ga EFSA i 2022 råd om nye, mulige kriterier for risikovurdering av planter produsert ved målrettet mutagenese, cisgenese, og intragenese (EFSA 2022a). I tillegg opprettes et EFSA-panel av eksperter som skal se på prinsippene for risikovurdering av genredigerte dyr på samme måte som for planter. Planlagt start for dette panelet er juli 2023. For mer om denne prosessen i EU, se kapittel 8 del II.
Som resultat av mulighet for målrettede endringer med høy effektivitet og presisjon innen arten (se kapittel 4.3), har flere land valgt å ta ut visse genomredigerte planter og/eller dyr av GMO-regelverket, eller myke opp krav for godkjenning (Buchholzer & Frommer 2022). Felles for disse er at dersom det er vurdert at planten og/eller dyret har genetiske endringer tilsvarende dem som kan oppstå naturlig, eller kan oppnås ved bruk av konvensjonelle foredlings- og avlsmetoder, reguleres organismene ikke som GMO. I Europa har England senest i 2023 skilt ut en egen kategori organismer fra GMO-regelverket, som faller inn under en ny genteknologiregulering dersom de oppfyller kravene til en «precision bred» (PB) organisme. Det skal vurderes fra sak til sak om en aktuell organisme kan anses som PB og faller inn under det nye regelverket.
I kapittel 10 drøfter utvalget hvordan en fremtidig regulering av genteknologi i Norge kan utformes. Regulering av GMO-legemidler drøftes separat i kapittel 12.
4.6.3 Regulering av GMO globalt
Internasjonal handel med GMO som produkter, eller del av produkter, har gjort at reguleringen av GMO er blitt et internasjonalt anliggende som favner bredere enn Norge og EØS-området. I 2000 ble Cartagena-protokollen om biosikkerhet under Konvensjonen om biologisk mangfold vedtatt av FN for å etablere en ramme for trygg håndtering, transport og bruk av GMO. Protokollen krever at land vurderer potensiell risiko ved GMO før de introduseres i miljøet, og avtalen angir prosedyrer ved import og eksport.
I EU og Norge har man et teknologi- og prosessbasert GMO-regelverk, der selve bruken av genteknologi gjør at regelverket kommer til anvendelse. Samtidig er produktvurderingen sentral. En risikovurdering av GMO-en skjer på bakgrunn av genet, egenskapen, framstilling og bruk av organismen, altså i neste omgang en produktbasert vurdering. Andre land, som USA og Canada, har en annen type regelverk, der teknologien og prosessen som benyttes for å framstille en GMO ikke er det avgjørende. Vurderingene i disse landene baserer seg på å sammenlikne produktet eller GMO-en med andre tilsvarende, konvensjonelle produkter.
4.6.4 Generelt om risikovurdering av genmodifiserte organismer
Mye av dagens genteknologiregelverk ble utformet på 1990-tallet. Føringene for hvordan risikovurderingene utføres i henhold til regelverket har imidlertid endret seg noe over tid, ut fra oppdatert kunnskap og kontinuerlige oppdateringer av tilhørende veiledningsmateriale. Formålet til risikovurderingen er å fange opp mulige negative effekter for helse og miljø. Vurdering av om en genmodifisert mikroorganisme, plante eller dyr utgjør en risiko, benytter en metodikk med standardiserte parametre. Som nevnt over om koblingen mellom gener, egenskaper og miljøet, er miljøet en viktig faktor for hvilke gener som kommer til uttrykk når. For å kunne vurdere hvordan et endret gen i en genmodifisert organisme vil komme til uttrykk, er det derfor krav om at den genmodifiserte organismen testes ut i ulike relevante miljøer i såkalte feltforsøk eller forsøksutsettinger. Data fra slike studier vil gi informasjon om hvordan den genmodifiserte organismen fungerer i miljøet, og om modifiseringen kommer til uttrykk som tiltenkt, eventuelt om det er utilsiktede effekter av modifiseringen som kommer til uttrykk i samspill med ytre faktorer i miljøet.
Informasjonen som danner grunnlag for å vurdere om en GMO utgjør en risiko for helse og miljø, fremskaffes av søker gjennom studier og ved vurdering av publisert vitenskapelig litteratur. I Norge er det Vitenskapskomitéen for mat og miljø (VKM) som utfører risikovurderinger på oppdrag fra forvaltningen. VKM har et spesielt fokus på særnorske forhold i sine vurderinger. I EU heter Kommisjonens risikovurderingsorgan European Food Safety Authority (EFSA). EFSA har utviklet en rekke veiledningsdokumenter for risikovurdering av genmodifiserte organismer.
Risikovurderingen av organismer fremstilt ved genteknologi blir omtalt mer inngående i kapittel 8.
4.6.5 Generelt om vurdering av genmodifiserte organismers bidrag til bærekraftig utvikling, samfunnsnytteverdi og etisk forsvarlighet
Genteknologiloven har som krav at det vurderes om den genmodifiserte organismen bidrar til bærekraftig utvikling, og er samfunnsmessig og etisk forsvarlig. Dette er særnorske kriterier, men både utsettingsdirektivet og Cartagena-protokollen åpner for å bringe inn sosio-økonomiske vurderinger i forbindelse med godkjenning av GMO. Veiledning og parametre for slike vurderinger er ikke standardisert internasjonalt, til forskjell fra helse- og miljørisikovurderinger. I Norge er det Bioteknologirådet som har ansvar for å vurdere bærekraft, samfunnsnytte og etikk av søknader om omsetning av genmodifiserte organismer etter genteknologiloven.
Hvordan utvalget mener disse kriteriene kan vurderes for genmodifiserte organismer i fremtiden, er omtalt i kapittel 9 og i de konkrete anbefalingene i kapittel 10.
4.6.6 Andre hensyn
Forbrukerhensyn og åpenhet har også vært en viktig del av bakgrunnen for dagens genteknologiregelverk. Genmodifiserte produkter skal derfor merkes som genmodifisert for å sikre forbrukeren mulighet til å ta informerte valg. I tillegg skal det være stor åpenhet om søknader, søknadsprosess og allmennheten har anledning til å spille inn på søknader gjennom høring av søknader etter genteknologiloven.
4.7 Genmodifiserte planter, dyr og mikroorganismer i bruk i dag
4.7.1 Genmodifiserte planter i verden i dag
Hovedvekten av genmodifiserte organismer på markedet er genmodifiserte planter til mat og fôr, og av disse er det genmodifisert soya, mais, bomull og raps som dominerer. Norge har i dag ingen godkjente genmodifiserte planter eller dyr til bruk som mat og fôr, men det er godkjent seks genmodifiserte nelliksorter for omsetning som snittblomster.
EU importerer mye genmodifisert fôr, og har i dag i underkant av 100 godkjente GMO til mat og fôr.7 Bare én mais er godkjent for dyrking. Denne har blitt dyrket i Spania og Portugal. Totalt sett utgjør genmodifiserte planter en betydelig del av den globale dyrkingen av mat- og fôrvekster. I 2019 ble det anslått at genmodifiserte planter utgjorde omtrent 10 % av total planteproduksjon og 78 % av avlingene brukes i dyrefôr (ISAAA 2019). En stor del av verdens kommersielle produksjon av mais (34 %), soya (74 %), bomull (79 %) og raps (27 %) er basert på genmodifiserte sorter.
Ifølge de nyeste tilgjengelige dataene fra «International Service for the Acquisition of Agri-biotech Applications» (ISAAA) var det i 2019 totalt 190,4 millioner hektar med genmodifiserte planter dyrket over hele verden. Det er store geografiske forskjeller på bruken. Fem land dyrket 91 % av disse GMO-ene, nærmere bestemt USA, Brasil, Argentina, India og Canada (av totalt 29 land som dyrket genmodifiserte planter), mens dyrking av GMO er svært begrenset i Europa, som tidligere nevnt. Mer enn 90 % av soyabønner, mais og bomull i USA er genmodifisert. Det dyrkes også genmodifiserte sorter av matvekster som sukkerroer, alfalfa, papaya, squash, potet, eple og aubergine. Arealet som disse vekstene dyrkes på, utgjør mindre enn 2 % av totalarealet med genmodifiserte planter.
Ser vi nærmere på hvilke egenskaper som er tilført de genmodifiserte mat- og fôrvekstene som er i bruk, så kan disse sorteres i følgende hovedgrupper (i avtakende rekkefølge, mest hyppig brukt egenskap er listet først):
Herbicidtoleranse: Denne egenskapen gjør det mulig for den genmodifiserte planten å tåle visse sprøytemidler, slik at bøndene kan bruke disse uten å skade planten. Et eksempel på dette er soyabønner som er blitt genmodifisert for å være tolerante overfor det bredspektrede sprøytemidlet glyfosat. Dette betyr at bøndene kan bruke glyfosat for å bekjempe ugress uten å skade de genmodifiserte plantene.
Insektresistens: Planten har her fått tilført gener fra bakterier eller andre organismer som produserer giftstoffer som er skadelige for insekter, og gjør den genmodifiserte planten motstandsdyktig mot skadedyr. Et eksempel på dette er Bt-bomull som er genmodifisert for å produsere Bacillus thuringiensis (Bt-toksin), som er skadelig for visse insekter. Med dette reduseres behovet for bruk av sprøytemidler.
Sykdomsresistens: Planten har fått tilført gener fra andre organismer som kan hjelpe planten å motstå visse plantesykdommer. For eksempel er Rainbow papaya en genmodifisert plantesort som er endret for å være motstandsdyktig mot ringspot-viruset, som tidligere var et stort problem for papayadyrkingen på Hawaii (Ferreira et al. 2002). Modifikasjonen introduserer et gen fra viruset som gjør planten motstandskraftig mot viruset.
Forbedret næringsinnhold: Genmodifisering kan øke nivåene av visse næringsstoffer i plantesorter, for eksempel vitaminer eller mineraler. Et eksempel på dette er Golden rice som er en genmodifisert nytteplante som er endret for å produsere høyere nivåer av betakaroten, en forløper til vitamin A (Dove 2000). Denne modifikasjonen ble utviklet for å bekjempe vitamin A-mangel, som kan føre til blindhet og andre helseproblemer.
Forbedret kvalitet: Dette innebærer å forbedre produktets egenskaper, som smak, tekstur eller utseende. For eksempel er en eplesort (Arctic apples) genmodifisert for å forhindre bruning når fruktene er kuttet eller skadet (Waltz 2015), noe som gjør eplene mer visuelt tiltalende for forbrukere. Modifikasjonen reduserer produksjonen av enzymet som forårsaker bruning.
Stress-toleranse: Hjelper planten å tåle miljømessige stressfaktorer som tørke, varme eller kulde. For eksempel er en tørketolerant maissort genmodifisert slik at den produserer et protein som hjelper planten å tåle perioder med tørke (Castiglioni et al. 2008). Denne modifikasjonen kan bidra til å sikre en mer pålitelig avkastning i områder med begrensede vannressurser. Tilsvarende er det også framstilt (og i noen land godkjent) en tørketolerant genmodifisert hvetesort (HB4).
Siden tidlig på 2000-tallet har det vært en utvikling mot at genmodifiserte planter har flere ulike transgener innført for å oppnå en kombinasjon av egenskaper, ofte både insektsresistens og sprøytemiddeltoleranse. Det er da ofte en kombinasjon av ulike insekstresistensgener (rettet mot ulike typer insekter), og ulike sprøytemiddeltoleransegener (mot ulike sprøytemidler). Slike genmodifiserte planter med mange transgener introdusert i samme plante, kaller man en «stacked» (på norsk «stablet») genmodifisert plantelinje. Slike «stacks» oppnås som oftest ved konvensjonell kryssing av flere genmodifiserte planter. Ved å velge ut avkom som har alle transgenene man ønsker introdusert, får man da en ny genmodifisert plante med alle transgenene til stede (se kapittel 6.5.5).
Ifølge ISAAA utgjorde herbicidtolerante og insektresistente planter henholdsvis 43 % og 12 % av det globale GM-areal i 2019. Den største dyrkingsandelen (45 %) hadde genmodifiserte planter som både er insektresistente og herbicidtolerante.
I tillegg til de genmodifiserte mat- og fôrplantene som utgjør størstedelen av det som omsettes og blir dyrket av genmodifiserte planter, er det også et titalls genmodifiserte prydblomster med endret farge på markedet i dag. Seks slike nelliksorter er godkjent for omsetning som snittblomster i Norge. Disse har fått innført gener fra andre plantesorter (som petunia og fiol) som gjør at de har farger som konvensjonell nellik normalt ikke har (nyanser av lilla).
4.7.1.1 Miljøeffekter av insektresistente og sprøytemiddeltolerante genmodifiserte planter
Bruk av sprøytemidler kan føre til at ugress over tid utvikler resistens. Dette gjelder ved bruk av både genmodifiserte og ikke-genmodifiserte planter. Slike ugress utgjør nå et problem for landbruket i mange land, blant annet i Nord- og Sør-Amerika (Clay 2021). Tidligere studier har gitt ulike resultater om hvorvidt bruken av genmodifiserte planter har ført til økt eller redusert bruk av sprøytemidler. I Canada har bruken av herbicider på genmodifisert soyabønne gått ned i perioden 1997-2018, men i Brasil økte sprøytemiddelbruken på genmodifisert soya sammenlignet med tradisjonelle sorter i perioden 2007-2014. Samlet sprøytemiddelbruk på genmodifisert soya har økt globalt sett i perioden 1997-2018, mens mengden har gått ned på GM bomull, raps og mais i samme periode.
Som et tiltak for å redusere bruken av og overkomme utviklet resistens mot sprøytemidler, brukes det nå genmodifiserte planter som produserer sin egen gift (bt-toksin) mot insektlarveangrep. GMO-er med bt-toksin har vært gjenstand for omfattende diskusjon om mulige miljømessige konsekvenser som dyrking av slike planter kan ha, spesielt på ikke-målorganismer som befinner seg over bakken, på bakken og i jordsmonnet. En laboratoriestudie som ble utført for over 20 år siden, vakte stor interesse da den antydet at GMO-er med bt-toksin kunne skade larvene til monarksommerfugl, en nærmest ikonisk art i amerikansk natur (Losey et al. 1999). Oppfølgingsstudier viste imidlertid at slike dramatiske effekter ikke kunne observeres på samme sommerfuglart ved dyrking av GMO-er ute i naturen (Sears et al. 2001). Selv om giftstoffene som disse GM-plantene danner har potensiale til å skade ikke-målorganismer, har det ennå ikke har oppstått omfattende negative miljøkonsekvenser ved dyrking (Alvarez et al. 2020, Pellegrino et al. 2018). Dette er blant annet underbygget av metastudier på mais og basert på lange feltstudier. Innsamlede data og studier er imidlertid begrenset når det gjelder effekten på jordlevende organismer, og enkelte rapporter peker på sporadisk nedgang i biomassen til for eksempel amøber, meitemark, flagellater, ciliater og nematoder i jord der det blir dyrket Bt-mais (Griffiths et al. 2005), sammenliknet med åkre uten bruk av sprøytemidler. Noen metastudier har senere underbygget dette (Krogh et al. 2020, Marvier et al. 2007).
Sammenligner man en Bt-åker med konvensjonelt landbruk, der det benyttes insektisider, indikerer metastudier at GMO-dyrkingen har en mindre negativ effekt på ikke-vertebrater (Krogh et al. 2020). En annen problemstilling som er forbundet med bruken av Bt-planter som mais og bomull, er at langvarig dyrking kan føre til at målorganismene (larver av insekter) utvikler resistens mot giftstoffene som disse plantene produserer (Tabashnik et al. 2013). For å hindre eller forsinke denne utviklingen, anbefales det vanligvis å bruke dyrkingsmetoder med refugier. Dette innebærer at man dyrker ikke-genmodifiserte planter i randsonen av Bt-åkrene. Et tilstrekkelig antall insekter kan dermed overleve og krysse seg med de insektene som står i fare for å utvikle resistens i Bt-åkeren. Dette bremser resistensutviklingen videre. En annen strategi er å benytte genmodifiserte planter som produserer flere ulike typer Bt-toksiner som er giftige mot et bestemt skadeinsekt samtidig. Sannsynligheten for at insektet utvikler resistens mot flere ulike toksiner samtidig, er mye lavere.
Genflyt er overføring av DNA-sekvenser fra én organisme til en annen, som oftest mellom kryssbare organismer. Dette kan også skje mellom genmodifiserte planter til deres ikke-modifiserte slektninger, ugress eller villplanter, liksom det motsatte. De potensielle konsekvensene av denne genflyten avhenger av om de overførte genene gir mottakerplanten en økt evne til å konkurrere i sitt miljø. Sannsynligheten for genflyt påvirkes av ulike faktorer, som reproduksjonsbiologi, tilstedeværelsen av pollinerende insekter, vindretning og avstanden mellom potensielle mottakerplanter.
Raps er et godt eksempel på en plante med stort utkrysnings- og spredningspotensial. Den produserer mye pollen og setter mange frø med gode overvintringsegenskaper som letter spredning. Det er blitt rapportert om etablering av genmodifisert raps utenfor dyrkingsområder i land som Canada, USA, Australia, Japan og Sveits (Bauer-Panskus et al. 2013).
4.7.1.2 Effekter for landbruket – på konvensjonelle og økologiske avlinger
Med dyrking av genmodifiserte planter vil det uten tiltak for å holde avlingene adskilt, kunne skje en innblanding av GMO i konvensjonelle og økologiske planter. I EU har ulike land i tråd med fellesskapets retningslinjer for fastsettelse av sameksistenstiltak, fastsatt nasjonale tiltak for at det ikke skal skje en slik uønsket innblanding. Studier fra Spania har vist at det er utfordrende å hindre spredning av genmodifisert mais til avlinger med konvensjonell og økologisk mais (Binimelis 2008, Herrero et al. 2017, Levidow & Boschert 2008). Slik uønsket spredning har også vært rapportert i Mexico (Agapito et al. 2017).
For å kontrollere effekter for landbruket i Norge som følge av eventuell godkjenning av genmodifiserte planter, ble det i 2007 utarbeidet et utkast til forskrift om dyrking av genmodifiserte planter (se kapittel 6.4.5.8). Det er ikke godkjent noen planter for dyrking i Norge og dette regelverket er ennå ikke ferdigstilt.
4.7.1.3 Helseeffekter av GMO til mat og fôr
Når det gjelder utvikling av GMO-er til mat og fôr, er man spesielt oppmerksom på produksjon av giftstoffer eller allergener som kan påvirke mat- og fôrtryggheten. Risikovurderinger av genmodifiserte planter og mikroorganismer inkluderer undersøkelser av toksisitet for å utelukke at det produseres nye stoffer som kan være giftige for mennesker (EFSA 2022b). Mennesker har til alle tider inntatt DNA og RNA gjennom maten, ettersom alle planter og dyr er levende organismer og har DNA og RNA i alle celler. Dette utgjør ingen risiko i seg selv, blant annet fordi molekylene brytes ned i tarmen og ikke transporteres ut intakte til kroppens celler.
En stor metastudie fra 2016 konkluderte med at genmodifiserte matplanter er like trygge å spise som ikke-genmodifiserte matplanter (National Academies of Sciences and Medicine 2016). En bakgrunn for dette er at alle GMO som godkjennes har gjennomgått en grundig helserisikovurdering. Ingen negative helseeffekter har heller her blitt avdekket. Det er også et grunnleggende premiss for godkjenning av GMO i EU og Norge. EU importerer store mengder genmodifisert dyrefôr, og en betydelig del av den animalske maten som mennesker spiser i EU kommer fra dyr som har blitt fôret med genmodifisert fôr.
4.7.1.4 Effekter på bærekraftig utvikling, samfunnsnytteverdi og etisk forsvarlighet
Bioteknologirådet har vurdert bærekraft, samfunnsnytteverdi og etisk forsvarlighet for en rekke av de genmodifiserte plantene nevnt over. Det vurderes i forbindelse med samfunnsnyttekriteriet om det er etterspørsel og behov for den genmodifiserte organismen i Norge. For kriteriet bærekraftig utvikling er det både miljømessig og sosial og økonomisk bærekraft som vurderes. Når det gjelder etisk forsvarlighet, vurderes det om det er etisk forsvarlig både med produksjon og bruk av den genmodifiserte organismen (se også kapittel 9 for utvalgets vurderinger av etisk forsvarlighet i denne sammenheng). Bioteknologirådets uttalelser har ofte delt seg mellom flertalls- og mindretallskonklusjoner. Flertallet i Bioteknologirådet har gjentakende ganger ment at insektsresistente og sprøytemiddeltolerante planter kan ha negative effekter på bærekraft og etisk forsvarlighet, og at det ikke er etterspørsel etter produktene i Norge.
4.7.2 Eksempler på genmodifiserte dyr i bruk
I motsetning til planter, finnes det få genmodifiserte dyr på markedet i dag. De mest kjente er genmodifisert fisk, hvorav de fleste er ulike typer genmodifiserte akvariefisk. I tillegg produseres en type genmodfisert laks til mat (se kapittel 7).
Ulike typer genmodifiserte fisk med fluorescens og forskjellige farger ble først benyttet som verktøy for biologisk forskning. Senere er det utviklet en rekke genmodifiserte fisk til bruk i akvarier. Av de ulike typene genmodifiserte akvarifisk, er sebrafisk (Daniorerio) mest kjent. Disse fiskene er modifisert for å produsere lyse fluorescerende farger, som rød, grønn og oransje.
Genmodifisert akvariefisk er ikke godkjent i Norge og EØS-området, men myndighetene får jevnlig varsel om ulovlige funn på markedet. Når det gjelder miljøeffekter, er det generelt konkludert med at det i kaldere strøk er redusert risiko knyttet til sebrafisk som unnslipper, fordi fisken har begrenset evne til å overleve og spre seg og den er godt synlig for sine predatorer, altså at transgenet gir dyret lav fitness.
4.7.3 Eksempler på genmodifiserte mikroorganismer (GMM) i bruk
Hovedvekten av genmodifiserte mikroorganismer anvendes i lukkede systemer. Det er få eksempler på utsetting av genmodifiserte mikroorganismer i naturen og miljøeffekter av disse. For omtale av teknologiske muligheter med genmodifiserte mikroorganismer, se kapittel 7.
Genmodifiserte organismer i legemidler er som regel genmodifiserte mikroorganismer (GMM), som virus, bakterier eller celler som har fått innsatt, endret eller fjernet genetisk materiale. For eksempel var to av covid-19 vaksinene som ble utviklet av AstraZeneca og Johnson&Johnson basert på genmodifiserte adenovirus. Genmodifiserte virus har før dette hovedsakelig blitt brukt som vektor for å få fraktet gener inn i menneskeceller for å kurere sykdom ved genterapi.
I dag foregår en rask utvikling på området, og det er forventet at stadig flere slike GMO-legemidler vil forskes frem. Legemidler som består av eller inneholder genmodifiserte organismer omtales i denne utredningen som GMO-legemidler, se kapittel 12. Miljø- og helseeffekter av denne typen genmodifiserte mikroorganismer vurderes fra sak til sak, og vil avhenge av bruk og organismetype.
4.7.4 Eksempler på forsøksutsetting av genmodifiserte insekter i naturen
Ville myggpopulasjoner kan bære med seg ulike overførbare sykdommer. Som en alternativ bekjempingsmetode, forskes det på utvikling av genmodifiserte, sterile mygg for å undertrykke myggpopulasjoner. En type sterile, genmodifiserte mygg har blitt sluppet ut i felt gjennom forskningsprosjekter blant annet i USA, Brasil, og Malaysia (Carvalho et al. 2015, Lacroix et al. 2012, Waltz 2021). En annen type genetisk sterile mygg har også blitt brukt i forskningsøyemed i Burkina Faso for å utvikle strategier for å bidra til å bekjempe spredning av malaria (Yao et al. 2022). I de tilfellene disse genmodifiserte insektene er sterile, vil den genetiske endringen de har blitt tilført ikke spres i miljøet. Disse forsøksutsettingene har møtt motstand i noen av landene hvor de har blitt gjennomført. Det er så langt ingen eksempler på utsetting av genmodifiserte insekter i Norge eller Europa.
Tidligere har konvensjonell mutagenese (stråling) blitt brukt til å lage sterile hanner av skadeinsekter som spyflue. Disse sterile hannene har blitt sluppet ut i naturen for å konkurrere med de fertile hannene om å reprodusere med hunnene, og på denne måten har man begrenset populasjonsøkningen av dette insektet. Imidlertid kan strålingen føre til ukontrollerte mutasjoner i målorganismen, noe som kan føre til dyrevelferdsproblemer og dårlig overlevelse hos de bestrålte individene. En alternativ strategi er å bruke genteknologi for å utvikle sterile insekter.
Det forskes videre på mulige teknologiske måter å oppnå enda mer effektiv begrensning av populasjoner av skadeinsekter ved hjelp av forbigående (transiente) og permanente gendrivere (se kapittel 7).
Fotnoter
Ploidi handler om hvor mange kromosomsett som finnes i hver celle i en organisme. En haploid art har ett kromosomsett (refereres til som haploid). Diploide arter (di = to) har to utgaver (ett par) av hver kromosomtype i det fulle kromosomsettet. Arter som har flere enn to sett med kromosomer kalles polyploide (poly = mange).
I eukaryote celler, som dyr og planter, består gener av exoner og introner, hvor det er exonene som er de kodende sekvensene som gir mRNA. Intronene fjernes. Ulik sammenspleising av exonene, kan gi ulike mRNA fra samme gen.
Bioteknologirådet har gode nettsider og figurer som enkelt forklarer mer om temaet https://www.bioteknologiradet.no/temaer/arv-og-genetikk/. Se Store Norske Leksikons sider om celledeling for mer detaljer om meiose https://snl.no/celledeling.
Mutagener er en betegnelse for alt som kan forårsake mutasjon i en organismes arvemateriale.
Databasen finnes på følgende nettside https://nucleus.iaea.org/sites/mvd/SitePages/Home.aspx
https://sml.snl.no/epigenetikk
https://webgate.ec.europa.eu/dyna2/gm-register/