10 Vurdering av behov for og forslag til mulige endringer i dagens regelverk eller forvaltningspraksis
10.1 Innledning
Både flertallet og mindretallet har hatt som mål å fremme forslag som stimulerer til ønsket innovasjon og ansvarlig bruk av genteknologi. Utvalget er samstemte om enkelte elementer, blant annet at regler bør gjelde alle organismetyper og bruksområder, at det trengs oppdaterte veiledninger til søkere samt enkelte forenklende grep for godkjenning av forsøksutsetting. For øvrig har utvalgsmedlemmene vesentlig ulikt syn på hvilke rammer som best bidrar til å nå målene. Utvalget har derfor delt seg, og beskriver her to ulike alternativer for regulering og forvaltning av genteknologi til mat og fôr og annen utsetting i naturen (legemidler omtales i eget kapittel 12).
10.2 Flertallets forslag – En ny kurs for genteknologi
Forord til flertallets anbefalinger
I dette kapittelet beskrives et forslag til regulering og forvaltning av genteknologi som markerer et tydelig skifte fra dagens system. Dette mener flertallet i utvalget (Anna Wargelius, Muath Alsheikh, Sigrid Bratlie, Trygve Brautaset, Espen Gamlund, Arne Holst-Jensen og Camilla Tøndel) er riktig av to hovedårsaker:
1. Genteknologiregelverket, -forvaltningen og -politikken vi har i dag hemmer innovasjon og tilgang til trygge og nyttige produkter, og har derfor ikke fungert godt nok.
Det er ikke godkjent noen GMO-produkter til mat eller fôr i Norge, selv om det kunne vært tilgang til flere av produktene som er tilgjengelige i EU – produkter som er vurdert som helse- og miljømessige trygge og som kan gi store økonomiske besparelser for aktører i både blå og grønn sektor. At de ikke er tilgjengelige skyldes dels manglende implementering av et EU-regelverk samt en villet restriktiv politikk som potensielt går på akkord med Norges folkerettslige forpliktelser (utdypes i kap. 10.2.3.4 og 10.2.3.13).
Det er lite innovasjon på produkter fremstilt med genteknologi i Norge – særlig knyttet til matproduksjon. Vi mener et strengt regelverk samt den restriktive politikken er en vesentlig del av årsaken. Når terskelen for markedstilgang er høy, blir det lite innovasjon. Også innen GMO-legemidler har regelverket og forvaltningspraksisen vært en hemmer for forskning og innovasjon, eksempelvis ved å sette i fare norske sykehus sine muligheter til å gjennomføre kliniske studier på nye kreftmedisiner1.
Dagens genteknologiregelverk og -politikk samt den folkelige motstanden mot GMO som brukes som argument for å opprettholde den restriktive politiske linjen, hviler på en antagelse om at det er noe iboende risikabelt og/eller etisk problematisk med produkter fremstilt med genteknologi. Vi mener en slik antakelse er uriktig, og viser til tiår med oppsamlet kunnskap i tusenvis av studier samt formelle risikovurderinger som viser at det ikke har vært vesentlige risikoer knyttet til GMO så langt (utdypes i kap. 4 og 8). Ingen teknologi er 100 % risikofri. Det er anvendelsen som i stor grad påvirker faktisk risiko. Risikoer og utfordringer knyttet til produkter fremstilt med genteknologi vil i likhet med det som gjelder for produkter framstilt med konvensjonell teknologi, være knyttet til produktets egenskaper og ikke teknologien som sådan. Når fagmyndigheten sier at et produkt er trygt nok, må vi stole på det, ellers virker ikke reguleringssystemene vi har laget. Norge og Europa har dessuten satt et meget høyt beskyttelsesnivå for matkjedene generelt, og det skal mye til for at det kommer utrygge produkter på markedet uansett hvordan de er produsert.
2. Dagens genteknologiregelverk vil fungere enda dårligere fremover, særlig for produkter og organismer fremstilt med genredigering og andre nye genteknikker som gjør det mulig å lage målrettede endringer i organismenes eget DNA, i våre forslag omtalt som presisjonsavlede produkter (fra engelsk Precision Bred, heretter PB).
Flertallet mener at krav til dokumentasjon og omfanget av risikovurderinger i dag (beskrevet i kap. 8), og dermed ressursbruken for både forvaltningen og utviklere i godkjenningsprosessen, er disproporsjonalt høye for produkter som er sammenlignbare med konvensjonelle produkter. Dette er samme konklusjon som ekspertgrupper over hele verden har kommet frem til. I EU-kommisjonens studie fra 20212, konkluderes det med at: «there are strong indications that the legislation is not fit for purpose for some NGTs (new genomic techniques) and their products, and that it needs to be adapted to scientific and technological progress.» I den påfølgende åpne høringen, som fikk flere tusen svar fra både organisasjoner og enkeltpersoner fra både offentlig, privat og ikke-statlig sektor, mente hele 80 % at dagens GMO-regulering ikke passer for planter utviklet med nye genteknikker (genredigering)3.
Vi vil understreke at genteknologi er muliggjørende teknologi for bioøkonomien – bærekraftig verdiskaping fra biologiske ressurser. Vi mener at dagens høye og kostbare krav til godkjenning hemmer innovasjon og utvikling av produkter som kan bidra til å løse store samfunnsutfordringer, eksempelvis klimatilpasning, økt matsikkerhet og mer effektive medisiner. Dette understøttes bl.a. av EUs ovennevnte høring der rundt to tredjedeler av innspillene argumenterte for at det nåværende regelverket negativt vil påvirke aktiviteten i deres sektor og muligheten til å oppnå målene i Green Deal og Farm-to-Forkstrategien (se kap. 8.3.2.2.2). For norske utviklere av plante- og husdyrgenetikk vil kostnadene knyttet til godkjenning være for store til at genredigering kan tas i bruk i utviklingsarbeidet.
Dersom Norge (og EU) skal ha vesentlig strengere krav enn resten av verden, vil det særlig svekke konkurransekraften til aktører som eksporterer til det internasjonale markedet. Det kan også føre til at internasjonale utviklere – som får bedre tilgang på teknologiene – kan levere bærekraftige og nyttige innovasjoner til det norske markedet mer effektivt enn norske utviklere kan. Ikke minst hindrer det innovasjon utenfor kapitalsterke virksomheter og industrialiserte næringsområder, og bidrar til monopolisering på viktige områder. En videreføring av dagens genteknologiregelverk vil hemme norsk konkurransekraft både nasjonalt og internasjonalt.
Dagens norske og europeiske genteknologiregelverk skiller ikke mellom PB-produkter som for alle praktiske formål tilsvarer konvensjonelle produkter, og produkter fremstilt med eldre genmodifiseringsteknikker. Alt puttes i GMO-sekken på grunn av en juridisk definisjon som ble laget før genredigering ble tilgjengelig. En GMO-merkelapp på PB-produkter mener vi blir villedende for forbrukerne og vil i seg selv hemme innovasjon på feltet, blant annet på grunn av omdømmerisiko for produsentene. Det vil svekke muligheten til å utnytte potensialet i teknologien til bærekraftig omstilling. Å kreve GMO-merking samt separate produksjonslinjer for PB-produkter vil dessuten innebære så store praktiske og økonomiske konsekvenser for mange næringsaktører at det ikke vil kunne gjennomføres i praksis. En videreføring av dagens GMO-regler er derfor i praksis et nei til genredigering i norsk matproduksjon. Dette utdypes i kapittel 10.2.3.
I dagens situasjon, med den kunnskapen vi har om hva denne teknologien kan utrette, mener vi det er mer risikabelt å beholde en streng regulering som hindrer eller unødvendig forsinker innovasjon, enn å gå inn for en oppmyking. Gitt de mulighetene som genteknologien kan skape med hensyn til klima, matforsyning og bærekraft, er det etisk mest riktige å lage et genteknologiregelverk som i større grad åpner opp for realiseringen av disse mulighetene.
I tråd med ovenstående punkter, ønsker flertallet derfor betydelige endringer i både innholdet i reguleringen, organiseringen av lovverkene, forvaltningsansvar og praktiseringen av GMO-politikken både nasjonalt og internasjonalt.
Oppsummert forslag til ny genteknologiregulering og forvaltning
Flertallet foreslår en helhetlig ny modell for regulering av produkter og organismer fremstilt med genteknologi, som vil gi en vesentlig raskere, mer forutsigbar og risikoproporsjonal vei både gjennom forsknings- og innovasjonsløp og frem til markedet (utdypes i kap. 10.2.2 og 10.2.3). Samtidig ivaretar denne modellen både risiko-, etikk- og åpenhetshensyn. Mange av regelverksendringene, eksempelvis forenklede krav til godkjenning samt unntak fra krav om GMO-merking for PB-produkter, vil potensielt kunne gjennomføres raskere i Norge enn i EU (utdypes i kap. 10.2.6). Dette kan sette Norge i en lederposisjon innen tilgang til nye genredigerte produkter i Europa mens EU jobber med implementering av sine eventuelle regelverksendringer, og samtidig gi Norge anledning til å sette standarden for samfunnsansvarlig innovasjon og bruk av genteknologi. I forslaget ligger også flere grep som harmoniserer det norske regelverket og norsk forvaltning med EUs i betydelig større grad enn i dag, herunder å følge EUs sektorprinsipp. Dette vil både kunne stimulere til mer innovasjon i Norge, og med relevans for Norge, gi norske virksomheter og forbrukere tilgang på flere nyttige importprodukter, sikre at Norge etterlever utenrikspolitiske forpliktelser og er mer integrert i det indre EØS-markedet, samt sikre at fremtidige, viktige regelverksendringer fra EU kan implementeres i Norge uten forsinkelse (utdypes i kap. 10.2.5, 10.2.6 og 10.2.7). Forslaget til differensiering for ulike produkttyper går i retning av lignende regelverksforenklinger gjort i andre land samt signaler gitt fra EU-kommisjonen, og kan derfor bidra til økt harmonisering og bedre tilgang til det globale markedet for Norge generelt.
Vi foreslår også flere grep for å stimulere til mer bærekraftig og samfunnsnyttig innovasjon som kommer flere til gode (utdypes i kap. 10.2.3.10 og 10.2.3.16). Blant annet tar vi inspirasjon fra feltet «orphan drugs» – legemidler til «ulønnsomme» pasientgrupper med et stort udekket behov – der en rekke offentlige virkemidler brukes for å insentivere utviklere. Vi anbefaler også at patentretten for organismer og produkter fremstilt med genteknologi beregnet på matsystemene begrenses i henhold til prinsippene i den differensierte reguleringen: PB-produkter kan sammenlignes med konvensjonelle produkter og får dermed en enklere vei til markedet, og bør derfor ikke kunne påberope seg rettighetsbeskyttelse utover det som gjelder generelt. Et slikt grep mener vi vil hindre konkurransedreining og urimelige begrensninger på tilgangen til produkter, noe som hittil har vært en del av kritikken mot GMO.
Det kan være en stor jobb å skulle snu tiår med teknologiskepsis som har fått slå dype røtter i ulike deler av samfunnet. Vi mener like fullt at det er en viktig oppgave som må til for å lykkes med ny politikk. Det er viktig at beslutningstakere, aktører i matverdikjedene, forbrukerorganisasjoner og samfunnet for øvrig bidrar til kunnskapsbasert, nyansert og konstruktiv dialog knyttet til genteknologi fremover.
Sammendrag av flertallets forslag til regelverksendringer
Forslagene som presenteres i dette kapittelet om flertallsmodellen, støttes av et flertall på syv utvalgsmedlemmer (Anna Wargelius, Muath Alsheikh, Sigrid Bratlie, Trygve Brautaset, Espen Gamlund, Arne Holst-Jensen og Camilla Tøndel). Forslagene omhandler organismer/produkter beregnet på mat og fôr samt annen utsetting til industrielle- og natur- og miljøformål. GMO-legemidler behandles særskilt i kapittel 12.
Risikoproporsjonal og differensiert regulering
Hovedmålet med denne flertallsmodellen er at reguleringen endres i en mer differensiert, risikoproporsjonal og fleksibel retning på en måte som fortsatt trygger helse og miljø, og samtidig bidrar til å fremme utvikling av bærekraftige produkter. Organismer med kun midlertidige genetiske endringer, som ikke er arvbare, bør ikke reguleres som genmodifiserte organismer og bør derfor unntas genteknologilovens virkeområde. For organismer med arvbare, stabile genetiske endringer opprettes to kategorier/definisjoner: Presisjonsavlet (PB, precision bred) for endringer innenfor artens genpool, og genmodifisert (GM) for endringer utenfor artens genpool. Videre opprettes to reguleringsnivåer innenfor hver kategori avhengig av kunnskap og erfaring om egenskapen, til sammen fire reguleringsnivåer. Det tas også hensyn til presisjonen i endringene og hvorvidt det kan ha oppstått utilsiktede endringer. Jo høyere grad av usikkerhet knyttet til endring eller egenskap, desto høyere reguleringsnivå. En villet konsekvens av denne differensieringen er at saksbehandlingen skjer på en raskere, mer forutsigbar og effektiv måte enn i dag. Det er også et mål at det skal være større grad av sammenheng mellom regulering av tradisjonell foredling i matkjeden, og nye, mer presise former for avl og foredling. Det viktigste grepet er at organismer og produkter innen kategorien PB – som bare har endringer innen artens genpool (målrettede mutasjoner, cisgener og intragener) – i stor grad likestilles med konvensjonelle produkter både i forhold til godkjenningskrav og markedsvilkår (merking, sporbarhet, sameksistens, immaterielle rettigheter, høring m.m.). Flertallet anser dette ikke bare som hensiktsmessig fra et vitenskapelig perspektiv, men også som avgjørende for at nye genteknologier kan tas i bruk i norsk avlsarbeid og norsk matproduksjon på en økonomisk og praktisk gjennomførbar måte for næringen. Prinsippene i differensieringen kan benyttes til alle de ulike formålene nasjonal bioproduksjon, import av produkter og forsøksutsetting, med noen tilpasninger i innhold i og vektlegging av ulike godkjenningskrav. Implementering av modellen krever endringer i både genteknologiloven og matloven, se utkast til anbefalte lovendringer i kapittel 10.2.7.5.3.
Vi anbefaler en trinnvis prosess der norsk regelverk og forvaltning tilpasses i tråd med den foreslåtte reguleringsmodellen så langt som mulig innenfor gjeldende handlingsrom, men med et overordnet mål om fullharmonisering med EØS-regelverk på sikt.
Etisk forsvarlighet
I modellen er det også lagt inn forslag til hvordan en vurdering av etisk forsvarlighet kan brukes som en gass eller brems for å legge bedre til rette for innovasjon og utvikling av bærekraftige produkter.
Et samlet utvalg mener at begrepet etisk forsvarlighet skal forstås som et overordnet og integrerende kriterium som inkluderer hensynet til samfunnsnytte, bærekraft og etikk (BSE). Dagens BSE-kriterier etter genteknologiloven er kompliserte og vanskelige for utviklere å tolke. Utvalget har derfor utarbeidet fire nye prinsipper for etisk forsvarlighet (nytte, bærekraft, rettferdig fordeling og åpenhet), som utvalget mener bør erstatte dagens krav om vurdering av BSE (se utdyping i kap. 9). Et samlet utvalg anbefaler at forsøksutsetting unntas krav om etikkvurderinger fordi det er vanskelig å beregne forventede samfunnseffekter før forsøk er gjort. Viktige hensyn ivaretas av annet regelverk (dyrevelferd m.m.).
Flertallet anbefaler videre noen ytterligere tilpasninger og presiseringer for bruk av etikkriterier for forbud på produkter til kommersielle formål, herunder at det skilles mellom nasjonal bioproduksjon og import, slik EU også gjør. Importforbud bør kun nedlegges dersom det er åpenbart moralsk problematiske forhold som også ville vært forbudsgrunnlag dersom produktet hadde vært fremstilt med konvensjonelle metoder. Legitime forbud på importvarer etter EØS-avtalen og WTO trenger ingen egen hjemmel i genteknologiloven. Tidligere praksis med forbud på import av GMO på etisk grunnlag anser flertallet er i strid med Norges folkerettslige og handelspolitiske forpliktelser. Flertallet i utvalget anbefaler derfor at det gis et oppdrag til Utenriksdepartementet om å utrede tidligere praksis samt det faktiske handlingsrommet knyttet til forbud på importvarer begrunnet i etiske hensyn opp mot internasjonal folkerett (EØS og WTO), når lovforslag skal skrives.
Etisk forsvarlighet er innarbeidet i forslaget til lovendringer i kapittel 10.2.7.5.3, se utkast til endring i genteknologiloven § 10 andre og sjette ledd og ny § 10 a) første ledd andre punktum.
Endring i forvaltningsansvar
Utvalgsmedlemmene som støtter denne modellen, mener også at alle produkter til mat og fôr, uavhengig av om de er utviklet med genteknologi eller ikke, bør reguleres etter matloven som forvaltes av matdepartementene og Mattilsynet. Forvaltningen blir da enhetlig og harmonisert med EUs regelverk og medlemslandenes forvaltning, og det tilrettelegger for en mer effektiv forvaltning i tråd med det ordinære sektorprinsippet. Slik kan også tiltak og virkemidler for bærekraftig omstilling av matsystemene innrettes på en helhetlig måte på tvers av teknologiområder.
Det er utarbeidet et forslag til lovendringer i henhold til denne anbefalingen i kapittel 10.2.7.5.3, se utkast til endring i genteknologiloven § 2 første ledd.
Oppfølging av NOU-en
Fordi genteknologiregelverk- og forvaltning dekker mange sektorer og har viktige koblingspunkter opp mot andre regelverk, særlig på områdene mat og helse, anbefaler flertallet at høringen som følger NOU-en sendes felles fra alle de fire berørte departementene (KLD, LMD, HOD og NFD). Den videre politiske prosessen bør også håndteres av de fire departementene i fellesskap. I spørsmål som berører utenrikspolitiske områder bør også Utenriksdepartementet konsulteres.
10.2.1 Innledning
Bioøkonomien – bærekraftig verdiskaping fra biologiske ressurser – må være helt sentral i et grønt skifte. Den realiseres av kunnskap og muliggjørende teknologier. Blant de viktigste er bioteknologi, inkludert genteknologi, som sammen med andre avlsmetoder og teknologier, kan bidra til grønn omstilling i hele matverdikjeden fra jord og fjord til bord. Det er bred enighet om at dette potensialet finnes:
I Horizon Europe (EUs rammeprogram for forskning og innovasjon), står det under arbeidsprogrammet Food, Bioeconomy, Natural Resources, Agriculture and Environment4, som understøtter EU sine missions innen grønn omstilling, at det er behov for å muliggjøre store fremskritt innen livsvitenskap og bioteknologi, herunder nye genomteknikker slik som genredigering. Målsettingen er at dette kan bidra til å løse de store samfunnsutfordringene i vår tid, slik som klimaforebygging og -tilpasning og økt ressurseffektivitet, på en trygg og bærekraftig måte.
Rågiverne til FNs Food Systems Summit skrev i 2021 at forbedret avl og foredling av planter og dyr til landbruket er en nøkkelkomponent i en helhetlig og integrert omstilling av matsystemene for å sikre sunn og næringsrik mat på bærekraftig vis i møte med klimaendringer. Å nå disse målene vil kreve hele verktøykassa med avlsteknologier, fra konvensjonell avl til nye avlsteknikker, og spesielt genredigering5.
FNs organisasjon for mat og landbruk (FAO)6 har identifisert genredigering som en nøkkelteknologi for å utvikle en mer bærekraftig og robust jordbrukssektor.
I begrunnelsen for tildelingen av både Kavli-prisen i 20187 og Nobelprisen i kjemi i 20208 til forskerne bak CRISPR-teknologien, fremheves blant annet teknologiens store potensial innen bærekraftig plante- og dyreavl.
FNs klimapanel9 har definert CRISPR som en av de muliggjørende teknologiene for å håndtere klimaendringer, blant annet gjennom raskere klimatilpasning av planter og gjennom å øke effektiviteten gjennom å tilpasse fotosyntesen.
EU-kommisjonen skriver i sin rapport10, publisert våren 2020, at flere genredigerte produkter har potensial til å bidra til å oppnå målene i EUs Green Deal – spesielt ‘Farm to Fork’, biomangfoldsstrategiene og FNs bærekraftsmål for et mer robust og bærekraftig matsystem.
Vitenskapskomiteen for mat og miljø (VKM) i Norge skriver i sin rapport Matproduksjon, mattrygghet og miljø – innspill om kunnskapsbehov til gjennomføringen av det grønne skiftet11: «Det er grunn til å forvente at genomredigeringsteknikker kan bli viktige hjelpemidler i planteforedling og i noen grad i husdyravl framover. For å nå målene om økt matproduksjon og i lys av behovet for raskere klimatilpassing av plantematerialene, vil det være nødvendig å ta i bruk bioteknologiske metoder som helgenomsekvensering, markørassistert seleksjon og genomredigering, i tillegg til tradisjonelle metoder i planteforedlingen.»
Dagens norske og europeiske genteknologipolitikk gir ikke i tilstrekkelig grad rom for ønsket innovasjon, og gjenspeiler ikke den raske og omfattende teknologiske utviklingen som har skjedd siden hovedlinjene i politikken og regelverket ble utformet for flere tiår siden. I dette kapittelet presenteres flertallets anbefalinger om betydelige endringer i både innholdet i reguleringen, organiseringen av lovverkene, forvaltningsansvar og praktiseringen av GMO-politikken nasjonalt og internasjonalt.
10.2.1.1 Vitenskapelig bakgrunn
Norge har en streng regulering av genmodifiserte organismer (GMO) i forhold til andre land i verden. Dette har det vært bred politisk enighet om, og vekslende regjeringer har fulgt opp Stortingets føringer i tiårene etter at genteknologiloven ble vedtatt i 1993. I genteknologiutvalgets mandat viste oppdragsgiver til at det har vært en betydelig teknologisk utvikling på feltet. Spesielt det siste tiåret, kan vi nærmest snakke om at det har funnet sted en genteknologisk revolusjon. I et matsikkerhets- og bærekraftperspektiv er det et kritisk behov for å implementere løsninger basert på et bredt spekter av avlsverktøy. Målrettede genetiske endringer ved hjelp av genredigering og andre nye genteknologier gir en mulighet til å møte utfordringer knyttet til global matsikkerhet, tilpasninger til klimaendringer, generell arealknapphet og ernæringsbehov. Det er viktig at Norge har et regelverk som stimulerer forskning, utvikling og bruk av bioteknologiske løsninger som kan hjelpe til å løse bærekraftsutfordringer.
Å få godkjenning for en GMO etter dagens regelverk er svært kostnads- og tidkrevende for søker. Totale kostnader for å utvikle en GMO med påfølgende testing og analyser for dokumentasjon til søknaden, kan med dagens regelverk med rimelighet antas å være på nivå med kostnadene og tidsbruken for godkjenning i EU, og dermed meget høye også i Norge (Lassoued et al. 2019). Næringsaktører har selv beregnet at det koster mellom 11-17 millioner euro å få et genmodifisert produkt godkjent til import og bruk i EU, og at saksbehandlingen er svært uforutsigbar og lang – i snitt 6 år (Garcia-Alonso et al. 2022). En annen studie har estimert at regulering av genredigerte nyttevekster som GMO, vil kreve 9 år og 14 millioner dollar ekstra før produktet kommer på markedet, enn om plantene var regulert som konvensjonelle planter (Lassoued et al. 2019). Manglende politisk mot eller vilje har så langt også forsinket mange godkjenningsbeslutninger i EU og Norge. Kostnader knyttet til implementering av krav til produkter på markedet, eksempelvis adskilte produksjonslinjer, kommer i tillegg.
Generelt har kun store multinasjonale selskaper hatt råd til å møte de regulatoriske kravene som foreligger for godkjenning og bruk av GMO. De høye kostnadene medfører også at utviklingen begrenses til avlinger med «global» utbredelse og inntjening. En studie fra Argentina (Whelan et al. 2020) viser at 90 % av omsøkte GMO-produkter var utviklet av utenlandske multinasjonale selskaper. Innenfor kategorien genredigerte produkter – som ikke klassifiseres som GMO i Argentina – var det helt motsatt: 91 % av produktene var det i hovedsak lokale bedrifter, offentlige forskningsinstitusjoner og utenlandske små- og mellomstore bedrifter som stod bak. Kartleggingen viste også en mye større bredde i både typen egenskaper og type organisme/art blant genredigerte produkter enn blant GMO-produkter.
Også andre forhold er medvirkende til at det i Norge per dags dato ikke er noen genmodifiserte planter tillatt for dyrking, og at det heller ikke er godkjent noen genmodifiserte mat- eller fôrprodukter til import. En viktig årsak er at EUs regelverk om genmodifisert mat og fôr foreløpig ikke er tatt inn i EØS-avtalen. Utkast til EØS-beslutning ble sendt fra Norge til Island i 2011, men utkastet er ennå ikke ferdig klarert til forhandlinger med EU. Så lenge dette regelverket ikke er implementert og gjennomført i norsk rett, må GMO-produkter til mat og fôr omsøkes særskilt i Norge. Ingen virksomheter har prioritert det norske markedet høyt nok frem til nylig (en søknad er til behandling etter matloven når denne NOU-en skrives). Det faktum at Norge ikke har et regelverk som er harmonisert med EUs regelverk, og at Norge så langt ikke har godkjent GMO i matkjeden, har bremset opp både tilgang til produkter og forskning og utvikling12.
GMO-definisjonen og tilhørende regulering i både Norge og EU/EØS er basert på genteknologiske metoder som ble brukt på begynnelsen av 1990-tallet. Dette var såkalt «genspleising», der gener i hovedsak ble satt inn på tvers av arter (transgener). Det var heller ikke mulig å styre hvor transgenene ble satt inn i genomet, og både antallet og integriteten (om hver enkelt kopi som ble satt inn var fullstendig) kunne variere. I tillegg brukte man på den tiden ofte antibiotikaresistensgener for å selektere ut den genetiske endringen på en effektiv måte. Planter og dyrs genomer (arvestoff) var heller ikke sekvensert eller karakterisert, mens man hadde hele genomsekvenser for noen få bakteriearter. Man visste også lite om alle de proteiner som kodes for i genomet. Det var derfor store usikkerheter, både faktisk og opplevd, tilknyttet genmodifisering. Det var også knyttet stor usikkerhet til om bruk av genmodifiserte organismer kunne skade miljøet og/eller helsen til dyr og mennesker.
Fordi kunnskapen var nokså begrenset, var det i begynnelsen rimelig med en føre-var-tilnærming og strenge krav til dokumentasjon i forbindelse med godkjenning av GMO-er. I årene som har fulgt har bruken av GMO på globalt nivå økt betydelig, og i 2019 ble det dyrket ca. 190 millioner hektar GMO13, som utgjør drøyt 12 % av dyrket mark globalt. Globale metastudier har vist at bruk av genmodifiserte planter kan ha flere positive effekter, slik som redusert bruk av pesticider, reduksjon av CO2-utslipp og økt avlingsutbytte (Klümper & Qaim 2014, Kovak et al. 2022). I tillegg har det ikke blitt fastslått negative helseeffekter av hittil godkjente GMO, og begrensede effekter på miljøet – hovedsakelig knyttet til utvikling av resistens mot sprøytemidler14 (Platani et al. 2022).
Genteknologi har siden slutten av 1990-tallet utviklet seg enormt. Særlig aktuelt i dag er såkalte genredigeringsteknikker. Ved bruk av målrettet genredigering, kan en introdusere små, målrettede og presise genetiske forandringer, helt uten innsetting av «fremmed DNA». Dette kan for eksempel være identiske kopier av mutasjoner som fra før har oppstått spontant eller blitt til ved klassisk avlsteknologi som konvensjonell mutagenese, innen den samme arten. Teknologien gir også mulighet for å kopiere og introdusere genvarianter svært presist, både innen en art og på tvers av arter. Genredigering beskrives som en demokratiseringsteknologi, da den er enklere, billigere og raskere enn klassisk genmodifisering og dessuten mer presis enn tradisjonell planteforedling.
Parallelt med muligheten til å redigere i gener, har teknologi for å undersøke og karakterisere genetisk informasjon utviklet seg raskt. Sekvensering av genomer går hånd i hånd med anvendt genteknologi. Det betyr at dersom en ønsker å bruke genteknologi for å forandre gener i en organisme, så vil ofte en del av prosessen inkludere å kjenne til og om nødvendig sekvensere den aktuelle artens genom. Samtidig er mange av de viktigste mikroorganismene, plantene og dyrene som brukes i industri og i matsystemene ferdig sekvensert og store deler av deres genomer er karakterisert. Slike referansegenomer representerer den vanligste genetikken innen en art. Teknologi- og kunnskapsutviklingen har også frembragt mye kunnskap om proteiners funksjoner, som gjør det enklere å predikere funksjoner av nye proteiner. Nye, kommende teknologier, særlig innen maskinlæring og kunstig intelligens, vil gjøre dette enda enklere fremover. For eksempel er det siden 2021 mulig å predikere rimelig nøyaktig den tredimensjonale strukturen til et protein kun basert på gensekvensen (AlphaFold) og det utvikles avanserte simuleringsmodeller for fenotypiske effekter fra ulike gener basert på stordata (Madani et al. 2023). Nylig er det også utviklet en rekke prediktive modeller (etter samme prinsipp som ChatGPT) som generer nye funksjonelle proteinsekvenser basert på avlesing av flere hundre millioner proteinsekvenser fra titusenvis av proteinfamilier (Madani et al. 2023). Den teknologiske utviklingen gjør derfor samlet at man har helt andre muligheter for å avdekke genetiske forskjeller og predikere de fenotypiske (egenskapsmessige) effektene av disse, sammenlignet med den kunnskap og de muligheter man hadde for 30 år siden. Dette er av stor betydning for risikovurderinger av produkter utviklet både med og uten hjelp av genteknologi.
Som en konsekvens av de store teknologiske fremskrittene, har sentrale fagmiljøer over hele verden konkludert at eksisterende GMO-regelverk, bl.a. i EU, ikke er risikoproporsjonale eller tilstrekkelig egnet for alle produkter fremstilt med genteknologi (EFSA 2022d, EFSA 2021, Ellens et al. 2019, Hallerman et al. 2022, Lassoued et al. 2019, Ramsay et al. 2022, Rozas et al. 2022). EU-kommisjonen sier selv i sin evaluering i 2021 at gjeldende regelverk ikke er «fit for purpose» og er til hinder for bærekraftig utvikling.
Et betydelig antall land utenfor EU har valgt å ta organismer med målrettede endringer ut av GMO-regelverket eller myke opp regelverkskrav for utvikling, omsetning og godkjenning av slike organismer(Buchholzer & Frommer 2022)15. Felles for de fleste av disse landene er at det forutsettes at den genetiske endringen ikke innebærer tilførsel av «fremmed DNA». Også en rekke EU-land, blant dem Sverige, signaliserte tidlig at de ønsket en slik avgrensning i gjeldende GMO-definisjon, men dette er inntil videre avvist gjennom EU-domstolens tolkning av dagens EU-regelverk den 25. juli 2018. Storbritannia har benyttet handlingsrommet etter de gikk ut av EU til å endre sin lovgivning, og har siden mars 2023 klassifisert planter med genetiske endringer innen arten som «Precision Bred Organism» (PBO), ikke GMO. For slike gjelder sterkt forenklede regler. De vil i neste runde forenkle regler for dyr, under forutsetning av at dyrevelferdskrav er ivaretatt. Noen land, som Canada, har aldri hatt en teknologibasert regulering, men har i stedet valgt å ha en produktbasert tilnærming hvor det gjøres en sak-til-sak vurdering av risiko, uavhengig av om produktet (organismen) er framstilt ved hjelp av genteknologi eller ikke.
Et hovedargument som har blitt brukt for å redusere reguleringskrav for målrettede endringer innen arten, er at risikoprofilen er sammenlignbar med tilsvarende endringer fremstilt med konvensjonelle metoder. EU-kommisjonens Chief Scientific Advisors konkluderer med at genetisk og fenotypisk lignende produkter fremstilt med ulike metoder ikke forventes å medføre ulik risiko16. Samme syn har Chief Scientist Office under FNs organisasjon for landbruk og mat (FAO)17, som sier at det i prinsippet kan antas at produkter fremstilt med målrettet mutagenese har samme risikospenn som tidligere mutasjons-baserte avlsmetoder, inkludert naturlige mutasjoner, mens innsetting av nye gener, også med nye teknikker, har samme risikospenn som tidligere transgene metoder. I tillegg kan den genetiske forandringen karakteriseres i detalj ved hjelp av moderne sekvenseringsteknologi. Det at man kjenner posisjonen til og typen genetisk endring, og at man i mange tilfeller kan forutsi fenotype (egenskap) basert på kjent funksjon til gen/protein (EFSA 2022a), gjør at slike organismer med større forutsigbarhet enn klassiske GMO-er kan forventes å ha lav risiko. Modellen som her presenteres legger imidlertid ikke til grunn at det aldri kan eksistere en risiko, men fremmer en mer risikoproporsjonal tilnærming, til forskjell fra dagens regulering som er teknologifokusert.
Avgjørelsen fra EU domstolen i 2018 om at den juridiske definisjonen av GMO etter dagens regelverk også omfatter organismer utviklet med nye genteknikker uten bruk av genspleising og transgener, var en juridisk tolkning av det eksisterende regelverket og ikke en vurdering av hvorvidt reguleringen er hensiktsmessig. På bakgrunn av ulike studier og høringer som understøtter behovet for regelverksoppdatering (se kap. 8.3.2.2.3), har EU-kommisjonen varslet at de vil legge frem forslag til nytt regelverk for genredigerte planter i juli 2023. Kommisjonen har videre varslet at en tilsvarende prosess for dyr og mikroorganismer vil gjennomføres senere når kunnskapsgrunnlaget er bedre utredet18.
10.2.1.2 Politikk, regelverk og forvaltning – overordnede perspektiver
Utvalgsflertallet mener at dagens norske og europeiske genteknologipolitikk ikke er risikoproporsjonal og legger unødvendige begrensninger på innovasjon og utvikling i en tid med behov for rask omstilling av matsystemene i en mer bærekraftig retning. Alle bærekraftige produkter, inklusive produkter fremstilt med genteknologi, må kunne godkjennes gjennom et forutsigbart og effektivt reguleringssystem. Dagens regelverk er foreldet og gjenspeiler ikke den omfattende teknologiske utviklingen og det økte kunnskapsgrunnlaget som er etablert siden hovedlinjene ble utformet for 30 år siden.
Flertallet mener den norske og europeiske genteknologipolitikken er for restriktiv, og at det er behov for betydelige regulatoriske og politiske endringer. Flertallet mener at alle typer genteknologi vil spille en viktig rolle i en bærekraftig fremtid – ikke bare nye teknikker som genredigering, men også GMO og syntetisk biologi. Det nåværende politiske handlingsrommet for endring, særlig i Europa, er imidlertid primært konsentrert rundt de enkleste formene for bruk av genteknologi som ligner på konvensjonell avl. Hovedtyngden av flertallets anbefalinger om tilpasning av godkjenningskrav i denne NOU-en gjelder derfor også slik «enkel» bruk. Flertallet håper at erfaringer med denne typen bruk av genteknologi senere vil åpne døren for regulatoriske og politiske tilpasninger som i større grad også åpner for mer avansert bruk av genteknologi.
Flertallet legger til grunn at innenfor matlovens og genteknologilovens formål, er hovedfunksjonen å sikre trygge produkter på markedet. Risikovurderinger som skal sikre at produktene er trygge for helse og miljø utgjør hovedelementet i alle GMO-regelverk, inkludert i EU og i Norge. Dette er tydelig fremhevet som et fortsatt viktig kriterium i EUs pågående politiske arbeid med nytt regelverk. Risikovurderinger er også hovedelementet i modellen som her foreslås av utvalgsflertallet. En rekke forhold tilsier at det er hensiktsmessig å differensiere risikovurderingene slik at de blir mer risikoproporsjonale. Dette med bakgrunn i teknologisk utvikling, økt kunnskapsgrunnlag, regulatoriske utviklingstrekk globalt samt politiske signaler. For å oppnå dette må kriterier for differensiering være nettopp risiko, i hvilken grad man på forhånd kan fastslå den og identifisere hvilken informasjon som eventuelt trengs for å opplyse saken tilstrekkelig, basert på et vitenskapelig og et godt fundert erfaringsbasert grunnlag.
Flertallet mener at regelverket også må stimulere til utvikling av bærekraftige produkter som kan bidra positivt til samfunnet. Videre mener flertallet det er viktig at regelverket og forvaltningen i Norge og EU er harmonisert. Det vil sikre en effektiv, enhetlig og helhetlig forvaltning og like konkurransevilkår i Norge som i resten av Europa. Det er også viktig at Norge og EU sikrer konkurransekraft på det globale markedet gjennom hensiktsmessige politiske og juridiske rammevilkår, samt sikrer at regelverket og politikken ikke kommer i konflikt med forpliktelser etter det internasjonale handelsregelverket (WTO) eller EØS-avtalen.
Flertallet stiller det prinsipielle spørsmålet om hvor begrunnelsesbyrden ligger ved veivalg om regulering. De som ønsker å beholde dagens strenge regelverk på genteknologiområdet vil mene at det er de som ønsker å forandre status quo som har begrunnelsesbyrden. På den andre siden kan man henvise til den oppdaterte kunnskapen vi har om genteknologi, og den potensielt store nytteverdien denne teknologien har i å løse viktige samfunnsutfordringer. Hvis genteknologi er en vesentlig del av løsningen på disse utfordringene, særlig om det ikke finnes aktuelle alternativer som er etisk mer forsvarlige, så taler mye for at begrunnelsesbyrden ligger på de som vil holde frem med en streng regulering. Flertallet mener at den kunnskapen vi har om den lave risikoen knyttet til organismer fremstilt med genteknologi, kombinert med det potensial slike produkter har med hensyn til å løse viktige samfunnsutfordringer, gir en større begrunnelsesbyrde hos de som vil bevare dagens strenge regulering som hindrer slike produkter å nå markedet.
I forlengelsen av dette kan det også reises et viktig etisk spørsmål om hva som er mest risikabelt med tanke på en regulering av genteknologiske produkter. De som forsvarer den strenge reguleringen som har gjort seg gjeldende i Norge og Europa de siste tiårene, vil gjerne hevde at loven har stått seg godt nettopp ved at den har hindret farlige produkter å nå markedet. Her har det gjeldende synet antagelig vært at det er mer risikabelt å lempe på den strenge reguleringen enn å la være. Mot dette kan det anføres at i dagens situasjon, med den kunnskapen vi har om hva denne teknologien kan utrette, er mer risikabelt å beholde en streng regulering enn å gå inn for en oppmyking. Mens de som forsvarer en fortsatt streng regulering gjerne vil hevde at det er etisk galt å endre kurs, mener flertallet at det i dag vil være etisk galt å beholde en streng regulering. Gitt de mulighetene som denne teknologien kan skape med hensyn til klima, matforsyning og bærekraft, er det etisk mest riktige å lage et genteknologiregelverk som åpner opp for realiseringen av disse mulighetene.
10.2.1.3 Hovedtrekk i flertallets foreslåtte reguleringsmodell
10.2.1.3.1 Midlertidige genetiske endringer unntas regulering
I tråd med prinsippet om en differensiert regulering basert på risiko, bør organismer med midlertidige, ikke arvbare genetiske endringer, unntas regulering etter GMO-regelverk. Denne anbefalingen er en essensiell del av modellen. Det følger av dette at genteknologiloven § 2 må endres, for å presisere at slike midlertidige genetiske endringer i en organisme ikke medfører at organismen faller inn under noen av lovens definisjoner. Eksempler på endringer som ikke skal dekkes av regelverket, er epigenetiske endringer, metoder der mRNA og siRNA brukes for å transient påvirke genutrykk, og mRNA- og DNA-baserte vaksiner.
Utvalgsflertallet begrunner dette generelle unntaket med at midlertidige endringer skjer hele tiden i alle organismer og at det faktum at de er midlertidige, dvs. ikke stabilt arvelige, gjør at både konkrete og hypotetiske konsekvenser vil være svært begrenset.
Flertallet viser videre til tidligere vedtak om unntak for fisk vaksinert med DNA-vaksinen Clynav, se omtale av Clynav i kapittel 8.2.7. Dette unntaket har EU begrunnet i at endringene er midlertidige, en begrunnelse som kan antas å ha prinsipiell betydning. Flertallet mener derfor at det ikke er EUs intensjon å regulere organismer med midlertidige endringer som GMO, og forventer at EU vil unnta alle produkter der genetiske endringer er midlertidige.
Slike produkter vil fremdeles være omfattet av annen regulering (f.eks. for mat, fôr, plantevernmidler, såvarer, legemidler, samt for dyrehelse- og velferd), slik at det ikke er snakk om en full deregulering av denne typer organismer. I flere av de aktuelle regelverkene er det krav også til helse- og miljørisikovurdering, og for enkelte produkter også krav om godkjenning. Generelle sporbarhetskrav som er hjemlet i matloven, vil dessuten omfatte alle slike produkter til bruk som mat og fôr.
Det er utarbeidet et forslag til lovendring som ivaretar denne anbefalingen i kap. 10.2.7.5.3, se forslaget til endring i genteknologiloven § 2 siste ledd, andre punktum.
10.2.1.3.2 Alle organismer med stabile, arvelige endringer i genomet fremstilt med genteknologi reguleres
Organismer med permanente genetiske endringer fremstilt med genteknologi skal etter flertallets mening omfattes av genteknologispesifikt regelverk, men med differensierte godkjenningskrav som beskrevet i neste kapittel.
Utvalgsflertallet mener det er essensielt å etablere et reguleringssystem som tilrettelegger for bærekraftig innovasjon med genteknologi i hele matsystemet og alle andre felt der produkter fremstilt med genteknologi anvendes (medisin, industri, naturbevaring m.m.). Flertallet mener at det er mulig å etablere gode reguleringsprinsipper som kan gjelde på tvers av arter, og som står seg over tid i møte med fremtidig teknologisk utvikling. Derfor mener flertallet at i motsetning til EUs tilnærming til regulering som i første omgang kun gjelder planter, bør en reguleringsmodell kunne gjelde alle typer organismer, både planter, dyr og mikroorganismer. Hensyn knyttet til særlig dyrevelferd og ulikt omfang av kunnskap for ulike organismegrupper ivaretas gjennom prinsippene i modellen. Er det reell usikkerhet om risiko eller andre ulemper, tilpasses kravene deretter.
10.2.1.3.3 Regulering basert på kunnskap om egenskap og risiko ved genetisk endring
Flertallet ønsker i likhet med EU-kommisjonen å sette et klart skille mellom genetiske endringer som ikke krysser artsgrenser og som kunne vært oppnådd med konvensjonelle metoder (målrettet mutagenese, cis-/intragenese) på den ene siden, og de som krysser artsgrenser og ikke kan oppnås med konvensjonelle metoder (transgener m.m.) på den andre. Det samme skillet har vært inngangen i en differensiering i alle andre land eller regioner som har tatt stilling til hvordan og hvorvidt organismer fremstilt med nye genomteknikker skal reguleres som GMO, inklusive Storbritannia19 og mange andre land i verden (Buchholzer & Frommer 2022). Et slikt skille – endringer innenfor artens genpool versus endringer utenfor artens genpool – utgjør et hovedelement i flertallets modell. Flertallet legger stor vekt på at risikoen knyttet til genetiske endringer laget med genteknologi ikke skiller seg fra tilsvarende endringer som oppstår ved konvensjonelle metoder. Reelt sett kan risikoen vurderes som lavere for produkter produsert med målrettede genteknologier (som CRISPR) enn med konvensjonelle metoder (se figur 10.2), fordi forekomsten av såkalte utilsiktede endringer er lavere ved målrettede genteknologier enn ved andre konvensjonelle metoder (European Commission 2017). Bioteknologirådet la også vekt på dette da de i 2018 anbefalte en differensiering som tok utgangspunkt i typen genetisk endring20.
Da risikoen ved et produkt ikke primært er knyttet til typen genetisk endring, men egenskapen(e) ved produktet, legger flertallet også vesentlig vekt på erfaring med trygg bruk (HoSU, jf. kap. 8 og 10.2.2.3), kjennskap til miljøeffekter av egenskapen(e) som er endret (familiaritet, jf. kap. 8 og 10.2.2.3) og kunnskap om genets funksjon. Dette er i tråd med EU-kommisjonens signaler i veikartet21. En slik modell er også sammenlignbar med systemet for godkjenning av «biotilsvarende» legemidler – der man legger data fra tidligere godkjente legemidler med samme virkemekanisme til grunn i en (risiko-)vurdering fordi de er tilstrekkelig sammenlignbare. Flertallet legger det samme prinsippet til grunn her: Der kunnskapen i stor grad er overførbar mellom organismer og produkter, bør slik kunnskap benyttes i større grad til å forenkle vurderingsprosessen. I tilfeller der man for eksempel med stor grad av sikkerhet på forhånd kan si at risikoen er lav og at produktet ikke bidrar negativt til bærekraft og etisk forsvarlighet, kan det derfor være tilstrekkelig med en meget forenklet godkjenningsprosess. Samme prinsipp er grunnlaget for anbefalingene om differensiering av godkjenningskrav for GMO-legemidler, se nærmere beskrivelse i kapittel 12.
I likhet med The European Food Safety Authority (EFSA) mener flertallet at risiko i hovedsak avgjøres av tre hovedparametre: om den genetiske endringen er innenfor eller utenfor artens genpool, om den genetiske endringen er gjort presist og uten utilsiktede effekter, samt om det finnes eksisterende og overførbar kunnskap om egenskapen den genetiske endringen gir. Flertallet foreslår en modell der godkjenningsnivå avgjøres ved et beslutningstre med basis i EFSAs foreslåtte kriterier for risikovurdering av planter endret med målrettet mutagenese og cis-/intragenesis (Buchholzer & Frommer 2022), men med justeringer og tilpasninger for å gjøre den gjeldende også for dyr og mikroorganismer samt alle typer genetiske endringer, herunder også transgener, invagener og novogener. Jo høyere grad av usikkerhet om mulig risiko, desto mer omfattende krav til godkjenning.
Flertallsmodellen kan derfor anses som en regulatorisk operasjonalisering av EFSAs forslag til kriterier for risikovurderingene. Fire ulike reguleringsnivåer foreslås basert på kombinasjonen av utfall av hovedparametrene. Figur 10.1 angir hvilket reguleringsnivå et produkt kan godkjennes etter, basert på utfallet av vurderingen etter de ulike kriteriene. Konseptuelt er modellen tenkt å kunne benyttes til godkjenning av organismer og produkter for alle formål; forsøksutsetting, nasjonal bioproduksjon (dyrking av planter, husdyrproduksjon m.m.) og import. Imidlertid vil det være forskjeller i innholdet i vurderingene i de fire tilfellene, blant annet for å ta høyde for praktiske og tekniske forhold samt internasjonale juridiske forpliktelser. Dette utdypes lenger ned, se blant annet kapittel 10.2.2.
Som det fremgår av figur 10.1, forutsettes det at søker kan vise at tilsiktede endringer ble som planlagt og at det ikke har oppstått noen bekymringsfulle utilsiktede endringer (punkt B). Kan ikke dette vises, vil det kreves ytterligere dokumentasjon og vurderinger som kan påvirke endelig reguleringsnivå og mulighet for godkjenning. Det samme gjelder dersom det skulle være vesentlig usikkerhet om risiko eller etiske ulemper knyttet til egenskapen etter gjennomgang av dokumentasjonen på angitt nivå, eller dokumentasjonen som leveres er mangelfull. Slike tilfeller med mangler eller andre forhold som ikke oppfyller kriteriene er angitt i rødt i hovedmodellen (beslutningstreet) i figur 10.3 lenger ned. Hovedfokuset i den videre modellbeskrivelsen er veien til markedet/utsetting for produkter som oppfyller kriterier og dokumentasjonskrav.
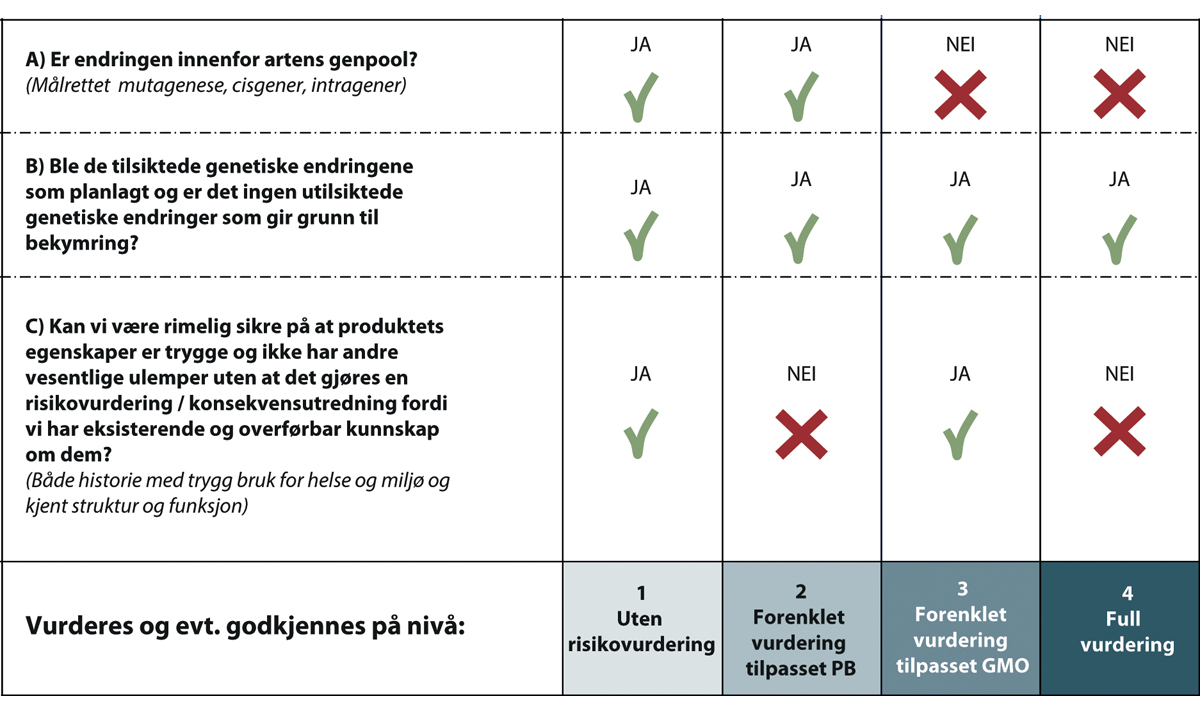
Figur 10.1 Konseptuell fordeling av organismer og produkter i hht. tre hovedparametre knyttet til risiko.
Innbakt i reguleringsmodellen er også en vurdering av etisk forsvarlighet. Modellen skal omfatte både forsøksutsetting, nasjonal bioproduksjon og import av levende og prosesserte produkter som kan brukes til mat, fôr, eller andre formål. Vilkår for markedstilgang som merking, sporbarhet, patent m.m. differensieres etter de samme prinsippene som i modellen forøvrig, der planter, dyr og mikroorganismer med genetiske endringer innen arten i stor grad likestilles med konvensjonelle produkter.
En villet konsekvens av en slik risikoproporsjonal og nivådifferensiert regulering, er at saksbehandlingen skjer på en raskere, mer forutsigbar og effektiv måte enn i dag og at terskelen for å kunne ta genteknologiske produkter inn i produksjon senkes. Det er også et mål at det skal være større grad av sammenheng mellom regulering av tradisjonell foredling i matkjeden, og nye mer presise former for avl og foredling.
10.2.2 Differensiert regulering – fire nivåer
10.2.2.1 Innledning
Dette kapittelet beskriver mer detaljert sentrale elementer i flertallsmodellen. Først gis en oversikt over hovedelementer i modellen, før begrepene presisjonsavl, historie med trygg bruk (HoSU; se også kap. 8 og kap. 10.2.3.2) og kjent neglisjerbar miljørisiko (familiaritet; se også kap. 8 og kap. 10.2.3.2) forklares. Deretter beskrives hvordan risikovurdering og godkjenning skal differensieres i de fire reguleringsnivåene. Deretter omtales kriterier i risikovurdering samt vilkår for markedstilgang (merking m.m.) mer inngående. Flertallets synspunkter på hvordan etiske kriterier kan brukes til å fremme mer samfunnsnyttig og bærekraftig innovasjon beskrives også nærmere i flere delkapitler lenger ned. Etter den differensierte reguleringsmodellen er beskrevet, peker flertallet på flere viktige grep knyttet til regelverksorganisering og forvaltning som forventes å ytterligere stimulere økt bruk av genteknologi til gode formål både i Norge og globalt.
10.2.2.2 Hovedelementer i modellen
Det settes først og fremst et grunnleggende skille mellom produkter med genetiske endringer innenfor og utenfor artens genpool, heretter omtalt som produkter framstilt med henholdsvis presisjonsavl (precision breeding, PB) og genmodifisering (GMO). Dette skillet har konsekvenser for godkjenningsløpet og saksbehandlingen hos myndigheten. Innenfor hver av kategoriene PB og GMO deles saksbehandlingen videre inn i to nivåer, nivå 1-2 for PB og nivå 3-4 for GMO, basert på kjennskap til egenskapen. Flertallet foreslår denne inndelingen med basis i prinsippet om risikoproporsjonalitet og likebehandling av sammenlignbare produkter. Jo høyere grad av usikkerhet om mulig risiko, jo mer omfattende krav til dokumentasjon og saksbehandling. Innbakt i modellen er også krav til dokumentasjon og vurdering av etisk forsvarlighet, og differensierte sporbarhets- og merkekrav. Modellen skal omfatte både forsøksutsetting, nasjonal bioproduksjon og import av levende og prosesserte produkter som kan brukes til mat, fôr, eller andre formål.
Oppsummering av hovedelementene som inngår i reguleringsmodellen (se også figur 10.2):
Alle organismetyper omfattes, det vil si planter, dyr og mikroorganismer, og inkluderer alle typer bruksområder uavhengig av hvilket regelverk de er tenkt regulert etter.
Organismer/produkter til mat og fôr reguleres etter matloven, organismer til annen bruk reguleres etter genteknologiloven.
Jo høyere grad av usikkerhet om mulig risiko med hensyn til den genetiske endringen og egenskapen, jo høyere krav til dokumentasjon og vurdering før godkjenning.
Modellen har følgende hovedtrekk:
Organismer med midlertidige, ikke arvbare genetiske endringer unntas regulering etter GMO-regelverket.
Organismer med arvbare, stabile genetiske endringer deles inn i to kategorier, med utgangspunkt i vesentlig ulike vilkår i markedet etter godkjenning.
Organismer med målrettede genetiske endringer innenfor artens genpool kalles PB – presisjonsavlede organismer/produkter (oversatt fra engelsk «precision breeding», PB brukes som forkortelse også på norsk).
Organismer som inneholder genetiske endringer som klassifiseres som transgene, invagene eller novogene (tilførsel av gener som ikke er kjent i arten fra før) klassifiseres som GMO.
Innenfor hver av kategoriene PB og GMO innføres to godkjenningsløp, basert på kunnskap om og erfaring med egenskapen den genetiske endringen gir (se kap. 10.2.3.2 og figur 10.2).
For å vurdere kunnskap og erfaring med egenskapen brukes begrepene historie med trygg bruk (heretter: HoSU –» History of Safe Use»), kjent neglisjerbar miljørisiko (engelsk «familiarity»; heretter familiaritet) samt kjennskap til genfunksjon på linje med begrepsbruken i EFSAs uttalelse (EFSA 2022a).
HoSU, familiaritet og kjennskap til genfunksjon gir grunnlag for forenklet saksbehandling innenfor begge kategorier (PB og GMO).
Det skal være hensiktsmessige sporbarhets- og merkekrav. Dette innebærer for PB-produkter, i likhet med produkter utviklet med konvensjonelle avls- og foredlingsmetoder, at det ikke er spesifikke obligatoriske merke- og sporbarhetskrav og at det ikke skal kreves analytiske deteksjonsmetoder (se figur 10.2). Dette ivaretar hensynet til ikke-diskriminering mellom like produkter. Alle andre produkter (GMO) omfattes av spesifikke merke- og sporbarhetskrav inkludert analysemetode for påvisning.
Vurdering av etisk forsvarlighet som også omfatter en bærekraftsanalyse, skal fungere som en gasspedal for mer bærekraftige produkter og brems for produkter som kan være negative for bærekraftig utvikling. Vurderingen skal være i tråd både med EUs fremtidige bærekraftskriterier for alle produkter og internasjonalt handelsregelverk. Vurderingen brukes for å vurdere fast track og/eller overføring til et annet reguleringsnivå (opp eller ned).
Immaterielle rettigheter differensieres i henhold til prinsippene i modellen: PB-produkter er sammenlignbare med konvensjonelle produkter og får derfor en enklere vei til markedet. Fordi de ikke representerer noe «vesentlig nytt» bør de heller ikke kunne rettighetsbeskyttes utover det som gjelder for konvensjonelle produkter.
Det åpnes for at invagener og novogener skal vurderes etter strengere kriterierer enn andre GMO, men det må da utvikles egne veiledere for saksbehandling (risiko- og etikkvurdering og tilhørende dokumentasjon).
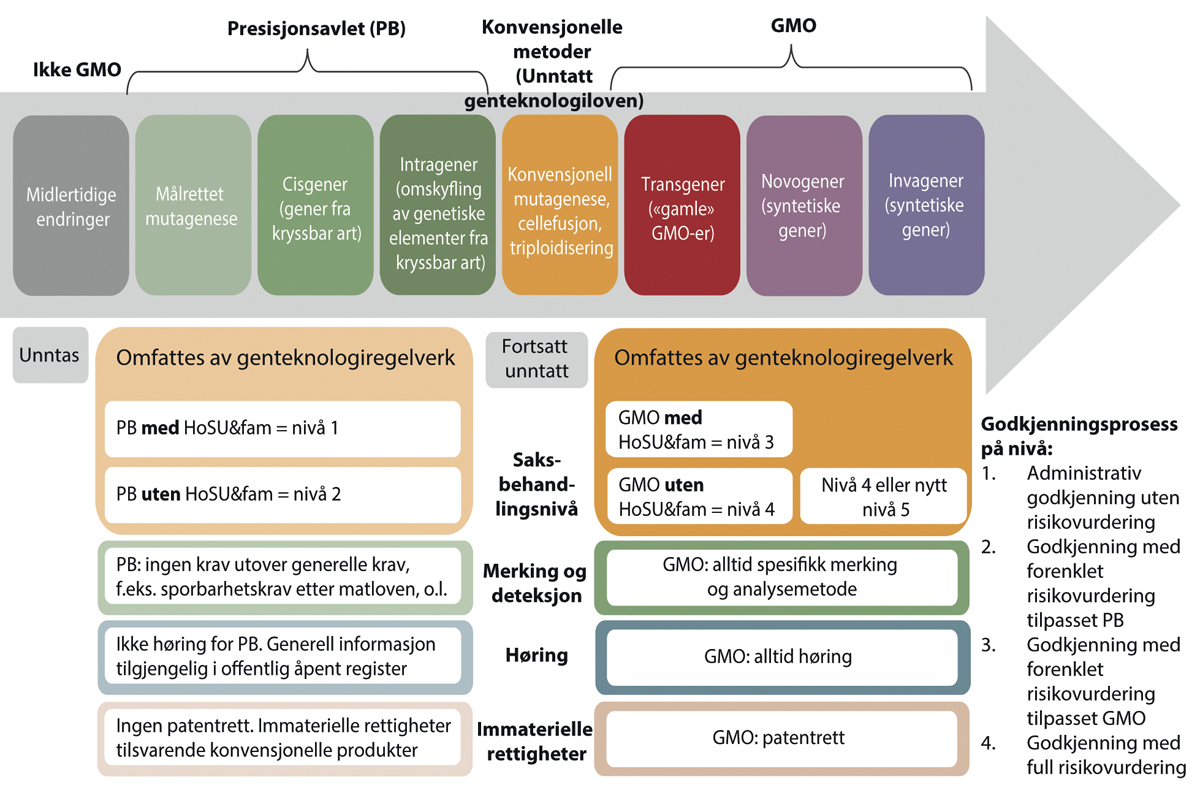
Figur 10.2 Oversikt over reguleringsnivå og vilkår for markedstilgang i flertallsmodellen som funksjon av type/presisjonsnivå for genetisk endring. I forhold til type/grad av/presisjonsnivå for genetisk endring, fordeles kategoriene PB og GMO på hver sin side av konvensjonelle metoder/-produkttyper som i dag ikke er regulert etter GMO-regelverk. Økende krav til dokumentasjon (høyere reguleringsnivå) jo høyere grad av usikkerhet både med tanke på genetisk endring og kjennskap og erfaring med fenotypen i miljøet.
10.2.2.3 Konseptene presisjonsavl, historie med trygg bruk og kjennskap til miljøeffekter
Flertallet definerer «precision breeding» (PB) som presisjonsavl der det brukes genteknologiske metoder for å oppnå endringer innenfor artens genpool. Dette fordi man oppnår den samme genetiske endringen som man ville kunne oppnå med konvensjonelle avlsmetoder, men på en mer presis måte: I stedet for å måtte endre mange gener for å oppnå én konkret egenskap (som ved kryssing eller tilfeldig mutagenese), introduseres den ønskede egenskapen/genet spesifikt ved hjelp av genteknologi. Med artens genpool menes alt genetisk materiale og genvarianter som ville vært tilgjengelig ved endring av den aktuelle organismen ved bruk av konvensjonelle/ikke-regulerte avlsteknologier. Teknologien (genteknologi eller konvensjonelle metoder) som brukes for å oppnå den genetiske endringen er ikke relevant når utfallet er det samme. Organismer fremstilt med slik presisjonsavl og produkter fra disse, er dermed produkter som ikke har «fremmed» DNA introdusert, det vil si at den genteknologibaserte endringen har ikke medført tilførsel av DNA-materiale som ikke foreligger i en eller annen form i artens genpool fra før. Disse organismene og produktene omtales som PB-produkter. Det presiseres at presisjonsavl brukes om alle typer organismer, selv om det innen planter gjerne brukes begrepet (genetisk) foredling. Presisjonsavl skal forstås å gjelde både som avl av dyr og foredling av planter ved bruk av genteknologiske metoder for å oppnå presise og målrettede endringer innenfor artens genpool. For mikroorganismer finnes det ikke et like godt etablert begrep som passer, men flertallet foreslår presisjonsforbedring innen homolog genpool, som et mulig begrep for å dekke den typen endringer som vil gjøre at mikroorganismer kan falle innenfor rammen av PB.
Eksempler på teknikker som kan benyttes for å utvikle PB-produkter omfatter blant annet målrettet mutagenese (i dag den vanligste formen for genredigering), cisgenese (overføring av gener fra en kryssbar organisme) og intragenese (gener sammensatt av ulike genetiske elementer som finnes i arten fra før). Disse metodene er nærmere beskrevet i kapittel 4. PB vil også omfatte produkter som utvikles med fremtidige metoder som resulterer i lignende endringer, så lenge det ikke introduseres funksjonelt DNA fra utenfor artens genpool.
Flertallet foreslår at regelverket endres slik at PB-organismer og produkter fra slike, ikke skal omfattes av like omfattende godkjennings- og merkekrav som i dag, men i større grad likestilles med konvensjonelle produkter.
Det er utarbeidet et forslag til lovendring som ivaretar denne anbefalingen i kap. 10.2.7.5.3, se forslaget til endring i genteknologiloven §§ 4 d), 10 a) og 10 b).
10.2.2.4 Kriterier i risikovurderingene
Kriterier for krav til dokumentasjon og behov for og omfang av risikovurdering foretatt av myndighetene, skal være forutsigbare. Som omtalt i innledningen, foreslår flertallet å ta utgangspunkt i EFSAs uttalelse om kriterier for risikovurdering av planter fremstilt med målrettet mutagenese og cis-/intragener (Buchholzer & Frommer 2022) og at disse også benyttes for dyr og mikroorganismer.
EFSA foreslår seks kriterier for risikovurdering av planter fremstilt med målrettet mutagenese, cisgenese og intragenese. De første fire kriteriene baserer seg på den molekylære karakteriseringen (se figur 10.3). Flertallet foreslår å bruke alle disse kriteriene inkludert off-target analyse. Videre mener flertallet at kriteriene prinsipielt også kan brukes for GMO, med enkelte tilpasninger i vurderingene.
Følgende kriterier er foreslått fra EFSA:
Kriterium 1 – Er eksogene DNA-sekvenser til stede?
Kriterium 2 – Stammer de eksogene DNA sekvensene fra artens genpool?
Kriterium 3 – Er den eksogene DNA sekvensen integrert på et kjent eller ukjent sted i genomet (kriterium gjelder bare for organismer med cis- eller intragene forandringer)?
Kriterium 4 – Har endogene gener blitt «ødelagt» ved integrasjon?
Kriterium 5 – Hvor kjent er effekten av det forandrede allelet på helse og miljø?
Kriterium 6 – Hvor kjent er funksjonen til det nye allelet?
Dette kan oppsummeres og oversettes til tre generelle hovedparametre (som vist i Figur 10.1):
Om den genetiske endringen er innenfor eller utenfor artens genpool (kriterium 1 og 2)
Om den genetiske endringen er gjort presist og uten utilsiktede effekter (kriterium 3 og 4)
Om det finnes det eksisterende og overførbar kunnskap om egenskapen og genfunksjonen (kriterium 5 og 6)
Kriteriene vil i flertallsmodellen også omfatte dyr og mikroorganismer.
10.2.2.5 Forslag til beslutningstre basert på risikoproporsjonalitet og forutsigbarhet
Figur 10.3 viser et beslutningstre for flertallets forslag til nivådeling av godkjenningsløp med fire alternativer. Endelig nivåplassering avhenger av at organismen/produktet oppfyller de relevante kriteriene og at søker oppfyller kravene til dokumentasjon. For produkter som ikke oppfyller kriteriene, eller der dokumentasjonen er mangelfull, vil myndighetene til enhver tid ha mulighet til å kreve ytterligere dokumentasjon eller flytte produktet til et annet nivå slik de finner hensiktsmessig. En slik saksgang beskrives ikke i detalj her.
Det første steget (A) i beslutningstreet vil være å klassifisere hvilken type genetisk(e) endring(er) som er introdusert med genteknologi i det aktuelle produktet (kriterium 1 og 2). Dette er relevant for å avgjøre hvilken dokumentasjon og hvilke analyser som senere behøves for å si noe om risiko. Dette avgjøres av kriterium 1 og 2 som sorterer produkter i henhold til om endringen er innenfor eller utenfor artens genpool, det vil si presisjonsavlet (precision bred, PB) eller genmodifisert (GMO). PB omfatter to undergrupper avhengig av om det er gjort målrettede mutasjoner (genredigert) eller om det er tilført/omorganisert DNA-sekvenser i genomet (cis-/intragener). Innenfor GMO finnes også ulike undergrupper kalt transgener (fra en annen art), novogener (designede gensekvenser) og invagener (bl.a. gendrivere). De to sistnevnte kategoriene er ikke ennå aktuelle for utsetting i særlig omfang på kort sikt. Det er fortsatt et begrenset kunnskapsgrunnlag for disse og krav til vurdering og regulering av slike bør etter flertallets oppfatning kanskje utredes videre. I denne modellen er krav og nivådeling for GMO derfor i hovedsak relevant for transgene organismer.
Når et produkt i dette steget er klassifisert som enten PB eller GMO er det ikke mulig å endre denne klassifiseringen og den tilhørende gangen i beslutningstreet senere, selv om produkter av begge typer kan få et lignende omfang av risikovurdering. Det er imidlertid mulig at et produkt erklært av søker som PB ved gjennomgang av dokumentasjon viser seg å falle utenfor definisjonen av PB og innenfor definisjonen av GMO. Søknaden vil da gå inn i et GMO-løp i stedet.
I det andre steget (B) i beslutningstreet skal det svares på om den tiltenkte genetiske endringen (det nye allelet/genet) ble som planlagt (kriterium 3) og om det har oppstått utilsiktede endringer i organismens genom som kan gi utilsiktede effekter (kriterium 4). Dette dokumenteres ved hjelp av egnede DNA-analyser. Hvilke analyser som bør kreves avhenger av tekniske forhold som hvilken type genetisk endring det er snakk om og hvilke metoder som er best egnet – noe som kan endre seg med teknologisk utvikling. EFSA har både eksisterende retningslinjer og et pågående utviklingsarbeid på dette området, og utvalgsmedlemmene ønsker å legge deres til enhver tid gjeldende anbefalinger til grunn for modellen. Svaret på disse to spørsmålene (kriterium 3 og 4) avgjør hva som blir inngangen til neste trinn i beslutningstreet, trinn (C). Er svaret «nei» på ett eller begge av disse kriteriene gjør myndigheten en vurdering av om utilsiktede endringer i enten det nye allelet/genet eller genomet for øvrig kan innebære en risiko. Identifiseres en mulig risiko, gjøres en tilleggsvurdering av denne før produktet kan gå videre i prosessen. Hva som kreves av dokumentasjon i denne tilleggsvurderingen avhenger av risikoens karakter og grad av usikkerhet. Utfallet av denne vurderingen kan påvirke endelig plassering på nivå og i ytterste konsekvens i seg selv føre til et forbud dersom risikoen er stor nok.
Det tredje steget (C) i beslutningstreethar som mål å avklare om det finnes tilstrekkelig kunnskap om eller erfaring med egenskapen som den tiltenkte genetiske endringen gir, til at man kan konkludere med at produktet ikke har en uakseptabel risiko eller andre ulemper. I vitenskapelige termer kan spørsmålet stilles som hvorvidt allelet/genet og egenskapen det gir har en historie med trygg bruk for helse og miljø (HoSU og familiaritet) (kriterium 5). Hvis ikke kriterium 5 kan oppfylles skal kunnskap om allelet/genets struktur og funksjon beskrives og kan tillegges vekt når nivå av risikovurdering skal bestemmes (kriterium 6). Alle produkter som har kommet videre etter vurdering i B-trinnet vil bli vurdert etter disse kriteriene. Disse kriteriene og forståelsen av dem er utdypet tidligere i teksten og i EFSAs forslag til kriterier for risikovurderinger.
Sammenligningsgrunnlaget for å vurdere om produktet oppfyller disse to kriteriene er eksisterende produkter/egenskaper som allerede er i bruk til samme formål. Hvis myndighetene i sin saksbehandling konkluderer med at det er dokumentert tilstrekkelig kunnskap i forhold kriterium 5 og/eller 6 som kan forutsi risiko og etisk forsvarlighet, vil PB bli godkjent uten ytterligere vurdering. Dette vil i utgangspunktet gjelde PB-produkter som er fremstilt med målrettet mutagenese eller cisgener, der det nye genet/allelet har kjent risikoprofil fra sammenlignbare produkter (kriterium 5), eller fordi kunnskapen om genets funksjon er god nok (kriterium 6). Disse kriteriene vil være spesielt relevante for produkter som har målrettede eller cis-gene endringer siden slike endringer kan ha oppstått naturlig eller blitt produsert ved naturlig konvensjonell avl. En GMO som oppfyller både kriterium 5 og 6 vil ikke kunne godkjennes uten en egen vurdering, men kan godkjennes på et noe forenklet nivå dersom eksisterende kunnskap tilsier at det er et trygt og etisk forsvarlig produkt.
For PB-produkter der søker ikke har tilstrekkelig dokumentasjon til kriterium 5 og/eller 6, vil det være nødvendig å gjøre en forenklet vurdering på nivå 2. I tillegg til PB-produkter med målrettede mutasjoner eller cisgener som man ikke har lang erfaring med eller god nok kunnskap om, vil dette gjelde alle PB-produkter med intragener fordi de ikke vil være sammenlignbare med eksisterende produkter og derfor ikke vil oppfylle kriterium 5 og/eller 6. Dersom denne forenklede vurderingen avdekker at det kan foreligge vesentlig risiko og/eller grad av etisk uforsvarlighet, vil produktet eventuelt bli omfattet av en fullstendig vurdering av risiko og etisk forsvarlighet i tråd med dagens krav. Hovedpoenget med steg C er at dersom det finnes eksisterende kunnskap som i stor grad er overførbar til produktet som vurderes, bør slik kunnskap i større grad enn i dag brukes til å forenkle vurderingsprosessen. Prinsippet er sammenlignbart med systemet for godkjenning av «biotilsvarende» legemidler – der man legger data fra tidligere godkjente legemidler med samme virkemekanisme til grunn i en vurdering fordi legemidlene er tilstrekkelig sammenlignbare.
Vedlagt dokumentasjon for å oppfylle krav til kriterium 5 og 6, i kombinasjon med svarene på de fire foregående kriteriene, avgjør hvilket reguleringsnivå et produkt til slutt havner på. Nivåplasseringen etter beslutningsprosessen handler derfor om hvorvidt produktet godkjennes eller forbys.
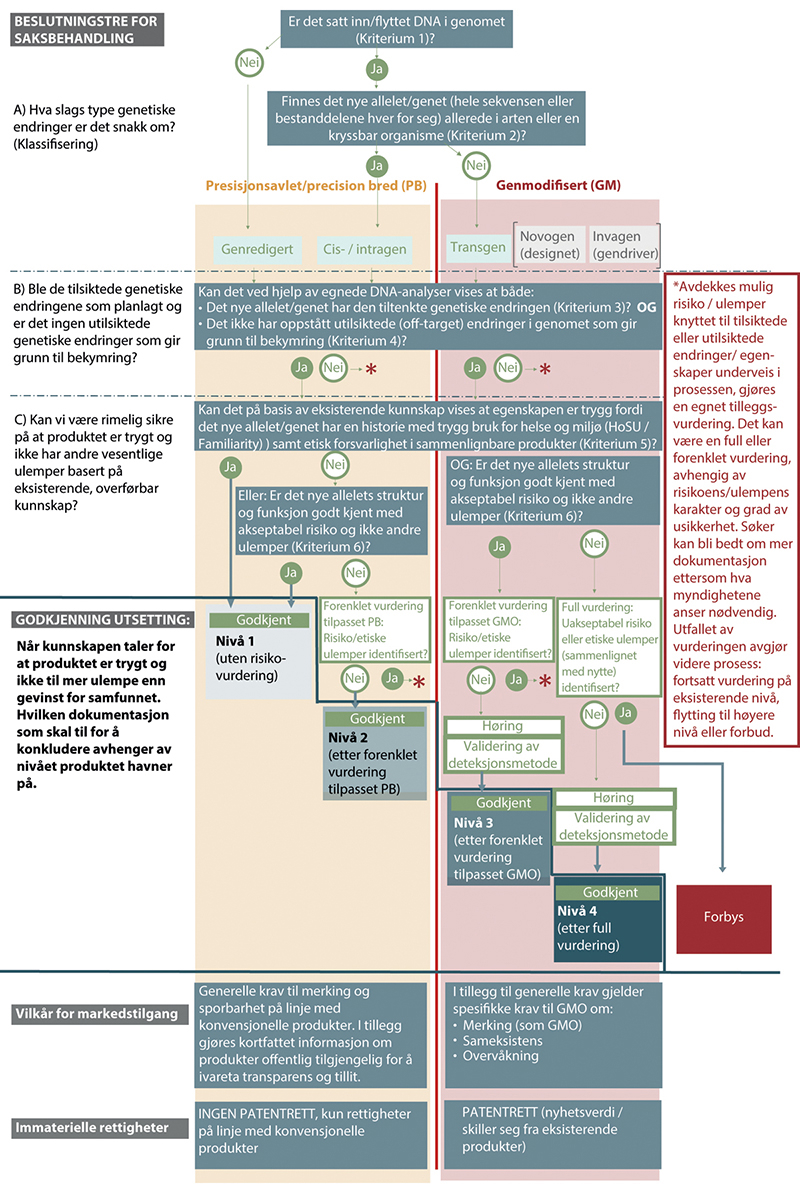
Figur 10.3 Forslag til beslutningstre for saksbehandling og markedsvilkår for PB- og GMO-organismer og produkter basert på prinsippet om risikoproporsjonalitet, forutsigbarhet om relevante forhold og større grad av likebehandling av like produkter.
10.2.2.6 Nærmere om saksbehandlings- og reguleringsnivåer
10.2.2.6.1 Godkjenningsløp på nivå 1 – Ingen risikovurdering for enkelte PB
Gjelder for produkter som faller innenfor definisjonen av PB, som både har den tiltenkte genetiske endringen, fravær av risikable utilsiktede endringer, samt forutsigbar akseptabel risikoprofil for egenskapen (kjent HoSU/ familiaritet eller tilstrekkelig kunnskap om det nye allelets struktur og funksjon).
På dette nivået kommer PB-produkter (som ikke er tilført DNA som ikke finnes innenfor artens genpool etter kriterium 1 og 2) som får «ja» på kriterium 3 og 4 samt 5 og/eller 6. Dette er altså produkter som har den tiltenkte gensekvensen og ikke bekymringsfulle utilsiktede endringer, og genetiske endringer/egenskaper som er kjent fra sammenlignbare produkter som har historie med trygg bruk for helse og miljø og er etisk forsvarlige. PB-produkter fremstilt med målrettet mutagenese og/eller cisgenese kunne ha blitt produsert ved konvensjonell avl eller oppstått naturlig og er derfor generelt sammenlignbare med konvensjonelle produkter. Det vil derfor kunne være tilstrekkelig for slike produkter at de har enten HoSU/familiaritet (kriterium 5) eller det finnes god kunnskap om allelets funksjon (kriterium 6), for at de havner på nivå 1.
Slike produkter kan med stor grad av forutsigbarhet fastslås å være like trygge som (eller tryggere enn) de konvensjonelle ekvivalentene, og en ytterligere risikovurdering vil derfor ikke være nødvendig. En lignende tilnærming beskrives i EFSAs uttalelse fra 2022 (Buchholzer & Frommer 2022):
«[…] the new allele obtained through genome editing and the associated trait characterising the final product are already present in a consumed and/or cultivated variety of the same species. In this case, the risk assessment may focus on the knowledge of that variety (the history of safe use) and specific data on the edited gene and its product may not be needed».
Produktene vil også være like etisk forsvarlige som sammenlignbare konvensjonelle organismer og produkter. Imidlertid viser flertallet til at konvensjonell avl- og foredling kan være etisk uforsvarlig, særlig knyttet til negative effekter på dyrevelferd (eksempelvis innen avl på hunder, eller fjørfe i kjøttproduksjon). Det er ikke ønskelig at genteknologi skal brukes til å replikere eller forsterke slike trekk selv om de allerede eksisterer og er tillatt. Derfor må dokumentasjonen på nivå 1 inneholde en beskrivelse av forhold knyttet til etisk forsvarlighet (nytte, åpenhet, bærekraft og rettferdig fordeling i tråd med utvalgets forslag i kap. 9), for å utelukke at de tilførte egenskapene er etisk uforsvarlige.
Utvalgsflertallet mener at for søknader på nivå 1 er det tilstrekkelig med et svært forenklet godkjenningsløp så lenge søker, på basis av dokumentasjon på type genetisk endring samt eksisterende kunnskap fra sammenlignbare organismer og produkter, kan sannsynliggjøre neglisjerbar risiko og etisk forsvarlighet.
Søknader på nivå 1 foreslås å omfatte:
Dokumentasjon på den tilsiktede genetiske endringen (sekvensdata o.l.).
Dokumentasjon på fravær av utilsiktede endringer i homologe områder (over forventet bakgrunnsnivå), fravær av vektor-integrasjon o.l.
Referanser og dokumentasjon som viser at allelet har neglisjerbar effekt på helse og miljø gjennom dokumentasjon på «history of safe use» (HoSU) og familiaritet og/eller en godt kjent genfunksjon.
Beskrivelse som underbygger produktets etiske forsvarlighet (nytte, åpenhet, bærekraft og rettferdig fordeling), inkludert forventede effekter på dyrevelferd basert på dokumentasjon fra dyr med den aktuelle genvarianten.
Ytterligere beskrivelser av nivå 1
Produkter på nivå 1 har en tilsvarende eller lavere risiko enn konvensjonelle produkter med samme egenskaper, fordi målrettede eller cisgene endringer er samme type endringer som oppstår naturlig eller kan introduseres konvensjonelt, men kan i mange tilfeller lages mer presist. Produktene er også minst like etisk forsvarlige som konvensjonelle produkter. Flertallet ønsker likevel å beholde denne produktgruppen innenfor et genteknologispesifikt regelverk fremfor å unnta dem, ut fra forbrukerhensynet. Det anses at en godkjenningsordning vil kunne skape trygghet om en teknologi som det har vært mye skepsis til og at det kan bidra til åpenhet om hvordan produktene er fremstilt, for eksempel ved å gjøre informasjon tilgjengelig i et register. Videre anføres at også myndighetenes behov for oversikt, kontroll og mulighet for overordnet styring av teknologiutviklingen, inkludert bruk av positive virkemidler, legitimerer regulering og av denne produktgruppen.
Flertallet mener at det ikke behøves data fra forsøksutsetting før godkjenning på nivå 1, da det ikke gjelder slikt krav for konvensjonelle organismer og det ikke forventes å frembringe ny informasjon som ikke allerede besvares av eksisterende kunnskap fra sammenlignbare produkter. På samme måte vil det ikke være krav om høring, da sammenlignbare konvensjonelle produkter ikke gjøres til gjenstand for høringer og det antas at virkningene av en utsetting heller ikke vil være ulik.
Dette sterkt forenklede godkjenningsløpet tar hensyn til kjente egenskaper ved produktet, gjør bedre bruk av eksisterende kunnskap for effektiviseringsformål, og sikrer at produkter har like lav helse- og miljørisiko som sammenlignbare konvensjonelle produkter. Omfanget av produkter som kvalifiserer for nivå 1-vurdering vil antakelig være begrenset i starten, men forventes å øke over tid etter hvert som man får erfaring med trygg og bærekraftig bruk av flere produkter. Dette er i tråd med intensjonen i føre-var-prinsippet om at kunnskapsnivået er utslagsgivende.
I saksbehandlingen på nivå 1 skal myndighetene foreta en vurdering av dokumentasjonen innenfor forvaltningslovens krav om å avgjøre saken uten ugrunnet opphold, jf. § 11a, og fatte et enkeltvedtak om hvorvidt dokumentasjonen er i samsvar med kravene. Utvalgsmedlemmene mener det er naturlig å skjele til hvordan konvensjonelle produkter reguleres, og ønsker generelt at tillatelsen gis for en lengst mulig tidsperiode, men vil harmonisere dette mest mulig med EUs nye regelverk. Det er vanlig klageadgang på vedtaket, jf. forvaltningsloven § 29. Myndigheten legger informasjon om godkjenningen inn i et register som er åpent tilgjengelig for alle.
Vilkårene i saksbehandlingsnivå 1 skal sikre at det ikke er noen vesentlige nedsider ved et produkt sammenlignet med det som allerede finnes på markedet. Dokumentasjonen gjennomgås av Mattilsynet (for mat- og fôrprodukter) eller Miljødirektoratet (for andre produkter enn mat og fôr til utsetting). Hvis myndigheten finner at kravene er oppfylt, fattes et enkeltvedtak om at dokumentasjonen er i samsvar med kravene og at produktet kan omsettes, forutsatt at vilkår i annet relevant regelverk er oppfylt. Dersom myndigheten finner at søker ikke kan dokumentere at kravene for saksbehandling på nivå 1 er oppfylt, blir søknaden overført til saksbehandlingsnivå 2.
En slik ordning ligner på den ordningen som praktiseres for innesluttet bruk av enkelte grupper av genmodifiserte mikroorganismer og som omtales som en meldeordning, jf. forskrift om innesluttet bruk av genmodifiserte mikroorganismer. En slik ordning er videre bygget på samme prinsipp som forslaget til differensiert regulering av kliniske studier med GMO-legemidler (se kap. 12). Ordningen passer inn i et helhetlig reguleringsbilde på GMO-området, der produkter man med stor grad av sikkerhet på forhånd kan si at har lav risiko, reguleres «likt» med et sterkt forenklet godkjenningsløp uten risikovurdering (av typen samsvarsvurdering).
Produkter på nivå 1 vil omfattes av andre bestemmelser i annen regulering, avhengig av type produkt (f.eks. for mat, fôr, plantevernmidler, plantesorter, såvarer, samt for dyrehelse- og velferd). I flere av de aktuelle regelverkene er det krav til helse- og miljørisikovurdering og for enkelte produkter også krav om godkjenning, blant annet sortsgodkjenning av de viktigste mat- og fôrvekstene.
Vilkår for markedstilgang etter godkjenning for produkter på nivå 1
Selv om flertallet mener det er hensiktsmessig å beholde en godkjenningsordning for PB-produkter av hensyn til teknologistyring og transparens, mener de at vilkår for markedstilgang bør likestilles med vilkår for konvensjonelle produkter. Produkter på nivå 1 (og nivå 2) vil derfor ikke ha særskilte krav til merking, sporbarhet, sameksistens, overvåkning eller immaterielle rettigheter (som illustrert i figur 10.3 over). Dette utdypes og begrunnes i ulike delkapitler senere i dette kapittelet.
Eksempler på organismer og produkter som vil havne på nivå 1
Flertallet viser til regulering av genredigerte dyr i USA som et praktisk eksempel på regulering som ligner på nivå 1 i modellen. I 2022 bestemte FDA (U.S. Food and Drug administration som er ansvarlig myndighet for genredigerte dyr) – basert på en forhåndsvurdering – å droppe risikovurdering av genredigert storfe som hadde fått en mutasjon/genvariant som gir kort pels og bedre toleranse for høye temperaturer (se også kap. 7.3.2). Genvarianten og egenskapen finnes naturlig i andre storferaser som brukes i matproduksjon, og har en lang historie med trygg bruk for helse og miljø. Genvarianten og egenskapen den gir, er også tidligere beskrevet i forskningslitteraturen, og har derfor en kjent struktur og funksjon. De genredigerte dyrene hadde heller ikke avvik fra forventet fenotype og hadde god helse ved inspeksjon. Utvikler sendte inn sekvensdata (helgenomsekvensering) som dokumenterte både tilsiktede og utilsiktede genetiske endringer. Utilsiktede mutasjoner var ikke forventet å utgjøre noen risiko. Produktet kan dermed selges på markedet i USA uten godkjenning eller særkrav knyttet til merking m.m.
I flertallsmodellen vil en aktuell og sammenlignbar case som beskrevet over, være å øke frekvensen av eksisterende genvarianter for hornløshet og ulike melkeproteiner i storfepopulasjonen til det norske avlsselskapet Geno (se nærmere beskrivelse i kap. 7.3.2). Dette er kjente genvarianter og egenskaper som – gitt at de genetiske endringene lages presist og man med rimelig sikkerhet kan fastslå at det ikke foreligger utilsiktede endringer – ikke forventes å medføre noen risiko eller ulemper som skiller seg fra de konvensjonelt avlede dyrene.
Et aktuelt eksempel innen planter (se nærmere beskrivelse i kap. 7.2.1), er dersom Graminor vil ønske å introdusere en mutasjon som gir korte strå i hvetesorten Mirakel slik at den ikke knekker så lett når det blåser og regner og ikke må tilføres stråforkorter. Slike mutasjoner er godt kjent fra andre, konvensjonelt foredlede hvetelinjer og andre kornarter og gir en forutsigbar effekt. En sammenlignbar case er introduksjon av genvarianten for korte strå i teff (Eragrostis tef) – en kornsort som er glutenfri og høy på gunstige næringsstoffer. Teff er en viktig matplante i Etiopia og andre utviklingsland, og dyrkes i tillegg i USA. En slik genredigert variant med korte strå, utviklet i samarbeid mellom amerikanske og etiopiske forskere, ble i april 2023 klarert for markedet i USA uten behov for godkjenning. Myndigheten (USDA/Aphis) viser til kjennskap til egenskapen og den genetiske endringen som begrunnelse22. Det forventes at korte strå kan redusere teff-svinnet med rundt 25 %.
I enkelte tilfeller kan det hende at kunnskap også er overførbar mellom arter, og at et PB-produkt kan godkjennes på nivå 1 selv om allelet ikke finnes i arten fra før. For eksempel er MLO-mutasjoner som gir melduggresistens godt kjent og har en lang historie med trygg bruk i en rekke plantesorter, blant annet bygg. Slik erfaring og kunnskap vil sannsynligvis i stor grad være overførbar til genredigert melduggresistent (MLO-mutert) hvete med tanke på risikoprofil (se beskrivelse av case i kap. 7.2.2). MLO-mutasjoner kan dessuten som regel fremskaffes med konvensjonelle metoder, men praktiske hindringer gjør at dette ikke er gjennomførbart i hvete. MLO-hvete kan derfor være aktuell for godkjenning på nivå 1 selv om allelet er nytt i arten. Dette vil antagelig være i tråd med EFSAs beskrivelse av hva som anses å ha HoSU/familiaritet: «[…]the gene/allele and the associated trait has a history of consumption as food and feed and/or familiarity for the environment». For andre, mindre beslektede plantearter kan det imidlertid være at kunnskapen om MLO-mutasjoner fra byggsorter og andre konvensjonelle melduggresistente planter er mindre overførbar med tanke på risikoprofil.
Et tredje eksempel kan være cisgene organismer der det er tilført et gen fra en kryssbar slektning og er en variant av et gen som finnes i organismen fra før (et homologt gen). Dette kan for eksempel være mais som har fått tilført et gen fra sin slektning teosinte for å kompensere for et ødelagt gen i maisen. Dette er, som beskrevet i kapittel 7.4, et eksempel på bruk av genteknologi for å gjeninnføre nyttige egenskaper som har gått tapt gjennom foredling, i dette tilfellet økt proteininnhold og nitrogeneffektivitet. Det samme vil gjelde eksempelvis tørråteresistens-gener fra én potetsort til en annen.
Et fjerde eksempel er genredigert steril laks med målrettet mutasjon i dnd-genet, som beskrevet i kapittel 7.3.5. Siden det er en målrettet mutasjon der funksjonen til allelet er godt kjent (kriterium 6) og man har nok informasjon til å oppfylle krav om miljøeffekt «familiaritet» (steril fisk uten spredningsevne) og det foreligger analyser av fiskens helse og velferd, kan det være mulig å saksbehandle også denne genetisk sterile laksen på nivå 1, selv om den ikke har HoSU.
For mikroorganismer til utsetting er generelt både kunnskapsgrunnlaget mindre og usikkerheten større enn for mange planter og dyr, og få produkter vil derfor i praksis havne på reguleringsnivå 1 på kort sikt. Det finnes imidlertid noen eksempler på mikroorganismer som kunne vært aktuelle allerede nå. Melkesyrebakterier (Lactobacillus) er en svært mangfoldig gruppe med mye genetisk variasjon, og generelt ansett som trygge (GRAS; Generally Recognized As Safe) og har vært brukt trygt i matproduksjon i over hundre år. Genredigering av slike arter for å flytte genvarianter/egenskaper mellom stammer vil kunne oppfylle krav til godkjenning etter saksbehandling på nivå 1.
Hvilke produkter og produktkategorier som havner på nivå 1 vil utvikle seg i takt med et økende kunnskapsgrunnlag. Det er også mulig å se for seg at man på sikt opparbeider så mye kunnskap og erfaring med organismer og produkter på dette nivået, at det kan være mulig å innføre et meldesystem i stedet for det foreslåtte sterkt forenklede godkjenningsløpet. Det finnes allerede en slik hjemmel i genteknologiloven § 10 femte ledd, og det er også hjemmelsgrunnlag i matloven for dette.
Oppsummert for reguleringsnivå 1:
Produkter omfattet av reguleringsnivå 1 er minst like trygge og etisk forsvarlige som sammenlignbare produkter.
Ingen krav om dokumentasjon fra forsøksutsetting i søknad om godkjenning.
Forutsigbar prosess der søker har ansvaret for at organismen/produktet oppfyller kravene til samsvarsvurdering (kan dokumentere at produktet ikke er tilført DNA som ikke allerede finnes i artens genpool i steg A) samt svare ja på steg B) og C) i beslutningtreet som vist i figur 10.3), og sannsynliggjøre at produktet er etisk forsvarlig.
Brukervennlige veiledere sikrer at søker vet hva som kreves for å oppfylle kravet om et sterkt forenklet godkjenningsløp. Myndigheten har også plikt til å veilede søkere som tar kontakt, jf. forvaltningsloven § 11.
Det foretas ingen helse- eller miljørisikovurdering.
Ingen spesifikke sporbarhets- og merkekrav er nødvendig.
Generelle sporbarhetskrav gjelder hvis det er mat og fôr.
Ingen krav til analytisk deteksjon.
Ved godkjenning av planter til dyrking er ingen spesielle sameksistenskrav nødvendig.
Ingen høring. Myndighetene tilgjengeliggjør en oversikt over meldte produkter.
Ingen patentrett.
10.2.2.6.2 Godkjenningsløp på nivå 2 – PB med forenklet risikovurdering
Gjelder for produkter som faller innenfor definisjonen av PB, som har den tiltenkte genetiske endringen og ikke har risikable utilsiktede endringer, men som har en mer uforutsigbar risikoprofil fordi egenskapen ikke er godt kjent fra før (ikke kjent HoSU, familiaritet eller god kjennskap til det nye allelets struktur og funksjon).
For PB-produkter som ikke oppfyller krav om HoSU/familiaritet og der tilstrekkelig kjennskap til allelets struktur og funksjon og disses betydning for risikoprofil mangler, mener utvalgsmedlemmene at det skal gjøres en forenklet helse- og miljørisikovurdering. Dette begrunnes med at risikospennet knyttet til produkter på dette nivået ikke skiller seg fra risikospennet for konvensjonelle produkter med lignende genetiske endringer. Men fordi risiko i stor grad henger sammen med egenskap og ikke type genetisk endring, kan det være rimelig å kreve noe dokumentasjon for å sikre at produktet er trygt. Produkter på dette nivået vil derfor kunne sies å være bedre dokumentert trygge enn konvensjonelle produkter med nye egenskaper som ikke risikovurderes på samme måte.
For å komme til dette saksbehandlingsnivået skal det foreligge god dokumentasjon knyttet til on-target og off-target effekter, og det skal ikke være identifisert noen risiko på grunnlag av denne dokumentasjonen. Søker kan på dette nivået imidlertid ikke svare ut kriteriene 5 og 6 adekvat, dvs. at det ikke på bakgrunn av eksisterende kunnskap kan sannsynliggjøres at genvarianten og egenskapen den gir har lav risiko. VKM utfører en forenklet helse- og miljørisikovurdering av organismene og produktene på oppdrag fra henholdsvis Mattilsynet (mat og fôr) og Miljødirektoratet (produkter til andre formål). Med forenklet menes det også at kravene i vurderingen er tilpasset PB-organismers egenskaper og typen genetiske forandringer.
Det gjøres videre en vurdering av etisk forsvarlighet før godkjenning. Søker bes på nivå 2, som på de andre nivåene, om å besvare fire spørsmål om verdiene nytte, åpenhet, bærekraft og rettferdig fordeling. Til forskjell fra nivå 1 der dokumentasjonen sjekkes av saksansvarlig etat, foreslås det at denne vurderingen på nivå 2 gjøres av en egnet (ikke-politisk) fagkomité etter samme modell som REK på medisin-området (drøftes i kap. 10.2.3.3.). Dette fordi egenskapen som introduseres ikke er kjent fra sammenlignbare produkter/organismer fra før og kan medføre ukjente utfordringer.
Dokumentasjonen på nivå 2 bør i tillegg til det som kreves på nivå 1, fokusere på en enkel karakterisering av den nye egenskapen.
Forslag til type dokumentasjon:
Dokumentasjon på de tilsiktede genetiske endringene (sekvensdata o.l.).
Dokumentasjon på fravær av utilsiktede mutasjoner i homologe regioner av genomet (over forventet bakgrunnsnivå), fravær av vektor-integrasjon o.l.
Dokumentasjon om fenotypen gitt av den genetiske endringen, fra små feltforsøk eller lignende. For mikroorganismer – tilleggsdokumentasjon som beskriver fitness i et økosystem og forekomst av horisontal genoverføring (horisontal gene transfer; HGT) i simulert naturlig miljø.
Beskrivelse av etisk forsvarlighet i henhold til fire kriterier. For dyr skal velferd dokumenteres gjennom relevante deler av livssyklus.
Vilkår for markedstilgang etter godkjenning for produkter på nivå 2
Flertallet mener at alle PB-produkter, dvs. alle produkter som godkjennes på nivå 1 og 2 bør likestilles med konvensjonelle produkter når de kommer på markedet. Produkter godkjent på nivå 2 vil derfor ikke ha særskilte krav til merking, sporbarhet, sameksistens, overvåkning eller immaterielle rettigheter (som illustrert i figur 10.3 over). Dette drøftes og begrunnes i større utdypning i ulike delkapitler senere i dette kapittelet.
Eksempler på produkter/organismer som egner seg for nivå 2
Et eksempel som kan passe på nivå 2, er genredigerte griser med en målrettet mutasjon som gir resistens mot sykdommen Porcine Preproductive and Respiratory Syndrome (PRRS). Genvarianten/egenskapen er ikke kjent fra noen art tidligere og bør derfor undersøkes i en forenklet vurdering for å utelukke negative effekter, særlig knyttet til dyrevelferd.
Et annet eksempel kan være å introdusere homologe gener fra stillehavslaks (Oncorhynchus spp.) til atlanterhavslaks (Salmo salar) for å øke resistens mot lakselus. Disse er klassifisert som ulike arter, men er nært beslektet og deler mange av de samme genene. En forenklet vurdering på nivå 2 kan derfor være hensiktsmessig.
Et planteeksempel kan være genredigerte sterile hageplanter, som er under utvikling av det norske selskapet Eliteplanter sammen med NIBIO23. Selv om en slik endring i utgangspunktet vil gjøre plantene tryggere for bruk enn de konvensjonelle variantene fordi det reduserer risikoen for at de sprer seg, kan det likevel være hensiktsmessig å vurdere dem på nivå 2 med en forenklet risikovurdering fordi egenskapen ikke er godt kjent fra andre planter til samme formål og fordi selve planteartene er fremmedarter i Norge.
Innen mikroorganismer kan et aktuelt eksempel på nivå 2 være genredigerte jordbakterier som fikserer nitrogen for ulike nyttevekster som mais og hvete (omtalt i kap 7.4). Både genetikken og egenskapen er kjent fra andre jordbakterier som naturlig fikserer nitrogen for belgvekster, og det genredigerte produktet er allerede i relativt utstrakt bruk i USA. Imidlertid er kunnskapen om mikroorganismer og deres samspill med miljøet generelt mer usikker enn for vanlige matplanter og husdyr, og det kan derfor foreløpig være riktig å vurdere dem på nivå 2 fremfor nivå 1.
Det kan videre være aktuelt å plassere på nivå 2 alle organismer/produkter med såkalte intragener, som er gener sammensatt av ulike genetiske elementer som finnes i arten fra før, men ikke i den spesifikke kombinasjonen. Det kan typisk være et gen med en ny promotor («volumknapp») som fører til et høyere genuttrykk enn normalt. EFSA har tidligere konkludert med at det for organismer med intragener kan oppstå nye risikomomenter sammenlignet med konvensjonelle organismer.
Oppsummert for saksbehandlingsnivå 2:
Produkter som er godkjent på nivå 2 er minst like trygge for helse og miljø og etisk forsvarlige som konvensjonelle produkter med nye egenskaper.
Krav til søknad for at den skal behandles på nivå 2 er at organismen er en PB hvor det ikke er identifisert noen risiko på grunnlag av egnet dokumentasjon til å vurdere on-target og off-target effekter av endringen, men som ikke oppfyller krav om HoSU/familiaritet eller at allelets struktur og funksjon er godt kjent.
Brukervennlige veiledere sikrer at søker vet hva som kreves for å oppfylle kravet om forenklet søknad. Myndigheten har også plikt til å veilede søkere som tar kontakt, jf. forvaltningsloven § 11.
Det foretas en forenklet helse- og miljørisikovurdering av VKM.
Det foretas en vurdering av etisk forsvarlighet av egnet fagkomite.
For PB på nivå 2 pålegges ikke krav om merking eller sporing via analytisk metode.
Ved godkjenning av planter til dyrking, er ingen spesielle sameksistenskrav nødvendig.
Ingen høring. Myndighetene tilgjengeliggjør en oversikt over godkjente produkter.
Ingen patentrett.
10.2.2.6.3 Godkjenningsløp på nivå 3 – GMO med forenklet risikovurdering
Gjelder GMO-produkter som tilfredsstiller både krav om kjent HoSU og familiaritet og der det nye allelets struktur og funksjon er kjent.
Også transgene GMO eller produkter fra slike kan ha en historie med trygg bruk og utsetting i miljøet. Noen GMO-er har vært i bruk i flere tiår, uten påviste negative effekter. Slik kunnskap kan inngå i et dokumentasjonsgrunnlag for historie med sikker bruk og utsetting til miljøet. Dersom kunnskapen er overførbar til nye GMO-er kan de ha en mer forutsigbar risikoprofil og etisk forsvarlighet enn GMO-er med nye egenskaper. Kan søker dokumentere HoSU/familiaritet samt god kjennskap til allelets struktur og funksjon, kan en GMO få forenklet vurdering på et reguleringsnivå 3 der kravene tilpasses GMO. Dette forutsetter at innholdet i kriteriene HoSU/familiaritet (for eksempel hvor lenge en GMO skal ha vært i bruk) defineres for GMO.
VKM utfører en forenklet helse- og miljørisikovurdering av organismene og produktene på oppdrag fra hhv. Mattilsynet (mat og fôr-produkter) og Miljødirektoratet (produkter til andre formål).
Vurdering av etisk forsvarlighet vurderes på bakgrunn av søkers besvarelse på fire spørsmål om verdiene nytte, åpenhet, bærekraft og rettferdig fordeling. Selv om egenskapene til produktet kan være kjent fra tidligere godkjente GMO-er, mener flertallet at GMO-er er vesentlig forskjellige fra konvensjonelle produkter og derfor bør vurderes av en (ikke-politisk) fagkomité etter samme modell som REK på medisinområdet (drøftes nærmere i kap. 10.2.3.3).
Forslag til type dokumentasjon:
Dokumentasjon på tilsiktede genetiske endringene (sekvensdata o.l.).
Dokumentasjon på fravær av vesentlige utilsiktede genetiske endringer (for eksempel at et gen har blitt forstyrret ved integrasjon).
Dokumentasjon om fenotypen gitt av den genetiske endringen, fra små feltforsøk eller lignende.
Beskrivelse av allel.
Der relevant: resultater fra små forsøksutsettinger som bekrefter forventet fenotype samt henvisning til faglitteratur som dokumenterer HoSU/familiaritet. For mikroorganismer – tilleggsdokumentasjon som beskriver fitness i et økosystem og forekomst av horisontal genoverføring (horisontal gene transfer; HGT) i simulert naturlig miljø.
Beskrivelse av etisk forsvarlighet etter fire kriterier. For dyr skal velferd dokumenteres gjennom relevante deler av livssyklus.
For å tilfredsstille krav til saksbehandling på nivå 3 skal det altså foreligge god dokumentasjon knyttet til on-target og off-target effekter, og det skal ikke være identifisert noen risiko på grunnlag av denne dokumentasjonen. Den forenklede vurderingen skal gjelde for GMO-er med gener/egenskaper som er kjente fra andre godkjente GMO-produkter, altså der det er en historie med trygg bruk og hvor genet og dets funksjon er kjent, eller som er kjente fra organismer som formelt er definert som en annen art. Fordi slike gener ikke finnes i arten fra før (og ikke kan overføres uten genteknologi), og fordi det fremdeles er begrenset erfaring med denne typen produkter, skal det gjøres en risikovurdering før en eventuell godkjenning kan gis, men det kan da være tilstrekkelig med en forenklet vurdering. Dersom denne vurderingen fører til at det identifiseres en risiko skal produktet behandles på saksbehandlingsnivå 4. Det samme gjelder hvis den forenklede etikkvurderingen avdekker mulighet for at produktet er etisk uforsvarlig.
Vilkår for markedstilgang etter godkjenning for produkter på nivå 3
Flertallet mener at GMO representerer noe vesentlig nytt sammenlignet med konvensjonelle produkter, og bør derfor ha særskilte krav for markedstilgang. Flertallet legger til grunn at dagens krav til merking, deteksjon, sporbarhet, sameksistens og immaterielle rettigheter videreføres for GMO. Dette innebærer blant annet at GMO-spesifikke sporbarhets- og merkekrav gjelder, i tillegg til at en spesifikk analytisk påvisningsmetode må følge søknaden. Det samme gjelder krav om overvåkingsplan som skal gjelde alle GMO uavhengig av reguleringsnivå. Det kreves også at risikovurderingen sendes på offentlig høring før endelig beslutningsvedtak kan gis.
Eksempler på organismer/produkter som egner seg for nivå 3
Et eksempel på et slikt produkt kan være en såkalt stack – en transgen organisme som har fått tilført en kombinasjon av flere gener som tidligere har vært godkjent enkeltvis i samme art (se kap. 4). Det finnes allerede mye informasjon fra tidligere risikovurderinger av de enkelte genene/produktene som vil være overførbar. Det kan imidlertid være hensiktsmessig å utføre en forenklet vurdering av genene i kombinasjon for å utelukke at det oppstår synergier som ikke kunne forutses. Dette praktiseres allerede, når EFSA risikovurderer stacked events som er hybrider mellom allerede risikovurderte og godkjente GMO-er (se kap. 8).
Et annet eksempel kan være produkter laget fra GMO, men der det ikke er noen rester igjen fra genmodifiseringen. Det kan eksempelvis være omega-3-beriket planteolje til bruk i fiskefôr, der oljen verken inneholder DNA eller proteiner. Slike ikke-formeringsdyktige produkter har forutsigbar lav risiko for miljøet, og vil ha HoSU dersom alle komponentene har vært konsumert trygt over tid (se f.eks. VKMs risikovurdering av genmodifisert rapsolje24).
På dette nivået kan potensielt også vurderes GMO-er som har fått satt inn gener/egenskaper som i seg selv har HoSU og familiaritet innenfor det tiltenkte bruksområdet. Det kan for eksempel være et gen fra én vanlig matplante overført til en annen vanlig matplante, slik som et helsebringende antioksidant-gen fra blåbær satt inn i tomat (i skrivende stund omsøkt og forventet snarlig godkjent i USA)25.
Oppsummert for saksbehandlingsnivå 3:
Produkter godkjent etter saksbehandlingsnivå 3 er trygge for helse og miljø, og er etisk forsvarlige.
Krav til søknad for at den skal behandles på saksbehandlingsnivå 3 er at organismen er en GMO som både oppfyller krav om kjent HoSU/familiaritet og har godt karakterisert genfunksjon.
Brukervennlige veiledere sikrer at søker vet hva som kreves for å oppfylle kravet om forenklet søknad. Myndigheten har også plikt til å veilede søkere som tar kontakt, jf. forvaltningsloven § 11.
Det foretas en forenklet helse- og miljørisikovurdering av VKM.
Det foretas vurdering av etisk forsvarlighet av egnet fagkomite.
Spesifikke sporbarhets- og merkekrav gjelder for alle GMO.
Godkjenning av planter for dyrking, gis under forutsetning av at dyrkingen skal skje i henhold til fastsatte regler (sameksistensregler.)
Overvåkingsplan/PMM.
Høring påkrevd. Myndighetene tilgjengeliggjør en oversikt over søkte produkter.
Patentrett i henhold til de enhver tid gjeldende patentregler.
10.2.2.6.4 Godkjenningsløp på nivå 4 – GMO med full risikovurdering
Godkjenning av GMO-produkter som ikke tilfredsstiller både krav om HoSU og familiaritet og at det nye allelets struktur og funksjon er kjent, eller som av andre grunner ikke kvalifiserer for behandling på lavere nivå. Gjelder for produkter som faller innenfor definisjonen av GMO, hvor det er usikkerhet om risiko og/eller det foreligger usikkerhet om hvorvidt produktet er etisk forsvarlig.
Flertallet mener i prinsippet at flere tiårs erfaring med risikovurderinger av GMO – som ikke har avdekket vesentlig risiko – tilsier at kravene også på nivå 4 bør reduseres. Det er imidlertid foreløpig lite politisk handlingsrom for et slikt grep, særlig i lys av at pågående prosesser med regelverksendringer i EU kun dreier seg om organismer og produkter fremstilt med nye teknikker (målrettet mutagenese og cisgener). Derfor legger utvalgsflertallet til grunn at godkjenningsløpet på nivå 4 i hovedsak ligner på dagens godkjenning av GMO-er. Ett viktig grep flertallet likevel foreslår, av dyreetiske hensyn, er å redusere bruken av forsøksdyr og fôringsforsøk til et minimum, slik at dette kun kreves der det er en plausibel mistanke om helserisiko ved konsum (utdypes i kap. 10.2.3.3). Foruten dette legges det på nivå 4 opp til en full helse- og miljørisikovurdering. Dette medfører vesentlig større krav til omfanget av dokumentasjon som skal følge søknaden enn på de andre nivåene. Krav til dokumentasjon er beskrevet i detalj i kapittel 8, og gjennomgås ikke på nytt her.
Det skal også gjøres en vurdering av etisk forsvarlighet etter de fire foreslåtte kriteriene nytte, bærekraft, rettferdig fordeling og åpenhet før godkjenning kan gis. Også på dette nivået, i likhet med nivå 2 og 3, bør en slik vurdering gjøres av en (ikke-politisk) fagkomité etter samme modell som REK på medisinområdet. Det kreves også høring før godkjenning kan gis. Også her kan vesentlig positivt bidrag til bærekraft eller samfunnsnytte for øvrig tilsi en hurtigprosedyre eller andre positive virkemidler.
Reguleringsnivå 4 er i utgangspunktet tiltenkt GMO-er med nye egenskaper. Til denne kategorien hører blant annet transgener, som kan oppnås med ulike eksisterende metoder som SDN-3, homolog rekombinasjon o.l. samt andre mulige fremtidige metoder, som ikke har historie med trygg bruk til det aktuelle formålet og heller ikke tilstrekkelig forutsigbar risikoprofil basert på kjennskap til genets struktur og funksjon.
Invagener og novogener (som gendrivere og syntetiske gensekvenser) saksbehandles enten på dette nivået eller på et enda høyere saksbehandlingsnivå. Flertallet har ikke hatt tilstrekkelig kunnskapsgrunnlag for, og tid til, å gå tilstrekkelig dypt inn i spørsmålet om hvordan slike produkttyper bør reguleres. De vurderes heller ikke som særlig aktuelle for utsetting på kort sikt. Utvalgsflertallet mener imidlertid at enkelte av disse produkttypene har potensielt høy risiko, større usikkerhet og reiser særskilte etikkspørsmål, og anbefaler at dette spørsmålet utredes separat.
Produkter som skal vurderes på saksbehandlingsnivå 4 omfatter alle GMO-produkter som ikke kvalifiserer for behandling på lavere nivåer, inkludert produkter som i utgangspunktet ble vurdert på nivå 3, men der det underveis i vurderingen av dokumentasjonen ble avdekket at produktet måtte flyttes til nivå 4.
På siste trinn i saksbehandlingen gjøres en totalvurdering der eventuell risiko og/eller etiske ulemper vurderes opp mot produktets nytteverdi. Taler kunnskapen for at den samlede nytten er større enn risikoen og ulempene forøvrig, godkjennes produktet som GMO. Desto større nytten er, jo mer risiko eller usikkerhet om risiko kan man akseptere. Dette er sammenlignbart med covid-vaksiner, som gjennom rolling review ble tillatt tidlig i pandemien tross en ikke-neglisjerbar risiko for bivirkninger samt manglende kunnskap om langtidseffekter, fordi den samfunnsmessige gevinsten langt overgikk ulempene. Jo større fordeler et produkt har for samfunnet, desto tyngre bør de veie i en vurdering. Særlig bør dette gjelde spørsmål om bærekraft, som også trekkes frem som et viktig hensyn i EU-kommisjonens arbeid med nytt regelverk for genredigerte planter.
Dersom risiko eller andre ulemper overstiger nytten, nedlegges forbud.
Vilkår for markedstilgang etter godkjenning for produkter på nivå 4
På nivå 4 gjelder samme særskilte vilkår for markedstilgang som på nivå 3, det vil si for alle GMO-er, i tråd med dagens krav til merking, deteksjon, sporbarhet, sameksistens og immaterielle rettigheter. Dette innebærer blant annet at GMO-spesifikke sporbarhets- og merkekrav gjelder, i tillegg til at en spesifikk analytisk påvisningsmetode må følge søknaden. Det samme gjelder krav om overvåkingsplan som skal gjelde alle GMO uavhengig av reguleringsnivå. Det kreves også at risikovurderingen sendes på offentlig høring før endelig beslutningsvedtak kan gis.
Oppsummert for reguleringsnivå 4:
Produkter godkjent etter behandling på saksbehandingsnivå 4 er trygge for helse og miljø, og er etisk forsvarlige.
Kriteriet for behandling søknad på nivå 4 er GMO med ny egenskap eller at organismen ikke oppfyller krav til behandling på lavere nivå.
Brukervennlige veiledere sikrer at søker vet hva som kreves for å oppfylle kravet om søknad om godkjenning. Myndigheten har også plikt til å veilede søkere som tar kontakt, jf. forvaltningsloven § 11.
Det foretas en helse- og miljørisikovurdering av VKM.
Det foretas vurdering av etisk forsvarlighet av egnet ekspertkomite.
Spesifikke krav om sporbarhet og merking gjelder for alle GMO.
Krav til analytisk deteksjon (spesifikk, validert metode og referansemateriale som i dagens krav).
Godkjenning av planter for dyrking, gis under forutsetning av at dyrkingen skal skje i henhold til fastsatte regler (sameksistensregler).
Overvåkingsplan/PMM.
Høring påkrevd.
Patentrett i henhold til de enhver tid gjeldende patentregler.
10.2.2.6.5 Forhold som er felles for alle nivåer
For å sikre at virksomhetene forstår kravene for de ulike godkjenningsløpene, er det viktig at det lages brukervennlige og brukertestede veiledere.
Flertallet mener det på alle nivåer er tilstrekkelig at organismer og produkter på alle nivåer ikke er etisk uforsvarlige, altså at de scorer nøytralt eller ikke-negativt sammenlignet med eksisterende produkter. Det behøver med andre ord ikke være et eksplisitt positivt bidrag. På den måten forbeholdes bruk av forbud til reelt problematiske produkter, og stimulerer til mer konkurranse fordi like gode produkter kan være i samme marked. Der søker kan dokumentere at produkter har et vesentlig positivt bidrag til bærekraft eller annen samfunnsnytte, og kan dekke et stort behov, kan det benyttes andre virkemidler for å stimulere utvikling og markedstilgang. For eksempel kan søknaden gå inn i en hurtigprosedyre (se kap. 10.2.3.10), med garanti om rask saksbehandlingstid, eller de kan være aktuelle for andre positive virkemidler (se kap. 10.2.3.16).
Prinsipielt mener flertallet at varigheten for tillatelse for PB-produkter etter godkjenning bør være så lang som mulig, for å oppnå målet om likestilling med konvensjonelle produkter. Av hensyn til internasjonal harmonisering mener flertallet imidlertid at varighet for tillatelse for ulike produktkategorier bør harmoniseres med varigheten for tillatelse etter EUs regelverk. Per i dag tilsier reglene at vedtaket er gyldig i 10 år, og med mulighet for forlengelse ved søknad om re-godkjenning etter 9 år.
10.2.2.6.6 Eksempel på effekter av nivådelingen for nasjonal bioproduksjon
En av de største konsekvensene av veivalg om reguleringssystem vil være kostnader for utviklere av nye produkter. Det vil være konsekvenser både for selve utviklingsarbeidet, samt i godkjenningsprosessen. Her beskrives utfallsscenarioer for utvikling av nye plantesorter for norske forhold, som det delvis statlig eide planteforedlingsselskapet Graminor har ansvaret for. Tallene er vanskelige å beregne presist og vil endres over tid, men gjenspeiler et antatt kostnadsnivå i 2023 når denne NOU-en publiseres.
Tilgang til genredigeringsteknikker vil effektivisere selve avls- og foredlingsarbeidet. Selv om det er vanskelig å estimere presist hva det normalt koster å utvikle en sort (avhenger av veksttypen og antallet sorter i et gitt år) er et anslag basert på tidligere kostnader at det ligger på rundt 2-5 millioner kroner. Med CRISPR vil kostnadene minst kunne halvveres, fordi utviklingstiden reduseres betraktelig. Det tar som regel 10-20 år eller mer å utvikle en ny sort med konvensjonell kryssing. Eksempelvis tok det over 45 år å utvikle tørråte-resistente potetsorter med konvensjonell innkryssing (Bionica og Toluca, introgresjon av ett resistens-gen Rpi, se mer info i del Mar Martínez-Prada 2021, Ghislain & Douches 2020).
Med genredigering vil tilsvarende introgresjon av et resistensgen kunne ta rundt 2-3 år dersom man har identifisert de genetiske målsekvensene. Skal flere resistensgener fra ulike potetsorter eller målrettede mutasjoner introduseres samtidig, noe som kan gi mer varig resistens, vil tidsforskjellen øke enda mer. Graminor har uttalt til genteknologiutvalget at dersom genredigerte/PB-sorter skal klassifiseres som GMO, er det ikke aktuelt for dem å ta genredigering i bruk for å utvikle produkter for markedet. Det vil være utfallet av en videreføring av dagens regulering eller mindretallsmodellen. Da må Graminor belage seg på konvensjonelle teknikker i utvikling av nye sorter, eksempelvis tørråte-resistent potet, når det dukker opp nye stammer med tørråte. Med flertallsmodellen sidestilles PB med konvensjonelle produkter i stor grad, og det vil være mulig for Graminor å benytte genredigeringsteknologi.
Kostnader knyttet til feltforsøk av sortene vil også bli ulike i de to veivalgene. Dersom en PB-sort klassifiseres som GMO, som den gjør i dagens system, vil feltforsøkene måtte gjøres under særskilte krav (sikkerhetstiltak m.m.) som innebærer vesentlig økte kostnader. En case som er beskrevet i denne NOU-en, er muligheten til å overføre en genvariant for korte strå og økt stråstyrke i hvetesorten Mirakel. Genvarianten er kjent fra andre hvetesorter. Feltforsøk med genredigert Mirakel-sorter ved klassifisering som GMO vil koste vesentlig mer enn feltforsøk med konvensjonelle, selv om genvarianten og dens effekt er den samme. Det er vanskelig å tallfeste kostnadene presist, da det så langt kun er utført ett feltforsøk med GMO i Norge for flere tiår siden og erfaringene er begrenset. Unntas PB-sorter fra GMO-krav, slik det gjør i denne flertallsmodellen, vil kostnadene bli på linje med kostnadene for konvensjonelle sorter, dvs. noen titusener for et forsøk som går over 2-3 sesonger.
Når det gjelder markedsgodkjenning har Graminor estimert at datapakken som kreves på nivå 1 i flertallsmodellen – PB med historie med trygg bruk / familiaritet – vil koste noen få hundretusener, der brorparten er kostnader for sekvensering for å kartlegge tilsiktede og utilsiktede genetiske endringer. Denne kostnaden vil sannsynligvis reduseres over tid når sekvensering blir billigere. På nivå 2 – PB-sorter med nye egenskaper som kunne ha vært fremskaffet med konvensjonelle metoder – vil det tilkomme ekstra kostnader for feltforsøk på noen titusener kroner. På nivå 1 og 2 vil derfor totale godkjenningskostnader kunne forventes å være under en halv million.
Til sammenligning vil kostnader for en tilsvarende markedsgodkjenning etter dagens regulering eller varianter av denne være i størrelsesordenen minimum titalls millioner, sannsynligvis mer enn 100 millioner. Dette er basert på eksisterende beregninger og erfaringer: En studie har estimert at regulering av genredigerte nyttevekster som GMO vil kreve 9 år og 14 millioner dollar ekstra før produktet kommer på markedet, enn om veksten var regulert som konvensjonell vekst (Lassoued et al. 2019). Bransjeaktører har beregnet at en godkjenning for GMO-produkter til import i EU koster mellom 11-16,7 millioner euro og at saksbehandlingen i snitt tar 6 år (Garcia-Alonso 2022).
10.2.3 Nærmere omtale av de ulike elementene i modellen
10.2.3.1 Innledning
PB-organismer og -produkter vil alltid, så lenge det kan dokumenteres at kriteriene er oppfylt og ingen risiko identifiseres underveis, behandles i reguleringsnivå 1 eller 2. Skillet mellom disse nivåene avhenger av om det foreligger dokumentasjon på HoSU og familiaritet. Dette fordi PB-organismer og -produkter er begrenset til genetiske endringer innenfor artens genpool.
Det må være forvaltningen, på bakgrunn av tilgjengelig dokumentasjon, som bestemmer på hvilket reguleringsnivå et produkt hører hjemme, ikke søker. I tilfeller der nivået er uklart, bør utvikler kunne konsultere myndighetene for å få en foreløpig klassifisering basert på en beskrivelse av relevante parametre, slik landbruksmyndighetene i USA tilbyr. Myndighetene bør også tilgjengeliggjøre en liste over hvilke genvarianter/egenskaper/produkttyper som kvalifiserer for godkjenning på reguleringsnivå 1 etter hvert som man gjør seg erfaringer med dem. En slik oversikt gir mer forutsigbarhet til utviklere.
Modellen vil også fungere for organismer som har fått flere genetiske endringer samtidig (multiplex/stacking). Hvis alle endringene/egenskapene kvalifiserer for nivå 1, kreves ingen risikovurdering. Hvis én eller flere av endringene er på et høyere nivå, vurderes søknaden på nivået som disse endringene tilsier, uavhengig av om enkelte endringer kvalifiserer for nivå 1.
Generelt bør veiledningstekster og krav tilpasses etter hvert som det blir et større mangfold av produkter med ulike egenskaper, for å sikre et mest mulig treffsikkert regelverk som verken over- eller underregulerer ulike produkter.
Etter hvert, når erfaringer og kunnskap tilsier det, bør man også kunne gå over til et meldingssystem for å forenkle prosessene ytterligere, særlig for produkter på nivå 1. Det finnes allerede en slik hjemmel i dagens genteknologilov § 10, femte ledd. Hjemmelen ble benyttet for å kunne gi dispensasjon fra godkjenningskravet etter genteknologiloven for covid-vaksiner, slik at de ble raskt tilgjengeliggjort (såkalt rolling review). Denne åpningen danner videre grunnlaget for utvalgets anbefaling om å innføre melding for utsetting av GMO-legemidler der det er enighet om at risikoen er lav (se kap. 12). Hjemmel for melding finnes også i matloven, og flertallet anbefaler at det på sikt åpnes opp for melding for PB i nivå 1. En melding vil innebære at en virksomhet fyller ut et skjema med informasjon om produktet og sender inn til kompetent myndighet. Skjemaet registreres automatisk, men myndigheten fatter ikke noe vedtak og produktet kan fritt omsettes.
Etter hvert, når erfaringer og kunnskap tilsier det, er det mulig å se for seg at også enkelte GMO-er kan reguleres på samme vilkår som PB nivå 1. Dette forutsetter enighet om hva som skal til for å kunne si at en egenskap/produkttype har tilstrekkelig historie med trygg bruk. En tommelfingerregel bør være om forvaltningen selv mener en risikovurdering (forenklet eller full) ikke vil frembringe ny informasjon som ikke eksisterende kunnskapsgrunnlag svarer ut. Dersom det er lite sannsynlig at en risikovurdering vil gi slik ny informasjon, og den eksisterende kunnskapen tilsier at produktet er trygt (for eksempel dersom det tidligere er godkjent sammenlignbare GMO-er) bør produktet kunne gis godkjenning uten risikovurdering.
For å kunne vurderes på reguleringsnivå 1 eller 2, bør organismen i seg selv ha en historie med trygg bruk til sitt formål, eksempelvis en plante som skal dyrkes og bli til mat og fôr. Er det snakk om en organisme som er ny i slik produksjon, bør det gjøres en mer omfattende risikovurdering.
10.2.3.2 Historie med trygg bruk og kjennskap til miljøeffekter
EFSA har fått i oppdrag fra EU Kommisjonen å produsere en veileder med en beskrivelse av krav til historie av trygt bruk (HoSU) og kjente miljøeffekter (familiaritet) for genredigerte planter. Generelt mener flertallet at dersom søker kan dokumentere at disse to forholdene oppfylles (kriterium 5 i modellen), er det tilstrekkelig med en godkjenning uten risikovurdering. Det som kjennetegner HoSU og familiaritet er, ifølge EFSA, at donororganismen og/eller genet/allelet og den resulterende egenskapen har en historie med å ha blitt konsumert som mat eller fôr og/eller har kjente miljøeffekter (se også kap. 8). Flertallet mener videre at det bør legges vekt på kunnskap om genet/allelets funksjon (kriterium 6 i modellen). Slik kunnskap, dersom den kan forutsi produktets risikoprofil, kan kompensere for manglende HoSU/familiaritet. Hensikten med kriterium 5 og 6 og vektingen av disse, er å plassere produkter med forutsigbar akseptabel risiko basert på overførbar eksisterende kunnskap på det laveste reguleringsnivået. Det må altså være god kjennskap til genforandringens effekt på biologien til organismen, og det må sannsynliggjøres en lav/akseptabel risiko for helse og miljø. Flertallet foreslår at slik kjennskap kan være:
Erfaring med genets funksjon og resulterende fenotype i organismen eller i sammenlignbare organismer som ikke medfører identifisert risiko (HoSU) sammenlignet med en ekvivalent konvensjonell organisme med samme genvariant/egenskap.
Kjennskap til det uttrykte proteinets funksjon i organismen eller i sammenlignbare organismer (HoSU).
For produkter til mat og fôr, kjennskap til effekt på næringsinnhold, toksisitet og allergenisitet, og sammenligning med en ekvivalent konvensjonell organisme med samme genvariant/egenskaper.
Kjennskap til den resulterende fenotypens effekt på et økosystem i sammenligning med en ekvivalent organisme i samme økosystem (familiaritet).
For å utvide begrepet HoSU og familiaritet til å også omfavne dyr og mikroorganismer, mener flertallet at man må følge EU på samme måte som for planter. I hovedsak synes flertallet at det også skal stilles krav om tilleggsdokumentasjon for
velferd hos PB/genmodifisert dyr sammenlignet med et ekvivalent konvensjonelt dyr,
og for mikroorganismer – tilleggsdokumentasjon som beskriver fitness i et økosystem og forekomst av HGT i simulert naturlig miljø (in vitro, ex vivo og/eller mindre feltforsøk) sammenlignet med en konvensjonell mikroorganisme.
Flertallet anbefaler i alle tilfeller å se hen til EFSAs fortolkning og praktisering av HoSU og familiaritet når dette operasjonaliseres.
10.2.3.3 Hvordan vurdere etisk forsvarlighet?
Et samlet utvalg mener det er viktig å legge til rette for at mer bærekraftige og samfunnsnyttige produkter blir tilgjengelige på markedet, og ønsker å bruke etikkvurderinger som en «gasspedal» for å oppnå dette.
Flertallet anser at kravene etter genteknologiloven om å vurdere bærekraft, samfunnsnytte og etikk (BSE) for levende GMO tidligere har blitt brukt som et nektelsesgrunnlag eller som en «brems» ved at kriteriene kun har blitt brukt til å forby produkter. Denne praksisen er viktig å snu. Etikk handler ikke bare om hvilke grunner eller hvilket grunnlag vi har til å forby noe, men like mye om hvilke grunner eller hvilket grunnlag vi har til å tillate noe. Dette perspektivet er en viktig føring i flertallsmodellen.
Dagens praksis med BSE-kriteriene oppleves altfor komplisert, både med tanke på hva søker selv skal vurdere og legge fram av informasjon, og hvordan myndighetene skal vurdere kriteriene. Det er derfor et stort behov for forenkling og faktisk operasjonalisering.
Etter en omfattende prosess, innførte EU i 2015 mulighet for medlemsland til å nekte dyrking av GMO på eget territorium («opt out»-direktivet, se også kap. 10.2.3.8.1)26 med begrunnelse i en ikke-uttømmende liste basert på en lang rekke «BSE» kriterier og flere andre (utover risiko for helse og miljø). Derimot fant man at det ikke var mulig å innføre tilsvarende mulighet for å nekte import av genmodifiserte produkter, da det ville stride mot handelsretten. Dette skillet har vært underkommunisert i den norske debatten om BSE. Flertallet vurderer hvordan skillet mellom et relativt stort handlingsrom for nasjonal bioproduksjon (planter, dyr mm.) og snevrere handlingsrom ved import av produkter skal ivaretas med hensyn til bærekraftsanalyse/BSE-vurderinger, se kapittel 10.2.3.4 om å skille mellom import og nasjonal bioproduksjon mht. etiske vurderinger.
I flertallsmodellen legges det opp til at bærekraft, samfunnsnytte og etikk skal vurderes samlet, der vurdering av etisk forsvarlighet gjøres overordnet og til slutt basert på vurdering av fire sentrale verdier; nytte, åpenhet, bærekraft og rettferdig fordeling. Søker skal besvare fire hovedspørsmål, som er svært forenklet sammenlignet med dagens krav til BSE-vurdering fra søker.
Angående hvilken instans som skal vurdere etisk forsvarlighet mener flertallet at sammensetningen av kompetanse i Bioteknologirådet (heretter rådet) ikke er fullt ut relevant for å gjøre slike vurderinger. Rådet er heller ikke et formelt forvaltningsorgan, og har derfor ikke tilgang til fullstendig dokumentasjon i en søknad. Rådet møtes dessuten ikke ofte nok til å kunne drøfte enkeltsaker innenfor så korte tidsfrister som det legges opp til i foreslått saksbehandling. Rådet bør derfor ikke ha ansvar for behandling av enkeltsøknader – slik de heller ikke i dag har på humanmedisinsk bruk av bioteknologi. Derfor anbefaler flertallet at det opprettes en ikke-politisk egnet rådgivende ekspertkomite til å gjøre vurderinger av etisk forsvarlighet, tilsvarende REK innen medisinsk forskning og Rådet for dyreetikk. Når det gjelder planter, er det en mulighet at eksisterende Plantesortsnemnd oppnevnt av Landbruks- og matdepartementet får et utvidet mandat i å gi råd om bærekraft og samfunnsnytte til Mattilsynet. Plantesortsnemnda er i dag rådgivende organ for Mattilsynet ved vurdering av nye plantesorter for opptak på norsk offisiell sortsliste, og vurderer i den forbindelse om sorten er egnet for dyrking i Norge og i tillegg vurderer de egenskaper av betydning for bærekraft. Når det gjelder dyr, kan Forsøksdyrkomitéen være en mulig kandidat for en tilsvarende rolle.
Flertallet mener at man også skal se hen til arbeidet med å utvikle generelle bærekraftskriterier for alle typer produkter gjennom EUs grønne giv (European Green Deal). Som en del av dette, arbeides det nå i forbindelse med Farm to fork-strategien med å utvikle regler for bærekraftige matsystemer i EU. Målsetningene er svært ambisiøse, samtidig som det er et mål at krav til bærekraft skal være i tråd med internasjonale handelsforpliktelser.
På sikt bør slike generelle bærekraftskriterier inngå i vurderingen av produkter utviklet med genteknologi. Det er rimelig å anta at Kommisjonens arbeid med bærekraftskriterier vil være i tråd med lovforslaget om planter utviklet med målrettet mutagenese, cisgenese og intragenese, og flertallet anbefaler at fremtidig bruk av genteknologilovens BSE-kriterier og myndighetenes vurderinger av norsk tilpasningstekst må være i tråd med det kommende lovforslaget i EU.
Et annet grep for å legge til rette for utvikling av mer bærekraftige produkter, er at det ikke skal gjøres etiske vurderinger for forsøksutsettinger (se videre omtale i kap. 10.2.3.5). Slike etiske vurderinger skal heller gjøres i forbindelse med søknad om omsetning, når resultater fra feltforsøk er tilgjengelige. Viktige forhold som dyrevelferd i forsøkene, ivaretas av blant annet dyrevelferdsloven og regler for forsøksdyr.
Flertallet legger generelt stor vekt på at dyrevelferd skal ivaretas og prioriteres. Vurdering av dyrevelferd er derfor foreslått innbakt i den etiske vurderingen på alle nivåer. Dyrevelferd henger dessuten tett sammen med dyrehelse, og at flertallet forventer at eventuelle ulemper for dyrehelse fanges opp i risikovurderingene, samt under det generelle dyrevelferds- og forsøksdyrregelverket. Positive effekter for dyrevelferd ved bruk av genteknologi, for eksempel reduksjon i praksis med avliving av hannkylling dersom kjønnsbestemmelse kan gjøres før eggene klekkes27, bør tillegges stor vekt i den etiske vurderingen. Slike anvendelser kan være aktuelle for hurtigprosedyre i godkjenningen (for store udekkete behov, se kap. 10.2.3.10) eller andre positive virkemidler (se kap. 10.2.3.16).
Flertallet legger videre stor vekt på bruken av forsøksdyr i risikovurderinger. Vanlig praksis ved godkjenning av GMO er at det skal inkluderes data fra fôringsforsøk på mus/rotter for å utelukke toksisitet eller lignende. I flertallets modell legges det opp til at godkjenning av PB-produkter likestilles med konvensjonelle produkter og derfor ikke krever særskilte fôringsforsøk. Dette vil redusere bruken av forsøksdyr betraktelig sammenlignet med dagens regulering der alle organismer/produkter fremstilt med nye genteknikker klassifiseres som GMO og som regel vil måtte testes i fôringsforsøk som en del av godkjenningen, selv om produktene i praksis er like som konvensjonelle produkter. I tillegg mener flertallet at på nivå 3 og 4 i den foreslåtte modellen, altså produkter som fremdeles skal klassifiseres som GMO, at bruken av forsøksdyr bør reduseres og kun brukes der det er skjellig grunn til å mistenke en helserisiko knyttet til konsum. Det bør minimum foreligge en plausibel og konkret risiko-hypotese som skal adresseres, for at bruk av forsøksdyr kan aksepteres. Dette begrunner flertallet med at erfaringene så langt, etter flere tiår med risikovurdering av GMO, ikke har avdekket sannsynlig helserisiko.
10.2.3.4 Å skille mellom import og nasjonal bioproduksjon med hensyn til etiske vurderinger
Flertallsmodellen er konseptuelt relevant også for risikovurdering av produkter som skal godkjennes til import. Når det gjelder vurderinger av etiske forhold, må modellen imidlertid skille mellom import og nasjonal bioproduksjon, fordi det juridiske handlingsrommet er betydelig snevrere i det første tilfellet.
Internasjonale handelsavtaler gir til en viss grad adgang til å begrense import av produkter basert på andre hensyn enn helse- og miljø. Slike andre legitime hensyn kan blant annet være at produktet strider mot offentlig moral28. Listen ligger antagelig nokså høyt for å legitimere en slik beslutning, se utdypning i kapitlene 5.4.3. og 5.4.4. Av denne grunn har EU valgt å skille mellom dyrking (nasjonal bioproduksjon) og import i sin GMO-regulering, der etiske forhold i praksis kun kan brukes til å forby produkter i det første tilfellet. I Norge har vi ikke dette skillet, selv om vi langt på vei har tilsvarende internasjonale forpliktelser som EU. Det har ført til uklarhet om handlingsrom og en praksis som innebærer en prosessrisiko for den norske stat.
Norge har tidligere forbudt en GMO-mais (1507) til import på bakgrunn av etiske forhold, selv om den faglige vurderingen fra VKM og Miljødirektoratet konkluderte med at det verken var risiki eller etiske forhold som forsvarte et forbud. Flertallet mener at det i Norge, som et lite land med en svært åpen økonomi, ikke er i nasjonens interesse å svekke det multilaterale systemet gjennom en forvaltningspraksis som utfordrer og som ikke finnes i resten av verdens land på GMO-området eller andre tilstøtende områder. I Stortingsmeldingen om Norges rolle og interesser i multilateralt samarbeid står: «Å forhindre svekkelse av internasjonal rettsorden og multilaterale styringssystemer er derfor Norges fremste utenrikspolitiske interesse»29. Flertallet vurderer at tidligere praksis for bruk av etisk argument for forbud, som eksemplifisert ved mais 1507, er for streng. Norge importerer en rekke konvensjonelle produkter som sprøytes med det samme sprøytemiddelet som mais 1507 er resistent mot, uten at Norge forbyr import av disse på etisk grunnlag. Hadde det vært en legitim etisk innvending mot en slik dyrkingspraksis, ville det etter WTO vært handlingsrom til å forby ethvert slikt produkt uavhengig av om det omfattes av genteknologiloven eller ikke. At Norge ikke forbyr konvensjonelle produkter som sprøytes med det samme sprøytemiddelet som mais 1507 er resistent mot, tyder på at forbud ikke er nødvendig for å beskytte den offentlige moral. En tilleggsfaktor er at genet som gir den aktuelle sprøytemiddelresistensen i mais 1507 var brukt som en markør i utviklingen og ikke er en del av det omsøkte bruksområdet i EU30.
Utvalgsflertallet mener det er behov for å etablere et tydelig skille mellom nasjonal bioproduksjon og import i den norske reguleringen og i forvaltningspraksisen når det gjelder etiske vurderinger, slik EU har. Dette vil klargjøre at det er et vesentlig ulikt handlingsrom for de to formålene og bidra til en endret politikk.
Vurderinger av etisk forsvarlighet bør imidlertid gjøres i alle tilfeller, både ifm. godkjenning av produkter til både nasjonal bioproduksjon og import, selv om innholdet i og vektleggingen av dem i de politiske beslutningene bør skilles tydelig. For produkter til import må de etiske innvendingene være vesentlige for at de skal kunne brukes til å nedlegge et forbud. Dette vil særlig kunne dreie seg om vesentlige problemer knyttet til dyrevelferd, slik tidligere saker behandlet i WTO-domstolen har vektlagt. Disse utvalgsmedlemmene anbefaler derfor at vurderinger og tilhørende praktisering av vedtak knyttet til etisk forsvarlighet ved godkjenning av GMO og PB-produkter etter flertallsmodellen tilpasses de to ulike formålene. Kun produkter med åpenbare moralsk problematiske sider bør forbys på etisk grunnlag, og et slikt forbud må kunne stå seg også om det skulle vært snakk om konvensjonelle produkter med like egenskaper. At det er benyttet genteknologi ved produksjon av produktet er ikke i seg selv en relevant etisk innvending. Flertallet legger spesielt stor vekt på dyrevelferd som etisk skranke både for importprodukter og for husdyr som inngår i nasjonal bioproduksjon. Handlingsrommet til å forby produkter som ikke møter strenge dyrevelferdsstandarder, uansett om de fremstilt med genteknologi eller ikke, må benyttes.
Flertallet anbefaler at det gis et oppdrag til Utenriksdepartementet om å utrede tidligere praksis samt det faktiske handlingsrommet knyttet til forbud på importvarer begrunnet i etiske hensyn opp mot internasjonal folkerett, når lovforslag skal skrives.
10.2.3.5 Forsøksutsetting
Flertallsmodellen beskriver veien til godkjenning av eller forbud mot utsetting og omsetning av genredigerte og genmodifiserte organismer og produkter til nasjonal bioproduksjon. Hovedprinsippene i modellen er også anvendbare for godkjenning av forsøksutsetting (syn. feltforsøk), men med noen tilpasninger som beskrives her.
De fleste stadier i forskning og utvikling vil foregå under innesluttet bruk, og organismer som benyttes i utviklingsstadier inne på laboratoriet eller i andre innesluttede fasiliteter, vil ikke omfattes av denne reguleringsmodellen. Det er først når det er ønskelig å gjøre forskning på organismer utenfor et lukket miljø, at forskningsaktiviteten vil defineres som en form for utsetting. Dette kalles utsetting i forsøksøyemed i genteknologiloven og gjelder kun for levende organismer.
All forsøksutsetting av GMO krever i dag godkjenning, og krav til hva søknaden skal inneholde finnes i konsekvensutredningsforskriften etter genteknologiloven (heretter kalt KU-forskriften).
Flertallet ønsker å forenkle søknadsprosessen for forsøksutsetting. For reguleringsnivå 1 foreslår flertallet at kravet til godkjenning av forsøksutsetting utgår (kun melding), mens differensierte risikoproposjonale godkjenningskrav skal gjelde for reguleringsnivå 2, 3 og 4. Krav til dokumentasjon for godkjenning av forsøksutsetting på disse nivåene må baseres på data innhentet fra innesluttede forsøk, siden forsøksutsetting vil være første gang organismen skal ut i miljøet. Slik skiller modellen for forsøksutsetting seg fra produkter til kommersielle formål, der det i sistnevnte tilfelle på nivå 2-4 vil kreves dokumentasjon fra forsøksutsetting av varierende omfang på de ulike nivåene.
Et samlet utvalg (gjelder for både flertallsmodellen og mindretallsmodellen) anbefaler at krav om etisk vurdering unntas ved behandling av søknader om forsøksutsetting. På dette stadiet er det ikke nødvendigvis generert slike data, og selve poenget med en forsøksutsetting er å samle data og opparbeide dokumentasjon som senere skal brukes i en søknad om godkjenning. For dyreforsøk vil etisk forsvarlighet dekkes av annet regelverk (dyrevelferdsloven). Forslaget er forenklende for både søker og myndigheter.
Flertallet anbefaler at det ikke gjennomføres høring for forsøksutsetting, jf. kap. 10.2.3.9. Det anbefales videre at det utvikles skriftlig veiledningsmateriale, og at det informeres tydelig på nett hvordan søker skal gå frem.
Forslag til endringer i regelverk/forvaltning:
Flertallet har kommet med et forslag til en ny bestemmelse i genteknologiloven som kan regulere forsøksutsettinger, se kapittel 10.2.7.5.3 og utkast til ny § 10 b). I tillegg må KU-forskriften under genteknologiloven og forskriftene under matloven revideres i henhold til føringene over.
10.2.3.6 Merking
Flertallet mener at PB-produkter ikke skal merkes. PB-produkter bør likestilles med konvensjonelle produkter som det ikke er spesifikke merkekrav til. De ulike bransjene kan selv initiere ulike frivillige merkeordninger, for eksempel for å promotere et bærekraftig produkt. I slike tilfeller skal termen ‘PB’ brukes. For alle GMO (nivå 3 og 4), mener medlemmene at dagens obligatoriske merkekrav skal gjelde.
Det er strenge krav til at merking av mat, fôr, såvarer og andre innsatsvarer skal være korrekt, gi tilstrekkelig informasjon og ikke villede forbrukerne. På den måten settes forbrukere i stand til å ta informerte valg, og det sikres et generelt høyt forbrukervern. I dag regulerer matloven merking av godkjente genmodifiserte såvarer og både levende og døde mat- og fôrprodukter, og merkekravene er omtrent like som i matlovsregelverket i EU. Merking av andre GMO enn såvarer og GMO til mat og fôr, reguleres av genteknologiloven, jamfør loven § 14 og underliggende forskrift om merking, transport, import og eksport av genmodifiserte organismer § 19.
Hovedhensikten med matloven § 10 om merking, presentasjon og reklame, er at forbrukerne ikke skal villedes og at man skal ha mulighet til å foreta informerte valg: Virksomheten skal sørge for at merking, presentasjon, reklame og markedsføring er korrekt, gir mottaker tilstrekkelig informasjon og ikke er egnet til å villede. Dette er også nedfelt i EUs matlov (General Food Law; gjennomført i matlovsforskriften), hvor det fremgår at regelverket skal ha som mål å verne forbrukerinteressene og gi forbrukerne et grunnlag for å foreta velbegrunnede valg med hensyn til de næringsmidler de konsumerer. Regelverket har som mål å forebygge; a) bedragersk eller villedende praksis, b) forfalskning av næringsmidler og c) enhver annen praksis som kan villede forbrukeren.
Andre ledd i matloven § 10 gir hjemmel for å gi nærmere forskrifter om merking, presentasjon og reklame, herunder om forbud mot helsemessig uønsket markedsføring og om vilkår for bruk av frivillige merkeordninger. Denne bestemmelsen hjemler blant annet forskrift om matinformasjon til forbrukerne (§ 4), forskrift om fôrvarer (§ 4b), forskrift om såvarer (§ 20) og forskrift om planter og tiltak mot skadegjørere (§ 14), som alle stiller krav til merking av godkjente genmodifiserte organismer og produkter.
Flertallet anbefaler at PB-produkter i prinsippet kan sidestilles med konvensjonelle produkter og derfor ikke skal merkes spesielt. For GMO anbefaler flertallet at produktene merkes, men med noen justeringer for å ivareta intensjonen som ligger til grunn for dagens merkekrav: Å sikre forbrukere muligheten til å gjøre informerte valg.
Av de generelle kravene er det viktig å fremheve kravet om at merkingen ikke skal være villedende og at man må være forsiktig med såkalt negativ påstandsmerking. En påstand som objektivt sett er sann, kan likevel i enkelte tilfeller eller sammenhenger fremstå som villedende. For eksempel vil appelsiner merket med at de ikke er genmodifiserte ikke kunne godtas av Mattilsynet, fordi ingen appelsiner på markedet er genmodifiserte. Andre negative deklarasjoner som f.eks. ‘100 % fri for GMO’ på et produkt som inneholder soya, mais, eller raps, vil heller ikke godtas da det i de fleste tilfeller i praksis vil være umulig å dokumentere at det ikke er noen sporforurensinger. I andre tilfeller er merkingen kanskje ikke ulovlig, men ikke anbefalt fra myndighetenes side. Det kan være varianter av påstander om at et produkt ikke inneholder genmodifisert materiale. Siden det er terskelverdier for sporforurensninger av EU-godkjent modifisert GMO, kan et produkt i visse tilfelle sies å være ikke-genmodifisert selv om det altså inneholder små forurensninger.
Det er mulig med frivillige merkeordninger for negativ påstandsmerking. Finske myndigheter har laget et slikt rammeverk som virksomhetene må forholde seg til hvis de ønsker å merke produktene31.
Flertallet anbefaler at det i eventuelle frivillige merkeordninger må skilles mellom PB og GMO. Annen merking som kan være aktuell for å fremheve spesifikke egenskaper fremkommet med genredigering, må følge ordinære merkekrav om for eksempel ernærings- og helsepåstander, nøkkelhullsregelverk o.a., og ordet ‘PB’ bør da benyttes.
Forslag til endringer i regelverk/forvaltning:
Både forskrift under genteknologiloven om merking, transport, import og eksport av genmodifiserte organismer og flere forskrifter om merking under matloven må revideres slik at PB-produkter likestilles med konvensjonelle produkter, det vil si at de ikke skal ha spesifikke, obligatoriske merkekrav utover innholds- og næringsdeklarasjon.
For å sikre at merking ikke misforstås som en advarsel, og for å ivareta et helhetlig behov for at forbrukere skal kunne ta informerte valg, er det behov for å gjøre endringer i dagens krav til og vilkår for merking av GMO-produkter. Dels bør informasjon slik som holdbarhets-/best før dato, næringsinnhold, og lot-nummer som et minimum være minst like tilgjengelig (farge, størrelse, plassering, osv.) som en merking knyttet til opprinnelsesland, produksjonsmetode (økologisk, konvensjonelt, genmodifisert, osv.) og annen informasjon som ikke angår mattrygghet og lignende. For det andre bør merking av et produkt som GMO inkludere informasjon om formålet og metoden som er benyttet i forbindelse med genmodifiseringen (obligatorisk, opplysninger koblet til produktgodkjenningen), og at produktet er godkjent for omsetning i Norge/EU etter en helhetlig vurdering som dokumenterer fravær av helse- og miljørisiko samt vurderinger knyttet til bærekraft og (i Norge) etisk forsvarlighet. Annen merking som kan være aktuell for å fremheve spesifikke egenskaper, må følge ordinære merkekrav.
10.2.3.7 Sporbarhet
Flertallet mener at PB-produkter skal underlegges dagens generelle, men strenge krav til sporbarhet på linje med sammenlignbare konvensjonelle produkter. GMO bør fremdeles ha særskilte sporbarhetskrav i henhold til til dagens EU-regelverk.
Det er ikke fastsatt eksplisitte krav til sporbarhet for godkjente genmodifiserte produkter per i dag, men forskrifter under matloven angir at det kan settes slike vilkår om sporbarhet i forbindelse med godkjenning av genmodifiserte produkter. I EU er det egne sporbarhetskrav for genmodifisert mat og fôr, se nærmere omtale i kapittel 6.4.2.3.
Når det gjelder generelle sporbarhetskrav gjelder de samme lovene i Norge som i EU, se nærmere omtale i kapittel 6.4.5.1.4. Det er først og fremst de generelle sporbarhetskravene som gjelder for alle produkter som faller inn under matloven som vil være aktuelle også etter eventuelle endringer i både genteknologiloven og matloven som følge av nivåreguleringsforslaget til flertallet. Det generelle sporbarhetskravet vil fortsatt gjelde for levende GMO godkjent etter genteknologiloven, så lenge det er produkter som også er regulert av matloven. Dette vil for eksempel gjelde prydblomster og akvariefisk, i tillegg til mat og fôr.
Flertallet mener at PB-produkter kun bør underlegges generelle krav til sporbarhet på linje med sammenlignbare konvensjonelle produkter. GMO bør fremdeles ha særegne sporbarhetskrav i hht. til dagens regler. Dette begrunnes dels i ønsket om å likebehandle PB og konvensjonelle produkter, dels i at krav om analytisk sporbarhet og tilgjengelig, validert og spesifikk påvisningsmetode ikke vil kunne etterleves for alle PB produkter som kan finnes på markedet. Hvis den genetiske endringen i en PB kunne ha oppstått ved bruk av konvensjonell, uregulert teknologi kan det være teknisk svært vanskelig eller umulig å bevise at endringen, selv om den påvises, skyldes bruk av genteknologi (Grohmann et al. 2019). To rapporter (Emons et al. 2018, ENGL 2019) fra EUs referanselaboratorium for genmodifisert mat og fôr (JRC) og European Network of GMO Laboratories (ENGL; nettverket av nasjonale GMO referanselaboratorier i Europa) viser blant annet til at flere land utenfor EU har valgt å definere visse grupper av produkter framstilt med genomredigeringsteknikker som ikke-GMO og frita disse fra regulering. Slike produkter vil da ikke være merket, og ved import til EØS-området vil det ikke foreligge noen informasjon eller sikker analysemetode for påvisning, og verken importører eller nasjonale myndigheter vil ha realistiske muligheter til å fastslå om produktet er framstilt med genteknologi. For GMO vil det alltid være slik at den genetiske endringen inkluderer ett eller flere sekvensmotiver som, ved påvisning, med stor grad av sikkerhet kan knyttes til bruk av genteknologi (Grohmann et al. 2019).
I prinsippet kan man se for seg nulltoleranse for ikke-godkjente GMO, men i realiteten vil både virksomheter og tilsynsmyndigheter være prisgitt tilgangen til egnet analysemetodikk og analysemetodenes deteksjonsgrense. Dagens regelverk stiller i utgangspunktet krav om merking hvis godkjent GMO er til stede i et produkt, uansett mengde, men gir unntak fra krav om merking dersom tilstedeværelsen av GMO er utilsiktet og teknisk uunngåelig og mengden ikke overstiger 0,9 %.
Flertallet anbefaler å videreføre dagens praksis for håndtering av sporforurensinger både av godkjente og ikke-godkjente GMO-er som er en harmonisering med EU, inntil EU eventuelt endrer sitt regelverk for sporforurensninger. Flertallet anbefaler at håndtering av merkegrenser og terskelverdier for ikke-toleranse også harmoniseres med EU etter regelverksendringer.
Forslag til endringer i regelverk/forvaltning:
Forskrifter under matloven og genteknologiloven revideres slik at PB-produkter underlegges dagens krav til sporbarhet på linje med sammenlignbare konvensjonelle produkter.
10.2.3.8 Sameksistens og adskilte linjer
10.2.3.8.1 Sameksistens
Sameksistensbegrepet brukes vanligvis om dyrkingsregler som skal sikre at de som dyrker konvensjonelle eller økologiske planteavlinger ikke lider økonomiske tap eller opplever andre ulemper på grunn av innblanding av GMO i avlingene som dyrkes i nærheten av arealer hvor det dyrkes GMO. EUs veileder om sameksistensregelverk og prosess i Norge med utarbeidelsen av utkast til nasjonale sameksistensregler, presenteres nærmere i kapittel 6.4.5.8).
Mattilsynet skrev på oppdrag fra Landbruks- og matdepartementet utkast til regelverk for dyrking mv. av genmodifiserte vekster (sameksistensforskrift) i 2007. Dette utkastet bør gås gjennom med tanke på endringer og justeringer som følge av EUs retningslinje for sameksistens som kom i 2010 og ny kunnskap på feltet.
For dyrking av genmodifiserte planter har EU-landene en egen mulighet til å begrense eller forby dyrking på eget territorium ved det såkalte ‘opt out’ eller Barosso-direktivet som er hjemlet i både GM mat- og fôrforordningen og utsettingsdirektivet. Endringsdirektivet ble innlemmet i EØS-avtalen 13. desember 2019, men Klima- og miljødepartementet har vurdert at gjennomføringen av endringsdirektivet i norsk rett ikke krever lovendring og at lovens krav om vurdering av bærekraft, samfunnsnytte og etikk er tilstrekkelig for å kunne nedlegge forbud mot dyrking. Flertallet anser at direktivet burde vært fullt ut gjennomført for derved å sikre muligheten for, i visse tilfeller, å kunne forby dyrking etter en ikke uttømmende liste av hensyn som ikke gjelder helse eller miljø og for å harmonisere fullt ut med EU.
Når det gjelder dyrking av GMO-planter (nivå 3 og 4) vil det alltid være et vilkår for godkjenning at dyrkingen skjer i henhold til fastsatte bestemmelser i en sameksistensforskrift. Flertallet anbefaler imidlertid at sameksistensreglene ikke skal gjelde for PB-produkter og -sorter (nivå 1 og 2), av flere årsaker: PB-sorter er sammenlignbare med konvensjonelle sorter i hvilke egenskaper som kan oppnås gjennom foredling og de kan i mange tilfeller sannsynligvis ikke påvises og skilles fra ekvivalente konvensjonelle produkter (jf. kap. 6.5) rent analytisk. GMO-merking med tilhørende separate produksjonslinjer ville i alle tilfeller innebære store økonomiske og praktiske konsekvenser for aktørene i verdikjeden.
10.2.3.8.2 Adskilte linjer
Sameksistensproblematikk gjelder også annen produksjon enn dyrking av planter. For produkter det er særskilte krav til, må virksomhetene sørge for hele kjeden fra produksjon av råvare og ingredienser og frem til ferdig produkt som skal omsettes, må holdes i egne linjer der de særskilte kravene kan dokumenteres i ettertid. Nedenfor beskrives relevante caser for norsk matproduksjon som illustrerer problematikken hvis dagens regelverk opprettholdes.
Geno vil gjerne bruke genredigering til å øke frekvensen av gunstige genvarianter som allerede finnes i deres avlspopulasjon, for å gi raskere avlsfremgang og hindre innavl. Dette er for eksempel gener som gir kollethet (hornløshet) og to ulike gunstige melkeprotein-varianter. Kombinasjonen av alle tre genene finnes i svært få dyr i dag (ca. 4 av 10.000), og er derfor ikke praktisk mulig å avle på. Dersom man skal øke kombinasjonsfrekvensen ved hjelp av genredigering, vil de genredigerte dyrene ha den samme genetikken som de konvensjonelt avlede dyrene. Dersom dagens reguleringskrav opprettholdes, vil imidlertid de genredigerte dyrene og de konvensjonelle dyrene måtte holdes helt adskilt. Kjøtt og melk fra de førstnevnte må nemlig merkes som GMO, mens de andre ikke må merkes. Særlig komplisert er dette for melkeproduksjon, siden melka fra ulike dyr og gårder normalt blandes. Dersom en del av melka skal merkes GMO, mens resten ikke skal, må det være helt adskilte produksjonslinjer fra gård til butikkhylle. Og der må én melkekartong merkes GMO mens en annen ikke merkes, selv om innholdet er det samme. Det samme gjelder alle andre meieriprodukter. Geno kan heller ikke videre krysse genredigerte dyr med de konvensjonelle dyra i sin avlspopulasjon, dersom det kreves en helt «GMO-fri» linje, fordi de må holdes separate så lenge genredigering klassifiseres som GMO. Det betyr tregere avlsfremgang i de konvensjonelle dyra fordi den genetiske variasjonen/ulike kombinasjonsfrekvenser vil være mye mer begrenset. Denne forskjellen vil øke over tid etter hvert som kunnskap om genetikk/egenskaper utvikler seg, siden den raskere kan implementeres i avlsprogrammene med genredigering.
Et annet, lignende eksempel fra planteforedlingen er en potensiell genredigert tørråte-resistent potet, som Graminor utvikler. Dersom slike poteter skal inn i verdikjedene, samtidig som det opprettholdes «GMO-frie» alternativer, må det også etableres helt separate produksjonslinjer frem til butikken, der én produktvariant merkes som GMO og en annen ikke. Graminor har også beskrevet for genteknologiutvalget hvordan de kan ønske å bruke genredigering til å raskere overføre gunstige egenskaper fra én kornsort til en annen, mye raskere enn ved kryssing. Eksempelvis har hvetesorten Mirakel gode bakeegenskaper, men må i dag tilføres stråforkorter ved dyrking for å unngå at den knekker. I flere andre hvetesorter finnes en mutasjon som gir korte strå og derfor bedre stråstyrke, men det vil være svært tidkrevende å krysse inn denne varianten i Mirakel. Ved hjelp av genredigering kunne denne mutasjonen overføres til Mirakel enklere og mer effektivt enn ved tradisjonell kryssing. Selv om den genetiske endringen/mutasjonen da vil være identisk i genredigert Mirakel som i andre konvensjonelle hvetesorter med korte strå, må den første – etter dagens regler – merkes GMO mens de andre ikke må. Dersom man ønsker å opprettholde en ikke-genredigert linje av Mirakel (med lange strå) må denne holdes helt adskilt fra genredigert Mirakel (med korte strå) i hele produksjonslinjen. Korn eller prosesserte produkter fra disse to variantene kan ikke på noe tidspunkt blandes fordi den ene skal GMO-merkes og den andre ikke skal.
Aktører i ulike ledd av verdikjeden forteller utvalget at det ikke vil være økonomisk og praktisk gjennomførbart å ha slike separate produksjonslinjer. Det er vanskelig å tallfeste nøyaktig hvilke kostnader og praktiske tilpasninger som må til, men alle de forespurte sier at det vil være svært omfattende og at de vanskelig kan se for seg at de har økonomi til å ha to produksjonslinjer.
Eksempelvis vil det for en gård som driver meieriproduksjon være behov for å dublere med adskilte dyr, melkelinjer, gårdstanker, melkesystemer (roboter og tradisjonelt opplegg) og det vil være vanskelig å garantere at det ikke blir innblanding i melkeorganer, rør, pumper og luftutskillere. Videre må produktene holdes adskilt gjennom hele verdikjeden helt til butikk. Det samme gjelder kjøttprodukter, der både dyr, kjøtt, organer og blod fra slaktelinja må holdes helt separat. Det påpekes at et eventuelt overskudd av GMO-varer ikke kan blandes inn i konvensjonell produksjon, slik økologiske produkter kan, noe som øker risikoen for at overskuddet kan gå til svinn.
Mange produkter, særlig planteprodukter, har lav margin og volumene i Norge er relativt sett små. En investering i en ekstra linje vil ha så høye kostnader for både produsenter og forbrukere at få vil være villig til å betale for produktene. Utvalget ble også fortalt at det heller ikke er fysisk plass til en ekstra produksjonslinje i eksisterende fabrikker, så da må det bygges en ny fabrikk (noe som normalt vil svekke bærekraftsregnskapet). Dersom en bonde velger å produsere kun GMO fordi det blir for dyrt å dublere med to linjer, vil det være krevende å senere skifte tilbake til konvensjonell produksjon, fordi det potensielt vil bli et omfattende arbeid med å fjerne spor av GMO.
Geno sier til genteknologiutvalget at dersom GMO-krav skal gjelde genredigerte dyr, er det praktisk og økonomisk umulig for dem å ta genredigering i bruk. De har videre uttalt til media at dersom de ikke kan ta genredigering i bruk, vil det potensielt svekke konkurransekraften deres så mye at de ikke vil kunne fortsette avlsarbeidet på Norsk Rødt Fe.32 Norsvin og Graminor har også uttalt at de ønsker tilgang til genredigering for å opprettholde konkurransekraften.33,34
Gitt dette bildet er realiteten at svært få produkter som krever merking og krav til separate produksjonslinjer, vil kunne tas i bruk i norsk matproduksjon av praktiske og økonomiske hensyn.
I flertallets modell vil PB-produkter etter godkjenning uten merkostnad kunne inngå i de ordinære konvensjonelle varestrømmene på linje med andre konvensjonelle produkter, uten krav til særmerking.
Flertallet mener at likestilling av PB-produkter med konvensjonelle produkter også kan gjøre dem egnet for økologisk matproduksjon, som i dag har forbud mot bruk av GMO. Flertallet viser til at mange egenskaper som er under utvikling med PB, som styrket plante- og dyrehelse for å redusere sprøytemiddel- og antibiotikabruk, kan være særlig nyttig for økologisk-sektoren.
Forslag til endringer i regelverk/forvaltning:
Det bør vurderes om det utarbeidede utkastet til regelverk for dyrking mv. av genmodifiserte vekster (sameksistensforskrift) fra 2007 skal oppdateres med tanke på endringer som følge av EUs retningslinje for sameksistens (fra 2010) og ny kunnskap på feltet. Det bør presiseres at PB-organismer er unntatt kravene i regelverket.
10.2.3.9 Høring
Det følger av utredningsinstruksen kapittel 3.3 at offentlige utredninger, forslag til lov og forskrift og «forslag til tiltak med vesentlige virkninger» normalt skal legges ut på høring. Høringsfristen skal normalt være tre måneder, og ikke mindre enn seks uker. Høringsfristen i EØS- og Schengen-saker skal tilpasses den tiden som står til rådighet og kan være kortere enn seks uker, men bør normalt ikke være kortere enn tre uker. Det må derfor vurderes om avgjørelsen av søknader om import, omsetning eller bruk av genmodifisert mat og fôr er tiltak med «vesentlige virkninger».
Det gjennomføres ikke nasjonale høringer i forbindelse med søknader om godkjenning etter Ny mat-regelverket, REACH-regelverket (kjemikalier) eller legemiddelregelverket, eller for plantesorter fremkommet ved tradisjonell foredling. Imidlertid følger det av genteknologiloven § 13 at det alltid skal gjennomføres offentlig høring i saker som gjelder godkjenning av søknad om utsetting av GMO.
For søknader til EU under forordning (EF) nr. 1829/2003 om genmodifisert mat og fôr, gjennomfører ikke Kommisjonen selv noen høring. I stedet gjennomfører EFSA en vitenskapelig høring av dokumentasjonen til hver søknad. Høringen er kun åpen for vitenskapelige organer utpekt av kompetente myndigheter i EØS. Etter at EFSA har ferdigstilt en helse- og miljørisikovurdering, sendes den på en fire ukers offentlig høring, og EFSA vurderer om innspillene har betydning for risikovurderingen. Frem til i dag har ikke EFSA endret noen av konklusjonene i risikovurderingene etter de offentlige høringene.
Det varierer hvordan de ulike medlemslandene praktiserer høring. Danske myndigheter gjennomfører to nasjonale høringsrunder for genmodifisert mat og fôr under forordningen: en høring på to uker av EFSAs risikovurdering samt en todagers høring av kommisjonens utkast til beslutning. Svenske myndigheter gjennomfører ikke nasjonale høringer, men legger ut opplysninger om kommisjonens høringer og lenker til kommisjonens sider med oppfordring om at det kan sendes innspill til EFSA med kopi til svenske myndigheter.
Formålet med høring er flersidig. Høring skal blant annet tjene til å opplyse saken så godt som mulig, forberede berørte på hva som kan bli vedtatt og gi berørte mulighet for å påvirke saksutfallet. Å gjennomføre høringer i Norge i forbindelse med nasjonale søknader, kan være nyttig med hensyn til å få sjekket ut om det foreligger andre særnorske forhold enn de VKM eventuelt har identifisert. Flertallet mener derfor at det er VKMs vurderinger som må sendes ut på høring, og at det ikke er nødvendig med en separat høring av et sammendrag av søknadene. Videre mener flertallet at det kan være hensiktsmessig at VKM og/eller myndigheten på sine nettsider informerer om og lenker til EFSAs offentlige høringer av deres risikovurderinger. Enhver kan sende høringsinnspill i EFSAs offentlige høringer, også enhver utenfor EU. VKM sender for øvrig høringsinnspill i EFSAs vitenskapelige høringer i forbindelse med søknader til EU om godkjenning av GMO.
Flertallet anser at det ikke er nødvendig med høring for alle de fire reguleringsnivåene. På nivå 1 og 2 (PB) vil ikke virkningene av tiltaket (utsettingen) være større enn for tilsvarende konvensjonelle produkter. På disse nivåene er det tilstrekkelig å informere om saken på adekvat måte, for eksempel ved en melding til myndighetene som offentliggjøres på nettsidene til mat- og miljøforvaltningen. Gjelder sakene produkter for EU-markedet, kan det lenkes opp til EU og EFSA for mer informasjon. For nivå 3 og 4 (GMO) bør det gjennomføres høring av risikovurderingen.
Når det gjelder forsøksutsetting, mener flertallet at det ikke bør være noen krav til høring. For flertallsmodellen omfatter derfor unntaket alle reguleringsnivåene. Søker har gitt tilbakemelding om at høring oppleves belastende, og flertallet mener at dette bør tillegges vekt. Ved forsøksutsetting forventes dessuten virkninger av tiltaket (utsettingen) å være svært begrenset. For å sikre åpenhet bør heller informasjon om feltforsøket gjøres tilgjengelig på relevante nettsider, eventuelt kan informasjonen være tilgjengelig i et register.
Forslag til endringer i regelverk/forvaltning:
Flertallet foreslår lovendringer i genteknologiloven § 13 for å sikre at høring vurderes konkret i hver enkelt sak om godkjenning av levende GMO.
I tillegg må saksbehandlingsrutinene i forvaltningen revideres i henhold til anbefalingene over.
10.2.3.10 Hurtigprosedyre for produkter for store, udekkede behov
Produkter som fyller et spesielt stort udekket behov, kan gis betinget godkjenning basert på noe mindre dokumentasjon enn normalt. Flertallet ser for seg at dette kan gjelde produkter som vanligvis ville havnet på reguleringsnivå 2, 3 eller 4. Relevansen og effekten av en slik ordning øker desto lengre og mer omfattende godkjenningsprosessen normalt er, det vil si i stigende grad på nivåene.
I genteknologilovens forarbeider er det omtalt at tilpassede krav kan tenkes gitt til produkter med særlig stor nytte. Det følger av Ot.prp. nr. 8 (1992–93) om genteknologiloven side 81, at dersom et prosjekt har en vesentlig nytteverdi og formålet ikke kan nås på annen måte, kan kravet om dokumentasjon på at (prosjektet) produktet ikke har helse- eller miljømessige skadevirkninger lempes noe.
I tråd med flertallsmodellen, som baserer seg på at alle produkter til mat og fôr skal godkjennes etter matloven med forskrifter, må en slik mulighet til lempeligere krav for PB og GMO for store udekkede behov inngå i regelverksendringsforslaget. Genteknologiloven og matloven med matlovens forskrifter som regulerer godkjenning av genmodifisert mat og fôr foreslås revidert for å inkludere en slik adgang. Flertallet anbefaler at det utvikles kriterier for hvordan det skal vurderes om et produkt kan havne i denne kategorien. Et annet alternativ, eventuelt i tillegg til slike kriterier, er at det tydeliggjøres at en bestemt myndighet kan vurdere/anbefale hvilke produkter som kan gå inn i et slikt godkjenningsløp. Dette vil forutsette åpenhet rundt slike vurderinger/anbefalinger. Det er viktig at vurderinger som gjøres i hurtigprosedyren er personuavhengig, og bør være så forutsigbar som mulig. En mulighet kan være å knytte denne vurderingen opp mot EUs bærekraftskriterier.
Utvalgsmedlemmer anser at covid-vaksinene er et godt eksempel på et produkt som dekker et stort behov. Det europeiske legemiddelbyrået EMA foretok en «rolling review», som vil si at de lot søker levere inn data og dokumentasjon underveis i søknadsprosessen da all dokumentasjon ikke var tilgjengelig på det tidspunkt søknadene ble sendt. I tillegg ble vaksinene godkjent av Kommisjonen med betinget markedsføringstillatelse. Betinget markedsføringstillatelse betyr at et legemiddel kan selges på markedet så snart tilstrekkelige, men ufullstendige data blir tilgjengelige, for å vise at fordelene oppveier risikoen. I tillegg kreves det at søker må gi ytterligere data fra pågående eller nye studier innen forhåndsdefinerte frister for å bekrefte at fordelene fortsetter å oppveie risikoen. Betinget markedsføringstillatelse har en varighet på ett år, med mulighet for fornyelse, og produktet kan trekkes fra markedet skulle det oppstå eventuelle negative virkninger. Enkelte av vaksinene var dessuten klassifisert som GMO og klinisk utprøving av GMO-vaksinene krevde i utgangspunktet godkjenning etter GMO-regelverket. Fordi nytten var så stor, ble det imidlertid gjort et unntak fra godkjenningskravet for å få vaksinene raskere klare til steget for søknad om markedsføringstillatelse.
Flertallet mener at søknadsprosessen for GMO eller PB med store, udekkede behov kan følge et lignende løp som betinget markedsføringstillatelse.
Forslag til endringer i regelverk/forvaltning:
Forskrifter under matloven og genteknologiloven anbefales revidert med sikte på å regulere en slik prosedyre. Det anbefales utviklet vurderingskriterier for om et produkt kan havne i kategorien «hurtigprosedyre» samt vurdere om det er fordelaktig å delegere ansvaret for å anbefale hvilke produkter som kan gå inn i et slikt godkjenningsløp til en bestemt myndighet.
10.2.3.11 Gebyr
I forbindelse med fastsettelse av matloven ble det lagt til grunn en ny finansieringsmodell med visse generelle prinsipper for avgifts- og gebyrordninger, jamfør St. prp. nr. 100 (2002–2003). Hovedprinsippene for finansieringen av matforvaltningen skal støtte opp under de sentrale strategier og mål som er lagt for organiseringen av matforvaltningen, blant annet om økt vekt på helkjedeperspektiv, risikobasert tilsyn, kostnadseffektivitet og forenklinger, i tillegg til at internasjonale forpliktelser skal kunne følges opp. Det skal være en logisk sammenheng mellom de oppgavene som matforvaltningen utfører og måten de finansieres på. Oppgaver som kan knyttes direkte til klart definerte brukere eller brukergrupper, skal kunne finansieres med gebyrer. Andre oppgaver finansieres over statsbudsjettet.
Gebyrer er vanlig brukt i statlige virksomheter til betaling av konkrete myndighetsoppgaver. Gebyret kan ikke overstige statens kostnader med oppgaven. Gebyrene kan ha formål utover de statsfinansielle formålene i det at de også kan brukes til å påvirke borgernes handlingsmønster på et bestemt område eller en måte. Gebyr for søknader om godkjenning av PB og GMO kan bidra til godt gjennomtenkte og forberedte søknader, som kan bidra til en mer effektiv søknadsbehandling. Samtidig bør størrelsen på gebyr vurderes i lys av å stimulere til innovasjon og mangfold.
Søknader om godkjenning av genmodifisert mat og fôr med hjemmel i matloven, er i dag gebyrbelagt etter forskrift om gebyrer for særskilte ytelser fra Mattilsynet. Behandling av søknader om godkjenning av PB og GMO mat og fôr, vil med flertallsmodellen, på samme måte være gjenstand for gebyrer. Forskrift om gebyrer for særskilte ytelser fra Mattilsynet, vedlegg 1, kapittel II, vil måtte revideres for å ivareta dette. Det bør vurderes om det skal være differensierte gebyrer i tråd med de fire reguleringsnivåene. Det å ilegge gebyr for denne type tjenester er i tråd med EUs praksis på området. Det må innføres samme type differensierte gebyr også for søknader som skal behandles etter genteknologiloven.
I alle tilfeller vil gebyret som kreves for standard behandling av søknad etter matloven være helt marginalt sammenlignet med kostnadene søker får ved innhenting og sammenstilling av dokumentasjonen som kreves for behandling av en GMO-søknad etter dagens krav i EUs GMO-regelverk og genteknologiloven i Norge.
For ikke å hindre innovasjon, bør søknader om forsøksutsetting unntas helt fra gebyrinnkreving.
Forslag til endringer i regelverk/forvaltning:
Forskrift om gebyrer for særskilte ytelser fra Mattilsynet, vedlegg 1, kapittel II, revideres for å ivareta fire gebyrklasser. Det utarbeides en forskrift om gebyr med hjemmel genteknologiloven § 22 i henhold til anbefalingene her.
10.2.3.12 Veiledning
Myndighetene har et særskilt ansvar for å hjelpe virksomhetene til å forstå og følge regelverket. Veiledning kan være skriftlig og muntlig, og myndighetene skal legge til rette for dialog og medvirkning i utvikling av brukertilpasset digitalt innhold og tjenester. Det er ikke nødvendig å fastsette egne regler for veiledning om PB og GMO med hjemmel i matloven og genteknologiloven, da myndighetsansvaret for veiledning allerede er stort, jamfør forvaltningsloven § 11.
Det må utarbeides gode veiledere som kan brukes både av virksomhetene og av forvaltningen. Dette sikrer transparens og forutsigbarhet, slik at søker kan se hva som vektlegges i de ulike kategoriene/nivåene. Veilederne bør omhandle både regulatoriske krav med forklaringer, og gi informasjon om hvordan tilsynsmyndigheten utfører offentlig kontroll for å sikre etterlevelse av regelverket. Veilederne bør brukertestes før de offentliggjøres, og ellers være levende dokumenter som endres i takt med erfaringer fra brukere og myndighetene og med hensyn til ny kunnskapsstatus for produkter og spesifikke egenskaper.
Det er viktig at veilederne inneholder informasjon om hvilke produkter som sorterer inn under de ulike reguleringsnivåene, og om de skal inn i et forenklet eller et mer tradisjonelt godkjenningsløp. Det må videre gis tydelig informasjon om hva slags krav som stilles til dokumentasjon for de ulike reguleringsnivåene, slik at søker settes i stand til selv å vurdere hvilket løp som er aktuelt og hva slags dokumentasjon som må legges ved.
Følgende momenter er viktig å informere godt om i veilederne:
Risiko – basert på genetisk endring (midlertidig, PB eller GMO) og history of safe use og/eller familiaritet som gir ulikt søknadsløp; svært forenklet, forenklet eller full søknad (GMO) basert på genetisk endring (PB eller GMO) og history of safe use og/eller familiaritet.
Etisk forsvarlighet – med beskrivelse av prinsippene om nytte, bærekraft, rettferdig fordeling og åpenhet, som sammen med vurderingen av helse- og miljørisiko, utgjør elementene i den samlede vurderingen av etisk forsvarlighet. Produkter av særlig positiv betydning for samfunnsnytte og bærekraft kan forsvare enklere og raskere saksbehandling.
Etisk forsvarlighet vurderes av egnede komitéer eller etater. Bioteknologirådets ansvar for vurdering i enkeltsaker opphører, men det generelle mandatet om uttalelser og offentlig debatt om genteknologi videreføres.
Etiske vurderinger vil tilpasses ulike formål: Ingen vurdering ved forsøksutsetting, og for kommersielle formål vil vektingen av etiske forhold være på nasjonal bioproduksjon og ikke på import med unntak av åpenbare moralsk problematiske tilfeller.
Høring – ikke nødvendig for forsøksutsetting eller PB-søknader. Nøkkelinformasjon legges ut i offentlig tilgjengelig register. For søknader om godkjenning av GMO, bør VKMs risikovurdering sendes på høring.
Merking – all merking må være informativ og ikke-diskriminerende. PB-produkter tilsvarer konvensjonelle produkter og bør ikke merkes annerledes. Dette er også av praktiske hensyn fordi det i mange tilfeller ikke vil være mulig å påvise at to like produkter er fremstilt med ulike teknologier. Dette gjelder særlig importvarer som ikke er klassifisert som annet enn konvensjonelle varer i opprinnelseslandet. Det vil videre være praktisk og økonomisk svært vanskelig for norsk matproduksjon å etablere helt separate produksjonslinjer. Fortsatt merking av transgene, novogene og invagene organismer (GMO, krav til spesifikk og validert analysemetode, og overvåking/PMM).
GMO/PB som fyller et spesielt stort udekket behov, eksempelvis knyttet til bærekraftsmål, kan gis betinget godkjenning basert på noe mindre dokumentasjon enn normalt.
Forslag til endringer i forvaltning:
Det må utarbeides gode veiledere for både næringsvirksomheter og for forvaltningen.
10.2.3.13 Føre-var-prinsippet
I norsk lovgivning anvendes føre-var-prinsippet både i forvaltningen av genteknologiloven og matloven, selv om det ikke nedfelles eksplisitt i lovtekstene. Se nærmere omtale av prinsippet i kapittel 6.7.
En viktig forskjell mellom føre-var-prinsippet i matlovsregelverket og genteknologiloven, er kravet i matlovsregelverket om at oppfølgingen av et føre-var-tiltak (forbud eller andre restriksjoner) må vurderes på nytt innen et rimelig tidsrom. Det påligger myndigheten ansvaret om å søke vitenskapelige data innen rimelig tid for å enten opprettholde eller avslutte det midlertidige tiltaket.
Dette er i tråd med WTO-regelverket om å skaffe nødvendig kunnskap innen rimelig tid slik at tiltaket ikke blir uproporsjonalt. Et nasjonalt forbud mot for eksempel sprøytemiddelresistente GMO, vil etter annet regelverk enn genteknologiloven derfor måtte vurderes aktivt på nytt innen et rimelig tidsrom etter at forbudet trådte i kraft.
Utvalgsflertallet mener føre-var-prinsippet er et viktig virkemiddel for å begrense skadevirkninger på helse og natur. Imidlertid er det også viktig at prinsippet bare anvendes når det er reelle og sannsynlige skadevirkninger ved utsetting av et produkt. I tidligere saker etter genteknologiloven har faglige vurderinger basert på risikovurderinger fra VKM og EFSA om at det ikke foreligger en sannsynlig miljørisiko, blitt overprøvet politisk med påfølgende nedlagt forbud mot omsetning med begrunnelse i en usikkerhet om miljørisiko (importforbud mot tre raps i 2017). Slike rent politiske vedtak bidrar til å svekke faglig uavhengighet samt tilliten til de faglige vurderingene som er gjort. Det svekker også intensjonen om å holde klart adskilt risikovurdering og risikohåndtering i forvaltningen. Ved fremtidige forbud begrunnet i føre-var-hensyn, er det viktig at norske myndigheter overholder forpliktelsen om å skaffe til veie vitenskapelig kunnskap i rimelig tid for å vurdere om et forbud med basis i føre-var skal opprettholdes.
Flertallet anbefaler ikke at føre-var-prinsippet lovfestes av forvaltningsmessige hensyn, da prinsippet retter seg mot myndighetene og ikke gir rettigheter eller plikter til private. Det anbefales imidlertid å forskriftsfeste med hjemmel i genteknologiloven, på samme måte som i matlovsforskriften, krav til myndighetene om å søke vitenskapelige data innen rimelig tid for å vurdere om et føre-var- tiltak kan opprettholdes.
Forslag til endringer i regelverk/forvaltning:
Det anbefales å revidere genteknologiloven og/eller dens forskrifter slik at den hjemler tilsvarende krav som under matloven om at myndigheten som har vedtatt føre-var-tiltak også har ansvar for å søke og skaffe til veie vitenskapelig dokumentasjon innen rimelig tid for å enten opprettholde eller avslutte et midlertidig føre-var-tiltak.
10.2.3.14 Åpenhet og offentlighetsprinsippet
EUs åpenhetsforordning (forordning (EU) 2019/1381) om åpenhet og bærekraft i EUs risikovurderinger i næringsmiddelkjeden, krevde endring i flere regelverk, blant annet i utsettingsdirektivet 2001/18/EF som er gjennomført i genteknologiloven. De øvrige bestemmelsene i åpenhetsforordningen ble gjennomført i forskrifter hjemlet i matloven, med unntak av endringen i forordning (EF) nr. 1829/2003 om genmodifisert mat og fôr som ikke er gjennomført i norsk rett per i dag.
Den generelle norske offentleglova om rett til innsyn i dokumenter i offentlig forvaltning, vil også regulere innsyn i dokumenter relatert til forvaltningens vurderinger av GMO. Den har som formål, jamfør § 1, å «leggje til rette for at offentleg verksemd er open og gjennomsiktig, for slik å styrkje informasjons- og ytringsfridommen, den demokratiske deltakinga, rettstryggleiken for den enkelte, tilliten til det offentlege og kontrollen frå ålmenta.». Etter offentleglova pålegges også forvaltningen å foreta en vurdering av meroffentlighet selv der forvaltningen har anledning til å unnta innsyn, jamfør loven § 11.
Selv om EUs regelverk om genmodifisert mat og fôr med de oppdaterte regler etter åpenhetsforordningen ikke er gjennomført i norsk rett per i dag, er ikke dette til hinder for å utarbeide tilsvarende regler for transparens og saksbehandling vedrørende søknader om godkjenning av PB og GMO hjemlet i matloven. Flertallet mener videre at det bør klargjøres hvilket juridisk rom som finnes for at forvaltningen skal kunne ta i bruk opplysninger fra andre søknader når en søknad er til behandling, for at slike opplysninger skal kunne brukes i oppbygging av forvaltningens kompetanse rundt behandling og vurdering av søknader og at forvaltningen kan ta dette rommet i bruk i så stor grad som mulig. Flertallet anbefaler at man her harmoniserer det nasjonale regelverket eller praksisen med EUs, frem til EUs regelverk om genmodifisert mat og fôr innlemmes i EØS-avtalen.
10.2.3.15 Immaterielle rettigheter og patenter
Immaterielle rettigheter har stor betydning for både innovasjon og tilgang til innovasjon. På den ene siden gir det insentiver til utviklere som får inntjening på sine oppfinnelser og således stimulans til mer innovasjon. På den andre siden kan det føre til økt grad av monopol i markedet, øke prisene på produkter og begrense tilgangen for andre utviklere og samfunnet forøvrig.
Dersom det skal kreves et patent, må det utviklede produktet skille seg vesentlig fra andre produkter på markedet. Det må også være mulig å påvise slike forskjeller for å kunne håndheve patentrettighetene. Fordi modellen sidestiller PB med konvensjonelle avlsmetoder, bør det heller ikke kunne kreves rettigheter for PB-produkter utover det som gjelder generelt for konvensjonelle produkter. Skal man få fordelen av en enklere vei til markedet på bakgrunn av likebehandling, må man også oppgi de eventuelle fordelene som følger med særbehandling.
GMO-produkter skiller seg fra konvensjonelle produkter, og er derfor noe vesentlig nytt. Da kreves en mer omfattende risikovurdering fordi det er større usikkerhet om effekter. Nyhetsverdien/oppfinnerhøyden er også det som legitimerer et patent. At produktet sikkert kan skilles fra andre produkter ved hjelp av analytiske deteksjonsmetoder er også en forutsetning for håndheving av patentretten. Derfor er det hensiktsmessig og rimelig å kreve analytisk deteksjon på nivå 3 og 4, men ikke på nivå 1 og 2.
Rammene for immaterielle rettigheter er imidlertid tett knyttet opp mot internasjonale avtaler og regelverk og må derfor harmoniseres med de til enhver tid gjeldende regler. Forslaget om nivådeling av rettigheter bør derfor spilles inn som en del av det helhetlige modellforslaget i relevante internasjonale fora, spesielt i EU. Dersom Norge velger å modernisere sitt regelverk før EU (se kap. 10.2.6) kan Norge imidlertid også sette en tidlig standard for å begrense patentrettigheter for PB-sorter/produkter til norsk bioproduksjon. Det vises til nærmere omtale av temaet i kapittel 11.
Forslag til endringer i regelverk/forvaltning:
Flertallet ønsker at PB skal ha tilsvarende vilkår for rettighetsbeskyttelse som konvensjonelle avlsprodukter, mens GMO skal ha utvidet mulighet til rettighetsbeskyttelse.
10.2.3.16 Virkemidler for å stimulere til mer bærekraftig og samfunnsnyttig utvikling
10.2.3.16.1 Insentivordninger
Flertallet anbefaler at produkter som forventes å ha et vesentlig positivt samfunnsbidrag kan få en såkalt fast-track søknadsbehandling og eventuelt betinget godkjenning med reduserte dokumentasjonskrav i en innledende fase, som beskrevet over. Det finnes også en rekke andre positive virkemidler som kan brukes for å stimulere til ønsket innovasjon. Her kan man se til erfaring fra feltet «orphan drugs» – legemidler til «ulønnsomme» pasientgrupper med et stort udekket behov – der en rekke offentlige virkemidler brukes for å gi insentiver til utviklere. Dette kan for eksempel være styrket vitenskapelig veiledning fra myndighetene – særlig til akademikere og små og mellomstore bedrifter. Her kan matforvaltningen lære av Statens Legemiddelverk, som har opprettet et innovasjonskontor med en slik funksjon for å støtte utviklere av nye legemidler. Et annet grep kan være å fjerne gebyr for søknader om utsetting i både feltforsøk og til kommersielle formål. Videre kan man bruke offentlige innkjøpsordninger til å prioritere spesielt nyttige produkter, og det kan etableres egne finansieringsordninger til særlig nyttige prosjekter – eksempelvis under Bionova eller lignende offentlige støtteordninger for grønn omstilling.
Insentivordningene bør, i tillegg til stimulering av norsk forskning og innovasjon, kunne innrettes spesielt for utviklere fra lavinntekstland. Dette kan eksempelvis være genredigerte sykdomsresistente bananer fra Uganda, genredigert tørkeresistent ris fra India eller andre produkter som kan styrke matsikkerhet og lokale bønders økonomi. I 2017 ga Canada en godkjenning for import av Golden Rice – A-vitaminberiket ris35. Produktet var ikke på den tiden i kommersiell dyrking, men Canada ga en slik tillatelse for å berede grunnen for eksport til det internasjonale markedet. Fra og med 2023 er risen godkjent for dyrking i Filippinene. Dette produktet er antagelig ikke så relevant for det norske markedet, men Norge kan på lignende vis og med ulike virkemidler gå foran og bidra til å legge til rette for at mindre privilegerte land kan utvikle sitt landbruk og styrke sin egen økonomi gjennom eksport. En aktuell case i nær fremtid er genredigert teff (Eragrostis tef) med korte strå, som er utviklet i et samarbeid mellom amerikanske og etiopiske forskere36. Teff er en viktig kornsort i Etiopia, og korte strå kan redusere svinn med rundt 25 % og dermed styrke matsikkerheten. Teff og produkter fra kornet selges i Norge som et alternativ til hvete fordi den er gluten-fri og er rik på fiber og andre gunstige næringsstoffer. Dersom Norge klarerer produkter fra denne genredigerte varianten for markedet, kan Norge bidra til å etablere et eksportmarked for landene som dyrker den.
10.2.3.16.2 Ansvarlig kommunikasjon og tillitsbygging
«Genetically modified organisms (GMOs) have become the target of a very intensive and, at times, emotionally charged debate», skriver FNs organisasjon for mat og landbruk (FAO).
Flertallet deler dette synet og mener det i stor grad henger sammen med at GMO-debatten er sterkt preget av mistillit. Flertallet ser det som et offentlig ansvar å bidra til en kunnskapsbasert debatt og til å bygge tillit til vitenskapen. Det er lite kunnskap om genteknologi spesielt og avlsarbeid generelt i befolkningen, viser undersøkelser. Blant annet mente 40 % av de som svarte på en norsk befolkningsundersøkelse om genredigert mat at det er mer sant enn usant at genmodifiserte tomater har gener, mens vanlige tomater ikke har gener. Videre mente 35 % at det var mer sant enn usant at tradisjonell avl ikke har noen ting med gener å gjøre. Bare halvparten hadde hørt om genredigering i det hele tatt37. Slik kunnskapsmangel er en vesentlig utfordring når man skal diskutere genteknologi i samfunnet. En enda større utfordring er mistillit til vitenskapen, som preger mange forskningsområder. Klimadebatten har i årevis vært preget av at enkelte ikke stoler på resultatene som forskerne produserer, noe som har forsinket nødvendig politisk handling. Det samme gjelder eksempelvis vaksinedebatten. GMO er dessverre også gjenstand for mye mistillit. En studie gjort av PEW Research Center i USA i 201538 viser at 88 % av forskere tilknyttet the American Association for the Advancement of Science (AAAS) mente at GMO er trygt å spise, mens bare 37 % av befolkningen mente det samme. Da regjeringen i 2020 gjorde unntak fra krav om godkjenning etter genteknologiloven for covid-vaksiner klassifisert som GMO-legemidler for å sikre rask tilgang under pandemien, kom over 1800 høringssvar som nesten utelukkende var fra vaksineskeptiske og GMO-skeptiske enkeltpersoner og organisasjoner som hevdet at disse vaksinene var eksperimentelle og farlige, spesielt fordi de var laget med genteknologi39.
Utvalgsflertallet både ønsker og øyner håp om at debatten kan bli mer kunnskapsbasert og nyansert. I en rekke undersøkelser fra flere land de siste årene, inkludert Norge40, Sverige41, Storbritannia4243 og Sveits44, viser resultatene tydelig at flertallet av folk er positive til genteknologi i matproduksjon, spesielt nye teknikker som genredigering, dersom formålet med bruken er godt.
De samme nyansene trenger vi inn i den politiske diskursen. Som Regjeringen skriver på sine nettsider45, har Norge en offisiell restriktiv politikk på genteknologi. Slikt bidrar til å opprettholde generell skepsis og mistro til genteknologi i befolkningen, fordi det underbygger at det må være noe iboende problematisk med teknologien, selv om kunnskapsgrunnlaget viser noe annet. Flertallet anbefaler at Norge skifter sin offisielle politikk slik at den bedre gjenspeiler genteknologilovens formål: at genteknologi skal brukes til det beste for samfunn og miljø.
10.2.4 Vurderingsforløp for ulike produkter basert på flertallsmodellen – eksempler
Flertallet er samstemte i at flertallsmodellen skal gjelde alle organismer, planter, dyr og mikroorganismer, men at kravene til godkjenning for forskjellige organismegrupper vil være forskjellig. Figur 10.4 gir en rekke eksempler på vurderings- og godkjenningsløpet for ulike arter og egenskaper slik de kan forventes å plasseres i modellen.
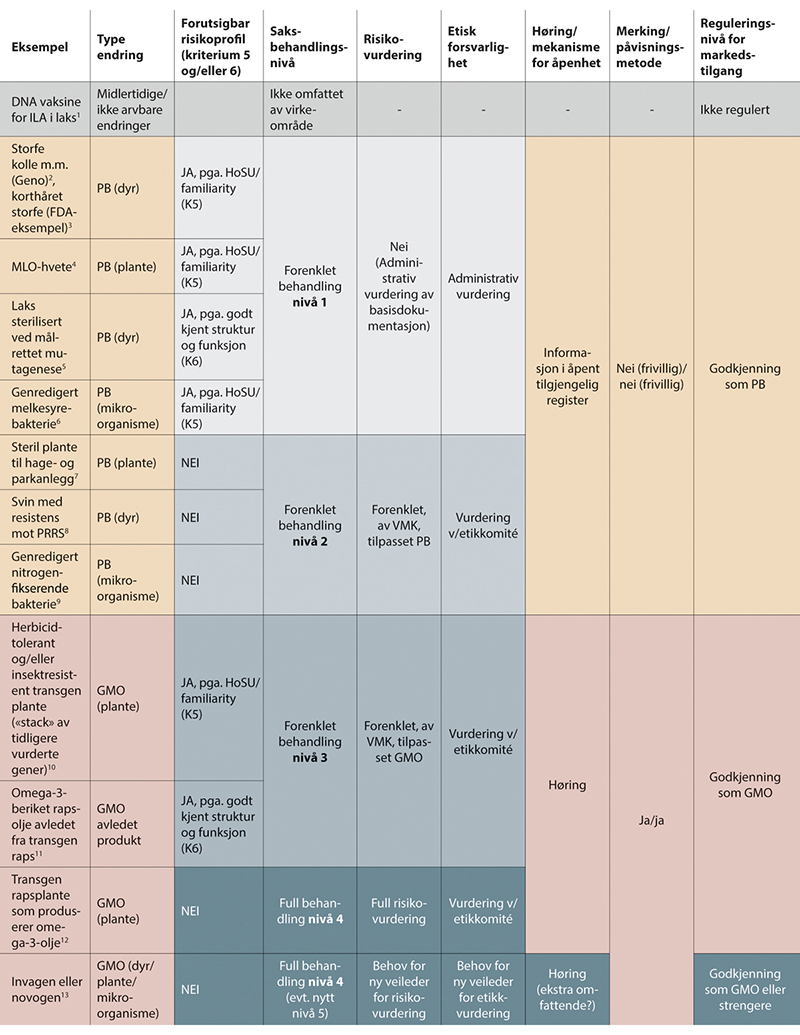
Figur 10.4 Eksempler på forventet vurderings- og godkjenningsløp for ulike arter og egenskaper etter flertallsmodellen.
1 Utbrudd av infeksiøs lakseanemi (ILA) medfører store restriksjoner for affiserte anlegg. ILA er listeført i EU og i OIE (Verdens dyrehelseorganisasjon) og Norge regnes som episenteret for sykdommen. God beskyttelse oppnås med mRNA/DNA-vaksiner, men ikke for helvirus-vaksiner. Det er derfor behov for en slik vaksine i Norge, men uklarhet omkring reguleringsstatus etter dagens genteknologilov gir utfordringer for utviklere. I modellen unntas slike vaksiner fra genteknologireguleringen fordi de gir midlertidige, ikke arvelige endringer.
2 I avlsmaterialet på Norsk Rødt Fe (NRF) som avles på av Geno finnes flere ønskede genetiske egenskaper, blant annet kollethet (hornløshet) og to ulike melkeproteiner med gunstige egenskaper. Imidlertid er det svært få av dyrene som har kombinasjonen av alle tre; bare omtrent 4 av 10.000 dyr. Det er for lite å avle på, pga. risiko for innavl og fordi disse dyrene ikke nødvendigvis har de høyeste verdiene på andre avlsmål. PB kan brukes til å øke frekvensen av gen-kombinasjonen og fungerer da som en erstatning for tradisjonell krysning.
3 Et tilsvarende case er overføring av en genvariant som gir kort pels fra en storferase til en annen ved hjelp av genredigering. Slike storfe er klarert for markedet i USA uten behov for risikovurdering fordi genvarianten og egenskapen er godt kjent og har historie med trygg bruk.
4 MLO-mutasjoner gir resistens mot meldugg og finnes i mange plantearter, både en- og tofrøbladete. Egenskapen som resulterer i resistens (alle MLO-kopier mutert). Mutasjonen som er aktuell er godt kjent i bygg, men finnes ikke i hvete, fordi genet finnes i seks kopier i hvete og det er usannsynlig at mutasjoner i alle sammen skal oppstå naturlig eller ved klassisk mutagenese. Forskere har brukt genredigering med CRISPR til å fremstille meldugg-resistent hvete.
5 Mesteparten av all lakseoppdrett foregår i sjø i åpne merdsystemer. Ved rømming kan oppdrettslaksen krysse seg med vill laks. En løsning er å bruke genetisk steril laks som har en målrettet mutasjon i et gen (dnd) som resulterer i sterilitet. Slike mutasjoner er godt kjent i mange fiske- og dyrearter men finnes ikke naturlig i atlantisk laks.
6 Melkesyrebakterier Lactobacillus har status som GRAS (Generally Recognized As Safe), har en lang HoSU og effekt og funksjon av både bakteriene selv og genene de bærer er i mange tilfeller svært godt kjent.
7 En rekke vanlige hagevekster er fremmedarter i Norge og kan utkonkurrere stedegne arter eller opptre som ugress i landbruket. Et pågående innovasjonsprosjekt i Norge undersøker om genredigering kan brukes til å lage sterile varianter av vekstene (https://eliteplanter.no/kan-nobelprisvinnende-teknologi-crispr-benyttes-for-a-utvikle-hageplanter-med-lavere-spredningspotensial/).
8 PRRS er et virus med store konsekvenser for svinenæringa globalt. Ved hjelp av genredigering har amerikanske og britiske forskere laget griser som er resistente mot viruset ved å klippe bort en liten bit av genet som viruset trenger for å infisere grisene. Egenskapen er ikke kjent i arten eller sammenlignbare arter fra før.
9 En genredigert nitrogenfikserende stamme av Klebsiella variicola omsettes i USA (Wen et al. 2021, https://www.pivotbio.com/product-proven). Genvariantene er kjent fra andre jordbakterier, men generelt begrenset kunnskap om mikroorganismers effekt på miljøet gjør at flertallet foreslår dette produktet på nivå 2 i første omgang, med mulighet for flytting til nivå 1 med noe mer erfaring.
10 Mange GMO-planter i dag er resistente mot sprøytemidler (herbicider) eller insekter, og produkter fra slike forventes også å komme på markedet fremover. I mange tilfeller er nye produkter en kombinasjon av tidligere vurderte GMOer, såkalte «stacks». I slike tilfeller er det tilstrekkelig å gjøre en forenklet vurdering fordi genene har vært vurdert enkeltvis tidligere.
11 Fisk i oppdrett har behov for marine fiskeoljer i dietten sin. Marine fiskeoljer inneholder de essensielle omega-3 fettsyrene og disse produseres bare av organismer i havet. Bruk av marine fiskeoljer er ikke en lavtrofisk løsning i fiskefôr siden de kommer fra annen fisk. Transgen raps som produserer langkjedete (> 20 C) omega-3 fettsyrer er utviklet. Oljen avledet fra rapsen er vurdert i Norge uten sannsynlig helse- eller miljørisiko. Produktet inneholder videre kun ingredienser som har lang historie med trygg bruk.
12 Selve GMO-rapsen som oljen i eksempelet over er avledet fra, kan også bli aktuell å godkjenne dersom den eksempelvis skal dyrkes i Norge. I dette tilfellet bør det gjøres en standard risikovurdering. Det kan imidlertid argumenteres for at produktet har vesentlig positivt bidrag til bærekraft og derfor bør kunne vurderes som aktuell for fast-track behandling.
13 Invagener (gen-drivere eller andre former for genetisk endring som har til hensikt å spre en egenskap i en populasjon, transient eller permanent) samt novogener (organismer tilført syntetiske elementer eller med helsyntetiske genomer) faller på mange måter utenfor dagens veiledere for saksbehandling og vurderinger. Derfor bør disse kanskje få et eget nivå for saksbehandling og markedsregulering.
10.2.5 Endringer i forvaltningsansvar og regelverksorganisering
Utvalgsflertallet mener at ansvaret for forvaltning av GMO mat og fôr, både levende og prosessert, bør samordnes under matforvaltningen, mens forvaltning av levende GMO for andre formål enn til mat og fôr bør videreføres under miljøforvaltningen. Dette vil sikre en harmonisering med måten EU forvalter området.
Flertallet mener at alle produkter til mat og fôr, uavhengig av om de er utviklet med genteknologi eller ikke, bør reguleres etter matloven som forvaltes av Mattilsynet og matdepartementene. Forvaltningen blir da enhetlig og harmonisert med EUs regelverk og medlemslandenes forvaltning, noe som tilrettelegger for en mer effektiv forvaltning. En slik endring er i tråd med en områdegjennomgang av miljøforvaltningen som ble gjort av en regjeringsoppnevnt arbeidsgruppe i 2016 (u. off.). Arbeidsgruppen bestod av fire representanter fra Klima- og miljødepartementet, to representanter fra Finansdepartementet og ble ledet av en representant fra Helse- og omsorgsdepartementet. Arbeidsgruppen kom med 32 anbefalinger. En av anbefalingene omhandlet GMO og lød: «Ansvaret for genmodifiserte organismer samles hos matforvaltningen.» Ett av arbeidsgruppens medlemmer var uenig i denne anbefalingen. Arbeidsgruppen skrev at «Forvaltningen av regelverket er organisert med mange aktører og til dels uklare roller» og at «Etter arbeidsgruppens syn bør ansvaret for genmodifiserte organismer samles hos matforvaltningen slik det har blitt gjort i EU-systemet.»
I EUs regelverk om genmodifisert mat og fôr skilles det ikke mellom levende GMO og produkter fra samme GMO som er bearbeidet og ikke lenger formeringsdyktige, det gis ett vedtak for alle bruksområder – «one door – one key». Etter dagens sektoransvar vil en implementering av dette regelverket i norsk rett hjemles i både matloven og genteknologiloven. Da vil det ved EU-godkjenning av en GMO måtte gis to vedtak for samme GMO i Norge – «two doors – two keys». Vedtakene kan være like (forbud eller godkjenning) eller ulike. Ulike vedtak for den samme GMO kan innebære både praktiske og kommunikasjonsmessige utfordringer, og det vil bli krevende og konkurransevridende for virksomhetene. Videre er det ikke utredet om EU-kommisjonen vil akseptere at det er to kompetente myndigheter for ett regelverk i Norge.
En videreføring av dagens forvaltningsansvar følger ikke det som ellers er det ordinære sektorprinsippet i Norge og i EU, hvor matforvaltningen har ansvaret for mat, fôr og innsatsvarene med et stort og profesjonelt veilednings- og kontrollsystem over hele landet. Matforvaltningen har videre ansvaret for regelverket for godkjenning av plantevernmidler, som er et forvaltningsområde som har likhetstrekk med GMO-området og hvor det kan anføres at Mattilsynet har stor fagkompetanse, både med hensyn til helse- og miljørisikovurderinger.
Flertallet mener det er mest hensiktsmessig og naturlig å samle forvaltningsansvaret for alle deler av matkjeden, inkludert GMO til mat og fôr, i matforvaltningen. Dette er mer i tråd med matforvaltningen for øvrig både i EU og i Norge, og kan gi en betydelig effektivisering av dagens forvaltning. Det er et tydelig politisk signal at utviklingen i norsk økonomi gjør det nødvendig å effektivisere offentlig sektor generelt. Det er også tidligere vurdert at det bør gjennomføres forenklinger og effektiviseringer for forvaltningsområdet GMO mat og fôr i Norge, og at effektivisering av forvaltningen bør være på plass før innlemmelse av EUs regelverkspakke for genmodifisert mat og fôr. I påvente av implementering av regelverk og overføring av forvaltningsansvar, er det viktig at oppdragene til VKM om forhåndsvurdering av produkter som faller innunder mat- og fôrforordningen innrettes slik at vurderinger av om det foreligger særnorske forhold som krever ytterligere vurderinger er klare når EU-kommisjonen tar opp risikovurderingene. Dette vil også sikre at produktene raskere kan tas inn i Norge når forordningen implementeres og gjennomføres i norsk rett.
Et stort og sammenhengende underliggende regelverk, kontrollforordningen, importkontrollregelverket med tollsamarbeidet og nytt overbygg om bærekraftige matsystemer (EUs farm-to-fork) som gjelder for all mat, fôr og innsatsvarer for øvrig, ligger under EUs matlov (gjennomført i den norske matloven). Det er derfor vanskelig å se at det vil gi en enhetlig og helhetlig forvaltning som samtidig er effektiv og rasjonell, hvis deler av GMO-området skal ligge utenfor matforvaltningen. Fordelen med å tilrettelegge for flertallsmodellen i nær fremtid, i stedet for å vente til innlemmelse av GM-pakken, er at tilpasningen samtidig bereder for nødvendige endringer på det tidspunktet Norge innlemmer dette regelverket. Viktigheten av gevinster som effektivisering av dagens forvaltning og en mer strømlinjeformet modell som er enklere å kommunisere og forstå for de ulike aktørene, kan også vektlegges. Og ikke minst, en samlet forvaltning av alt regelverk på matområdet vil gjøre det enklere å helhetlig utvikle matsystemene i en mer bærekraftig retning.
I mandatet til genteknologiutvalget fremgår det at forvaltningen av genteknologi og genmodifiserte organismer ikke kan være så forskjellig fra den i EU. Ved å samle all forvaltning av mat og fôr under én forvaltningsmyndighet, vil prinsippet for forvaltningsansvaret i flertallets modell likne på en variant som flertallet i utvalget tilrår om ansvarsdeling og forvaltning av klinisk utprøving av legemidler. Det vil også være i tråd med ordinært sektorprinsipp. Flertallet mener videre at miljøforvaltningen kan høres i saker der det vil være hensiktsmessig. Organismer som er fremstilt med genteknologi og ikke er til mat og fôr, bør som i dag forvaltes av miljøforvaltningen etter genteknologiloven, og matforvaltningen kan høres i saker der det er hensiktsmessig. Flertallsmodellen vil kreve endringer i genteknologiloven, i forskrifter under matloven og muligens også matloven, herunder slik at det kan fastsettes differensierte krav til godkjenning mv. basert på prinsippet om risikoproporsjonalitet.
Flertallet ser det som hensiktsmessig at beslutningsmyndighet etter genteknologiloven overføres fra KLD til Miljødirektoratet for PB og GMO som ikke er til mat, fôr eller legemidler. Mattilsynet bør være beslutningsmyndighet for mat og fôr, herunder også levende PB og GMO. Slik blir forvaltningen mer enhetlig og mindre politisk, samt at beslutningsprosessen etter genteknologiloven vil gjennomføres på vesentlig kortere tid enn i dag. Det er utarbeidet et endringsforslag i genteknologiloven for å lette en slik overføring av myndighet, se kapittel 10.7.5.3 i utkastets genteknologilov § 2 første ledd, første setning.
Anbefaling: Flertallet foreslår at matmyndighetene kan vurdere nærmere hvordan man sikrer tilstrekkelig hjemmel i matloven slik at alle forhold som ligger inne i begrepet etisk forsvarlighet, herunder bærekraft, kan ivaretas når matforvaltningen fatter vedtak om godkjenning, begrensning av eller totalforbud mot innhold av eller produkter laget fra presisjonsavlede eller genmodifiserte organismer. Flertallet mener tilpasninger må ses i lys av kommende bærekraftsregelverk på matområdet generelt. Flertallet legger videre til grunn at matloven sikrer at det ikke kommer uforsvarlige produkter på markedet, og at det anses lite sannsynlig at ikke-bærekraftige produkter vil godkjennes for bioproduksjon i Norge. Flertallet oppfordrer forvaltningen til straks å igangsette arbeidet med å tilpasse norsk regelverk i henhold til innholdet i begrepet etisk forsvarlighet, både på genteknologiområdet og på matområdet generelt.
Anbefalingen ligner den som utvalget har foreslått for mandatpunktet om å vurdere norsk praksis for vurdering og godkjenning av GMO-legemidler til klinisk utprøving (se kap. 12). Der ble praksisen om at samme søknad behandles av to instanser gjennomgått. Søknader om slik klinisk utprøving av GMO-legemidler ble behandlet både av Legemiddelverket og av Miljødirektoratet etter henholdsvis legemiddelloven og genteknologiloven. Ordningen ble ansett å være tungvint og med lang saksbehandlingstid.
Etter en høringsrunde ble det i november 2021 besluttet at myndigheten til å behandle søknader om klinisk utprøving av GMO-legemidler etter genteknologiloven skulle overføres fra Miljødirektoratet til Legemiddelverket. Myndighetsoverføringen gjelder både legemidler til mennesker og til dyr, og formålet med myndighetsoverføringen har vært å forenkle søknadsprosessen for søker og øke antallet kliniske utprøvinger med (nye) GMO-legemidler i Norge slik at norske pasienter får muligheten til å prøve disse. Utvalget anbefaler at myndigheten for GMO-legemidler beholdes hos helseforvaltningen, men at ved godkjenning etter genteknologiloven skal Legemiddelverket i alle saker innhente uttalelse fra Miljødirektoratet, samt en vurdering fra VKM, som grunnlag for beslutningen. I miljørisikovurderingen skal det legges avgjørende vekt på uttalelsene fra miljømyndighetene. Disse anbefalingene beskrives nærmere i kapittel 12.
Flertallet anbefaler videre i kapittel 12 at GMO-legemidler i sin helhet reguleres i helseregelverk. Flertallet legger opp til at kravene til kliniske studier legges til en egen forskrift. Denne forskriften mener flertallet bør forvaltes av helsemyndighetene, slik at det blir en helhetlig regulering og praksis både på GMO-legemidler spesielt, men også i sammenheng med legemiddelområdet generelt. Dette bør gjelde kliniske studier til både mennesker og dyr. Flertallet anbefaler videre at også selve lovgrunnlaget for GMO-legemidler i sin helhet legges til legemiddelloven. Dette vil gjøre det enklere å utvikle regler og praksis på tvers av teknologiområder innen helse i fremtiden, og sikre en enhetlig forvaltning av både det rettslige grunnlaget og forvaltningsansvaret.
Flertallet anbefaler at utsetting til natur- og miljøformål beholdes i genteknologiloven og at disse reglene forvaltes av Miljødirektoratet og KLD som i dag. Det forventes at også på dette området vil det komme mange relevante bruksområder for genteknologi. Allerede i dag er aktuelle produkter under utvikling, eksempelvis genredigerte, sterile hagevekster (fremmede arter) som kan ha mindre spredning til miljøet enn de konvensjonelle vekstene. I fremtiden vil aktuell bruk kunne være eksempelvis genmodifiserte trær til karbonlagring eller genmodifiserte mikroorganismer til bioremediering (nedbrytning av plast i naturen m.m.), som beskrevet i kapittel 7.
Når anbefalingene om forvaltningsansvar og regelverksorganisering for de ulike områdene GMO mat og fôr, GMO-legemidler og annen bruk ses i sammenheng, utgjør flertallets forslag som vist i figur 10.5, en enhetlig og ressurseffektiv organisering i tråd med sektorprinsippet. En fellesnevner for vurdering av søknader om PB og GMO til henholdsvis mat og fôr, legemidler og annen bruk, er at VKM skal gjøre en forenklet eller full risikovurdering. Det er hensiktsmessig med tanke på å sikre et konsistent beslutningsgrunnlag på tvers av ulike sektoransvar og på tvers av ulike lover. Figur 10.5 viser hvordan forvaltningsansvaret og regelverket i så fall vil fordeles på de ulike områdene. Innesluttet bruk som forvaltes av Helsedirektoratet er ikke med i figuren. Det er ikke foreslått noen endringer av forvaltningsansvaret når det gjelder innesluttet bruk av GMO-legemidler i klinisk utprøving av legemidler til mennesker og dyr.
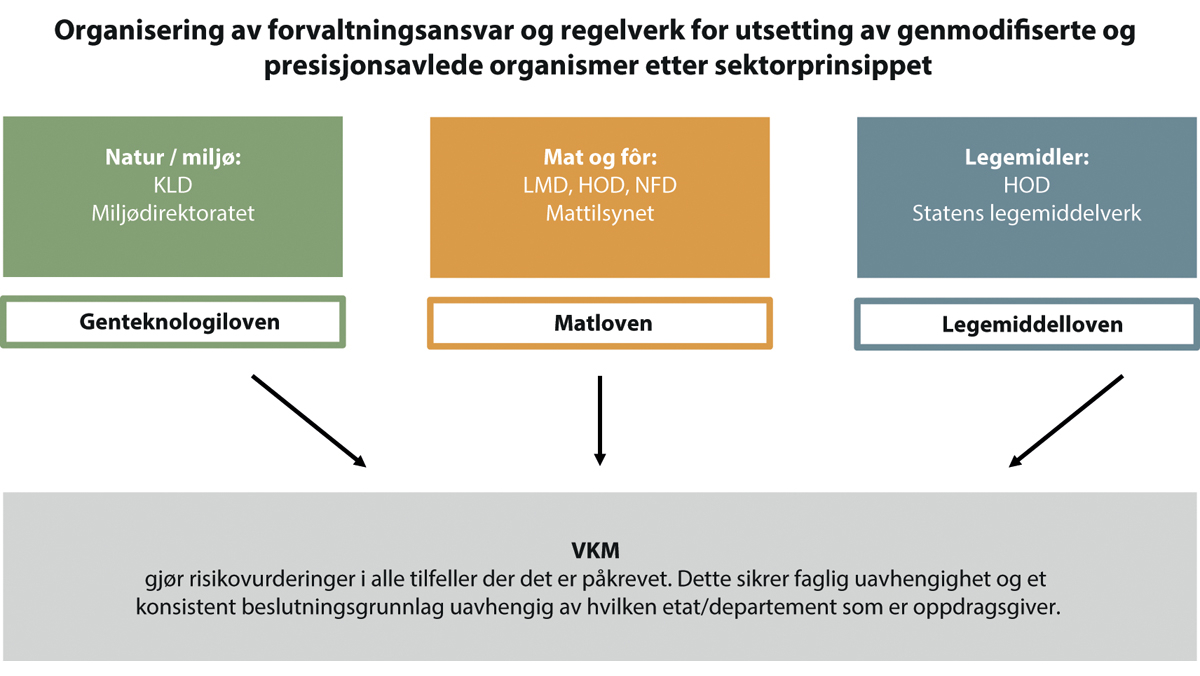
Figur 10.5 Flertallets anbefaling om forvaltningsansvar og regelverksorganisering i tråd med sektorprinsippet.
10.2.6 Mulige veier for gjennomføring av flertallsmodellen og EU-harmonisering
10.2.6.1 Harmonisering med EU med norsk overgangsordning
Flertallet har to hovedmål med sine anbefalinger: Forenkle og differensiere reguleringen i henhold til den foreslåtte modellen (nivådeling og skille mellom PB og GMO), samt harmonisere regelverk og forvaltning med EU for å sikre et velfungerende indre marked og tilgang på EU-godkjente produkter på det norske markedet.
Imidlertid begrenses begge disse målene av at Norge (og Island) ennå ikke har innlemmet EUs regelverk for genmodifisert mat og fôr i EØS-avtalen: godkjente GM-produkter blir ikke ferdigbehandlet og tilgjengelige i Norge og forventede endringer i EU-regler for nye genteknikker (i flertallets modell omtalt som PB) vil ikke kunne tas inn i Norge fordi de antakelig vil hjemles i forordningen. I et fremtidig scenario (med uviss tidslinje) vil forordningene være implementert, og norsk regelverk og forvaltning være harmonisert med EU. Men i påvente av dette kan Norge gjøre tilpasninger i nasjonalt regelverk som i praksis vil gi større grad av harmonisering enn i dag. Videre kan Norge potensielt gjennomføre forenklinger i reguleringen av PB-produkter og -organismer til mat og fôr allerede før EU har gjennomført sine lovendringsprosesser. Det er nemlig usikkert når EUs NGT-regelverk ferdigstilles og trer i kraft, da den politiske behandlingen i Rådet og Europaparlamentet kan ta lang tid. GMO- og PB-produkter som faller inn under matloven er i dag derfor kun underlagt nasjonal regulering inntil videre, og det gir flere mulige alternativer for regelverkstilpasninger for PB og GMO under matloven.
Flertallet mener at frem til EUs nye NGT-regelverk har trådt i kraft, må det nasjonale handlingsrommet utnyttes slik at den differensierte reguleringsmodellen kan tas i bruk i Norge for å fremme innovasjon og bærekraftig utvikling. Endringer kan forholdsvis enkelt gjennomføres for produkter som allerede omfattes av matloven (prosesserte mat- og fôrprodukter). Følges flertallets anbefalinger om flytting av regler for levende GMO mat- og fôr fra genteknologiloven til matloven, kan en tilsvarende forenkling gjøres for alle organismer og produkter som skal inngå i matsystemene, inkludert nasjonal produksjon.
Før genteknologiloven endres, er PB definert som GMO (f.eks. PB-GMO). Muligheten for differensierte godkjenningskrav for PB-GMO må vurderes nærmere, herunder hvordan KU-forskriften kan revideres for å kunne differensiere krav til miljørisikovurdering og operasjonalisere BSE til ‘etisk forsvarlighet’.
I forskrifter under matloven må det innføres differensierte krav til forsøksutsetting, godkjenning og merking av henholdsvis PB og GMO og tilhørende saksbehandlingsnivå avhengig av produktets egenskap og teknologi. Videre må VKM utarbeide retningslinjer for forenklede risikovurderinger, og det må gjøres unntak fra krav om GMO-merking for PB-produkter. Veiledere må utarbeides i henhold til forslagene etter denne modellen.
Flertallet anbefaler imidlertid beslutningstakere å også skjele til anbefalingene fra EU om genredigerte planter, som forventes å komme kort tid etter at denne NOU-en er lagt frem, med sikte mot fremtidig harmonisering på viktige områder. Det anbefaler videre at det kan være hensiktsmessig med en egen juridisk vurdering av hvilke konsekvenser EU-dommen fra 201846 om at organismer/produkter fremstilt med nye teknikker reguleres som GMO, har for Norge – både ved dagens regulering og fremtidige scenarioer for regelverksendring.
Flertallet mener videre at det også må gjøres materielle tilpasninger i regelverket under matloven slik at norske aktører får like konkurransevilkår som EUs virksomheter når det gjelder muligheten for å kunne ta i bruk GMO som per i dag er godkjent i EU. Norge bør i så fall legge til grunn både EFSAs risikovurderinger og VKMs parallelle risikovurderinger av eventuelle særnorske forhold for slike produkter.
Det er foreløpig et marginalt marked for genmodifiserte matvarer, og GMO benyttes i liten grad direkte i matvarer i EU. I EU importeres og omsettes imidlertid store mengder genmodifisert fôr til bruk i kjøttproduksjon. Norske fôrprodusenter, særlig fiskefôrprodusenter, ønsker tilgang til genmodifiserte, prosesserte fôrråvarer for å forebygge en ikke-bærekraftig økning av kostnadene som følge av redusert tilgang på GMO-frie fôrråvarer. På samme måte som det er unntaksbestemmelser i genteknologiloven for GMO som godkjennes i EU etter utsettingsdirektivet, er det mulig å endre fôrregelverket under matloven slik at det ikke kreves godkjenning i Norge for EU-godkjent GMO. Matforvaltningen vurderer for tiden om det kan være aktuelt å åpne opp for EU-godkjente, prosesserte GM-fôrråvarer som er godkjente i EU og vurdert av VKM. Flertallet støtter at det åpnes opp for slike genmodifiserte, EU-godkjente fôrråvarer som en overgang til full harmonisering med EUs regelverk. Dersom regler for levende genmodifisert mat og fôr flyttes fra genteknologiloven til matloven, slik utvalgsflertallet anbefaler (beskrevet i kap. 10.2.7.5.2), vil en slik overgangsordning kunne gjelde både levende og prosesserte EU-godkjente mat- og fôrprodukter.
Flertallet mener at parallelt med disse regelverksendringene må den forvaltningsmessige ansvarsfordelingen endres slik at Mattilsynet snarest mulig får ansvaret også for levende GMO til mat og fôr. I påvente av at de foreslåtte lovendringene om en slik overflytning formelt gjennomføres, kan forvaltningsansvaret for genmodifisert mat- og fôrprodukter etter genteknologiloven delegeres fra Klima- og miljødepartementet til matmyndighetene (Helse- og omsorgsdepartementet, Landbruks- og matdepartementet og Nærings- og fiskeridepartementet). Klima- og miljødepartementet delegerte tilsynsmyndighet etter genteknologiloven til Mattilsynet allerede i 2004 for tilsyn og offentlig kontroll av mat og fôr med mulig innhold av ulovlig GMO. Klima- og miljødepartementet kan på samme måte delegere godkjenningsmyndigheten for GMO mat og fôr til matmyndighetene.
10.2.6.2 Trinnvis endring
Utvalgsmedlemmene foreslår endringer i det norske regelverket i tre trinn, se også figur 10.6:
1. Tilpasning av eksisterende matregelverk for prosessert mat og fôr
a. Differensiering av regler for prosesserte mat- og fôrprodukter utviklet med genteknologi i henhold til flertallsmodellen: En differensiering av godkjenningsprosedyren og andre krav (merking m.m.) for prosesserte GMO- og PB-produkter, som allerede hører inn under matloven, kan gjøres forholdsvis raskt ved revisjon av forskrifter under matloven. Det må vurderes om det behøves en ny bestemmelse i matloven som utvider lovens formål slik at alle hensynene under vurdering av etisk forsvarlighet, herunder særlig bærekraft, omfattes i henhold til utvalgsflertallets anbefalinger for å gi en dekkende forskriftshjemmel.
b. Endring av fôrforskriften under matloven slik at det ikke kreves godkjenning i Norge for prosesserte GM-fôrråvarer som er godkjente i EU og vurdert av VKM å være uten særnorsk risiko.
2. Flytting og tilpasning av regler og forvaltningsansvar for all mat og fôr
a. Endring av forvaltningsmessig ansvarsfordeling slik at Mattilsynet får sektoransvaret også for levende GMO til mat og fôr. Myndighet etter genteknologiloven kan delegeres fra Klima- og miljødepartementet til matmyndighetene i påvente av lovendringer.
b. Flytting og forenkling av regler for levende mat- og fôrprodukter utviklet med genteknologi: For å kunne gjøre en tilsvarende tilpasning for levende GMO- og PB-produkter til mat og fôr, må genteknologiloven endres slik at regulering av all mat og fôr legges til matloven. En slik flytting er uansett hensiktsmessig for å organisere regelverket slik EU gjør («one door – one key»), som vil være ressursbesparende for den norske forvaltningen og sikre en mer samkjørt godkjenningsprosess for alle produkter som inngår i matsystemene. Det vil også sikre at fremtidige regelverksendringer fra EU, blant annet oppmykning av regler for visse produkter laget med nye genteknikker (PB-produkter i flertallets modell), kan harmoniseres uten forsinkelse. Disse EU-reglene kommer etter all sannsynlighet til å hjemles i mat- og fôrforordningen i EU, som Norge ikke har innlemmet per i dag. Ved å legge de norske reglene for all mat og fôr under matloven, kan reglene harmoniseres i praksis mens det jobbes med implementering.
3. Fullharmonisering med EUs regelverk for mat og fôr utviklet med genteknologi
På sikt er målet en fullharmonisering med EU for å sikre etterlevelse av intensjonene i EØS-avtalen, et fungerende indre marked samt like konkurransevilkår for norske og europeiske aktører. I dette scenariet er mat- og fôrforordningen gjennomført i norsk rett. Videre er norske regler for nye genteknikker harmonisert med EUs. Dette vil for eksempel være eventuelle lettelser for genredigerte planter. Flertallet ser slike lettelser som noe EU sannsynligvis vil foreslå i første omgang, mens tilsvarende lettelser for genredigerte dyr og mikroorganismer antas å komme senere. Det vil antagelig ta minst et par år før disse regelverksendringene er endelig utarbeidet og vedtatt i EU. Slik harmonisering vil ikke være mulig dersom man beholder dagens organisering av norsk regelverk, selv om harmonisering er intensjonen etter EØS-avtalen. Nye EU-regler for genredigerte mat- og fôrprodukter kan antakelig ikke innlemmes i EØS-avtalen før GM mat- og fôrforordningen innlemmes. Det betyr at Norge kan gå glipp av en rekke produkter. Et slikt scenario, der det blir en vesentlig enklere vei for genredigerte produkter til EU-markedet enn det norske, vil sette Norge i en uheldig konkurransemessig posisjon. I ytterste konsekvens vil norske innovasjoner godkjennes i andre land, men ikke i Norge. Flertallet anbefaler at en harmonisering av norsk regelverk med EUs regelverk fungerer som en rød tråd for alle revideringer av regelverk på området. Dette vil sikre like konkurransevilkår og et velfungerende indre marked.

Figur 10.6 Trinnvis endring av det norske regelverket.
10.2.6.3 Hvorfor disse grepene nå?
En snarlig forenkling av det norske regelverket gir Norge en unik mulighet til å etablere nytt reguleringssystem og gi raskere tilgang til nye, genredigerte produkter for norske matprodusenter enn i Europa for øvrig. Dette vil særlig være en fordel for norske utviklere som utvikler produkter for det norske markedet. Det vil også kunne gi betydelige fordeler for forskning og innovasjon innen genteknologi i Norge, siden regler for forsøksutsetting også vil kunne forenkles sammenlignet med EUs regelverk inntil nytt EU-regelverk er vedtatt. Norge har relativt sett lite forskning og innovasjon innen genteknologi sammenlignet med andre land både i Europa og i verden, og har således et vanskelig utgangspunkt konkurransemessig. En rask implementering av forenklede regler for presisjonsavlede (PB-) produkter og organismer vil potensielt kunne bidra til både å stimulere til mer innovasjon i Norge samt gjøre Norge til et attraktivt land for markedsføring av nye produkter fra internasjonale utviklere. Dette kan være produkter i ulike ledd i verdikjedene; i primærproduksjon (eksempelvis husdyr, fisk, korn, grønnsaker og frukt), bearbeidede produkter som kjøtt og melk, samt ingredienser i sammensatte, prosesserte produkter som mel eller oljer i industrileddet.
Forhåpentligvis kan en slik periode med Norge som «pilot» for differensierte regler for PB og GMO også bidra til å demonstrere for europeiske beslutningstakere hvordan et slikt system kan fungere, og derigjennom påvirke EUs fremtidige regelverk. Det vil også gi verdifull erfaring for den norske forvaltningen.
10.2.7 Forslag til regelverksendringer
10.2.7.1 EUs regulering og forvaltning av området
Gjennom EØS-avtalen er Norge tett tilknyttet GMO-reguleringen i EU. I mandatet til NOU-utvalget fremgår det at forvaltningen av genteknologi og genmodifiserte organismer i Norge derfor ikke kan være så forskjellig fra den i EU. Mat og fôr, inkludert genmodifisert mat og fôr, reguleres i EU av EUs matlovsforordning (forordning (EF) nr. 178/2002) og genmodifisert mat og fôr av rettsaktene i den såkalte GM-pakken (forordning (EF) nr. 1829/2003) m.fl.). Disse rettsaktene er sammen med kontrollforordningen (EU) 2017/625, hovedrammeverket for godkjennings-, sporbarhets- og merkekrav, samt for kontroll og overvåkning av GMO til bruk som mat og fôr, mens det refereres til utsettingsdirektivet for GMO-definisjonen og kravene for miljørisikovurderingen. Kravene til helserisikovurderingene finnes i en egen rettsakt med hjemmel i GM mat- og fôrforordningen (EF) nr. 1829/2003. I tillegg har EFSA og EUs felles forskningssenter (JRC) utviklet flere ulike veiledningsdokumenter til bruk i risikovurderinger. Mer detaljer om EUs regelverk for genmodifiserte produkter finnes i kapittel 6.
10.2.7.2 EUs pågående og sektoroverskridende arbeider med relevans for GM-området
Det fokuseres nå på bærekraft på svært mange områder og på tvers av tradisjonelle sektorer i EU. EUs «Green Deal» omfatter blant annet en biodiversitetsstrategi, en kjemikaliestrategi, en handlingsplan for sirkulær økonomi og en for nullforurensning. «Green Deal» omfatter også den store bærekraftstrategien for matområdet «Farm to Fork» (F2F), som i nær fremtid vil sette standarden for bærekraftige matsystemer og gjelde hele matområdet, især for produktgrupper som er omfattet av godkjenningsordninger (bl.a. GMO). EU har i tillegg pågående arbeider om bærekraftige produkter og «green claims» som også vil kunne bli relevante for GMO-området.
EU-kommisjonen arbeider for å etablere det rettslige grunnlaget for de systemiske endringene som er nødvendige for å akselerere overgangen til et mer bærekraftig matsystem, samt å stimulere til økt produksjon av bærekraftig mat. Kommisjonens Generaldirektorat (DG) Sante leder arbeidet sammen med DG-ene Envi, Agri og Mare. Regelverket skal fastsette generelle mål, prinsipper og felles definisjoner for hele matområdet, og dekke hele bærekraftsbegrepet (miljømessige, sosiale og økonomiske forhold m.fl.). Det skal favne alle aktører og alle forhold, herunder produksjon, prosessering, mat og fôr (inkl. frø, GMO, gjødsel, plantevernmidler, veterinærmedisin, animalske biprodukter m.fl.), samt tilsynet og kontrollen. Av tiltak som diskuteres er blant annet «push/pull», hvor man skal ha regelverk og tiltak som kutter ut de minst bærekraftige operasjonene og produktene, samtidig som man har regelverk og tiltak som stimulerer til nye, bærekraftige metoder og produkter.
Signaler fra Kommisjonen tyder på at det blir laget et eget rammeregelverk for bærekraftige matsystemer «ved siden av» Food Law. Dette diskuteres nå i en ekspertgruppe i EU der LMD, HOD og Mattilsynet deltar.
10.2.7.3 Overføring av forvaltningsansvar fra miljø- til matforvaltningen
I Norge regulerer matloven alle mat- og fôrprodukter, unntatt de antatt formeringsdyktige GMO mat og fôrproduktene som reguleres av genteknologiloven og tilligger miljøforvaltningens ansvarsområde. Reguleringen av genmodifisert mat og fôr i Norge følger med andre ord ikke det som ellers er det ordinære sektorprinsippet i både Norge og i EU, hvor matforvaltningen har ansvaret for mat, fôr og innsatsvarene. Matforvaltningen har videre ansvaret for regelverket for godkjenning av plantevernmidler, som er et forvaltningsområde som har likhetstrekk med GMO-området og hvor det kan anføres at Mattilsynet har stor fagkompetanse, både med hensyn til helse- og miljørisikovurderinger.
I den norske genteknologiloven fra 1993 er bærekrafthensyn allerede lovfestet. Det er gjennomført eller igangsatt flere konkrete regelverksprosesser for å inkludere bærekraft i ulike eksisterende regelverk under EUs matlov, blant annet om bærekraftig bruk av plantevernmidler, merkeregler om matsvinn, om bruk av nye fôr- og fôrtilsetningsstoffer og om dyrevelferd. Mattilsynet gjennomfører disse endringene i regelverk under matloven. Regelverket for planteformeringsmateriale (12 direktiver) er også gjenstand for en totalgjennomgang for blant annet å se på hvordan bærekraftkriteriet bør inngå i prøvingen av nye plantesorter.
Dagens forvaltning er lite effektiv og medfører dobbeltarbeid i flere etater. Kombinasjonen av EØS- og nasjonalt regelverk gir dårligere konkurransevilkår for norske virksomheter sammenlignet med næringsvirksomhetene i EU. I EU fattes kun ett vedtak for all bruk av en GMO til mat og fôr («one door-one key»-prinsippet), mens i Norge må det fattes to vedtak for den samme GMO. Vedtakenes konklusjon kan også være ulike og de kan fattes på ulikt tidspunkt.
Ulike forslag om effektivisering av forvaltningen er fremsatt både gjennom vurderinger gjort av Mattilsynet og Miljødirektoratet og i forbindelse med en områdegjennomgang av hele miljøforvaltningen i 2016 (se kap. 10.2.5).
Mattilsynet ble i sin tid tillagt ansvaret for «en helhetlig forvaltning av matområdet» og matloven er hjemmelsgrunnlaget for regulering av forhold langs hele matproduksjonskjeden fra primærproduksjon til omsetning – fra jord/fjord til bord («farm-to-fork»). I tråd med tildelt sektoransvar, er Mattilsynet derfor ansvarlig myndighet for alle hensyn som skal ivaretas for hele matkjeden, herunder mattrygghet, plante- og dyrehelse, dyrevelferd, miljøhensyn og miljøvennlig produksjon, kvalitet og forbrukerinteresser. Virkeområdet er gjort bredt for å fange opp hele kjeden fra fjord/jord til bord og kunne omfatte alle bestemmelser som har direkte eller indirekte innvirkning på næringsmidler og innsatsvarer. Alle ledd i produksjon, bearbeiding og distribusjon av næringsmidler og innsatsvarer er omfattet, blant annet med godkjenning av plantevernmidler, såvarer og tildeling av planteforedlerrett.
Med unntak av at godkjenningskravet for antatt formeringsdyktige GMO til bruk som mat og fôr er hjemlet i genteknologiloven, er all annen regulering av disse produktene, uavhengig av om de er levende eller døde, regulert av matloven (se bl.a. kap. 6.4.3). Siden 2004 har Mattilsynet dessuten hatt delegert myndighet etter genteknologiloven §§ 18 – 21 og § 24 for tilsyns- og vedtaksansvar for import og omsetning av levende GMO i mat, fiskefôr og innsatsvarer i landbruket (fôrvarer, såvarer, plantedeler m.m.). Myndighet er ikke delegert for GMO som ikke er til mat og fôr, herunder prydplanter, akvariefisk og andre hobby- og kjæledyr som Mattilsynet ellers fører tilsyn med etter annet regelverk i matloven. Miljødirektoratet fører tilsyn med GMO som ikke er til mat og fôr.
10.2.7.4 Videre politisk prosess i oppfølgingen av NOU-en
Fordi genteknologiregelverk- og forvaltning dekker mange sektorer og har viktige koblingspunkter opp mot andre regelverk særlig på områdene mat og helse (se kap. 6.10.6), anbefaler flertallet at høringene som følger av utredningen sendes felles fra alle de fire berørte departementene (KLD, LMD, HOD og NFD). Den videre politiske prosessen bør også håndteres av de fire departementene i fellesskap. I spørsmål som berører utenrikspolitiske områder bør også Utenriksdepartementet konsulteres.
10.2.7.5 Regelverksendringer
10.2.7.5.1 Anbefalinger – tilliggende områder
Kloning reguleres av genteknologilovens kapittel 3 a) og er ikke et område som er omfattet av dette utvalgets mandat. Flertallet ser dog at området er nært beslektet med GM-området og ønsker derfor å anbefale at myndighetene ser på dette området bredere og vurderer endringer på tvers av alle typer teknologier ved neste gjennomgang av regelverket.
10.2.7.5.2 Om endringer av myndighet
For å gjennomføre en endring av forvaltningsansvaret for genmodifisert mat og fôr slik at systemet harmoniserer med EU, samt endres fra full godkjenning av alle typer GMO til en differensiert reguleringsmodell for PB og GMO, er det to alternative fremgangsmåter.
Alternativet som best tilrettelegger for en harmonisering med EUs GM mat- og fôrregelverk, er at GMO mat og fôr som i dag omfattes av genteknologiloven unntas fra denne loven, men at genteknologiloven fortsetter å regulere øvrige produktgrupper. Matlovens virkeområde omfatter allerede levende og prosessert, genmodifisert mat og fôr, og den hjemler krav om godkjenning for å omsette eller markedsføre mat- og fôrprodukter som består av, inneholder eller er fremstilt på grunnlag av GMO. Det er imidlertid satt inn unntak fra godkjenningskrav i forskriftene under matloven for produkter som reguleres etter genteknologiloven.47,48 Genmodifiserte mat- og fôrprodukter som ikke reguleres av genteknologiloven, vil dermed reguleres av matloven og dens forskrifter. Matloven, og forskrifter under denne, må imidlertid endres slik at alle genmodifiserte mat- og fôrprodukter reguleres på den måten flertallet ønsker, herunder at de skal vurderes opp imot kriteriet etisk forsvarlighet som blant annet inkluderer bærekraft.
En annen fremgangsmåte kan være å delegere myndighet etter genteknologiloven og tilhørende forskrifter til matforvaltningen, slik at det fattes vedtak med hjemmel i to lover. Sistnevnte vil antakelig medføre involvering av begge sektorer og er mindre aktuelt. Flertallet anbefaler det første alternativet og at genteknologiloven innskrenkes til å gjelde andre produkter enn GMO mat og fôr (og legemidler), se forslag til endringer i genteknologiloven § 2 første ledd som ivaretar dette (kap. 10.2.7.5.3).
10.2.7.5.3 Om endringer i genteknologiloven og matloven
I tråd med prinsippet om en differensiert regulering basert på risiko, skal organismer med midlertidige, ikke arvbare genetiske endringer, unntas regulering etter GMO-regelverk. Denne anbefalingen er en essensiell del av flertallsmodellen. Det følger av dette at genteknologiloven § 2 må endres, for å presisere at slike midlertidige genetiske endringer i en organisme ikke medfører at organismen faller inn under noen av lovens definisjoner. Eksempler på endringer som ikke skal dekkes av regelverket er epigenetiske endringer, metoder der mRNA og siRNA brukes for å transient påvirke genutrykk, og mRNA- og DNA-baserte, ikke-integrerende vaksiner.
For å tilpasse gjeldende regelverk til flertallsmodellen, behøves endringer i både genteknologiloven og matloven. Definisjoner i genteknologiloven må skille mellom GMO og PB. Videre må det også skilles i godkjenningskrav for GMO og PB i genteknologiloven. Det må videre vurderes om forskrifter under genteknologiloven bør oppdateres og presiseres (forskrift om merking, transport, import og eksport av genmodifiserte organismer). Herunder må man også regulere en hurtigprosedyreadgang for godkjenning av GMO-produkter som skal dekke store, udekkede behov i samfunnet. Forskrift om konsekvensutredning etter genteknologiloven må endres for å tilpasse ulike nivåer av krav til miljørisikovurderinger. Forslag til slike lovendringer i genteknologiloven følger nedenunder.
Flertallet har kommet med en anbefaling om at det må sikres tilstrekkelig hjemmel i matloven slik at de ulike hensyn som faller inn under vurdering av etisk forsvarlighet kan vektlegges i godkjenningsløpene. Alternativt må det utarbeides en egen, horisontal forskrift som regulerer de ulike godkjenningsløpene med tilhørende sporbarhets- og merkekrav for PB og GMO som skal reguleres av matloven. Kriteriene historie med trygg bruk (HoSU) og familiaritet må defineres i underliggende regelverk, forskrifter og veiledere. Begrepet «etisk forsvarlighet» må utdypes i forarbeidene til lovendringen. Et slikt regelverk som her foreslås, vil harmonere bedre med EUs regelverk for disse produktene.
Flertallet er av den oppfatning at det er viktig at regelverket i Norge og EU er harmonisert. BSE-kriteriene slik de i dag er regulert i genteknologiloven, bør ikke videreføres på samme måte under matloven. Det vil ikke være i tråd med WTO-avtalen, og heller ikke harmonisere med EUs tilnærming til bærekraft med nytt regelverk for bærekraftsanalyse. Flertallet antar at innholdet i begrepet og kravene til etisk forsvarlighet vil være forenlig med EUs nye regelverk om bærekraftsanalyse og bærekraftige matsystemer, men detaljene i dette må diskuteres videre.
Genteknologiloven
Endringer fra dagens regelverk er fremhevet med overstrekning av lovtekst som utgår og ny lovtekst i kursiv.
§ 1. Lovens formål
Denne loven har til formål å sikre at framstilling og bruk av genmodifiserte og presisjonsavlede organismer og framstilling av klonede dyr skjer på en etisk og samfunnsmessig forsvarlig måte i samsvar med prinsippet om bærekraftig utvikling og uten helse- og miljømessige skadevirkninger.
Denne loven har til formål å sikre at framstilling av klonede dyr skjer på en etisk og samfunnsmessig forsvarlig måte, i samsvar med prinsippet om bærekraftig utvikling og uten helse- og miljømessige skadevirkninger.
§ 2. Lovens saklige virkeområde
Loven gjelder framstilling og bruk av genmodifiserte og presisjonsavlede organismer, med unntak av genmodifiserte organismer og presisjonsavlede organismer til mat og/eller fôr eller legemidler. Loven gjelder også framstilling av klonede virveldyr og krepsdyr. Lovens bestemmelser om genmodifiserte organismer gjelder også for stoffer og produkter som består av eller inneholder genmodifiserte organismer eller presisjonsavlede organismer, med unntak av slike stoffer og produkter til mat og/eller fôr eller legemidler.
Med mindre genmodifiserte organismer brukes som foreldreorganismer, gjelder loven ikke for framstilling ved hjelp av celleteknologi av
a. genmodifiserte planteceller når resultatet også kan oppnås ved tradisjonelle foredlingsmetoder, og
b. dyreceller i kultur der cellematerialet hentes fra ulike individer innen samme art og hvor cellene kunne oppstått ved naturlig formering, samt bruk av slike plante- eller dyreceller.
Med mindre hensikten er å fremstille et klonet individ, gjelder loven ikke for kloning av gener, celler og vev.
Loven gjelder ikke for framstilling av ikke-genmodifiserte klonede dyr som også kan forekomme som resultat av naturlige biologiske prosesser. Loven gjelder ikke framstilling og bruk av organismer med midlertidige, ikke arvbare genetiske endringer.
§ 4. Definisjoner
I denne lov menes med:
a) mikroorganismer: enhver cellulær eller ikke-cellulær mikrobiologisk enhet som er i stand til å formere seg eller til å overføre genetisk
b) genteknologi: teknikker som innebærer at arvestoff isoleres, karakteriseres, modifiseres og innsettes i levende celler eller virus.
c) presisjonsavlede organismer: mikroorganismer, planter og dyr der det er brukt genteknologiske metoder for å gjøre permanente og arvbare genetiske endringer innenfor artens genpool.
d) artens genpool: alt genetisk materiale og genvarianter som finnes i arten eller ville vært tilgjengelig ved endring av den aktuelle organismen ved bruk av konvensjonelle, ikke-regulerte teknologier.
e) genmodifiserte organismer: mikroorganismer, planter og dyr hvor den genetiske sammensetning er endret ved bruk av gen- eller celleteknologi der det er brukt genteknologiske metoder for å gjøre permanente og arvbare genetiske endringer utenfor artens genpool og hvor deler av eller hele endringen omfatter genetisk materiale som ikke er del av artens genpool.
f) celleteknologi: teknikker for framstilling av levende celler med nye kombinasjoner av genetisk materiale ved fusjon av to eller flere celler
g) klonet dyr: et dyr som har likt eller tilnærmet likt arvemateriale som et annet dyr
h) kloning av dyr: enhver teknikk for framstilling av dyr med likt eller tilnærmet likt arvemateriale.
§ 10. Krav om godkjenning av genmodifiserte organismer
Utsetting av genmodifiserte organismer kan bare skje etter godkjenning. Det kreves ikke godkjenning av annen utsetting av et produkt som er godkjent for omsetning etter denne bestemmelsen.
Utsetting av genmodifiserte organismer kan bare godkjennes når det ikke foreligger fare for miljø- og helsemessige skadevirkninger. Ved godkjenning av utsetting av genmodifiserte organismer til annet enn import, skal det vektlegges om utsettingen etter formålene i denne lov er etisk forsvarligVed avgjørelsen skal det dessuten legges vesentlig vekt på om utsettingen har samfunnsmessig nytteverdi og er egnet til å fremme en bærekraftig utvikling.
Kongen kan ved forskrift bestemme at utsetting som nevnt i § 9 bokstav g og h kan skje uten forutgående godkjenning når nærmere fastsatte vilkår er oppfylt, f.eks. vilkår om særskilt emballasje og merking av produkter. Det kan bestemmes at slik utsetting i stedet skal være meldepliktig.
Det kreves ikke godkjenning av eller melding om eksport, med mindre annet er bestemt ved forskrift gitt av Kongen.
Kongen kan i forskrift bestemme at bestemte typer genmodifiserte organismer kan settes ut i bestemte miljøer uten godkjenning etter første ledd første punktum. Slik utsetting skal i stedet være meldepliktig.
Det kreves ikke godkjenning for omsetning av et produkt som er godkjent for omsetning i et annet EØS-land etter reglene fastsatt i EØS-avtalen vedlegg XX punkt 25d (rådsdirektiv 2001/18/EF). Myndighetene etter loven her kan likevel forby eller begrense omsetningen dersom den etter deres syn medfører risiko for helse eller miljø, eller omsetningen for øvrig er i strid med denne lovs formål. Dersom den genmodifiserte organisme omsøkes til annet enn import, kan myndighetene også forby eller begrense omsetningen dersom den ikke oppfyller nasjonale krav til etisk forsvarlighet.
§ 10 a) Krav om godkjenning av presisjonsavlede organismer
Utsetting av presisjonsavlede organismer kan bare godkjennes når det ikke foreligger fare for miljø- og helsemessige skadevirkninger. Ved godkjenning av utsetting av presisjonsavlede organismer til annet enn import, skal det vektlegges om utsettingen etter formålene i denne lov er etisk forsvarlig.
Kongen kan gi forskrifter om begrensning av eller totalforbud mot innhold av presisjonsavlede organismer, og mot innhold av gener fra presisjonsavlede organismer.
Kongen kan i forskrift bestemme at presisjonsavlede organismer kan settes ut uten godkjenning. Det kan bestemmes at slik utsetting i stedet skal være meldepliktig.
§ 10 b) Forsøksutsetting
Forsøksutsetting av presisjonsavlede eller genmodifiserte organismer kan bare godkjennes når det ikke foreligger fare for miljø- og helsemessige skadevirkninger.
Kongen kan i forskrift bestemme at bestemte typer presisjonsavlede eller genmodifiserte organismer kan settes ut i bestemte miljøer som forsøk uten godkjenning.
§ 13. Offentlig høring
For framstilling og bruk av genmodifiserte organismer Ved saker som krever godkjenning etter denne loven, kan godkjenningsmyndigheten bestemme at det skal gjennomføres en offentlig høring. Det skal alltid gjennomføres offentlig høring i saker som gjelder godkjenning av søknad om utsetting av genmodifiserte organismer. Høring skal holdes i god tid før søknaden blir avgjort. Høringsprosessen må i så fall gjennomføres på en måte som sikrer at allmennheten, og i særlig grad berørte interessegrupper, får tilgang til relevant informasjon og gis en reell mulighet til å komme med synspunkter og kommentarer i saken.
Matloven – flertallets anbefalinger
Flertallet foreslår at matmyndighetene kan vurdere nærmere hvordan man sikrer tilstrekkelig hjemmel i matloven slik at alle forhold som ligger inne i begrepet etisk forsvarlighet, herunder bærekraft, kan ivaretas når matforvaltningen fatter vedtak om godkjenning, begrensning av eller totalforbud mot innhold av eller produkter laget fra presisjonsavlede eller genmodifiserte organismer. Flertallet legger til grunn at matloven sikrer at det ikke kommer uforsvarlige produkter på markedet, og at det anses som lite sannsynlig at ikke-bærekraftige produkter vil godkjennes for bioproduksjon i Norge. Flertallet oppfordrer forvaltningen til straks å igangsette arbeidet med å tilpasse norsk regelverk i henhold til innholdet i begrepet etisk forsvarlighet, både på genteknologiområdet og på matområdet generelt.
10.3 Mindretallets anbefaling. Modernisering av dagens regelverk og forvaltning (Moderniseringsalternativet)
10.3.1 Innledning
10.3.1.1 Bakgrunn for anbefalingen
Utvalgets mindretall, medlemmene Aina Bartmann, Ingvild Ulrikke Jakobsen, Kaare Magne Nielsen og Fern Wickson, foreslår en modernisering av GMO-regelverket. Alle anbefalinger om endringer er forslag til forenklinger, oppdateringer eller utredninger av dagens regelverk og forvaltning. Mindretallets anbefaling omtales i det følgende som moderniseringsalternativet.
Medlemmene som støtter moderniseringsalternativet mener genteknologi, inkludert nye metoder innen genredigering, har potensiale til å bidra til samfunnsnyttige og mer bærekraftige løsninger på en rekke samfunnsområder. For å sikre at genteknologien blir brukt på en måte som tjener samfunnet som helhet, mener disse medlemmene det er overordnet at et fremtidsrettet GMO-regelverk bidrar til å opprettholde tillit, trygghet og åpenhet. Lov og forvaltning må videre bidra til å redusere ulike typer usikkerhet og være fleksible for å kunne håndtere en rask utvikling av nye metoder og anvendelsesområder på genteknologiområdet. Regelverket må fremme etisk forsvarlighet og bidra til mer bærekraftig teknologi- og produktutvikling.
Omtalen av moderniseringsalternativet er delt i tre deler. Første del består av bakgrunn for mindretallets alternativ og en punktvis oversikt over anbefalinger om endringer (anbefaling 1-11), anbefalinger om å bevare og styrke (anbefaling 12 – 23) og anbefalinger om å utrede (anbefaling 24 og 25). Den andre delen utdyper anbefalingene med tilknyttede forslag til endringer. Den tredje delen omtaler hvilke overordnede vurderinger og hensyn som ligger til grunn for moderniseringsalternativet.
Mindretallets anbefaling er en modernisering av dagens regelverk og praksis og må derfor sees i sammenheng med omtalen av dagens regelverk. Dette regelverket omtales i kapittel 6 Dagens regulering og forvaltning av genmodifiserte organismer og avledete produkter. I tillegg er mange av anbefalingene forslag om modernisering av regelverk, veiledninger og praksis for risikovurdering. Dette omtales i kapittel 8 Risikoaspekter ved genteknologi og nye teknikker – risikoanalyse, regulering, regelverksprosesser og risikooppfatning.
Internasjonale avtaler innebærer også folkerettslige forpliktelser som har betydning for regulering av GMO. Disse avtalene omtales i kapittel 5 Internasjonale avtaler - forpliktelser og handlingsrom for GMO og avledede produkter. EUs arbeid med bærekraftige matsystemer.
Moderniseringsalternativet anbefaler å videreføre tilpasningsteksten i EØS-avtalen som gir norske myndigheter adgang til å forby EU-godkjente GMO-er bl.a. ut fra hensyn til bærekraft, samfunnsnytte og etikk. Etisk forsvarlighet omtales i kapittel 9 Etisk forsvarlighet av organismer & produkter utviklet med genteknologi.
Moderniseringsalternativet bygger på dagens regelverk og forvaltning, samt erfaringer og praksis utviklet i de tretti årene genteknologiloven har vært i bruk.
For å sikre et fortsatt høyt beskyttelsesnivå for helse og miljø anbefaler mindretallet å videreføre hovedtrekkene i dagens regulering. Mindretallet ønsker videre å legge til rette for forskning og innovasjon som kan bidra til bærekraftige organismer, produkter, prosesser og systemer. Det anbefales derfor en rekke teknologi-tilpassede oppdateringer og forenklinger av lover, forskrifter og forvaltningspraksis som skal gjelde for alle genmodifiserte organismer (GMO).
Moderniseringsalternativet er i tråd med Norges folkerettslige forpliktelser, deriblant forpliktelser som følger av Cartagenaprotokollen, EØS- og WTO-avtalen. Alternativet krever ikke endring av dagens EØS-regelverk for å kunne gjennomføres.
Ulike metoder innen genteknologi er i rask utvikling. Dagens genomteknikker vil forbedres og det vil utvikles metoder, anvendelsesområder og produkter vi ikke kjenner til i dag. Fremtidig regulering kan derfor ikke utformes på grunnlag av kjente teknikker og produkter, eller mulige prosesser og produkter beskrevet i dagens forskningslitteratur. Moderniseringsalternativet bygger på at et robust lovverk bør være generisk og fleksibelt slik at det kan tilpasses en rask utvikling både med hensyn til teknologisk utvikling og nye anvendelsesområder.
Moderniseringsalternativet legger vekt på at regelverk og forvaltning skal ha høy tillit i befolkningen. To sentrale virkemidler knyttet til myndighetenes behandling er åpenhet og høring. Innlemmelse av EUs åpenhetsforordning i EØS-avtalen med påfølgende endring av genteknologiloven § 12 er et viktig bidrag. Et viktig formål med forordningen i EU var å gjenopprette tilliten til EFSA, blant annet ved krav om at EFSA skal gjøre bruk av mer uavhengig forskning ved risikovurdering og kravet om konsultasjon med uavhengige forskere. Mindretallet anbefaler at samme krav til åpenhet skal stilles til VKM og Bioteknologirådet.
Mindretallet vil opprettholde dagens krav til åpen høring ved alle søknader om utsetting av GMO etter genteknologiloven. Høring kan ha betydning for utfallet i enkeltsaker, i tillegg kan høringer gi viktige innspill knyttet til etisk forsvarlighet og befolkningens verdisyn.
Moderniseringsalternativet legger også vekt på at myndighetene skal ha kontroll over bruk av genmodifiserte organismer og avledede produkter, samt at forbrukere sikres retten til informasjon. Moderniseringsalternativet understreker behovet for å sikre at framstilling og bruk av genmodifiserte organismer skal være uten helse- og miljømessige skadevirkninger, jamfør genteknologiloven § 1. For omtale av denne paragrafen, se kapittel 6 6.2.1.
I tråd med dette anbefales det at man opprettholder dagens regelverk som krever konsekvensutredning med en faglig risikovurdering fra sak til sak av alle organismer og avledede produkter som omfattes av definisjonen av genmodifiserte produkter. Denne fremgangsmåten er i tråd med EFSA og VKMs praksis ved risikovurdering og med både EFSA og VKMs anbefalinger knyttet til risikovurdering utviklet ved nye genomteknikker, jamfør kapittel 8. Hovedbegrunnelsen for dette er at det ikke er en lineær sammenheng mellom teknikken brukt, omfanget av en genmodifisering og endringen i organismens risikoprofil. Det innebærer at små genotypiske endringer kan ha betydelige fenotypiske eller miljømessige konsekvenser, og vice versa.
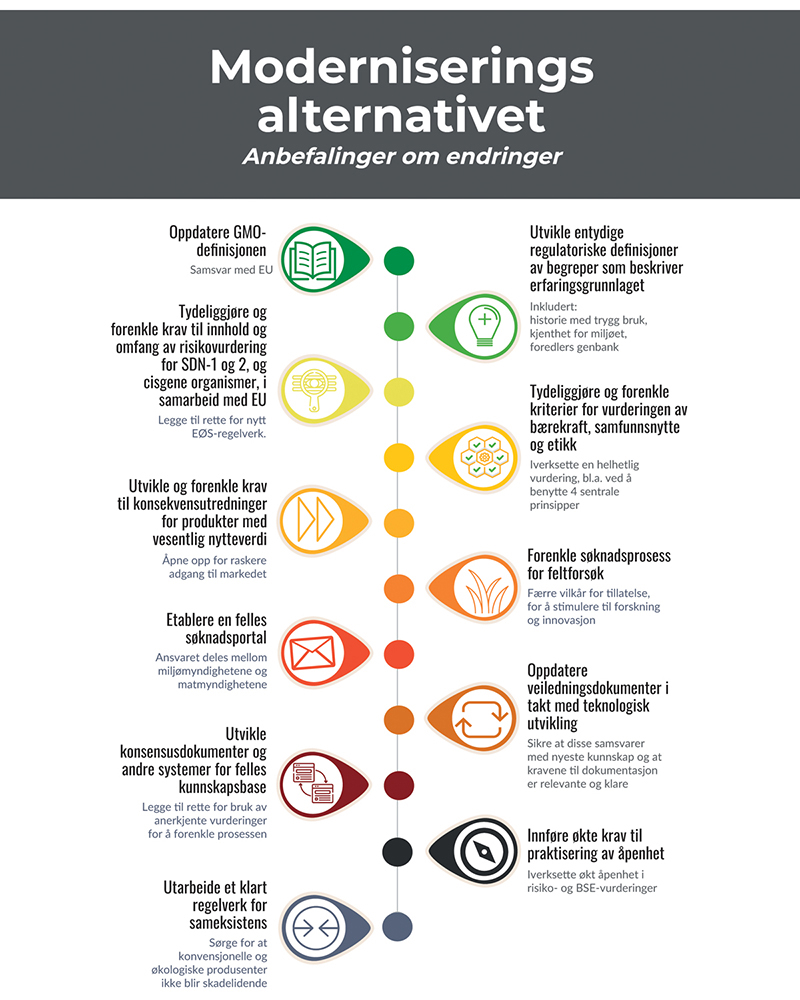
Figur 10.7 Mindretallets anbefaling om endringer i dagens regelverk og praksis
Kilde: Fern Wickson 2023
Risikovurderinger må fortsatt være proporsjonale med helse- og miljørisikoen de genmodifiserte organismene og avledede produktene representerer, basert på omforente veiledningsdokumenter. Mindretallet mener også at det er behov for å tydeliggjøre dagens handlingsrom. Risikovurderinger bør forenkles gjennom utvikling av et felles kunnskapsgrunnlag. Dette kunnskapsgrunnlaget krever større åpenhet om forskningsresultater, inkludert økt grad av bruk av databanker med åpen tilgang, publisering, og bruk av uavhengige fagfellevurderinger. Utviklingen av et åpent, etterprøvbart og felles kunnskapsgrunnlag, blant annet ved utarbeiding av entydige definisjoner og konsensusdokumenter, vil også kunne forenkle søknadsprosessen.
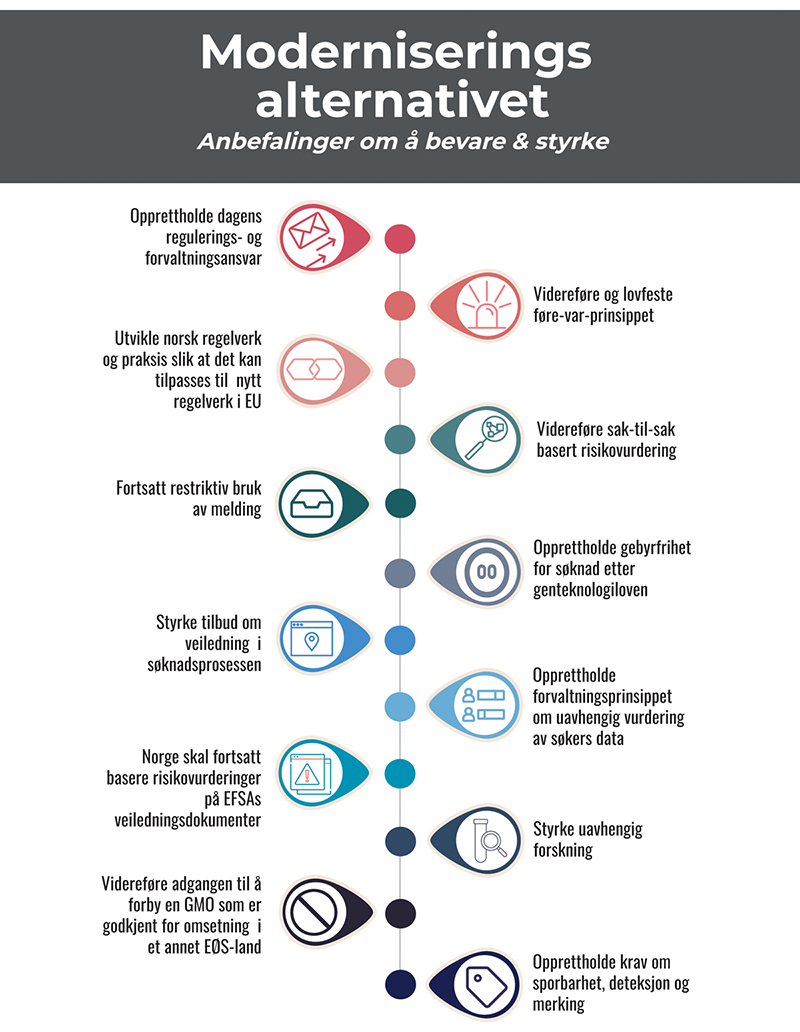
Figur 10.8 Mindretallets anbefalinger om å bevare og styrke
Kilde: Fern Wickson 2023
Mindretallet ønsker å opprettholde dagens regulerings- og forvaltningsansvar, det vil si at levende GMO reguleres etter genteknologiloven og prosessert GMO til mat eller fôr reguleres etter matloven.
Mindretallet legger i den forbindelse særlig vekt på at hensynet til naturens mangfold og økologiske funksjoner må ivaretas ved utsetting av levende GMO.
Det utvikles stadig flere typer levende GMO-er med sikte på flere anvendelsesområder. Felles for dem er at de kan reprodusere seg, noe som kan utgjøre en fare for uønsket spredning av genmodifiserte organismer i naturen. Utvikling og bruk av genmodifiserte organismer skal heller ikke komme i konflikt med bestemmelser i naturmangfoldloven og forurensningsloven. Begge lover forvaltes av miljømyndighetene. Dette tilsier etter mindretallets mening at miljømyndighetene må beholde dagens regulerings- og forvaltningsansvar for alle levende GMO-er.
Miljømyndighetene har et klart sektorovergripende ansvar som tydeliggjøres i den norske genteknologiloven med krav til bærekraft, samfunnsnytte og etikk (BSE). Disse kriteriene er spesielt viktige ved utsetting av GMO i naturen, og gjelder forhold både i Norge og forhold i produksjonslandene ved import.
Det er behov for forenkling og klargjøring, blant annet for å underlette søknadsprosessen. Veiledningen til produktutvikler eller søker må styrkes.
Føre-var-prinsippet er førende for forvaltningens behandling av GMO-søknader etter genteknologiloven, men er ikke lovfestet i genteknologiloven. Prinsippet følger også av Grunnloven §112 og av utsettingsdirektivet i EØS-avtalen. I tillegg er det lovfestet i naturmangfoldloven. Mindretallet mener det er behov for en klargjøring av regelverket, en klargjøring som ikke har til hensikt å endre gjeldende rett. Det foreslås en lovfesting av føre-var-prinsippet basert på tilsvarende bestemmelse i naturmangfoldloven.
Medlemmene som støtter moderniseringsalternativet, er opptatt av at en opplyst samfunnsdebatt forutsetter erkjennelse og respekt for at det kan være ulike perspektiver og interesser knyttet til bruk av genteknologi.
Det kan for eksempel være interessekonflikter knyttet til fordeler og ulemper ved bruk av GMO, og ulik vekting av risiko og muligheter. Det kan også være uenighet om det er de riktige problemene som adresseres, for eksempel om teknologiske løsninger blir oppfattet som symptombehandling eller som del av mer langsiktige løsninger.
Sist, men ikke minst, vil det kunne være ulike syn på valgfrihet, på natur og i hvilken grad det finnes bedre og mer velprøvde metoder for å nå målene.
10.3.1.2 Anbefalinger om endringer
1. Oppdatere GMO-definisjonen
Dagens GMO-definisjon oppdateres til å inkludere genredigering som ikke tilfører nytt/fremmed DNA. Det skal fortsatt som hovedregel ikke være noe krav om at genetiske endringer skal være arvbare for at en organisme skal defineres som en GMO. Dette er i tråd med EUs definisjon og praksis. Alle organismer utviklet med genteknologi kalles GMO, såfremt organismene er definert som GMO i EU.
Det foreslås lovendring.
2. Utvikle entydige regulatoriske definisjoner av begreper som beskriver erfaringsgrunnlaget
Flere begreper som anvendes i forbindelse med genredigering er upresise og mangler en felles definisjon. For eksempel brukes history of safe use (historie med trygg bruk), familiarity (kjenthet for miljøet) og could have occurred naturally (kunne oppstått naturlig) og breeders gene-pool (foredlers genbank) på ulike måter. Entydige definisjoner av begreper vil være viktige som del av sak-til-sak vurderinger og ved mulig fremtidig differensiering av risikovurderingsforløp.
Det anbefales en egen prosess for å utvikle entydige og vitenskapelig robuste definisjoner.
3. Tydeliggjøre og forenkle krav til innhold og omfang av risikovurdering for SDN-1 og 2, og cisgene organismer
Moderniseringsalternativet bygger på at dagens regelverk gir fleksibilitet i omfang av risikovurderinger, både i Norge og EU. Forenkling og tydeliggjøring oppnås ved å videreutvikle veiledningsdokumenter for risikovurdering basert på type og omfang av genetiske endringer og endret egenskap. En forenkling og presisering av hva som skal anses som ikke relevante dokumentasjonskrav for noen typer genredigeringer, gir derfor mulighet for differensiering av krav til dokumentasjonsgrunnlaget. Omfanget av miljørisikovurderinger for disse organismene vil fortsatt avhenge av en komparativ tilnærming og organismens spredningsevne og miljøet den skal settes ut i.
EU vurderer nå kriterier for forenklede dokumentasjonskrav for en fortsatt sak-til-sak risikovurdering av planter utviklet med målrettet mutagenese og cisgenese.
Det anbefales at godkjenningsmyndigheten benytter handlingsrommet etter forskriften for å gjøre helt eller delvis unntak fra kravene til konsekvensvurdering. Videre anbefales det at når EUs vurderinger foreligger, utvikler kompetente eksperter konkrete forslag for innhold og omfang av risikovurdering for SDN-1 og 2, og cisgene organismer (planter, dyr og mikroorganismer).
4. Tydeliggjøre og forenkle kriterier for vurdering av bærekraft, samfunnsnytte og etikk (BSE)
Det foreslås en ny, tydeligere vurderingsstruktur. Det foretas en samlet vurdering av etisk forsvarlighet som bygger på bærekraft, nytte, rettferdig fordeling og åpenhet, samt en vurdering av helse- og miljørisiko. Eget skjema og veiledningsdokument utarbeides. Forsøksutsetting (feltforsøk) unntas krav om vurdering av etisk forsvarlighet.
Det foreslås forskriftsendring.
5. Utvikle og forenkle krav til konsekvensutredninger for produkter med vesentlig nytteverdi
Det er et ønske om å legge spesielt til rette for at produkter som fyller et spesielt stort udekket behov, og der formålet ikke kan nås på en annen måte, kan få en betinget godkjenning for å komme på markedet raskt. Datagrunnlaget knyttet til vurderingen kan så fylles på i etterkant.
Det foreslås forskriftsendring.
6. Forenkle søknadsprosessen for feltforsøk/forsøksutsetting av GMO
Det innføres mer tilpassede krav til dokumentasjon for feltforsøk. Det innebærer blant annet at krav til vurdering av BSE utgår ved feltforsøk. Dette fordi resultater fra feltforsøk kan være nødvendig for å vurdere om et produkt fyller disse kriteriene. I tillegg vil det kunne stimulere til økt forskning og utvikling. Prinsippet om trinnvis utsetting opprettholdes.
Det foreslås lovendring og forskriftsendring.
7. Etablere en felles søknadsportal
En felles portal utvikles i felleskap mellom mat- og miljømyndighetene for å forenkle søknadsprosessen.
Det foreslås praksisendring.
8. Oppdatere veiledningsdokumenter i takt med teknologiutviklingen
Dokumentasjonsgrunnlaget som etterspørres i risikovurderingen oppdateres i takt med kunnskapsutviklingen slik at det er tydelig for søker hvilke datakrav som forventes/er relevant for risikovurdering av organismer utviklet med ulike genredigeringsteknikker. Det foreslås at arbeid knyttet til oppdatering av veiledningsdokumenter i VKM intensiveres og at Norge bidrar til EFSAs kontinuerlige arbeid med utvikling av veiledning.
9. Utvikle konsensusdokumenter og andre systemer for å bygge felles kunnskapsgrunnlag
Det er et behov for systematisk å utvikle konsensusdokumenter og andre fagfellevurderte lærende systemer som vil lette både risikovurderingen og utviklingen av fremtidige søknader. Det er i dag få insentiver for produktutviklere til å publisere/tilgjengeliggjøre studier fra dokumentasjonsgrunnlaget i søknader. Dette hindrer utvikling av systematiske oversikter, metaanalyser av data, og genererer behov for repeterte risikovurderingsprosesser av samme genetikk/egenskap over tid. Åpen publisering av datagrunnlaget under FAIR- prinsipper (se kapittel 7) vil lette muligheten for å samle erfaring og bygge biologisk konsensus; som også kan forenkle søkers utforming av dokumentasjonsgrunnlaget. Det foreslås derfor økte krav til offentliggjøring, og derav adgang for risikovurderings- og håndteringsorgan for raskere å kunne utvikle generisk kunnskap basert på tidligere søknader. Det foreslås også en lovendring som innebærer at forvaltningen og VKM kan ta i bruk opplysninger i andre søknader, såfremt opplysningene fremdeles unntas innsyn.
10. Innføre økte krav til praktisering av åpenhet
Åpenhetsforordningens bestemmelser skal praktiseres for VKMs risikovurdering og Bioteknologirådets vurdering av etisk forsvarlighet. Offentlig, tidseffektiv høring av enkeltsaker skal gjennomføres. Det foreslås en gjennomgang av hvordan forordningen praktiseres.
Det foreslås også under dette punktet at opplysninger om genetisk materiale, som allerede kreves i en konkret sak i henhold til naturmangfoldloven eller forskrifter i medhold av naturmangfoldloven, skal sendes inn sammen med søknader etter genteknologiloven.
11. Utarbeide et klart regelverk for sameksistens
Bruk av genmodifiserte produkter til bruk i mat eller fôr forutsetter et klart regelverk for sameksistens. Regelverket skal sørge for at konvensjonelle og økologiske produsenter ikke blir skadelidende. Sameksistensregelverket skal også sikre forbrukernes reelle muligheter til å velge GMO-frie alternativer. Regelverk for sameksistens må være operativt før dyrking av GMO kan tillates.
10.3.1.3 Anbefalinger om å bevare og styrke
12. Opprettholde dagens regulerings- og forvaltningsansvar
Levende GMO reguleres i genteknologiloven, og forvaltningsansvaret beholdes i miljøforvaltningen. Prosessert GMO til mat og fôr reguleres i matloven.
Det foreslås ikke endringer.
13. Lovfeste føre-var-prinsippet
Lovfesting i genteknologiloven har ikke til hensikt å endre gjeldende rett, men vil klargjøre lovgrunnlaget.
Det foreslås lovendring.
14. Legge til rette for at norsk regelverk og praksis kan tilpasses nytt regelverk i EU
Moderniseringsalternativet legger til rette for at norsk regelverk kan tilpasses nytt regelverk i EU, blant annet når det gjelder GMO-definisjonen og risikovurderinger. Det legges til rette for innlemmelse av fremtidig EØS-regelverk, i tråd med vedtak i EØS-komiteen og av regjering og Storting.
Dagens tilpasninger i EØS-avtalen videreføres.
15. Videreføre sak-til-sak basert risikovurdering
Moderniseringsalternativet bygger på at det ikke er en lineær sammenheng mellom hvilken teknikk som er anvendt og/eller omfanget av genmodifisering og endringen i organismens risikoprofil. Genmodifiserte organismer, herunder de genredigerte, må vurderes fra sak-til-sak ut fra risiko for negative helse- og miljøeffekter i tråd med anbefalingene fra VKM og EFSA. Det foreslås fortsatt sak-til-sak tilnærming for alle redigerte organismer uavhengig av mulige differensierte krav til dokumentasjonsgrunnlaget.
16. Fortsatt restriktiv bruk av melding
Gitt punktet over, vil det som hovedregel fortsatt ikke åpnes for melding i stedet for søknad.
Det foreslås ingen endringer i dagens praksis.
17. Opprettholde gebyrfrihet for søknad etter genteknologiloven
Dette følger dagens praksis og er i motsetning til søknader etter matloven.
Det foreslås ingen endring.
18. Styrke tilbud om veiledning i søknadsprosessen
Styrking av innledende veiledningssteg mellom søker og myndigheter gjennom utvikling av veiledningsdokumenter, jamfør også EFSAs oppdaterte rutiner (kapittel 8).
Det foreslås lovendring og gjennomgang/endring av praksis.
19. Opprettholde forvaltningsprinsippet om uavhengig vurdering av søkers data
Uavhengige fagfellevurderinger er grunnleggende for å kvalitetssikre og korrigere vitenskapelige studier, særlig siden mange studier som benyttes i risikovurderingen oftest ikke er publisert eller underlagt annen fagfellevurdering. Åpne høringer, uavhengighet, åpenhet i datagrunnlaget og god forvaltning av habilitetsprinsippet er også nødvendig for tillit til ny bruk av teknologi i matkjeden.
Det foreslås fortsatt bruk av uavhengige vitenskapelige paneler som vurderer dokumentasjonsgrunnlaget for alle typer genteknologier. Disse støttes av offentlige høringer som videreføres som i dag.
20. Norge skal fortsatt basere risikovurderinger på EFSAs veiledningsdokumenter
EFSAs ekspertpaneler har utviklet veiledere som spesifiserer dokumentasjonsgrunnlaget for risikovurderinger av GMO. Disse er hjemlet i EUs direktiver og forordninger, og oppdateres/komplementeres fortløpende (se kapittel 8). VKMs risikovurderinger tar utgangspunkt i EFSAs veiledningsdokumenter.
Det foreslås at VKM fortsatt benytter EFSA-dokumenter som grunnlag for å strukturere risikovurderingen av organismer/produkter omsøkt i Norge og via andre EU land, og at VKM fortsatt fokuserer på høringer og på særnorske forhold.
21. Styrke uavhengig forskning
For å sikre at forskningen ikke gjøres avhengig av kommersielle interesser, og det oppstår partiskhet i kunnskapsgrunnlaget, er det behov for økt bruk av offentlige midler til forskning på, og effekter av de nye teknologiene. Forskningen skal være åpen og ha tillit blant ulike aktører og interessenter. I tillegg må forskningsinnsatsen styrkes rundt implementering, regulering, samt risikovurdering og håndtering av nye teknologier i mat og økosystemer. Det opprettes flerårige forskningsprogrammer for å øke kunnskapsgrunnlaget knyttet til uavhengige studier av effekter av ny teknologi, herunder risiko, implementering og samfunnsmessige konsekvenser.
22. Videreføre adgangen til å forby en GMO som er godkjent for omsetning i et annet EØS-land
Det er behov for å tydeliggjøre dagens bestemmelse. Det foreslås derfor lovendring. Lovendringen vil ikke endre adgangen for norske myndigheter til å nedlegge forbud.
23. Opprettholde krav om sporing, deteksjon og merking
Det vil ikke være hensiktsmessig å utvikle særnorske krav for sporbarhet, deteksjon og merking. Alle organismer som defineres som GMO vil merkes etter EUs regler. Det foreslås ingen regelverksendring.
10.3.1.4 Anbefalinger om å utrede
24. Utrede muligheten for å ta inn kriterier om bærekraft, samfunnsnytte og etikk i matloven
Myndighetene bes utrede muligheten for at kravene om bærekraft, samfunnsnytte og etikk i genteknologiloven innarbeides helt eller delvis i matloven.
25. Utrede muligheten for å innføre krav til merking av animalske produkter der GMO er brukt i husdyrfôr
Myndighetene bes utrede mulighetene for å innføre krav til merking av animalske produkter der GMO er brukt i husdyrfôr.
10.3.2 Utdyping av de konkrete forslagene i modellen med noen juridiske vurderinger
10.3.2.1 Oppdatere GMO-definisjonen
GMO-definisjon i genteknologiloven § 4 oppdateres ved å introdusere ordlyd som spesifiserer at bestemmelsen ikke forutsetter at nytt genmateriale alltid tilføyes. Det innebærer at alle organismer utviklet ved bruk av genteknologi kalles GMO, såfremt organismene er definert som GMO i EU. Det foreslås lovendring. Dagens lov og praksis innebærer også, som hovedregel, at det ikke er krav til at genetiske endringer skal være arvbare for at en organisme skal defineres som en GMO; i tråd med EUs definisjon og praksis.
I genteknologiloven § 4 defineres genmodifiserte organismer som mikroorganismer, planter og dyr hvor den genetiske sammensetning er endret ved bruk av gen- eller celleteknologi. Genteknologi defineres i § 4 bokstav c som teknikker som innebærer at arvestoff isoleres, karakteriseres, modifiseres og innsettes i levende celler eller virus.
I EUs utsettingsdirektivet artikkel 2 defineres GMO som en organisme, unntatt mennesker, der genmaterialet er endret på en måte som ikke forekommer ved naturlig formering og/eller naturlig rekombinasjon. I vedlegg IA del 1 er det en opplisting av teknikker som omfattes av definisjonen, og i vedlegg IA del 2 er det listet opp teknikker som ikke omfattes av definisjonen.
Moderniseringsalternativet foreslår at dagens norske definisjon oppdateres for å ta høyde for at nye genteknologier også identifiserer og endrer eksisterende genetikk, uten at nytt genmateriale settes inn i organismen. Det gjøres ved at ordlyden i §4 bokstav c endres ved å ta ut ordet innsettes.
Forslag til regelverksendring
Ny ordlyd i genteknologiloven § 4 c:
c) genteknologi: teknikker som innebærer at arvestoffet til levende celler eller virus isoleres, karakteriseres og modifiseres.
10.3.2.1.1 GMO-definisjonen når det gjelder midlertidige og ikke-arvelige genetiske endringer
Moderniseringsalternativet foreslår en fortsatt sak-til-sak-vurdering når det gjelder spørsmålet om GMO-definisjonen skal omfatte midlertidige organismer med aseksuell reproduksjon og ikke-arvelige endringer hos organismer med seksuell reproduksjon. Dette kan være saker med komplisert biologi og genetikk som krever helhetlige vurderinger.
I en beslutning 27. juni 2017 kom EU-kommisjonen til at fisk vaksinert med DNA-vaksinen Clynav ikke skulle defineres som GMO. Det ble samtidig fremhevet at konklusjonen ikke gjelder for alle DNA-vaksiner, men at hver vaksine vil måtte vurderes individuelt. Av hensyn til EØS-samarbeidet besluttet norske miljømyndigheter at det også skulle være norske myndigheters forståelse at fisk vaksinert med Clynav ikke skal defineres som GMO, og ikke omfattes av genteknologiloven. Dette harmonerer ikke så godt med ordlyden i genteknologiloven, siden loven også omfatter organismer der en genetisk endring er forbigående.
Moderniseringsalternativet legger til rette for at Norge kan følge EU både når dette innebærer at organismer som ellers ville falle innenfor loven, likevel ikke skal omfattes av loven, og omvendt.
Forslag til regelverksendring
Dette kan gjennomføres i genteknologiloven ved å innta følgende nye sjette ledd i § 2:
Som følge av utvikling i praksis og regelverk innen EU av betydning for Norges forpliktelser etter EØS-avtalen, kan Kongen gi forskrift om at organismer som ellers ville falle inn under definisjonen i § 4 bokstav b, ikke skal omfattes av loven, og om at organismer som ellers ville falle utenfor definisjonen i § 4 bokstav b, likevel skal omfattes av loven.
Det kan gis forskrift som innebærer sammenfall mellom Norges og EUs praksis når det gjelder hvilke organismer som skal anses som GMO og falle innenfor regelverket, og hvilke som ikke skal det.
Videre legges det til grunn at for forsøk som gjelder midlertidige og ikke arvelige endringer, vil det være særlig aktuelt med forenklede krav ved feltforsøk og annen forsøksutsetting.
10.3.2.1.2 GMO-definisjonen når det gjelder genredigerte organismer med få endringer
Genredigerte organismer endret ved bruk av nye genomteknikker, og som ikke inneholder rekombinant DNA, er å anse som GMO etter genteknologiloven. Det samme gjelder etter dagens EU-regelverk, jamfør EU-domstolens domsavsigelse i sak C-528/16 og etter den foreslåtte GMO-definisjonen over. I moderniseringsalternativet legges det også til rette for innlemmelse av fremtidig EU-regelverk i tråd med vedtak i EØS-komiteen og av regjering og Storting.
Forslag til regelverksendringer
Det er ikke behov for endring i GMO-definisjonen utover presiseringen som foreslått innledningsvis.
10.3.2.2 Utvikle entydige regulatoriske definisjoner av begreper som beskriver erfaringsgrunnlaget
Både kategorisering og differensiering av risikovurdering av organismer/produkter utviklet ved nye genteknologier vil måtte bygge på en entydig begrepsutvikling av bredt aksepterte og internasjonalt harmoniserte definisjoner. Det gjelder blant annet:
HoSU − History of safe use (historie med trygg bruk), jf. EFSA 2022a
Familiarity (kjenthet for miljøet)
Breeders gene pool (foredlers genbank)
Kunne ha oppstått naturlig / ved tradisjonell foredling / bruk av foredlers genbank
organismer framstilt ved visse teknikker for genmodifisering som tradisjonelt er blitt anvendt for ulike formål uten å medføre sikkerhetsproblemer (engelsk: organisms obtained through certain techniques of genetic modification which have conventionally been used in a number of applications and have a long safety record), jamfør utsettingsdirektivet 2001/18 fortalen punkt 17 og sak C-528/16 (EU-domstolen 2018).
Disse begrepene benyttes med ulik betydning i dagens omtaler av nye genomteknikker og fremstår viktige med hensyn på mulig fremtidig differensiering av risikovurderinger. Utvikling av entydige begreper vil være nyttige som en del av helhetlige risikovurderinger fra sak-til-sak-.
Forslag til regelverksendring
Det foreslås ikke regelverksendring, men det anbefales å nedsette en arbeidsgruppe i VKM som utvikler forslag til slike definisjoner i nært samarbeid med EU/EFSA.
10.3.2.3 Tydeliggjøre og forenkle krav til innhold og omfang av risikovurdering for SDN-1 og 2, og cisgene organismer
I moderniseringsalternativet understrekes at dagens gjeldende regulatoriske rammeverk gir fleksibilitet i omfang av risikovurderinger; og at dette ikke er benyttet i den grad det er mulig. Dette gjelder både i EU og Norge. Fleksibiliteten finnes i spennet mellom lovverkets formelle krav, etablert operasjonalisering (for eksempel oppdaterte EFSA-veiledninger) og praktisering av dette i sak-til-sak-vurderinger. Fleksibiliteten fremgår blant annet av forskrift om konsekvensutredning etter genteknologiloven vedlegg 1, der det heter at Det stilles ikke krav om å legge fram et bestemt delsett av opplysninger angitt i vedlegg 1 del A eller vedlegg 1 del B dersom det ikke er relevant eller nødvendig for risikovurderingen for den bestemte søknaden, særlig med hensyn til den genmodifiserte organismens egenskaper, omfanget av og vilkårene for utsettingen eller tiltenkte bruksvilkår. Bestemmelsen bygger på en tilsvarende bestemmelse i utsettingsdirektivet.
Det er allerede i dag en løpende revidering og oppdatering av krav til dokumentasjonsgrunnlaget. En viktig del av dokumentasjonsgrunnlaget er ofte data produsert av søker. Deler av veiledningen er derfor rettet mot kvalitetssikring av søkers fremlagte data. Det gjelder for eksempel veiledning om nødvendig forsøksdesign som håndterer naturlig variasjon og definerer kvalitet og signifikansnivå, hvordan eksperimentelle begrensninger i nyere omics-baserte teknikker, herunder hvordan helgenom-sekvenseringsdata håndteres.
Moderniseringsalternativet fremmer at videre utvikling av veiledningsdokumenter raskt kan tilpasses behov knyttet til vurdering av nye genredigerte organismer. Ulike EFSA-arbeider har også konkludert med at de nye genteknikkene ikke representerer fundamentalt nye risikofaktorer som ikke allerede er tatt opp i dagens veiledere. Det er derfor ikke behov for nye typer analyser, og i mange tilfeller/bruksområder kan risiko være redusert, for eksempel ved kjent punkt for redigering, fravær av innsatt DNA etc. Det er per i dag ikke etablert et biologisk/genetisk kunnskapsgrunnlag som tilsier at risikoprofilen kan differensieres på en systematisk måte basert på hvilken ny type av genomteknikk som er anvendt.
10.3.2.3.1 Differensiert risikovurdering av noen genredigerte organismer basert på krav til relevant dokumentasjon
Utgangspunktet for dagens regulering er et ubegrenset potensial for endringer i genetikken til den modifiserte organismen. Dette vil også være utgangspunktet for regulering av organismer produsert ved nye genteknologiske metoder. Fremstilling av genmodifiserte organismer skjer ofte ved at man benytter en kombinasjon av etablerte og nye genomteknikker. De nye metodene kan derfor resultere i organismer som har samme genetikk og egenskaper som kan oppnås ved etablert genmodifisering, og som er underlagt dagens GMO-regulering. De nyere genomteknikkene gir imidlertid også muligheter for å fremstille organismer som ikke kunne blitt produsert ved å bruke etablerte teknikker. Kombinering av etablerte og nye genomteknikker innebærer at det ikke er et systematisk skille mellom ulike typer genmodifiserte organismer på bakgrunn av genteknikkene som er benyttet.
Ulike typer bruk av nye genomteknikker vil produsere organismer som har ulik type og grad av genetiske endringer. En risikovurdering av disse organismene vil ikke være identisk med hensyn på behov for omfang og type data, for å konkludere på risiko. Mulighetene for en differensiert tilnærming til genmodifiserte produkter ligger i at de nye teknikkene kan brukes til å foreta mindre og mer målrettede endringer i et genom, og at det ikke settes inn fremmed (eksogent) DNA. Systematiske forskjeller i datagrunnlaget for ulike typer genredigerte organismer kan derfor gi en mulighet for differensiert risikovurdering. Forskjeller kan være knyttet til at det ikke innsettes nytt DNA, at målsete for den genetiske endringen er godt kjent, at tilsvarende genetisk variasjon allerede er i matkjeden etc.
Nærmere om differensiering av ulike genomteknikker og avledede anvendelser og produkter
Ved en nærmere differensiering av ulike typer organismer og produkter fremstilt ved ulike metoder for genmodifisering er det altså den modifiserte organismens endrede genetikk som legges til grunn. Endringer i genetikken vil være både tilsiktede endringer og utilsiktede endringer (se kapittel 8) i organismen som vurderes i forhold til tiltenkt bruk. Graden av endringer i genetikken til organismer ved ulik bruk av genteknologi kan deles inn i flere nivåer:
a. Endringer i enkeltbasepar i et genom (målrettet mutagenese)
Avhengig av antall endringer kan/kan ikke tilsvarende endringer oppstå naturlig eller oppnås ved tradisjonell avl eller foredling (EFSA: SDN-1 og noen typer SDN-2).
b. Overføring av enkeltgener (alleler) mellom kryssbare organismer (cisgenetikk)
SDN-3 basert overføring av enkeltgen/egenskaper mellom kryssbare arter. En slik overføring vil i noen tilfeller kunne skje også ved tradisjonell avl, men en unngår negative effekter av tilbakekryssing (introgresjon). Endringer skjer innenfor en arts genpool og opprettholder de regulatoriske elementene for kontroll av genuttrykk.
c. Redigeringer av et genom og overføring av genetisk materiale innen artens genpool (intragenetikk)
Intragenetikk vil være samlebegrepet på genetiske endringer som kan innbefatte kombinasjoner av endringer som nevnt under punkt 1 og 2 over, men også andre redigeringer i et genom. Intragenetikk begrenses til genetisk variasjon som finnes i artens genpool, men kan også inkludere rekombinasjoner av variasjon som ikke oppnås ved tradisjonell avl, eksempelvis nye kombinasjoner av ulike regulatoriske elementer og proteinkodende gener fra samme art.
d. Overføring og rekombinering av genetisk materiale mellom arter (transgenetikk)
Innebærer overføring av genetisk materiale på tvers av artsgrenser, noe som er tilfelle for de fleste GMO-er på markedet i dag. Genetisk materiale er ofte DNA-sekvenser som har nye kombinasjoner av ulike regulatoriske elementer og proteinkodende gener fra ulike arter, og som ved bruk av etablerte genmodifiseringsteknikker satt tilfeldig inn i vertsgenomet, eller målrettet ved bruk av nye genomteknikker.
e. Gendrivere for å endre nedarvingsmønstre i populasjoner (transgenetikk)
Baseres på transgenese og innebærer innsetting av genetiske elementer som gjør at vanlig mendelsk nedarving i en populasjon bortfaller. En gitt egenskap «drives» i stedet gjennom og sprer seg etter hvert til alle avkom i hvert generasjonsledd. Teknologien kan for eksempel brukes til populasjonskontroll av insekter. Den tilsiktede effekten av modifiseringen er at en gitt egenskap skal spre seg så raskt som mulig, noe som kan føre til at også organismen sprer seg (økt fitness), eller motsatt, at populasjoner kollapser (får redusert fitness, dersom tilført egenskap f.eks er hunnsterilitet).
f. Syntetisk biologi (transgenetikk)
Baseres på transgenese og innebærer en modulbasert tilnærming til organismers genom, for eksempel for å utvikle økt kontroll av (oftest encellede) organismers produksjon av ønskede metabolitter. Dagens bruk av denne teknologien er med fokus på innesluttet og industriell produksjon.
g. Forbigående genetiske endringer (RNA interference, DNA- og RNA-vaksiner)
Baseres oftest på bruk av DNA/RNA/RNAi som gir forbigående genetiske endringer i en organismes somatiske celler.
h. Stacks (kombinasjoner av innsatt genetisk variasjon ved kryssing av organismer)
Er rekombinante organismer som representerer kombinasjoner innad eller mellom gruppe A-D. De fremkommer med konvensjonell avl/kryssning av genmodifiserte organismer som bærer ulike genetiske endringer (A-D).
De fleste GM plantene på markedet i dag er stacks.
Punkt A-B beskriver teknikker som kan resultere i svært få endringer i et genom og uten tilstedeværelse av artsfremmed DNA i det endelige produktet. Slike anvendelser av nye genredigeringsteknikker gir en mulighet for differensierte dokumentasjonskrav for en risikovurdering av organismene og produktene.
10.3.2.3.2 Tilpasning og forenkling av dokumentasjonsgrunnlaget på grunnlag av minimale endringer i genetikk og/eller biologisk kompleksitet
Moderniseringsalternativet innebærer at dagens krav om dokumentasjon kan tilpasses og forenkles basert på minimale endringer i genetikk/biologisk kompleksitet for endringer i enkeltbasepar i et genom (kategori A) og overføring av enkeltgener (alleler) mellom kryssbare organismer ved cisgenese (B). Dette er også i tråd med oppdaterte vurderinger av VKM og EFSA.
For kategoriene A og B vil de organismene og produktene som har mindre endringer kunne medføre redusert behov for data for å gjennomføre en risikovurdering. Selv om totalomfanget av relevante data vil være mindre, vil risikovurderingen likevel kunne variere fra sak til sak blant annet basert på organismens endrede biologi og miljøet den settes ut i.
For eksempel vil overføring av enkeltgener (alleler) mellom kryssbare organismer (cisgenetikk) og redigeringer av et genom og overføring av genetisk materiale innen artens genpool (Intragenetikk) (kategori B og C) som oftest ha tilført nye kjente eller ikke kjente proteinkodende gener. Dette kan for eksempel dreie seg om nye proteiner som kan ha behov for vurderinger av toksisitet eller allergenisitet. I slike tilfeller vil derfor data knyttet til historie med trygg bruk (history of safe use) og kjenthet for miljøet (familiarity) kunne støtte risikovurderingen i fravær av andre data.
Det er andre muligheter for fenotypiske effekter basert på endringene som gjøres i vertsgenomet for B- og C-organismer enn det er for A-organismer. B- og C-organismer vil ha fått satt inn genetisk materiale og dermed ha et innsettingspunkt i genomet som innebærer en omrokkering av vertsgenomet. Utilsiktede effekter av selve innsettingen har vært en sentral del i risikovurderingen av dagens GMO-er.
De nye genomteknikkene gir imidlertid mulighet til å forhåndsdefinere innsettingspunktet og dermed redusere usikkerhet knyttet til utilsiktede genetiske/biologiske effekter. EFSA-veiledning bør derfor oppdateres i forhold til den endrede genetikken/biologien som ligger til grunn for A-C-organismer. Dette fremgår også av EFSA 2011a, 2012b, 2022d. Den omfattende VKM-rapporten fra 2021 inneholder også en vurdering av hvilke datakrav som ikke er relevante for noen typer organismer utviklet med bruk av genomteknikker.
Det er et behov for tydeliggjøring av relevant dokumentasjon for risikovurdering av A-, B- og C-organismer. En mulighet er å be VKM bygge på det omfattende selvinitierte arbeidet som presentert i rapport (VKM, 2021), med sikte på å utarbeide relevante og derav redusert datakrav. Dette arbeidet må koordineres med pågående prosesser i EU. Dette vil forenkle saksbehandlingen og gjøre den mer forutsigbar. EFSA vil også kunne få et tilsvarende oppdrag knyttet til Europakommisjonens prosess, jamfør omtale i kapitlene 4 og 8.
Genteknologianvendelsene for fremstilling av transgene organismer, gendrivere og syntetisk biologi (kategori D-F) blir i liten grad diskutert i dagens debatt rundt fremtidig regulering av genmodifisering. Moderniseringsalternativet bygger på at dagens GMO-regelverk fortsatt er godt egnet for disse kategoriene, i tråd med uttalelser fra både EFTA og VKM. For transgene organismer (D), kan det være grunnlag for reduserte datakrav gitt at erfaringsgrunnlaget etter hvert øker for enkelte egenskaper, og at det utvikles konsensusdokumenter som kan understøtte risikovurderingen.
Det forutsettes en videre utvikling av regelverk og oppdateringer knyttet til risikovurdering og håndtering av organismer med gendrivere (E) og organismer som er framstilt ved syntetisk biologi (F). Det pågående arbeidet med utarbeiding av veileder for risikovurdering av gendrivere under CBD må også følges opp i norsk regelverk og praksis.
For organismer med forbigående genetiske endringer som ikke er arvelige (G-organismer), eksempelvis etter eksponering for RNAi eller behandling med DNA- og RNA-vaksiner, legges det til rette for at Norge kan følge EU. Det innebærer at selv om slike organismer i utgangspunktet omfattes av genteknologiloven, kan det fastsettes unntak i forskrift dersom dette følger av EUs regelverk eller praksis.
Stacks er organismer som kan fremkomme ved kryssing av ulike genmodifiseringer (events) (H). I dag er det vanlig at genmodifiserte planter bærer mange (>6 ulike) innkryssede transgener. EFSA har utarbeidet en forenklet veiledning for stacks.
Det må også forventes stacks bygget på kryssing av A- til C-organismer. Hvordan den økte kompleksiteten i kombinasjoner av genetiske endringer vil måtte risikovurderes for ulike krysninger av A-C-organismer er foreløpig uavklart. Dagens vurderinger av slike organismer baseres på enkelthendelser (eventer i førstegenerasjon (EFSA, 2022d).
Det er mulig og ønskelig å redusere kravene til konsekvensutredning for visse genmodifiserte organismer der dette er biologisk relevant/begrunnet.
En differensiering må være vitenskapelig begrunnet, forutsigbar og håndterbar i en risikovurderingssammenheng. Det forutsettes at vurderingen fortsatt skal være basert på en sak-til-sak-behandling og ta høyde for rask teknologiutvikling.
En slik differensiering vil være hensiktsmessig dersom det oppnås enighet i EU om grunnlaget for differensiering og elementene som inngår i risikovurderingen.
EFSA foreslår i sin artikkel om kriterier til støtte for risikovurdering av A-C planter at EU-kommisjonen må arbeide videre med sikte på å utvikle kriterier. Det innebærer også utvikling av definisjoner av sentrale begreper, deriblant historie med trygg bruk (history of safe use), kjenthet for miljøet (familiarity), foredlers tilgjengelige genbank (breeder’s gene pool), genomic safe harbours (GSH). Definisjoner av sentrale begreper må avklares før de kan brukes i ekspertpaneler som foretar risikovurderingen og for å kunne gi tydelig veiledning om dokumentasjonkrav til søker.
Differensiering gjøres gjennom en egen bestemmelse i genteknologiloven § 11 eller i forskrift om konsekvensutredning etter genteknologiloven.
Forslag til regelverksendring
Godkjenningsmyndigheten skal benytte handlingsrommet etter forskriften og gjøre helt eller delvis unntak fra kravene til konsekvensvurdering for følgende kategorier av søknader:
1. der kravene ikke er relevante eller økt/etablert kunnskap tilsier at kravene kan reduseres fordi de er overflødige
2. der slike lempede krav er i overensstemmelse med anbefalinger fra VKM og EFSA eller
3. der det er utarbeidet anerkjente generelle vurderinger av kunnskapsgrunnlaget (konsensusdokumenter) som erstatter ny etablering av slik kunnskap for å understøtte en konkret risikovurdering. Dette kan for eksempel gjelde forståelsen av en organismes generelle fenotype, endret protein, innsettingspunkt mm.
10.3.2.4 Tydeliggjøre og forenkle kriterier for vurdering av bærekraft, samfunnsnytte og etikk (BSE)
Bioteknologirådet har ansvar for vurderinger knyttet til kriteriene bærekraft, samfunnsnytte og etikk i Norge. I dag foretar Bioteknologirådet denne vurderingen i etterkant av VKMs helse- og miljørisikovurdering. Vurderingen legger VKMs vurdering til grunn, samt annen relevant kunnskap, inkludert eventuelle andre risikovurderinger.
Moderniseringsalternativet innebærer at det fortsatt skal utføres vurdering av bærekraft, samfunnsnytte og etikk ved godkjenning etter genteknologiloven og at Bioteknologirådet fortsatt skal vurdere alle omsetningssøknader for GMO opp mot kriteriene. Dette gjøres ved en samlet vurdering av etisk forsvarlighet som bygger på bærekraft, nytte, rettferdig fordeling og åpenhet, som beskrevet i kapittel 9.
Bioteknologirådet må derfor være bredt sammensatt. Det må også være tilstrekkelig genteknologisk kompetanse og faglig balanse blant medlemmene.
Prosesser i EU om å bruke bærekraft som kriterium på ulike politikkområder viser at EU nærmer seg norsk genteknologilov.
Forskrift om konsekvensutredning etter genteknologiloven endres i tråd med dette og det utarbeides eget skjema for å lette søknadsprosessen.
Forslag til regelverksendring
I forskrift om konsekvensutredning etter genteknologiloven må § 17 endres. Bestemmelsen gjelder andre følger av utsettingen enn miljø- og helsevirkninger. Videre må vedlegg 4 til forskriften endres. Vedlegget omhandler vurdering av bærekraft, samfunnsnytte og etikk. Det skal foretas en samlet vurdering av etisk forsvarlighet som bygger på bærekraft, nytte, rettferdig fordeling og åpenhet, samt helse- og miljørisiko. Eget skjema utarbeides.
Forsøksutsetting (feltforsøk) unntas krav om vurdering av etisk forsvarlighet, da slike forsøk danner noe av grunnlaget for å vurdere slik forsvarlighet. Se nærmere om forsøksutsetting under punkt 10.3.2.6.
10.3.2.5 Utvikle og forenkle krav til konsekvensutredninger for produkter med vesentlig nytteverdi
Det følger av Ot.prp. nr. 8 (1992–93) om genteknologiloven side 81 at dersom et produkt har en vesentlig nytteverdi og formålet ikke kan nås på annen måte, kan kravet om dokumentasjon på at produktet ikke har helse- eller miljømessige skadevirkninger lempes noe. Dette kommer imidlertid ikke til uttrykk i regelverket. Det foreslås derfor at en bestemmelse om dette tas inn i lov eller forskrift, og at dokumentasjon som skal kreves og hvilke prosedyrer som skal gjelde ved saksbehandling av denne kategorien søknader, klargjøres for søkerne.
Moderniseringsalternativet innebærer at det kan gis en betinget godkjenning basert på noe mindre omfattende dokumentasjon enn normalt for å få produkter med høy etisk forsvarlighet raskt tilgjengeliggjort. Dette forutsetter en fortsatt sak-til-sak-vurdering. Datagrunnlaget knyttet til vurderingen kan så fylles på i etterkant.
Aktuelle eksempler er legemidler til mennesker og dyr som fyller et stort udekket behov og der formålet ikke kan oppnås på annen måte.
Forslag til regelverksendring
Kravet til dokumentasjon kan for eksempel reguleres ved at følgende bestemmelse tas inn i genteknologiloven eller i forskrift om konsekvensutredning etter genteknologiloven:
Et produkt som fyller et spesielt stort udekket behov og formålet ikke kan nås på annen måte, kan gis en betinget godkjenning basert på noe mindre dokumentasjon på helse- eller miljømessige skadevirkninger enn det som normalt kreves. Datagrunnlaget skal fylles på i etterkant.
10.3.2.6 Forenkle søknadsprosessen for feltforsøk/forsøksutsetting av GMO
Moderniseringsalternativet innebærer at vurderingen av kriteriene bærekraft, samfunnsnytte og etikk ikke skal være til hinder for forskning og innovasjon og stimulere til utvikling av produkter og prosesser som er etisk forsvarlige. I moderniseringsalternativet foreslås det derfor enklere søknadsprosedyre enn i dag for godkjenning av feltforsøk og annen forsøksutsetting.
I denne fasen bør vurderingene begrenses til miljøaspekter, spredningspotensialet, miljørelaterte helsekonsekvenser og krav om risikohåndtering for å begrense spredning eller miljø- og helseskade fra forsøket.
Det foreslås at utsetting i forsøksøyemed unntas krav om vurdering av etisk forsvarlighet. Begrunnelsen er at det kan være vanskelig å konkludere om et produkt kan være samfunnsnyttig, bærekraftig og etisk forsvarlig før det gjennomføres feltforsøk. Vurdering av om et produkt er etisk forsvarlig vil nettopp kunne være avhengig av resultater fra feltforsøk. Forslaget er forenklende for både søker og myndigheter.
For dyreforsøk vil hensyn til etisk forsvarlighet dekkes av annet regelverk (dyrevelferdsloven).
Når det gjelder kravene til konsekvensutredning utover vurderingen av etisk forsvarlighet, stiller forskrift om konsekvensutredning etter genteknologiloven visse krav som bygger på utsettingsdirektivet. Det skal etter direktivet foretas en miljørisikovurdering, ved forsøksutsetting som ved annen utsetting. Vurderingen skal omfatte helse og miljø, og kravene er detaljerte. Ordlyden er imidlertid på flere punkter fleksibel, for eksempel heter det i vedlegg III at søknadene som hovedregel skal inneholde disse opplysningene, og at det ikke stilles krav om fremleggelse av opplysningene hvis det ikke er relevant eller nødvendig.
For å gjøre det enklere med forsøksutsetting, foreslås det i moderniseringsalternativet at kravene til konsekvensutredning ved forsøksutsetting begrenses til en vurdering av miljørelaterte helsekonsekvenser samt relevante miljøaspekter, slik som spredningspotensialet til GMO-en samt krav om risikohåndteringstiltak for å begrense spredning og helse- og miljøskader fra forsøket.
Moderniseringsalternativet innebærer også at det lages egne søknadsskjemaer for forsøksutsetting av ulike typer genmodifiserte organismer. Også dette vil forenkle søknadsprosessen for søker. Etter hvert som kunnskapsgrunnlaget utvikles, er det også mulig at noen typer forsøksutsettinger kun vil kreve melding om visse vilkår er oppfylt.
Fortsatt trinnvis utsetting
I moderniseringsalternativet beholdes prinsippet om at utsetting som hovedregel skal skje trinnvis. Prinsippet finnes i genteknologiloven § 10 første ledd og i fortalen punkt 24 til utsettingsdirektivet.
Forslag til regelverksendringer
Unntak av søknader om utsetting i forskningsøyemed (feltforsøk) fra vurdering av etisk forsvarlighet kan gjøres med et nytt tredje ledd i genteknologiloven § 10 med følgende ordlyd:
Utsetting som nevnt i § 9 bokstav a kan godkjennes uten noen vurdering av bærekraft, samfunnsnytte og etikk.
Konsekvensutredning er regulert i genteknologiloven § 11. Det følger av første ledd at søknad om godkjenning av en utsetting skal inneholde konsekvensutredning blant annet for å klarlegge risikoen for helse- og miljømessige skadevirkninger, og at Kongen kan i forskrift gi bestemmelser om blant annet utredningens innhold og om unntak fra utredningsplikten. Det kan i §11 eller i forskrift om konsekvensutredning etter genteknologiloven tas inn en bestemmelse om forsøksutsetting med for eksempel følgende ordlyd:
For søknad om utsetting som nevnt i § 9 bokstav a skal kravene til konsekvensutredning anses som oppfylt dersom søknaden inneholder
a) vurdering av miljørelaterte helsekonsekvenser
b) vurdering av relevante miljøaspekter slik som spredningspotensialet og
c) risikohåndteringstiltak for å begrense helse- og miljøskade fra forsøket.
Det utarbeides eget søknadskjema for å forenkle prosessen for søker.
10.3.2.7 Etablere en felles søknadsportal
En søknad etter genteknologiloven har en saksbehandlingsfrist på inntil 90 dager. Tidsfrister for saksbehandling følger av forskrift om konsekvensutredning etter genteknologiloven § 8 og § 9 for nesten alle typer utsetting av GMO, inkludert omsetning. Fristen for vedtak eller vurderingsrapport er senest 90 dager og følger av utsettingsdirektivet.
Det er likevel viktig at saksbehandlingen etter genteknologiloven ikke er mer langvarig eller omstendelig enn nødvendig. I 2017 vedtok miljøforvaltningen nye rutiner for behandling av søknader om omsetning som fremmes under utsettingsdirektivet. Rutinene innebærer at nasjonale instanser har fått klargjort sitt ansvar, ingen instanser involveres mer enn én gang, og saksbehandlingen foregår parallelt med saksbehandlingen i EU. Rutinene gjelder ikke GMO-legemidler, som behandles etter annet regelverk. Norske myndigheter har så langt ikke mottatt noen søknader fremmet under utsettingsdirektivet etter at de nye saksbehandlingsrutinene trådte i kraft.
Moderniseringsalternativet innebærer etablering av en felles søknadsportal for å lette søknadsprosessen for søker. Søker kan dermed om ønskelig sende inn en søknad som gjelder både levende og prosessert GMO ett sted, i stedet for to søknader til to myndigheter.
Miljømyndighetene (ansvar for levende GMO) og matmyndighetene (ansvar for prosessert GMO) koordinerer søknadsbehandlingen seg imellom. Myndighetene foretar også eventuell koordinering med EU, alternativt kobles den norske søknadsportalen til søknadsportalen i EU. Søker vil motta vedtak etter begge lover, dette kan om ønskelig gjøres i ett og samme dokument.
Regelverksendring
Det foreslås ikke endring i regelverk, men endring i praksis ved etablering av felles søknadsportal.
10.3.2.8 Veiledningsdokumenter oppdateres i takt med teknologiutviklingen
EFSA har en rekke dokumenter som veileder søker i utarbeidelsen av dokumentasjonsgrunnlaget bak en søknad. Det er viktig at de oppdateres jevnlig i takt med kunnskapsgrunnlaget og opparbeidet erfaring. Dokumentene må være tydelige på hvilke datakrav som er relevante for risikovurdering av organismer som bærer genetiske endringer innført ved for eksempel målrettet mutagenese (A) og cisgenese (B). I EU er det nå en vurdering av regelverket for planter framstilt ved målrettet mutagenese og cisgenese. Moderniseringsalternativet legger til rette for at norsk regelverk kan tilpasses nytt regelverk i EU for slike planter.
Fortsatt vil ansvaret for den vitenskapelige risikovurderingen ligge hos VKM. Pågående prosesser i EFSA med hensyn på oppdatering og videreutvikling av dagens veiledningsdokumenter må følges opp kontinuerlig.
Forslag til regelverksendring
Det foreslås ikke regelverksendring, men legges til rette for at norsk regelverk kan tilpasses nytt regelverk i EU.
10.3.2.9 Utvikle konsensusdokumenter og andre systemer for å bygge felles kunnskapsgrunnlag
Det foreslås at datagrunnlaget som benyttes i risikovurderinger, utvikles bevisst med hensyn til å bygge opp og dokumentere erfaring med genetikk, organisme og egenskap. Utvikling av fagfellevurderte konsensusdokumenter og annen systematisk innsamling og presentasjon av data vil lette vurderingen av GMO-er, og utviklingen av fremtidige søknader, jamfør bruk av begrepene Qualified presumption of safety og Generally recognized as safe i risikovurderingen bak bruk av mikroorganismer i matkjeden.
Det foreslås endret praksis med hensyn til publisering av studier som ligger til grunn for søkers dokumentasjon knyttet til risiko, og økt adgang for myndighetene til å kunne utarbeide generiske vurderinger basert på kunnskap etablert i tidligere søknader og fra produkter i markedet. Det foreslås lovendring.
Økte krav og forventninger til rutinemessig publisering av all forskning som underbygger risikovurderinger, vil muliggjøre bruk av generiske konsensusdokumenter som del av risikovurderingen. Slike dokumenter kan etableres og forvaltes på ulike måter, og omfatte fagfellevurderte kunnskapsoppsummeringer og andre sammenstillinger av data. Det er viktig at dokumentene er åpent tilgjengelig.
Dokumentene kan fokusere på etablert kunnskap knyttet for eksempel til innsettingspunkt, genetikk, genetisk trekk/endring, organismens grunnleggende biologi med mer, og derfor være mest aktuelle for ofte benyttede genetiske endringer/organismer. Dokumentene vil heller ikke gi svar på alle risikomomenter i en organismes egenskaper i tiltenkt miljø og det vil derfor fortsatt være behov for sak-til-sak-tilnærming, Slike dokumenter vil være effektiviserende både for søkers etablering av dokumentasjonsgrunnlag og for risikovurderingsprosessen.
For å bidra til raskere og enklere saksbehandling bør informasjon som ikke er åpent tilgjengeliggjort eller unntatt offentlighet kunne nyttiggjøres i påfølgende risikovurderinger. En mulighet er at myndighetene og VKM får en klar hjemmel til å ta i bruk informasjon fra tidligere søknader, som er unntatt offentlighet, ved behandling av nye søknader om lignende forhold. Denne informasjonen skal ikke offentliggjøres, men danne grunnlag for å etablere og bygge generisk kunnskap til forvaltningens eget bruk.
Erfaringer fra VKM viser at selskaper er opptatt av at informasjon i søknader ikke skal brukes for andre formål. En klar hjemmel i genteknologiloven for forvaltningen og VKM til å bruke informasjonen i forbindelse med andre saker (samtidig som behov for konfidensiell informasjon vurderes), vil klargjøre rettstilstanden både for søkere og for forvaltningen. En slik hjemmel skal ikke kunne benyttes til å redusere annet offentlig innsyn eller åpenhet.
Siden informasjonen skal være til forvaltningen eller VKMs eget bruk, og fremdeles ikke gis innsyn i, antas det at en bestemmelse om dette ikke vil være i strid med utsettingsdirektivets bestemmelser om offentlighet i artikkel 25. Denne bestemmelsen ble sist endret ved den såkalte åpenhetsforordningen. Den anses heller ikke å være i strid med Cartagenaprotokollen artikkel 21, blant annet fordi det ikke er snakk om å bruke informasjonen for et kommersielt formål, jamfør artikkel 21 nr. 4.
Forslag til regelverksendring
Spørsmålet om offentlighet reguleres i dag av genteknologiloven § 12. Det foreslås at det tas inn et nytt femte ledd i bestemmelsen med for eksempel følgende ordlyd:
Bestemmelsene om taushetsplikt er ikke til hinder for at forvaltningen eller Vitenskapskomiteen for mat og miljø tar i bruk opplysninger i søknader til oppbygging av erfaring og kompetanse, såfremt opplysningene fremdeles unntas fra innsyn.
10.3.2.10 Innføre økte krav til praktisering av åpenhet
Offentlig høring av enkeltsaker skal fortsatt gjennomføres. Moderniseringsalternativet innebærer at det fortsatt skal foretas høring for søknader om utsetting av alle GMO-er. Dette følger i dag av genteknologiloven §13 og utsettingsdirektivet artikkel 9.
Formålet med forslaget er primært kvalitetssikring, åpenhet og å opprettholde tilliten mellom myndighetene og befolkningen. Høringen bør skje på en effektiv måte, og høringsfristen kan kortes ned der det er etablert praksis og erfaringsgrunnlag.
I den grad den ikke allerede kommer til anvendelse, bør åpenhetsforordningens bestemmelser knyttet til EFSAs behandling av GMO-søknader også gjelde for VKMs risikovurdering samt for Bioteknologirådets vurdering av etisk forsvarlighet.
I kapittel 11 omtales blant annet regler i annet lovverk om tilgang til genetisk materiale, herunder slike regler i naturmangfoldloven §§ 57 – 61 a. Som det fremgår der bør kravene om opplysninger som finnes i naturmangfoldloven, også reflekteres i genteknologiloven. Dette kan gjøres ved at opplysninger, som uansett kreves i henhold til naturmangfoldloven, skal ligge ved søknader etter genteknologiloven, og dermed være en del av søknadsprosessen. Slike opplysninger vil typisk være relevante ved vurderingen av BSE-kriteriene.
Det er aktuelt å ta i betraktning hvilken form for immaterielle rettigheter søkeren om utsetting eller omsetning av en GMO har ervervet eller tar sikte på å erverve ved vurderingen av BSE-kriteriene. Hvordan søkeren har skaffet seg tilgang til genmaterialet vil følgelig kunne få betydning for utfallet av søknader om utsetting eller markedsføring av GMO-er. Tilsvarende kan det være aktuelt å ta i betraktning om søkeren har gjort digital informasjon om gensekvenser tilgjengelige i offentlige eller private databaser, og hva slags tilgang andre vil ha til disse dataene. Eksempelvis vil informasjon om avtaler om fordeling av goder med urfolk som har bidratt med tradisjonell kunnskap, være relevant når det skal tas stilling til hvordan GMO-en bidrar til bærekraftig utvikling. På denne bakgrunn foreslås det en ny bestemmelse i genteknologiloven.
Forslag til regelverksendring
Det foreslås en gjennomgang av hvordan åpenhetsforordningen praktiseres.
Videre foreslås det en ny bestemmelse i genteknologiloven § 10 med følgende ordlyd:
Opplysninger om genetisk materiale, som kreves i den konkrete saken i henhold til lov 19. juni 2009 nr. 100 om forvaltning av naturens mangfold §§ 57 – 61 a eller forskrifter i medhold av loven, skal sendes inn sammen med søknader etter genteknologiloven.
10.3.2.11 Utarbeide et klart regelverk for sameksistens
Ved eventuell dyrking av GMO i Norge må det sikres at de som dyrker konvensjonelle eller økologiske avlinger ikke lider økonomiske tap eller opplever andre ulemper på grunn av innblanding av GMO i avlingene som dyrkes i nærheten av arealer hvor det dyrkes GMO, dette omtales som sameksistens. For mer omtale av sameksistens, se punkt 10.3.2.24.
Dyrking, håndtering, lagring eller transport av avling må foregå på en slik måte at genmodifisert plantemateriale ikke spres til arealer der det ikke dyrkes genmodifiserte vekster, eller til avlinger fra slike arealer. Bønder som dyrker genmodifiserte planter, må derfor opprette en buffersone for å hindre spredning.
Utsettingsdirektivet hjemler retten til å gjennomføre nasjonale tiltak som sikrer dette og Europakommisjonen utarbeidet i 2003 retningslinjer. De ble oppdatert i 2010.
Sameksistensregelverket er en forutsetning for å kunne ha adskilte linjer fra jord til bord, ikke minst for å sikre forbrukeres mulighet til å velge mellom genmodifiserte produkter og produkter som ikke inneholder, består av eller er framstilt på grunnlag av genmodifiserte organismer, jamfør punkt 23 i moderniseringsalternativet.
Det foreslås at det utarbeides et regelverk for sameksistens ved dyrking, blant annet basert på Mattilsynets utkast fra 2007 og kommisjonens oppdatering i 2010. Regelverket må være oppdatert i henhold til kunnskaps- og teknologiutviklingen etter 2010.
Behovet for regelverk for sameksistens må også vurderes knyttet til eventuell utsetting av genmodifiserte dyr og mikroorganismer, eksempelvis ved utsetting av genmodifisert oppdrettslaks.
Forslag til regelverksendringer
Det foreslås ingen regelverksendringer.
10.3.2.12 Opprettholde dagens regulerings- og forvaltningsansvar
I dag reguleres levende GMO i genteknologiloven og miljømyndighetene har ansvar for utsetting (inkludert omsetning) av levende GMO. Prosessert GMO til mat og fôr reguleres i matloven og matmyndighetene har ansvaret for forvaltningen. Dette er omtalt i kapittel 6. I tillegg har helsemyndighetene ansvar for genmodifiserte legemidler, jamfør kapittel 12. I moderniseringsalternativet foreslås at dette regulerings- og forvaltningsansvaret opprettholdes.
Levende GMO kan spre seg i naturen og påvirke andre organismer, populasjoner eller økosystemer. Egenskapen organismen er tilført ved genmodifiseringen kan også spre seg ved kryssing, ikke minst hvis egenskapen medfører økt fitness. Levende GMO har derfor andre miljømessige utfordringer enn prosessert GMO.
Naturmangfoldloven legger til grunn at naturens mangfold og økologiske funksjoner må bevares på lang sikt. I lovens formål (§ 1) står det at naturen skal tas vare på slik at den også gir grunnlag for menneskers virksomhet, kultur, helse og trivsel, og også som grunnlag for samisk kultur. I dag står verden midt i en naturkrise og innvirkninger som nå skjer i løpet av kort tid kan være like store som de samlede virkningene av aktiviteter som skjedde over flere hundre år tidligere i historien.
Også i Norge er det stadig økende press på natur og økosystemer, og det må derfor tilstrebes å forvalte naturen på en bærekraftig måte.Naturmangfoldloven er en helt sentral del av denne forvaltningen og utsetting av levende GMO som har konsekvenser for naturmiljøet må dermed også være i overensstemmelse med denne loven. Det er miljømyndighetene som har regulerings- og forvaltningsansvar for naturmangfoldloven.
Utvalgsmedlemmene Aina Bartmann, Ingvild Jakobsen, Kaare Magne Nielsen og Fern Wickson mener hensynet til naturens mangfold og økologiske funksjoner må ivaretas ved all utsetting av levende GMO.
Miljømyndighetene har et klart, sektorovergripende ansvar når det gjelder naturmiljøet og besitter fagkompetanse og lang erfaring med å håndtere miljørisiko.
Disse medlemmene vil derfor opprettholde miljøforvaltningens ansvar for å legge en helhetlig tilnærming til grunn for regulering og forvaltning av levende GMO.
Kriteriene bærekraft, samfunnsnytte og etikk skal etter genteknologiloven tillegges vesentlig vekt i vurderingen av alle saker om utsetting, bortsett fra forsøksutsetting. Medlemmene bak moderniseringsalternativet mener det er viktig å opprettholde dette kravet til utsetting av alle levende GMO-er, noe som også tilsier at dagens regulerings- og forvaltningsansvar opprettholdes.
Dagens regulerings- og forvaltningsansvar er ikke til hinder for forenkling og effektivisering.
Aktuelle tiltak for effektivisering er tydeliggjøring av de ulike instansenes roller for å unngå overlapp, tidsmessig parallell/koordinert saksbehandling i de tilfeller der flere instanser er involvert, og innføring av flere delfrister slik at saksbehandlingstiden ikke blir lengre enn nødvendig for en forsvarlig saksbehandling.
Forslag til regelverksendringer
Det foreslås ikke regelverksendringer.
10.3.2.13 Lovfeste føre-var-prinsippet
Genteknologiloven har en oppbygning i tråd med føre-var-prinsippet, men prinsippet er ikke nevnt i selve lovteksten. Gjennom EØS-avtalen er Norge på dette området også forpliktet av føre-var-prinsippet i utsettingsdirektivet.
Moderniseringsalternativet legger vekt på at en lovfesting av føre-var-prinsippet i genteknologiloven vil klargjøre lovgrunnlaget og betydningen av føre-var-prinsippet. En lovfesting kan også bidra til en mer ensartet praksis etter genteknologiloven. En lovfesting har ikke til hensikt å endre gjeldende rett.
Mindretallet viser til at Norge gjennom EØS-avtalen er forpliktet til å følge føre-var-prinsippet i EUs utsettingsdirektiv. Prinsippet er også tatt inn i folkerettslige avtaler som Norge er bundet av. En lovfesting i genteknologiloven kan dermed også klargjøre Norges internasjonale forpliktelser.
Moderniseringsalternativets utgangspunkt for lovtekst er bestemmelsen om dette i naturmangfoldloven § 9 som lyder:
Når det treffes en beslutning uten at det foreligger tilstrekkelig kunnskap om hvilke virkninger den kan ha for naturmiljøet, skal det tas sikte på å unngå mulig vesentlig skade på naturmangfoldet. Foreligger en risiko for alvorlig eller irreversibel skade på naturmangfoldet, skal ikke mangel på kunnskap brukes som begrunnelse for å utsette eller unnlate å treffe forvaltningstiltak.
Forslag til regelverksendring
Når det treffes en beslutning under utøvelse av offentlig myndighet uten at det foreligger tilstrekkelig kunnskap om hvilke virkninger den kan ha for helse eller miljø, skal det tas sikte på å unngå mulige vesentlige helse- og miljømessige skadevirkninger. Foreligger en risiko for alvorlig eller irreversibel skade på helse eller miljø, skal ikke mangel på kunnskap brukes som begrunnelse for å utsette eller unnlate å treffe forvaltningstiltak.
10.3.2.14 Legge til rette for at norsk regelverk kan tilpasses nytt regelverk i EU
Europakommisjonen vurderer for tiden nytt regelverk for planter utviklet med målrettet mutagenese og cisgenese. Moderniseringsalternativet legger til rette for at norsk regelverk kan tilpasses nytt regelverk i EU, blant annet når det gjelder GMO-definisjonen og risikovurderinger. Det legges til rette for innlemmelse av fremtidig EØS-regelverk, i tråd med vedtak i EØS-komiteen og av regjering og Storting.
Forslag til regelverksendring
Det fremmes ikke forslag til regelverksendringer.
10.3.2.15 Videreføre sak-til-sak basert risikovurdering
Moderniseringsalternativet legger til grunn at det ikke er en lineær sammenheng mellom hvilken teknikk som er anvendt og/eller omfanget av genmodifiseringen og endringen i organismens risikoprofil. Det innebærer at små genotypiske endringer kan ha betydelige fenotypiske eller miljømessige konsekvenser, og vice versa. Det er derfor nødvendig å opprettholde dagens sak-til sak-tilnærming ved all risikovurdering av genmodifiserte organismer og produkter i Norge og EU, et standpunkt som også deles av EFSA og VKM, jamfør kapittel 8.
En organisme kan ha negative helse- og miljøeffekter selv om ikke fremmed DNA er tilført. En hypotetisk laks som er genredigert for å fremme veksten vil for eksempel måtte gjennom en omfattende miljørisikovurdering selv om omfanget av de genetiske endringene ikke nødvendigvis er omfattende.
Dagens lovfestede og etablerte praksis med sak-til-sak-vurdering av risiko starter med et fareidentifikasjons-steg (hazard identification). Identifisert fare karakteriseres og vurderes, og det konkluderes samlet på risiko med hensyn på tiltenkt bruk (kapittel 8). En risikovurdering baseres på en komparativ analyse for å bekrefte tilsiktede og utelukke utilsiktede effekter. Datagrunnlaget for forståelsen av organismen skjer i tiltenkt miljø. Dette utdypes i kapittel 8.
Genteknologiloven § 10 og utsettingsdirektivet vedlegg II om miljørisikovurdering slår fast at det skal være en sak-til-sak-vurdering. I moderniseringsalternativet videreføres sak-til-sak basert risikovurdering.
Forslag til regelverksendring
Det foreslås ingen endring i regelverket.
10.3.2.16 Fortsatt restriktiv bruk av melding
Moderniseringsalternativet legger til grunn at alle GMO må godkjennes fra sak til sak, men vil opprettholde adgangen til å bruke melding i genteknologiloven § 10 femte ledd. Det innebærer at Kongen kan gi forskrift om at bestemte typer genmodifiserte organismer kan settes ut i bestemte miljøer uten godkjenning, men utsettingen skal være meldepliktig. Denne adgangen gjelder tilfeller der bestemte organismer er satt ut i bestemte naturmiljøer, og erfaringene viser at den aktuelle form for utsetting ikke medfører fare for helse eller miljø, jamfør Ot.prp. nr. 8 (1992–93).
Klima- og miljødepartementet kom i 2020 til at forskrift 23. oktober 2020 nr. 2124 om klinisk utprøving og utlevering av GMO-legemidler til behandling eller forebygging av covid-19 kunne fastsettes med hjemmel i genteknologiloven § 10 femte ledd.
Det er ikke helt samsvar mellom lovens ordlyd om melding og føringen i Ot.prp. nr. 8 (1992–93), som synes strengere. Moderniseringsalternativet legger lovens formulering, som er videre, til grunn. Dette kan eventuelt presiseres i en ny lovproposisjon.
Forslag til regelverksendring
Det foreslås ingen endring i regelverket
10.3.2.17 Opprettholde gebyrfrihet for søknad etter genteknologiloven
Moderniseringsalternativet innebærer at søknader etter genteknologiloven fortsatt kan fremmes uten gebyr. I motsetning til under matloven er det i dag ikke gebyr for søknader etter genteknologiloven. Formålet med gebyrfriheten er å gjøre det lettere å fremme søknad, og dermed bidra til innovasjon.
Forslag til regelverksendring
Det foreslås ingen endring i regelverket.
10.3.2.18 Styrke tilbud om veiledning i søknadsprosessen
Erfaring tilsier at det kan ta lang tid fra lovvedtak til det blir utarbeidet forskrifter og veiledningsmateriell som er viktig for effektiv og målrettet gjennomføring av loven. I moderniseringsalternativet legges det stor vekt på å sikre effektiv gjennomføring av loven. Dette innebærer at loven må stimulere til vedtak av forskrifter og veiledningsmateriell der dette er særlig viktig for effektiv gjennomføring.
Veiledning bør være tilgjengelig tidlig i produktutviklingen, slik at det informeres godt om de formelle og regulatoriske konsekvensene av å benytte ulike teknikker/DNA materiale, og dessuten sent i prosessen, der det blant annet er spørsmål om å vurdere positivt bidrag når det gjelder etisk forsvarlighet og hvilke data som skal oversendes sammen med søknaden. Veiledning skal gis ved at det publiseres oppdaterte skriftlige veiledningsdokumenter, som kan suppleres med muntlig veiledning ved behov. På denne måten kan forvaltningen veilede søker om saksbehandling og praksis, herunder kravene til konsekvensutredning, og gi råd om hva søker bør legge ved av data for å fremme en effektiv saksbehandling. Slik veiledning kan være ressursbesparende, bidra til mer tidseffektive konsekvensutredninger og fremme bærekraftige produkter. Dette kan samtidig medføre at forvaltningen får færre søknader til behandling for GMO-er og produkter som er mangelfulle, og som returneres søker med uavklart risiko for miljø- og helseskade. Slik veiledning bygger på og videreutvikler forvaltningens veiledningsplikt i forvaltningsloven § 11.
Forslag til regelverksendring
En nærmere regulering av spørsmålet om veiledning i genteknologiloven kan gjøres på ulikt vis. Det foreslås at Klima- og miljødepartementet utarbeider en veileder til søker.
10.3.2.19 Opprettholde forvaltningsprinsippet om uavhengig vurdering av søkers data
Uavhengig vurdering er grunnleggende for å vurdere og korrigere kvalitet i vitenskapelige studier. Søkers dokumentasjonsgrunnlag er i dag oftest basert på søkers egne studier. Slike studier blir som oftest ikke publisert eller presentert på en måte som er effektiv for uavhengig fagfellevurdering. I dag vurderer EFSA og andre risikovurderingsorganer holdbarhet og kvalitet på søkers risikovurderinger/studier/data i lys av evidensbasen som i hovedsak produseres og kontrolleres av produsentene. Dette problemet forsterkes ved at det ikke er fri tilgang til genmodifisert materiale for å gjøre uavhengige studier.
Selektiv rapportering og manglende offentlig innsyn kan påvirke faktagrunnlaget. Det bør derfor settes tydeligere krav til blant annet publisering av risikorelevante studier, slik at kunnskapsgrunnlaget bygges over tid.
Hoveddelen av studier som benyttes i risikovurderingen av GMO-produkter på markedet i dag, er ikke underlagt annen fagfellevurdering enn den som skjer i risikovurderingen gjort av ekspertpaneler, eksempelvis i EFSA og VKM. Det er derfor viktig for tillit til forskningen og kunnskapsbyggingen i fagfeltene at data og studier gjøres tilgjengelig slik at de kan etterprøves (Nielsen, 2013).
Moderniseringsalternativets forslag om å styrke uavhengig forskning kan bidra til dette. Det samme kan forslaget om at VKM skal ha samme praksis som EFSA som følge av åpenhetsforordningen.
Forslag til regelverksendring
Det foreslås ikke regelverksendring,
10.3.2.20 Norge skal fortsatt basere risikovurderinger på EFSAs veiledningsdokumenter
Moderniseringsalternativet tar utgangspunkt i EFSAs veiledningsdokumenter som kontinuerlig oppdateres. VKM bruker også EFSAs retningslinjer i sine risikovurderinger hvor særnorske forhold tillegges vekt.
I 2021 publiserte VKM en rapport der de vurderte relevansen av retningslinjene for både planter, dyr og mikroorganismer utviklet ved hjelp av nye metoder for genmodifisering. Rapporten konkluderer med at EFSAs veiledning er egnet til å foreta helse- og miljørisikovurdering av et bredt spekter av organismer med ulike egenskaper og bruksområder, inkludert genomredigerte organismer. En hovedårsak til dette er at veiledningene er fleksible og bygger på en sak til sak tilnærming.
VKM konkluderte videre med at de delene av helse- og miljørisikovurderingen som tar utgangspunkt i egenskap (det vil si fenotypen til en organisme), kan benyttes for alle kategorier av genomredigerte organismer. Når det gjelder de delene av helse- og miljørisikovurderingen som tar utgangspunkt i genetisk endring (det vil si genotypen til en organisme), kan retningslinjene til EFSA benyttes for risikovurdering av genomredigerte organismer hvor det er satt inn gener eller lange fragmenter av DNA. Retningslinjene kan imidlertid ikke benyttes fullt ut for genomredigerte organismer med enkle nukelotidendringer som enkeltbaseendringer, herunder sletting.
Når det gjelder miljøvurderinger konkluderer VKM med at EFSAs retningslinjer for miljørisikovurdering kan anvendes fullt ut ved vurdering av organismer utviklet ved nye genomteknikker (VKM 2021).
Samlet sett anser VKM i 2021-rapporten at EFSAs veiledning danner et funksjonelt rammeverk for risikovurdering av genomredigerte organismer, men at det i tillegg vil være gunstig å inkludere aspekter som er spesifikke for genomredigerte organismer for å sikre at produktutviklere og risikovurderere har en felles forståelse av type og omfang av data som trengs for å utføre en risikovurdering. VKM konkluderte også med at det er mye usikkerhet knyttet til forholdet mellom mulighetene de nye teknologiene gir, hvordan organismer utviklet med de nye teknologiene skal risikovurderes og det regulatoriske landskapet, jamfør VKM 2021, kapittel 12.
Moderniseringsalternativet bygger på VKM-rapporten og legger til grunn at dagens veiledning også er relevant ved vurdering av nye genredigerte organismer og produkter, men at de må oppdateres for noen typer av organismer/produkter, deriblant organismer der det ikke er satt inn fremmed (eksogent) DNA. Det antas at veiledningen vil oppdateres i tråd med konklusjonene fra VKM.
Forslag til regelverksendring
Det foreslås ikke regelverksendring.
10.3.2.21 Styrke uavhengig forskning
For å bidra til økt kunnskap om genteknologi og genmodifiserte organismer er det behov for mer uavhengig forskning. Denne forskningen skal være åpen og ha tillit blant ulike aktører og interessenter. For å sikre forskning som er uavhengig av kommersielle interesser, er det behov for økt bruk av offentlige midler til forskning.
Den uavhengige forskningen må bidra til å løse biologiske, økologiske og samfunnsmessige grunnproblemer knyttet til genteknologi og genmodifiserte organismer. Forskningen bør inngå som en del av det grønne skiftet ved å bidra til å løse utfordringer som klimaendring og tap av naturmangfold.
Det er viktig å forske på mulige anvendelsesområder og innovasjoner. Her er det mange pågående forskningsprogrammer i Norge, både i landbruk og oppdrettsnæring. Det er også viktig at det offentlige tar et særlig ansvar for å finansiere grunnforskning som vanskelig lar seg finansiere med private midler, deriblant forskning knyttet til mulig risiko. Det foreslås å opprette flerårige, brede forskningsprogrammer.
10.3.2.22 Videreføre adgangen til å forby en GMO som er godkjent for omsetning i et annet EØS-land
Når det gjelder Norges adgang til å forby import av GMO-produkter basert på bærekraft, samfunnsnytte og etikk, viser det norske forbudet i 2017 at det er handlingsrom for å forby GMO-produkter ut fra etikkhensyn etter WTO-regelverket, jamfør omtale i kapittel 6. Cartagenaprotokollen artikkel 26 nr. 1 som omhandler adgangen til å kunne forby ut fra sosioøkonomiske hensyn er også relevant. Når det gjelder EØS-avtalen, åpner tilpasningsteksten til utsettingsdirektivet for at Norge kan forby ut fra sin nasjonale lovgivning også når helse og miljø ikke berøres.
I moderniseringsalternativet legges stor vekt på bærekraft, samfunnsnytte og etikk. Det foreslås å opprettholde dagens adgang til å forby EU-godkjente GMO-er ut fra BSE-kriteriene.
Mindretallet viser også til at krav til bærekraft nå blir del av EUs regelverk på ulike samfunnsområder.
Pedagogiske hensyn kan tale for å dele opp § 10 slik at sjette ledd blir en egen paragraf og mer synlig. Videre er det ønskelig å klargjøre bestemmelsens innhold noe, ved å presisere at GMO-en er tillatt omsatt i Norge inntil norske myndigheter eventuelt nedlegger forbud. Dette gjøres ved å ta inn ordlyden Produktet er tillatt omsatt i Norge inntil norske myndigheter eventuelt nedlegger forbud.
Samtidig ønsker mindretallet å beholde en fleksibel ordlyd. En vurdering av bærekraft, samfunnsnytte og etikk innebærer bruk av skjønn, og ulike regjeringer vil kunne vektlegge hensynene ulikt.
Klima- og miljødepartementet har 5. juli 2017 fastsatt saksbehandlingsprosedyrer for søknader om omsetning etter genteknologiloven, fremmet under utsettingsdirektivet. Prosedyrene kommer til anvendelse både når søknaden fremmes i et annet EØS-land og der søknaden fremmes i Norge. Rutinene forenkler tidligere rutiner og legger til rette for at Norge kan komme til en avgjørelse kort tid etter godkjenning av en GMO i EU. Dette gjøres ved at saksbehandlingen i Norge foregår parallelt med EUs saksbehandling. VKM, Mattilsynet og Bioteknologirådet skal hovedsakelig involveres i forbindelse med konsultasjonsrundene i EU.
Dersom Norge er mottakerland for søknaden, skal Miljødirektoratet utarbeide en tidsplan for behandlingen av søknaden, og snarest informere berørte organer. VKM vil etter rutinene bli bedt om å utarbeide en risikovurdering av den omsøkte GMO-en. Mattilsynet vil bli bedt om å gi en vurdering av søknaden innenfor sine ansvarsområder til Miljødirektoratet. Bioteknologirådet vil bli bedt om å innhente og vurdere informasjon vedrørende bærekraft, samfunnsnytte og etikk. Vurderingsrapporten med tilrådning sendes av Miljødirektoratet sammen med søknaden til Europakommisjonen etter konsultasjon med Klima- og miljødepartementet.
Saksbehandlingen i EU, uavhengig av om søknaden fremmes i Norge eller ikke, starter ved at søknaden om omsetning vurderes av mottakerlandet. Vurderingsrapporten oversendes EU-kommisjonen. Dersom ansvarlig nasjonal myndighet anbefaler søknaden godkjent, forelegger EU-kommisjonen saken for de øvrige EØS-landene gjennom en eller to konsultasjonsrunder på henholdsvis 60 og 45 dager. I de tilfeller hvor et eller flere EØS-land eller EU-kommisjonen har innsigelser eller spørsmål, skal EU-kommisjonen be EFSA om en vitenskapelig vurdering av disse forhold.
De norske saksbehandlingsrutinene nevner ikke uttrykkelig det tilfelle at en søknad om omsetning under utsettingsdirektivet som fremmes i Norge avslås av hensyn til bærekraft, samfunnsnytte og etikk. Mindretallet anser at det vil være mest i tråd med utsettingsdirektivet at slike søknader likevel videresendes av norske myndigheter til EU, siden avslagsgrunnen ikke knytter seg til utsettingsdirektivets kriterier (helse og miljø).
Det foreslås endring i genteknologiloven ved at § 10 sjette ledd oppheves og erstattes av ny § 10 a:
Forslag til regelverksendring
§ 10 a Godkjenning av et produkt som er godkjent i et annet EØS-land
Det kreves ikke godkjenning for omsetning av et produkt som er godkjent for omsetning i et annet EØS-land etter reglene fastsatt i EØS-avtalen vedlegg XX punkt 25d (rådsdirektiv 2001/18/EF). Produktet er tillatt omsatt i Norge inntil norske myndigheter eventuelt nedlegger forbud. Myndighetene etter loven her kan likevel forby eller begrense omsetningen dersom den etter deres syn medfører risiko for helse eller miljø, eller omsetningen for øvrig er i strid med denne lovs formål.
10.3.2.23 Opprettholde krav om sporing, deteksjon og merking
Moderniseringsalternativet innebærer at dagens krav til sporing, deteksjon og merking opprettholdes for alle GMO-er.
10.3.2.23.1 Sporing
Sporing er ikke omtalt i genteknologiloven, men i forskrift om konsekvensutredning etter genteknologiloven. Vedlegg 1 Del A i forskriften beskriver opplysninger som skal gis i søknad om utsetting av andre genmodifiserte organismer enn høyerestående planter. Opplysningene skal blant annet omfatte Metoder for sporing av de genmodifiserte organismene og overvåking av virkningene, jamfør punkt V, A 1.
Den samme bestemmelsen finnes i utsettingsdirektivet Vedlegg III A om opplysninger som skal gis i søknad om utsetting av andre genmodifiserte organismer enn høyerestående planter. Opplysningene skal blant annet omfatte metoder for sporing av de genmodifiserte organismene og for overvåking av virkningene, jamfør punkt V, A 1.
Sporing er videre regulert i utsettingsdirektivet artikkel 4 nr. 6. Denne bestemmelsen forplikter medlemsstatene til å treffe tiltak for å sikre sporbarhet på alle stadier av omsetningen av GMO-er, som er tillatt for omsetning, i overensstemmelse med kravene i bilag IV.
Sporbarhet reguleres for EU-landene videre av forordning (EF) nr. 1830/2003 om sporbarhet og merking av genetisk modifiserte organismer m.m. Forordningen innebærer blant annet at utsettingsdirektivet artikkel 4 nr. 6 erstattes av EUs regler. Forordningen er foreløpig ikke innlemmet i EØS-avtalen.
Moderniseringsalternativet innebærer at kravene til sporing/sporbarhet opprettholdes. Sporingen kan være dokumentbasert, en praksis som også brukes i matforvaltningen, for eksempel innen økologisk produksjon.
Forslag til regelverksendring
Det foreslås ingen endring i regelverket.
10.3.2.23.2 Deteksjon/påvisning
Deteksjon (påvisning) er ikke omtalt i selve genteknologiloven, men i forskrift om konsekvensutredning etter genteknologiloven. Forskriften vedlegg 1 omhandler opplysninger som er nødvendige for beskrivelse av det tiltaket det søkes om godkjenning for i henhold til forskriften § 13 – § 16. Her nevnes blant annet metoder og teknikker for påvisning. Påvisning er også nevnt i vedlegg 2 og 3. Det vises til omtalen av genteknologiloven i kapittel 6. Forskrift om konsekvensutredning etter genteknologiloven bygger på utsettingsdirektivet med vedlegg.
Moderniseringsalternativet innebærer at dagens krav til deteksjon opprettholdes. For noen genredigeringsteknikker er det foreløpig ikke utviklet gode verktøy for detektering. Det er derfor viktig å utvikle pålitelige metoder som blir praktisk tilgjengelig og som er økonomisk akseptable for aktørene i matkjeden.
Forslag til regelverksendring
Det foreslås ingen endring i regelverket.
10.3.2.23.3 Merking
Mindretallet mener det er viktig at alle GMO-er merkes for å gi forbrukere mulighet til å ta informerte valg. Merking av GMO reguleres av genteknologiloven § 14, som er en ren forskriftshjemmel, og forskrift til genteknologiloven om merking, transport, import og eksport av GMO (forskrift 2. september 2005 nr. 1009).
Paragraf 19 i forskriften krever at et godkjent GMO-produkt skal merkes med at det inneholder GMO. Bestemmelsene om merking gjelder for genmodifiserte organismer som i henhold til genteknologiloven § 10 er godkjent for utsetting som definert i genteknologiloven § 9 a-f, eller som i henhold til loven § 7 er godkjent eller meldt for innesluttet bruk som definert i loven § 5, eller som kan transporteres i henhold til loven § 10 og bestemmelsene i forskriften kapittel 2. Nærmere bestemmelser om merkingen gis i forskriften. § 19 gjelder ikke for næringsmidler, fôrvarer og såvarer, jamfør § 2.
Utsettingsdirektivet regulerer merking blant annet i artikkel 19 nr. 3, artikkel 21 og vedlegg IV. Artikkel 19 nr. 3 omhandler tillatelse til markedsføring. Det fremgår her at den skriftlige tillatelsen skal i alle tilfeller uttrykkelig angi merkekrav i overensstemmelse med kravene i vedlegg IV. Merking kan altså ikke unnlates. Merkingen skal klart angi at produktet inneholder en GMO, på en etikett eller i et dokument som ledsager produktet. I vedlegg IV gis noen nærmere regler. Kravene differensieres ikke.
Artikkel 21 inneholder også noen unntak fra merkekravet, knyttet til terskelverdier av GMO.
Moderniseringsalternativet innebærer at dagens krav til merking for alle GMO-er opprettholdes.
Forslag til regelverksendring
Det foreslås ingen endring i regelverket.
10.3.2.24 Separate linjer
Separate linjer fra jord/fjord og til bord er sentralt for sporing, deteksjon og merking av genmodifiserte organismer og produkter. Separate linjer er også nødvendig for å skille genmodifiserte organismer og produkter fra konvensjonelle og økologiske. Regler om sameksistens ved dyrking er bygget på prinsippet om separate linjer, jamfør punkt 10.3.2.11. Prinsippet om separate linjer er i dag også brukt for å skille konvensjonelle og økologiske produkter.
Mindretallet understreker viktigheten av separate linjer for å kunne opprettholde dagens krav til sporing, deteksjon og merking av alle genmodifiserte produkter.
10.3.2.25 Utrede muligheten for å ta inn kriterier om bærekraft, samfunnsnytte og etikk i matloven
I Norge behandles levende GMO-er til bruk i mat eller fôr etter genteknologiloven, mens prosesserte GMO-er behandles etter matloven. Det er ikke konsistens mellom krav i genteknologiloven og matloven når det gjelder vurderinger etter kriteriene bærekraft, samfunnsnytte og etikk.
Solbergregjeringens begrunnelse for å forby mais 1507 i 2017 viser at kriteriene bærekraft, samfunnsnytte og etikk kan benyttes på forhold i produksjonslandet, forhold som vil kunne være uavhengig av om en GMO er formeringsdyktig eller ikke ved import til Norge.
Norge har ikke innlemmet EUs mat- og fôrforordning i EØS-avtalen og har dermed handlefrihet til å endre regelverket slik at alle søknader om bruk av genmodifiserte organismer til mat eller fôr vurderes etter kriteriene bærekraft, samfunnsnytte og etikk. Ved en eventuell innlemmelse kan det være hensiktsmessig at denne handlefriheten beholdes ved å få samme tilpasning for behandling av prosessert GMO etter matloven som vi i dag har for levende GMO etter genteknologiloven.
Myndighetene bes utrede muligheten for at kravene om bærekraft, samfunnsnytte og etikk i genteknologiloven innarbeides helt eller delvis i matloven.
10.3.2.26 Utrede muligheten for å innføre krav til merking av animalske produkter der GMO er brukt i husdyrfôr
Det er i dag krav til å merke genmodifisert fôr, men det er ikke krav om å merke produkter fra dyr som har spist genmodifisert fôr. Krav om slik merking støttes av forbrukerorganisasjoner i Europa, inkludert Forbrukerrådet. I punkt 4 i sitt innspill til genteknologiutvalget 19. november 2021 skriver Forbrukerrådet at det bør arbeides for å få innført krav om merking av animalske produkter (slik som kjøtt, melk, ost og fisk) fra dyr som har fått GMO-fôr. Dersom det blir importert GMO-fôr til bruk i fiskeoppdrett eller landbruk, bør produktene merkes med dette.
Et krav om å merke produkter fra dyr som får GMO i fôret er i tråd med målet om at forbrukere skal ha rett til å gjøre informerte valg. Det er etablert frivillige merkeordninger i noen europeiske land, eksempelvis merket Ohne Gentechnik i Tyskland. Denne ordningen er nå markedsdominerende på meieri- og fjørfeprodukter.
Myndighetene bes utrede mulighetene for å innføre krav til merking av animalske produkter der GMO er brukt i husdyrfôr.
10.3.3 Overordnede vurderinger og hensyn som ligger til grunn for moderniseringsalternativet
10.3.3.1 Innledning
Genteknologi, inkludert nye metoder innen genredigering, har potensiale til å bidra til samfunnsnyttige og mer bærekraftige løsninger. Dette gjelder blant annet på områdene humanmedisin, miljø og matproduksjon.
I del 3 beskrives her noen av de overordnede hensynene som ligger til grunn for våre anbefalinger, med hovedvekt på GMO i matproduksjon.
Klimaendringer og tap av fruktbar matjord gjør det nødvendig å utvikle planter og dyr som er mer robuste og som kan gi gode avlinger og høy ytelse under krevende forhold. Ulike metoder innen genteknologi er viktige verktøy i dette arbeidet.
Det at teknologien kan bidra til mer bærekraftige produkter er imidlertid ikke et argument for å svekke reguleringen. Etter mindretallets vurdering er regulering tvert imot nødvendig for å stimulere til en ønsket utvikling. Bare gjennom et godt lovverk kan vi som samfunn velge å godkjenne de produktene vi ønsker å ta i bruk, og velge å forby de produktene vi ikke vil ha.
Moderniseringsalternativet legger til grunn FNs bærekraftsmål og norske myndigheters vedtatte politikk for mat, miljø, handel og bistand.
Moderniseringsalternativet er et helhetlig alternativ som innebærer endringer i flere lover, forskrifter, veiledninger og forvaltningspraksis. Alternativet bygger på internasjonale konvensjoner og avtaler. Et viktig hensyn er at endringer som foreslås i alternativet er i tråd med Norges internasjonale forpliktelser, deriblant Konvensjonen om biologisk mangfold (CBD), Cartagena-protokollen, Nagoya-protokollen, Århuskonvensjonen og WTO-avtalen. Det samme gjelder for norske forpliktelser etter EØS-avtalen, inkludert tilpasningene til utsettingsdirektivet.
10.3.3.2 Bærekraftige matsystemer
I vurderinger av om genmodifisering vil bidra positivt til matsikkerhet i fremtiden er det sentralt å vite i hvilken grad GMO-er har egenskaper som kan bidra til bærekraftige matsystemer.
GMO har fram til i dag i hovedsak blitt brukt til å produsere dyrefôr. Dette har foregått i et industrielt landbrukssystem med utstrakt bruk av monokulturer, kontraktproduksjon og sprøytemiddelresistente planter. Teknologien har vært kontrollert av noen få internasjonale selskaper som både har patentrettigheter til såfrøene og som selger de kjemiske sprøytemidlene frøene er resistente mot.
Bærekraftige matsystemer skal støtte opp under matsikkerhetens ulike dimensjoner. Det innebærer blant annet at systemene sikrer nok mat til alle, er robuste mot ulike kriser, og er bærekraftige og helsebringende. I tillegg skal alle, ikke minst de mest sårbare, ha innflytelse over hvordan matsystemene er utformet.
Et sentralt spørsmål knyttet til bærekraftige matsystemer er eierskap og råderett over naturressursene. På land er hovedspørsmålet som oftest knyttet til råderett over landbruksjord, vann, kapital og såfrø. I fiskerinæringene står rettigheter til fiskeressurser og arealbruk sentralt.
Retten til mat er den sentrale rettigheten knyttet til matsikkerhet. Matsikkerhet har ulike dimensjoner, deriblant individers og gruppers kontroll over maten de spiser og produserer, samt adgangen til å ha politisk innflytelse på beslutninger knyttet til mat.
Det vil være av stor betydning at nye GMO-er blir underlagt demokratisk kontroll slik at genteknologi ikke kommer i konflikt med prinsippet om at hvert enkelt land har rett til å utforme sin egen matpolitikk.
I Norge synes det å være bred politisk enighet om satsingen på bærekraftige matsystemer. I Solberg-regjeringens handlingsplan for bærekraftige matsystemer, Mat, mennesker og miljø49 og i Støre-regjeringens handlingsplan, Kraftsamling mot svolt legges det hovedvekt på å styrke småskalaprodusenter og deres verdikjeder. Rundt 80 % av all mat som blir konsumert i utviklingsland produseres av småskalaprodusenter. I Støre-regjeringens handlingsplan tas det til orde for agroøkologiske metoder og matsuverenitet for å sikre global matsikkerhet.
Det er bred enighet om at det produseres nok mat i verden til å brødfø dagens befolkning. FAO har utgitt oversikt over tilgang til mat, målt i kalorier. Hvis average dietary supply adequacy er høyere enn 100, er tilgangen større enn behovet. I perioden 2018-20 var tallet 124 for verden under ett. FAOs analyse viser at årsaken til vedvarende sult i verden først og fremst er knyttet til fordeling.
I fremtiden er det behov for å produsere mer mat, men like viktig er det å sikre matsystemer som er egnet til å fordele mat og produksjonsressurser rettferdig.
Rettferdighet betyr at økning i matproduksjon må foregå på måter som ikke forringer produksjonsressurser som genetisk mangfold, fruktbar matjord, hav eller ferskvannsressurser, og som på den måten undergraver fremtidige generasjoners matsikkerhet.
10.3.3.2.1 Landbruk internasjonalt
Global matproduksjon har store variasjoner i struktur, fra ren industriproduksjon på den ene siden til ulike former for familielandbruk på den andre siden.
I rapporten Sustainable Solutions to End Hunger50, utgitt av Ceres203051, oppgis følgende tall:
De fleste, omtrent to tredjedeler, av de som rammes av sult, lever på landsbygda.
Omtrent fire av fem gårdsbruk i verden er mindre enn 2 hektar.
Tre av fire småbruk befinner seg i områder hvor det er lite tilgang til vann, og to tredjedeler har ikke tilgang til kunstig vanning.
I regjeringen Solberg sin handlingsplan for bærekraftige matsystemer, Mat, mennesker og miljø står det at bærekraftige matsystemer skal sørge for matsikkerhet og god ernæring for alle og sikre det økonomiske, sosiale og miljømessige grunnlaget for fremtidige generasjoner52. Solbergregjeringen viser i denne forbindelse også til FAO53.
FAO med flere viser i en rapport i 202154 til ulike årsaker til sult og feilernæring de siste ti årene, som konflikter, klimaendring, og økonomisk stagnasjon eller nedgangstider. Dette er årsaker som forsterkes av vedvarende høy ulikhet. I rapporten vises det også til seks mulige veier (pathways) for å løse problemet, der fattigdomsbekjempelse er helt sentralt55.
Moderniseringsalternativet legger til grunn at alle nasjoner har rett til å utforme sin egen matpolitikk, inkludert retten til å velge å ta i bruk GMO eller ikke. Det er viktig å styrke internasjonale avtaler som sikrer denne retten. Det er også viktig at det i internasjonale avtaler om global matsikkerhet blir gjort helhetlige vurderinger av hvilke typer teknologier som anbefales med hensyn til ulike produksjonssystemer og sosioøkonomiske forhold.
10.3.3.2.2 Fiske og akvakultur internasjonalt
Norges andel av fiske og akvakultur globalt er betydelig, men Norad viser til at utviklingsland, inkludert Kina, står for 70 % av alt fiske og 90 % av all akvakultur. Et hovedtrekk er at dette i all hovedsak er småskalaproduksjon.
Det brukes genmodifisert fisk i oppdrettsnæringen, men omfanget er relativt begrenset, jamfør kapittel 4. I tillegg brukes det genmodifisert fôr. Norske selskapene driver oppdrett av laks i andre land og Skretting Norge viser i sitt høringssvar til at de bruker oljen Aquaterra, basert på genmodifisert raps, til fiskefôr i Chile og Nord-Amerika56.
Norsk bistand på fiskeri- og akvakulturområdet er først og fremst knyttet til Fisk for utvikling, der
(d)et overordnede mål … er fattigdomsbekjempelse gjennom matsikkerhet, bærekraftig forvaltning og lønnsom næringsvirksomhet.
10.3.3.2.3 Landbruket i Norge
Den norske landbruksmodellen vektlegger støtte til variert bruksstruktur og produksjon over hele landet, eierskap gjennom samvirkeorganisering og åpen deling av kunnskap. Hovedmålet er å produsere mat til egen befolkning.
Norsk landbruk tar raskt i bruk ny teknologi, herunder genteknologi innen konvensjonelt avl- og foredlingsarbeid. GMO er ikke tatt i bruk i planter, dyr eller fôr.
I Norge og EU er føre-var-prinsippet førende for matproduksjon og matsikkerhet.
Moderniseringsalternativet legger til grunn at norsk landbruk og norske forbrukere er tjent med en videreføring av hovedtrekkene i norsk og europeisk politikk på matsikkerhetsområdet, inkludert regulering av GMO.
10.3.3.2.4 Fiske og akvakultur i Norge
I Norge er fiskeriene og havbruket betydelige næringer med en samlet eksport i 2022 på over 150 milliarder kroner.
Per primo mai 2023 er det ikke godkjent genmodifisert fisk eller genmodifisert fiskefôr til bruk i norsk havbruksnæring. Fram til 2014 var det gitt en midlertidig tillatelse til bruk av EU-godkjente GMO i fiskefôr, men den ble trukket tilbake da ingen aktører valgte å benytte seg av GMO i fôret.
Det er en betydelig import av ressurser knyttet til oppdrett. I 2020 ble det brukt nesten 2 millioner tonn fôringredienser til laks, hvorav om lag 1,8 millioner tonn var importert. Mesteparten av fôringrediensene kom fra vegetabilske kilder.
I Norge forskes det på genmodifisering i havbruket. Mye av forskningen er knyttet til fiske, helse- og miljøulemper ved dagens produksjonsmåte, eksempelvis resistens mot sykdom og sterilitet mot faren for spredning.
10.3.3.3 Teknologiens rolle
I debatten om genteknologi vil det være ulike perspektiver, interesser og forventninger knyttet til utvikling og bruk av denne teknologien generelt og genmodifisering spesielt.
Moderniseringsalternativet legger til grunn at all forskning, utvikling og bruk av genteknologi primært må ta utgangspunkt i hvilke ulike løsningsstrategier som finnes.
Fordeler og ulemper ved ny teknologi må også vurderes opp mot det systemet den skal brukes i, ikke minst for å sikre at mulige gevinster og byrder fordeles på en rettferdig måte, jamfør omtale av prinsippet rettferdig fordeling i kapittel 9 punkt 9.6.2.
Det er også sentralt å vurdere konsekvenser teknologien vil kunne få i forbindelse med FNs bærekraftsmål om å utrydde fattigdom, bekjempe ulikhet og stoppe klimaendringene, jamfør omtale i kapittel 9 punkt 9.6.2.
Selv om genteknologi nå er mer tilgjengelig for flere aktører vil det fremdeles være behov for kapital og tilgang til markeder, inkludert mekanismer som gir etterspørsel. Dette er forutsetninger som ikke løses av teknologien, men av andre forhold. Dette inkluderer jordbrukspraksiser, tradisjon, identitet og eierskap til egne såvarer (Westengen et al. 2023).
Genteknologi er en kraftfull og kapitalkrevende teknologi som fram til i dag først og fremst har vært kontrollert av multinasjonale selskaper. Selskapenes kontroll over genteknologien er trolig en viktig årsak til at GMO-debatten har blitt polarisert.
Med enklere og rimeligere metoder innen genmodifisering er det nå stadig flere akademiske miljøer og små og mellomstore aktører som forsker på, eller tar genmodifisering i bruk. Dette bidrar til en mer åpen og opplyst samfunnsdebatt.
En opplyst samfunnsdebatt vil blant annet måtte omfatte følgende perspektiver knyttet til bruk av genteknologi:
Lokal matkultur, tradisjoner og identitet
Interessekonflikter knyttet til fordeling av fordeler og ulemper
Ulikt syn på om det er de riktige problemene som adresseres, for eksempel om teknologiske løsninger blir oppfattet som symptombehandling eller langsiktig løsning på problemet
Ulikt syn på om det finnes bedre og mer velprøvde metoder for å nå målet, for eksempel gjennom konvensjonelt avlsarbeid eller etablerte landbruksmetoder
Uenighet når de forskningsbaserte konklusjonene ikke samsvarer med erfaringsbasert kunnskap, eller det er manglende tillit til ekspertisen på grunn av lite åpenhet om datagrunnlag og uavhengige vurderinger
Ulik vekting av risiko og muligheter
Usikkerhet knyttet til fremtidig bruk av teknologiene
Konsentrering av eierforhold/patenter og redusert tilgang til genetisk diversitet i avl og foredling
Uenighet om prioritering innen forskning og innovasjon
Forbrukere og matprodusenters rett til å gjøre informerte valg
Bærekraftig utvikling og rettferdig fordeling
Ulike verdisyn og syn på naturlighet
10.3.3.4 Tilnærming til risiko og bærekraft
Behovet for regulering er et uttrykk for samfunnets kollektive forståelse av en teknologi, dets tilsiktede og utilsiktede effekter, herunder usikkerhet, tillit til forskningsbasert kunnskap og ekspertise, og det iboende potensialet i teknikkene. Dette omfatter også vurdering og håndtering av risiko, jamfør kapittel 8 og vurdering av etisk forsvarlighet, herunder bærekraft og samfunnsnytte, jamfør kapittel 9.
Etter en lang prosess med flere offentlige utredninger og tre stortingsmeldinger57, vedtok Norge i 1993 genteknologiloven der selve teknologien ligger til grunn for reguleringen, men der det er hvert enkelt produkt som blir vurdert fra sak-til-sak. Loven er dermed basert på en kombinasjon av teknologi- og produkttilnærming. Ved innføring av matloven ti år senere, ble det bestemt at prosesserte GMO-er til bruk i mat og fôr reguleres under denne. Regulerings- og forvaltningsansvaret som følger av genteknologiloven og matloven har fungert godt og bør derfor videreføres.
Når det gjelder bruk av genteknologi, deriblant bruk av genmodifiserte organismer, har land ulike reguleringer, inkludert ulike vurderinger av risiko og etisk forsvarlighet. FAO-rapporten Gene editing and food safety – Technical considerations and potential relevance to the work of Codex Alimentarius fra 2023 beskriver disse ulikhetene, blant annet basert på landenes politiske og regulatoriske historie, men skriver også at almost all governments share some general key objectives, which are to protect the health of consumers and to ensure fair practices in food trade.58
Behov for harmonisering, blant annet av hensyn til internasjonal handel, har resultert i prinsipper for risikovurdering og etisk forsvarlighet internasjonalt, der enkeltland har handlingsrom både når det gjelder håndtering av risiko og etiske vurderinger, jamfør kapittel 5. I Norge ble dette handlingsrommet brukt av regjeringen Solberg til å forby genmodifisert mais i 2017, jamfør kongelig resolusjon av 2. juni 2017.
Tilnærmingen til risiko bygger videre på erfaringer, kunnskap, regelverk og praksis utviklet over en 30 års periode med bruk av rekombinant DNA-teknologi i matkjeden. Fremtidig regulering må bygge på denne kunnskapen, erfaringen og etablerte strukturer for uavhengig vitenskapelig risikovurdering, samt vurderinger av etisk forsvarlighet. Det er også viktig å legge vekt på at risikovurdering er et eget fagfelt.
Reguleringen må også ta høyde for at de nye genmodifiseringsteknikkene gir større muligheter for høyere tempo og omfang av genetiske endringer enn da GMO-regelverket ble etablert.
Denne holdningen til regulering bygger ikke minst på rapporter og uttalelser fra VKM og EFSA som konkluderer med at dagens veiledning for risikovurdering fortsatt kan benyttes for organismer som er utviklet ved hjelp av nye genteknikker, men at tilpasninger og justeringer er nødvendig. Dette innebærer en videreføring av dagens sak til sak-vurdering og krav om trinnvis utsetting.
Ved utsetting baseres risikovurderingen på en helhetlig forståelse av den genmodifiserte organismen i et miljø, deriblant gjensidig påvirkning mellom organismer og samspillet i et økosystem. For å redusere usikkerhet baserer risikovurderingen seg også på data som dokumenterer tilsiktede og utilsiktede effekter på gen-, celle-, organisme-, populasjons-, og økosystemnivå.
I sin vurdering av Europakommisjonens studie59 peker det tyske miljødirektoratet Bundesamt für Naturschutz (BfN) på at en liten endring i en plantes genom kan ha betydelige miljøkonsekvenser. BfN konkluderer også med at genmodifiserte planter utviklet ved målrettet mutagenese eller cisgenese kan ha like stor eller høyere risiko enn planter utviklet ved hjelp av dagens genmodifisering. Et eksempel er risiko knyttet til at en genmodifisert plante som er motstandsdyktig mot tørke fortrenger andre organismer. Denne risikoen, knyttet til fitness, kan være uavhengig av omfanget av genmodifiseringen og hvilken teknikk som er brukt.
I en NINA-rapport om gendrivere (Hindar et al. 2020), skrevet på oppdrag fra Miljødirektoratet, peker Hindar med flere på begrensninger ved bruk av matematiske modeller for å kunne forutsi de økologiske konsekvensene av gendrivere i biologiske samfunn og økosystem. Matematiske modeller kan brukes til å lage scenarier og synliggjøre kunnskapshull, mens selve risikovurderingene må være ekspertvurderinger der så mye kunnskap som mulig innhentes om sannsynlige interaksjoner mellom gendriverorganismen, andre arter, og deres miljø. VKM viser i sin rapport til at denne begrensningen også gjelder for risikovurdering av genmodifiserte organismer utviklet ved CRISPR og andre genomredigeringsteknikker (VKM 2021).
Rapportene fra BfN, NINA og VKM understreker behovet for å foreta konkrete vurderinger av miljørisiko fra sak-til-sak, ikke minst fordi sentrale miljørisikofaktorer, som spredningsfare, kan være uavhengig av genmodifiseringsomfang og -teknikk. Fraværet av en slik lineær sammenheng er en av grunnene til at VKM konkluderer med at EFSAs retningslinjer for miljørisikovurdering kan anvendes fullt ut ved vurdering av organismer utviklet ved nye genomteknikker (VKM 2021). EFSA har også kommet til samme konklusjon som VKM når det gjelder miljørisikovurdering av planter utviklet ved bruk av målrettet mutagenese og cisgenese.
10.3.3.5 Sporing, deteksjon og merking
Gode sporingssystemer er en forutsetning for å sikre valgfrihet for produsenter og forbrukere, og myndighetenes mulighet for miljøovervåking. Mye av dagens globale handel med mat er basert på slike dokumentbaserte sporingssystemer. Dette gjelder for eksempel økologiske produkter og produkter med beskyttet, geografisk opprinnelse.
I tillegg til dokumentbaserte systemer er det ønskelig å ha deteksjonsmetoder. For noen genredigeringsteknikker (målrettet mutagenese) er det foreløpig ikke utviklet gode verktøy for detektering. Dette viser at teknologien på dette området foreløpig er umoden. Det er derfor viktig å utvikle pålitelige metoder som blir praktisk tilgjengelige og som er økonomisk akseptable for aktørene i matkjeden.
I EUs niende rammeprogram for forskning og innovasjon, Horisont Europa, er det et forskningsprogram for nye deteksjonsmetoder for produkter utviklet ved bruk av nye genomteknikker60. Budsjettrammen er om lag 100 millioner kroner (10 millioner euro), hvorav 50 millioner kroner finansieres av Europakommisjonen. Formålet er å gi myndigheter, utviklere og aktører i matkjeden deteksjonsverktøy for å sikre åpenhet og pålitelighet. Dette vil i neste omgang bidra til å sikre forbrukere retten til å gjøre informerte valg.
Det foregår også forskning på deteksjonsmetoder i Norge, blant annet gjennom prosjektet FoodPrint61, finansiert av Norges forskningsråd.
I moderniseringsalternativet foreslås det at alle GMO-er fortsatt skal merkes, ikke minst for å forhindre at selskapenes problemer med sporing og deteksjon veltes over på forbrukere og matprodusenter. I tillegg vil krav til sporing, deteksjon og merking bidra til utvikling av bedre deteksjonsmetoder.
I moderniseringsalternativet legges det til grunn at myndighetene fortsatt må regulere sporing, deteksjon og merking, og ikke erstatte disse med frivillige ordninger. Offentlig regulering sikrer åpenhet, etterprøvbarhet og tillit. Dette synet er i samsvar med krav fra forbruker- og miljøorganisasjoner både i Norge og EU.
Selskaper som ikke kan innfri kravene til sporing og merking i Norge og EU, vil ikke få godkjent sine søknader om omsetning av GMO.
10.3.3.6 Genteknologiens/GMO-enes rolle hittil
Det har vært en rivende genteknologisk utvikling de siste tiårene, deriblant utvikling av nye genomteknikker. Samtidig har utviklingen av genmodifiserte organismer basert på disse teknikkene vært mer begrenset, jamfør kapittel 4. Ti år etter oppdagelsen av CRISPR er det fortsatt bare en håndfull produkter til bruk i mat og fôr i ordinært kommersielt salg.
Et bærekraftig matsystem består av en rekke komponenter, og genteknologien har frem til nå hatt en begrenset rolle, jamfør omtale i punkt 10.3.3.2. Etter tretti år er genmodifiserte organismer fortsatt basert på etablerte genomteknikker og på kort sikt er det først og fremst disse som vil bli brukt til mat eller fôr. Denne utviklingen er ikke bare innovasjonsdrevet, men følger også av at multinasjonale selskaper har eierskap til GMO-er som allerede er i bruk.
GMO-er utviklet ved hjelp av etablerte genomteknikker til bruk i mat eller fôr, er først og fremst planter som er tolerante overfor ulike sprøytemidler, eksempelvis soya, mais, raps og ris dyrket i land som Canada, USA, Brasil og Argentina. Ulike tilnærminger til risiko i ulike land innebærer også at en del av disse plantene dyrkes ved hjelp av sprøytemidler som er forbudt brukt både i Norge og i EU62, eksempelvis glufosinat-ammonium.
Bioteknologirådet har i tidligere uttalelser også konkludert med at sprøytemiddeltolerante planter heller ikke bidro til bærekraftig utvikling eller var samfunnsnyttige, blant annet i en vurdering fra 2017 knyttet til fem soyasorter. I konklusjonen ba rådet også styresmaktene legge vekt på at det er selskapa som har søkt om godkjenning, sitt ansvar å dokumentere om dei genmodifiserte soyasortane bidreg til berekraftig utvikling, er samfunnsnyttige og etisk forsvarlege63.
Norge har i tillegg avslått en søknad på etisk grunnlag. Det var en søknad i 2017 om å importere og ta i bruk en genmodifisert mais til fôr. Begrunnelsen var knyttet til at maisen var tolerant overfor glufosinat-ammonuim, et sprøytemiddel som ble forbudt i Norge i 2008. Saken er omtalt andre steder i denne utredningen, deriblant i kapittel 9. Etisk forsvarlighet av organismer& produkter utviklet med genteknologi.
Ulike regjeringer har ved flere anledninger siden slutten av 1900-talet ment at disse genmodifiserte plantene ikke har vært i tråd med det brede formålet i genteknologiloven.
Samlet sett viser dette at i all hovedsak bidrar ikke de GMO-ene som i dag er på markedet til bærekraftig utvikling, blant annet fordi de er ment for et industrialisert landbruk der det brukes betydelige mengder sprøytemidler. I tillegg er viktige drivkrefter eierskap til og kontroll over viktige innsatsfaktorer, blant annet basert på immaterielle rettigheter.
De nye genomteknikkene er viktige verktøy som kan benyttes i avl og foredling uten bruk av genmodifiserte organismer og det er viktig at denne muligheten benyttes. Det samme gjelder ved innesluttet bruk, selv om bruksområdene hittil ser ut til å være mer begrenset.
Mindretallet mener på bakgrunn av det ovenstående at det er viktig å vurdere hvordan ulike teknologier vil påvirke utviklingen av matsystemer med hensyn på systemets innvirkning på tillit i matkjeden og etterspørsel etter produkter. Det samme gjelder tilgang og eierskap til genetiske ressurser, inkludert hvordan patenter og andre immaterielle rettigheter påvirker fremtidige utviklingsmuligheter og markeder.
Det er også behov for å fremme forskning, utvikling og innovasjon for å utvikle alternative løsningsstrategier til bruk av GMO. Det er viktig å utvikle stor bredde i løsninger som kan understøtte det grønne skiftet og redusere negative effekter på klima og miljø.
10.3.3.7 Genteknologiens/GMO-ers framtidige rolle
Genteknologi vil få økt betydning og være et viktig bidrag til å løse grunnleggende problemer på mange samfunnsområder.
I dag er humanmedisin et av de mest lovende områdene, der det blant annet utvikles genterapier, legemidler og vaksiner basert på genmodifiserte organismer. Folks holdninger til GMO i humanmedisin synes å være mer positive enn til bruk i matproduksjon. Dette skyldes trolig flere forhold. I tråd med den strenge reguleringen av legemidler, vil utvikling og bruk av genmodifiserte organismer på dette området nøye overvåkes og kontrolleres. For genmodifiserte legemidler er det heller ikke snakk om utsetting i naturen på samme måte som for planter og dyr.
Bruk av genteknologi, som for eksempel genredigering, i avl og foredling forutsetter kunnskap om genmarkører koblet til enkeltgen eller informasjon om selve enkeltgenener med stor effekt (QTL=Quantitative Trait Loci) på en egenskap. Slik teknologi er dermed mindre anvendelig i tilfeller der ønskede egenskaper er bestemt av flere gener med liten effekt hver, noe som oftest er tilfelle for kvantitative egenskaper som fruktbarhet, vekst, ytelse eller produktkvalitet, jamfør kapittel 4 figur 4.3.
I avl og foredling av planter og dyr blir egenskaper endret/forbedret som resultat av et komplekst samspill mellom mange gener og miljøet der egenskapene er styrt av flere gener, ofte med liten effekt hver for seg. Disse geneffektene og interaksjonene er fremdeles oftest ukjente.
Eksempler på dette komplekse samspillet er
at flere gener kan styre en egenskap
at ett gen kan regulere flere egenskaper
effekten av en genvariant (eller allel, for eksempel mutasjon) avhenger av tilstedeværelse eller fravær av andre alleler (for eksempel mutasjoner) i andre gener (epistasi)
at et allel kan ha additive, recessive og dominante effekter
at genetiske uttrykk av en egenskap avhenger av miljøbetingelser
epigenetisk variasjon
sammenvevde regulatoriske nettverk (mellom gener, proteiner og metabolitter)
Dette viser at å avle eller foredle frem dyr eller planter med flere egenskaper med kompleks eller ukjent genetisk samvariasjon og nedarving ofte tar mange generasjoner med seleksjon og/eller kryssing. Dette kan derfor ta svært lang tid, og eller i noen tilfeller kan det i praksis bli umulig for eksempel å forbedre flere egenskaper samtidig på grunn av uønskede genetiske korrelasjoner mellom egenskapene. Denne typen begrensninger vil gjelde både ved konvensjonell avl og foredling og ved utvikling av genmodifiserte organismer. Problemet med å utvikle en tørråteresistent potet er et eksempel på slike utfordringer.
Manglende konkret kunnskap om organismers biologiske og genetiske egenskaper, i tillegg til at genmodifiseringsteknikken har vært lite målrettet, har ført til at selskaper har utviklet GMO-er med enkle endrede egenskaper. Sprøytemiddeltolerante planter hvor resistensen er knyttet til et innført gen er et slikt eksempel.
Europakommisjonens utredningssenter, Joint Research Centre (JRC) utarbeidet i 2021 en rapport om dagens og framtidas bruk av GMO-er utviklet ved hjelp av nye genomteknikker (Parisi & Rodríguez-Cerezo 2021). Rapporten, som var underlagsmateriale for kommisjonens GMO-studie, viste at flere av disse plantene er utviklet for å være sprøytemiddeltolerante. I tillegg vil sprøytemiddelresistente planter utviklet ved hjelp av etablere genomteknikker være i bruk i mange år framover.
Eierskap, kunnskap og immaterielle rettigheter til ny genteknologi er sentrale deler av innovasjonssystemet og dermed også sentralt for utvikling og bruk av genteknologi. Dette understrekes også i et innspill til genteknologiutvalget fra forskere ved Nofima og Fridtjof Nansens Institutt, Anne Helena Kettunen, Ingrid Olesen og Kristin Rosendal, der det blant annet står at
(t)eknologier som kan patenteres eller som kan gi kortsiktig gevinst som for eksempel genredigering kan derfor bli valgt selv om det kan finnes mer langsiktige løsninger (for eksempel seleksjon for bredt avlsmål med både produksjon, helse og produktkvalitet) som kan være mer bærekraftig på lenger sikt.64
Flere aktører som forskningsinstitusjoner og små og mellomstore bedrifter kan ha immaterielle rettigheter, men slike rettigheter kan i ettertid overtas eller forvaltes av multinasjonale selskaper. En studie fra 2021 av immaterielle rettigheter knyttet til CRISPR/Cas-9 viser at store selskaper som Bayer og Corteva har betydelig kontroll over immaterielle rettigheter på dette området, ikke minst som et resultat av selskapsovertagelser og -sammenslåinger etter 2017 (Jefferson et al. 2021).
Westengen med flere viser i et arbeid til at det er ulike syn på om det er produktutvikler eller bondens rettigheter som skal sette premissene for utvikling og bruk av nye såvarer. Viktige aktører i et såvaresystem er de som vedlikeholder og utvikler nytt frømateriale, de som produserer såvarer, de som distribuerer såvarer, de som regulerer såvarer i et marked, og ulike forhold som bestemmer såvarens plass i et matsystem (Westengen, 2023).
10.3.3.8 Definisjoner
Et problem knyttet til presentasjonen av utviklingen og bruken av nye genteknologier, er mangel på tydelige internasjonale definisjoner av sentrale begreper, deriblant begreper som brukes for å beskrive ulike nye typer genteknologier, og prosesser og organismer utviklet ved bruk av slike teknikker.
I FAO-rapporten om genredigering og matsikkerhet fra 2023 står det at (t)o date, no country has created a new and separate category for the regulation of gene edited food products.65 Rapportens gjennomgang av ulike lands tilnærming til regulering av slik produkter viser også ulike reguleringsmåter og ulike definisjoner av sentrale begreper. Ulikhetene mellom land er så store, at det er ikke er fruktbart å dele verden inn i generelle reguleringskategorier.
Manglende felles begrepsapparat gir utfordringer i kommunikasjonen innad og mellom fagfelt, ved utforming av lovverk, ved risikovurdering og håndtering og i den bredere offentlige debatten. Utviklingen av et slikt begrepsapparat vil kunne løse noen av disse utfordringene, blant annet ved å legge grunnlaget for en mer konstruktiv informasjonsflyt og debatt.
10.4 Sammenlignende tabell
Figur 10.9-10.12 gir en oversikt over utvalgets delte innstilling for regulering av utsetting av organismer og produkter utviklet med genteknologi til bruk som mat, fôr eller annen bruk. Tabellen omfatter ikke GMO-legemidler. Fokuset er å presentere likheter og forskjeller mellom de to forslagene til regulering fra henholdsvis flertallet og mindretallet.
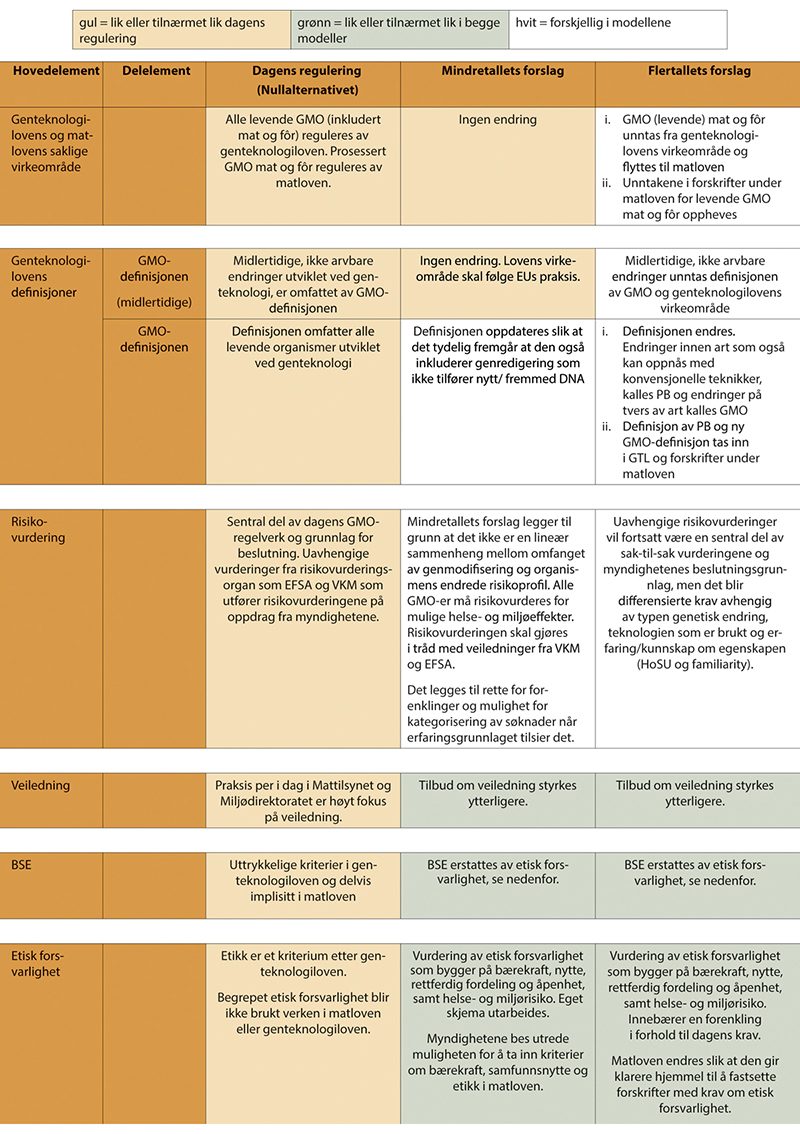
Figur 10.9 Oversikt over to alternativer til regulatoriske og forvaltningsmessige endringer

Figur 10.10 forts. av figur 10.9
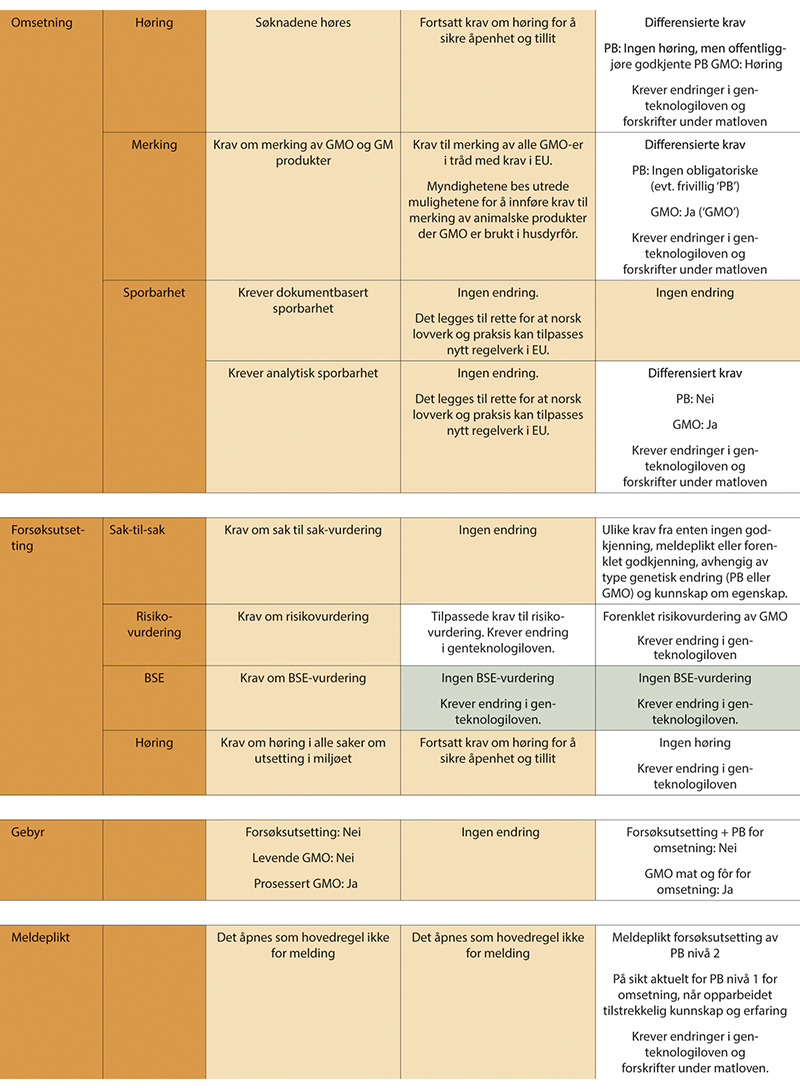
Figur 10.11 forts. av figur 10.9
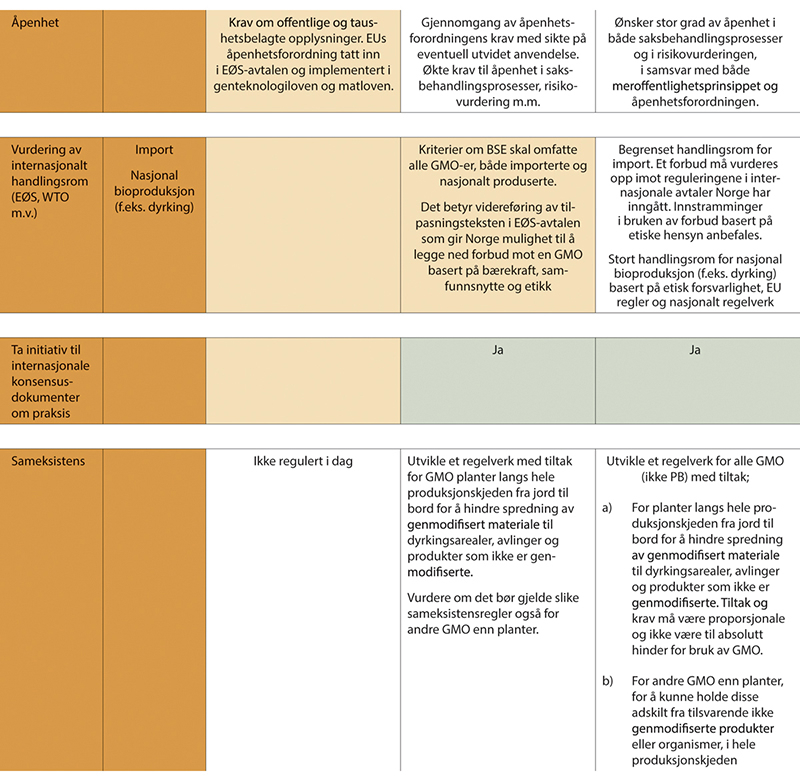
Figur 10.12 forts. av figur 10.9
Fotnoter
https://www.dagensmedisin.no/lov-og-rett/kreftstudie-satt-pa-vent-absurd-situasjon/208810
https://food.ec.europa.eu/system/files/2021-04/gmo_mod-bio_ngt_eu-study.pdf
https://ec.europa.eu/info/law/better-regulation/have-your-say/initiatives/13119-Legislation-for-plants-produced-by-certain-new-genomic-techniques/public-consultation_en
https://ec.europa.eu/info/funding-tenders/opportunities/docs/2021-2027/horizon/wp-call/2021-2022/wp-9-food-bioeconomy-natural-resources-agriculture-and-environment_horizon-2021-2022_en.pdf
https://sc-fss2021.org/wp-content/uploads/2021/06/FSS_Brief_IAP_Europe.pdf
https://www.fao.org/science-technology-and-innovation/gene-editing-techniques-and-agrifood-systems/en
https://www.kavliprize.org/prizes/nanoscience/2018
https://www.nobelprize.org/prizes/chemistry/2020/press-release/
https://www.ipcc.ch/sr15/
https://food.ec.europa.eu/plants/genetically-modified-organisms/new-techniques-biotechnology/ec-study-new-genomic-techniques_en
https://vkm.no/download/18.933c6721868a526ec31cbcf/1677486652801/Matproduksjon,%20mattrygghet%20og%20milj%C3%B8%20-%20innspill%20om%20kunnskapsbehov%20til%20gjennomf%C3%B8ringen%20av%20det%20gr%C3%B8nne%20skiftet%20.pdf
https://www2.itif.org/2016-suppressing-innovation-gmo.pdf
Global Status of Commercialized Biotech/GM Crops: 2019 – ISAAA Brief 55-2019 ISAAA.org
https://www.nationalacademies.org/our-work/genetically-engineered-crops-past-experience-and-future-prospects
https://www.fao.org/3/cc5136en/cc5136en.pdf
European Commission, Directorate-General for Research and Innovation (2017), New Techniques in agricultural biotechnology, Publications Office.
https://www.fao.org/3/cc3579en/cc3579en.pdf
https://www.europarl.europa.eu/RegData/etudes/BRIE/2021/698760/EPRS_BRI(2021)698760_EN.pdf
https://www.bbc.com/news/science-environment-64596453
https://www.bioteknologiradet.no/filarkiv/2018/12/2018-12-03-Komplett-genteknologiloven-Bioteknologir%C3%A5det-til-web.pdf
https://ec.europa.eu/info/law/better-regulation/have-your-say/initiatives/13119-Legislation-for-plants-produced-by-certain-new-genomic-techniques_en
https://www.aphis.usda.gov/aphis/newsroom/stakeholder-info/sa_by_date/sa-2023/aphis-rsr-ddct-msls
https://eliteplanter.no/kan-nobelprisvinnende-teknologi-crispr-benyttes-for-a-utvikle-hageplanter-med-lavere-spredningspotensial/
Risk assessment of Aquaterra® rapeseed oil for its intended use as ingredient in fish feed (vkm.no)
https://www.aphis.usda.gov/aphis/newsroom/stakeholder-info/sa_by_date/sa-2022/purple-tomato
Europaparlaments- og Rådsdirektiv (EU) 2015/412 av 11. mars 2015 om endring av direktiv 2001/18/EF med hensyn til medlemsstatenes mulighet til å begrense eller forby dyrking av genmodifiserte organismer (GMO) på sitt territorium.
https://cordis.europa.eu/article/id/442114-counting-your-chickens-before-they-hatch
GATT artikkel XX(a).
Meld. St. 27 (2018–2019) Norges rolle og interesser i multilateralt samarbeid.
https://vkm.no/download/18.4fdace2015eceedf2143f44c/1507028536027/Risk%20assessment%20of%20maize%201507%20for%20cultivation.pdf
https://www.ruokavirasto.fi/globalassets/tietoa-meista/asiointi/oppaat-ja-lomakkeet/yritykset/elintarvikeala/pakkausmerkinnat/en/gmo_vapaa_ohje_en.pdf
https://www.nationen.no/landbruk/geno-frykter-forbud-mot-genredigering-betyr-slutten-for-nrf-kua/
https://www.nationen.no/norsvin-onsker-mer-liberale-regler-for-genredigering/s/5-148-101972
https://www.bondebladet.no/graminor-vil-ha-tilgang-pa-crispr/o/5-150-17172
https://www.acsh.org/news/2018/03/17/another-win-golden-rice-canadian-government-approves-12714
https://www.danforthcenter.org/news/usda-clears-danforth-centers-genome-edited-teff/
https://www.bioteknologiradet.no/filarkiv/2020/04/Rapport-holdninger-til-genredigering.pdf
https://www.pewresearch.org/science/2015/01/29/public-and-scientists-views-on-science-and-society/
https://www.regjeringen.no/no/dokumenter/horing-forslag-til-endringer-i-forskrift-om-nasjonalt-vaksinasjonsprogram-vaksinasjon-mot-covid-19/id2791196/?expand=horingssvar&lastvisited=undefined
https://www.bioteknologiradet.no/filarkiv/2020/04/Rapport-holdninger-til-genredigering.pdf
https://www.genteknik.se/wp-content/uploads/2022/02/Svenskars-installning-till-genomredigering_2022.pdf
https://royalsociety.org/~/media/policy/projects/gene-tech/genetic-technologies-public-dialogue-hvm-full-report.pdf
https://www.food.gov.uk/sites/default/files/media/document/consumer-perceptions-of-genome-edited-food.pdf
https://swiss-food.ch/files/213057_Genom-Editierung_gfsbern_Publ.pdf
https://www.regjeringen.no/no/tema/helse-og-omsorg/folkehelse/innsikt/ernaring-og-mattrygghet/genmodifisert_mat/id426441/
Se saksnr. C-528/16, CURIA – List of results (europa.eu).
Generell forskrift for produksjon og omsetning mv. av næringsmidler § 16a).
Forskrift om fôrvarer § 4a).
Regjeringen Solberg: Mat, mennesker og miljø – Regjeringens handlingsplan for bærekraftige matsystemer i norsk utenriks- og utviklingspolitikk 2019–2023 https://www.regjeringen.no/globalassets/departementene/ud/dokumenter/planer/planer-matsystemer-i-norge_norsk_web-versjon190919.pdf
Laborde, D., Murphy, S., Parent, M., Porciello, J. & Smaller C. (2020). Ceres2030: Sustainable Solutions to End Hunger – Summary Report. Cornell University, IFPRI and IISD
https://ceres2030.iisd.org/wp-content/uploads/2021/03/ceres2030_en-summary-report.pdf
Ceres2030 er et samarbeid mellom Cornell University, International Food Research Policy Institute (IFPRI) og International Institute for Sustainable Development (IISD) utgitt av Ceres2030 https://ceres2030.iisd.org/our-team/
https://www.regjeringen.no/globalassets/departementene/ud/dokumenter/planer/planer-matsystemer-i-norge_norsk_web-versjon190919.pdf
FAO. 2018. Sustainable food systems: concept and framework. Technical Brief, side 1) https://www.fao.org/3/ca2079en/CA2079EN.pdf
FAO, IFAD, UNICEF, WFP and WHO: The State of Food Security and Nutrition in the World (2021), side xviii https://www.fao.org/3/cb4474en/cb4474en.pdf
FAO, IFAD, UNICEF, WFP and WHO: The State of Food Security and Nutrition in the World (2021), side xx
Høringssvar fra Skretting Norge til Mattilsynet, datert 21.4.23 https://www.mattilsynet.no/konfigurasjon/Innspill_til_regelverk/14320985_18907183_1pdf.50003/binary/14320985_18907183_1.pdf
Bioteknologiutvalget, oppnevnt 12.06.87, la fram to innstillinger: «Bioteknologi og patentering», datert 31.03.89 og «Moderne bioteknologi. Sikkerhet, helse og miljø», datert 02.10.89. Etikkutvalget, oppnevnt 08.04.88, la fram innstillingen: «Mennesker og bioteknologi», datert 30.11.90. De tre stortingsmeldingene er: Stortingsmelding nr. 8 (1990-91) «Om bioteknologi», Stortingsmelding nr. 36 (1990-91) «Tilleggsmelding om bioteknologi» og Stortingsmelding nr. 25 (1992-93) «Om mennesker og bioteknologi»
FAO. 2023. Gene editing and food safety – Technical considerations and potential relevance to the work of Codex Alimentarius. Rom, side 19. (https://doi.org/10.4060/cc5136en)
Bundesamt für Naturschutz (Federal Agency for Nature Conservation) New developments and regulatory issues in plant genetic engineering, oktober 2021. https://www.bfn.de/sites/default/files/2021-10/Viewpoint-plant-genetic-engeneering_1.pdf
HORIZON -New detection methods on products derived from new genomic techniques for traceability, transparency and innovation in the food system- https://ec.europa.eu/info/funding-tenders/opportunities/portal/screen/opportunities/topic-details/horizon-cl6-2023-farm2fork-01-11;callCode=HORIZON-CL6-2023-FARM2FORK-01;freeTextSearchKeyword=;matchWholeText=true;typeCodes=1;statusCodes=31094501,31094502,31094503;programmePeriod=null;programCcm2Id=null;programDivisionCode=null;focusAreaCode=null;destinationGroup=null;missionGroup=null;geographicalZonesCode=null;programmeDivisionProspect=null;startDateLte=null;startDateGte=null;crossCuttingPriorityCode=null;cpvCode=null;performanceOfDelivery=null;sortQuery=sortStatus;orderBy=asc;onlyTenders=false;topicListKey=callTopicSearchTableState
https://www.norceresearch.no/en/projects/foodprint
COMMISSION DELEGATED REGULATION (EU) 2020/1068, punkt 7
https://eur-lex.europa.eu/legal-content/en/TXT/PDF/?uri=CELEX:32020R1068&from=EN
Brev til Miljødirektoratet, Sluttføring av søknader om godkjenning av genmodifisert sprøytemiddelresistent soya til import, prosessering, mat og fôr, datert 5. mai 2017. https://www.bioteknologiradet.no/filarkiv/2017/05/Sluttf%C3%B8ring-av-s%C3%B8knader-om-godkjenning-av-genmodifisert-spr%C3%B8ytemiddelresistent-soya-til-import-prosessering-mat-og-f%C3%B4r.pdf
https://files.nettsteder.regjeringen.no/wpuploads01/sites/447/2021/11/Innspill-til-Genteknologiutvalget-2021.pdf
FAO. 2023. Gene editing and food safety – Technical considerations and potential relevance to the work of Codex Alimentarius. Rom, side 19. (https://doi.org/10.4060/cc5136en)