7 Genteknologiens muligheter og begrensninger, med eksempler
7.1 Innledning
Evaluering av vårt erfaringsgrunnlag og de produkter og teknologiske løsninger som genteknologien så langt har gitt oss, kan være nyttig med tanke på framtidige forventninger, muligheter og begrensninger. Det er delte meninger, både i samfunnet og i dette utvalget, om hvor stor betydning genteknologi kan og bør få innen områder som medisin, industri, matproduksjon og naturbevaring. Noen forventer og ønsker at genteknologi vil spille en sentral rolle i å skape et mer bærekraftig samfunn, som et kraftfullt supplement til andre konvensjonelle teknologier. Andre er mer forbeholdne. Det er imidlertid bred enighet om at nye genteknologiske teknikker ikke alene kan løse utfordringene, men er ett av flere midler for å nå et mer bærekraftig samfunn. Hvilke anvendelser av teknologien som vil lykkes, påvirkes vesentlig av en rekke faktorer utover teknologiutviklingen i seg selv. Dette er blant annet offentlig og privat investeringsvilje, juridiske og politiske rammevilkår, teknologiens vekselvirkning med ulike miljøfaktorer og økosystemer og i tillegg befolkningens aksept for å ta teknologiene i bruk. Utvalget har i varierende grad gått inn i alle disse forholdene.
Med teknologien som utgangspunkt, forsøker utvalget i dette kapitlet å oppsummere forhold som har påvirket eller vil påvirke muligheter og begrensninger for utviklingen og bruken av genteknologi. Kapitlet tilstreber å besvare mandatpunktet «Gjere greie for teknologisk status, forventa teknologisk utvikling, og moglegheiter og avgrensingar». Utvalget tar derfor opp både det historiske perspektivet, som har brakt oss dit vi er i dag, og det potensialet og de forventningene som angår overskuelig framtid. Utvalget lener seg i stor grad på publiserte, fagfellevurderte artikler samt rapporter utarbeidet av organisasjoner med en solid faglig tyngde. Særlig har utvalget sett hen til studier og kunnskapssammenstillinger utarbeidet av EU-kommisjonens ekspertpaneler, National Academy of Sciences, USA, og Vitenskapskomitéen for mat og miljø i Norge.
Kapitlets hovedfokus er de teknologiske mulighetene og begrensningene. I underkapitlene 7.2–7.6 om de ulike organismene eller produktgruppene, gis eksempler som illustrerer noe av bredden i innovasjonsområdene. Kapitlet berører også andre forhold av betydning for innovasjon som tilgjengelighet av kunnskap, åpenhet og immaterielle rettigheter, se kapittel 7.1.2.2 og faktorer som indirekte påvirker teknologi- og produktutvikling, kommersialisering og bruk, se kapittel 7.1.2.3.
7.1.1 Genteknologien som verktøykasse
Genteknologien har fra starten av vært resultatet av en tett sammenkobling av kunnskaps- og teknologiutviklingen innen cellebiologi (kloning, muligheter for å dyrke og endre cellers responser på ulike stimuli), molekylærbiologi, biokjemi (analyseteknikker og tekniske verktøy for moduleringer) og informasjonsteknologi (databaser, biostatistiske analyseprogrammer, grafisk og teknisk design). Mange av verktøyene som genteknologien benytter, har derfor primært viktige anvendelser på andre områder enn for å kunne gjøre genetiske endringer i en organisme. Dette gjelder for eksempel til analyser av mat- og miljøprøver, sykdomsdiagnostikk, kunnskapsutvikling innen medisin og biologi, risikovurderinger, og så videre. Den teknologiske utviklingen, særlig innen molekylærbiologi, biokjemi og informasjonsteknologi, har gått fort, og avansert teknologi er mer tilgjengelig både økonomisk og praktisk. Samtidig vil de mest avanserte løsningene alltid både ha veldig høy kapasitet, kreve høy spesialkompetanse og dyrt utstyr. Mange aktører vil derfor heller ønske å kjøpe tjenester dimensjonert for sine behov framfor å bygge opp egen kompetanse og utstyr. Bestiller- og tolkningskompetanse og kvalitetssikring av leveransene vil da være av stor betydning. Denne utviklingen forventes å fortsette framover.
Forskning og teknologiutvikling skjer i et samspill hvor teknologien setter rammene for hva man kan forske på, men hvor også forskernes spørsmål driver teknologien videre. De nevnte verktøyene har dels bidratt til, dels blitt til i forbindelse med, at man har identifisert og karakterisert sentrale biokjemiske prosesser i ulike organismer. Dette er prosesser som at celler har ulike reparasjonssystemer for skader på DNA, at det finnes enzymer som både kan klippe over og lime sammen DNA, og at endringer i DNA kan gi både midlertidige og permanente endringer i en organismes egenskaper. Man har for eksempel avdekket at virus kan fungere som injeksjonssprøyter for overføring av RNA og DNA. Videre finnes det mobile genetiske elementer, det vil si elementer som mer eller mindre på egenhånd kan flytte seg innen og mellom genomer blant annet i planter, sopp og bakterier. I bakterier har noen slike elementer egenskaper som gjør at de effektivt kan plukke opp DNA fra omgivelsene. Mange av disse oppdagelsene er et resultat av grunnforskning, men har også skapt nye muligheter for å kunne gjøre endringer i ulike organismers gener. Genteknologiske verktøy brukes naturlig nok også til å forbedre tidligere utviklete verktøy. Forbedringer kan blant annet bidra til å gjøre et verktøy mer spesifikt, utvide bruksmulighetene, gjøre en teknisk løsning mer praktisk tilgjengelig eller billigere. Eiendoms- og bruksrettigheter til teknologiske løsninger kan imidlertid påvirke den reelle tilgangen vesentlig. Endelig er verktøyene med på å øke kunnskapen om komplekse samspill mellom genetikk og miljøfaktorer. Også denne utviklingen forventes å fortsette framover.
Genteknologiens verktøykasse utvides kontinuerlig, og det samme gjør anvendelsesmulighetene. Samtidig må det understrekes at det alltid vil være praktiske begrensninger når det gjelder anvendelsesmulighetene, for eksempel biologiske, tekniske, etiske, juridiske og økonomiske. Diskusjonen om genteknologi dreide seg lenge om å være for eller imot genteknologi, men dreier seg nå mer om den konkrete teknologianvendelsen, hva vi som samfunn ønsker at teknologien skal kunne brukes til eller ikke.
Sammenlignet med etablerte metoder for genmodifisering har genomredigeringsverktøy som lokasjonsspesifikke nukleaser (SDN), langt på vei revolusjonert mulighetene for å endre og flytte kjent genetisk variasjon, både med hensyn til hvor i et genom det gjøres endringer og hva slags endringer som kan gjøres (Zhan et al. 2021, se definisjon av genomredigering i ordlista i kapittel 3, samt utdypende forklaring i kapittel 4). Det foregår en kontinuerlig utvikling for å forbedre disse verktøyene, samtidig som det også utvikles nye verktøy som utvider mulighetsrommet til å endre på alt fra enkeltbaser (også epigenetisk) til å målrette og begrense hvor i genomet det oppstår endringer, hvilke organismer dette kan benyttes på, og hvor store deler av et genom som kan endres parallelt (Mushtaq et al. 2021, Arroyo-Olarte et al. 2021, Perisse et al. 2021). Det gjøres også store framskritt med hensyn til å redusere sannsynligheten for off-target effekter og å øke sannsynligheten for å avdekke og risikovurdere disse (Atkins et al. 2021).
For noen formål vil det være ønskelig at en genetisk endring er midlertidig og ikke nedarves i vanlig forstand. Vaksinering med DNA kan indusere en ønsket immunrespons, som i tilstrekkelig grad oppnås med kortvarig tilstedeværelse av det aktuelle DNA-et, slik flere av COVID-vaksinene eksemplifiserer. Somatiske behandlinger som genterapi, kan bidra til å oppnå en ønsket effekt, for eksempel behandling av sykdom, uten at tilførte gener vil bli overførbare til neste generasjon. Man kan også ønske å påvirke geners aktivitetsnivå for kortere eller lengre tid, uten at man ønsker å endre den genetiske koden (epigenetikk). Spekteret av teknologier som gjør det mulig å tilføre midlertidige genetiske endringer, er også i kontinuerlig utvikling. Epigenetiske endringer er i utgangspunktet miljøbetingede og reversible, og derfor midlertidige, men endringene kan i noen grad også overføres fra en generasjon til den neste avhengig av miljøfaktorer (Wu & Sirard 2020, Liu & He 2020, Trerotola et al. 2015). Genteknikker for midlertidige endringer er nærmere beskrevet i kapittel 4.3.3.
Gendrivere og syntetisk biologi
I den andre enden av skalaen ligger gendrivere (se kapittel 4.5 om gendrivere og 7.7 om invagener). Gendrivere gjør det mulig å øke spredning av en genetisk endring i en populasjon raskere enn det som kan skje gjennom seksuell formering og naturlig seleksjon, og å oppnå at individer automatisk blir homozygote når de får en ny egenskap. Dette gjelder selv om naturlig seleksjon i denne sammenheng også omfatter bruk av kunstig seleksjon, for eksempel bruk av biocider for å øke andelen av biocidtolerante individer. Biocidtoleranse har for øvrig en lang historikk som seleksjonsmarkør koblet til den genetikken man egentlig ønsker å favorisere.
Økende kunnskap om geners og genprodukters struktur og funksjon, kombinert med utviklingen innen informasjonsteknologi og biokjemisk syntese, gjør at man i økende grad også kan predikere egenskaper og effekter av gener designet in silico (på datalaboratoriet). I første omgang kan slik novogenese (definert av utvalget som en retning innen syntetisk biologi, se kapittel 7.7.1) bidra til å effektivisere de tidligste utviklingsfasene. For eksempel kan novogenese brukes til å designe ulike genversjoner med antatt mer effektiv baserekkefølge uten å endre hvilke aminosyrer genet koder for (Holst-Jensen et al. 2012). Novogenese kan også brukes til å lage et begrenset antall varianter som med større eller mindre sannsynlighet har spesifikke ønskede egenskaper, slik at man kan prøve ut disse i innesluttede småskala laboratorieforsøk. Utviklingen innen novogenese er foreløpig i startgropen og vil dra nytte av utviklingen innen kunstig intelligens for in silico design.
Både invagene og novogene teknologier har hypotetisk særlig store anvendelsesrom, men reiser også nye problemstillinger innen risikovurderinger og etikk, som vil kunne begrense mulighetsrommet i praksis. Kunnskapsutviklingen, den offentlige diskursen og det regulatoriske rammeverket, vil derfor være av stor betydning for veien videre.
Bioreaktorer
Både mikroorganismer, planter og dyr kan benyttes som bioreaktorer. I praksis er det først og fremst mikroorganismer som (under innesluttet bruk) har fått slik anvendelse fram til nå (se kapittel 7.5). Bruken av planter og dyr som bioreaktorer har i stor grad fokusert på mulighetene for å framstille råmateriale for biodrivstoff, medisinske produkter som har mer optimale medisinske egenskaper enn produkter framstilt i mikroorganismer, og/eller kan inntas som del av matvarer. Man har også sett potensialet i å kunne bruke dyr som donorer for organer til organtransplantasjon til mennesker (xenotransplantasjon)1, se kapittel 7.3.1. Viktige begrensninger fram til nå er både bekymring for at bioreaktororganismer utilsiktet kan komme inn i matforsyningskjeder, etiske sider ved bruken av dyr, og at det ofte er snakk om mer omfattende genetiske endringer som kombinerer nye og etablerte genteknologier og kan gjøre blant annet krav til dokumentasjon for risikovurderinger mer omfattende.
Siden medisinsk forskning har hatt stor betydning for utviklingen av genteknologien, har mange av verktøyene potensielle anvendelser innen medisinen, i spennet fra pasienttilpasset behandling og genterapi til vaksiner, medisiner og organtransplantasjoner. Dette vil bli omtalt nærmere i senere delkapitler, med konkrete eksempler, se kapittel 7.6.
Utvikling av mer og mer komplekse metoder og analyser
Genomredigeringsverktøy har en svært viktig rolle i kunnskapsutviklingen, fordi de utvider mulighetene for å teste og vurdere effektene av spesifikke genetiske endringer eksperimentelt. Man har lenge benyttet genteknologi til å slå av og på enkeltgener (knock-out og knock-in), særlig i bakterie- og musemodeller hvor man også relativt enkelt har kunnet gjøre endringer direkte både i gener og regulerende sekvenser (Doyle et al. 2012). Nye verktøy gjør at slike endringer i stadig større grad kan gjøres i også andre dyr og i levende planter (Nakashima & Miyazaki 2014). På sikt er det også forventninger til at dette kan gjøres i mer komplekse systemer hvor flere gener og etter hvert også organismetyper samspiller. Denne utviklingen avhenger i stor grad av parallell utvikling av teknologi for å innhente og bearbeide data. I tillegg vil rommet for kunnskapsutvikling avhenge sterkt av hvordan rammevilkår for forskning og særlig feltforsøk reguleres framover.
Utviklingen av nye og kraftige molekylærbiologiske og kjemiske analysemetoder (såkalte –omics: genomikk, transkriptomikk, proteomikk, metabolomikk, med mere) er et resultat av en parallell utvikling av kraftfull teknologi for produksjon, innsamling, lagring og behandling av data (analyseinstrumenter/-kjemi, programvare, maskinvare og infrastruktur). Mulighetene for å håndtere store og komplekse datasett og avdekke kryptiske sammenhenger og mønstre, gjør det stadig enklere å oppdage nye og interessante egenskaper og å predikere effekter av spesifikke genetiske endringer. Tilgjengeligheten av slike sammenstilte datasett kan imidlertid være en vesentlig begrensende faktor i avl og foredling. Dels er det langt fra alle data som gjøres offentlig tilgjengelige, for eksempel i store internasjonale databaser. Dels er dataformater og infrastruktur ikke alltid tilrettelagt eller økonomisk oppnåelig. Karakterisering av data øker anvendeligheten. Dette vil kunne oppfattes som verdifull immateriell kunnskap som en del interessenter ønsker å beskytte med tanke på kommersiell utnyttelse. Bruk av muse- og andre dyremodeller er vanlig i humanmedisinsk forskning, og genetiske data fra denne forskningen er i stor grad både tilgjengelig og anvendelig også for andre dyrearter. Arbeidet med karakterisering og systematisering av slike data for både planter, dyr og mikroorganismer er gjerne organisert i større internasjonale team, men med en skjev representasjon av arter (Hotaling et al. 2021). I beste fall kan denne utviklingen tilrettelegge for omfattende innovasjon, inkludert syntetisk biologi eller novogenese. I verste fall vil vesentlige data ikke bli delt eller forbli utilgjengelige av andre årsaker, som for å oppnå konkurransefordeler i forhold til andre utviklere.
Komplekse analyser med store datasett er av stadig større betydning for å forstå blant annet genetikk. Såkalte genomvide assosiasjonsstudier (GWAS) baserer seg på å studere korrelasjoner mellom en egenskap (fenotype) og mutasjoner (vanligvise på enkeltbasenivå) i genomene hos et stort antall ubeslektede individer av samme art. GWAS avdekker ofte at mange ulike gener og mutasjoner er assosiert med egenskapen, og er for eksempel godt egnet for å belyse komplekse og antatt arvelige sykdommer (Power et al. 2017, Alqudah et al. 2020, Giral et al. 2018). Bedre kunnskap om multigene egenskaper og mekanismer kan styrke mulighetene til å vurdere risiko knyttet blant annet til sammenheng mellom innsettingspunkt og off-target effekter.
Metastudier og in silico verktøy
Tilgangen til større datasett og mer avanserte databehandlingsmetoder er også av betydning for å understøtte robuste risikovurderinger. Underliggende og kryptiske mønstre i store og komplekse datasett kan avdekkes gjennom metastudier, hvor det er korrelasjoner og statistiske sannsynligheter som studeres og ikke hvert enkelt kasus. Man har blant annet kommet langt i å kunne predikere funksjoner knyttet til spesifikke gensekvenser in silico (Zhao et al. 2020). Slike prediksjoner er i dag nyttige i en forskningssammenheng, og for analyser eller vurderinger av effekter av innsettingspunkt ved tilført DNA i sammenheng med risikovurdering. In silico-baserte tilnærminger til DNA-analyser vil ikke erstatte funksjonelle analyser på kort sikt, men kan bidra til å gjøre utvikling av nye produkter enklere, for eksempel ved at man får et bedre grunnlag for tidlig å vurdere usikkerheter i en innovasjonsidé. Slike analyser er prediksjoner med ulik statistisk kvalitet, og det er ofte stor usikkerhet knyttet til sammenhenger mellom DNA-sekvens, predikert proteinstruktur og antatt funksjon (Hamada 2014, Gligorijević et al. 2021).
Andre potensielle anvendelser av in silico verktøy, både for utvikling og tilgjengeliggjøring av nye genressurser og som mulige tilskudd til risikovurderinger, inkluderer simuleringer. I en simulering kan man beskrive matematiske modeller for mulige sammenhenger og gjøre justeringer i parametere for å avdekke sannsynlige konsekvenser og utfall. Med stadig bedre data og kunnskap om korrelasjoner vil man også kunne gjøre stadig mer presise simuleringer. Maskinlæring eller kunstig intelligens er en videreutvikling av metastudier, hvor databehandlingsprosessen kontinuerlig forholder seg til nytt tilgjengelig kunnskapsgrunnlag, og hvor prosessen i tillegg kan lære av og korrigere på grunnlag av egne feil og erfaringer. Denne teknologiske utviklingen gjør det også enklere å stille helt nye spørsmål og kunne få relativt gode og raske svar, med begrensete ressurser. I 2020 ble kunstig intelligens brukt til å løse et av biologiens største uløste problemer, nemlig å predikere hvordan et polypeptid folder seg sammen til et funksjonelt protein. Algoritmen AlphaFold har med stor presisjon klart å predikere den romlige strukturen av nærmest alle kjente proteiner. Det er store forventninger til at kunstig intelligens vil kunne spille stor rolle innenfor modellering og design knytta til genteknologi framover. Kunstig intelligens bringer med seg mange forskjellige problemstillinger, men omtales ikke nærmere her.
7.1.2 Innovasjonsrommet (fremmere og hemmere av innovasjon)
Noen fagområder og samfunnsbehov driver gjerne utviklingen på en måte som påvirker langt bredere, også utenfor det aktuelle fagområdet. Medisinsk forskning og diagnostikk, forebygging og behandling har vært den sterkeste driveren av den genteknologiske utviklingen. Mulighetene for innovasjon avhenger av både teknologiske, verdi- og samfunnsmessige forhold, blant annet de økonomiske og juridiske rammebetingelsene.
Genteknologiområdet er stadig under utvikling og både utviklere, kunnskapsmiljøer og andre støttespillere har store forventninger om teknologiens potensiale for å kunne bidra til å løse alt fra nisjeproblemer til store globale utfordringer. I diskursen rundt teknologiens muligheter er det nyttig å skjele til hvor moden den aktuelle teknologien er. Internasjonalt brukes gjerne begrepet Technology Readiness Level (TRL) for å beskrive dette (Mihaly 2017). Veien fra idé og konseptualisering til kommersiell anvendelse, er tradisjonelt lang og krevende, og samspill mellom mange ulike faktorer avgjør utfallet. En av styrkene ved moderne genteknologi er at veien fra idé til anvendelse (kommersielt eller i forskning) kan gjøres langt kortere, forutsatt at genetikken bak en ønsket egenskap er godt klarlagt. De ulike eksemplene som gis senere i dette kapitlet og i andre kapitler, befinner seg langs hele TRL-skalaen.
Målene for bruk av teknologien kan være å oppdage eller skape nye genvarianter, karakterisere genomer og biokjemiske mekanismer, studere samspill mellom gener, genprodukter, individer, populasjoner, arter og miljøfaktorer, og til å samle inn, systematisere og bearbeide data til anvendelig kunnskap.
I det følgende går vi nærmere inn på hvordan disse forholdene kan fremme eller hemme innovasjon.
7.1.2.1 Genteknologi som avls- og foredlingsverktøy
Klassisk avl og foredling (planter og dyr) er begrenset av den genetiske variasjonen som er tilgjengelig for foredleren, det vil si genetisk variasjon innen kryssbar art og blant de individene som foredleren har tilgang til å krysse med (innen planteavl bruker man gjerne begrepet «breeders gene pool»). I tillegg er krysning tidkrevende og hemmet av at man ikke bare krysser inn den ønskede egenskapen, men får med mange uønskede genvarianter i tillegg (genetisk drag), som man i stor grad vil måtte krysse ut igjen. Det finnes flere muligheter til å oppnå mer målrettet foredling også med konvensjonelle teknikker. Innavl kan gi mer ensartet avkom og forsterke visse egenskaper. Hybridisering som innebærer å krysse to individer som begge har mange ønskede egenskaper, kan bidra til å få fram individer med bedre egenskaper enn begge foreldrene, for eksempel økt fitness. Mutagenese som både kan oppnås med og uten genteknologi, kan øke tilgangen til relevant genetisk variasjon. Molekylære undersøkelser er også nyttige for å identifisere tilstedeværelse av spesifikke ønskede gener (markør-assistert seleksjon) i et materiale før kryssing.
Genteknologien gir, i hvert fall teoretisk, tilnærmet ubegrensede muligheter for å tilføre en ønsket egenskap uten genetisk drag, og utvikle det ønskede produktet til dels langt raskere enn med krysning. Dette vil i dag gjelde for de egenskapene som uttrykkes med enkle eller få gener, og der genetikken i stor grad allerede er kjent. VKM påpeker i sin rapport om CRISPR og andre genomredigeringsteknikker (2021) og EFSA i sin uttalelse om kriterier for risikovurdering av planter produsert ved målrettet mutagenese, cisgenese og intragenese (EFSA 2022a), at graden av historie med trygg bruk (HoSU) og familiaritet (se kapittel 8, blant annet 8.2.4.4) vil ha stor betydning for risikovurderingen og hvor raskt et eventuelt produkt kan nå markedet. De fleste avlsmål i planteforedling og dyreavl er multigene. Det betyr at egenskapene kodes av mange gener som kan være plassert ulike steder i genomet, og deres funksjon vil fremkomme i komplekse samspill som man foreløpig sjelden vil ha full oversikt over (se figur 4.3, kapittel 4). Hovedandelen av avlsmålene vil derfor fortsatt tilnærmes med konvensjonelle foredlingsmetoder i overskuelig framtid, men genteknologiske verktøy vil i økende grad understøtte avlsarbeidet på ulike måter, sterkt påvirket av hvor sikker kunnskap man har for en konkret problemstilling. For planteforedling vil genoverføring eller -redigering skje i sorter som ikke nødvendigvis er den som skal sortsgodkjennes og kommersialiseres. Det vil i slike tilfeller være nødvendig med betydelig konvensjonell krysning og seleksjon for å få fram et kommersielt produkt. Kapittel 4 inkluderer en mer detaljert introduksjon både til de tidlige og de nyere genteknologiene. De nye genteknologiske verktøyene gir både mulighet for å erstatte en mindre ønsket genvariant med en mer ønsket variant, innenfor den kryssbare arten og uten genetisk drag, og for å innføre helt ny genetikk. Kombinasjonen av større bredde i tilgjengelige egenskaper for foredling, potensielt større presisjon i de endringene som gjøres og at endringer kan oppnås på langt kortere tid, gir derfor et betydelig forbedret utgangspunkt for innovasjon og rask produktutvikling. Fortsatt er det i praksis vesentlige begrensninger i faktisk kjennskap til og oppdagelse av gener og genvarianter som gir de ønskede egenskaper. Genteknologien erstatter derfor ikke klassisk avl og foredling, men vil være et kraftfullt supplement og få økende betydning ettersom kunnskapsnivået øker.
Hva som er mulig å oppnå vil avhenge av hvilke tekniske muligheter og begrensninger som finnes og er naturlig nok avgjørende for en innovasjonsprosess. En rekke forhold er av betydning, blant annet:
om endringen skal være stabil arvelig eller midlertidig
for en stabil endring; om den ønskede egenskapen er multigen eller kodes av et enkelt gen
om egenskapen kodes av et enkelt gen, om genet eller en genvariant er kjent eller ikke
om egenskapen er multigen, hvordan de involverte genene samspiller med hverandre og andre gener
om genet allerede finnes i den aktuelle organismen, men i mindre optimal variant, eller om nytt gen må tilføres
om det er teknisk mulig å endre genet der det sitter
om det er flere kopier av genet som alle må endres for at ny egenskap skal etableres
om det er mulig å flytte nytt DNA inn i den aktuelle cellen, og om DNA-et kan integreres stabilt i genomet
muligheter for å sikre at det ikke oppstår utilsiktede endringer.
Genteknologiens utvikling har gradvis endret mulighetsrommet på alle disse punktene, selv om de faktiske mulighetene fortsatt vil avhenge av hvilken organisme og egenskap det er snakk om, og varierer fra sak-til-sak.
De fleste avlsmål er multigene, og dette setter betydelige begrensninger for innovasjon innen avl og foredling. Organismers genetikk medfører også forskjeller med hensyn til muligheter og begrensninger. Planter er for eksempel ofte polyploide, og det kan gjøre det vanskelig å oppnå en ønsket endring med klassisk genmodifisering og konvensjonell avl. Selv om man endrer eller tilfører én endret genkopi vil det fortsatt være flere opprinnelige kopier igjen. Nye genteknologiske verktøy gjør at man potensielt kan endre alle de aktuelle kopiene av et eksisterende gen samtidig, på samme målrettede måte, og dermed oppnå en ønsket fenotypisk effekt, noe som tidligere ikke var mulig. Teknologisk utvikling for datainnsamling, eksperimentell biologi, databehandling, simulering og kunstig intelligens eller «deep learning», forventes å bidra til å redusere viktige begrensninger for ulike typer avl, både med eller uten bruk av genteknologi. Hvor raskt slik ny kunnskap vil utvikles og kunne tas i bruk, vil likevel variere mye mellom organismegrupper, problemstillinger og ressurstilgang hos innovatører.
Tekniske muligheter og begrensninger er ikke kun avhengig av teoretisk kunnskap. De handler også om infrastruktur, kostnader, kompetanse og andre kapasiteter. Man må vurdere om man har utstyret og materialet som trengs, eller om prosjektet er for dyrt å gjennomføre, eller tar for lang tid. Videre er det nødvendig å vurdere om man har kvalifisert personale som kan håndtere de nødvendige studiene, og i tillegg få fram nødvendig dokumentasjon og kunnskap innenfor de gitte rammene (tidsfrister, økonomi med mer). Utviklere vil også vurdere forhold som ikke er knyttet til selve teknologien, eller bare indirekte er knyttet til teknologien. Dette kan være om det finnes eller kan utvikles et marked for produktet, om markedspotensialet forsvarer utviklingskostnadene og investeringsrisikoen. Det kan også være at en teknologisatsing vil generere merverdi som kan utnyttes i andre sammenhenger (for eksempel utstyr eller ny kunnskap).
7.1.2.2 Kunnskapens tilgjengelighet – åpenhet og immaterielle rettigheter
Innovasjon bygger på eksisterende kunnskap. Begrensninger i tilgangen til eksisterende kunnskap kan lett begrense innovasjonsrommet. Relevante forhold er om kunnskapen holdes hemmelig, og/eller om det man utvikler egentlig er utviklet allerede. Videre om kunnskapen er rettsbeskyttet, og om den i så fall er tilgjengelig på visse begrensende vilkår. Rettsbeskyttelse kan oppnås ved bruk av immaterielle rettigheter og patenter. Dette omtales nærmere i kapittel 11. Her i kapittel 7 gis en teknologisk vinkling på tilgjengelighet av kunnskap.
For en virksomhet som utvikler ny kunnskap, kan det være ønskelig at den nye kunnskapen ikke kan utnyttes av konkurrerende virksomheter. Man har da to åpenbare løsninger; å hemmeligholde kunnskapen eller å rettsbeskytte den. En tredje mulighet er å være først ute med å levere et så godt produkt at man i praksis fyller nisjen hvor produktet etterspørres, og gjør det veldig krevende for konkurrenter å forsøke å overta nisjen.
Ved å gjøre kunnskapen tilgjengelig kan man forebygge mistanker om at man har noe å skjule, og man signaliserer at man selv har tillit til andre samfunnsaktører. Samtidig er det naivt å tro at åpenhet ikke kan skade (kunnskaps-)utvikleres interesser. Hvilke krav og vilkår samfunnet stiller til åpenhet, og hvilke vurderinger utviklere selv gjør, er derfor vesentlig for hvilken innovasjon som vil finne sted. Forordning (EU) 2019/1381 om åpenhet og bærekraft i EUs risikovurdering i næringsmiddelkjeden (åpenhetsforordningen) har blant annet som formål å sikre at publikum har adgang til de vitenskapelige undersøkelsene som følger for eksempel søknader om godkjenning av nye plantevernmidler. Forordningen ble tatt inn i norsk rett i 2022.
Det har de senere årene vært et førende prinsipp at all offentlig finansiert kunnskapsutvikling skal komme fellesskapet til nytte. I praksis har det medført at åpenhet er normalen. Åpenhet er også vesentlig for å sikre etterprøvbarhet av forskning. Samtidig signaliserer de som finansierer offentlig forskning et ønske om at kommersialiserbare resultater skal rettsbeskyttes, slik at det kommersielle potensialet kan utnyttes. Noen velger å publisere sine resultater uten å rettsbeskytte disse, men med det formål å sikre at den tilknyttede kunnskapen skal være åpent tilgjengelig og forhindre at andre skal kunne rettsbeskytte den samme kunnskapen.
For planteforedling har man gjennom UPOV (International Union for the Protection of New Varieties of Plants) etablert spesielle rettigheter for beskyttelse og videreutvikling av nye plantesorter2. Unionens formål er å tilby og fremme et effektivt system for beskyttelse av nye plantesorter og derigjennom oppmuntre til utvikling av nye plantesorter. UPOVs medlemmer har nasjonalt regelverk som gir sortseierne tilnærmet de samme rettigheter i alle land hvor sorten er blitt beskyttet. I Norge er det Plantesortsnemnda som forvalter lov og forskrift om planteforedlerrett. Når Plantesortsnemnda tilkjenner en sortseier planteforedlerrett, får hen enerett til å produsere og selge formeringsvare (såkorn, frø, morplanter, settepotet og lignende) av sorten. Denne eneretten, også kalt rettsbeskyttelse, utnyttes oftest ved at sortseieren mot betaling av en avgift (lisensavgift, royalty, etc.), tillater andre å produsere og selge formeringsvare av sorten. Myndighetene har ingen innvirkning på avgiftenes størrelse, bortsett fra de tilfeller avgiften er satt høyt med tanke på å hindre dyrking av sorten3. For at en plantesort skal kunne rettsbeskyttes, må den nye sorten oppfylle blant annet kriteriene som innebærer at den er skillbar fra andre sorter, ensartet og stabil (DUS), og vilkårene for sortsbetegnelse. Sorten blir da rettsbeskyttet for en avgrenset tidsperiode, men rettbeskyttelsen er begrenset til oppformering av sortsmaterialet (for eksempel såvare), mens andre kan bruke sorten som grunnlag for videreforedling til en ny sort. Rettsbeskyttede sorter kan altså fritt brukes i forskning og videre foredling. Dette omfatter også utvelgelse av muterte planter i en rettsbeskyttet sort. Slike utvalg vil kunne oppnå rettsbeskyttelse som egen sort. Konseptuelt er dette en praksis som ivaretar utviklers behov for å få noe igjen for en investering og samtidig legger opp til videre innovasjon på basis av eksisterende kunnskap og tidligere innovasjon, noe som er vesentlig forskjellig fra en patentbasert rettighetspolitikk.
Gjennom FNs organisasjon for ernæring og landbruk (FAO) er Norge også tilknyttet den internasjonale avtalen om plantegenetiske ressurser for mat og landbruk4, som blant annet skal bidra til bevaring og bærekraftig bruk av alle plantegenetiske ressurser for mat og landbruk.
Det er de senere årene også en tydelig utvikling i retning av å tilgjengeliggjøre alle data i forskning. FAIR prinsippene (Findabilty, Accessibility, Interoperability & Reusability)5 er i dag bredt internasjonalt anerkjent, og ofte nedfelt som førende krav for håndtering av data fra offentlig finansiert forskning. Generelt er det økende fokus på åpenhet og datadeling (open science, open access), ikke minst i EU/EØS, og krav om dette kan også være aktuelt å nedfelle i lovverk, for eksempel knyttet til spørsmål om å gi markedstilgang. Kapittel 11 berører også denne problemstillingen.
Sentrale aspekter i teknologiutviklingen er tilgjengeligheten (hvor enkelt anvendelig er teknologien, inkludert i hvilken grad den er rettsbeskyttet), presisjonen (forutsigbarhet, suksess- og feilrater) og mulige bruksområder (kan den for eksempel brukes bare på dyr eller bare under spesielle fysiske betingelser). Teknologi som krever omfattende infrastruktur, store investeringer og høy kompetanse, vil nødvendigvis begrense innovasjon på områder hvor interessentene har små ressurser og markedet for innovasjonen er uklart. Fremtidig uforutsigbarhet og manglende harmonisering rundt lovregulering av teknologi og genteknologibaserte produkter i ulike jurisdiksjoner og markeder, påvirker også innovasjon både kvalitativt og kvantitativt. Hvis ulike teknologiske løsninger på samme problem kan gi to vesentlig forskjellige prosesser fram til et eventuelt ferdig resultat, uansett om det er ren kunnskapsutvikling eller et kommersielt produkt, vil en utvikler sannsynligvis velge det som framstår som den mest effektive og minst usikre og/eller ressurskrevende prosessen.
Viljen til å investere i en konkret innovasjonsidé vil avhenge av mange faktorer. Formålet med idéutviklingen kan være å utvikle et kommersielt produkt, å bidra til å løse et konkret problem, eller primært å utvikle ny kunnskap. Som eksemplene senere i dette kapitlet vil vise, er mange idéer for produktutvikling i tidlig fase, og bygger ny kunnskap på veien til noe som senere kan gi grunnlag for utvikling av kommersielle produkter. Kommersialiseringsgraden vil blant annet avhenge av om funn fra utviklingsstadier kan bekreftes i felt/kliniske forsøk, om det gjøres funn som gir grunnlag for usikkerhet om produktet, og hvilke andre investeringer idéen konkurrerer med. Regulering kan også gi klare føringer for hvilke produkttyper, anvendelser og teknologiske løsninger som kan forventes å kunne bli godkjent. De norske kravene til vurdering av bærekraft, samfunnsnytte og etikk (se kapittel 9) som er nedfelt i genteknologiloven, er eksempel på dette. Problemstillinger knyttet til disse hensynene, som går utover de rent tekniske, omtales også i kapittel 9, og i noen grad i neste punkt 7.1.2.3.
7.1.2.3 Faktorer som indirekte påvirker teknologi- og produktutvikling, kommersialisering og bruk
I tillegg til potensialet i, og tilgjengeligheten av teknologiske løsninger for produktutvikling, vil det være mange sosioøkonomiske og ikke-teknologiske faktorer som på ulike måter vil påvirke hva som faktisk vil bli utviklet, kommersialisert og tatt i bruk.
Hvordan oppfatter innovatører og investorer teknologi- og markedspotensial? Hvordan ser den offentlige diskursen ut, hvordan påvirkes den, og hvordan påvirker denne samfunnets holdninger til og aksept for bruk av teknologien på ulike bruksområder, for eksempel matvarer, industriprodukter, naturbevaring eller medisinske formål? Hvilke vesentlige endringer av politiske styringssignaler kan komme (for eksempel økt fokus på system, bærekraft, nasjonal og/eller regional selvforsyning)? Hvor fleksibel er den teknologien man investerer i, det vil si kan den omstilles for flere formål?
Kunnskapsgrunnlaget man bygger på har også stor betydning. En ting er hvor stor åpenhet det er rundt data. Noe annet er hvor objektive data- og kunnskapskilder er, og hvordan dette påvirker tillit til disse, og i hvilket omfang det oppstår interessekonflikter, og hvordan disse håndteres. Et relevant spørsmål er hvilke muligheter som finnes for å få tilgang på materiale for å kunne utføre uavhengig forskning, produsere egne data eller etterprøve andres. Eierskap til genressurser og teknologier, patenter og regulering av immaterielle rettigheter diskuteres som tidligere nevnt også i kapittel 11, og til dels i reguleringsalternativene i kapittel 10. Slikt eierskap vil være en vesentlig driver eller brems for åpen innovasjon og diversitet i innovasjonsøkosystemet. Dette berører blant annet hva man ser på som kjente og naturlige genressurser.
FNs konvensjon for biologisk mangfold tilrettelegger gjennom Nagoya-protokollen (se kapittel 5.6.1), for å sikre nasjoner rettigheter til egne genressurser. Det er ikke entydig om slikt regelverk og praktisering av det tilrettelegger for eller hindrer at slike genressurser blir tatt i bruk. Eksempler på andre viktige innovasjonspåvirkende faktorer er kapasitetsbygging, særlig i det som kalles lav- og mellominntektsland (Low and Middle Income Countries – LMIC-land), felles definisjoner og internasjonal harmonisering av regelverk, og utvikling av effektive mekanismer for bærekraftig bruk og utnyttelse av genressurser. Videre pekes det i en rapport fra FAO 2022, på asymmetrien i teknologikunnskap og forskjellen i bruk og utvikling mellom industrialiserte land og LMIC-land. Dette har betydning for hvordan eierforholdene til den nye genteknologien utvikles videre i ulike landbrukssystemer, herunder hvordan rettferdig fordeling sees i lys av patenter og ulike interessenter i såvarekjeden og de produktene som fremmes i ulike markeder.
7.1.3 Trender i teknologi- og produktutvikling
Med den raske utviklingen av den genteknologiske verktøykassa de senere årene, særlig innen genomredigering, har også innovasjonstakten økt, og bruksområdene blitt mer mangfoldige enn tidligere. Europarådet ba i 2019 (Rådsbeslutning (EU) 2019/1904) om en bredere studie av nåværende og framtidige markedsanvendelser av nye genomteknikker (new genomic techniques; NGTs, se også ordlista). Joint Research Centre (JRC), EU-kommisjonens felles forskningssenter, som ligger under generaldirektoratet for helse og mattrygghet (DG Health and Food Safety), publiserte i 2021 en studie6 om status for disse teknikkene. Denne kom i lys av EU-domstolens avgjørelse fra 2018 (C-528/16). Se også omtale av studien og relaterte prosesser i kapittel 8 del II. Definisjonen av NGT brukt i hele studien er «teknikker som kan endre genetisk materiale i en organisme, utviklet etter at EUs utsettingsdirektiv 2001/18 ble vedtatt». Denne overordnete NGT-studien rapporterte blant annet at antallet finansierte forsknings- og innovasjonsprosjekter med nye genomredigeringsteknikker firedoblet seg fra syvende rammeprogram (2007–2014) til Horisont 2020 (2014–2020). Til sammen i begge periodene ble det gitt midler til over tusen slike prosjekter, der omtrent en femtedel var innen bioøkonomi og de resterende innen biomedisinske anvendelser. Satsingen illustrerer både forventninger til teknologiens potensial som supplement til konvensjonelle teknologier for avl og produktutvikling for landbruk, miljø, industrielle og medisinske formål, og behovet for styrket kunnskapsutvikling om de nye genteknologiene.
EUs nye rammeprogram for forskning og innovasjon, Horisont Europa, inkluderer blant annet arbeidsprogrammet for mat, bioøkonomi, naturressurser, landbruk og miljø. Her er genteknologi trukket frem som et viktig fokusområde. Det står (oversatt av utvalget):
«Det er behov for å muliggjøre store fremskritt innen biovitenskap og bioteknologi, i nye genomteknikker, som gen-/genomredigering. Dette tar sikte på å sikre at de kan bidra trygt og bærekraftig til å møte de store samfunnsutfordringene i vår tidsalder, slik som håndtering og tilpasning til klimaendringer, forbedret ressurseffektivitet i industrien og i ulike sektorer i økonomien. Dette omfatter anvendelser i biobaserte sektorer, f.eks. utvikling av forbedrede og mer motstandsdyktige mat- og fôrråvarer, planter og husdyr, for å oppnå en mer effektiv ressursbruk, lengre holdbarhet for landbruksproduktene, samt å gjøre produkter eller biprodukter fra matproduksjon mer egnet for gjenbruk».
JRC har videre gjort en kartlegging av nåværende og fremtidig marked for ulike anvendelser av nye genomteknikker per 2021 (Parisi & Rodríguez-Cerezo 2021) som grunnlag for den overordnete NGT-studien. Dataene er basert på informasjon hentet inn fra både private og offentlige aktører fra hele verden, og representerer således den globale aktivitetsfronten. Av teknologiene som er rapportert brukt i de kartlagte eksemplene, er CRISPR-baserte metoder langt de mest populære og utgjør rett i underkant av 70 prosent av alle produktapplikasjonene. Av rundt 645 identifiserte produkter under utvikling, er planter den mest omfangsrike kategorien, etterfulgt av humane celler, dyr og sopp (se figur 7.1).
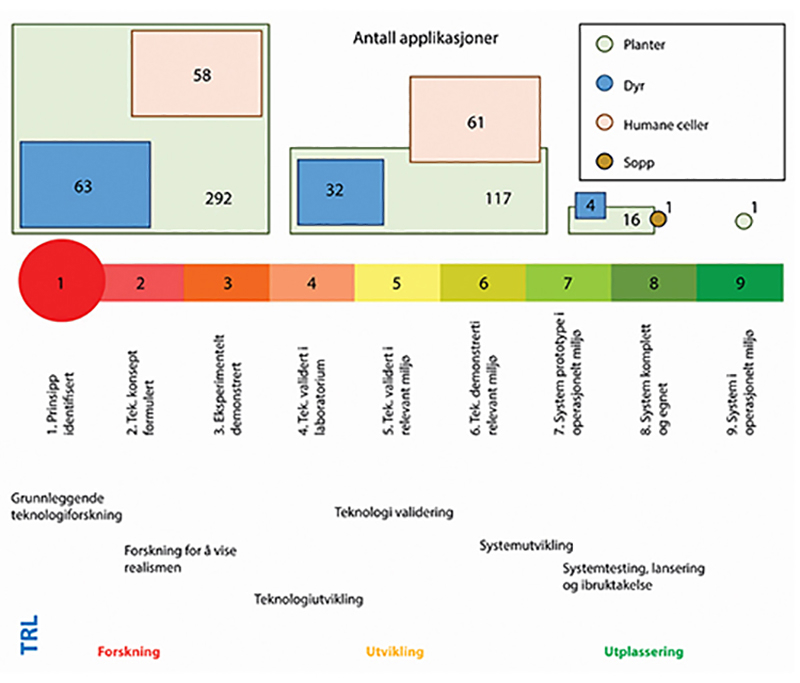
Figur 7.1 Ekstrapolert grovfordeling av teknologisk modenhet, TRL (technology readiness level), for totalt 645 NGT-applikasjoner.
Figuren viser applikasjoner for henholdsvis planter, dyr, humane celler og sopp. Horisontal akse = TRL skala, med forklaringer under. Størrelsen på boksene over linjen er størrelsesmessig korrekte i forhold til hverandre. Den relative mengdefordelingen (antall applikasjoner) er hentet fra figur 1 i forskningsrapport fra EUs Joint Research Centre (Parisi & Rodríguez-Cerezo 2021), og forholdt seg ikke aktivt til TRL-skalaen. Plasseringen langs denne aksen er derfor basert på vurderinger fra utvalgsmedlemmer, og skal anses som grove estimater. I rapporten understrekes det at mye av datagrunnlaget er konfidensielt og derfor ikke offentliggjort. Det påvirker også presisjonen med hensyn til TRL-plasseringer. Humane celleapplikasjoner i utviklingsfasene inngår typisk i fase I/II kliniske studier.
Produkter som er framstilt bare med teknikker som eksisterte før utsettingsdirektivet ble vedtatt i 2001, for eksempel Agrobacterium-mediert transformasjon og biolistiske teknikker (bruk av genkanon, se også kapittel 4) faller utenfor rammen av selve NGT-studien og den ovennevnte JRC-studien om markedspotensialet av NGT-er. JRC har også publisert en annen slik grunnlagsstudie. Denne er en gjennomgang av alle de forskjellige teknikkene under paraplybegrepet NGT (Broothaerts et al. 2021). Begge studier grupperte teknikkene inn i fire typer:
Teknikker som lager dobbelttrådet brudd i DNA, inkludert lokasjonsspesifikke nuklease (SDN) teknikker slik som teknikker basert på CRISPR/Cas9, TALENs, ZFNs. Dette er teknikker som kan brukes til mutagenese og eventuelt også til cisgenese, intragenese og transgenese. Disse teknikkene utgjorde over 90 % av eksemplene i studiene.
Teknikker som involverer enkelttrådet DNA-brudd eller ikke involverer brudd i genomet, slik som baseredigering og prime redigering. Disse utgjorde omtrent 8 % av eksemplene, hovedsakelig planter.
Epigenetiske teknikker som RNA-styrt DNA metylering eller CRISPR interferens.
Teknikker som virker direkte på RNA (RNA redigering).
I den ene av de to JRC-studiene (Parisi & Rodríguez-Cerezo 2021) ble det innledningsvis etablert en database for NGT på eller nær markedet. Databasen ble bygd opp på basis av offentlig tilgjengelige data (online), ekspertkonsultasjoner (skriftlig og på video), en spørreundersøkelse til offentlige og private teknologiutviklere, integrasjon og rensing av data fra ulike kilder og inndeling i ulike utviklingsstadier (på markedet, nær markedet, under forskning/utvikling og i veldig tidlig utviklingsstadium). Den siste inndelingen kan grovt sies å tilsvare henholdsvis TRL-nivå 9, 7-8, 4-6 og 1-3.
Når det gjelder arter og egenskaper viste kartleggingen at de fleste planter JRC antok kunne tas i bruk i løpet av en femårsperiode, er de samme artene og med tilsvarende egenskaper som dagens genmodifiserte planter, det vil si soya, mais, raps, potet og egenskaper som herbicidtoleranse, resistens mot soppinfeksjoner, modifisert olje- eller stivelsesinnhold, og anti-bruningsegenskaper. Mot 2030 vil det derimot kunne være mange ulike egenskaper fordelt på langt flere plantearter. For dyr viste JRC til fire organismer som de mente kunne være på markedet i løpet av fem år; kolla og varmetolerante kyr, gris som er motstandsdyktig mot en virussykdom (PRRS) og en oppdrettsfisk (tilapia) som vokser raskere. JRC anslo at antallet dyrearter og egenskaper vil øke betraktelig mot 2030. De manglet data for å gjøre tilsvarende antagelser for mikroorganismer, men viste til at det allerede kan være et betydelig antall som benyttes under innesluttet bruk. I disse tilfellene er det normalt ikke mikroorganismen selv, men biokjemiske produkter framstilt av mikroorganismen, som er det egentlige produktet. Datasettet inkluderte også en bakterie som er godkjent for utsetting, som har til hensikt å fiksere eller binde nitrogen i jorda. JRC viste til at det på forskningsstadiet kan være flere slike bakterier. Kartleggingen inkluderte dessuten flere medisinske NGT-produkter, de fleste mot kreft, virussykdommer og arvelige sykdommer. Det var gjennomført kliniske studier for mange av dem, men JRC fant ingen som var på markedet. Dette har endret seg, ikke minst på grunn av vaksiner mot Covid-19. Se videre omtale av vaksiner og GMO-legemidler i kapittel 7.6.
I JRC-rapporten er produktene delt inn i fire utviklingstrinn. Det tidligste trinnet, konseptbevis (proof of concept), som utvalget grovt vurderer å tilsvare tre de laveste TRL-nivåene, omfattet drøyt 400 av de identifiserte NGT-produktene. Det er ikke noe anslag for når produkter på dette trinnet kan være på markedet. Det neste trinnet, som utvalget grovt vurderer å tilsvare de mellomste TRL-nivåene, produkter som kan være klare for markedet innen 2030, omfattet mer enn hundre planter og flere dusin dyr og medisinske anvendelser (humane celler). Det siste trinnet før markedsføring, produkter som JRC vurderte at kan komme på markedet i løpet av fem års tid, grovt vurdert av utvalget til å tilsvare TRL-nivåene 7 og 8, omfattet omkring 30 produkter. Produkter som omsettes i minst et land, TRL-nivå 9, omfattet en soyaplante med endret fettsyreprofil og en nitrogenfikserende jordbakterie til utsetting, som er på markedet i USA. I tillegg er det mange NGT-mikroorganismer som fungerer som bioreaktorer i innesluttede prosesser. Det var ingen dyr, sopp eller produkter for medisinsk anvendelse i denne kategorien. Flere av produktene som JRC-rapporten omtaler, blir beskrevet nærmere i eksempler senere i dette kapitlet.
Som ledd i utarbeidelsen av sin rapport om CRISPR og andre genomredigeringsteknikker (VKM 2021), gjennomførte VKM litteratursøk for å identifisere fagfelleartikler som hadde relevans for genomredigering av planter, dyr og mikroorganismer. Søket identifiserte 60 relevante artikler for planter, 60 for dyr og 20 for mikroorganismer. Videre redegjorde rapporten for både konvensjonelle og genteknologiske avls- og foredlingsteknologier, og beskrev virkemåter og hva slags genetiske endringer som kan oppnås med ulike teknologialternativer. I rapporten skrev de (oversatt av utvalget):
De fleste genomredigerte plantearter som er under kommersiell utvikling, er relevante for Norge, enten for import, som soya til fôrproduksjon, eller for landbruksproduksjon som poteter. Planteprodukter hvor CRISPR har blitt brukt for å slå ut gener (knock-out) og forbedre egenskaper, som stresstoleranse og bedret ernæringsmessig verdi, er nærmest markedet i dag, mens vi kan forvente at knock-in mutanter som bærer deler av eller hele gener fra nære slektninger eller andre arter, introduseres i framtiden (VKM 2021, side 83).
Plantearter som er aktuelle for dyrking i Norge, ble drøftet i et eget underkapittel i rapporten som omfattet potet (fokus på endret stivelsesinnhold, forbedrete lagringsegenskaper og redusert akrylamidinnhold), raps (herbicidtoleranse), tomat (sykdomsresistens), og oljedodre, en oljerik plante med endret fettsyresammensetning. Dyrearter som er aktuelle for Norge, ble også drøftet i et eget underkapittel som omfattet laks (fokus på sterilitet/kjønnsmodning, fettsyresammensetning, vekst/produktivitet og sykdomsresistens), storfe (kollethet, økt muskelmasse/kjøttproduksjon, prion knock-out, jurhelse/redusert mastitt, og endret melkeproteinprofil), svin (sykdomsresistens, termoregulering og redusert forekomst av rånesmak), kylling (allergenfrie egg, sykdomsresistens og kjønnsbestemmelse), sau og honningbier. Kapitlet om mikroorganismer presenterte ikke eksempler med spesifikk relevans for Norge, blant annet med henvisning til at de aller fleste anvendelser av mikroorganismer vil være for innesluttet bruk. VKMs mandat er hovedsakelig knyttet til risikovurderinger, og dette har derfor fått særlig stor oppmerksomhet i rapporten, se også kapittel 8 i denne utredningen.
Selv om det kan forventes at en stadig økende andel av nye produkter som utvikles med genteknologi for markedet, vil utvikles med NGT, er det store flertallet av produkter både på og nær markedet utviklet med eldre genteknologier. Det framgår heller ikke alltid tydelig, verken av generell litteratur eller av JRC-rapportene, om det kun er benyttet NGT eller en kombinasjon av NGT og eldre teknikker i framstilling av et produkt, og eventuelt i hvilke stadier av produktutviklingen teknikkene er benyttet. Det gjør at eksemplene som listes i tabellen under omfatter produkter utviklet med både eldre teknikker og med NGT.
Figurer 7.2–7.4 viser eksempler på organismetyper, anvendelsesområder, tilsiktede genetiske effekter, estimerte teknologiske modenhetsnivåer og type teknologi som er benyttet i forskning og innovasjon. Så langt det har vært mulig for utvalget er det henvist til vitenskapelige referanser, men for enkelte kommersielle produkter er henvisning begrenset til produsentens egne opplysninger, som ofte er lite informative med hensyn til å dokumentere valg av teknologisk løsning, faktiske effekter av genetisk endring, og så videre. TRL-nivå angis vanligvis ikke i vitenskapelig litteratur, og angitt TRL-nivå er derfor et estimat gjort av utvalgsmedlemmer på bakgrunn av informasjon som er tilgjengelig i de vitenskapelige referansene eller fra andre kilder (for eksempel om produktet er kommersielt tilgjengelig fra en nettside, risikovurdert med tanke på feltforsøk eller kommersialisering, og så videre). Se i tillegg vedlegg 1 for referanser til eksemplene. Eksemplene omtales i flere tilfeller også i andre kapitler, og hovedintensjonen med tabellen er å presentere eksempler som belyser flere ulike aspekter ved de aktuelle teknologiene og derfor kan tas fram i ulike sammenhenger i utredningen.
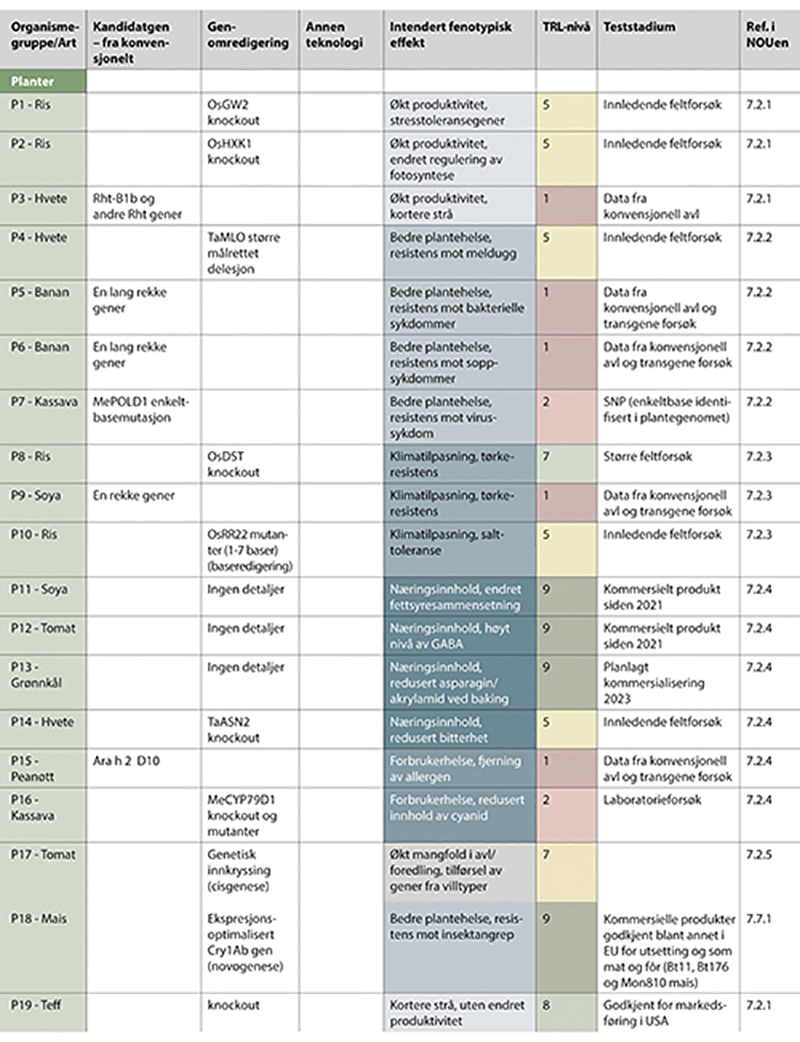
Figur 7.2 Eksempler på genteknologiske anvendelser i forskning og innovasjon - del I.
Del I - del III vises i figur 7.2 - 7.4. (ett nytt figurnummer for hver side i utredningen). Eksemplene i del I - del III er sortert på organismetyper, og har følgende nummerering; P1 - P19 for planteeksempler, D1 - D18 for eksempler med anvendelser i dyr, M1 - M5 for eksempler med mikroorganismer, og ett eksempel med legemidler. Figuren viser type teknologi som er benyttet, tilsiktede genetiske effekter, estimerte teknologiske modenhetsnivåer og anvendelsesområder. Siste kolonne viser hvor i kapittel 7 eksemplet er nærmere beskrevet. Se i tillegg vedlegg 1 for referanser til eksemplene.
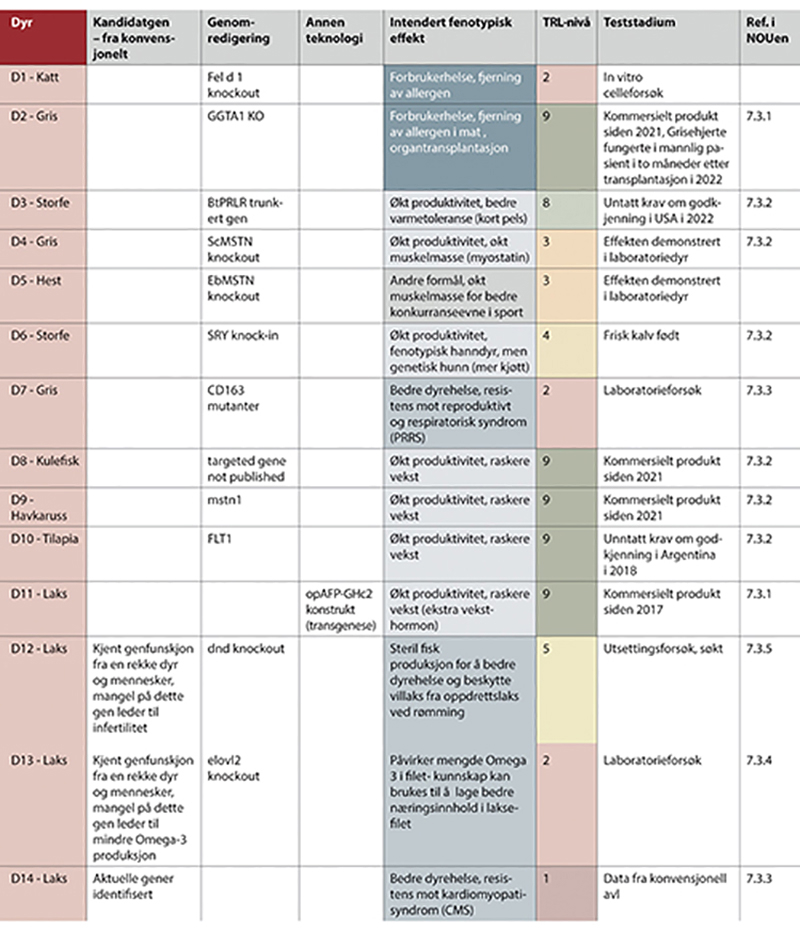
Figur 7.3 Eksempler på genteknologiske anvendelser i forskning og innovasjon - del II.
Del I - del III vises i figur 7.2 - 7.4. (ett nytt figurnummer for hver side i utredningen). Eksemplene i del I - del III er sortert på organismetyper, og har følgende nummerering; P1 - P19 for planteeksempler, D1 - D18 for eksempler med anvendelser i dyr, M1 - M5 for eksempler med mikroorganismer, og ett eksempel med legemidler. Figuren viser type teknologi som er benyttet, tilsiktede genetiske effekter, estimerte teknologiske modenhetsnivåer og anvendelsesområder. Siste kolonne viser hvor i kapittel 7 eksemplet er nærmere beskrevet. Se i tillegg vedlegg 1 for referanser til eksemplene.
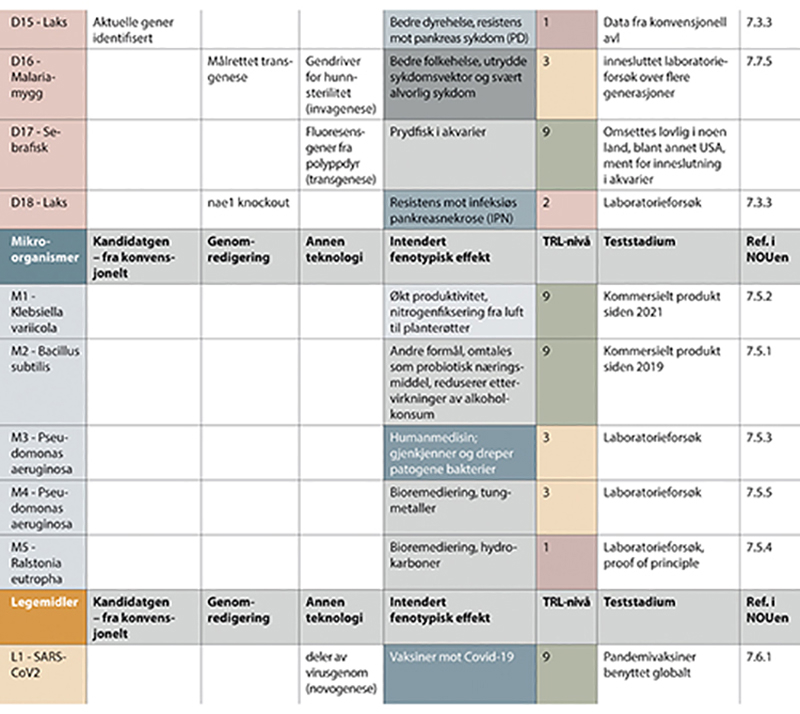
Figur 7.4 Eksempler på genteknologiske anvendelser i forskning og innovasjon - del III.
Del I - del III vises i figur 7.2 - 7.4. (ett nytt figurnummer for hver side i utredningen). Eksemplene i del I - del III er sortert på organismetyper, og har følgende nummerering; P1 - P19 for planteeksempler, D1 - D18 for eksempler med anvendelser i dyr, M1 - M5 for eksempler med mikroorganismer, og ett eksempel med legemidler. Figuren viser type teknologi som er benyttet, tilsiktede genetiske effekter, estimerte teknologiske modenhetsnivåer og anvendelsesområder. Siste kolonne viser hvor i kapittel 7 eksemplet er nærmere beskrevet. Se i tillegg vedlegg 1 for referanser til eksemplene.
I de følgende underkapitlene vil ulike anvendelser av genomredigering i planter (kapittel 7.2), dyr (kapittel 7.3), mikroorganismer (kapittel 7.5) og GMO-legemidler (kapittel 7.6) beskrives nærmere. Det gis eksempler på produkter som er i ulike stadier av utvikling, noen er på forskningsstadiet og andre er på eller nært markedet i andre deler av verden utenfor Europa. Hensikten er å vise et mangfold av prosjekter, aktører og mulige bruksområder for genomredigering. Visse begrensninger omtales i et eget underkapittel for hver organismetype, men generelt er begrensninger diskutert på overordnet plan i kapittel 7.1. Deretter gis eksempler, av nyere dato, på mer spesielle produkter og anvendelser av genteknologier, både eksisterende og under utvikling (kapittel 7.4 og 7.7). Disse er basert både på eldre genteknologier og nye teknologiske løsninger, inkludert det utvalget har definert som novogenese. De fleste eksemplene er gitt med henvisninger til vitenskapelige publikasjoner, men for enkelte kommersialiserte produkter kan det være henvist til andre kilder.
7.2 Planter
De aller fleste GMO som omsettes på verdensmarkedet, er transgene planter framstilt med eldre genteknologiske teknikker som gir tilfeldige innsettinger. Majoriteten av disse plantene er enten herbicidtolerante, insektresistente eller kombinasjoner av disse to typene egenskaper. Mange av GMO-ene er i tillegg hybrider av slike GMO-er (se kapittel 4.7.1 om stacks).
Globalt er innovasjonslandskapet for planteforedling med NGT mangfoldig, både med tanke på bruksområder, type vekster og aktører som er involvert. Eksempellisten (tabell 1 i JRC-studien om markedspotensiale) inneholder i stor grad de samme planteartene som man tidligere har modifisert med eldre genteknikker, men bruksområdene som ble listet opp i JRC-studien har en mye større bredde og domineres ikke av herbicidtolerante og insektresistente planter, med unntak for de produktene som har kommet lengst i retning av kommersialisering. Produktene på listen omfatter flest kornvekster (nær 40 %), men også en rekke andre vekster som grønnsaker, frukt, knoller/rotfrukter, belgvekster, gress og andre fôrvekster, prydplanter og trær. Dette gjelder også flere vekster som ikke tradisjonelt har vært utviklet i særlig grad på grunn av begrenset kommersiell verdi i et markedsbasert landbruk, som kassava og hirse.
Av tiltenkte, framtidige kommersielle bruksområder for de nye genomteknikkene, omfattet eksemplene flest planteprodukter med endret næringsinnhold med mer (ca. 25 %) og styrket motstand mot biotisk stress som følge av angrep av insekter og andre planteskadegjørere (ca. 25 %). Videre omfattet eksemplene økt produktivitet og plantestruktur (ca. 20 %), toleranse for abiotisk stress som klimatilpasning med mer (nær 10 %), reproduksjonsegenskaper som blomstringsfrekvens med mer (nær 10 %), sprøytemiddeltoleranse (8 %), lagringsegenskaper og endret farge/smak. Det ble registrert flere offentlige og akademiske utviklere enn private utviklere i denne kartleggingen (figur 7b i JRC studien). Der herbicidtoleranse og insektresistens er totalt dominerende blant dagens kommersielle GMO-er, er det altså andre egenskaper og bruksområder som ligger an til å dominere den langsiktige utviklingen gitt at de ulike tiltenkte bruksområdene har et potensiale i markedet.
Graminor AS utvikler plantesorter for norsk jord- og hagebruk. De har ikke tatt i bruk nye genomteknikker i sin foredling. Sortsutviklingen fokuserer på kornarter, engvekster, poteter, frukt og bær med egenskaper som gjør sortene særlig egnet for norske forhold. Graminors prioriterte avlsmål inkluderer for eksempel i bygg; høy avling, stråstyrke og stråkvalitet, resistens mot soppsykdommer og tidlighet, i hvete; høy avling, tidlig modning, stråstyrke og stråkvalitet, resistens mot soppsykdommer, god overvintringsevne for høsthvete, i tillegg til gode produktegenskaper for videre bruk, i engvekster; avling, varighet, sykdomsresistens, vinterherdighet, fôrkvalitet, frøsettingsevne, i potet; sykdomsresistens og produksjonsegenskaper for videre foredling og bruk står sentralt, i frukt og bær; sykdomsresistens og vinterherdighet antas å være sentrale, i tillegg til produktkvaliteter. Dersom nye genomteknikker skal tas i bruk i norsk planteforedling, vil det være for raskere og lettere å kunne nå avlsmålene for norsk planteforedling, primært med de artene som er mest relevante for dyrking under norske forhold. Plantemangfoldet vil imidlertid kunne endre seg over tid både på grunn av klimaendringer og mulighetene som de nye genomteknikkene gir.
Nedenfor tar vi for oss noen utvalgte tiltenkte bruksområder og eksempler på genomredigerte planter eller produkter som er relevante både globalt og i noen tilfeller i Norge. De fleste eksemplene er fra regioner utenfor Europa der noen av disse produkttypene ikke nødvendigvis reguleres som GMO.
7.2.1 Produksjonsegenskaper
At kulturplanter har produksjonsegenskaper som gjør dem enkle å dyrke og gir størst mulig avlingsutbytte, er og har helt siden jordbrukets opprinnelse vært viktige avlsmål. Avlingsutbytte har betydning både for bondens økonomi, for matsikkerhet og for arealeffektiv produksjon. Det gis her flere eksempler på hvordan nye genomteknikker kan bidra til å forbedre slike produksjonsegenskaper, ved å benytte disse i tillegg til andre avlsverktøy.
I Kina har forskere gjort feltforsøk med genomredigert ris med målrettede mutasjoner i tre såkalte stressreseptorer. Innledende feltforsøk indikerer at risplantene fikk økt vekst og avlingsutbytte med opptil 30 prosent, uten reduksjon i stresstoleranse (Zeng et al. 2020). Andre studier har vist at det kan være mulig å utvikle kornplanter med flere eller større korn (Achary & Reddy 2021), og tomater med flere og tettere voksende bær (Kwon et al. 2020).
Eksempel: Kornvekster med kortere strå
Genvarianter som gir kornvekster korte strå, kan redusere sjansen for at planten knekker og kan ha potensiale til å øke avlingsutbyttet. Egenskapen har vært foredlet konvensjonelt i lang tid og har vært svært viktig for matsikkerheten, for eksempel i utviklingen av robuste hvetesorter under den grønne revolusjonen. Med genomredigering ligger det et potensiale i at genvarianten eller egenskapen også kan flyttes til nye linjer og uttrykkes på måter som ikke har vært mulig ved kryssing eller konvensjonell mutagenese. En feltstudie har vist at slike egenskaper kan være oppnåelige med genomredigering (Jobson et al. 2019). Et slikt tenkt eksempel fikk genteknologiutvalget høre om ved besøk til det norske foredlingsselskapet Graminor A/S: Hvetesorten Mirakel har gode bakeegenskaper, men må i dag tilføres stråforkorter ved dyrking for å unngå at den knekker7. Utvalget diskuterte om genredigering kunne være et alternativ til tradisjonell kryssing, for enklere og mer effektivt å oppnå kortere strå, og derav forbedre dyrkingsegenskapene til Mirakel. I USA ble en tilsvarende genomredigert kortstrået variant av teff (en endemisk kornsort av stor nasjonal betydning for matsikkerhet og matkultur i Etiopia), deregulert og tillatt for dyrking i USA, 3. april 20238 på basis av familiaritet, kjennskap til egenskapene og forståelse av de genetiske endringene.
Eksempel: Mer effektiv fotosyntese
Fotosyntesen, prosessen der planter gjør CO2 og vann om til sukker (plantemat) og oksygen ved hjelp av sollys, er grunnlaget for alt liv på jorda og naturens eget karbonlagringssystem. I fotosyntesen går mye av energien fra sollyset tapt som varme eller gjennom ineffektiv fiksering av karbon av enzymene i planten. Genene involvert i fotosyntesen er godt kartlagt, og genteknologi har på ulike måter potensial til å øke utnyttelsen av sollyset (Long et al. 2015). Ideen peker på et stort nyttepotensial, ikke minst sett opp mot klimautfordringene og bærekraftig bioproduksjon, men vil for noen også framstå som etisk uakseptabelt.
Et eksempel på forskning som kan bidra til mer effektiv fotosyntese, er en kinesisk studie som viste at målrettede mutasjoner i genet OsHXK1 øker aktiviteten til en rekke gener som er involvert i fotosyntesen og dermed avlingsutbyttet i ris (Zheng et al. 2021). Andre forskere jobber med å forbedre fotosyntetiske enzymer som utfører de biokjemiske reaksjonene (Hines et al. 2021), eller å gjøre plantene i stand til raskere å tilpasse seg skiftende lysforhold (Pacher-Zavisin 2017). En artikkel i National Geographic omtaler at eksperter på fagområdet anslår at dersom man slår sammen mange fotosynteseforbedrende mutasjoner i samme plante, for eksempel i ris, kan mengden CO2 som plantene fikserer, økes med 30 prosent eller mer9. FNs klimapanel IPCC trekker i sin 1,5 graders-rapport frem genetisk tilpasning (engineering) av fotosyntesen som ett eksempel på teknologisk innovasjon som er relevant for å nå klimamålene.
IPCC10 (2022, s. 90-91) skriver (oversatt av utvalget): Konvensjonell foredling assistert av genomikk introduserer egenskaper som tilpasser veksten til klimaendringer (høy konfidens). Genetiske forbedringer med moderne bioteknologi har potensial til å øke plantenes robusthet for vekslende klima i matproduksjonssystemer (høy konfidens), men biofysiske begrensninger, tekniske, agroøkosystemiske, sosioøkonomiske og politiske variabler har sterk innflytelse og begrenser anvendelsesgraden av slike vekster, særlig for småbønder.
7.2.2 Plantehelse
Plantesykdommer er en betydelig trussel mot matsikkerheten. I snitt per år er for eksempel avlingstapet som følge av angrep fra virus, bakterier og sopp estimert til 21,5 % av hveteavlingene, 30 % av risavlingene, 22,5 % av maisavlingene, 21,4 % av soyaavlingene og 17,2 % av potetavlingene, noen av verdens viktigste matplanter (Savary et al. 2019). Med klimaendringer kan utfordringene forventes å bli enda større, fordi mange skadegjørere trives i varmt og fuktig vær. Noen plantesykdommer kan bekjempes med sprøytemidler, men disse kan ha negative effekter for miljøet. EUs Green Deal har som mål å halvere sprøytemiddelbruken innen 2030. Planteforedling for å styrke plantehelsen vil spille en viktig rolle, og flere produkter under utvikling har dette som mål, både produkter utviklet med konvensjonelle metoder, genomredigering og transgenetikk. Som statistikken i rapporten fra JRC viser, bruker enkelte utviklere genomredigering til å lage planter som bedre tåler sprøytemidler, men mange flere bruker teknologien til å prøve å gjøre plantene motstandsdyktige mot sykdommen i seg selv og dermed kutte behovet for sprøyting. Sykdomsresistens kan styrkes ved å endre på planteproteiner som virus, bakterier og sopp trenger for å komme inn i eller formere seg i planten. Forfatterne av en nylig FAO-rapport «Gene editing and agrifood systems» fra 202211, anser at det å utvikle planter som har resistens mot sykdommer og skadedyr, vil være en pågående prosess fordi resistens overvinnes gjennom evolusjon og tilpasning av skadedyr og patogener.
Eksempel: Melduggresistens i korn
Meldugg er en sopp som kan angripe mange plantearter og er en utfordring for matproduksjon mange steder i verden. Imidlertid finnes plantesorter som er motstandsdyktige mot soppen fordi de har mutasjoner i genet MLO. For eksempel har det blitt funnet melduggresistente sorter av bygg i Etiopia som har slike mutasjoner naturlig. Egenskapen er over mange år krysset inn i elitesorter beregnet på moderne landbruk. Mange byggsorter med MLO-mutasjoner brukes og selges også i Norge12. Det finnes også byggsorter og en rekke andre planter med MLO-mutasjoner som er laget ved hjelp av stråling og kjemikalier (konvensjonell mutagenese).
MLO-genet finnes i de aller fleste plantearter som er interessante for matproduksjon. De færreste har imidlertid naturlige mutasjoner som gjør dem resistente mot meldugg, og er derfor utsatt for angrep med mindre man finner andre måter å lage mutasjonene på. Hvete er en kornart som også blir angrepet av meldugg. Det er imidlertid ikke sannsynlig at man kan få en resistent variant med MLO-mutasjoner verken naturlig, med kryssing, stråling eller med kjemikalier. Det er fordi hvete har hele seks kopier av arvestoffet sitt, og tilsvarende mange kopier av MLO. Med genredigering har man muligheten til å lage disse mutasjonene målrettet, og i alle alleler samtidig. Forskere har utviklet en slik melduggresistent genredigert hvete ved å mutere MLO-genene. Ved å tilpasse mutasjonene unngikk de også reduksjon i vekst og ytelse, noe som tradisjonelt fremstilte melduggresistente plantesorter ofte har (Li et al. 2022).
I Norge er poteten en viktig matplante, men den sopplignende sykdommen tørråte fører til store avlingstap. Tørråte er den skadegjøreren det blir sprøytet mest mot i norsk landbruk (Heggen et al. 2003). Dette er både kostnadsdrivende og skadelig for miljøet. Gjennom forskningsprosjektet GENEinnovate skal Graminor i samarbeid med Norges miljø- og biovitenskapelige universitet (NMBU), teste ut ny genredigeringsteknologi for å forbedre tørråteresistens i norske potetsorter13. Introgresjon fra ville slektninger til kommersielle potetsorter er særlig tidkrevende hvis det også foreligger kryssingsbarrierer som ulike EBN (endosperm balance numbers). Eksempelvis tok det mer enn 45 år å krysse inn Rpi-blb2-genet for tørråteresistens fra villplanten Solanum bulbocastaneum til potetsortene Bionica og Toluca (Haverkort et al. 2016). Med genteknologi kan resistensgener introduseres mer effektivt sammenlignet med konvensjonell kryssing.
I andre deler av verden er plantesykdommer en enda større trussel for matsikkerheten enn i Norge. I sub-tropiske strøk er bananen en viktig kilde til næring og økonomisk inntekt for småbønder i rundt 150 land, men den trues av flere bakterie- og virussykdommer. Ved International Institute of Tropical Agriculture (IITA) i Nairobi i Kenya forskes det på utvikling av sykdomsresistent banan ved hjelp av CRISPR og andre genteknologier (Tripathi et al. 2022; Wang et al. 2021). Andre forskere arbeider med å utvikle sykdomsresistent kassava14 – en matplante som utgjør en viktig del av næringsgrunnlaget for over 600 millioner mennesker sør for Sahara.
7.2.3 Klimatilpasning og klimaforebygging
Klimaendringene forventes å få store konsekvenser for verdens matproduksjon. Klimatilpasning, særlig av planter, er derfor et prioritert forskningsområde. Både FNs klimapanel IPCC og de vitenskapelige rådgiverne til FNs Food System Summit, har trukket frem genomredigering som en muliggjørende teknologi for klimatilpasning, som et av flere momenter som kan bidra. Mer effektiv fotosyntese som ble omtalt sist i kapittel 7.2.1, er et eksempel.
Eksempel: Tørkeresistent ris
En variant av den mest populære rissorten i India – indica – har ved hjelp av genredigering fått økt tørkeresistens (Santosh Kumar et al. 2020). Egenskapen, som så langt er observert in vitro, skyldes en delesjon i et gen kalt DST (drought and salt tolerance) og er kjent fra andre rissorter, men ville uten genredigering vært tid- og arbeidskrevende å krysse inn. Mutasjonen gjør at bladene på planten blir bredere og får færre såkalte stomata – en type fuktventiler – slik at den holder bedre på vannet ved tørke. Denne genredigerte risen har fått tillatelse til feltforsøk som oppgis å være planlagt gjennomført i 202415. Det forskes også på mulighetene for å utvikle tørkeresistent soya, men denne forskningen har kommet kortere (Rasheed et al. 2022).
Et annet eksempel, også i ris, er økt salttoleranse ved hjelp av genomredigering (Zhang et al 2019). Dette kan gjøre plantene mindre sårbare for økt saltkonsentrasjon som følger med økt tørke.
Også i et nordisk klima er det et stort behov for klimatilpasning av planter siden dyrkingsforholdene vil endres og bli mer ustabile fremover. Et eksempel på hvordan genredigering potensielt kan brukes til et slikt formål, er det EU-finansierte prosjektet Editgrass4food, et samarbeidsprosjekt mellom Research Centre for Agriculture and Forestry i Latvia, Tallin University of Technology i Estland og NMBU i Norge16. De skal utvikle genredigering som foredlingsverktøy for raigras, en type flerårig gress som ofte dyrkes på beitemark, med et langsiktig mål om raskere tilpasning til frost og tørke som et tiltak for å bedre beitemarkenes produksjonssikkerhet også ved klimaforandringer.
7.2.4 Næringsinnhold og andre forbrukerorienterte egenskaper
De første genomredigerte produktene på det globale markedet har egenskaper som er ment å gi nytte til forbrukeren. I USA har selskapet Calyxt utviklet olje fra genomredigert soya som de hevder gir olje med 20 prosent redusert innhold av mettet fett og er fri for transfett17, noe som skal gi produktet en sunnere fettprofil enn annen soya. Produktet har vært markedsført for kjøp direkte fra produsentens nettside siden 2019.
I Japan ble genomredigerte tomater med høye nivåer av gamma aminosmørsyre (GABA), et stoff som har viktige signalfunksjoner i sentralnervesystemet og som er et populært helsekosttilskudd, lansert i 2021 av det japanske selskapet Sanatech Seed (Waltz 2022). Disse produktene er ikke regulert som GMO i de respektive markedene. Tomaten er et eksempel på et produkt som ville kreve særskilt helsemerking i EU og Norge ifølge Mattilsynet.
En rekke planteprodukter med forbedret næringsinnhold og bedre smak er under utvikling. Genomredigert grønnkål med redusert bitterhet er ett av flere produkter som utvikles av det amerikanske startup-selskapet Pairwise. Selskapet sier selv at produktet forventes lansert på markedet i løpet av 202318.
Genteknologier kan, i likhet med konvensjonelle avlsmetoder, også brukes til å gjøre mat tryggere. I England har forskere brukt CRISPR i hvete til å redusere mengden asparagin – en aminosyre som blir konvertert til kreftfremkallende akrylamid ved varmebehandling, for eksempel når brød stekes. Hveten har vært testet i feltforsøk, og resultatene viste at akrylamidnivåene var halvert og at hveten ga normale avlinger når den ble dyrket utendørs (Raffan et al. 2023). En annen mulig bruk av genomredigering er å redusere mengden av allergener for å gjøre maten tryggere for matallergikere. Dette kan for eksempel være redusert gluten i hvete eller reduserte nivåer av allergifremkallende proteiner i peanøtter, noe som det forskes på (Brackett et al. 2022). Et annet eksempel er kassava med reduserte nivåer av det naturlig forekommende toksinet cyanid i roten (Juma et al. 2022). Bruk av kassavarot som ikke er riktig prosessert, fører til nerveskader hos mennesker på grunn av høyt cyanidinnhold.
Dyrking av nisjesorter
Sikori er en plante som dyrkes i Europa og brukes til utvinning av kostfiber som tilskudd i mange matprodukter. Foredling av sikori er imidlertid en svært tid- og ressurskrevende prosess, og veksten er derfor underutnyttet tross sine gunstige agronomiske egenskaper. I et prosjekt kalt CHIC19 har 17 ulike akademiske, private og offentlige aktører fra 10 europeiske land gått sammen for å utvikle genomredigering som avlsverktøy for sikori, som nyttige tilleggsverktøy til konvensjonell foredling og avl. Målet er å utvikle sorter som kan brukes til å produsere kostfiber med forbedrede prebiotiske egenskaper som kan styrke tarmhelse, samt andre stoffer med medisinske egenskaper som kan brukes til utvikling av nye legemidler. Prosjektet har fått 7.3 millioner euro (omtrent 86 millioner kroner) i støtte fra Horisont 2020.
7.2.5 Økt mangfold i produksjon, (re)-domestisering av ville arter
Av de over 300.000 planteartene som finnes i verden, er under 200 av dem viktige kommersielle matplanter. Brorparten av kaloriinntaket kommer fra bare tre arter – mais, ris og hvete. Det finnes en rekke spiselige plantearter som i liten grad benyttes, eller for eksempel bare har geografisk og kulturelt begrenset bruk. Genteknologi kan på sikt bidra til å supplere og utvide mangfoldet av arter i matproduksjon gjennom å korte ned tiden det tar å gjøre ville plantearter dyrkbare (domestisering), eller tilpasse lite brukte matplanter til mer industrialiserte produksjonssystemer. Genteknologi kan også styrke mangfoldet av sorter, blant annet ved å gjenintrodusere verdifulle egenskaper fra plantens ville opphav som har gått tapt i foredlingsprosessen (rewilding). Det siste kan også være mulig å oppnå gjennom konvensjonell innkryssing (introgresjon), men det vil ta lengre tid. Genteknologi har potensial til å forenkle avlsarbeidet i arter som ellers er vanskelige å avle på, og å omgå utfordringer med innavl når en ønsket genvariant/egenskap er sjelden.
Eksempel: Fra villtomat til spiselig tomat på en brøkdel av tiden
Tomaten er svært ulik sin ville forfar. Det som opprinnelig var et buskas med små sure bær har blitt til en lett dyrkbar plante med store, søte frukter. Dette er et resultat av århundrer med foredling. Forskere har vist at med genomredigering, og takket være omfattende kjennskap til tomatplantens genetikk og ulike egenskaper, kan man gjenta domestiseringsprosessen for en villtomat ved å tilpasse produksjonsegenskapene på bare noen måneder. I tillegg forbedret forskerne en rekke egenskaper som mer smak, økt sykdomsresistens og høyere nivå av C-vitamin og andre helsefremmende stoffer som tomater vanligvis har lave nivåer av (Zsögön et al. 2018) 20.
7.2.6 Begrensninger
En hovedutfordring for utvikling av planter med genomredigering og annen genteknologi, er tilgangen til sikker kunnskap om aktuell genetikk, og at mange av de aktuelle egenskapene er multigene. Det gjør det både vanskelig å endre eller tilføre egenskapene, og medfører økt risiko for pleiotrope effekter (se figur 4.3, kapittel 4).
Det er også vesentlige forskjeller knyttet til ulike plantegrupper og arter, og hva slags produktnisjer man tar sikte på å fylle.
Forhold knyttet til rettsbeskyttelse er også av særlig betydning. Disse og andre relevante utfordringer er bredere diskutert i kapittel 7.1.2.
7.3 Husdyr
7.3.1 Godkjenningsstatus internasjonalt for genmodifiserte dyr
Genmodifiserte dyr har vært mye brukt innen forskning, særlig medisinsk forskning, men i liten grad kommersielt i land- og havbruk og matproduksjon. I USA og Canada er ett genmodifisert dyr kommersielt tilgjengelig som mat. Det dreier seg om en laks som har fått tilført et gen som gjør at den vokser raskere (AquaBounty) (Waltz 2017). Denne laksen kultiveres i innendørs anlegg og fisken er steril etter triploidisering. Teknikken triploidisering regnes i Norge som konvensjonell teknologi. Godkjenningsprosessene fram til endelig markedstilgang for denne transgene laksen til bruk som mat, tok til sammen over 30 år. Den ble godkjent for bruk i USA og Canada i 2017, og både laksen og godkjenningsprosessene har vært debattert i media over lang tid over hele verden.
USA har også godkjent en gris som har fått satt inn en bit DNA for å ødelegge et sukkermolekyl som kan forårsake allergiske reaksjoner (GGTA1 knockout; GalSafe21). Grisen er godkjent til matproduksjon, men det primære målet med Galsafe-grisen er ikke å spise den, men å bruke den blant annet som organdonor for mennesker (Dolgin 2021; Fischer & Scnieke 2022). Denne grisen er heller ikke solgt som mat i USA. Produsenten indikerte at eventuelt salg som mat ville gå via direktesalg fra virksomheten, ikke gjennom supermarkeder. Det er begrenset offentlig informasjon om detaljene i de genetiske endringene, men disse inkluderer tilførsel av gener fra mennesker, noe som gjør grisene transgene.
Videre har USA godkjent tre transgene genmodifiserte dyr (kanin, kylling og geit) som bioreaktorer for framstilling av medisiner til behandling av humane pasienter (Intentional Genomic Alterations (IGAs) in Animals | FDA). I Argentina ble det tidlig på 2000-tallet utviklet flere typer transgene kuer som bioreaktorer for blant annet humant veksthormon (Salamone et al. 2006), men kuene hadde høy grad av genetisk mosaikk (Salamone et al. 2012). Disse kuene beitet utendørs, men har aldri blitt godkjent for kommersialisering. Det kan se ut som virksomheten har avsluttet dette prosjektet.
VKM beskriver i sin rapport om genomredigering (VKM 2021) at genredigering har flere potensielle anvendelser i husdyravl, eksempelvis tilpasninger til ulike produksjonsforhold, økt sykdomsresistens og økt dyrevelferd. Genredigering er et supplement til konvensjonelle avlsteknikker, men ikke en erstatning. Ingen av eksemplene over er basert på NGT, med et mulig delvis unntak for GalSafe-grisen da NGT sannsynligvis er brukt på denne i kombinasjon med eldre genteknologier. Dagens husdyravl karakteriseres i stor grad av bruk av genomisk (markørassistert) seleksjon av ønskede egenskaper i kombinasjon med reproduktive metoder for å øke forekomsten av en ønsket genotype i avlsmateriale. Slike reproduksjonsmetoder kan være for eksempel cryopreservering og kunstig inseminering. Ved avl av dyr er blant annet livssyklusens lengde, mulighet for å holde avlsdyr og genetisk variasjon begrensende. Under følger noen eksempler på aktuell bruk av genredigering i husdyr i Norge og andre land.
7.3.2 Produksjonsegenskaper
Eksempel: Genomredigering muliggjør bruk av eksisterende genvarianter i avl
SLICK-genet er et naturlig forekommende gen i visse kvegraser som lever i varme og fuktige områder. Dette genet gjør det mulig for dyrene å bedre regulere kroppstemperaturen og å takle varmestress fordi det gir kort pels. Forskere i USA har brukt genredigering for å få denne genvarianten over i en rase av storfe som ikke er godt tilpasset varme og fuktige klima (Sosa et al. 2021). Målet med prosjektet, som gjøres i regi av et kommersielt selskap (Acceligen22), er å utvikle flere kvegraser som bedre kan trives i varme og fuktige miljøer. Dette kan føre til mer effektiv produksjon av kjøtt- og meieriprodukter i varme områder på jorda. SLICK genomredigerte kuer er fortsatt i forskningsfasen, i likhet med andre prosjekter selskapet driver innen genomredigering av produksjonsdyr. De amerikanske myndighetene vurderte i 2022 at SLICK-storfe ikke behøver GMO-godkjenning fordi genetikken allerede er kjent i storfe og har lang historie med trygg bruk (HoSU) i matproduksjon fra før (Harrison 2022) 23. Det er usikkert når disse blir kommersialisert.
Lignende bruk av genomredigering kan være aktuelt i norsk husdyravl. Norsk Rødt Fe (NRF) er kjent for god dyrehelse og god fruktbarhet, i tillegg til gode produksjonsegenskaper for melk og kjøtt. Genos avlsmål per februar 202324 omfatter over 40 egenskaper, hvor flere er knyttet til enkeltgener. Blant avlsdyra finnes en rekke genvarianter som gir attraktive egenskaper. Dette er for eksempel kollethet (hornløshet) som gjør at dyra ikke må fysisk avhornes (Carlson et al. 2016), og to ulike melkeproteiner som er etterspurt av produsentene. Imidlertid finnes kombinasjonen av alle disse tre ønskede genvariantene i svært få dyr i avlsbestanden, noe som kan gi utfordringer med innavl hvis disse egenskapene skal avles spesifikt på. Dyra som har denne ønskede trioen av genvarianter, er heller ikke nødvendigvis de som har best verdier på andre avlsmål. Genomredigering kan omgå disse begrensningene fordi teknologien kan brukes til å øke frekvensen av og flytte ønskede genvarianter mellom individer/linjer og dermed gi samme resultat som ved konvensjonell kryssing, men raskere og mer presist og uten fare for innavl/reduksjon i genetisk variasjon. Dette kan være et aktuelt bruksområde i norsk husdyravl i fremtiden25.
Et annet eksempel belyser hvordan genteknologi kan, i likhet med andre avlsverktøy, brukes til formål som ikke bare er fordelaktige:
Eksempel: Økt muskelmasse – mer mat, men på bekostning av dyrevelferd?
Genomredigering og andre nye genteknologier kan, i likhet med alle andre avlsverktøy, brukes til formål som kan anses problematiske for dyrevelferden. Et eksempel er genomredigerte husdyr med mutasjoner i myostatin-genet som gir dobbel muskulatur. Slike mutasjoner er kjent fra konvensjonell avl, som i storferasen belgisk blå. Egenskapen gir økt kjøttproduksjon, men har negative konsekvenser for dyrevelferd (Kambadur 1997). Det er rapportert om at genomredigering har blitt brukt til å fremstille griser med slike myostatin-mutasjoner i Kina (Wang 2015). Imidlertid er velferdsaspektet ved slike myostatin-mutasjoner og andre vekstfremmende mutasjoner ulikt i ulike arter. Fisk lever i en nesten vektløs tilstand i vann og økt muskelmasse påvirker ikke velferden negativt på samme måte som for landlevende dyr. I Japan produseres og omsettes det nå en havkaruss med målrettet mutasjon i myostatin-genet (red sea bream), og japansk kulefisk (fugu) med en målrettet mutasjon i et annet vekstgen26. I Argentina er det også godkjent en tilapia fremstilt via genomredigering som resulterer i raskere vekst27. I både Japan og Argentina er dyr (og planter) fremstilt med genomredigeringsteknikker som danner lokasjonsspesifikke målrettede mutasjoner uten tilføring av transgent DNA, ikke klassifisert som GMO. I Japan må både havkarussen og den japanske kulefisken oppdrettes i kar på grunn av hensyn til biosikkerhet.
Genteknologi kan også gjøre det mulig å introdusere og endre produksjonsegenskaper utover det som finnes i eksisterende avlsmateriale og kan oppnås med tradisjonell avl. Et eksempel er et forskningsprosjekt der storfe-linjer har blitt genredigert slik at alle avkom er okser (hanner)28. Dette kan oppnås ved at spermen som brukes til befruktning tilføres et gen (SRY) som sender kjønnsutviklingen i retning av hann, selv om det inneholder et kvinnelig kjønnskromosom X. Motivasjonen for en slik endring kan være at okser gir mer kjøtt enn kuer. I den publiserte studien ble det rapportert at det var født én kalv som hadde denne egenskapen, og det er uklart om utviklingsarbeidet tas videre fra tidlige stadier.
7.3.3 Dyrehelse
Genetikk har stor betydning for dyrehelse, og god dyrehelse er et prioritert avlsmål for norsk husdyravl. Dette har blant annet bidratt til lavt forbruk av antibiotika og relativt god velferd i norsk landbruk og akvakultur.
I et genetikkperspektiv, påvirkes helsen til dyret av mange gener, som regel i samspill, men i noen tilfeller kan enkeltgener være avgjørende, særlig for dyrets mottakelighet for sykdomssmitte. For eksempel oppdaget forskere i 2007 naturlige genvarianter i atlanterhavslaks som ga motstandsdyktighet mot Infeksiøs Pankreasnekrose (IPN), en sykdom som i lang tid var en av de største utfordringene for norsk lakseoppdrett. Systematisk innkryssing av en tilsvarende genvariant i oppdrettslinjer av laks har ført til at forekomsten av sykdommen falt dramatisk. Imidlertid har man de siste årene oppdaget nye varianter av viruset som kan infisere laks til tross for at den har genvarianten som gir resistens (Godoy et al. 2022, Hillestad et al. 2021). At dette skjer er forventet siden det pågår et kontinuerlig kappløp mellom vertens (laksens) motstandsevne og virusets (IPN) infeksjonsevne. Forskere ved Roslin institute har nylig brukt genomredigering for å endre på et protein som er viktig for virusinfeksjonen (Pavelin et al. 2021), som teoretisk gjør at det er mulig å indusere bedre resistens mot IPN. Dette er imidlertid på tidlig utviklingsstadium og de første forsøkene er utført bare i cellekultur og ikke i levende fisk.
Sykdomsresistens er også aktuelt i landlevende husdyr. Ved hjelp av genomredigering, har forskere vist at griser kan gjøres resistente mot reproduktivt og respiratorisk syndrom (PRRS) (Mark Cigan & Knap 2022), en viral infeksjonssykdom som forårsaker ekstremt høy sykelighet og dødelighet i griseproduksjon globalt. Bare i Europa er det beregnet å representere et tap på mer enn 1,3 milliarder britiske pund per år (Holtkamp et al. 2013). Genomredigering har blitt brukt til å klippe bort en bit av et gen som koder for et overflatemolekyl på grisens celler, og dermed forhindres PRRS-viruset fra å komme inn i cellene siden det trenger dette molekylet som «inngangsport». De genomredigerte grisene er resistente mot sykdommen og følgende studier har ikke påvist negative effekter (Burkard et al. 2017, Whitworth et al. 2016). Det er også mulig å vaksinere mot PRRSV, men dagens vaksiner mot PRRSV har variabel effektivitet og beskytter derfor i mange fall ikke godt nok mot virussykdommen (Chae 2021). I Kina er svineproduksjonen spesielt viktig, og der har staten nå gått tungt inn med finansiering av forskning og lisensiering av CRISPR-genomredigering29 for å utvikle svin som er resistente mot PRRS samt Afrikansk svinepest. Denne sykdommen førte på et år til et økonomisk tap på 0,78 % av Kinas BNP, og sykdommen sprer seg raskt over hele verden (You et al. 2021).
Norsvin er et norsk avlsselskap som også eksporterer til det internasjonale genressursmarkedet. Norsvin oppgir ikke spesifikke avlsmål på sine nettsider, men omtaler i mer generelle vendinger at de inkluderer helse-, livskraft- og produksjonsegenskaper30. Norsvin leder forskningsprosjektet GENEinnovate som har som mål å etablere genomredigering som verktøy i norsk husdyravl og planteforedling, der sykdomsresistens er et hovedfokus.
Å kunne bruke genomredigering til å styrke fiskehelsen er et aktivt forskningsområde i Norge i både offentlig og privat sektor. Ved Havforskningsinstituttet undersøkes muligheten for å genredigere laks for å oppnå resistens mot to virussykdommer som forårsaker store problemer for oppdrettsnæringen; pankreassykdom (PD) og kardiomyopatisyndrom (CMS)31. For disse to sykdommene kjenner man noe av det genetiske grunnlaget for resistens (Boison et al. 2019; Hillestad et al. 2020), og denne kunnskapen ønsker man å bruke til å lage målrettede endringer i genomet for å styrke laksens resistens mot viruset.
Sykdomsresistens hos dyr kan også redusere faren for smitte fra dyr til mennesker (zoonotisk smitte). Et eksempel på en slik smitte er fugleinfluensa. Et selskap kalt EggXYt har lisensiert en teknologi fra Tropic Biosciences (GEiGS)32 og forsøker å bruke genomredigering til å «bygge inn» et immunforsvar mot virus i kylling33. Dette skal oppnås ved å omprogrammere cellenes iboende RNAi-kodende gener til å rettes mot virus-gener. Slik inaktiveres viruset når cellene blir smittet.
7.3.4 Forbedring av næringsinnhold
Næringsinnholdet i oppdrettslaks kan endres ved hjelp av genredigering. Et eksempel på et slikt mål er å øke innholdet av omega-3. Fordi laks nå i stor grad fôres med vegetabilsk fôr med mindre innhold av marine fettsyrer, inneholder også laksefileten lavere nivåer av det nyttige omega-3-fettet. For å kompensere for dette er det mulig å stimulere oppdrettslaksens egen evne til å produsere omega-3. Det er vist i levende laks under innesluttet bruk, at genredigering av omega-3 -synteseenzymer endrer innholdet av omega-3 i oppdrettslaks (Datsomor et al. 2019). Dette kan være én mulighet til å øke nivået av marine fettsyrer i laksen selv om den fôres med vegetabilsk fôr. Et alternativ er å benytte fôrråvarer som har en mer optimal fettsyresammensetning. Et dagsaktuelt eksempel er en søknad til Mattilsynet om godkjenning av rapsolje (Aquaterra®) fra raps som er genmodifisert for å gi økt innhold av flere langkjedete omega-3 fettsyrer. Tiltenkt bruk av oljen i Norge omfatter import og bruk kun i fiskefôr. Søknaden er under behandling av Mattilsynet våren 2023.
7.3.5 Redusert miljøbelastning fra husdyrproduksjon
Med økende befolkning på jorda blir den menneskelige påvirkningen på klima og natur stadig større, og matproduksjon er en vesentlig bidragsyter. Et eksempel er utslipp av klimagasser som metan fra husdyrproduksjonen. Lavere metanutslipp er derfor et aktuelt avlsmål innen storfeavlen i Norge34. Genteknologi kan potensielt bidra til å nå slike mål mer effektivt gjennom tilpasning av genetikken i drøvtyggerne selv, i fôret de spiser eller i mikroorganismene som produserer metanen i drøvtyggertarmen (Subedi et al. 2022).
I Norge er produksjon av oppdrettslaks en stor og viktig industri, og genteknologi, som en av flere løsninger, kan potensielt bidra til å redusere miljøbelastningen fra oppdrettsnæringen. To av de mest aktuelle problemområdene er rømming, som blant annet fører til genetisk forurensing av villaksen som i 2021 ble oppført på rødlisten over truede arter35, og lakselus, som har store dyrevelferdsmessige, miljømessige og økonomiske konsekvenser36.
Eksempel: Steril oppdrettslaks
Mesteparten av all lakseproduksjon i Norge foregår i åpne merder i sjø, og slik akvakultur er utsatt for rømningsfare. Ved rømming kan oppdrettslaks krysse seg med og påvirke den genetiske sammensetningen i villakspopulasjoner. Slik innkryssing anses som det mest negative, langsiktige miljøavtrykket fra merdoppdrett av atlantisk laks37. Dette aspektet har nylig fått enda større aktualitet siden villaksen er kommet på rødlista over truede arter i Norge. For å oppnå biologisk inneslutning av oppdrettslaks, kan bruk av steril fisk i kommersiell akvakulturvirksomhet være en strategi for å beskytte ville bestander av laks mot genetisk forurensing fra rømminger.
I dag er triploidisering den eneste tilgjengelige metoden for å sterilisere laks i kommersiell skala. Dette skjer ved at eggene trykkbehandles, noe som gjør at laksen får et ekstra sett av kromosomer. Imidlertid er slik triploid laks følsomme for suboptimale oppdrettsmiljøer, noe som gjør dem utsatt for skjelettdeformasjoner, og mindre tolerante for økende sjøvannstemperatur. Triploidisering anses derfor ikke som en bærekraftig løsning for produsentene (Madaro et al. 2022). En alternativ tilnærming for å oppnå sterilitet, er å bruke genomredigering til å skru av gener som er viktige for utvikling av kjønnsceller eller for at fisken skal bli kjønnsmoden. Denne typen genomredigert laks er utviklet ved Havforskningsinstituttet i Bergen (Wargelius et al. 2016; Andersson et al. 2022). Livsløpsanalyser fra innesluttede studier, viste at fisken hadde like god velferd som ikke-redigerte oppdrettslaks (komparator), og vesentlig bedre velferd enn laks som ble sterilisert ved triploidisering (Kleppe et al., 2022).
Forskningsgruppen jobber nå med å utvikle metoder for å kunne gjøre den genetiske steriliteten arvbar over flere generasjoner, og slik muliggjøre storskalaproduksjon av steril laks. Dette kan for eksempel oppnås ved at en genetisk steril stamfisk gjøres midlertidig fertil gjennom tilførsel av det manglende proteinet (TRL 4-5) (Güralp et al., 2020) eller ved å bruke «surrogatfisk» som kan produsere genetisk sterile kjønnsceller (Nagasawa et al. 2019) (TRL 1). Disse alternativene er fortsatt på forskningsstadiet, men det søkes nå om forsøksutsetting av den genetisk sterile laksen, etter at vekst- og velferdsparametere hos laksen har blitt studert i innendørs kar. Dette betyr imidlertid ikke at slik genetisk steril laks kan komme i bruk i Norge innen kort tid. Det er flere utfordringer som må løses når det gjelder teknologien, deriblant må man sikre at teknologien gir 100 % sterilitet i produksjonsfisk, og at det er god velferd også i sjø. For at produktet skal kunne kommersialiseres, er det også vesentlig at forbrukerne vil ha laksen. I tillegg kommer kostnaden som ligger ved utviklingen av slik genetisk steril fisk, som så langt er finansiert av Norges forskningsråd og andre statlige forskningsmidler. Havforskningsinstituttet ønsker at de beskrevne teknologiske løsningene skal kunne benyttes fritt, og har derfor valgt å la være å ta patent på den sterile laksen, se også kapittel 11 om immaterielle rettigheter.
7.3.6 Begrensninger
En hovedutfordring ved å bruke genomredigering og annen genteknologi til utvikling av dyr, er tilgangen til sikker kunnskap om aktuell genetikk, og at mange av dyras egenskaper er multigene. Det gjør det vanskelig både å endre eller tilføre egenskapene, og medfører økt risiko for pleiotrope effekter (se figur 4.3, kapittel 4).
Det er vesentlige forskjeller knyttet til ulike typer av dyr og de enkelte artene, for eksempel hva angår antall avkom og hvor lang reproduksjonssyklus de har. Begge deler påvirker hvor effektivt en egenskap kan tas i bruk, og ikke minst er det viktig hvilke miljøer dyra lever i med tilhørende spredningsmuligheter.
Andre relevante utfordringer er bredere diskutert i kapittel 7.1.2.
7.4 Mer avansert bruk av genteknologi i matproduksjon på sikt
Mange av eksemplene som er beskrevet hittil i dette kapitlet, er forholdsvis «enkle» anvendelser av genteknologi. Det dreier seg gjerne om målrettet endring av ett eller noen få eksisterende gener i planter og husdyr som er forholdsvis godt kjent. Det er slike produkter som forventes å bli søkt kommersialisert på kort sikt i løpet av de første fem til ti årene. På lengre sikt, etter hvert som metodene utvikler seg, er det rimelig å anta at bruken av genteknologi gradvis øker både i kompleksitet og diversitet.
Et eksempel på mer avansert bruk av genredigering er teknologien fra Afingen38, et amerikansk selskap, som gjør det mulig å lage systemiske endringer i uttrykk av gener som er viktige for vekst i planter. Ved hjelp av genomredigering endres såkalte transkripsjonsfaktorer, det vil si proteiner som styrer «volumknappen» på en rekke andre gener som gjerne virker sammen i ulike biokjemiske signalveier i planten. Endringene målrettes til spesifikke plantevev. Det nevnte selskapet har testet teknologien i flere ulike planter og skriver på sine sider at de i drivhusforsøk blant annet kan doble veksthastigheten og øke frøstørrelse og -antall i raps. Ifølge virksomheten, gav endringene i den flerårige urteplanten blålusern (alfalfa) i tillegg til vesentlig økt vekst, også et betydelig dypere rotsystem. Røtter er viktige for lagring av CO2 i jorda, og i dette tilfellet også for opptak av nitrogen fra lufta siden blålusern tilhører erteblomstfamilien som har et symbiotisk forhold med nitrogenfikserende bakterier på røttene sine. Afingen utvikler også en type gress (switchgrass) som brukes i fôr, der de på sine nettsider viser til både økt vekst og redusert innhold av lignin i utvalgte plantefibre, noe som skal gjøre plantestoffet lettere fordøyelig og nedbrytbart.
En aktuell bruk av cis- og intragener fremover vil være å hente tilbake egenskaper som har gått tapt gjennom lang tids avl og foredling. I en artikkel fra 2022 har forskere vist at moderne mais har lavere proteininnhold enn sin ville slektning (teosinte) blant annet fordi genet THP9 har mistet en bit og derfor ikke fungerer i mais (Huang et al. 2022). Genet finnes altså i moderne, kommersiell mais, men denne varianten gir lavere proteininnhold sammenlignet med teosinte. Ved å sette inn THP9 fra teosinte med genteknologi, økte både proteininnholdet og nitrogeneffektiviteten i maisen.
Også genetiske endringer som går utover artens genpool, vil kunne få stor betydning for global matproduksjon fremover, fordi det gjør det mulig å introdusere helt nye funksjoner. Transgene GMO-er er godt kjent fra før, hovedsakelig sprøytemiddel- og insektresistente varianter av de viktigste matplantene som mais, soya og raps. Men det finnes også eksempler på en helt annen type bruk av transgener, med potensial for å endre ernæringsmessig sammensetning. Det mest kjente eksemplet er Golden Rice – den gyldne risen – som etter nesten 30 år med utvikling, er i kommersiell produksjon på Filippinene. Risen har fått tilført gener fra bl.a. mais, som øker nivåene av betakaroten (provitamin A), som i tarmen konverteres til vitamin A. Golden Rice er omdiskutert, se nærmere omtale med referanser i kapittel 9. Forskere arbeider med å utvikle en lignende vitamin-A-beriket banan, beregnet på afrikanske land (Paul et al. 2017).
7.5 Mikroorganismer
Mikroorganismer er encellede organismer og inkluderer både prokaryoter (bakterier) og eukaryote celler (gjær, mikroalger og sopp). Alle disse har betydelige bruksområder innenfor bioteknologien. Industriell bioteknologi utvikler og anvender mikroorganismer som såkalte mikrobielle cellefabrikker (bioreaktorer) for bioproduksjon av en rekke kjemikalier, biomaterialer, enzymer, antibiotika, biofarmasøytika, samt komponenter for tilsetning i mat og fôr som for eksempel aminosyrer, vitaminer og fettsyrer (Heux et al. 2015, Kordi et al. 2022). Disse cellefabrikkene er spesialiserte mutanter som enten er utviklet ved klassisk mutagenese og seleksjon (ikke GMO), eller ved bruk av moderne rekombinant DNA-teknologi (GMO). Særlig bakterier og gjær er mye anvendt, og det finnes nesten ikke grenser for hvilke typer produkter disse organismene kan produsere basert på moderne genteknologi. Industriell bioteknologi foregår i all hovedsak ved innesluttet bruk hvor både dyrking og produksjon med disse cellefabrikkene utføres i såkalte fermentorer og med full destruering av cellene etter at produksjonsprosessen er ferdig. Det første og mest kjente eksemplet på bruk av GMO innenfor industriell bioteknologi, var rekombinant produksjon av det human-medisinske proteinet insulin. Bakterien Escherichia coli ble tilført mange kopier av det humane insulingenet og kunne dermed effektivt produsere insulin for behandling av diabetes hos mennesker. I dag produseres en rekke ulike biofarmasøytika, antistoffer og antibiotika for human medisinsk bruk av genmodifiserte mikroorganismer.
I sterkt økende grad er det innenfor industriell bioteknologi også fokus på råmaterialet (karbonkilden) disse cellefabrikkene dyrkes på. Dette er dels fordi råstoffet er den største produksjonskostnaden og dels ut fra et miljø- og bærekraftperspektiv. Industriell bioteknologi foregår ofte i svært store volum, og tradisjonell bruk av sukkerbaserte karbonkilder baserer seg på bruk av dyrket mark og er dermed i uheldig konkurranse med matproduksjon. I tillegg er markedet for industriell bioteknologi og bioprodukter økende og vokser i dag raskere enn markedet for både biomedisin og jordbruk (Kordi et al. 2022). I dag anvender forskere derfor genteknologi til å også utvikle mikrobielle cellefabrikker som kan vokse på alternative råmaterialer inkludert tilgjengelig overskuddsbiomasse fra trevirke (cellulose, hemicellulose), biomasse fra fisk, alger og havbruk, naturgass og metanol, samt sollys og CO2 (fotosyntese). En elegant løsning som kombinerer produksjon av biodrivstoff med anvendelse av hemicellulose som et bærekraftig og miljøvennlig råmateriale, er en såkalt konsolidert prosess. I en slik konsolidert prosess er en bakterie framstilt ved bruk av syntetisk biologi, tilført biosyntesegener for effektiv produksjon av biodrivstoff samt gener for rekombinant produksjon og sekresjon av cellulaser (se mere om disse nedenfor). Denne GMO-bakterien kan så vokse på hemicellulose fra avfallstrevirke ved at cellulasene den sekreterer, bryter ned denne biopolymeren til glukosekomponenter som naturlig fungerer som karbon- og energikilde for vekst, og dertil produksjon av biodrivstoff. Det er ventelig at det vil utvikles mange slike konsoliderte bioprosesser framover ved bruk av syntetisk biologi. En begrensning for industriell anvendelse av slike betydelige genmodifiserte mikroorganismer, er å beholde effektiviteten ved den nødvendige oppskaleringen til industrielle betingelser.
Det er i dag store forventinger til at kombinasjonen syntetisk biologi og systembiologi skal være slagkraftig for utvikling av nye og bedre mikrobielle cellefabrikker. Systembiologi brukes til design av genetiske endringer som skal innføres for å utvikle gode mutanter, mens syntetisk biologi omhandler avansert genteknologi for å utføre disse endringene som blir stadig mere avanserte. Bruk av trans-gener er svært utbredt innenfor mikroorganismer, mens det er relativt lite bruk av endringer innen en art av mikroorganismer. I 2010 utviklet amerikanske forskere en levende bakterie basert på et fullstendig kjemisk syntetisert genom bestående av ett kromosom (Gibson et al 2010). Denne teknologien åpner for å kunne skreddersy helt nye bakterier for anvendelser innenfor industriell bioteknologi. Senere er også hele gjærkromosomer blitt kjemisk syntetisert; disse er betydelig større enn bakteriene sine kromosomer og det sprenges stadig nye grenser innenfor denne teknologien. De nyeste genomredigeringsteknikkene (CRISPR/Cas) har ikke representert en tilsvarende revolusjon innenfor mikroorganismer som for høyere organismer (van der Oost & Patinios 2023), ganske enkelt fordi presise kromosomale mutasjoner, delesjoner eller addisjoner av gener har vært mulig med andre teknikker utviklet tidligere, som for eksempel homolog rekombinering (Clomburg et al. 2017). Genomredigering vil kunne spille en større rolle fremover, særlig innen optimalisering av egenskaper ved ulike enzymer og proteiner. Et eksempel er målrettede mutasjoner som øker temperatur- og pH-stabilitet i plastnedbrytende enzymer (Lu et al. 2022).
Mikroorganismer har, i tillegg til å være cellefabrikker for innesluttet bruk, mange andre mulige bioteknologiske anvendelser som vil innbefatte utsetting. Mikroorganismer inngår i dag som viktige komponenter i en rekke mat- og meieriprodukter, cellene kan i seg selv være viktige proteinkilder i fôr og mat, de kan anvendes innenfor husdyrhold og dyrehelse, til agronomiske formål i landbruket, samt innenfor produksjon og utvikling av vaksiner og legemidler. Det kan også tenkes anvendelser til deteksjon og nedbrytning av miljøgifter ute i naturen, såkalt bioremediering. Vi skal i det følgende se nærmere på disse anvendelsene som altså innebærer utsetting av mikroorganismene og hvor genteknologi tenkes benyttet.
7.5.1 Mikroorganismer i mat og fôr
Som beskrevet ovenfor så brukes mikroorganismer innenfor industriell bioteknologi og fermenteringsindustrien som cellefabrikker for bioproduksjon av ulike forbindelser med bredt nedslag av anvendelser, inkludert også i mat og fôr. I all hovedsak separeres da cellene fra selve produktet før anvendelse, og hele prosessen er innesluttet. Et viktig unntak er såkalte single cell protein (SCP) hvor man dyrker bestemte bakterier til høye celletall for så å bruke hele bakteriene (knust og pulverisert) som proteinkilde i dyr og fiskefôr (Ritala et al. 2017, Jones et al. 2020). Også mikroalger, gjær og sopp har vært forsøkt utnyttet for produksjon av SCP, selv om bakterier er å foretrekke da disse har høyest proteininnhold blant mikroorganismene. Også for produksjon av SCP, som er høy-volum produkter, har råmaterialet stor betydning både med hensyn til økonomi og miljø. Bakterien Methylococcus capsulatus kan bruke naturgass (metan) som karbon- og energikilde for vekst, og den har en gunstig proteinsammensetning for direkte anvendelse som SCP i fiskefôr. I utgangspunktet kan den naturlige bakterien anvendes, men bruk av genteknikker kan muliggjøre utvikling av mutanter med ytterligere optimalisert proteinsammensetning, for eksempel større andel essensielle aminosyrer, for slike formål. Genteknologi kan også tenkes anvendt for å kombinere optimalt proteininnhold med andre ernæringsmessig ønskelige egenskaper, inkludert rekombinant produksjon av vitaminer, antioksidanter og andre næringskomponenter. I dag foregår det forskning på anvendelse av ulike bakteriearter, mikroalger og sopp eller gjær for produksjon av SCP.
Eksempel: Marine mikroalger
Marine mikroalger har flere gunstige egenskaper som gjør dem interessante for direkte bruk som SCP i fiskefôr, og til produksjon av flerumettede fettsyrer for tilsetning til fiskefôr (Patil et al. 2005). Disse fotosyntetiske algene bruker CO2 og sollys som karbon- og energikilde for vekst, noe som selvsagt er både energi- og miljøgunstig. Selv om disse råmaterialene også er økonomisk gunstige, så krever produksjonen bruk av lys. Mikroalger dyrkes derfor i spesialiserte reaktorer som er kostbare og mindre volumeffektive sammenlignet med bruk av tradisjonelle fermentorer. Marine mikroalger er naturlig rike på fettsyrer som det er stort behov for i fiskefôr. I dag er det i vesentlig grad plantebasert fiskefôr som brukes i akvakultur, og fettsyrer typisk utvunnet fra nettopp fisk og havdyr, må derfor tilsettes fiskefôret. Koblingen bruk av sollys og fiksering av CO2 for bioproduksjon av gunstige fettsyrer, er naturligvis forlokkende ut fra et miljøperspektiv. Det pågår utstrakt forskning med bruk av moderne genteknologi til å både øke fettsyreproduksjonen i mikroalgene og å effektivisere fotosyntesen deres for bedre cellevekst. Genomredigeringsteknikker er godt utviklet for disse eukaryote mikroorganismene og denne teknologien har akselerert forskningen på mikroalger betydelig siste årene.
Historisk sett har mennesker utviklet og spist en rekke matprodukter der mikroorganismer er en naturlig og viktig komponent, særlig gjelder dette meieriprodukter hvor melkesyrebakterier (lactobacilli) inngår i prosessering og påvirker blant annet smak i yoghurt, ost og andre melkeprodukter. Mange mikroorganismer kan omdanne råmaterialer til fermenterte produkter, for eksempel produksjon av melkesyre. I dag brukes naturlige bakterier som har de nødvendige egenskapene for slike formål. Slike mikroorganismer som i generasjoner har vært en naturlig del av kostholdet, benevnes derfor gjerne «Generally Regarded As Safe» (GRAS). Basert på konvensjonell mutagenese er det i mange tilfeller selektert fram gode mutanter av GRAS-bakterier. Disse bakteriene er altså ikke GMO. Slike bakterier bidrar til å bevare (preservere) maten ved å hindre vekst av andre uønskede bakterier som bederver mat og kan forårsake sykdom. Bakterier som har en gunstig effekt på menneske- eller dyrehelse, omtales gjerne som probiotika (Lebeer et al. 2008). Et eksempel er en genmodifisert variant av bakterien Bacillus subtilis som siden 2019 har vært markedsført i USA, som et probiotikum som reduserer ettervirkninger av alkoholkonsum.
Også innenfor dette området er det åpenbart at bruk av genteknologi kan bidra til å videreutvikle og skreddersy bakterier. Et tenkt formål kan være å utvikle melkesyrebakterier som kan anvendes for å få fram nye og bedre meieriprodukter, samt å øke næringsverdien i eksisterende meieriprodukter. Dette kan eksempelvis være ved å øke vitamininnholdet i bakteriene eller andre nærings- eller helsefremmende komponenter, eller ved å innføre bestemte heterologe (trans-) gener. Mennesker har liten eller ingen evne til selv å syntetisere vitaminer og disse må derfor tilsettes i dietten vår. Både planter og dyr derimot, syntetiserer vitaminer naturlig. Bakterier anvendes allerede for industriell produksjon av flere ulike vitaminer, inkludert riboflavin (vitamin B2), askorbinsyre (vitamin C), cobalamin (vitamin B12) og biotin (vitamin B7). Ved bruk av syntetisk biologi vil man kunne utvikle skreddersydde melkesyrebakterier med kjemisk syntetiserte kromosomer som inneholder kun de gener man trenger fra bakteriens naturlige repertoar pluss tilført heterologe (trans-) gener for ytterligere å forbedre dem.
7.5.2 Mikroorganismer til agronomiske formål i landbruk
Eksempel: Nitrogenfikserende bakterier
For noen plante- og nyttevekster, primært i erteblomstfamilien, lever bakterier i jorda i en symbiose med plantenes røtter i et gjensidig avhengighetsforhold knyttet til nitrogenfiksering. Nitrogen er livsnødvendig for alle levende organismer, det være seg bakterier og planter, og nitrogen finnes i lufta vi alle omgir oss med i form av nitrogengass (N2). For at denne nitrogengassen skal kunne nyttiggjøres av planteceller må den først fikseres til ammoniakk (NH3) og denne egenskapen til å fiksere nitrogen fra atmosfæren er det kun noen spesialiserte bakterier som har utviklet. Tilbakebetalingen fra planten er andre næringsstoffer som bakterien på sin side trenger for å leve (= symbiose). Mange jordbruksvekster slik som hvete og mais, har ingen slik utviklet symbiose og derfor brukes mineralgjødsel til å besørge nitrogentilførselen. Mineralgjødsel har negative effekter på klima og miljø, og kan innebære store kostnader for bonden. Det foregår betydelig forskningsaktivitet på å utvikle spesialiserte nitrogenfikserende bakterier for både mais og hvete, noe som kan øke avlinger betydelig og samtidig redusere bruk av miljøbelastende mineralgjødsel. Forskning, blant annet i USA, har kommet særlig langt på dette området. Det er utført store feltforsøk med utsetting av både GMO- og genredigerte bakterier for slike formål, med svært lovende resultater (Geddes et al. 2015, Haskett et al. 2022). Selskapet Pivot Bio har tilbudt slike genomredigerte bakterier kommersielt siden 2019. Ifølge ulike nyhetsmeldinger har produktet fått stor anvendelse39.
Tilsvarende, ved bruk av genteknologi er det også utviklet mutanter av jordbakterien Klebsiella variicola som utfører nitrogenfiksering og effektivt lager gjødsel for maisplanter. Disse GMO-bakteriene hjelper dermed maisplantene til å vokse og gi høye avlinger, med betydelig redusert behov for tilførsel av mineralgjødsel. Denne Klebsiella-bakterien har naturlig gener som gjør den i stand til å fiksere atmosfærisk nitrogen via et enzym som kalles nitrogenase. Forskerne laget en Klebsiella-mutant som produserer store mengder av dette enzymet, og dermed besørger effektiv nitrogenfiksering og tilførsel av ammoniakk til maisplanten (Haskett et al. 2022). Denne bakterien er deregulert i USA.
Det er også utført forskning på bruk av genteknologi på ytterligere bakteriearter med samme overordnete mål å fremme mere robuste jordbruksavlinger. Den naturlige bakterien Pseudomonas syringae lever på mange planter og produserer et bestemt protein som fremmer frostskader hos planten. Ved bruk av genteknologi har man laget GMO-mutanter av denne bakterien, hvor genet for dette bestemte proteinet er tatt vekk. Tanken er så å spraye denne mutanten på plantene slik at den utkonkurrerer den naturlige bakterien og dermed kan hindre frostskader på planten.
7.5.3 Mikroorganismer til bruk i husdyrproduksjon
Bønder har i mange generasjoner brukt antibiotika for å forbedre produksjon av kylling, gris og storfe, noe som er problematisk sett opp mot den akselererende utviklingen av antibiotikaresistens. Derfor har landbruket gradvis beveget seg fra anti- til probiotika, det vil si anvendelse av levende mikroorganismer som har iboende egenskaper som gjør bruk av antibiotika mindre nødvendig eller overflødig. Probiotika anvendes for å øke produksjon av kylling, gris og kyr ved å påvirke (effektivisere) fordøyelsen i disse dyrene samt gjøre dem mer motstandsdyktige mot smittsomme sykdomsbakterier. En annen fordel med bruk av probiotika er at disse kan ha mange ønskede virkemåter og fordeler for husdyrproduksjonen som til sammen påvirker også dyrehelsen på en god måte (Lebeer et al. 2008). Også her ser man klare muligheter i å anvende genteknologi for å utvikle flere og bedre probiotika.
Gastrointestinale mikroorganismer lever i symbiose med dyr. I tarmen bidrar disse mikroorganismene med bedre fordøyelse av fôr, beskyttelse mot infeksjoner, samt at noen av mikrobene produserer viktige næringsstoffer som dyret trenger. Det pågår mye forskning for bedre å forstå de komplekse symbiotiske forholdene mellom gastrointestinale mikrober og dyrene de lever i. Målet er at denne kunnskapen skal anvendes til å forbedre både husdyrproduksjon og dyrehelsen, der genteknologi vil være en naturlig del av løsningen (Welch et al. 2022). Husdyr klassifiseres gjerne på basis av type fordøyelse, og gastrointestinale mikroorganismer kan ha ulike virkesteder i dyretarmen. I enkelte tilfeller produserer disse bakteriene spesialiserte enzymer som de skiller ut og som bidrar i nedbrytningen av fôret dyrene spiser. Mikroorganismer i andre områder av mage-tarmkanalen kan også bidra med å bryte ned fôr ved anaerobe prosesser som kalles fermentering.
Cellulose er det organiske materialet det finnes mest av i verden. Rent kjemisk er dette en biopolymer bestående av glukose (druesukker) bundet sammen til mekanisk og kjemisk sterke makromolekyler. Cellulose finnes i alt plantemateriale, og husdyr spiser dermed mye cellulose. For at dyrene skal kunne nyttiggjøre seg dette makromolekylet ernæringsmessig, må cellulosen brytes ned til nettopp glukose som cellen kan omsette. Pattedyr mangler enzymer som kan bryte ned cellulose (cellulaser), og derfor har de mikroorganismer i mage-tarmkanalen som produserer cellulaser og besørger nedbrytingen av cellulose. Den symbiotiske interaksjonen med slike gastrointestinale mikroorganismer gjør at dyrene effektivt kan nyttiggjøre seg næringsstoffene i maten de spiser (Newbold & Ramos-Morales 2020). Også her kan man se for seg at genteknologi kan anvendes for å utvikle spesialiserte mikrober som bedre besørger utnyttelse av cellulosen i dyretarmene.
Syntetisk biologi kan anvendes for å skreddersy komplekse genetiske endringer i mikroorganismer for å tilføre og utvikle bestemte nye egenskaper. Et interessant eksempel er hvordan forskere har utviklet en ikke-patogen E. coli bakterie som er utrustet med tre ulike heterologe syntetiske gen-moduler som gjør den i stand til å eliminere patogene bakterier; den ene gen-modulen gjør at den kan gjenkjenne og detektere patogene bakterier i omgivelsene, den andre gen-modulen produserer et giftstoff (toksin) mot den patogene bakterien, og den tredje gen-modulen besørger at bakterien sprenger seg selv og dermed frigjør dette toksinet (mekanisme kalt lysis). Resultatet er at begge bakteriene dør og dermed hindres den patogene bakterien i å infisere dyret. Metoden kan tenkes anvendt både innenfor dyre- og menneskehelse; for eksempel så har det vært utviklet syntetiske bakterier som spesifikt gjenkjenner og dreper Pseudomonas aeruginosa bakterier, som kan forårsake sykdom hos mennesker (Saeidi et al. 2011).
7.5.4 Mikroorganismer til deteksjon og nedbrytning av miljøgifter
Begrepet bioremediering dukket opp allerede på 1980-tallet, da man oppdaget potensialet hos enkelte mikroorganismer til å kunne både gjenkjenne, absorbere og bryte ned ulike organiske forbindelser inkludert miljøgifter i naturen. I dag er dette et betydelig forskningsfelt med stort potensiale og forventninger innenfor deteksjon og nedbrytning av miljøgifter, særlig i havet og i drikkevann (Perpetuo et al. 2011, Adams et al. 2014). Bioremediering omhandler å ta i bruk biologiske metoder hvor særlig mikroorganismer eller enzymer anvendes for opprydding av farlige kjemikalier og miljøgifter i naturen, ved metabolsk omdanning til ikke-giftige stoffer. Slike metoder med bruk av spesialiserte mikroorganismer, anvendes for å rense forurenset vann, til nedbrytning av råolje i strandsoner, samt degradering av mikroplast. OECD anser bioremediering som en både skånsom og kostnadseffektiv metode for å rense kjemiske forurensinger sammenlignet med konvensjonelle metoder for opprydding som for eksempel oppgraving og forbrenning av avfallsmasse, eller deponering i spesialavfallsdeponier (OECD 2015).
Bioremediering er blitt testet ut for å rense opp flere ulike miljøgifter, inkludert tungmetaller, hydrokarboner (diesel, bensin, parafin), klorinerte forbindelser, eksplosiver med mer. Anvendelsesområdene for bioremediering kan variere fra enkelt husholdningsnivå til store remedieringstiltak for både akutt forurensing og større opprensingsprosjekter. I litteraturen beskrives tre hovedformer for bioremediering; naturlig attenuering (svekkelse), biostimulering, og bioaugmentering, hvor den siste omhandler bruk av mikroorganismer (Adams et al. 2015).
I utgangspunktet kan naturlige mikroorganismer besørge bioremediering og samtidig har forskning vist at mere spesialiserte mikrober utviklet ved bruk av GMO, vil kunne være nødvendig for at dette skal fungere effektivt. For eksempel mikrobiell nedbrytning av olje i en strandsone påvirkes av mange ulike fysiske, kjemiske og biologiske parametere (Si-Zhong et al. 2009). Disse inkluderer temperatur, tilgang på næringsstoffer og oksygen, naturlige mikrobielle samfunn (mikrobiotaer) i omgivelsene, og ikke minst den kjemiske sammensetningen av oljen – alt dette vil kunne påvirke prosessen. Olje består av mange ulike kjemiske komponenter hvor noen er lett nedbrytbare for mikroorganismer, mens andre er tungt nedbrytbare. Oljens sammensetning vil derfor være viktig for det biologiske nedbrytingspotensialet. Med utgangspunkt særlig i naturlige bakterier foregår det i dag bred FoU-virksomhet for å forstå hvilke gener og enzymer som inngår i nedbrytingen av olje eller andre miljøgifter, for så å bruke genteknologi til å gjøre mikroorganismene enda mere effektive. I tillegg forsøker man å koble ulike gunstige egenskaper hentet fra flere arter av mikroorganismer for å konstruere en supermikrobe som både er tilpasset de aktuelle miljøbetingelsene der de skal virke (temperatur, oksygen, pH med mer) og som effektivt kan bryte ned ulike typer olje og miljøgifter. En slik supermikrobe kan volde skade utenfor det tiltenkte bruksområdet, og må derfor risikovurderes nøye før utsetting.
Mikroorganismer og enzymer kan også anvendes til å utvikle svært sensitive og spesifikke biosensorer for deteksjon av miljøgifter og anvendelser innenfor miljøovervåking, særlig i hav og vann (Mathur et al. 2023). Innenfor syntetisk biologi foregår det mye kreativ FOU på dette området. Prinsippet er alltid å kunne anvende biologiske reseptorer som binder spesifikke miljøgifter med stor spesifisitet, som så er koblet til et enzymatisk katalysert biologisk signal, typisk uttrykk av et fluorescerende protein som enkelt kan detekteres, og i noen tilfeller også kvantifiseres. Dette kan være genetisk modifiserte mikroorganismer eller cellefrie biologiske kretser og komponenter bestående av ulike enzymer. I dag kan man utvikle reseptorer og eller enzymer til presist og selektivt å gjenkjenne og binde nær sagt ethvert tenkelig kjemisk molekyl ved koblet bruk av bioinformatikk, maskinlæring, robotisering og syntetisk biologi.
En variant av bakterien Pseudomonas aeruginosa er genmodifisert for å benyttes i bioremediering av tungmetaller (Singh et al. 2013).
7.6 GMO-legemidler
Genmodifiserte mikroorganismer har en lang rekke medisinske anvendelser og anvendelsesmuligheter både for mennesker og dyr. I dag produseres mange farmasøytiske produkter ved bruk av genmodifiserte mikroorganismer som dyrkes i fermentorer. I dette tilfellet fungerer de genmodifiserte mikroorganismene som cellefabrikker til produksjon av legemidler, hvor legemiddelet skilles fra cellene før videre rensing og bruk, gjerne omtalt som presisjons-fermentering.
Genmodifiserte mikrooorganismer kan også i seg selv være et legemiddel. Legemidler som består av, eller inneholder, genmodifiserte organismer omtales som GMO-legemidler. GMO-legemidler er gjerne mikroorganismer, virus eller humane celler som har fått innsatt, endret eller fjernet genetisk materiale. GMO-legemidler til mennesker er i hovedsak knyttet til genterapi hvor målet er å korrigere feil i gener som følge av sjeldne genetiske sykdommer, modifiserte celler som brukes i kreftbehandling og genmodifiserte virusvaksiner. GMO-legemidler til dyr er hovedsakelig virusvaksiner. GMO-legemidler brukes både til forebygging og til behandling av sykdommer.
7.6.1 Eksempler på bruk av genmodifiserte mikroorganismer i legemidler
Bruk av levende genmodifiserte organismer i medisinsk behandling, er et felt i rask vekst. Det finnes ulike typer og organismer i GMO-legemidler til forskjellige formål. I det følgende gis det eksempler på noen av de vanligste bruksområdene.
Eksempel: Celleterapi i kreftbehandling
Immunterapi – der man stimulerer pasientens immunforsvar til å drepe kreftceller, har blitt en viktig del av kreftbehandlingen de senere år. Genetisk endrede immunceller, kalt celleterapi, er en ny gren innen immunterapi. De første celleterapiene, kalt CAR-T (chimeric antigen reseptor; «kimær antigen-reseptor»; CAR), har basert seg på at det settes inn et nytt konstruert gen i en type immunceller som kalles T-celler, slik at de gjenkjenner spesifikke molekyler som sitter på kreftcellenes overflate. Siden behandlingen er brukt i flere år nå, er det mulig å vurdere langtidseffekten. Ved oppfølging drøyt 10 år etter start av behandlingene, ser man pasienter som fortsatt er kreftfrie. Forskerne ser ved oppfølging av pasientene at CAR-T cellene har delt seg og at cellene fortsatt er i kroppen, hvilket innebærer at pasientene fortsatt er beskyttet mot tilbakefall. Slik behandling har vist svært god effekt for pasienter med alvorlig blod- og lymfekreft; to tredjedeler av barn med ellers uhelbredelig akutt lymfatisk leukemi blir kreftfrie med denne behandlingen. Det samme gjør drøyt 40 prosent av voksne med diffust storcellet B-celle lymfom som ikke har effekt av annen behandling.
Eksempel: Skreddersydd kreftbehandling med genomredigering
Det utvikles også en rekke andre typer celleterapier basert på både etablerte metoder for genmodifisering og nye genomredigeringsteknikker, som gjør det mulig å justere på immuncellenes eksisterende gener. For eksempel har forskere i England prøvd ut en celleterapi der CRISPR har blitt brukt til å justere på gener i immunceller fra donorer, slik at de kan brukes til behandling av pasienter som selv ikke har tilstrekkelig av egne immunceller til å bli behandlet med vanlig celleterapi.
En 13 år gammel jente fra England fikk i 2022 diagnosen akutt T-celle lymfoblastisk leukemi. T-celler finnes i blodet og er en del av kroppens immunforsvar. Men jentas sykdom gjorde at disse cellene vokste og formerte seg for raskt, noe som skader kroppen. Hvis det ikke var for den eksperimentelle behandlingen, ville hun mistet livet.
Den eksperimentelle medisinen ble laget ved hjelp av en metode beskrevet første gang i 2016. I stedet for å kutte DNA-et, skifter forskerne ut en base med en annen. Med utgangspunkt i sunne T-celler som kom fra en frisk donor, startet legene med å modifisere disse cellene ved hjelp av ‘base-redigering’:
Den første modifiseringen deaktiverte T-cellenes målretningsmekanisme slik at de ikke skulle angripe jentas kropp.
Den andre modifiseringen fjernet en kjemisk merking, CD7, som finnes på alle T-celler.
Den tredje modifiseringen gjorde at cellene ikke ble drept av cellegift.
I den fjerde og siste fasen modifiserte legene T-cellene til å gå på jakt etter hva som helst med CD7-merket. Det ville ødelegge alle T-celler i kroppen hennes, også dem som var rammet av kreft.
Etter en måned fikk jenta en beinmargstransplantasjon for å gjenoppbygge immunsystemet. Etter seks måneder var det ingen tegn til at kreften har vendt tilbake. Legene vil imidlertid fortsette å teste henne.
I 2021 var det over 2000 celleterapier under utvikling, og dette representerer det mest aktive forskningsområdet innen immunonkologi (Yu et al. 2019).
Eksempel: Genterapi for sjeldne sykdommer
Å kunne reparere eller kompensere for en sykdomsgivende genfeil med genterapi gir store muligheter for en rekke pasientgrupper som til nå ikke har hatt noen utsikter til behandling. Særlig gjelder dette alvorlige arvelige genetiske sykdommer. Individuelt sett er slike tilstander sjeldne, men til sammen omfatter gruppen tusenvis av diagnoser og pasienter globalt.
Genterapi innebærer å endre genene i pasientens kroppsceller for å behandle sykdom. Endringene påvirker ikke kjønnscellene og går derfor ikke i arv. Som oftest blir et «friskt» gen, som skal kompensere for et uvirksomt gen, levert inn i pasientens celler ved hjelp av en såkalt virusvektor (et ufarliggjort virus). En håndfull genterapier er godkjent for markedet i Europa. En av dem er Zolgensma-genterapi for den alvorlige muskelsykdommen Spinal Muskelatrofi (SMA), der en funksjonell kopi av genet SMN-1 settes inn slik at cellene kan produsere det manglende proteinet. Genet føres inn i de cellene det trengs ved hjelp av et modifisert virus som ikke forårsaker sykdom hos mennesker.
Uten behandling mister barna gradvis muskelfunksjonene og dør vanligvis før de fyller to år. Av barna som var med i de første kliniske studiene, og som nå er fulgt opp over flere år, lever samtlige og de fleste har oppnådd viktige milepæler som å kunne sitte eller stå på egenhånd (Mendell et al. 2021).
En annen genterapi som er godkjent for markedet i Europa, er Luxturna til behandling av retinal dystrofi, en tilstand som fører til gradvis synstap og blindhet på grunn av mutasjoner i RPE65-genet. Luxturna er et modifisert virus som inneholder en funksjonell kopi av RPE65-genet. Etter injeksjon leverer viruset genet til netthinnen, det tynne laget med vev bakerst i øyet som fanger opp lys. Dette gjør at netthinnen kan produsere proteiner som er nødvendige for synet. Viruset som brukes til å levere genet gir ikke sykdom hos mennesker. Ved å erstatte en ødelagt versjon av genet RPE65 i cellene under netthinnen i øyet, har det blitt vist i en fase III studie at det funksjonelle synet forbedres.
Kliniske studier viser at forbedringen er vist å vare i minst 4 år i menneske, men noen studier antyder at effekten kan vare opp til 7,5 år (Leroy et al. 202340).
Både Zolgensma og Luxturna tilbys i den offentlige norske helsetjenesten, og andre er til vurdering for slik offentlig refusjon når denne NOUen skrives.
I tillegg til «klassisk» genoverføring, slik de første genterapiene har vært basert på, vil det komme nye behandlinger basert på nye genomredigeringsteknikker som CRISPR.
Eksempel: Vaksiner
Et annet viktig innovasjonsområde innen GMO-legemidler er vaksiner. Slike har vært i bruk siden 1970-tallet, men fikk særlig aktualitet under covid-pandemien. Flere av covid-vaksinene var basert på samme teknologi som genterapi – en liten bit med DNA som er pakket inn i en virusvektor og leveres av sistnevnte41. Biten med DNA inneholder oppskriften for ett av proteinene fra covid-viruset, som blir oversatt og produsert av kroppens egne celler. Dette fører til immunitet mot covid.
Forebyggende vaksiner som benytter virusvektorer, er også utviklet mot andre virussykdommer, inkludert mot zika-virus, ebola-virus, influensavirus og hepatitt B. Blant annet ble slike benyttet under utbrudd av ebola i Afrika i årene 2013-2020.
En lignende teknologi er mRNA-baserte vaksiner som i prinsippet har samme effekt, men ikke formelt klassifiseres som GMO-legemidler fordi de ikke baserer seg på bruk av virusvektor som leveringsmekanisme.
Genteknologi har også andre mulige anvendelsesområder innen vaksineproduksjon. Blant annet kan dette være spiselige vaksiner. Planter er potensielle kilder for produksjon av monoklonale antistoffer, vaksiner, legemidler og immunomodulerende proteiner. Vitenskapen belyser at planter er en rik kilde til orale vaksiner, som kan gis enten ved å spise de spiselige delene av planter og/eller de raffinerte proteinene fra planten.
For å tilberede den spiselige vaksinen, blir planten genmodifisert for å uttrykke antigener i den spiselige delen; når den spiselige delen er konsumert, induserer den en immunrespons (Van Buren & Schaffner 1991). Spiselige vaksiner for hepatitt, diaré, rabies, kolera og cystisk fibrose er under kliniske studier (Qian et al., 2008, Tacket et al., 1998, Tacket et al., 2000).
Det har blitt gjort en del studier på plantebaserte spiselige vaksiner uten at det foreløpig har materialisert seg som et godkjent behandlingsalternativ (Khalid et al. 2022).
7.6.2 Et voksende innovasjonsfelt i Norge
De første GMO-legemidlene som har blitt tilgjengelig i Norge, har vært produkter utviklet internasjonalt. Nå pågår en bred satsing på utvikling av nye avanserte terapier også i Norge: I 2021 ble det etablert et nasjonalt Senter for Avansert Celleterapi (ACT-senteret) ved Oslo Universitetssykehus – en klinisk utprøvingsenhet for kliniske studier med gen- og celleterapi42. Dette omfatter infrastruktur for egen produksjon av genmodifiserte celler ved hjelp av virus. I 2022 ble det tildelt rundt 100 millioner kroner fordelt på fire akademiske kliniske fase-I-studier med slike avanserte terapier fra Nasjonalt program for klinisk behandlingsforskning i spesialisthelsetjenesten43. Dette omfatter studier innen celleterapi for alvorlig kreft, samt CRISPR-basert behandling av alvorlig immunsvikt. I tillegg ble det høsten 2022 gitt en stor tildeling til et nytt Senter for Fremragende Forskning (SFF, program under Forskningsrådet) på presisjonsimmunterapi – PRIMA – der man skal akselerere den pre-kliniske utviklingen av avanserte terapier44. De mest lovende innovasjonene skal deretter prøves ut i ACT-senteret.
Innovasjon og produksjon av vaksiner har også blitt pekt på som et mulig satsingsområde i Norge og Norden. Blant annet publiserte regjeringen, ved Nærings- og fiskeridepartementet, i 2022, en mulighetsstudie om nordisk samarbeid som pekte på ulike aktuelle vaksineteknologiplattformer, inkludert GMO-vaksiner45.
7.6.3 Sykdomsbehandling via mikrobiotaen
Probiotika som er beskrevet i kapittel 7.5.1 og 7.5.3 om mikroorganismer i henholdsvis mat, fôr og husdyrproduksjon, kan også ha anvendelser innenfor GMO-legemidler. Probiotika kan brukes for å opprettholde balansen i de mikrobielle samfunnene (mikrobiotaer) i tarmsystemet hos både mennesker og dyr, for å redusere mulighetene for infeksjoner og andre tarmsykdommer (Lebeer et al. 2008). Effekten av å anvende probiotika til behandling av fedme er nært knyttet til mikrobenes påvirkning av gallemetabolismen og reduksjon i fettmetabolismen hos mennesker. Probiotika har også vist gode resultater på behandling av diabetes og flere ulike kreftformer i rotter. Studier har vist sammenhenger mellom mikrobiota i tarmene og hjernen vår, og i dag utforskes probiotika i behandling av alt fra infeksjonssykdommer til mentale lidelser. Dette omtales også som bioterapeutika og er blitt en integrert del av moderne medisin.
Stoffskiftesykdommer skyldes som regel medfødte genfeil som hindrer produksjon av enzymer som er viktige for å bryte ned næringsstoffer i tarmen. Ved hjelp av genmodifisering kan en «frisk» versjon av genet settes inn i bakterier som kan produsere enzymet som mangler i tarmen46. Slike GMO-bakterier prøves ut i kliniske studier for blant annet Føllings sykdom (Fenylketonuri) (Durrer et al. 2017).
Nye genteknologier som CRISPR har også stort potensial i behandling av sykdommer som stammer fra mikrobiotaen. For eksempel utvikler det danske selskapet SNIPR Biome CRISPR til målrettet eliminasjon av spesifikke stammer av bakterier. CRISPR pakkes inn i virusvektorer kalt bakteriofager som infiserer spesifikke bakterier. Deretter «klipper» CRISPR i stykker bakterienes gener. Målet er blant annet å erstatte bruk av antibiotika som ikke bare dreper sykdomsfremkallende mikrober, men også friske bakterier i kroppen og driver utvikling av antibiotikaresistens. Deres første behandling, en CRISPR-basert terapi mot E.coli-infeksjon, er i skrivende stund til utprøving i en klinisk utprøving i USA (Gencay et al. 2023). Selskapet har også inngått et samarbeid med USAs største kreftbehandlingssenter MD Anderson om å utvikle CRISPR-behandling av tarmmikrobiotaen for å øke effekten og redusere bivirkninger av immunterapi mot kreft47. SNIPR Biome gir bred tilgang til teknologien sin gjennom et non-profit lisensieringsprogram48.
7.6.4 Teknologiske begrensninger og perspektiver
Genteknologi ble først utviklet på prokaryoter (bakterier) og i dag er det få teknologiske begrensninger med hensyn til hva som er mulig å få til i bakterier. Etter hvert vil det samme gjelde for eukaryote mikroorganismer som gjær/sopp og mikroalger. Innesluttet bruk av mikroorganismer innenfor fermentering er i dag en velutviklet og betydelig industri på verdensbasis. Med unntak av særlig produksjon av proteiner og enzymer, som i all hovedsak innbefatter bruk av genteknologi og GMO, er det helt fram til i dag, i betydelig grad brukt mutanter utviklet ved bruk av konvensjonell mutagenese og seleksjon, det vil si at de ikke er definert som GMO.
Årsaken til dette er til dels at disse metodene fortsatt er de mest effektive, og dels at de regulatoriske aspektene knyttet til bruk av GMO, ennå favoriserer konvensjonelle mutanter. Særlig med syntetisk biologi er imidlertid utviklingen innenfor bruk av genteknologi sterkt økende og forventes å kunne utkonkurrere de klassiske metodene for å lage gode stammer for industriell bioteknologi. Dessuten er mulighetsrommet for anvendelser, det vil si både å kunne fremstille nye produkter og muliggjøre utnyttelse av bærekraftige råmaterialer (biomasse, avfall, trevirke, med mer), betydelig større ved bruk av genteknologi. Innenfor innesluttet bruk er mulighetene store og de teknologiske begrensningene små, samtidig som de regulatoriske begrensningene ennå er betydelige når GMO-produkter har anvendelser innenfor mat og fôr, legemidler og utsetting i miljøet for eksempel for bioremediering.
Når det gjelder bruk av genmodifiserte mikroorganismer til utsetting, er erfaringene med dette ennå begrenset, samtidig som at mulighetene og perspektivene er store. Syntetisk biologi har gjort store framskritt på utvikling av biosensorer som har både svært høy spesifisitet og sensitivitet, med store brukspotensial innenfor bioremediering både i ferskvann og saltvann. Også innenfor direkte anvendelser i mat og fôr kan genmodifiserte mikroorganismer bidra med bærekraftig produksjon av fettsyrer, vitaminer, og andre næringskomponenter, og være verdifulle proteinkilder. Her er teknologien moden for feltforsøk og mulige anvendelser.
Risikoen for spredning ved utsetting av mikroorganismer, er naturlig høy da disse har svært kort generasjonstid og stor spredningsevne både via luft og vann. Bruk av antibiotikaresistensgener i mikrobielle GMO-er er ikke nødvendig i dag og bør dermed ikke være en tilleggsrisiko. Det foregår mye forskning knyttet til å utvikle bakterier som ikke kan overleve i naturen utenfor de spesifikke felter og arealer de er beregnet for. I bakterien E. coli ble i alt 22 ulike essensielle gener re-kodet til å inkludere kodon for en syntetisk aminosyre som ikke finnes i naturen. Ideen er å gi denne GMO-bakterien tilgang til den syntetiske aminosyren i felt og arealer der den settes ut for å gjøre sin tiltenkte funksjon. En eventuell spredning forventes ikke å utgjøre noen risiko siden bakterien ikke kan overleve i naturen (Rovner et al. 2015).
Det er i sum forventet at det fortsatt vil foregå en omfattende utvikling innenfor genmodifisering av mikroorganismer. Dette innbefatter bruk av syntetisk biologi inkludert utstrakt bruk av heterologe (trans-) gener og kromosom-syntese for anvendelser knyttet til utsetting, innenfor jordbruk og husdyrhold, mat, fôr, og til bioremediering. Fortsatt er det mye forskning for å gjøre disse mikroorganismene effektive, robuste og spredningssikre til slik bruk, men utviklingen skjer raskt. Både regulering og lover, samt vanlige folks aksept eller skepsis til genteknologiske produkter og anvendelser, vil være avgjørende for hvor mye av dette som faktisk vil komme til anvendelse.
Videre forventes det at den teknologiske utviklingen i hovedsak knyttes til etablerte genteknologier og økt bruk og sammenstilling av transgener og novogener. Muligheter for å foreta enkle og målrettede genomredigeringer i mikroorganismer har vært til stede lenge før utviklingen av nye genteknologier for eksempel ved transformasjon og homolog rekombinering. De nye genteknologiene representerer derfor ikke det samme nye potensialet for genetisk endring av mikroorganismer som for planter og dyr.
7.7 Syntetisk biologi – novogener og invagener
Begrepet syntetisk biologi brukes på mange ulike måter, både i faglitteratur og det offentlige ordskiftet. I denne utredningen defineres syntetisk biologi som en tverrfaglig disiplin som kombinerer prinsipper fra biologi og ingeniørfag for å bygge nye biologiske systemer og komponenter. Novogenese og invagenese er eksempler på bruk av syntetisk biologi. Syntetisk biologi omfatter imidlertid også endringer i andre systemer, cellestrukturer og molekyler enn nukleinsyrer.
7.7.1 Novogener
Novogenese er et begrep som introduseres i denne utredningen. Det defineres som framstilling av en genetisk sekvens ved hjelp av in silico design, det vil si at sekvensen (novogenet) ikke har en homolog sekvens i en naturlig utviklet celle. Et novogen kan omfatte både et lite element, for eksempel en designet promoter, men også et stort kromosom eller genom kan være et novogen. En novogen organisme er en organisme hvor hele eller deler av et gen eller genom er framstilt ved novogenese.
Et av de tidligste eksemplene på novogenese er optimalisering av et bakterielt gen som skulle overføres til mais gjennom transgenese. Genet, cry1Ab, koder for et toksin som dreper visse skadeinsekter (bt-toksin). Gensekvensen i bakterien har relativt høyt innhold av A-T basepar sammenlignet med den mer optimaliserte sekvensen i ulike transgene maistyper som har høyere innhold av C-G basepar. Fordi den genetiske koden med sine totalt 64 kodons (se kapittel 4) i mange tilfeller kan gi samme aminosyre med forskjellige kodons, og fordi mais har en større andel tRNA molekyler (se kapittel 4) som har C eller G enn som har A eller T i «valgfrie» posisjoner, ble gensekvensen justert gjennom novogenese før den ble satt inn i maisen. Disse endringene kunne gjøres uten at man endret selve proteinsekvensen (Holst-Jensen et al. 2012).
Figur 7.5 Sammenligning av fire ulike Cry1Ab varianter.
Figuren viser de første 240 basene i Cry1Ab-sekvensen. Bt Cry1Ab = sekvensen som naturlig finnes i bakterien Bacillus thuringiensis. Bt11 = sekvensen som finnes i GMO mais Bt11, Bt176 = sekvensen som finnes i GMO mais Bt176. Mon810 = sekvensen som finnes i GMO mais Mon810. Translation = oversettelse (100% konsensus) av de alternative DNA-sekvensene til aminosyrer. Variantene som finnes i de tre GMO-maisene er alle framstilt ved novogenese, primært som tilpasning til at mais har en annen foretrukket kodonbruk for samme aminosyre enn det bakterien Bacillus thuringiensis har.
Et nyere og mer kjent eksempel på novogenese er bakterien som fikk navnet Synthia (Gibson et al. 2010). Dette var en bakterie som fikk hele sitt genom (ett kromosom) kjemisk syntetisert og satt inn i en bakteriecelle som på forhånd hadde fått fjernet hele sitt opprinnelige genom. Synthias genom var en sterkt redusert versjon av et bakteriegenom, designet slik at alle gener for livsnødvendige funksjoner skulle være bevart, og i tillegg var det satt inn noen få markørgener som skulle gjøre det enkelt å se og vise at bakterier som ble dyrket fram var basert på denne novogenesen.
En svært aktuell anvendelse av novogenese er for utprøving av målrettede endringer i enkeltgener. Gjennom in silico design og med SDN-2 teknikker kan man parallelt prøve ut flere av de antatt mest aktuelle genvariantene i tidlige forsøksstadier, som ledd i en mer effektiv produktutvikling.
7.7.2 Invagener
Invagene mekanismer er kjent fra naturen, og omfatter blant annet såkalte egoistiske genelementer («selfish genes»), som arves til tross for at de ofte ikke gir noen fordeler til verten. Transposoner som «hopper» rundt i genomet og settes inn tilfeldige steder, homing endonukleasegener som kopierer seg selv i målrettede steder i genomet, og Wolbachia-bakterie symbiose som forfordeler avkom fra infiserte hunnmygg, er noen eksempler på mekanismer for styrt nedarving (Sinkins & Gould 2006). Flere eksempler finnes blant annet i EFSAs vurdering fra 2020 (EFSA 2020b).
Forskere har brukt kunnskapen fra disse mekanismene for styrt nedarving til å lage syntetiske invagener, men det var ikke før oppdagelsen av CRISPR-Cas9 teknologien at syntetiske invagener ble en reell mulighet i alle organismer.
7.7.3 Syntetiske invagener og gendriverprinsippet
Gendriverorganismer er genmodifiserte organismer som har fått innsatt et syntetisk genkonstrukt, for at et målgen skal kunne nedarves og spres gjennom en populasjon raskere enn ved vanlig nedarving. Formålet for fremstilling av gendriverorganismer er ofte å erstatte et villtypeallel med et allel med ønsket funksjonalitet, og slik påvirke populasjonen i en eller annen retning. Metoden kalles ofte for «cheating Mendel»-metoden, ettersom den omgår vanlige nedarvingsregler (Champer et al. 2016). Potensielle bruksområder for gendriverorganismer er blant annet utrydding av sykdomsbærende insekter, fjerning av skadelige fremmede arter, vern av truede arter, og re-sensitivering av planter til plantevernmidler.
7.7.4 Fremstilling av syntetiske gendrivere
Det er flere teknikker som har vært utprøvd for å lage syntetiske gendrivere, men metoden med bruk av CRISPR-Cas enzymet er det som har revolusjonert området og tatt dette et steg videre til realisering. CRISPR-Cas kutter DNA-et i spesifikke DNA-sekvenser, se kapittel 4.3.1 om genredigering. Ved å sette genet som koder for CRISPR-Cas inn i en organisme, sammen med DNA-sekvensen til målgenet som man vil endre i organismen (koder for gRNA, se kapittel 4), klippes målgenet og ønsket mutasjon introduseres i målgenet. Ved seksuell reproduksjon vil det oppstå en kjedereaksjon hvor CRISPR/Cas-komplekset arves til samtlige individer i påfølgende generasjoner, og det dermed introduserer samme mutasjon i målgenet. Slik kan en ønsket genvariant tvinges gjennom en hel populasjon. Det står mer om gendrivere i kapittel 4.5.
Man kan klassifisere gendrivere etter effekten de er ment å utøve i populasjonen de introduseres i:
Elimineringsdrivere ved blant annet innføring av sterilitet eller kjønnsutvelgelse (kun hanner/hunner) kan utrydde en populasjon (for eksempel sykdomsbærende malariamygg eller rotter/mus, eller invasive, skadelige fremmede organismer)
Sensitiveringsdrivere hvor formålet er å introdusere sensitivitet til en egenskap (for eksempel re-introduksjon av herbicid-sensitivitet i planter, antibiotika-sensitivitet i bakterier med mer)
Immuniseringsdrivere for introduksjon av beskyttende gener (for eksempel resistens mot sykdommer i truede arter)
Reverseringsdrivere hvor formålet er å reversere effekten av en opprinnelig gendriver
7.7.5 Noen eksempler på muligheter ved bruk av syntetiske gendrivere
Eksempel: Bekjempelse av insektsbårne sykdommer
Området hvor man har kommet lengst med forskning på både naturlige invagener og syntetiske gendrivere, er i malariamygg (Anopheles gambiae). Malariamyggen er bærer av parasitten Plasmodium som forårsaker malaria hos mennesker etter at de har blitt stukket av infisert mygg. Det finnes en godkjent malariavaksine, men det forskes mye på alternative bekjempingsmetoder. Det er hunnmyggen som stikker mennesker, så fokuset har ofte vært å undertrykke hunnpopulasjonen (kjønnsseleksjon for hannmygg), eller sterilitet for undertrykking eller eliminasjon av hele myggpopulasjonen. Laboratorieforsøk har vist at slike gendriverstrategier kan være effektive for å eliminere populasjonen. Nye strategier er også under utvikling. For eksempel viser en nylig publikasjon i tidsskriftet Nature at modifisering av myggen slik at de produserer to nye antimikrobielle peptider i tarmen, effektivt kan stoppe utviklingen av to ulike malariaparasitter. På den måte brytes overføringen av parasitten innad i en populasjon og videre overføring til mennesker og dyr (Hoermann et al. 2022). Genmodifisering og/eller invagener i sykdomsbærende mygg kan altså ha andre alternativer i fremtiden enn utsletting av hele populasjoner. Firmaet Oxitec har i samarbeid med nasjonale myndigheter, laget hannsterile GMO-mygg som er blitt satt ut for å spre hannsterilitet i myggpopulasjoner i ulike deler av verden (www.oxitec.com). Oxitec benytter imidlertid ikke en gendriverteknologi/invagen teknologi.
Det forskes også på bruk av gendriver- eller invagenteknologi i andre sykdomsbærende myggarter, som Aedes aegypti, som er bærer av blant annet denguefeber og zikavirus. Teknologien har her ikke kommet like langt.
Eksempel: Bekjempelse av insekter som opptrer som skadegjørere i landbruket
Drosophila suzukii er en fruktflue som stammer fra Sørøst-Asia. I de siste tiårene har den blitt spredd til europeiske og amerikanske områder hvor det produseres mye frukt. Fruktfluen er svært tilpasningsdyktig, og kan spres, overleve og etablere seg i et mangfold av miljøer. Insektet er årsak til økonomiske tap både gjennom tap av avling, kortere holdbarhet for infisert frukt og økte produksjonskostnader. Insekticider (biocider) er det som har vært brukt for å holde skadegjøreren i sjakk, men insektet utvikler ofte resistens mot slike midler etter en tid. Integrert plantevern (IPV) er foreslått som metode for å kontrollere denne skadegjøreren i jordbruket. Metoden innebærer overveielse og bruk av alle tilgjengelige teknikker og metoder som lar seg forene for å forhindre skadegjørere fra å utvikle seg, og som holder bruken av plantevernmidler og andre former for inngrep på et økonomisk og økologisk forsvarlig nivå, samtidig som risikoen for menneskers helse og for miljøet reduseres eller minimaliseres, jamfør forskrift om plantevernmidler, § 2 Definisjoner. En slik metode er basert på biologien og økologien til insektet, sammen med produksjonsmetoder (Tait et al. 2021). Bruk av syntetiske gendrivere i Drosophila suzukii er en metode som potensielt kan fungere for å undertrykke eller eliminere en hel populasjon i et område (Buchman et al. 2018).
Eksempel: Bekjemping av invasive og skadelige fremmede arter for å gjenopprette opprinnelige økosystemer – gendrivere mot gnagere på New Zealand
Bekjemping av invasive, fremmede og skadegjørende arter som mus og rotter i sårbare økosystemer som øyer, ble tidlig postulert som et mulig bruksområde for gendrivere i naturbevaring (se blant annet Esvelt et al. 2014, National Academies of Sciences, Engineering and Medicine 2016). Introduserte mus og rotter truer disse økosystemene ved å ødelegge habitater for andre arter, og opptrer som predatorer som spiser fugleegg, med mer. (Leitschuh et al. 2018). Et gen, Sry, for seleksjon av hanner, er identifisert som en kandidat for bruk i en slik syntetisk gendriver i mus (Piaggio et al. 2017). Forfatterne av studien identifiserte flere risikoer knyttet til en slik gendriver-strategi, som utilsiktet translokasjon og spredning av gendriverkonstruktet til beslektede ikke-målorganismer, uforventede økosystemkonsekvenser etter utslettelse av arten, eller spredning av gendriveren til fastlandet, og mulige effekter der. Forfatterne foreslår som risikominimeringstiltak at det kan brukes reverseringsdrivere eller klassiske giftmetoder, dersom slike utilsiktede effekter skulle oppstå.
7.7.6 Begrensninger
Utviklingen av gendriverorganismer er på utviklingsstadiet, men utviklingen går raskt (Bier 2022). Syntetiske gendrivere har mulige bruksområder som sykdomsbekjempelse og bekjempelse av fremmede arter i naturen, begge er formål med høy samfunnsnytte. Det er samtidig knyttet usikkerhet til hvordan slike gendriverorganismer vil påvirke økosystemer og populasjoner over tid, og om utilsiktet spredning av gendriverorganismer til andre geografiske områder, kan gi opphav til irreversible endringer og skade (Esvelt & Gemmell 2017). Det er både tekniske, regulatoriske, samfunnsmessige og etiske begrensninger og problemstillinger som må adresseres før syntetiske gendriverorganismer kan tas i bruk i naturen49 (Nielsen 2021).
7.7.6.1 Teknologiske begrensninger
Gendrivere er best studert i noen modellorganismer som ulike arter av malariabærende mygg. Selv om CRISPR/Cas-gendriverkomplekser potensielt kan brukes i flere liknende typer insekter, er metodene ikke direkte overførbare (Bier 2022). Teknologien fungerer også best i noen typer organismer som kan formeres med seksuell reproduksjon, gjerne kombinert med kort generasjonstid. Når det gjelder gendriveres funksjonalitet i naturen over tid, er det vist at ved introduksjon av gendriver i mygg, hvor formålet er å utrydde populasjoner, utvikler myggen naturlige resistensmekanismer mot gendriveren. Dette stopper gendriveren fra å spres videre (Unckless et al. 2017). Det er allerede forsket på veier for å omgå dette, blant annet ved å finne gener som er sterkt konservert over lang tid, og dermed har mindre sannsynlighet for å bli mutert. Ved å målrette gendriveren mot slike konserverte gener, er det større sannsynlighet for at gendriveren vil spres gjennom en populasjon med 100 % effektivitet. Blant annet er dette vist i et forsøk i myggen Anopheles gambiae og fertilitetsgenet doublesex (Kyrou et al. 2018).
7.7.6.2 Utfordringer knyttet til risikovurdering og trygg bruk
Dagens risikovurderingsmetodikk for tradisjonelle GMO-er utfordres til dels av syntetiske gendrivere. Ved utsetting av syntetiske gendriverorganismer til utryddelse av insekter eller fremmede arter, er selve formålet at genmodifiseringen spres i naturen gjennom en hel populasjonen i et område. Ved risikovurdering av GMO vurderes risiko for, og ikke nytten av, spredning av et innsatt eller endret gen i GMO-en til arter i naturen, og man anser tradisjonelt sett slik spredning som en uønsket og utilsiktet effekt ved utsetting av GMO-en. Det har derfor vært vurdert både i EU-sammenheng (EFSA 2020b) og i tilknytning til Cartagena-protokollen om biosikkerhet, at det er behov for utarbeidelse av ny veiledning og muligens også behov for ny metodikk for risikovurdering av syntetiske gendriverorganismer.
For å forhindre eventuelle utilsiktede negative effekter av gendriveren i naturen, er det foreslått at feltforsøk må gjennomføres slik at de både sikrer at gendriveren er kontrollert molekylært (begrensende faktor) og/eller økologisk (gjennomføres på avsidesliggende sted som en øy) (Long et al. 2020). Det forskes derfor på om det er mulig å begrense effekter av CRISPR-Cas gendriverkomplekser temporalt og romlig i en populasjon gjennom det molekylære designet av gendriveren, og slik hindre at den spres ukontrollert gjennom flere populasjoner over store avstander. En teknikk for dette som foreløpig kun er på skrivebordet, er såkalte daisy-drives (Noble et al. 2019).
Matematiske modeller kan også benyttes til å modellere noen av prosessene og dermed informere vurderinger av økologisk effekt av gendriverorganismer. Noen modeller har blitt utviklet og modellerer alt fra genflyt av gendriverkomplekset gjennom populasjonen (Noble et al. 2017), invasive egenskaper (Noble et al. 2018), resistens mot gendriverkomplekset, til kritisk masse av populasjonen som settes ut (Tanaka et al. 2017). Hindar et al. publiserte i 2020, på oppdrag fra Miljødirektoratet, en rapport om matematiske modeller for å forstå gendriverorganismers påvirkning på målorganismer og økosystem. I sammendraget omtales nytte og begrensning av slik modellering i risikovurdering av gendriverorganismer:
«Matematiske modeller for hvordan en gendriver sprer seg innen en bestand og til omkringliggende bestander, og i neste omgang hvilke konsekvenser dette har for biologiske samfunn og økosystemer, er viktige i risikovurderingene av gendriverorganismer. (…) De største begrensningene for matematiske modeller i dag er å kunne forutsi de økologiske konsekvensene av gendrivere i biologiske samfunn og økosystem. Matematiske modeller kan her ha sin største nytte i å lage kvalitativt informative scenarier og synliggjøre hvor kunnskapshullene er, mens selve risikovurderingene må være ekspertvurderinger der så mye kunnskap som mulig innhentes om sannsynlige interaksjoner mellom gendriverorganismen, andre arter, og deres miljø».
7.7.6.3 Regulatoriske begrensninger og samfunnsmessig aksept
Både forskningsmiljøer og sivilsamfunnet har tatt til orde for at utsetting av gendrivere må skje på en trygg og ansvarlig måte, at det må være åpenhet om forskning og teknologiutvikling, at urfolk og lokalsamfunnet hvor gendriverorganismene skal settes ut involveres, og at regulatoriske prosesser er adaptive (Hartley et al. 2019, Oye et al. 2014, National Academies of Sciences, Engineering and Medicine 2016, Long et al. 2020). Taitingfong et al. (2023) så nærmere på nytten av et åpent register for gendriver-prosjekter, blant annet for å sikre åpenhet omkring gendriverforsøk og tilgang til informasjon.
En studie (Hartley et al. 2022) har undersøkt publisert litteratur om emnet og identifisert syv prinsipper til veiledning av gendriverforskning og utvikling i naturkonserveringssammenheng: 1) styresettet må være inkluderende, bredt og gi myndighet til deltakelse; 2) gendriverforskning og -utvikling må ha offentlig tilslutning og aksept; 3) et bredt spekter av betraktninger og perspektiver må innarbeides i beslutningsprosesser; 4) stater og internasjonale aktører må samarbeide og handle; 5) styresettet må bygge på brede inkluderende rammeverk som tar inn etiske prinsipper; 6) et bredt utvalg av eksperter må bidra med innspill; 7) utviklere må foreta egen-regulering og opptre ansvarlige.
Det er delte meninger om gendriverteknologi bør brukes til naturkonserveringsformål. Flere organisasjoner og politiske organer som EU-parlamentet50, har ønsket et moratorium på utsetting av gendriverorganismer til man har mer kunnskap om disse og/eller et felles internasjonalt regulatorisk system. Ettersom gendriverorganismer potensielt kan forflytte seg over hele verden, ønsker flere at det må komme på plass et internasjonalt instrument som kan regulere disse effektivt. Konvensjonen for biologisk mangfold (CBD) og den underliggende Cartagena-protokollen for biosikkerhet, er foreslått som et slikt instrument og har allerede tatt noen skritt for å behandle gendriverorganismer under disse.
7.8 Særmerknad fra mindretallet til kapittel 7
Utvalgsmedlemmene Aina Bartmann, Ingvild Jakobsen, Kaare Magne Nielsen og Fern Wickson viser til eksemplene på mulige genteknologiske anvendelsesområder beskrevet i kapittel 7, og har følgende merknad:
I beskrivelsen av de valgte eksemplene er det etter vår vurdering lagt ensidig vekt på ønskede effekter, og liten eller ingen vekt på mulige ikke-tilsiktede effekter. Bruk av genteknologi i det omfang eksemplene antyder vil kunne ha andre effekter på økosystemer og sosioøkonomiske forhold enn de antatte fordelene som gjengis i teksten.
Disse medlemmene vil spesielt peke på at det er vesentlige kunnskapshull knyttet til organismer og deres funksjoner i ulike økosystemer. Dette gjelder i særlig grad mikroorganismer i jord og akvatiske systemer.
Disse medlemmene mener genteknologi har potensiale til å bidra positivt til mer bærekraftige løsninger, men vil understreke at utfordringer knyttet til global matsikkerhet i hovedsak må løses gjennom grunnleggende endringer i dagens matsystemer.
Fotnoter
USA: Første person med transplantert grisehjerte – NRK Urix – Utenriksnyheter og -dokumentarer
https://upovlex.upov.int/
Planteforedlerrett – Plantesortsnemnda
https://www.fao.org/plant-treaty/en/
The FAIR Guiding Principles for scientific data management and stewardship Scientific Data (doi.org)
https://food.ec.europa.eu/system/files/2021-04/gmo_mod-bio_ngt_eu-study.pdf
https://www.yara.no/gjoedsel/gjodselaktuelt/gjodselaktuelt-var-2016/mirakel-krever-riktig-gjodsling/)
https://www.aphis.usda.gov/aphis/newsroom/stakeholder-info/sa_by_date/sa-2023/aphis-rsr-ddct-msls
https://www.nationalgeographic.com/environment/article/can-we-hack-plant-dna-to-suck-up-more-carbon-emissions
IPCC (2022), Summary for policymakers: https://www.ipcc.ch/report/ar6/wg2/downloads/report/IPCC_AR6_WGII_SummaryVolume.pdf
https://www.fao.org/documents/card/en/c/cc3579en
https://bilder.felleskjopet.no/medias/sys_master/DefaultCelumAssetsFolder/celum_assets/h5e/h73/8820716929054/Edel-bygg-V-rkorn-2015-21249.pdf
https://graminor.no/9-millioner-kroner-til-forskning-pa-genredigering/
https://ethz.ch/en/news-and-events/eth-news/news/2022/07/resistance-to-mosaic-disease-explained.html
https://www.pib.gov.in/PressReleasePage.aspx?PRID=1842778
https://www.editgrass4food.lu.lv/en/
https://calyxt.com/first-commercial-sale-of-calyxt-high-oleic-soybean-oil-on-the-u-s-market/
https://www.pairwise.com/conscious-foods
http://chicproject.eu/
https://www.aftenposten.no/viten/i/a2zedL/forskere-lager-supertomater-med-genteknologi
https://www.fda.gov/news-events/press-announcements/fda-approves-first-its-kind-intentional-genomic-alteration-line-domestic-pigs-both-human-food
https://www.acceligen.com/
https://www.fda.gov/media/155706/download
https://www.geno.no/fagstoff-og-hjelpemidler/avlsprogram-for-norsk-rodt-fe/avlsmalet-for-nrf/
https://www.nationen.no/en-gamechanger/o/5-148-328531
https://www.nature.com/articles/s41587-021-01197-8
https://www.fishfarmingexpert.com/aquabounty-argentina-gene-editing/aquabounty-gets-argentina-go-ahead-for-edited-tilapia/1151140
https://www.genethique.org/boys-only-a-crispr-research-project-to-produce-only-male-cattle/?lang=en
https://gb.pic.com/2019/05/16/genus-continues-to-advance-prrs-resistance-global-initiative-new-strategic-collaboration-in-china-with-beijing-capital-agribusiness/
https://norsvin.no/avl/
PD (TUNESAL/301602) og CMS (CMSedit/294504)
https://www.geigs.com/
https://www.gulfagriculture.com/eggxyt-licenses-the-geigs-technology-platform-from-tropic-biosciences-in-a-groundbreaking-project-to-develop-resistance-against-avian-influenza-virus-in-chickens/
https://www.geno.no/fagstoff-og-hjelpemidler/ny-teknologi-i-avlsarbeidet/klimakua-nrf/
https://artsdatabanken.no/lister/rodlisteforarter/2021/
https://www.vetinst.no/rapporter-og-publikasjoner/rapporter/2023/fiskehelserapporten-2022/_/attachment/download/164c2980-d87f-4ac9-a11d-bff201c7ed10:6cfc7ebf70fb9f790736d0a670ca1ecdc63caaf6/FHR%202022.pdf
https://www.hi.no/hi/nettrapporter/rapport-fra-havforskningen-2023-5#sec-6-11
https://afingen.tech/apfl-platform/
Se blant annet: https://www.pivotbio.com/, https://www.agweb.com/news/crops/crop-production/study-finds-pivot-bio-provenr-40-increases-grower-revenue, https://www.globenewswire.com/news-release/2022/08/30/2506837/0/en/Pivot-Bio-Launches-the-First-Ever-On-Seed-Nitrogen.html
Statens Legemiddelverk, SLV (2019): Voretigene Neparvovec (Luxturna)_ID2016_057_offentlig utgave – oppdatert versjon.pdf (nyemetoder.no)
https://www.gavi.org/vaccineswork/what-are-viral-vector-based-vaccines-and-how-could-they-be-used-against-covid-19
https://www.ous-research.no/act
https://kliniskforskning.rhf-forsk.org/tildeling-av-100-millioner-kroner-til-klinisk-behandlingsforskning-innen-rusmiddelavhengighet-hjernesykdommer-og-genterapi/, https://helse-sorost.no/nyheter/tildeling-av-97-millioner-kroner-til-klinisk-behandlingsforskning
Nytt Senter for fremragende forskning på immunterapi – Institutt for klinisk medisin (uio.no)
A Nordic joint feasibility study (regjeringen.no)
Synlogic Receives Orphan Drug Designation from FDA for SYNB1934 for Treatment of Phenylketonuria – Synlogic (synlogictx.com)
MD Anderson and SNIPR BIOME collaborate on CRISPR microbiome therapies MD Anderson Cancer Center
https://www.globenewswire.com/news-release/2022/10/03/2526476/0/en/SNIPR-Biome-Launches-A-Non-Profit-Patent-Licensing-Program-To-Enable-The-Field-of-CRISPR-Editing-in-Prokaryotes.html
https://genedrives.ch/report/
European Parliament resolution of 9 June 2021 on the EU Biodiversity Strategy for 2030: Bringing nature back into our lives, punkt 158: «158. Is concerned about the new legal, environmental, biosafety and governance challenges that might arise from the release of genetically engineered gene drive organisms into the environment, including for nature conservation purposes; acknowledges the outcome of the Ad Hoc Technical Expert Group of the Convention on Biological Diversity on gene drives and living modified fish(94), which raises concerns about the difficulties of predicting their behaviour, assessing their risks and controlling them after release; notes that gene drive organisms could become invasive species in themselves; considers that global and EU-level risk assessment guidance materials, tools and an environmental monitoring framework, as well as clear global governance and effective mechanisms for controlling and reversing the effects of gene drive organisms, should be fully developed, and that additional research is required on the health, environmental, ecological, ethical and other implications of gene drive organisms to better understand their potential impact; considers therefore that no releases of genetically engineered gene drive organisms should be allowed, including for nature conservation purposes, in line with the precautionary principle».