Del 4
En refusjonsordning som fremmer riktig bruk av legemidler
14 Bakgrunn og mål
Refusjonssystemet gir dekning for utgifter til legemidler som brukes i behandling av alvorlige kroniske sykdommer, eller tilstander der langvarig behandling er nødvendig for at alvorlig sykdom skal unngås i fremtiden. Refusjonssystemet skal sikre at befolkningen får en mest mulig lik og enkel tilgang til legemidler, uavhengig av betalingsevnen til den enkelte.
Folketrygdens utgifter til legemidler har økt sterkt over flere år. I 1995 ble det refundert legemidler for om lag 3,8 mrd. kroner og i 2003 for om lag 8,2 mrd. kroner. Dette er en fordobling av utgiftene i denne perioden, og justert for generell prisstigning er utgiftene økt med nesten 80 prosent. Folketrygdens andel av de totale legemiddelutgiftene var i 1995 på 51 prosent. Denne andelen har steget til 57 prosent i 2003. Utgiftsveksten kan hovedsakelig forklares med en overgang til nye og dyrere legemidler. Veksten skyldes også økt volum av solgte legemidler. Denne utviklingen viser behovet for et refusjonssystem som legger til rette for riktige prioriteringer, målretting av stønader og god etterlevelse.
Refusjonsordningen for legemidler skal bidra til å nå følgende mål, jf. Ot.prp. nr. 29 (1998–1999):
Sikre mest mulig lik og enkel tilgang til effektive legemidler for små og store pasientgrupper med dokumenterte behov for medikamentell behandling.
Gi samfunnet verdier for pengene, det vil si at fellesskapet skal refundere utgifter til legemidler som gir sikker helsegevinst for pasienten, og har god effekt i forhold til kostnadene. Det er viktig med god kostnadsstyring, slik at en sikrer best mulig utnyttelse av de midler som bevilges.
Stimulere til ansvarlig og kostnadsbevisst forskrivning og bruk av legemidler hos lege og pasient.
Medvirke til at individer med moderat og lav risiko for fremtidig sykdom, og hvor behandlingseffekten er liten eller usikker, tar et størst mulig ansvar for egen helse. Det offentlige har først og fremst forpliktelser overfor pasienter med alvorlig sykdom eller høy risiko for sykdom, hvor det finnes effektive legemidler.
Så langt mulig reflektere kunnskaper om gevinster og kostnader ved bruk av legemidler, basert på helseøkonomiske undersøkelser og vurderinger.
Være enkel å administrere og forstå.
Gi myndighetene anledning til å fjerne medikamenter hvor det dokumenteres at nytten ikke står i forhold til kostnadene.
Departementet legger disse kravene til grunn for refusjonssystemet også i fremtiden.
Det er etablert tre ulike ordninger for refusjon av utgifter til legemidler som gis utenom sykehus eller kommunehelsetjenesten. Forhåndsgodkjent refusjon hvor legen skriver ut en blå resept, er den vanligste ordningen. Det er også mulig å søke om refusjon på individuelt grunnlag eller om bidrag til store sykdomsutgifter.
Ved behandlingen av St.prp. nr. 1 (2004–2005) vedtok Stortinget følgende: «Stortinget ber Regjeringen om at dersom Statens legemiddelverks utredning angående legemidlet Remicade gir grunnlag for å endre refusjonsvilkår, legges saken frem for Stortinget med sikte på en avklaring i Revidert nasjonalbudsjett våren 2005». Departementet har startet arbeidet med å utrede finansieringsordninger i forhold til Remicade og andre tilsvarende legemidler og vil presentere dette for Stortinget i forbindelse med Revidert nasjonalbudsjett 2005. Dette spørsmålet er derfor ikke behandlet nærmere i denne meldingen.
Finansiering av kostbar medikamentell behandling i spesialisthelsetjenesten (sykehus), herunder legemidler til behandling av kreft, er en aktuell problemstilling. Helse- og omsorgsdepartementet har startet arbeidet med en gjennomgang av finansieringssystemet for spesialisthelsetjenesten sin evne til å fange opp utviklingen av slik medikamentell behandling. Stortinget vil få en foreløpig orientering om dette arbeidet i forbindelse med fremleggelsen av Revidert nasjonalbudsjett for 2005.
15 Forhåndsgodkjent refusjon
15.1 Dagens regelverk og saksbehandling
15.1.1 Oversikt
Forhåndsgodkjent refusjon, eller «blåreseptordningen», er den mest omfattende ordningen innenfor det norske refusjonssystemet. Produsenten av legemidlet søker om refusjon, og Statens legemiddelverk vurderer om søknaden oppfyller forskriftskravene. Legemidler som godkjennes for refusjon, føres opp på listen over refusjonsberettigede legemidler (preparatlisten). Det er så legen som må vurdere om pasientene oppfyller de vilkårene som Statens legemiddelverk har satt for refusjon av de enkelte legemidlene. Dersom vilkårene er oppfylt, kan legen skrive en såkalt «blåresept» som gir pasienten rett til refusjon. Utgifter til legemidler etter forhåndsgodkjenning dekkes vanligvis etter hjemmel i blåreseptforskriften § 9.
Statens legemiddelverk fatter årlig vedtak i 75 til 100 refusjonssaker. Dette inkluderer søknader om refusjon av generiske legemidler, nye administrasjonsformer, nye styrker og nye virkestoff. Om lag 10 refusjonssøknader avslås årlig.
I det følgende er det gitt en omtale av dagens regelverk og saksbehandlingsrutiner i forbindelse med refusjon av nye legemidler. I punkt 15.1.2 er de nye saksbehandlingsreglene kort beskrevet. For at et legemiddel skal kunne innvilges refusjon må de faglige kravene gitt i legemiddelforskriftens § 14–13 oppfylles. Disse kravene er nærmere omtalt i punkt 15.1.3.
Dersom et nytt legemiddel oppfyller de faglige kravene, er den videre saksbehandlingen avhengig av om Statens legemiddelverk er delegert beslutningsmyndighet. Statens legemiddelverk har myndighet til å innvilge refusjon, dersom det ikke er nødvendig å opprette nytt sykdomspunkt eller legemiddelgruppe i blåreseptforskriften § 9 (se punkt 15.1.4), og de årlige merutgiftene ved refusjon er mindre enn 5 millioner kroner (se punkt 15.1.5). I de øvrige sakene må beslutning om refusjon fremmes for Stortinget som en del av samlet budsjettfremleggelse se punkt 15.1.6.
15.1.2 Nye saksbehandlingsregler i 2003
Refusjonsordningene for utgifter til legemidler er i utgangspunktet et nasjonalt anliggende. EUs Rådsdirektiv 89/105 (Transparensdirektivet) oppstiller imidlertid krav til tidsfrister, klageadgang og objektive kriterier for når en søknad om refusjon skal innvilges. Departementet ga nye forskrifter om saksbehandling av søknader om opptak av legemidler i blåreseptordningen 6. juni 2003. Det ble innført en rekke krav til søknadene, og kriterier for opptak ble forskriftsfestet. Statens legemiddelverk fikk vedtaksrett og -plikt i alle saker. Behandlingsfrist for pris- og refusjonssaker er samlet 180 dager, og den slutter å løpe når Statens legemiddelverk har fattet vedtak. Alle vedtak kan påklages til Helse- og omsorgsdepartementet. Nytt er også bruk av en Blåreseptnemnd til kvalitetssikring av beslutningsgrunnlaget i utvalgte saker. Departementets vurdering er at dette har gitt en mer åpen og forutsigbar prosess ved behandlingen av refusjonssøknader.
15.1.3 Faglige krav til legemidlet
Det er en forutsetning for innvilgelse av refusjon etter blåreseptforskriften § 9 at legemidlet oppfyller overordnede krav stilt til lidelsens alvorlighet, til behandlingens varighet og til forholdsmessighet mellom behandlingsverdi og kostnader. Statens legemiddelverk foretar denne vurderingen ut fra følgende faglige kriterier i legemiddelforskriften § 14–13:
Legemidlet skal brukes i behandling av alvorlige sykdommer eller av risikofaktorer som med høy sannsynlighet vil medføre eller forverre alvorlig sykdom.
Sykdommen eller risiko for sykdom som nevnt i bokstav a) medfører behov for eller risiko for gjentatt behandling over en lang periode.
Legemidlet har en vitenskapelig godt dokumentert og klinisk relevant virkning i en definert, aktuell pasientpopulasjon.
Kostnadene ved bruk av legemidlet står i et rimelig forhold til den behandlingsmessige verdi og til kostnader forbundet med alternativ behandling.
15.1.4 Krav om sykdomspunkt og legemiddelgruppe
Oppføring på preparatlisten forutsetter videre at legemidlet er godkjent for behandling av en sykdom (diagnose) som er uttrykkelig nevnt i blåreseptforskriften § 9, og forskrevet på de vilkår som fremgår av de tilhørende merknadene. Det er i dag over 40 slike sykdomspunkter i forskriftens såkalte sykdomsliste. Legemidlet må også omfattes av en legemiddelgruppe nevnt under det aktuelle sykdomspunktet. Se tabell 15.1 for en illustrasjon av forskriftens oppbygging. Sykdomspunktene og legemiddelgruppene definerer, sammen med preparatlisten, pasientenes rettigheter i blåreseptordningen.
Tabell 15.1 Eksempel fra sykdomslisten i blåreseptforskriften § 9
| Sykdomsliste: | Legemiddelgrupper: | Merknader: |
|---|---|---|
| 4. […] | ||
| 5. Diabetes mellitus | a) Insulinpreparater.b) Andre midler til diabetesbehandling.c) Ved stadig hypoglykemiske anfall.d) Tiazolidindioner (glitazoner), også som kombinasjonspreparater | Til bokstav d: i) Glitazoner refunderes kun som kombinasjonsbehandling, ogii) bare til pasienter som ikke oppnår en tilstrekkelig sykdomskontroll med en kombinasjon av metformin pluss sulfonylurea eller får uakseptable bivirkninger med metformin-, sulfonylureapreparater eller en kombinasjon av disse, ogiii) kun til de pasienter hvor alternativ behandling ville vært insulin, ogiv) skal kun forskrives av leger som har utstrakt erfaring med behandling av type 2 diabetes mellitus. |
| 6. […] |
Det store flertallet av refusjonssøknader gjelder legemidler i nye styrker eller generiske versjoner av allerede refunderte legemidler. I disse tilfellene er de nødvendige sykdomspunktene og legemiddelgruppene allerede oppført i forskriften, og opptak på refusjon av legemidlene vil normalt ikke øke folketrygdens utgifter. Ved slike saker oppdaterer Statens legemiddelverk preparatlisten fortløpende gjennom enkeltvedtak.
Nye legemidler som er basert på nye behandlingsprinsipper, vil i utgangspunktet ikke falle inn under de eksisterende sykdomspunktene og legemiddelgruppene i forskriften. Dersom disse skal kunne tas opp på preparatlisten og refunderes i blåreseptordningen, vil det være nødvendig med en forskriftsendring. Folketrygdens utgifter til legemidler gjennom blåreseptordningen følger direkte av reglene i blåreseptforskriften, og bevilgningene er derfor regelstyrte.
Endringer i hvilke sykdommer eller legemiddelgrupper som skal gi rett til refusjon kan øke de samlede legemiddelutgiftene. Det er bare Stortinget som kan bevilge midler til å utvide refusjonsordningen. Søknader om refusjon for legemidler som ikke faller inn under punktene i blåreseptforskriften § 9, kan derfor ikke innvilges av Statens legemiddelverk. Dette gjelder selv om de faglige kravene i legemiddelforskriften § 14-13 er oppfylt. Det er bare diabeteslegemidlene Actos og Avandia som de siste to årene ikke har blitt innvilget refusjon på grunn av manglende legemiddelgruppe i forskriften. Disse legemidlene er senere innvilget refusjon etter inngåelse av refusjonskontrakt.
15.1.5 Bagatellgrense
I de aller fleste tilfellene vil refusjon av legemidler som dekkes av eksisterende sykdomspunkter og legemiddelgrupper, ikke medføre merkostnader av betydning for staten. Imidlertid er noen av sykdomspunktene og legemiddelgruppene så generelt formulert at også enkelte nye legemidler basert på nye behandlingsprinsipper oppfyller forskriftskravet. Bakgrunnen for dette er at legemiddelgruppene og sykdomslisten i § 9 er gitt en generell utforming i forbindelse med opptak av bestemte legemidler. Virkeområdet kan således være definert så vidt at også andre legemidler kan tas inn, selv om det opprinnelig ikke var foretatt en bevisst avveining av dette. Sykdomspunktet « allergiske lidelser i de øvre luftveier, øyne og tarm » kan for eksempel ha kommet inn som en følge av at et bestemt legemiddel mot en spesiell form for allergi ble gitt refusjon. I ettertid hjemler imidlertid dette sykdomspunktet inntak av alle typer allergimedisin.
Dersom disse tilfellene ikke hadde blitt særregulert, ville Statens legemiddelverk ved administrative vedtak være forpliktet til å innvilge refusjon, selv om dette ville medføre store merutgifter for folketrygden. På denne bakgrunn ble det 6. juni 2003 forskriftsfestet at Statens legemiddelverk bare har fullmakt til å innvilge refusjon for et legemiddel uten Stortingets samtykke, dersom dette gir en beregnet årlig merutgift for trygden på mindre enn 5 millioner kroner (bagatellgrense) fem år etter refusjonsinnvilgelse. I løpet av de to siste årene har Statens legemiddelverk behandlet søknader for fire legemidler som ville ha gitt større utgifter enn det bagatellgrensen tillater (utgifter over 5 millioner kroner). De anslåtte merutgiftene for disse legemidlene i forhold til eksisterende terapi varierte mellom 30 og 140 millioner kroner årlig. Av disse legemidlene har to senere blitt innvilget forhåndsgodkjent refusjon og to er til vurdering i departementet.
15.1.6 Vedtak og videre behandling av legemidler som ikke oppfyller kravene
Dersom alle kravene i forskriften er oppfylt, fatter Statens legemiddelverk vedtak om opptak av legemidlet på blå resept. Dersom kravene ikke er oppfylt, fatter Statens legemiddelverk alltid avslagsvedtak. Søkeren kan klage på vedtaket. Arbeidet med søknaden avsluttes i de tilfellene hvor avslaget skyldes at de faglige kravene (langvarig behandling, alvorlig sykdom og kostnadseffektivitet) ikke er oppfylt.
I de tilfellene der avslaget skyldes at Statens legemiddelverk ikke har fullmakt til å innvilge refusjon, skal etaten gi departementet en vurdering av om de faglige vilkårene er oppfylt. Det vil være aktuelt dersom legemidlet ikke omfattes av blåreseptforskriften § 9 eller bagatellgrensen er overskredet. En eventuell positiv konklusjon vil være ett av flere elementer i Regjeringens, og eventuelt Stortingets, vurdering av om refusjonssystemet bør utvides slik at det også skal dekke det aktuelle legemidlet. Departementet opprettet i april 2004 en Blåreseptnemnd for å gi mulighet til å utdype og kvalitetssikre det faglige beslutningsgrunnlaget i blant annet slike legemiddelsaker. Nemnda er sammensatt av et fast utvalg av syv personer med bred kompetanse, herunder flere leger og en representant for legemiddelbrukerne. I tillegg skal det for hver sak oppnevnes to eller tre kliniske spesialister med relevant ekspertise fra den medisinske spesialitet som legemidlet vedrører. Søkeren får innsyn i beslutningsgrunnlaget for refusjonsvurderingen i forbindelse med Blåreseptnemndas behandling, og kan gi innspill i prosessen. Legemiddelfirmaene får anledning til å komme med tilleggsopplysninger og rette opp eventuelle misforståelser underveis i behandlingen av saken. Videre kan Statens legemiddelverk få nyanserte innspill fra nemnda i faglig vanskelige spørsmål.
Dersom Statens legemiddelverk på bakgrunn av denne prosessen finner at de faglige kravene er oppfylt, vil refusjonssaken bli behandlet som en del av Regjeringens ordinære budsjettprosess og prioriteres opp mot andre tiltak og utgifter innenfor statsbudsjettets ulike utgiftsområder, se avsnitt 15.4. Legemiddelverkets faglige vurdering er begrenset til sammenligning med annen behandling for samme sykdom. Denne vurderingen er derfor bare et innspill til de overordnede politiske vurderingene av om det skal gis samtykke til å utvide refusjonssystemet.
Dagens saksgang ved opptak av legemidler på blå resept er oppsummert i figur 15.1. De nye prosessene og rettighetene som ble forskriftsfestet i juni 2003 er nå fullt implementert.
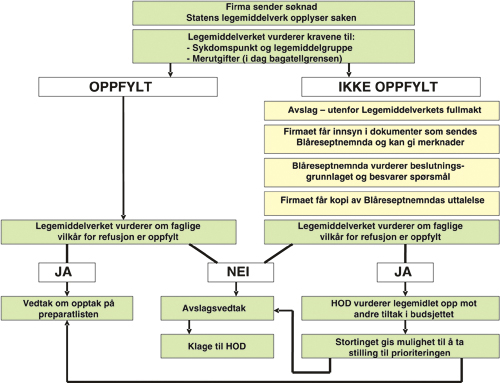
Figur 15.1 Saksbehandlingen ved opptak av legemidler på blå resept
15.2 Sammenligning av refusjon og markedsføringstillatelse
Vilkårene for innvilgelse av refusjon er ikke de samme som for innvilgelse av markedsføringstillatelse. Forskjellene skyldes at refusjonsadgang er noe mer enn en ren markedsadgang. Refusjon skaper rettigheter og plikter for leger, pasienter og myndigheter.
Det er Statens legemiddelverk som kan gi en legemiddelprodusent tillatelse til å selge et legemiddel i Norge. Salgstillatelse gis ved at legemidlet får en såkalt markedsføringstillatelse. Markedsføringstillatelse gis dersom det er dokumentert at legemidlet produseres med god kvalitet, har effekt og har en akseptabel bivirkningsprofil. Generelt er det et krav at et nytt legemiddel skal ha bedre effekt enn placebo (ingen behandling), og at det samlet sett ikke har dårligere effekt og sikkerhetsprofil enn andre legemidler til behandling av sykdommen. Kravene til de kliniske studiene som skal dokumentere dette, er beskrevet i internasjonale retningslinjer. Det er altså ikke et krav for å oppnå markedsføringstillatelse at nye legemidler skal ha en bedre effekt enn de legemidlene som allerede er godkjent for salg. Markedsføringstillatelsen er i de fleste tilfellene en overnasjonal beslutning, som fattes som en del av det europeiske legemiddelsamarbeidet og som Norge er forpliktet til å følge gjennom EØS avtalens regelverk. Legemidlets pris er ikke en del av vurderingsgrunnlaget når Statens legemiddelverk gir et nytt legemiddel markedsføringstillatelse.
Det er først når et legemiddel har fått markedsføringstillatelse, at legemiddelprodusenten søker Statens legemiddelverk om maksimalpris og forhåndsgodkjent refusjon for legemidlet (blå resept). Etaten vurderer om de kravene som er stilt for at legemidler kan innvilges refusjon er oppfylt, se avsnitt 15.1. Dette er ikke en overprøving av de effekt- og sikkerhetsvurderingene som følger av markedsføringstillatelsen, men tilleggskrav fordi refusjonsverdighet ikke vurderes når et legemiddel får markedsføringstillatelse. Tilleggskravene skal danne grunnlag for riktige prioriteringer og er hjemlet i legemiddelforskriften § 14–13. I tabell 15.2 er forholdet mellom markedsføringstillatelse og krav til refusjon oppsummert.
Tabell 15.2 Søknadskrav
| Krav | Ved søknad om markedsføringstillatelse | Ved søknad om refusjon |
|---|---|---|
| 1. Legemidlet har dokumentert effekt, sikkerhet og produksjonskvalitet. | Kreves | Kreves |
| 2. Legemidlet behandler en alvorlig sykdom eller risikofaktorer som gir alvorlig sykdom. | Kreves ikke | Kreves |
| 3. Behandlingen er langvarig. | Kreves ikke | Kreves |
| 4. Kostnaden ved bruk av legemidlet må stå i et rimelig forhold til effekten. | Kreves ikke | Kreves. Et legemiddel som har en høyere pris enn en allerede refundert behandling, med tilsvarende effekt og bivirkningsprofil, kvalifiserer ikke til refusjon. |
15.3 Kravet om sykdomspunkter og legemiddelgruppe ved opptak
Dersom forhåndsgodkjent refusjon skal innvilges for legemidler som ikke omfattes av eksisterende sykdomspunkt eller legemiddelgruppe i blåreseptforskriften § 9, må Stortinget gi sitt samtykke til de nødvendige forskriftsendringene. Dette gjelder i dag selv om refusjon av legemidlene vil gi beskjedne merutgifter for folketrygden, se punkt 15.1.5.
Kravet om at et legemiddel må omfattes av eksisterende sykdomspunkter og legemiddelgrupper for å kunne tas opp i blåreseptordningen, forsinker innvilgelse av refusjon for legemidler i den lavere delen av kostnadsskalaen. Etter departementets vurdering er denne begrensningen unødvendig for å sikre riktig prioritering av samfunnets ressurser etter at bagatellgrensen på 5 millioner kroner ble innført i 2003.
Departementet vil på denne bakgrunn foreslå at sykdomspunktene og legemiddelgruppene i blåreseptforskriften § 9 ikke brukes som opptakskriterium på blå resept i fremtiden. Dette fordrer en endring av legemiddelforskriften. Sykdomspunktene og legemiddelgruppene i forskriften vil imidlertid fremdeles være avgjørende for pasientenes rettigheter og for hva legene kan forskrive på folketrygdens regning. Departementet vil derfor foreslå at departementet gis en generell fullmakt til å foreta de forskriftsendringene i sykdomspunkt og legemiddelgrupper som hvert enkelt opptak av legemidler nødvendiggjør. En slik fullmakt vil bare gjelde for legemidler hvor utgiftene anslås å ligge under bagatellgrensen, se punkt 15.1.5.
15.4 Forvaltningens fullmakt til å gi forhåndsgodkjent refusjon
15.4.1 Problemstillingen – prioritering
Departementet mener at det er uhensiktsmessig at alle refusjonssaker fremmes for Stortinget, uavhengig av størrelsen på de fremtidige utgiftene. Stortinget har satt en utgiftsgrense på 5 millioner kroner for den fullmakten legemiddelmyndighetene har til å ta opp nye legemidler i refusjonsordningen.
Både Legemiddelindustriforeningen og pasientorganisasjoner har fremmet synspunkter om at nye legemidler må få raskere opptak på refusjon enn i dag. I forbindelse med behandling av Ot. prp. nr. 88 (2002–2003) om refusjonskontrakter uttalte Sosialkomitéen følgende med hensyn til opptak av nye legemidler i blåreseptordningen i Innst. O. nr. 29 (2003–2004):
«Komiteen konstaterer at dagens regelverk og prosedyrer innebærer at enkelte legemidler blir brakt inn i Stortinget for å sikre finansiering. På den måten blir Stortinget medlemmer en slags saksbehandler i fagmedisinske spørsmål om legemidler skal tas opp i blåreseptordningen eller ikke. Komiteen mener i likhet med departementet og høringsinstansene at det er nødvendig å finne en rimelig og forutsigbar måte å sikre kostnadskontroll på. Komiteen vil be departementet i forbindelse med en bredere gjennomgang av blåreseptordningen også å vurdere andre modeller for kostnadskontroll enn refusjonskontrakter, der en form for overslagsbevilgning underlagt strenge økonomiske kontrollmekanismer kan være en del av vurderingen».
Problemstillingen er hvorvidt legemidler som tilfredsstiller de faglige kriteriene for refusjon, men som medfører kostnadsøkninger, skal innvilges refusjon uten politisk behandling i Stortinget.
15.4.2 Overslagsbevilgning
Det er i utgangspunktet strenge forutsetninger knyttet til overslagsbevilgninger. I veileder for statlig budsjettarbeid utarbeidet av Finansdepartementet sies blant annet følgende:
«Sykepenger og pensjoner fra folketrygden er typiske eksempler på tilfeller der stikkordet kan nyttes. I slike tilfeller har Stortinget som hovedregel vedtatt uttømmende regler om tilskuddsordningen og ytelsene utløses av objektivt bestemte faktorer. Utgiftene følger således automatisk av et regelverk fastsatt av Stortinget, og kan ikke styres av forvaltningen. Stikkordet «overslagsbevilgning» gir imidlertid ikke et departement adgang til å overskride bevilgningen ved å utvide utgiftsgrunnlaget i forhold til de premisser bevilgningen bygger på, for eksempel ved å fastsette standardhevinger eller gjøre nye grupper tilgjengelig til tilskuddet»
Ingen av postene under Helse- og omsorgsdepartementets del av folketrygdbudsjettet har fått tilføyd stikkordet «overslagsbevilgning». De fleste postene er imidlertid regelstyrte i den betydning at folketrygden fortsetter refusjonsutbetalingene selv om bevilgningene overskrides. Det er videre slik at budsjettanslagene på postene ikke baserer seg på rammer, men prognoser for utgiftene fra Beregningsgruppa for Folketrygden. Å ta inn nye legemidler i refusjonsordningen kan beskrives som en «standardheving» som må vurderes i de samlede budsjettfremlegg til Stortinget. På denne bakgrunn vil ikke en innføring av betegnelsen «overslagsbevilgning» innebære en endring i forhold til dagens praktisering av opptak av nye legemidler i refusjonsordningen.
15.4.3 Departementets vurdering
To prioriteringsnivå
Statens utgifter til refusjon av legemidler har økt sterkt over flere år. En av de største drivkreftene bak denne veksten er refusjon av nye og dyrere legemidler. Det er flere eksempler på at det utvikles svært dyre legemidler for utvalgte sykdommer. I de nyeste behandlingsmetodene for leddgikt inngår blant annet legemidler som koster om lag 150 000 kroner årlig per pasient. Eksemplet illustrerer en utvikling som vil stille stadig større krav til riktige prioriteringer, både mellom ulike behandlingsmetoder og ulike helsetjenester, se kapittel 3.
Dagens ordning for opptak av legemidler på forhåndsgodkjent refusjon baserer seg på at det foretas to ulike prioriteringer.
Den første prioriteringen bygger på medisinske og helseøkonomiske betraktninger. Statens legemiddelverk vurderer om det legemidlet som søkes refundert, oppfyller de faglige kravene som beskrevet i punkt 15.1.3. Spørsmålet er da om legemidlet er like bra eller bedre enn andre behandlingstilbud for en konkret lidelse, og om prisen står i forhold til behandlingsverdien. Legemidlet prioriteres ikke opp mot legemidler eller helsetiltak som benyttes i behandling av andre sykdommer.
Den andre prioriteringen er av en annen karakter. Dersom legemidlet oppfyller de faglige kravene i den første prioriteringen, men refusjon vil gi merutgifter som overstiger bagatellgrensen på 5 millioner kroner, må det foretas en prioritering på et overordnet nivå. Spørsmålet for Regjeringen og Stortinget er da om det nye legemidlet bør prioriteres foran andre tiltak på helseområdet.
Forutsetningene som ligger til grunn for disse prioriteringene er forskjellige, og det er derfor rimelig at de kan gi forskjellig utfall. Det er på denne bakgrunn ikke gitt at refusjon av et legemiddel bør prioriteres før andre helsetiltak, selv om legemidlet oppfyller faglige vilkår.
Problemstillingen er derfor om bevilgninger til legemidler skal prioriteres opp mot andre helsetiltak innenfor en samlet budsjettfremleggelse, eller gis særlig «forkjørsrett» ved at det eneste som legges til grunn er vurderinger begrenset til et enkelt sykdomsområde.
En slik forkjørsrett vil i praksis innføres ved å fjerne eller heve bagatellgrensen. Statens legemiddelverk vil ved en slik løsning få delegert et utvidet ansvar for å ta opp legemidler på listen over forhåndsgodkjente legemidler (blå resept). Bagatellgrensen er fastsatt for å balansere behovet for kostnadskontroll og prioritering opp mot behovet for en rask behandling av refusjonssaker. Virkningen av å heve bagatellgrensen vil være at flere legemidler innvilges refusjon, selv om pasientenes nytte av andre tiltak kan vurderes å være høyere. Det må imidlertid understrekes at de fleste legemidler kan refunderes etter individuell søknad for pasienter med særlige behov. De fleste legemidler vil derfor være tilgjengelig for pasientene innenfor egenandelstaket. Det er departementets målsetting at pasientene skal ha tilgang til legemidler innen rimelig tid gjennom den søknadsbaserte ordningen.
Valg mellom ulike helsetiltak er krevende, særlig når et nytt behandlingstilbud rettes mot pasienter som har et dokumentert behov for behandling. Etter departementets vurdering vil det være uheldig dersom ansvaret for disse krevende politiske prioriteringene mellom ulike helsetiltak delegeres til en fagmyndighet. En heving av bagatellgrensen ville innebære at Statens legemiddelverk i de aller fleste saker blir delegert ansvaret for krevende prioriteringer innenfor helsevesenet. Dette er vedtak som kan forplikte samfunnet for betydelige utgifter, og som derfor kan ha store prioriteringsmessige konsekvenser for befolkningens samlede og fremtidige helsetilbud. Legemidler gis i så fall en særskilt prioritet som det ikke er grunnlag for. En slik utvikling vil kunne få uheldige konsekvenser for det samlede tilbud av helsetjenester til befolkningen.
Legemiddelmarkedet domineres av sterke aktører som arbeider for tilgang til nye og dyre legemidler over refusjonssystemet. Andre nye behandlingstilbud innenfor helsetjenesten kan også tilfredsstille grunnleggende krav til behov, kostnadseffektivitet og faglighet. Slike tilbud uten støtte fra tilsvarende sterke interesser må vurderes mot hverandre innenfor en samlet budsjettramme. Det er lite som tilsier at det er vanskeligere å vurdere legemidler i en prioriteringssammenheng enn andre helsetiltak. Legemidler bør derfor underlegges samme politiske prioritering som andre vel begrunnede helsetiltak innenfor en samlet budsjettramme.
I løpet av de to siste årene har Statens legemiddelverk behandlet fire søknader med kostnader som overstiger bagatellgrensen. De beregnede merutgiftene varierte mellom 30 og 140 millioner kroner årlig. For å oppnå en vesentlig reduksjon i antall saker som må vurderes i budsjettsammenheng, vil det på denne bakgrunn kreves en betydelig heving av bagatellgrensen. Dette tyder på at dagens bagatellgrense balanserer hensynet til prioritering og effektiv saksbehandling på en god måte.
Departementet mener videre at andre tiltak enn bagatellgrensen, så som prisregulering, informasjon og kontrolltiltak, ikke vil være tilstrekkelige for å beholde en god nok kostnadskontroll og sikre riktig prioritering av helseressursene. Disse tiltakene får bare virkning på legemidler som allerede er tatt opp til refusjon, og gir ikke mulighet til å påvirke selve opptaket av nye legemidler. Erfaringsmessig er det krevende å etablere gode kostnadskontrollerende ordninger innenfor refusjonssystemet som politisk og faglig oppnår tilstrekkelig grad av aksept.
Ny kvalitetssikring i saksbehandlingen
Ved behandlingen av refusjonssaker er det viktig at forvaltningens saksforberedelse har stor faglig legitimitet, slik at Stortinget kan fokusere på prioritering mellom ulike samfunnsnyttige tiltak. Nye saksbehandlingsregler ble innført i 2003, blant annet for å gi forvaltningens vedtak en større faglig legitimitet. Det er innført åpenhet i prosessen, mulighet for partene til å kommentere beslutningsgrunnlaget, en klar klageprosedyre og bruk av en bredt sammensatt Blåreseptnemnd for å kvalitetssikre vedtaksgrunnlaget. Dette er etter departementets mening egnet til å gi større tillit til at de faglige spørsmålene er tilstrekkelig belyst, når legemiddelmyndighetene, Regjeringen eller Stortinget skal ta stilling til opptak av nye legemidler i blåreseptordningen. Blåreseptnemnda ble oppnevnt i april 2004, og har ennå ikke uttalt seg i refusjonssaker som Stortinget har tatt stilling til. De nye saksbehandlingsreglene er derfor først nå implementert fullt ut. Dette innebærer at legemiddelfirmaenes argumenter knyttet til egne produkters effekter og samfunnsnytte vil være vurdert av både Statens legemiddelverk og Blåreseptnemnda i fremtiden. Dette vil, etter departementets oppfatning, gjøre det enklere for Stortinget å fokusere på den overordnede prioriteringen mellom legemidler og andre helsetiltak.
Konklusjon
Så lenge det skjer en prioritering ved opptak av legemidler, vil det alltid være noen legemidler som ikke innvilges refusjon. Erfaring tyder på at et legemiddelfirma som får avslag på sin refusjonssøknad, vil forsøke å få omgjort vedtaket. Dette gjelder uavhengig av hvilket beslutningsnivå avslaget er fattet på.
Departementet vil derfor foreslå å beholde dagens bagatellgrense for opptak av legemidler for forhåndsgodkjent refusjon. Legemidler som vil gi en årlig merutgift på mer enn 5 millioner kroner fem år etter en eventuell refusjonsinnvilgelse, må prioriteres opp mot andre tiltak i den årlige budsjettprosessen.
Der er i de fleste tilfeller begrenset dokumentasjon tilgjengelig om legemidlets effekt, bivirkninger og kostnadseffektivitet når et legemiddel søkes refundert. De vurderingene som gjøres av Statens legemiddelverk når et nytt legemiddel vurderes for refusjon, vil derfor ofte bygge på usikre forutsetninger. Når ulike helsetiltak vurderes opp mot hverandre innenfor et samlet budsjettfremlegg, er dette en usikkerhet som departementet må forholde seg til. Departementet vil derfor foreslå at Statens legemiddelverk i sine vurderinger i refusjonssaker i større grad gir utrykk for usikkerheten knyttet til konklusjonene i den enkelte utredning.
15.5 Opptak av nye legemidler gjennom endringer innenfor legemiddelbudsjettet
Det har vært fremmet forslag basert på at prisreduksjonen som skjer når et legemiddel går av patent, kan skape rom for å ta opp flere nye legemidler på blå resept. Et annet alternativ er at nye legemidler kan innvilges refusjon ved at eldre, mindre kostnadseffektive legemilder fjernes fra ordningen.
Det er få eksempler på at nye legemidler både er billigere og bedre enn eldre. I slike tilfeller vil det oftest kunne innvilges refusjon innenfor de fullmakter som er gitt Statens legemiddelverk, se avsnitt 15.1. I de fleste tilfelle er imidlertid situasjonen at et nytt legemiddel kan være noe bedre, men dyrere enn eksisterende behandling. Selv om det er knyttet en kostnad til et opptak, kan legemidlet likevel anses som kostnadseffektivt dersom ekstrakostnaden vurderes å stå i et rimelig forhold til nytten. Opptak av slike legemidler i refusjonsordningen innebærer derfor en prioritering av legemidlet fremfor andre helsetiltak.
Eldre legemidler vil ofte ha et lite salg, og det vil derfor normalt være lite å spare på å fjerne disse fra refusjon.
Et annet spørsmål er om frigjorte midler i forbindelse med at eldre legemidler går av patent skal knyttes direkte til opptak av nye legemidler. En avgjørende innvending mot dette forslaget er at det ikke legger til rette for gode overordnede prioriteringer. Ressurser som frigjøres fra folketrygden, må kunne prioriteres opp mot annen anvendelse, uten å være bundet til bruk på legemidler. Dette er situasjonen på alle andre budsjettområder. Etter departementets syn bør den overordnede prioriteringen av opptak av nye legemidler derfor skje uavhengig av kostnadsreduksjoner knyttet til legemidler som allerede er omfattet av ordningen.
15.6 Midlertidig refusjon
Legemiddelindustriforeningen og Funksjonshemmedes Fellesorganisasjon har foreslått at legemidler må kunne tas opp på blå resept midlertidig med betingelse om at utdypende dokumentasjon leveres innen en fastsatt frist. Dersom legemiddelprodusenten ikke oppfyller kravene til dokumentasjon innen fristen, vil legemidlet ikke lenger ha rett til forhåndsgodkjent refusjon. Ordningen omtales derfor som midlertidig refusjon, og vil etter forslagsstillernes mening være et virkemiddel for raskere tilgang til nye legemidler gjennom den forhåndsgodkjente ordningen. Bakgrunnen for forslaget er at dokumentasjonen er begrenset når en legemiddelprodusent søker om refusjon for et nytt legemiddel. Krav om fullgod dokumentasjon vil ifølge foreningene innebære en unødvendig utsettelse av refusjonsrett for pasientene.
Dersom målsettingen om raskere adgang til nye legemidler på blå resept skal oppnås, må det også innebære at kravene til det første opptaket på blåreseptordningen reduseres. Vedtak om refusjon for de legemidlene som oppfyller de faglige kravene, kan trolig ikke gjøres så mye raskere enn i dag. Det er derfor bare et potensial for raskere opptak for de legemidlene som etter dagens praksis ikke oppfyller de faglige vilkårene. Under slike forutsetninger vil flere legemidler innvilges refusjon før tilstrekkelig dokumentasjon er gitt. Etter departementets vurdering må en beslutning om refusjon av legemidler baseres på den kunnskapen om effekt, bivirkninger og kostnads-effektforhold som er tilgjengelig på tidspunktet for behandlingen av refusjonssøknaden. Det vil fremstå som en uthuling av refusjonssystemet, dersom refusjon innvilges under forutsetning av at dokumentasjon med varierende grad av sikkerhet kan fremskaffes i fremtiden.
Erfaring viser også at legemidler som er gitt refusjon, kan være vanskelige å fjerne hvis det senere viser seg at dokumentasjonen ikke er tilfredsstillende. Forhåndsgodkjent refusjon er ofte en forutsetning for omfattende bruk. Det kan i enkelte tilfelle reises tvil om et legemiddels effekt og bivirkninger i refusjonssammenheng. Dersom legemiddelmyndighetene vurderer det slik at usikkerheten er for høy, bør det være mulig å avslå refusjon i påvente av mer dokumentasjon.
Departementet vil på denne bakgrunn ikke åpne for midlertidig refusjon i den betydning at opptakskriteriene reduseres i en prøveperiode.
Av legemidddelforskriften § 14–24 fremgår det at vedtaket om refusjon kan gjøres betinget av at ytterligere dokumentasjon om legemidlet gjøres tilgjengelig innen en bestemt tidsperiode. Dette gjelder imidlertid bare under forutsetning av at den tilgjengelige dokumentasjonen anses tilfredsstillende for opptak i refusjonsordningen. Det kan i slike tilfeller være behov for å belyse sikkerhetsspørsmål grundigere eller få bekreftet velfunderte hypoteser om legemidlets effekt. Slik dokumentasjon kan pålegges fremlagt to eller tre år etter at refusjon innvilges. Mangel på dokumentasjon vil kunne føre til endring av refusjonsvilkårene eller bortfall av refusjon. Dette praktiseres i en viss utstrekning i Sverige og har også vært brukt i Norge. Departementet vil be Statens legemiddelverk om å rutinemessig vurdere behovet for å stille som vilkår for fortsatt refusjon for et legemiddel, at ytterligere dokumentasjon av usikre forhold gis i løpet av en nærmere bestemt periode. Dette vil være et supplement til en videreføring av dagens faglige opptakskrav.
15.7 Bruk av vilkår for refusjon
15.7.1 Behovet for vilkår
Beslutning om refusjon av utgifter til legemidler må baseres på den kunnskap om legemidlets effekt og bivirkninger som er dokumentert i kliniske studier. Pasienter med samme lidelse vil kunne ha ulik nytte av et legemiddel. For kolesterolsenkende legemidler er for eksempel nytten avhengig av pasientens risikofaktorer for fremtidig sykdom.
Når det fastsettes vilkår for hvilke pasienter som skal få forhåndsgodkjent refusjon, er det på grunn av følgende årsaker:
Refusjonen målrettes til de gruppene av pasienter som tilfredsstiller krav til dokumentert effekt, og der effekten står i et rimelig forhold til kostnadene.
Pasientene får raskere og enklere tilgang til legemidler fordi legen får ansvar for å kontrollere at pasienten har rett til refusjon.
Den mulighet man har for å målrette refusjon gjennom vilkår, varierer mellom legemidler. For noen legemidler kan det fastsettes klare og kontrollerbare vilkår. For andre legemidler er vilkårene mer generelle, og vurderingen av om pasientene tilfredsstiller disse er langt på vei en vurdering legen må gjøre, basert på klinisk skjønn.
15.7.2 Oppdatering av vilkår
Departementet vil legge til rette for at Statens legemiddelverk kan utarbeide mest mulig konkrete og kontrollerbare refusjonsvilkår for de fleste av legemidlene som gis forhåndsgodkjent refusjon. Vilkårene for refusjon må ta hensyn til legemidlets effekt, sikkerhet og kostnadseffektivitet. Eksempler på vilkår kan være egenskaper ved pasienten, at annet legemiddel skal være forsøkt først, at legemiddelbehandlingen skal startes av spesialist eller at andre legemidler ikke gir tilstrekkelig effekt.
Etter at et legemiddel er gitt refusjon, vil det ofte komme studier som sammenligner legemidlet med annen relevant behandling og studier som viser langtidseffekter eller legemidlets effekt i klinisk hverdag. Dette kan gi ny kunnskap om legemidlet og kan ha betydning for de vilkårene som er stilt for refusjon. Kunnskap om legemidlets konsekvenser for ressursbruk i helsetjenesten og pasientenes livskvalitet bygges gradvis opp. Det kan også komme nye legemidler som endrer eldre legemidlers plass i behandlingen, prisene på konkurrerende legemidler kan falle som følge av at de går av patent og andre behandlingsmåter kan komme istedet for bruk av legemidler. Vilkårene som er gitt for refusjon må derfor oppdateres regelmessig.
Refusjonsstatus til legemidler som har fått innvilget forhåndsgodkjent refusjon, har hittil i svært liten grad blitt revurdert. Det kan derfor oppstå et ubegrunnet gap mellom den forskrivningen som tilfredsstiller gjeldende vilkår for refusjon, og den forskrivning som er riktig ut fra oppdatert kunnskap. I Statskonsults rapport «Informasjon og kontroll i blåreseptordningen» fra april 2004 fremgår det at leger oppfatter flere av refusjonsvilkårene som lite relevante og faglig foreldede. Et eksempel er refusjonsvilkårene for kolesterolsenkende legemidler som ble gitt i 1994 og som fremdeles er gjeldende. Det synes klart at de kriteriene som ble satt ut fra den kunnskap man da hadde om effekten av disse legemidlene, ikke er i overensstemmelse med det som nå er allment akseptert kunnskap. Det er derfor behov for en kontinuerlig oppdatering av refusjonsvilkårene for å oppnå den nødvendige legitimitet, etterlevelse og oppfølging fra myndighetenes side med informasjon og kontroll av forskrivningen. Kontinuerlig vurdering av refusjonsstatus og tydelig utformede vilkår er også en forutsetning for å kunne overføre flere legemidler fra individuell refusjon til forhåndsgodkjenning, se avsnitt 16.2.
Departementet vil gi Statens legemiddelverk i oppdrag å legge opp til en kontinuerlig vurdering av legemidlers refusjonsstatus på viktige terapiområder. En slik vurdering av det første terapiområdet skal skje så snart planleggingsarbeidet tillater det. Arbeidet må gjennomføres i samarbeid med andre etater og berørte aktører. Nasjonalt kunnskapssenter for helsetjenesten vil kunne oppsummere tilgjengelig kunnskap til bruk ved Statens legemiddelverks vurdering av refusjonsvilkår. Rikstrygdeverket bør gi råd om hvordan utformingen av vilkårene best mulig kan tilpasses kontroll av etterlevelse. Forslag til endringer av refusjonsvilkår sendes på høring til berørte parter på en måte som sikrer at saken blir tilstrekkelig belyst. Det vil være behov for informasjonstiltak overfor leger og pasienter i forbindelse med at vilkår endres.
En slik oppdateringsprosess vil introdusere et klart dynamisk element i refusjonsordningen. Legemidler som etter en gjennomgang ikke lenger forsvarer sin plass i refusjonssystemet, vil kunne fjernes fra forhåndsgodkjent refusjon, mens andre legemidler kan få nye vilkår som enten øker eller reduserer det antall pasienter som har rett til refusjon.
I Sverige og Danmark er myndighetene i ferd med å planlegge en systematisk gjennomgang av alle refunderte legemidler for å oppdatere vilkårene for refusjon, se boks 15.1. De faglige vurderingene som gjøres av disse landenes myndigheter, vil også måtte gjøres i Norge. Nordisk samarbeid på dette området vil kunne gi en mer effektiv bruk av ressursene og raskere gjennomgang av de viktige områdene. Det kan også resultere i større gjennomslagskraft og aksept for resultatene. Departementet vil ta initiativ til et nordisk samarbeid om kontinuerlig oppdatering av refusjonsvilkår for legemidler.
Boks 15.13 Oppdatering av refusjonsvilkår i Sverige
I Sverige er det besluttet å revurdere legemidler som fikk refusjon før dagens krav til kostnadseffektivitet ble innført. Det er definert 49 terapeutiske grupper, og rekkefølgen for revurderingen bestemmes av salgsverdi i 2003. Gjennomgangen begynner med legemidler mot syrerelaterte problemer og migrene, og fortsetter så med høyt blodtrykk, fulgt av astma, depresjon og høyt kolesterol. Det vil trolig ta noen år før alle legemidlene er vurdert som planlagt. Saksgangen består av to faser. I en kartleggingsfase vil det opprettes en prosjektgruppe for hvert terapiområde. Berørte firma vil bli bedt om å sende inn opplysninger, og prosjektgruppen gjennomgår medisinsk litteratur systematisk. Man vil også rådføre seg med eksterne eksperter. Denne fasen avsluttes med en vurdering av om hele terapigruppen fortsatt skal ha refusjon eller om det er grunnlag for å vurdere enkelte legemidler nærmere. Hvis det er usikkerhet om ett eller flere av legemidlene i gruppen er refusjonsverdige, vil man gå over i beslutningsfasen. Hvert enkelt legemiddel vil utredes i større detalj og ytterligere spørsmål stilles til firmaene. Det vil bli laget en rapport til Läkemedelsförmånsnemnden. Firmaene og landstingene får uttale seg om dette. Nemnden fatter så en beslutning.
15.8 Informasjon om vilkårene for forhåndsgodkjent refusjon
Utviklingen mot et mer målrettet refusjonssystem basert på presise vilkår stiller krav til informasjon både til pasienter og leger. Etterlevelse krever en klar og tydelig kommunikasjon av vilkårene for refusjon. Informasjon om hvilke legemidler som refunderes for hvilke sykdommer og etter hvilke vilkår, finnes i dag tilgjengelig blant annet i Norsk Legemiddelhåndbok, i Felleskatalogen og på Statens legemiddelverks hjemmeside. Det forutsettes at legen er klar over at det finnes refusjonsvilkår og aktivt oppsøker informasjon om disse. Dette er en del av legens plikt til selv å holde seg oppdatert om regelverket.
Statskonsult har på oppdrag fra departementet i 2004 gjennomført undersøkelsen «Informasjon og kontroll i blåreseptordningen» som omhandler etterlevelse av vilkårene for forskrivning av legemidler på blå resept. Undersøkelsen konkluderer med at det er behov for bedre informasjon om endringer og praktiseringen av regelverket for å kunne oppnå riktigere forskrivning.
Legenes elektroniske journalssystemer har en sentral plass i forskriverens hverdag og inneholder mye informasjon som legene baserer sine beslutninger på. Refusjonsvilkårene har i noen grad vært integrert i legenes journalsystem, men dette har ikke vært lagt opp systematisk nok fra myndighetenes side. Informasjon om, og kontroll av, riktig forskrivning kan i langt større grad enn i dag automatiseres ved at legen elektronisk bekrefter at vilkårene for refusjon er oppfylt. Inntil nylig kunne disse systemene ikke knyttes opp mot eksterne nettverk av sikkerhetsmessige årsaker. Dette har gjort det vanskelig å gi oppdatert og aktuell informasjon inn til legens elektroniske arbeidsverktøy.
Kommunikasjonsløsningen Nasjonalt helsenett er nå etablert, noe som gir nye muligheter for oppdateringer. Med den planlagte innføringen av elektroniske resepter vil reseptinformasjon kunne overføres elektronisk fra forskriver til apotek og trygdeetaten. Elektroniske resepter skal kombineres med at forskriver får tilgang til anbefalinger om riktig legemiddelbruk og refusjonsvilkår i sitt journalsystem. Departementet vil også utvikle en løsning for elektronisk bekreftelse av refusjonsvilkår i forbindelse med innføringen av elektroniske resepter. Et entydig regelverk er en forutsetning for en slik løsning.
Statskonsult anbefaler i sin rapport at trygdeetaten legger sterkere vekt på å formidle informasjon om praktisering av blåreseptordningen. Departementet vil gi Rikstrygdeverket og Statens legemiddelverk i oppdrag å foreta en fornyet vurdering av hvordan særlig refusjonsvilkår og endringer i regelverket kan formidles på en hensiktsmessig måte til forskrivende lege frem til elektroniske resepter og forskrivningsstøttesystemer er etablert.
Legemiddelindustrien driver en utstrakt markedsføring av legemidler overfor leger. Legemiddelfirmaene har uttalt at de vil informere bedre om refusjonsvilkårene, og det har i det senere vært gode eksempler på at dette gjøres. Statens legemiddelverk har utviklet konkrete krav til hvordan vilkårene skal presenteres i reklame og informasjon fra legemiddelleverandørene. Et forslag til forskriftsendringer om dette vil sendes på ordinær høring. Inngåelse av refusjonskontrakter etter legemiddelloven § 6 mellom staten og legemiddelfirma åpner også for at produsentene får et ansvar for at refusjonsvilkårene etterleves. Dette kan bidra til å gjøre informasjon om refusjonsvilkår bedre tilgjengelig for legen.
I kapittel 6 omtales en bedret organisering av offentlig legemiddelinformasjon til leger og pasienter, tilbakemelding på legens egen forskrivningspraksis, bedre tilrettelagt utdanning og større åpenhet rundt legenes forhold til legemiddelindustrien. Tiltak på disse områdene vil også kunne bidra til en bedre etterlevelse av bestemmelsene i refusjonssystemet.
15.9 Oppfølging av om forskrivning er i tråd med refusjonsvilkårene
Statskonsults rapport behandler spørsmålet om i hvilken grad vilkårene for forskrivning av legemidler på blå resept etterleves, og hvorfor dette eventuelt ikke skjer. De spurte legene ga uttrykk for at de som oftest følger regelverket for utstedelse av blåresept, men oppgir foreldede vilkår, mangel på spesialister og hensynet til pasienten som hovedårsak til at brudd forekommer. En av syv leger opplyste at de i stor grad opplevde press fra pasientene for å forskrive legemidler på blå resept. En stor andel av apotekansatte har inntrykk av at legene i stor eller svært stor grad forskriver dyrere legemiddelbehandling enn nødvendig.
Rikstrygdeverket er delegert forvaltningsansvaret for blåreseptordningen, fra forskrivning av resept hos legen til det økonomiske oppgjøret med apotek. En spørreundersøkelse utført av Statskonsult viser at ett av fem oppgjørskontor aldri foretar kontroller av forskrivningen på blå resept, og halvparten av kontorene foretar slik kontroll i svært liten grad.
I St.prp. nr. 1 (2003-2004) ble det bevilget 9 millioner kroner for å øke kontrollen med legenes etterlevelse av refusjonsvilkårene. Rikstrygdeverket har startet et prosjekt der man gjennom stikkprøver går inn i pasientjournaler hos legen for å kontrollere at pasienten har rett til refusjon. Informasjon om kontrollene og regelverket skal gis til legene både før kontrollene starter og i oppfølgingsfasen. Dette er viktig for å gi legene bedre anledning til å lære av de eventuelle feilene som finnes ved undersøkelsene. Metoden er prøvd ut i et pilotprosjekt der resultatene forelå i begynnelsen av 2004, og dette kontrollarbeidet ble videreført i samarbeid med de seks regionoppgjørskontorene i 2004. Alle landets leger fikk tilsendt brev med informasjon om kontrollarbeidet, kanaler for tilbakemeldinger fra publikum ble opprettet og trygdeetaten gjennomførte en omfattende annonsekampanje rettet mot legene og pasientene. Ved hver kontroll ble det plukket ut 100 resepter fra hver oppgjørsregion, som tilfredsstilte bestemte kriterier. Legene som hadde forskrevet resepten, ble bedt om å sende inn journalopplysninger for kontroll.
På oppdrag fra Rikstrygdeverket gjennomførte MMI i november 2004 en spørreundersøkelse blant 1500 leger. Formålet var å undersøke legenes kunnskaper om kontrolltiltaket og blåreseptordningen. Seks av ti leger mener at deres kunnskap om refusjonssystemet har økt i løpet av det siste året. Informasjonstiltakene har ifølge 37 prosent av allmennleger og privatpraktiserende spesialister ført til endret forskrivningspraksis. Til sammenligning har bare om lag 10 prosent av legene til nå sendt inn journalopplysninger til trygdeetaten for kontroll. Halvparten av legene er helt eller delvis enige i at kontrollene vil medføre reduserte utgifter for folketrygden.
Det foreligger per desember 2004 resultater for over 1300 resepter fordelt på tre kontroller. To av kontrollene omfattet legemidler til behandling av spiserørsbetennelse, mens den tredje kontrollen omfattet legemidler til behandling av epilepsi. Dette utvalget dekker kun en begrenset del av legenes forskrivning på blå resept. Områdene ble plukket ut fordi det av ulike årsaker var mistanke om feil forskrivning. Legemidler til behandling av spiserørsbetennelse er også blant de mest omsatte.
De to kontrollene av legemidler til behandling av spiserørsbetennelse ble foretatt med et halvt års mellomrom, med omtrent samme resultat. Her presenteres derfor kun den siste av disse to kontrollene. På grunn av manglende eller mangelfull dokumentasjon fra mange av legene som inngikk i kontrollene, var det bare mulig å ta stilling til om det forelå brudd på refusjonsvilkårene eller ikke i om lag to tredeler av sakene. Andelen brudd og etterlevelse var omtrent like stor. Se figur 15.2. Hyppigst forekommende brudd var at diagnosen i journalen ikke samsvarte med sykdomspunktet i blåreseptforskriften, det vil si at pasienten i virkeligheten ikke hadde den lidelsen som det aktuelle legemidlet kunne refunderes for.
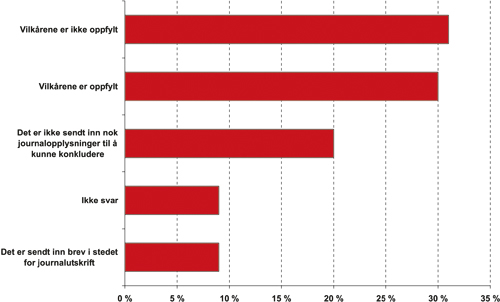
Figur 15.2 Resultat av kontroll av forskrivning av legemidler mot spiserørsbetennelse mars 2004
Kilde: Rikstrygdeverket, 2004
Ved kontrollen av resepter for legemidler til bruk ved epilepsi var det mulig å konkludere i om lag tre firedeler av sakene. Andelen brudd var over fem ganger så høy som andelen av etterlevelse. Se figur 15.3. Også her var det hyppigste bruddet at pasienten viste seg å ha en annen lidelse enn den som var godkjent for refusjon. Den høye forekomsten av brudd skyldes antakelig at det aktuelle legemidlet også brukes ved andre sykdommer enn epilepsi. Legene oppga epilepsipunktet i sykdomslisten, selv om pasienten hadde en annen lidelse. Andre brudd var at behandlingen ikke var startet av spesialist og at behandlingen ikke var langvarig.
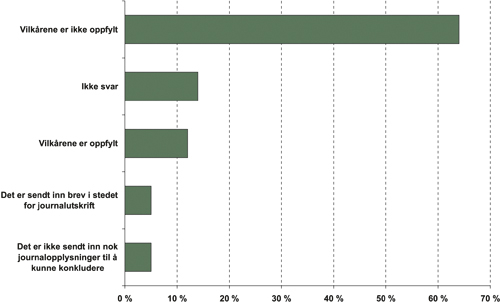
Figur 15.3 Resultat av kontroll av forskrivning av gabapentin mot epilepsi i april 2004
Kilde: Rikstrygdeverket, 2004
Rikstrygdeverket har på de utvalgte områdene avdekket mange brudd på de reglene som er gitt for forhåndsgodkjent refusjon. Departementet ser alvorlig på dette og vil intensivere kontrollen med riktig forskrivning på blå resept. Statens legemiddelverk vil lede et arbeid med å oppdatere legemidlenes refusjonsvilkår, slik at disse fremstår som relevante og kontrollerbare, se avsnitt 15.5. Et viktig element i trygdeetatens tilnærming til undersøkelsene har vært å informere legene om regelverket i forkant av kontrollene. Dette arbeidet må videreføres og suppleres med en økt satsing på informasjon om refusjonsvilkårene til legene. Departementet har gitt Rikstrygdeverket i oppdrag å videreføre den informasjons- og kontrollmetodikken som er utviklet, og implementere et kontrollsystem som omfatter de fleste legemidler som refunderes. Seks selvstendige regionale enheter er planlagt å være i virksomhet fra 1. januar 2006. Disse enhetene vil tilrettelegge kontrollene for lokale forhold, men vil også delta i nasjonale undersøkelser på bestemte terapiområder.
Statens legemiddelverk vil videre styrke sin satsning på informasjon om refusjonsvilkårene, se punkt 5.4.3.
Informasjons- og kontrolltiltak bør målrettes til områder hvor det er mistanke om manglende etterlevelse av refusjonsvilkårene. Arbeidet vil løpende kunne avdekke svakheter i refusjonsvilkårene som kan tilsi at Statens legemiddelverk foretar en gjennomgang av bestemte refusjonsvilkår. Denne oppgaven vil kreve et nært samarbeid mellom Rikstrygdeverket og Statens legemiddelverk.
Eresept prosjektet vil kunne lette arbeidet med kontroll av forskrivningen på blå resept. Dagens kontroller er basert på papirbaserte resepter, noe som er tungvint å håndtere. Dersom alle refunderte resepter foreligger elektronisk, vil det bli mye lettere å velge ut, oversende og kontrollere reseptene. Det er også en fordel at legene har regelverket implementert elektronisk i sine journalsystemer. Dersom forskrivers bekreftelse på at pasienten oppfyller refusjonsvilkårene lagres elektronisk sammen med pasientens journal, kan dette gjøres på et format som er mest mulig egnet for enkel etterkontroll fra Rikstrygdeverkets side. Slike kontrolltiltak vil kunne stimulere til etterlevelse av refusjonsvilkårene. Ved hjelp av generell statistikk fra det nylig etablerte reseptbaserte legemiddelregisteret vil man få indikasjoner på hvilke terapiområder som er mest aktuelle for kontrolltiltak.
Dersom trygdeetaten avdekker at en lege har skrevet ut legemidler på folketrygdens regning i strid med refusjonsvilkårene, kan Rikstrygdeverket bestemme at det ikke skal ytes godtgjørelse for behandling eller tjenester som vedkommende utfører, jf folketrygdloven § 25–6. Dette er imidlertid en reaksjonsform som vil være forbeholdt vesentlige eller gjentatte brudd på regelverket. Det synes å være behov for et bredere spekter av sanksjonsmuligheter, som kan åpne for en mer fleksibel håndhevelse fra myndighetenes side. Departementet vil gi Rikstrygdeverket i oppdrag å utrede muligheten for å innføre også andre reaksjonsformer overfor leger som bryter med forskrivningsreglene, herunder økonomiske sanksjoner. Innspill fra Legeforeningen bør innhentes i en tidlig fase av dette arbeidet.
15.10 Forenkling og forbedring av regelverket
Statskonsults rapport «Informasjon og kontroll i blåreseptordningen» fra april 2004 peker på at refusjonssystemet er komplisert, og at det er behov for en opprydding i regelverket. Refusjonsvilkårene må være så konkrete som mulige, slik at forskrivningen på en enkel måte kan etterleves av legene og følges opp av myndighetene. Mange av sykdomspunktene og legemiddelgruppene i blåreseptforskriften § 9 er i dag for generelt utformet, slik at det kan oppstå tvil om legemidler uten refusjon likevel kan refunderes. Det er også et problem at enkelte refusjonsvilkår er formulert som «bør»-bestemmelser. Av hensyn til medisinske, kontrollmessige og statistiske formål bør regelverket på disse punktene tydeliggjøres og oppdateres. Enkelte sykdomsområder er bedre egnet til dette enn andre. Statens legemiddelverk skal videreføre arbeidet med å presisere vilkårene, og gjennomgå sykdomslisten og preparatlisten med tanke på forenklinger. Preparatlisten skal gjøres bedre tilgjengelig og mer anvendelig, blant annet ved at legen kan ta utgangspunkt både i legemiddel og lidelse for å finne frem til hvilke refusjonsmuligheter som gjelder.
Departementet vil også som et ledd i forenklingen av refusjonssystemet foreta en gjennomgang av blåreseptforskriften. I den sammenheng vil departementet vurdere å samle dagens ordninger for forhåndsgodkjent refusjon i én ordning. Dette vil ikke ha økonomiske konsekvenser, men kan gi en mer oversiktlig ordning for leger og apotek.
15.11 Mulighetene ved terapeutisk likeverdighet
15.11.1 Teraputisk likeverdighet
For de fleste diagnoser er flere ulike legemidler tilgjengelige i behandlingen. Hvilke legemidler som brukes mest, varierer fra lege til lege. Såkalte generiske legemidler er legemidler med samme virkestoff, men produsert av ulike firma. Virkemåten for disse legemidlene er den samme, og de er i hovedsak fullt byttbare.
Legemidler som har ulike virkemåter og virkestoff, kan imidlertid også regnes som likeverdige, dersom det ut fra vitenskapelig dokumentasjon ikke er grunnlag for å tro at effekt og bivirkninger vil være vesentlig forskjellige. Slike legemidler omtales som terapeutisk likeverdige legemidler, fordi de hos et flertall kan brukes til å behandle samme lidelse og gi samme forventede helseeffekt. Enkelte pasienter vil imidlertid kunne oppleve at effekt og toleranse varierer mellom ulike terapeutisk likeverdige legemidler. Det er vanligvis ikke mulig å vite hvilke pasienter dette gjelder før behandlingen har vært prøvet.
Vesentlige prisforskjeller oppstår typisk mellom legemidler med terapeutisk likeverdig effekt når et av flere konkurrerende legemidler mister patentbeskyttelsen, se boks 15.2. Prisen for virkestoffet som har mistet patentbeskyttelsen, vil reduseres, mens prisen på likeverdige legemidler med patent opprettholdes. Markedsføringsinnsatsen for et legemiddel trappes som regel ned når patentet utløper. Riksrevisjonen konkluderte i sin rapport, 2004: 1 «Riksrevisjonens undersøkelse av refusjon av utgifter til legemidler på blå resept», med at utbetalingene til refusjon er betydelig større enn nødvendig, fordi det forskrives dyre legemidler i stedet for billigere, likeverdige alternativer. Konklusjonene er basert på medisinsk ekspertises vurderinger av forskrivningen på utvalgte terapiområder og observerte prisforskjeller fra apotek.
Boks 15.14 Prisforskjeller på kolesterolsenkende legemidler
De kolesterolsenkende legemidlenes (statinenes) effekt og bivirkninger er godt dokumentert. Simvastatin har vært markedsledende og hadde tidligere en pris tilsvarende de øvrige virkestoffene, men prisen er nylig betydelig redusert som en følge av at patenttiden er utløpt. Årlig kostnad for de de to mest omsatte statinene utgjør ca. 1700 kroner for simvastatin 40 mg og ca. 4800 kroner for atorvastatin 20 mg. Antall pasienter som bruker simvastatin har det siste året økt fra 110 000 til 112 000, mens pasi-enter som bruker atorvastatin er økt fra 96 000 til 108 000. Se figur 15.4.
Årsaken til at det vesentlig dyrere legemidlet atorvastatin (Lipitor) har hatt fremgang til tross for at den tidligere markedslederen har fått betydelig redusert pris, er trolig ulik markedsføringsaktivitet. Det er grunn til å anta at markedsføringsaktivitetene for simvastatin er redusert, som følge av at det har gått av patent, i motsetning til aktiviteten for det patenterte atorvastatin.
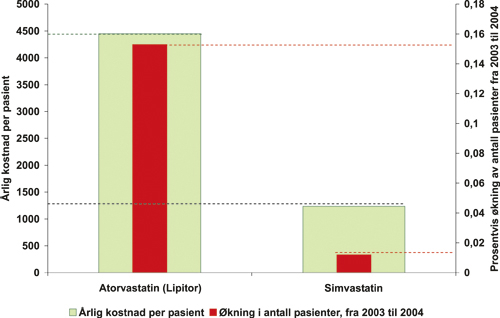
Figur 15.4 Figur 15.4 Pasientøkning og kostnader for statiner
For å sikre faglig og økonomisk riktig bruk innen grupper av terapeutisk likeverdige legemidler, er det viktig å stimulere til bruk av det rimeligste alternativet, samtidig som det åpnes for å kunne gjøre unntak for pasienter med spesielle behov. Det vil kunne stimuleres til riktigere bruk av terapeutisk likeverdige legemidler ved å innføre et terapeutisk referanseprissystem eller en ordning hvor ett eller flere legemidler skal være førstevalg (foretrukket legemiddel).
15.11.2 Terapeutisk referansepris
I et terapeutisk referanseprissystem samles alle legemiddelpakninger som regnes for terapeutisk likeverdige i en gruppe. Det defineres en referansepris for disse legemidlene, som regel laveste pris i gruppen, som er det beløpet trygden refunderer uansett valg av legemiddel. Pasienten må betale mellomlegget dersom et legemiddel med høyere pris enn referansepris foretrekkes etter pasientens ønske. Legen kan imidlertid gjøre unntak dersom det foreligger medisinske årsaker, slik at pasienten ikke påføres en merutgift.
For å kunne fastsette en referansepris må det defineres hvilke legemidler og hvilken styrke som skal inkluderes i en gruppe, samt hvilke doser som skal regnes som likeverdige mellom de ulike legemidlene.
Referansepris er i utgangspunktet et tiltak som er utviklet for å stimulere til reduserte priser innenfor generiske (byttbare) legemiddelgrupper, hvor gruppering, likeverdige doser og bruksområde som regel er ukomplisert. Terapeutisk likeverdige legemidler gir andre forutsetninger. Her vil målsettingen være å stimulere til medisinskfaglig og økonomisk riktig valg av legemiddel. For terapeutisk likeverdige legemidler finnes det sjelden dokumentasjon som entydig kan underbygge hvilke doser som er ekvivalente (gir samme effekt) og som dermed kan gi grunnlag for nøyaktige prisberegninger. I tillegg vil flere av legemidlene i en behandlingsgruppe også kunne brukes til behandling av andre lidelser. Dette kan føre til konkurransevridninger på andre behandlingsområder som referanseprissystemet ikke tilsikter. Et eksempel er beta-blokkere til blodtrykksbehandling som også har en rekke andre indikasjoner (blant annet hjertesvikt og migrene) som kan skille seg fra andre blodtrykkslegemidler. Internasjonale erfaringer, blant annet fra Tyskland, viser at innføring av terapeutiske referanseprissystemer kan skape store uenigheter mellom aktørene.
Det finnes noe erfaring fra ordninger med terapeutiske referansepris i andre land, se boks 15.3.
Boks 15.15 Terapeutisk referanseprissystem i andre land
Nederland etablerte i 1991 et referanseprissystem for legemidler som ansees som terapeutisk likeverdige. I den canadiske provinsen British Columbia ble terapeutisk referansepris innført i 1995 og omfatter i dag fem legemiddelgrupper.
Tyskland innførte referansepriser for enkelte terapeutisk likeverdige legemidler fra 1. januar 2005. Det er opprettet fire referansegrupper knyttet til protonpumpehemmere, sartaner, triptaner og statiner. Det er forventet at tiltaket skal redusere utgiftene med ca. 16 prosent. Det er planlagt ytterligere utvidelse av ordningen i 2005. Beregningsmetodene er kompliserte, og hver enkelt pris for en referansegruppe må sendes på høring. Det er oppstått stor uenighet mellom sykekassene og legemiddelindustrien blant annet om hvilke legemidler som representerer en stor nok forbedring til ikke å inkluderes i et referanseprissystem. En dom i EF-domstolen av 16. mars 2004 har bekreftet at terapeutisk referanseprising ikke er i strid med EU-retten.
15.11.3 Foretrukket legemiddel
I en ordning med foretrukket legemiddel fastsettes det hva som ut fra medisinskfaglige og økonomiske hensyn regnes som det riktige førstevalget innen et terapiområde. Det stilles som vilkår for refusjon at legen forskriver det foretrukne legemidlet, men legen kan gjøre unntak fra ordningen dersom det foreligger medisinske årsaker. Dersom pasienten utfra eget ønske vil ha et annet terapeutisk likeverdig legemiddel, må dette eventuelt skrives på hvit resept.
Ordningen forutsetter ikke at det må beregnes referansepriser, og det er derfor heller ikke nødvendig å fastsette hva som er nøyaktig ekvivalente doser. Av samme årsak vil det ikke være prinsipielt nødvendig å fastsette detaljerte lister over hvilke legemidler og legemiddelpakninger som inngår i ordningen.
Ordningen vil kunne tilpasses de ulike behandlingsområdenes særegenheter ved bruk av ulike refusjonsvilkår. På enkelte terapiområder kan det for eksempel være riktig at alle pasientene bør bytte til ett bestemt legemiddel, mens det i andre tilfeller bør begrenses til at bare nye pasienter starter med det foretrukne legemidlet.
15.11.4 Departementets vurdering
Et system basert på foretrukket legemiddel synes å ha en rekke fordeler sammenlignet med et terapeutisk referanseprissystem. Hovedforskjellen er at det verken vil være nødvendig å beregne referansepriser eller å gi en uttømmende liste over hvilke legemidler som er omfattet av ordningen. Dette vil gi en prioritering av riktig legemiddelbruk som er langt mindre administrativt krevende for myndigheter, leger og apotek enn et referanseprissystem. Erfaringer fra det tyske referanseprissystemet for terapeutisk likeverdige legemidler tyder på at det er store utfordringer knyttet til å finne medisinsk ekvivalente doser og riktige sammenligningsgrunnlag. Ved å bruke en løsning med foretrukket legemiddel vil disse spørsmålene ikke være aktuelle i samme grad. En fordel med å utpeke ett eller flere legemidler som førstevalg, er at vilkårene bedre kan tilpasses de behovene som finnes på de forskjellige terapiområdene. Dette gir en nødvendig fleksibilitet i valg av løsninger. Etterlevelse av ordningen vil kunne kontrolleres i legenes journal.
Forskjeller mellom tiltakene er oppsummert i tabell 15.3.
Tabell 15.3 Sammenligning av terapeutisk referansepris og en ordning med foretrukket legemiddel
| Foretrukket legemiddel | Terapeutisk referanseprissystem | |
|---|---|---|
| 1. Bestemmelse av referansepris | Ikke nødvendig å beregne en referansepris. Folketrygden refunderer legemidlets vanlige pris, med ordinær egenandel. | For hver pakning av et legemiddel må det fastsettes en referansepris, basert på sammenlignbare styrker og doseringer. |
| 2. Oppdatering av systemet | Det er sjelden behov for å oppdatere systemet. Anbefalt produkt kan endres når viktige forutsetninger endres. (F.eks. når legemidler går av patent). | Referanseprisen må oppdateres løpende basert på prisendringer. Prisforskjeller mellom apotek kan vanskeliggjøre et oppdatert og oversiktlig system. |
| 3. Administrativt arbeide | Ikke ekstraarbeid for apotekeneLiten administrativ belastning for myndighetene. | Apotekene må beregne eventuell egenbetaling og kreve dette inn fra pasientene.Stor administrativt arbeid for myndighetene. |
| 4. Faglige styringssignaler | Helsemyndighetene kan gi faglige styringssignaler ved å avgjøre hvilke legemidler som foretrekkes.Vil oppfattes som faglig begrunnet. | Det er vanskeligere med faglige tilpasninger, ettersom systemet fremmer det billigste legemidlet.Vil kunne oppfattes som faglig kontroversielt. |
En ordning med foretrukket legemiddel vil gjøre det mulig å redusere legemiddelutgiftene til terapeutisk likeverdige legemidler, samtidig som hensynet til pasientene ivaretas på en god måte. Fordelene ved å ta i bruk en løsning med foretrukne legemidler fremstår som større enn et referanseprissystem. Departementet legger vekt på at målsettingen om bruk av billigere likeverdige legemidler kan oppnås uten store administrative ressurser, med større grad av faglig konsensus og med en fleksibilitet som ikke referansepris gir.
Departementet vil på denne bakgrunn innføre en ordning med foretrukket legemiddel i de tilfellene det er faglig grunnlag for å fremme bruk av terapeutisk likeverdige legemidler. Generelt vil det være slik at når ett virkestoff innenfor et terapiområde får generisk konkurranse, vil dette føre til et betydelig prisfall. I denne forbindelse vil det være naturlig å vurdere om det er terapeutiske forskjeller mellom dette legemidlet og andre alternative legemidler for samme lidelse. Dersom en ordning med foretrukket legemiddel i enkelte legemiddelgrupper ikke medfører tilstrekkelig økt forskrivning av de billigere legemidlene, må departementet vurdere andre metoder for å oppnå det samme. Hva som regnes som tilstrekkelig forskrivning av billigere legemidler, må vurderes for hver enkelt legemiddelgruppe.
Statens legemiddelverk har sendt et forslag til innføring av foretrukket legemiddel for kolesterolsenkende behandling på høring. Det er foreslått at simvastatin skal være førstevalg. Legemiddelutgiftene kan reduseres uten at behandlingsresultatet for pasientene endres. Tiltaket vil kunne implementeres fra 1. juni 2005. Trygdeetaten vil følge opp systemet med kontroll, og en evaluering er planlagt.
Foruten kolesterolsenkende legemidler finnes det internasjonal erfaring med tiltak innen følgende grupper: Antihistaminer (mot allergi), protonpumpehemmere (mot magesår og halsbrann), NSAIDs (betennelsesdempende) og SSRI (antidepressiva). Departementet vil eventuelt komme tilbake til utvidet bruk av ordningen med foretrukket legemiddel i særskilt utredede enkeltsaker som sendes på høring. Departementet vil legge opp til et tett samarbeid med Legeforeningen i arbeidet med disse sakene.
Norge har i likhet med andre land behov for oversikt over hvilke legemidler som er terapeutisk likeverdige. Departementet vil søke internasjonalt samarbeid for å sikre at slike oversikter utvikles, er tilgjengelige og oppdateres.
Departementet har gjennom Statens legemiddelverk hatt på høring et forslag om innføring av klassepris for utvalgte legemidler. Hensikten med systemet var å begrense trygdens utgifter til terapeutisk likeverdige legemidler i de tilfelle der nye, videreutviklede legemidler ikke har fordeler sammenlignet med eldre versjoner av legemidlet. Høringsrunden avdekket imidlertid forhold som gjorde at Statens legemiddelverk frarådet at systemet ble innført som foreslått. Departementet vil arbeide videre med ordningen med foretrukket legemiddel i stedet for en ordning med klassepris for utvalgte legemidler.
16 Refusjon etter individuell søknad
16.1 Regelverket
Dersom et legemiddel ikke er innvilget forhåndsgodkjent refusjon etter § 9 i blåreseptforskriften, kan legen søke trygdeetaten om individuell refusjon etter § 2 eller § 10a. Bestemmelsen i § 10a gjelder legemidler som ikke er tatt opp på blåreseptlisten, når legemidlet brukes mot sykdommer som allerede er refusjonsberettiget. Bestemmelsen i § 2 kan brukes når en alvorlig sykdom ikke står nevnt i sykdomslisten – i praksis er dette tolket til å gjelde sjeldne sykdommer.
Den individuelle søknadsordningen skal, på lik linje med den forhåndsgodkjente ordningen, sikre pasientene tilgang til nødvendige legemidler. Forskjellen er først og fremst knyttet til at kontrollen med forskrivningen er lagt til trygdeetaten og ikke kun til den enkelte lege. Innvilgelsesvedtaket er normalt ikke tidsbegrenset, med mindre annet er spesifisert i vedtaket. Med noen få unntak kan alle legemidler søkes refundert gjennom de individuelle ordningene, men følgende krav må som hovedregel være oppfylt:
Pasienten har prøvd ett av de legemidlene som er forhåndsgodkjent, uten tilstrekkelig effekt eller med uakseptable bivirkninger (ved § 10a), eller pasienten har en alvorlig lidelse som utelukker bruk av forhåndsgodkjente legemidler.
Behandlingen skal være startet opp av spesialist, men allmennlege kan søke om refusjon.
Legemidler uten markedsføringstillatelse må søkes refundert av spesialist.
Legen må i søknaden begrunne pasientens behov for behandlingen.
Det er bare når «særlige grunner» taler for det at refusjon gis etter søknadsordningen. Dette fordrer en individuell vurdering av den enkelte pasients situasjon. For å forenkle saksbehandlingen i trygdeetaten, og for å fremme likebehandling, er det til enkelte jevnlig søkte legemidler utarbeidet grovmaskede retningslinjer for når refusjon skal gis eller avslås. Disse retningslinjene er tilgjengelige for innsyn på forespørsel. I saker der det ikke er utarbeidet retningslinjer, eller retningslinjene ikke fanger opp pasientens situasjon, skal sakene sendes til en rådgivende farmasøyt for en individuell vurdering. Pasienter som ikke oppfyller de grovmaskede retningslinjene, kan derfor også få refusjon.
Trygdeetaten mottok over 153 000 søknader om stønad for utgifter til legemidler i 2004, en økning fra 130 000 søknader i 2003. Disse tallene omfatter alle stønadsordningene, det vil si blåreseptforskriften §§ 2 og 10a, bidragsordningen, krigspensjonslovene og yrkesskadebestemmelsene. Ifølge Rikstrygdeverket ble det i 2004 innvilget om lag 68 000 søknader etter blåreseptforskriften §§ 2 og 10a. Antall totale avslag er ikke registrert. Rikstrygdeverket har imidlertid innhentet tall for fordelingen mellom innvilgelser og avslag i 2004 når det gjelder søknader om alfa-blokkerne Carduran og Sinalfa etter § 10a. Om lag 36 prosent av søknadene ble avslått. Behandlingen av disse søknadene er ikke nødvendigvis representativ for behandlingen av alle søknader om refusjon etter individuell søknad, men indikerer likevel at avslagsprosenten ved behandlingen kan være betydelig.
Det ble i 2003 innvilget refusjon på individuelt grunnlag for et beløp i størrelsesorden én milliard kroner. Søknadsbehandlingen tar normalt mellom én og tre måneder, og antall individuelle søknader har vært økende de senere årene. En meget stor andel av utgiftene til individuell refusjon av legemidler går til relativt små pasientgrupper, se tabell 16.1.
Tabell 16.1 Fordeling av omsetningen på individuell refusjon.
| Sykdom | Legemidler | Omsetning etter 10 mnd 2004 (millioner kr) | Andel av total omsetning |
|---|---|---|---|
| Revmatiske sykdommer | TNF-hemmere (Enbrel, Humira) | 262 | 28 prosent |
| Multippel sklerose | Interferon beta og glatiramer acetat | 129 | 14 prosent |
| Ernæringsmidler | 65 | 7 prosent | |
| Anemi hos nyresviktpasienter | Erytropoietin (Aranesp, NeoRecormon, Eprex) | 65 | 7 prosent |
| ADHD | Concerta, Strattera | 42 | 4 prosent |
| Enzymsykdommer (Gauchers, Fabry’s) | Cerezyme, Fabryzyme, Replagal | 37 | 4 prosent |
| Koagulasjonsfaktorer | 36 | 4 prosent | |
| Leukemi | Glivec | 31 | 3 prosent |
| Kreft (styrke immunforsvar hos pasienter som får cellegift) | Neupogen, Neulasta | 26 | 3 prosent |
| Minske risiko for blodpropp | Plavix | 24 | 3 prosent |
| KOLS | Spiriva | 22 | 2 prosent |
| Pulmonell arteriell hypertensjon | Tracleer, Flolan | 19 | 2 prosent |
| Hypertensjon | Carduran | 13 | 1 prosent |
| Triglyseridsenkning | Omacor | 10 | 1 prosent |
| Virusinfeksjoner: herpes genitalis, herpes zoster ophatalmicus | Valtrex, Valcyte | 9 | 1 prosent |
| Annet | 146 | 16 prosent | |
| Totalt | 936 | 100 prosent |
Kilde: Norges Apotekerforening
16.2 Departementets vurdering
Gjennom den søknadsbaserte ordningen skal trygdeetaten kunne gi individuell refusjon til legemidler som ikke er innvilget refusjon etter forhåndsgodkjenning. Den individuelle refusjonsordningen har over tid utviklet seg til å bli en relativt omfattende ordning, noe som har virket begrensende på refusjon av legemidler og i enkelte perioder gitt lange behandlingstider for nye søknader.
Refusjon etter individuell søknad sikrer at pasienter som tilfredsstiller de kravene som er satt for refusjon, får dette legemidlet refundert innenfor det samlede egenandelsopplegget. Innenfor en forhåndsgodkjent refusjonsordning må også pasientene oppfylle refusjonsvilkårene for å få innvilget refusjon, men det er delegert til legene å påse at vilkårene for refusjon er oppfylt. Departementet vil derfor understreke at den individuelle søknadsordningen er en refusjonsordning som, på lik linje med den forhåndsgodkjente ordningen, skal sikre de riktige pasientene tilgang til refusjonsverdige legemidler. Forskjellen er derfor først og fremst knyttet til hvem som kontrollerer at pasienten opfyller vilkårene for refusjon.
I en søknadsbasert ordning er det naturlig å inkludere for eksempel legemidler uten markedsføringstillatelse i Norge og legemidler som ennå ikke er vurdert for forhåndsgodkjent refusjon. For andre legemidler kan individuell refusjon etter søknad gis, dersom bruken av legemidlet er vanskelig å kontrollere eller dersom individuelle behov ikke kan ivaretas ved bruk av generelle refusjonsvilkår. Individuell søknad etablerer en klar terskel for forskrivning og oppfordrer legen til å vurdere de medisinske behovene. Dette kan bidra til å sikre at det bare er i medisinsk begrunnede tilfeller at refusjon søkes. Dette innbærer at det også i fremtiden vil være behov for en søknadsbasert refusjonsordning.
Departementet vil foreslå en forenkling av systemet ved at enkelte legemidler som i dag refunderes etter individuell søknad, vurderes innvilget forhåndsgodkjent refusjon, men med klare refusjonsvilkår. Dette vil være aktuelt for legemidler der det tydelig kan avgrenses en pasientgruppe, og hvor det kan stilles klare vilkår for refusjonen. Overføringen av legemidler til forhåndsgodkjent refusjon skal skje etappevis og evalueres etter hver overføring. Dersom evalueringen viser en dårlig etterlevelse, bør overføringen stanses inntil årsakene er evaluert og etterlevelsen sikret. Økt forskrivning utenfor vilkårene vil kunne begrunne en tilbakeføring til individuell refusjon.
Departementet vil gi Statens legemiddelverk i oppdrag å utvikle klare og kontrollerbare refusjonsvilkår for legemidler som er egnet for en slik overføring, se avsnitt 15.5. Dette er en arbeidskrevende prosess som vil kunne ta noe tid. Vilkårene må deretter effektivt formidles til forskrivere og pasienter, samt følges opp med kontroll av legenes forskrivningspraksis.
Rikstrygdeverket er i startfasen med å utvikle en informasjons- og kontrollstrategi, og Statens legemiddelverk er på samme måte i ferd med å utvikle en informasjonsstrategi for refusjonsvilkår. I andre deler av denne meldingen omhandles også tiltak som vil styrke etterlevelsen, så som kontinuerlig oppdatering av refusjonsvilkår, forskrivningsstøtte, elektroniske resepter og produsentuavhengig informasjon. En forenkling ved at utvalgte legemidler overføres fra individuell til forhåndsgodkjent refusjon, vil slik kombineres med tiltak som skal sikre at etterlevelsen av refusjonsvilkårene ikke blir dårligere enn ved dagens individuelle søknadsbehandling.
Det er i dag et krav for individuell refusjon av legemidler at behandlingen skal være startet opp eller forskrevet av spesialist. På enkelte terapiområder er det et begrenset antall spesialister med en ujevn geografisk fordeling, noe som kan lede til lang ventetid, lange reiser og til at spesialistkapasitet bindes opp. For enkelte legemidler er det som en del av den medisinske godkjennelsen, et krav at den legen som forskriver legemidlet er spesialist eller har erfaring med diagnostisering og behandling av den aktuelle sykdommen. I disse tilfellene mener departementet at spesialistkravet må opprettholdes. For andre legemidler er det ikke alltid tungtveiende faglige grunner som tilsier at en spesialistvurdering er nødvendig. Dette gjelder særlig legemidler som inngår i behandlingen av sykdommer som primærlegetjenesten normalt er ansvarlig for. I disse tilfellene er spesialistkravet begrunnet med at man ønsker bedre kontroll med bruken av legemidlet. En opphevelse av spesialistkravet vil kunne gi pasientene bedre tilgang til legemidler som refunderes etter søknad. På den annen side vil trolig antall individuelle søknader øke. Argumentene for å opprettholde spesialistkravet kan variere i styrke, avhengig av hvilke legemidler det er tale om. Departementet vil derfor ikke foreslå at spesialistkravet oppheves på generell basis, men vil foreslå endringer som åpner for at enkelte legemidler også kan refunderes på individuelt grunnlag uten spesialistkrav. Spesialistkravet vil vurderes for det enkelte legemiddel, med utgangspunkt i faglige behov og potensielt antall søknader, og behandles i budsjettsammenheng. En avvikling av spesialistkravet for de aktuelle legemidlene må følges opp med informasjons- og kontrolltiltak.
Dersom den individuelle søknadsbaserte refusjonsordningen skal fungere etter intensjonen, er det et krav at søknadsbehandlingen skjer innenfor frister som tilfredsstiller pasientenes behov. Departementet vil derfor be Rikstrygdeverket om å gjennomgå rutinene for den søknadsbaserte ordningen for å vurdere ytterligere tiltak som kan effektivisere denne saksbehandlingen, herunder oppdatering og utvikling av retningslinjer for trygdeetatens skjønnsutøvelse.
17 Bidragsordningen
17.1 Regelverket
Frem til forløperen for blåreseptordningen ble innført i 1953, hadde flere trygdekontor benyttet trygdekassens overskudd til formål som stod i forbindelse med sykepleien, herunder legemidler. Dagens bidragsordning i folketrygdloven § 5–22 er en videreføring av denne ordningen, og omfatter med noen få unntak alle reseptpliktige legemidler som markedsføres i Norge og som ikke omfattes av blåreseptordningen. Bidragsordningen er ikke rettighetsbasert som refusjonsordningene, men praktiseres i stor grad på samme måte. Det kan som hovedregel ytes bidrag med 90 prosent av kostnaden som overstiger 1600 kroner per kalenderår. Bidragsordningen omfatter også andre helsetjenester enn legemidler.
Pasienten betaler hele kostnaden når legemidlet hentes på apoteket, men kan ved å ta vare på kvitteringene søke det lokale trygdekontor om dekning av utleggene. Det ble i 2004 dekket legemidler over bidragsordningen for et beløp i størrelsesorden 250 millioner kroner.
Bidragsordningen kompliseres ved at det er en rekke unntak fra hovedregelen. For pasienter med kreft og immunsvikt i langtkommen fase dekkes utgiftene for nødvendige lindrende legemidler fullt ut, og apoteket kan utlevere legemidlene uten forhåndsbetaling for pasienten. P-piller til jenter mellom 16 og 19 år er gratis. Det gjelder også særlige regler for dekning av utgifter til vanedannende legemidler og legemidler til bruk ved infertilitetsbehandling.
17.2 Departementets vurdering
For en rekke legemidler dekker bidragsordningen utgiftene fullt ut uten egenbetaling for pasientene, herunder smertelindrede legemidler for kreftpasienter i terminalfase. Gjennom ordningen gis det imidlertid også bidrag til legemidler som ikke oppfyller kravene til refusjon i blåreseptordningen. Som et utgangspunkt kan utgifter til alle legemidler på hvit resept refunderes, med en begrenset egenandel. Med forbehold om at enkelte legemidler ikke er vurdert i refusjonssammenheng, kan slike legemidler på noe usikkert grunnlag utgjøre om lag én tredel av de totale bidragene til legemidler. Bidragsordningen er trolig lite kjent, men utgiftspotensialet kan være stort sett i lys av at pasientene i dag betaler ca. 1,7 mrd. kroner for reseptpliktige legemidler på hvit resept.
Departementet mener at det er avgjørende at de overordnede faglige kriterier som gjelder i blåreseptordningen bør være oppfylt, dersom utgifter til et legemiddel skal dekkes av folketrygden. Dette fordrer en vurdering av sykdommens alvorlighet og langvarighet. Videre vurderes legemidlets effektivitet og sikkerhet, om annen behandling er bedre og om kostnadene står i forhold til nytten. Departementet vil derfor foreslå at de legemidlene som oppfyller vilkårene for forhåndsgodkjent refusjon innvilges dette, mens de øvrige legemidlene på vanlig måte kan vurderes refundert etter individuell søknad. Legemidler vil således etter dette forslaget ikke lenger dekkes etter bidragsordningen. Dette gjennomføres ved at alle legemidler trekkes ut av bidragsordningen samtidig. Legemidler som er særlig aktuelle å overføre til det ordinære refusjonssystemet, er lindrende behandling ved kreft og immunsvikt og legemidler ved kronisk sterke smerter. Behandling av infertilitet og P-piller til jenter mellom 16 og 19 år er særskilt begrunnede helsetiltak som bør videreføres i en vel avgrenset dekningsordning. Et slikt uttrekk av legemidler fra bidragsordningen vil gi pasientene samme eller noe gunstigere egenbetalingsvilkår enn i dag. Omleggingen vil medføre at pasienter som hovedregel selv må betale fullt ut for legemidler som ikke oppfyller vilkårene for forhåndsgodkjent refusjon eller refusjon etter individuell søknad. Grunnlaget for å anslå hvilke legemidler og pasientgrupper dette omfatter, er i dag svært mangelfullt. Dette understøtter at en slik omlegging først kan skje etter at det er gjennomført en grundig utredning av de aktuelle legemidlenes forhold til refusjonssystemet.
Departementet vil gi Statens legemiddelverk og Rikstrygdeverket i oppdrag å planlegge arbeidet med å vurdere hvilke legemidler som bør overføres fra bidragsordningen til den generelle ordningen med forhåndsgodkjent refusjon, hvilke legemidler som ikke lenger bør dekkes av trygden og når omleggingen kan finne sted. Det enkelte legemiddel må vurderes i forhold til kriteriene for refusjon i blåreseptordningen, og det kan derfor ta noe tid før en samlet overføring kan skje.
18 Refusjon av smertestillende legemidler
Smertepasienter har generelt vært en underprioritert pasientgruppe i folketrygdens refusjonsordninger. Enkelte av de legemidlene som brukes til behandling av smerter er dårlig dokumentert, har ikke indikasjonen smerte eller har ikke markedsføringstillatelse. Ofte vil legemidlene i tillegg være vanedannede. Det er store individuelle forskjeller mellom pasientene når det gjelder hvilke legemidler som gir best smertelindrende effekt, og hvor store doser som må gis.
Smertestillende legemidler med markedsføringstillatelse gis forhåndsgodkjent refusjon etter blåreseptforskriften § 9 for enkelte indikasjoner, men ikke for kroniske smerter generelt. På grunn av risiko for misbruk gis ikke vanedannende legemidler forhåndsgodkjent refusjon. Enkelte pasienter kan imidlertid motta bidrag til vanedannende legemidler etter bidragsordningen. Fullt bidrag gis for smertestillende legemidler til pasienter med kreft eller immunsvikt som er kommet i en fase hvor sykdommen er langtkommen og uhelbredelig. Pasientene henter legemidlene på apoteket uten utlegg. Vanlig bidrag på 90 prosent av kostnaden ut over 1600 kroner i løpet av 12 måneder kan gis for smertestillende legemidler mot andre kronisk sterke smerter. Pasienten må legge ut, ta vare på kvitteringene og søke om dekning.
Tidligere ble det ikke gitt bidrag til vanedannende legemidler mot smerter, dersom de ikke hadde markedsføringstillatelse. Dette gjaldt blant annet høye doser fremstilt ved apotek. Nødvendigheten av å myke opp reglene ble klargjort da innføringen av Rikstrygdeverkets elektroniske oppgjørsprogram APOK avslo bidrag til pasienter som tidligere hadde fått dette i strid med regelverket. Det er etter departementets oppfatning ingen grunn til at pasienter med behov for smertelegemidler skal behandles ulikt avhengig av et legemiddels produksjonssted. I desember 2004 besluttet derfor departementet at også smertestillende legemidler uten markedsføringstillatelse som en midlertidig løsning skulle dekkes fullt ut ved bidrag til pasienter med kreft eller immunsvikt, der sykdommen har gått inn i en langtkommen og uhelbredelig fase. Forutsetningen er at markedsførte alternativer ikke kan benyttes og at behandlingen er instituert ved sykehus.
Det er imidlertid også behov for en mer langsiktig løsning for refusjon av utgifter til smertelindrende legemidler. De fleste pasienter kommer i dag dårligere ut gjennom bidragssystemet enn ved refusjon på vanlig blå resept. Kroniske smerter må ses på som en alvorlig sykdom og bør gis status på lik linje med andre alvorlige sykdommer. Legemidler mot smerter bør derfor etter departementets mening innvilges forhåndsgodkjent refusjon, dersom de faglige vilkårene er oppfylt. Legemidlene må da innfri kriteriene om langvarighet, alvorlighet, effekt og kostnadseffektivitet. Løsningen vil være i overensstemmelse med forslaget i kapittel 17 om å overføre enkelte legemidler fra bidragsordningen til ordinær refusjon. Dette vil gi pasientene bedre rettigheter, lavere egenandel og en mer praktisk tilrettelagt ordning. Samtidig vil det være en forenkling av refusjonssystemene.
De pasientgruppene som i dag gis fullt bidrag, dvs. pasienter med kreft eller immunsvikt, bør få full refusjon ved overføringen til blåreseptsystemet. Alle pasienter i livets sluttfase bør likestilles med kreft- og immunsyke og gis full utgiftsdekning til smertebehandling. Pasientene bør ikke forskjellsbehandles ut fra årsakene til store smerter. Særlig gjelder dette når smertebehandling er det eneste alternativet. Vanedannende legemidler for andre enn pasienter i terminalfasen bør underlegges individuell refusjon av hensyn til kontroll med bruken. Legemidler som ikke har markedsføringstillatelse eller smertebehandling som godkjent medisinsk indikasjon, bør også underlegges individuell refusjon. Bakgrunnen for dette er at forhåndsgodkjent refusjon i slike tilfelle kan fjerne insentivene for legemiddelfirmaene til å søke godkjenning av sine produkter. Legemidler uten markedsføringstillatelse er ikke maksimalprisregulert.
Pasienter som får bidrag ved kreft og immunsvikt i terminal fase, får allerede i dag full utgiftsdekning, og en overføring til forhåndsgodkjent refusjon vil derfor ikke medføre økte kostnader. En overføring av legemidler med vanlig utgiftsdekning på 90 prosent vil imidlertid kunne gi økte utgifter for folketrygden. Utgiftsøkningen er vanskelig å fastslå nøyaktig, men vil være beskjeden da bidragsordningen i mange tilfeller vil gi tilnærmet like god dekning som forhåndsgodkjent refusjon. En overføring av legemidler fra bidragsordningen til forhåndsgodkjent refusjon vil gjøre ordningen mer kjent og kan føre til noe økt etterspørsel. Dette vil i mindre grad gjelde pasienter med kreft eller immunsvikt. Departementet antar imidlertid at omfanget av refusjon for andre legemidler mot kroniske sterke smerter vil kunne øke noe. Noe av dagens forbruk dekkes trolig allerede i strid med regelverket. Utgiftsveksten er ikke beregnet fordi det mangler statistikk.
19 Egenandeler
19.1 Bakgrunn
Skatt er den grunnleggende finansieringsformen for helsetjenester i Norge. På visse områder er det likevel innført egenbetaling for helse- og sosialtjenester. Brukerbetaling kan bidra til å bevisstgjøre brukerne om at tjenestene har en kostnad, til å begrense lite begrunnet etterspørsel etter tjenester og til å sikre et godt offentlig tilbud av grunnleggende velferdsgoder, jf. St.meld. nr. 8 (2004–2005) Perspektivmeldingen for en drøfting av brukerbetaling for offentlige tjenester.
En egenandelsordning for legemidler skal stimulere til riktig bruk og god ressursutnyttelse, men samtidig sikre pasienten tilgang til likeverdig helsetilbud i hele landet. Det offentlige finansierer derfor en stor del av nødvendig medikamentell behandling gjennom blåreseptordningen, behandling i sykehus og sykehjem, samt gjennom bidragsordningen. Offentlige budsjetter dekker kostnadene for nærmere 70 prosent av det totale legemiddelsalget som i 2003 var på 14,7 milliarder kroner, se avsnitt 2.3.
Når folketrygden som en tredje part finansierer en vesentlig del av legemiddelforbruket, svekkes motivet både for lege og pasient til å legge vekt på kostnader. Lav egenbetaling og pasientenes begrensede kjennskap til likeverdige legemiddeltilbud gjør etterspørselen etter refusjonsberettigede legemidler lite følsom for legemidlets pris. Slik tredjepartsfinansiering vanskeliggjør god ressursutnyttelse gjennom riktig legemiddelbruk, og er hovedårsaken til behovet for omfattende regulering av legemiddelmarkedet i svært mange land.
Program for helseøkonomi ved Universitet i Bergen har på oppdrag fra Nasjonalt råd for prioritering gått gjennom undersøkelser og annen dokumentasjon om egenandeler innen helseområdet (2003). Rapporten oppsummerer følgende:
Etterspørselen lar seg påvirke av egenandeler. Innføres egenandeler på helsetjenester, vil etterspørselen falle. I hvilken grad etterspørselen påvirkes av egenandelene avhenger av helsetjenestens art og av størrelsen på egenandelene.
Egenandeler reduserer etterspørselen etter både nødvendige og unødvendige helsetjenester. En studie viser imidlertid at reduksjonen i etterspørsel knyttet til unødvendige legemidler er høyere enn for nødvendige legemidler.
Egenandeler tenderer til å påvirke helse og inntekt i befolkningsgrupper på en skjev måte. Studiene indikerer at personer med lav inntekt og personer som tilhører visse sosiale grupper, rammes mest negativt.
Økt egenbetaling vil øke kostnadsbevisstheten, men kan samtidig virke imot målsettingen om tilgjengelighet uavhengig av betalingsevne. Det er nødvendig å finne en riktig balanse mellom disse målsettingene.
19.2 Dagens regelverk
Pasienten er i dag beskyttet mot høy egenandelsbetaling for legemidler gjennom tre ulike typer tiltak:
Pasienten betaler 36 prosent av legemidlets egentlige kostnad.
Pasienten betaler ikke mer enn totalt 490 kroner per resept.
Pasienten betaler ikke mer enn totalt 1585 kroner i egenandeler i løpet av et kalenderår. Dette gjelder både legemidler på blå resept og andre utvalgte helsetjenester.
Minstepensjonister og barn under syv år skal ikke betale egenandel for legemidler. Barn under 16 år kan legge sine egenandeler sammen med egenandelene til en av foreldrene. Når disse familiemedlemmene samlet har nådd egenandelstaket, får hver av dem utstedt et frikort. Egenandeler kreves ikke for legemidler som refunderes for allmennfarlige, smittsomme sykdommer eller som brukes ved lidelser som skyldes yrkes- eller krigsskade.
Egenandelene for legemidler inngår som en del av skjermingsordningen som omtales som egenandelstak 1. Denne ordningen omfatter også legehjelp, psykologhjelp, sykepleieartikler og reiseutgifter i forbindelse med behandling. Når utgiftstaket er nådd, får pasienten et frikort som innebærer at det offentlige dekker kostnadene ved disse tjenestene resten av året. I 2004 fikk om lag 1 million personer frikort. Av samlet refusjon av egenbetaling (egenandelstak 1) på 2 895 millioner kroner i 2004 gjaldt 1 087 millioner kroner, eller 37 prosent, legemidler og sykepleieartikler på blå resept. Beregningen av egenandelene følger kalenderåret.
For legemidler som ikke omfattes av blåreseptordningens regelverk for generell og individuell refusjon, kan det søkes utgiftsdekning gjennom bidragsordningen. Etter hovedregelen kan folketrygden bidra dersom engangsutgiftene eller de samlede utgifter til det aktuelle formålet i løpet av tolv måneder overstiger 1 600 kroner. Bidrag ytes med 90 prosent av overskytende utgifter og utbetales i ettertid. Flere formål dekkes imidlertid fullt ut uten nedre beløpsdekning. Det gjelder for eksempel enkelte smertestillende legemidler til kreft- og immunsviktpasienter.
19.3 Situasjonen i andre land
Andelen av legemiddelforbruket som finansieres av pasienten, er relativt lik i Danmark, Island, Sverige og Norge. Pasientens andel lå på om lag 1/3 av de totale legemiddelutgiftene (inklusive hvitresept og reseptfritt) i disse landene i 2003. I Finland refunderes nesten alle reseptpliktige legemidler, men mange av disse refunderes bare med 50 prosent. Totalt betaler pasientene i Finland hele 43 prosent av legemiddelutgiftene.
Når det gjelder egenandeler for legemidler som dekkes av nasjonale refusjonsordninger, ligger Norge lavt sammenlignet med andre vest-europeiske land. I Danmark, Finland og Sverige betaler pasienten mellom 24 og 37 prosent av de samlede kostnadene til refunderbare legemidler (Tall og fakta 2004 – LMI). Tilsvarende andel er 13 prosent i Norge, når dekning gjennom frikortordningen ikke trekkes fra. Men til gjengjeld er ikke alle reseptpliktige legemidler dekket av refusjonsordningen. Disse legemidlene utgjorde 12 prosent av omsetningen av legemidler i 2003. Selv om egenandelene innenfor refusjonsordningen fremstår som lave i Norge, er altså pasientenes totale betaling for legemidler på linje med andre nordiske land.
I Danmark og Sverige har man en trappetrinnsmodell for egenandeler der man i utgangspunktet betaler hele legemidlets kostnad. Etter hvert som den akkumulerte egenbetalingen øker, gis det en økende andel av refusjon. Dette prinsippet gjør at personer med et lavt legemiddelforbruk ikke belaster refusjonssystemet. I Finland betales like stor egenandel for hver resept frem til høykostnadstaket. Sverige, Danmark og Finland har til forskjell fra Norge takordninger som bare inkluderer legemidler.
19.4 Departementets vurdering
Ordningen med et årlig utgiftstak for egenandeler ble innført i 1984 med sikte på å skjerme storbrukere av helsetjenester. Antall utstedte frikort de første årene – mindre enn 150 000 per år – gjenspeilte dette. Sammenholdt med utviklingen i konsumprisindeksen er utgiftstaket i 2004 reelt sett på om lag samme nivå som i 1984. I forhold til utviklingen i minstepensjonene og lønnsutviklingen i samme periode, har egenandelstak 1 økt betydelig mindre. Med en parallell oppjustering av frikortnivået i forhold til pensjonsutviklingen for enslige minstepensjonister i perioden skulle frikortnivået i 2005 vært knapt 2 400 kroner. Sett i forhold til utviklingen i pensjonsnivå for minstepensjonistpar, skulle frikortnivået vært drøyt 2 600 kroner, mens lønnsutviklingen isolert sett tilsier et egenandelstak på om lag 2 250 kroner.
I 1984 tilsvarte egenandelstaket 15–20 egenandeler for legehjelp og legemidler på blå resept. Egenandelene som inngår i ordningen er imidlertid blitt vesentlig høyere i løpet av perioden. For eksempel tilsvarer utgiftstaket nå vel tre maksimale egenandeler på blå resept tilsvarende 490 kroner. Som følge av dette ble det utstedt om lag 1 million frikort i 2004. Ordningen er dermed lite målrettet som skjermingstiltak for storbrukere av helsetjenester, men omfatter i stedet en betydelig del av befolkningen, herunder mange med et relativt normalt forbruk av helsetjenester. I St.prp. nr. 1 (2004-2005) foreslo Regjeringen derfor endringer med sikte på en bedre målretting. Regjeringen foreslo å øke egenandelstaket til 2 500 kroner, og samtidig å innføre et lavere tak for minstepensjonister på 1 550 kroner. Stortinget vedtok imidlertid en økning av taket til 1 585 kroner, jf. Budsjett Innst. S. nr. 11 (2004-2005).
I Sverige og Danmark slår støtteordningene for legemidler først inn når de totale kostnadene har nådd et visst nivå. I Norge har vi et skjermingssystem hvor legemidler og andre helsetjenester ses under ett. Departementet har vurdert muligheter for å innføre modeller som ligner den svenske og danske, men har kommet til at fordelen med en mer målrettet ordning for egenandeler på legemidler ikke oppveier ulempen ved at disse ikke lenger blir sett i sammenheng med andre helsetjenester. Frem til et system med elektronisk resept blir tatt i bruk, vil dagens ordning også være enklere å administrere enn en modell for egenandeler som i Sverige og Danmark.
Departementet har også vurdert et system med et fast kronebeløp per legemiddel eller per pakning. Dette vil imidlertid kunne ramme pasienter som bruker mange legemidler og derfor være mindre målrettet enn dagens ordning. Et slikt system gir videre et insentiv til salg av store pakninger.
Salget av legemidler i apotekene øker tradisjonelt i desember måned og er lavt i januar. Årsaken er trolig at pasientene vil hente ut legemidler mens de fremdeles har frikort. Det er hevdet at et tiltak for å redusere denne effekten kan være å endre perioden for beregning av frikort fra kalenderår til løpende 12 måneders perioder. Apotekene vil da ikke oppleve det samme presset mot slutten av året. En slik løsning gir imidlertid pasientene et enda sterkere insentiv til å hente ut mest mulig legemidler i frikortperioden, ettersom dette vil kunne utsette starten av neste egenandelsperiode. Svenske myndigheter praktiserer rullende 12 månedersperioder og opplever dette som et problem. Egenandeler for legemidler i Norge inngår videre som en del av en takordning hvor også blant annet legekonsultasjoner dekkes. En omlegging av frikortperioden for legemidler vil derfor enten kreve en tilsvarende endring for andre egenandeler, eller at legemidler overføres til en egen ordning.
På denne bakgrunn foreslår ikke departementet endringer i regelverket for egenandeler nå, men vil fortsatt revurdere beløpsgrenser i forbindelse med de årlige statsbudsjettene.
20 Refusjonssystemet i andre nordiske land
Det er vanskelig å sammenligne refusjonssystemer mellom land. Dette skyldes hovedsakelig at refusjonssystemet for legemidler ikke kan sees isolert fra de øvrige helsetjenester som tilbys og de samlede egenbetalingene som pasientene avkreves innenfor helsetjenesten. Av denne grunn begrenser oversikten seg til en gjennomgang av refusjonssystemene i Norden.
Sverige innførte en ny lov om legemiddelrefusjon i 2002 der hensikten var å få bedre kontroll med de stadig økende offentlige legemiddelkostnadene. Et legemiddel gis som hovedregel enten generell refusjon for hele det godkjente bruksområdet eller ingen refusjon. I unntakstilfeller kan imidlertid refusjon begrenses til et bestemt bruksområde eller en pasientgruppe. Myndighetene kan stille vilkår til legemiddelfirmaene om innlevering av ytterligere dokumentasjon innen en gitt tidsfrist. For å få refusjon må legemiddelfirmaene dokumentere overfor Läkmedelförmånsnemnden at kriteriene for refusjon er oppfylt. Det er ikke etablert en ordning for å søke om individuell refusjon.
I Danmark er det en tredelt refusjonsordning som består av forhåndsgodkjent refusjon, «klausulert» refusjon hvor legen via resepten tilkjennegir at pasienten oppfyller gitte vilkår for refusjon, og søknad for individuell refusjon. Om lag 100 000 søknader håndteres årlig med en behandlingstid på 2–3 uker.
I Finland vil alle legemidler som har fått godkjent en pris være kvalifisert for refusjon, men nivået av refusjon varierer. Finland er det eneste landet som har en ordning med gradert refusjon, hvor enten 50, 75 eller 100 prosent av utgiftene refunderes avhengig av hvor viktige legemidlene er.
Hvor stor andel av legemiddelforbruket som omfattes av refusjonsordningene, varierer mellom de nordiske landene. Finland skiller seg ut ved å ha en refusjonsordning som omfatter nesten alle legemidler, men der egenandelene til dels er relativt høye.
Felles for landenes opptak av legemidler i refusjonssystemet er krav om dokumentasjon av effekt og sikkerhet, og at nytten står i rimelig forhold til kostnadene. I Sverige legges det også særlig vekt på prinsipper om behov og solidaritet. Alle de nordiske landene avgrenser i større eller mindre grad refusjonen til bestemte bruksområder eller til en avgrenset pasientgruppe.
Beslutninger om opptak av legemidler på refusjonsordningen fattes både i Sverige og Danmark av en nemnd. I disse landene er det også anledning til å klage over beslutningene om å inkludere medisiner i refusjonssystemet til rettsapparatet. Det er ingen politisk involvering i disse beslutningene.
Kontrollen med bruk av ordningene i de øvrige nordiske landene skjer ved bruk av de individuelle ordningene eller ved å desentralisere ansvaret for utbetalingene og oppfølging. I Sverige og Danmark brukes det lite administrasjon på nasjonalt nivå til kontroll, mens landsting og amter følger opp legemiddelbruken i varierende grad.
Boks 20.16 Tiltak
For å effektivisere refusjonssystemet og legge til rette for riktige prioriteringer vil departementet:
Foreslå å fjerne sykdomslisten som opptakskriterium for forhåndsgodkjent refusjon, men beholde listen som ramme for legens forskrivning.
Beholde dagens bagatellgrense for vedtak fra Statens legemiddelverk om opptak av legemidler på forhåndsgodkjent refusjon.
Legge til rette for at Statense legemiddelverk kan utarbeide spesialiserte samt mest mulig konkrete og kontrollerbare refusjonsvilkår for de fleste av de legemidlene som gis forhåndsgodkjent refusjon.
Kontinuerlig vurdere legemidlers refusjonsstatus på viktige terapiområder og ta initiativ til et nordisk samarbeid på området.
I større grad kreve bedre dokumentasjon av effekt når et refundert legemiddel har blitt brukt en periode, med sikte på en fornyet vurdering av refusjonsstatus.
Utvikle en løsning for elektronisk bekreftelse av refusjonsvilkår i forbindelse med innføringen av elektroniske resepter.
Vurdere hvordan søknadsinformasjon, refusjonsvilkår og endringer i regelverket kan formidles på en hensiktsmessig måte til forskrivende lege inntil til eresepter og elektroniske forskrivningsstøttesystemer er etablert.
Videreføre den kontrollmetodikken som trygdeetaten har utviklet, og implementere et kontrollsystem som omfatter alle legemidler som refunderes.
Utrede muligheten for å innføre nye reaksjonsformer overfor leger som bryter med forskrivningsreglene, herunder økonomiske sanksjoner.
Klargjøre vilkårene for refusjon og foreta en teknisk gjennomgang av sykdomslisten og preparatlisten.
Foreta en teknisk gjennomgang av blåreseptforskriften.
Ta i bruk ordninger med foretrukket legemiddel i de tilfellene det er faglig grunnlag for å velge et billigere legemiddel fremfor andre legemidler.
Foreslå at legemidler med en tydelig avgrenset pasientgruppe, og som kan tilknyttes klare vilkår for refusjon, vurderes innvilget forhåndsgodkjent refusjon i stedet for refusjon etter individuell søknadsbehandling. Dette kombineres med tiltak som sikrer at etterlevelsen av refusjonsvilkårene ikke blir dårligere enn ved dagens individuelle søknadsbehandling. Økt forskrivning utenfor vilkårene vil kunne begrunne en tilbakeføring til individuell refusjon.
Vurdere endringer som tillater at enkelte legemidler også kan søkes individuelt refundert av allmennleger og ikke bare av spesialister.
Foreslå at alle legemidler trekkes ut av bidragsordningen samtidig, og at de legemidlene som oppfyller de faglige kriteriene for refusjon, overføres til forhåndsgodkjent refusjon eller vurderes refundert etter individuell søknad.
Foreslå at legemidler mot smerter innvilges forhåndsgodkjent refusjon, dersom de faglige vilkårene er oppfylt.
21 Økonomiske og administrative konsekvenser
Flere av tiltakene som er foreslått i denne meldingen, vil kunne få økonomiske og administrative konsekvenser. Det er behov for å styrke arbeidet i den offentlige forvaltningen på legemiddelområdet, noe som vil kunne kreve overføringer til de aktuelle etatene. Departementet vil også vurdere mulighetene for å omdisponere midler for å styrke arbeidet med de oppgavene som er omtalt i denne meldingen.
Tiltakene for å styrke oppfølgingen av pasientenes etterlevelse av riktig legemiddelbruk vil kreve en vesentlig økning av Sosial- og helsedirektoratets aktivitetsnivå på de delene av legemiddelområdet som etaten i dag har ansvar for, både til tidsavgrensede prosjekter og til oppfølging av langsiktige oppgaver. Også Folkehelseinstituttet vil måtte avsette saksbehandlerressurser. Økt bruk av multidose vil medføre økte tilskudd, men kompenseres av riktigere legemiddelbruk hos den enkelte pasient samt mindre kassasjon.
Meldingen foreslår klarere ansvarsfordeling og bedre samarbeid mellom de involverte etatene ved formidling av produsentuavhengig informasjon. Formålet er å effektivisere bruken av dagens ressurser og infrastruktur og utvikle en solid plattform for satsing på legemiddelinformasjon. Intensivering av informasjonsarbeidet vil kreve ressurser i form av flere årsverk og mer informasjonsmateriell. Videreføring av Legemiddelhåndboken i offentlig regi vil gi en merutgift.
Offentlig tildeling av varenummer for legemidler, med et tilhørende offentlig register for pakningsinformasjon, vil kunne kreve ressurser til etablering og drift. Et mer aktivt tilsyn med markedsføring av legemidler vil kunne kreve ressurser i Statens legemiddelverk.
Igangsetting av offentlige studier som sammenligner legemidlers effekt i klinisk praksis vil kreve ressurser. Departementet skal utrede finansieringen og organiseringen av slik forskning nærmere. Resultatene vil kunne føre til riktigere refusjonsavgjørelser og bedre ressursutnyttelse. Et mulig nordisk samarbeid kan gjøre studiene mindre kostnadskrevende for det enkelte land.
Departementet foreslår utvidet adgang til å sende legemidler fra apotek. Det vil kunne gi lavere omsetning i distriktsapotekene. Departementet vil om nødvendig motvirke dette ved støttetiltak for å opprettholde en tilfredsstillende apotekdekning i distriktene. Samlet driftsstøtte kan bli større enn i dag, men finansieres ved midler fra næringen selv gjennom legemiddelavgiften.
Mer oppdaterte og klare refusjonsvilkår i blåreseptordningen, bedre informasjon om vilkårene og bedre kontroll med forskrivningen vil også være sentrale tiltak for bedre ressursutnyttelse. En spørreundersøkelse hos forskrivende leger indikerer klart at kontroll- og informasjonstiltak virker, se avsnitt 15.9. Det er vanskelig å anslå effekten av de forelåtte tiltakene, men et forsiktig anslag kan være en kostnadsreduksjon på fem prosent. Det utgjør i tilfelle om lag 450 millioner kroner årlig.
Oppdatering av refusjonsvilkår for legemidler vil isolert sett kreve en styrking av Statens legemiddelverk og Nasjonalt kunnskapssenter for helsetjenesten. Legemiddelloven § 6 fjerde ledd hjemler en avgift for «oppfølging av refusjonssøknader». Oppdateringen vil primært søkes finansiert gjennom en omprioritering innenfor etatenes rammer, men departementet vil også utrede en avgift på blåreseptlegemidler som tilsvarer kostnadene ved oppdatering.
Tiltakene vil etter departementets syn samlet sett bidra til bedre ressursutnyttelse på området.
Økonomiske konsekvenser som måtte følge av de foreslåtte tiltakene i tillegg til interne omorganiseringer, vil departementet komme tilbake til i de årlige budsjettene.