4 Praksis frem til i dag
4.1 Transplantasjonsvirksomheten
4.1.1 Historikk
4.1.1.1 Organtransplantasjon
Ved transplantasjon av levende celler fra ett til et annet genetisk ulikt individ vil cellene uvegerlig bli drept (avstøtt) av mottakerens immunsystem med mindre dette svekkes på en eller annen måte. Den første vellykkede organtransplantasjonen, utført i Boston (USA) i 1954, lyktes fordi giver og mottaker var eneggede tvillinger, og den transplanterte nyren var dermed beskyttet mot avstøtning.1
I Norge ble de første nyretransplantasjoner utført på Rikshospitalet fra 1956, før dialyse var etablert.2 Den første langtids vellykkede organtransplantasjon i Norge ble utført på Ullevål sykehus i 1963. Pasienten fikk nyre fra sin mor, og begge levde ved god helse i mange år etterpå.
Internasjonalt utviklet transplantasjonsmedisinen seg raskt i 1960-årene. Ved bruk av vevstyping (HLA typing) og immundempende medisiner ble resultatene bedre. Det krevde imidlertid god immunologisk overensstemmelse mellom giver og mottaker. Innen familien er sjansen for å finne en immunologisk velegnet giver stor. Blant ubeslektede er den liten, og for å finne en egnet mottaker til en nyre fra en ubeslektet (avdød) giver måtte man ha mange mottakere å velge mellom. Flere sykehus kunne utveksle donornyrer for å finne en egnet mottaker. Dette krevde et system for å bevare og transportere donornyrer til riktig sykehus på en slik måte (nedkjølt) og så raskt (innen ca. 24 timer) at nyren beholdt sin funksjonsevne til den kunne transplanteres til mottakeren.
Dette var bakgrunnen for de nordiske helseministrenes henvendelse til Nordisk Råd om opprettelsen av Scandiatransplant i 1969.3 Dette nordiske samarbeidet regulerer ventelister og utveksling av organer til transplantasjon. Alle transplantasjonssykehusene i Norden rapporterer sine pasienter og sine organgivere til en felles datasentral i Århus. Organer fra avdøde givere utveksles i henhold til vedtatte kriterier, som endres i henhold til den medisinske utvikling. I starten ble mange nyrer utvekslet. Etter hvert som bedre immundempende medisiner ble utviklet, kunne man lempe på de immunologiske kravene, slik at det ble lettere å finne egnete pasienter på egen venteliste. De senere år har 5-7 % av donornyrene blitt utvekslet.4 Til gjengjeld begynte man fra 1980-tallet å utveksle også andre organer til transplantasjon, og samarbeidet i Scandiatransplant ble desto viktigere. Særlig viktig er det for pasienter i overhengende fare for å dø mens de venter på transplantasjon av hjerte, lunge eller lever. Disse pasientene har sterkt begrenset mulighet for alternativ livsforlengende behandling, slik dialyse er for pasienter som venter på nyretransplantasjon. Ved årlige møter diskuteres og utarbeides felles retningslinjer, spesielt kriteriene for organutveksling og infeksjonskontroll, samt felles forskningsprosjekter.
Audun Flatmark ved Rikshospitalet ble fra sist på 1960-tallet den drivende kraft i organiseringen av et nasjonalt transplantasjonsprogram. Et nasjonalt vevstypelaboratorium ble opprettet på Rikshospitalet, og på et møte med overlegene ved landets indremedisinske avdelinger ble planene for et nasjonalt program for behandling av pasienter med nyresvikt diskutert. Det skulle satses både på dialyse og transplantasjon for å dekke det store udekkete behovet, anslått til ca. 50 pasienter pr. år.5 Behandlingstilbudet skulle være nasjonalt, med felles venteliste på tvers av profesjons- og fylkesgrenser. Pasientene skulle få dialysebehandling ved de større fylkeskommunale sykehus, mens transplantasjonsbehovet skulle dekkes av Ullevål sykehus for Oslos pasienter og Rikshospitalet for resten av landet. Stikkordet var samarbeid, ikke konkurranse om pasientene, slik man så i de fleste andre land, hvor det ble opprettet altfor mange og små transplantasjonsenheter, og hvor mange dialyseleger vegret seg for å henvise pasienter til transplantasjon. Allerede på 1980-tallet ble det klart at sykehus som transplanterer mange pasienter oppnår bedre resultater enn mindre enheter.6
Det nye behandlingstilbudet kom i gang ved Rikshospitalet i 1969 og fortsatte som før ved Ullevål sykehus. Fra starten ble nyrer transplantert fra familiemedlemmer, og med strenge krav til vevstypelikhet mellom giver og mottaker. Fordi de fleste pasientene manglet en slik giver, ble det utenlands i økende grad utført nyretransplantasjoner fra avdøde (ubeslektede) givere. Dette ble fra 1969 i økende grad også gjort i Norge. Medisinsk teknologi hadde for lengst gjort det mulig å opprettholde åndedrett og blodsirkulasjon etter at hjernen var ødelagt, og organer fra en slik avdød person kunne transplanteres med godt resultat. Dette krevde ny lovgiving og en ny dødsdefinisjon, som i Norge kom på plass i 1973 med forskrifter i 1977. De følgende år ble 28 sykehus godkjent som donorsykehus.
I 1983 ble all norsk transplantasjonsvirksomhet samlet på Rikshospitalet. Samme år kunne man ta i bruk et nytt immundempende medikament (ciklosporin, utvunnet fra en sopp sveitsiske forskere hadde funnet på Hardangervidda) som i vesentlig grad forbedret transplantasjonsresultatene. Utenlands hadde man de forutgående tiår utviklet kirurgiske metoder til transplantasjon av lever, bukspyttkjertel, hjerte og lunge. Med den nye medikasjon ble resultatene så gode at behandlingen ikke lenger var å betrakte som eksperimentell. Den første transplantasjon av bukspyttkjertel i Norge ble utført forsommeren 1983 på Rikshospitalet.7 Samme høst ble Nordens første hjertetransplantasjon utført ved sykehuset.8 I 1984 fulgte transplantasjon av lever,9 i 1986 av kombinert hjerte og lunge (den første i Norden)10 og i 1990 av lunge.11 Det ble etablert nasjonale transplantasjonsprogrammer for pasienter med henholdsvis hjertesvikt, diabetes komplisert med nyresvikt (disse pasientene blir transplantert med både bukspyttkjertel og nyre), leversvikt og lungesvikt. Den videre utvikling er omtalt senere.
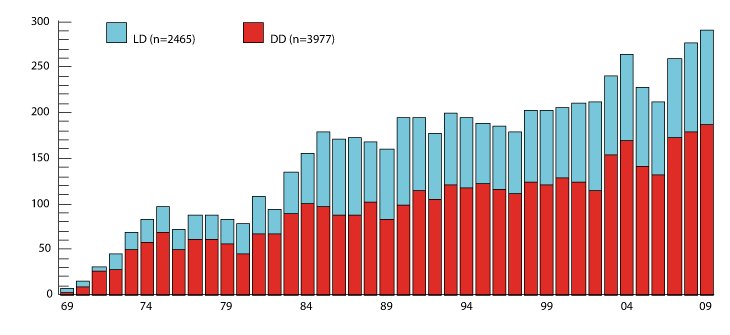
Etter at man begynte å transplantere også andre organer enn nyre, måtte donorvirksomheten reorganiseres. Når flere organer skulle opereres ut fra en avdød giver, måtte inngrepet utføres av spesialtrente kirurger fra Rikshospitalet. Transporten tilbake til Rikshospitalet måtte skje raskt fordi andre organer har kortere «holdbarhet» og må transplanteres innen 4-8 timer.12 Donorteamet fra Rikshospitalet må reise med ambulanse eller charterfly. Donorinngrep og etterfølgende transplantasjon er kompetanse- og ressurskrevende, og belastningen på personale og sykehusbudsjett stor. Helsedirektoratet oppnevnte derfor en arbeidsgruppe for å vurdere behovet for og organiseringen av virksomheten. Konklusjonen i 1989 var at den burde fortsette som tidligere, og at behandlingsbehovet ville øke.13 Stadig flere pasienter trengte behandling. Tilgangen på organer hadde man greid å øke noe. Allerede var Norge på verdenstoppen når det gjaldt nyretransplantasjon fra levende givere, og andelen avdøde givere som ga flere organer enn nyrer (multiorgangivere) ble raskt større enn i andre land.14 Flere organer ble transplantert (Figur 4.1).
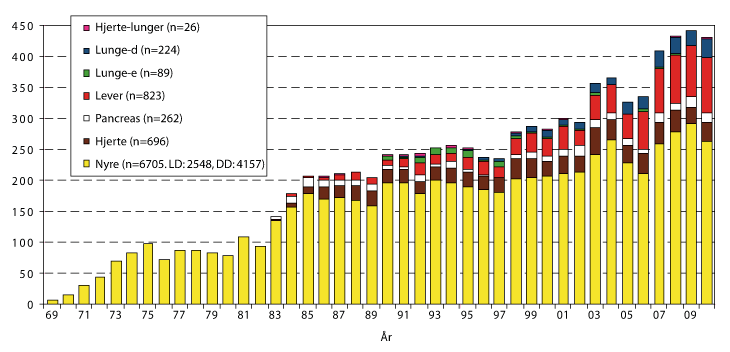
Figur 4.1 Årlige antall transplantasjoner i perioden 1969-2010. Totaltallet for hvert organ i hele perioden er gitt i fargekodeboksen. «Hjerte-lunger» er samtidig transplantasjon av hjerte og to lunger. «Lunge-d» er samtidig transplantasjon av to lunger. «Lunge-e» er transplantasjon av en lunge. «Pancreas» er bukspyttkjertel. . Figuren inkluderer ikke transplantasjon av stamceller (818), øyceller (51) og tarm (7), samt av 148 nyretransplantasjoner utført ved Ullevål sykehus i årene 1969-83.
Kilde: Figur v/Bjørn Lien, Oslo universitetssykehus, Rikshospitalet
Behovet økte likevel mer enn tilbudet kunne dekke. Som i andre land økte ventelistene pga. mangel på organer, og for noen pasienter ble ventetiden for lang – de døde mens de ventet.
Som Figur 4.2 viser, greide man ikke gjennom 1980-årene å øke antallet avdøde organgivere.
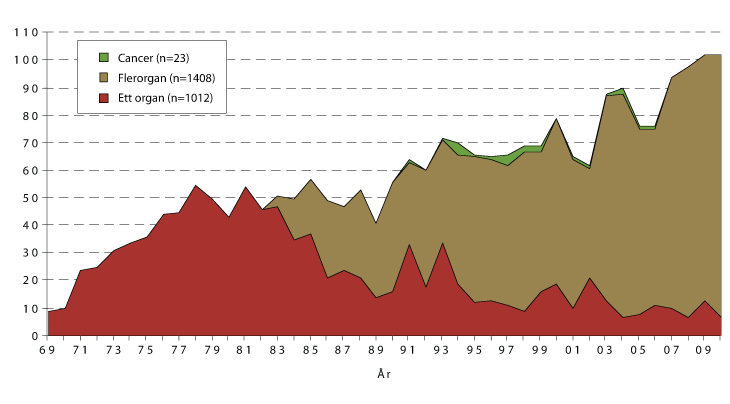
Figur 4.2 Årlig antall avdøde organgivere i perioden 1969-2010
Den røde kurven viser antall givere som bare har gitt nyrer, den gule de som har gitt andre organer i tillegg. Den grønne delen av kurven Viser påvist kreftsykdom. ( Organer fra personer med kreftsykdom blir ikke transplantert).
Kilde: Figur v/Bjørn Lien OUS, Rikshospitalet
Den største utfordringen ble fra nå av å øke antall organdonasjoner fra avdøde. Nyvinninger innen kirurgisk teknikk og utstyr, infeksjonsmedisin, bildediagnostikk (ultralyd, CT, MR) og immunologi, og nye og bedre immundempende medikamenter gjorde det mulig å tilby bedre og sikrere transplantasjonsbehandling til stadig nye pasientgrupper (eldre, pasienter med mer kompliserte helseproblemer etc.). Men dersom ikke flere donororganer kunne skaffes til veie, var dette til liten hjelp for pasienter som ble stående på ventelisten – og kanskje døde mens de ventet.
Organdonasjon er medisinsk mulig bare fra noen få prosent av alle pasienter som dør på sykehus, anslått til kanskje 50 donasjoner pr. million innbyggere årlig.15 Disse pasientene er i koma, puster ved hjelp av respirator (pustemaskin) og behandles i intensivavdelinger pga. hjerneblødning, stort hjerneinfarkt, stor hodeskade eller i forbindelse med forsøk på gjenoppliving (etter drukning, hjerteinfarkt o.a.). Meningsmålinger har vist at ca. 80 % av befolkningen er positiv.16 Men i den konkrete situasjonen, i sorg og sjokk over et kjært familiemedlems ofte brå og uventede død, er mange i tvil. Ikke minst fordi de ikke kjenner avdødes mening. Selv om den norske transplantasjonsloven bygger på presumert (formodet) samtykke fra avdøde, har praksis vært at pårørendes standpunkt til eventuell organdonasjon alltid har blitt respektert. Gjennom årene har dette medført at man har avstått fra donasjon i tidligere 40 % nå 18 % av tilfellene der dette var medisinsk mulig.17
I 1990-årene økte antall organdonasjoner i Spania sterkt som følge av en betydelig nasjonal satsing med ansettelse og opplæring av donoransvarlige leger på alle større sykehus. Samarbeid med intensivavdelingene stod sentralt. Transplantasjonsmiljøet ved Rikshospitalet ønsket en tilsvarende satsing i Norge. Norsk rådgivningsgruppe (senere Ressursgruppe) for organdonasjon (NOROD), bestående av fagfolk fra Rikshospitalet og flere donorsykehus, ble dannet i 1992. Målsettingen for gruppen var at man ved intensivavdelingene skulle kunne påvise flest mulig potensielle organgivere, ta opp spørsmålet om donasjon med pårørende, og gjøre dette på en slik måte at flest mulig svarte ja. NOROD startet kursvirksomhet og arrangerte årlig 3-4 kurs for personalet på landets intensivavdelinger.18
Organmangelen ble et helsepolitisk problem. Helsedirektørens prosjektgruppe for bedret tilgang på organer til transplantasjon tilrådet i 1995 ansettelse av donoransvarlige leger ved donorsykehusene, styrking av NORODs virksomhet, ansettelse av transplantasjons-koordinatorer som skulle styrke kommunikasjon og samarbeid mellom Rikshospitalet og donorsykehusene, samt øremerket finansiering av donorvirksomheten ved donorsykehusene.19 Disse tiltakene ble delvis realisert i løpet av de neste årene. Men til tross for at alle donorsykehus i 2003 ble pålagt å ansette en donoransvarlig lege, er dette enda ikke fullt ut gjennomført, og kun et mindretall har bevilget midler til donoraktiviteten.20
Pasientorganisasjonene begynte tidlig å engasjere seg i arbeidet med å øke tilgangen på organer til transplantasjon. Dels arbeider de for dette via sine kontaktmuligheter med myndighetene, dels driver de informasjonsvirksomhet overfor befolkningen for å øke kunnskap om og støtte til donasjonsvirksomheten. I 1997 introduserte Stiftelsen Organdonasjon (som pasientorganisasjonene sammen står bak) et donorkort i forbindelse med en stor mediakampanje som reklamebransjen organiserte gratis. Folk ble oppfordret til å tenke gjennom og informere sine pårørende om de ønsket å donere organer dersom dette skulle bli aktuelt, og utfylle et donorkort hvor deres standpunkt samt telefonnummer til pårørende er oppført. Kortet skal de ha i sin lommebok eller noe annet som de vanligvis bærer med seg, slik at helsepersonell eventuelt kan få fatt i informasjonen. Stiftelsen har til nå distribuert 4,6 millioner donorkort via legekontor, apotek etc., og i 2011 ble donorkortet også lagt ut som en applikasjon knyttet til iPhone og Android telefoner.21
Den mangeårige innsatsen for å øke tilgangen på donororganer ga seg utslag i en 60 % økning i donasjonstallet fra 1992 til 2010, med en enda større økning av antall transplantasjoner (Figur 4.2 og 4.1). Dette har konsolidert Norges posisjon som et av verdens ledende land innen organtransplantasjon; knapt noe land transplanterer flere organer (i forhold til folketallet) og har bedre behovsdekning.22 Behandlingsresultatene viser høy internasjonal standard (Figur 4.3).
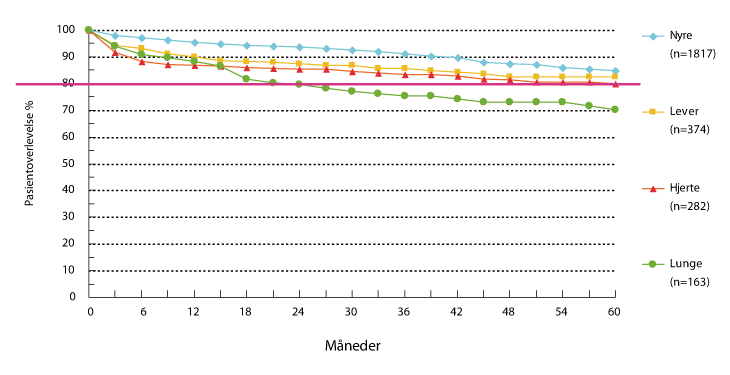
Figur 4.3 Overlevelse de første fem årene etter transplantasjon av ulike organer.
Kilde: Figur v/Torbjørn Leivestad, OUS Rikshospitalet.
Ventelistene og ventetidene er i Norge kortere enn i andre land. Likevel kan ventetiden bli lang for mange pasienter, og noen dør mens de venter (Figur 4.4)
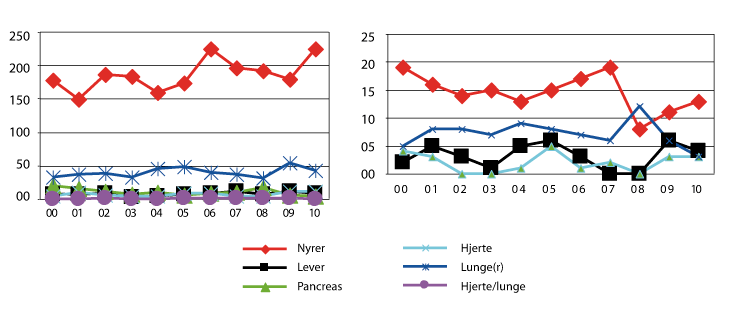
Figur 4.4 Venstre del av figuren viser antall pasienter som ved årets slutt ventet på transplantasjon av ulike organer de siste ti år. Høyre del viser antall pasienter som hvert år døde i ventetiden.
Kilde: Figur v/Torbjørn Leivestad og Bjørn Lien
Det er derfor fortsatt et stort behov for å øke tilgangen på organer til transplantasjon. I 2009 og 2010 var det 102 avdøde organgivere hvert år, dvs. 21,2 pr. million innbyggere (pmp) i 2009 og 20,8 pmp i 2010.23 Regjeringen har stilt opp et måltall på 30 pmp.24
Norge er blant de ledende i verden når det gjelder antall organtransplantasjoner pr million innbygger (pmp) hvert år. I 2009 var tallet 91,8 pmp, i 2010 87,9 pmp. Det er bare Østerrike som har flere organtransplantasjoner pmp (94,4 pmp for 2009, og 90,7 pmp for 2010). Spania, som er ledende i Europa når det gjelder antall avdøde donorer (2009: 34,4 pmp og 2010: 32 pmp), har likevel en lavere utnyttelsesgrad enn Norge. Antall organtransplantasjoner i 2009 var 85,5 pmp, og i 2010 80,2 pmp.25
4.1.1.2 Hornhinnetransplantasjon26
De første prosedyrer var lamellære, det vil si at ugjennomsiktige lag i hornhinnens overflate ble fjernet. Tanken om å kurere hornhinneblindhet på denne måten ble foreslått av den greske legen – og grunnlegger av eksperimentell fysiologi – Galen (år 130–300). Ideen om å stanse ut et område av den ugjennomsiktige hornhinnen ble fremmet av Erasmus Darwin (1731–1802) – Charles Darwins bestefar.
Det var fremskritt innen medisinske disipliner, som kunnskap om inflammatoriske reaksjoner, hornhinnens fysiologi, utvikling av prosedyrer for anestesi og innsikt i betydningen av aseptiske kirurgiske prosedyrer, som førte til at Eduard Konrad Zirm i desember 1905 kunne utføre den første vellykkede gjennomgripende transplantasjon av to hornhinner. Gjennomgripende betyr transplantasjon av hornhinnen i hele dens tykkelse – ca. 0,5 mm. Pasienten var en arbeider som hadde mistet synet på begge øyne på grunn av en skade. Selv om det ene transplantatet ble uklart, beholdt pasienten en synsstyrke på 6/36 på det andre øyet. Zirm brukte – i tråd med Erasmus Darwins anbefalinger – en trepan som stanser ut en sirkelformet del fra hornhinnen både hos mottager og fra donorøyet.
En av pionerene i Norge var overlege Per Riise ved St. Torfinns klinikk i Hamar som utførte den første gjennomgripende hornhinnetransplantasjon i Norge i 1933. En rekke forhold, blant annet introduksjon av antibiotika og steroider samt utvikling av instrumenter og prosedyrer for mikrokirurgi, førte til at antall transplantasjoner økte betydelig i tiårene som fulgte. Transplantasjon av hornhinner er i dag den vanligste prosedyre innen transplantasjonskirurgi.
Stor betydning for transplantasjonskirurgien på dette feltet fikk etableringen av hornhinnebanker, der donorhornhinner kan lagres i forskjellige medier. I 1974 viste McCarey og Kaufman, som utviklet M–K preservation medium, at donorhornhinner kunne lagres ved +40C i opp til 5 dager før transplantasjon. På slutten av 70-tallet var det en velfungerende hornhinnebank ved øyeavdelingen på Ullevål sykehus under ledelse av professor Jan Ytteborg. Denne ble driftet av overlege Albert Kolstad som i 1979 publiserte et klinisk materiale vedrørende transplantasjon av donorhornhinner lagret i organkultur ved +320C. Prosedyrene ble hentet fra Hornhinnebanken/Øyeavdelingen i Århus. Ved denne metoden kunne hornhinnene lagres i opp til 4 uker om nødvendig.
Hornhinnetransplantasjon var ikke lenger en hastesak. Ved slik lagring fikk man bedre muligheter for kvalitetskontroll av donorvev og planlegging av operasjoner. Hornhinnebank ble også etablert ved Rikshospitalet under professor Hørven og professor Anseth, ved Øyeavdelingen på Haukeland sykehus under ledelse av professor Torstein Bertelsen og ved enkelte andre øyeavdelinger.
Hornhinnen består av levende celler og bindevevsfibre. Selv om lagringstiden av hornhinnen forut for transplantasjon kan forlenges i en hornhinnebank, så har tiden som går fra sirkulasjonsstans hos donor og frem til uttak av hornhinnen, betydning. Dette gjelder for alle vev/organer med levende celler der cellene skal gjenoppta normale funksjoner etter transplantasjon til en pasient.
I Europa fikk Øyeavdelingen/hornhinnebanken ved universitetssykehuset i Århus en sentral posisjon under ledelse av professor Niels Ehlers. Det ble her lagt grunnlag for prosedyrer vedrørende lagring og internasjonal utveksling av hornhinner. Personell ved enkelte sykehus i Danmark fikk opplæring vedrørende donasjon/uttak. Donerte øyne/hornhinner ble transportert til Hornhinnebanken i Århus for videre preparering, lagring og distribusjon. Samhandling ble også et stikkord. Ved forskjellige sykehus tar donoransvarlig kontakt med personell ved hornhinnebanken dersom man har en mulig donor. Alle øyeavdelinger i Danmark der det utføres transplantasjonskirurgi, tilføres donorhornhinner fra hornhinnebanken i Århus.
Professor Niels Ehlers startet i European Eye Bank Association (EEBA), og det første møtet ble avholdt i Århus i 1989. Organisasjon har stor betydning som en arena for blant annet utdanning og utveksling av kompetanse innen donasjonsproblematikk, lagring av hornhinner og transplantasjonskirurgi. Et av formålene er å sette standard for prosedyrer i en hornhinnebank. De fleste større hornhinnebanker i Europa, blant annet Norsk hornhinnebank ved Oslo universitetssykehus, er medlemmer i organisasjonen. EEBA har en rekke europeiske og internasjonale samarbeidsorganisasjoner.
Kunnskap om hornhinnecellenes biologi førte på slutten av 1900-tallet til at man i dag kan la hornhinnevev med epitelceller vokse/utvikle seg i næringsmedier i slike laboratorier og benytte epitelvevet ved transplantasjon. Dette gjør det mulig å behandle enkelte øyesykdommer og skader som tidligere ikke kunne behandles.
Første prosedyre for utvikling av slikt hornhinnevev i næringsmedium uten produkter fra dyr ble utviklet ved Norsk hornhinnebank/Senter for øyeforskning OUS/UiO, og de første transplantasjoner av slik vev ble foretatt av professor Liv Drolsum ved Øyeavdelingen, Oslo Universitetssykehus, Ullevål.
Utvikling innen mikrokirurgi har ført til mer målrettede prosedyrer. En viktig årsak til at hornhinnen blir uklar, er at tallet på endotelceller blir for lavt. Ved øyeavdelingene ved Oslo universitetssykehus, Haukeland sykehus og ved St. Olavs Hospital i Trondheim kan man nå utføre en transplantasjon av endotelcellelaget uten at hornhinnens ytre lag må fjernes. Ved Øyeavdelingen ved Oslo universitetssykehus utgjør denne type transplantasjoner ca. 30 % av det totale antall.
Resultater etter hornhinnetransplantasjon er relatert til flere faktorer, som kvalitet på donorvev, type transplantasjon og indikasjon for inngrepet. Hos pasienter i lav risikogruppe er resultatet vellykket i 90 – 100 %, mens det i risikogrupper kan falle til under 50 %. Ved transplantasjon av hornhinneepitel utviklet i organkultur, er inngrepet vellykket i 50 – 70 % av tilfellene. Ved retransplantasjoner økes prosenten av vellykkede inngrep. Dette i motsetning til gjennomgripende transplantasjoner der prognosen blir dårligere.
Transplantasjoner ved Oslo universitetssykehus de siste to år viser følgende tall: 2009: 169 transplantater (97,9 % godkjent; alle fra San Diego Eye Bank godkjent), 174 transplantasjoner utført. 2010: 127 transplantater mottatt (93,4 % godkjent av disse, 101 fra San Diego Eye Bank), 110 transplantasjoner utført.
Det er en utfordring , at til tross for alle fremskritt, så skjer det et betydelig tap av endotelceller fra donorhornhinnen i de første månedene etter en transplantasjon. Slikt tap av celler og immunreaksjoner er blant de vanlige årsakene til at pasienter må få utført en ny transplantasjon.
Det er en generell mangel på organer, celler og vev for transplantasjon. Av hensyn til både donorer og pasienter er det nødvendig å bedre samhandling mellom de forskjellige transplantasjonsmiljøer i Norge. Slik samhandling skjer i en rekke land det er naturlig å sammenligne oss med. Det kan nevnes som et eksempel at i Danmarks hornhinnebank i Århus er antall hornhinner som kommer fra multiorgandonorer, nå steget til over 20%.
4.1.2 Nærmere om de ulike former for transplantasjon
4.1.2.1 Nyretransplantasjon
Nyre kan transplanteres både fra levende og avdøde givere. I flere land var man lenge skeptisk til donasjon fra en levende giver; Dels mente man det var galt å utsette et friskt menneske for et kirurgisk inngrep, dels fryktet man helseskade på sikt. I USA, Sverige og Norge anså fagmiljøet risikoen som så liten at en godt informert åndsfrisk voksen person med god helse og ønske om å redde liv og helse til et familiemedlem ikke burde nektes dette. Helt fra starten av det norske transplantasjonsprogrammet i 1969 ble det derfor satset på å informere familiene om muligheten for nyredonasjon. Slike donasjoner har bidradd med 30-40 % av alle nyretransplantasjoner.27
Figur 4.5 viser årlig antall nyretransplantasjoner fra avdød giver (rød) og levende giver (blå) i perioden 1969-2009. Figuren inkluderer ikke 142 nyretransplantasjoner utført ved Ullevål sykehus i årene 1963-83.
Kilde: Figur v/Torbjørn Leivestad, OUS Rikshospitalet
Pasienter med nyresvikt utredes og får råd om behandlingsmuligheter hos nyrelegen (eller barnelegen) ved det lokale sykehus. Utredning for transplantasjon utføres i henhold til en nasjonal veileder utarbeidet av Norsk nyremedisinsk forening (NNMF). Det er ingen aldersgrense for donasjon; medisinske forhold er avgjørende. Dersom transplantasjon anses som den beste behandling, sendes søknad til OUS, Rikshospitalet. Søknadene vurderes på ukentlige møter der spesialister fra ulike fagfelt deltar. Dersom transplantasjon vurderes som den behandling pasienten er best tjent med aksepteres søknaden. Få søknader avslås.28
Spørsmålet melder seg så om noen i familien kan gi nyre. Etter dagens retningslinjer skjer det ved at nyrelegen kontakter mulige givere: Pasienten bør ikke selv ha en slik oppgave. Ofte fremkommer spontant giverønske fra ett eller flere familiemedlemmer, en sjelden gang fra en nær venn/venninne. Givere utredes og informeres av lokalsykehusets nyreleger i henhold til ovennevnte veileder fra NNMF.29 Blodprøver av mulige givere sendes Rikshospitalet for vevstyping. Dersom det finnes en medisinsk egnet levende giver med altruistisk giverønske, sendes søknad om donasjon til Oslo universitetssykehus, Rikshospitalet, hvor søknaden vurderes på det ukentlige transplantasjonsmøte. Få søknader avslås. Pasient og giver blir vanligvis innen et par måneder innkalt til transplantasjon etter en plan som kan tilpasses pasientens helsesituasjon, giverens ønsker og sykehusets kapasitet.
Pasienter som ikke har en levende giver settes på venteliste for transplantasjon fra avdød giver. Når en nyre fra en egnet donor blir tilgjengelig, innkalles pasienten som øyeblikkelig hjelp til Oslo universitetssykehus Rikshospitalet. Pasienter velges til transplantasjon fra ventelisten i henhold til blodgruppe- og vevstypeforhold, ventetid og i noen grad alder (barn og ungdom prioriteres). Median ventetid har vært 8-10 måneder, men for immuniserte pasienter kan ventetiden i verste fall bli flere år.30
Mens en nyretransplantasjon tidligere krevde flere ukers sykehusopphold, blir mange nå utskrevet innen en uke. Tilstøter komplikasjoner (begynnende avstøtning, infeksjon o.a.) kan sykehusoppholdet bli langvarig, opptil måneder. Etter utskrivelse kontrolleres pasientene poliklinisk ved Oslo universitetssykehus, Rikshospitalet vanligvis ca. tre måneder. Utenbysboende bor da på pasienthotell. Pasienten fortsetter med immundempende behandling og jevnlig kontroll hos fastlege og nyrelege nær hjemstedet livet ut, i henhold til en nasjonal veileder og pasientens behov. Det norske nyreregister ved Oslo universitetssykehus, Rikshospitalet innhenter årlig informasjon om hvordan det går med den enkelte pasient .
Sykehusoppholdet etter nyredonasjon varer inntil en uke. De fleste er tilbake i vanlig virke i løpet av noen uker, og kontrolleres videre hos fastlege og nyrelege nær hjemstedet i henhold til NNMFs veileder. Det norske nyregiverregister ved Oslo universitetssykehus, Rikshospitalet innhenter årlig informasjon om hvordan det går med hver giver livet ut. Totalt er det ved Oslo universitetssykehus, Rikshospitalet utført mer enn 2600 nyredonasjoner fra levende givere uten mortalitet. Ca. 2 % har måttet reopereres pga. komplikasjoner. Etterundersøkelser har vist at færre givere blir uføretrygdet enn i normalbefolkningen, og dødeligheten er lavere. Svært få angrer på sitt valg, langt de fleste er svært glad for det.31 Vel 30 % av giverne var søsken, knapt 30 % foreldre som ga til sine barn, ca. 20 % ektefelle/samboer, ca. 10 % voksne barn som ga til sine foreldre, ca. 5 % andre slektninger og ca 5 % nærstående venner.32 Den yngste var 19 år, svært få under 25 år. Det er ingen øvre aldersgrense; medisinske forhold er avgjørende
Transplantasjon fra levende giver gir en rekke gevinster: Langt flere nyresviktpasienter kan på denne måte tilbys transplantasjonsbehandling. Transplantasjonen kan gjøres tidlig i sykdomsforløpet, helst før pasienten trenger dialyse (som er besværlig og belastende for helsen på sikt). Man kan utføre inngrepet på det tidspunkt pasienten er i best mulig form, og det muliggjør planlegging både for familien og for sykehuset. Sist og ikke minst: transplantasjonsresultatene er bedre.
3-4 % av nyretransplantasjonene gjøres til barn, 80 % med levende giver (som regel en av foreldrene). Yngste pasient var 9 måneder. Behovet for nyretransplantasjon hos barn har i flere tiår vært dekket i Norge. Medianalderen for voksne pasienter er nå 55 år, og stadig økende. Der er ingen nummerisk aldersgrense; den eldste var 83 år.3334
Organiseringen av nyretransplantasjonsvirksomheten med desentralisert utredning og oppfølging og sentralisert transplantasjon, samt satsing på donasjon både fra levende og avdøde givere er mer konsekvent gjennomført i Norge enn i andre land.
Etter transplantasjon fra levende giver lever 85 % fem år senere med fungerende transplantat, mot 72 % av de som får fra avdød giver (Figur 4.3).35 Det største frafallet skyldes at pasienter, de fleste godt opp i årene, dør av annen sykdom, men med fungerende nyretransplantat. Andre mister nyren pga. avstøtning, noen fordi den opprinnelige sykdommen ødelegger også den nye nyren. Disse pasientene behandles da med dialyse. Mange av dem blir transplantert på ny med godt resultat. Hos unge pasienter er resultatene enda bedre, likeledes ved god vevstypelikhet (HLA-match) mellom giver og mottaker.36
Behovet for nyreerstattende behandling (dialyse og/eller transplantasjon) har økt kraftig. I 1980 startet 170 nye pasienter slik behandling . 87 pasienter ble transplantert, og 50 pasienter sto på venteliste for transplantasjon.37 I 2009 var tallet på pasienter som startet nyreerstattende behandling øket til 561. I 2010 ble det utført 263 nyretransplantasjoner, og 224 sto på venteliste ved årets slutt.38 Økningen skyldes dels en økende andel av eldre i befolkningen, som langt hyppigere enn yngre utvikler nyresvikt, men mest at kvalitativt og kvantitativt bedret behandlingstilbud har medført at langt flere eldre med nyresvikt tilbys nyreerstattende behandling.39 Mange av de eldste er på grunn av andre helseproblemer ikke tjent med transplantasjon og behandles med dialyse. Dette, sammen med et øket transplantasjonstilbud, har medført at ventelisten for transplantasjon har økt lite de senere år (Figur 4.3 og 4.4). Men fortsatt må mange vente, og noen må vente lenger enn helsen tåler. Med stadig flere eldre er det antatt at behovet for behandling – mest for dialyse, men også for transplantasjon – øker i årene fremover.
Det er alminnelig enighet om at pasienter som behandles med nyretransplantasjon oppnår langt bedre livskvalitet og lever lenger enn de som behandles i dialyse. De fleste kan gjenoppta et tilnærmet normalt liv og vende tilbake til utdanning eller arbeidsliv. Også helseøkonomisk gir transplantasjonsbehandling store fordeler i forhold til dialyse.
4.1.2.2 Levertransplantasjon
Levertransplantasjon er eneste overlevelsesmulighet for pasienter med leversvikt i sluttstadiet. Riktignok har man de senere år ved hjelp av spesiell teknologi (MARS, populært kalt leverdialyse) kunnet forlenge livet noen døgn, noe som kan være livreddende inntil en donorlever blir tilgjengelig. Levertransplantasjon er blant de største og mest kompliserte prosedyrer moderne medisin rår over, også fordi pasientene ofte er i svært dårlig forfatning.
Etter den første transplantasjonen i Norge i 1984 økte det årlige antall fra to til femten frem til 1995.40 Få pasienter ble henvist, ofte for sent til å tåle behandlingen. Etter hvert ble den kirurgiske teknikken forbedret, ny teknologi og bedre immundempende behandling kunne tas i bruk, og kompetansen ved landets sykehus om leversykdom ble bedre.41 Stadig flere pasienter ble henvist i tide og transplantert (Figur 4.1), og det med resultater som etter hvert kom opp på samme nivå som ved nyretransplantasjon (Figur 4.3). Totalt er det (t.o.m. 2010) utført 823 levertransplantasjoner. Fordi langt de fleste donasjoner i Norge er multiorgandonasjoner (Figur 4.2), har man i alle år hatt god tilgang på donorlevere, slik at behovet stort sett har vært og er dekket, unntatt i spesielle øyeblikkelig hjelp-situasjoner (se senere). Venteliste (5-12 pasienter) og ventetid (median 3-5 uker) har vært kort (Figur 4.4).42 I 2010 ble det utført 89 levertransplantasjoner, flere enn i nesten alle andre land (i forhold til folketallet)43, der det er stor mangel på organer til levertransplantasjon. Flere steder utføres derfor også transplantasjon av en del av leveren som opereres ut fra en levende giver, som regel fra en av foreldrene til et leversykt barn. Denne metoden brukes ikke i Norge fordi behovet dekkes ved bruk av donororganer fra avdøde givere.
Pasienter henvises til og utredes ved innleggelse i Oslo universitetssykehus, Rikshospitalet, og settes ved behov på venteliste til transplantasjon. De fleste alvorlige leversykdommer er kroniske, men ofte med uforutsigbar progresjon i sen sykdomsfase. Det er derfor viktig å forberede pasienten i tide på transplantasjon, som bør utføres før tilstanden blir akutt livstruende. I noen tilfelle inntrer akutt leversvikt, eventuelt med leverkoma, og bare transplantasjon innen dager kan være livreddende. Hvis ikke et donororgan raskt kan skaffes, går det galt. MARS-behandling og samarbeidet i Scandiatransplant er til hjelp i slike situasjoner. Likevel får man ikke alltid et donororgan i tide, og hvert år dør noen pasienter på ventelisten (Figur 4.4).
14 % av pasientene har hittil vært barn i alderen 4 mndr-16 år, nær halvdelen av disse er spedbarn. De ble transplantert pga. medfødt misdannelse eller sykdom (genetisk) (70 %) eller kreft.44 De voksne (medianalder 48 år, den eldste 73 år) ble behandlet pga. sykdom i galleveiene (40 %), virushepatitt (10 %), alkoholskade (10 %), kreft, eller akutt forgiftning (oftest paracetamol i suicidal hensikt)4546. De senere år er det i økende grad behandlet pasienter med kreftsykdom lokalisert utelukkende i leveren (enten primært eller ved spredning fra annen kreftsykdom uten tegn til spredning uten for leveren)47.
Sykehusoppholdet varer 3-4 uker, med etterfølgende poliklinisk kontroll ved Oslo universitetssykehus, Rikshospitalet i noen uker før hjemreise. Pasientene må resten av livet bruke immundempende medisiner og gå til jevnlig kontroll hos fastlege og spesialist ved sitt lokalsykehus. Ved levertransplantasjon er avstøtning et noe mindre problem enn ved andre former for organtransplantasjon, særlig i langtidsforløpet, mens kirurgiske komplikasjoner er noe hyppigere. Enkelte pasienter får tilbakefall av den opprinnelige leversykdommen. Komplikasjoner etc. har medført at ca. 7 % av pasientene har mistet sitt transplantat og blitt transplantert på ny, som regel med godt resultat (Figur 4.3). Etter ett, fem og femten år lever henholdsvis 90 %, 85 % og 70 %.48 Erfaringene tyder på at levertransplanterte pasienter i enda større grad enn nyretransplanterte gjenvinner god livskvalitet og rehabilitering, noe som også henger sammen med at de er yngre.
Levertransplantasjon er etter stamcelletransplantasjon den mest ressurskrevende standardprosedyre i norsk helsevesen. DRG taksten var i 2010 967 000 kroner for sykehus-oppholdet ved en levertransplantasjon. Hittil er den gjennomsnittlige (foreløpige) levealder etter levertransplantasjon 18,5 år, hvilket tilsier en pris på ca. 51 000 kroner pr. vunnet leveår.49
4.1.2.3 Hjertetransplantasjon
Hjertetransplantasjon er eneste langtids overlevelsesmulighet for pasienter med hjertesvikt i sluttstadiet. I mer enn et halvt århundre har man riktignok kunnet holde pasienter uten hjertefunksjon i live en tid ved hjelp av en hjerte-lungemaskin, og de senere år er det utviklet mekaniske pumper som hos noen pasienter kan erstatte hjertefunksjonen i månedsvis. De senere år har nær hver tredje pasient som har fått hjertetransplantasjon, trengt slik behandling i ventetiden før de ble transplantert.50 Implanterbare pumper kan kanskje vise seg å gi virkelig langtids overlevelse. I dag er imidlertid hjertetransplantasjon den aktuelle behandling i den grad man kan skaffe donororganer.
Siden starten i 1983 er det (t.o.m. 2010) utført 696 hjertetransplantasjon (Figur 4.1). De fleste pasientene ble behandlet pga. sykdom i hjertets blodårer (koronarsykdom) eller muskulatur og noen pga. medfødt hjertefeil eller hjerteklaffsykdom, gjennomsnittsalderen var 47 år, og ca. 7 % var barn og ungdom.51 De siste ti årene har både antall transplantasjoner og ventelisten vært forholdsvis stabil (Figur 4.1 og 4.4). Knapt 10 % av ventelistepasientene døde i ventetiden (Figur 4.4). I 2010 ble det gjennomført 31 hjertetransplantasjoner, 11 pasienter sto på venteliste, og tre døde mens de ventet52. I forhold til folketallet et det bare noen få land som utfører flere hjertetransplantasjoner.53
Pasientene blir henvist og innlagt til undersøkelse ved Oslo universitetssykehus, Rikshospitalet for vurdering av eventuell hjertetransplantasjon. Tilgangen på donorhjerter er liten, bl.a. fordi de fleste avdøde organgivere i Norge er i en alder hvor hjertet ikke egner seg for transplantasjon. Ca. 85 % av donorhjertene kommer fra norske donorsykehus, de øvrige fra våre naboland via Scandiatransplant, og enkelte fra andre europeiske land (Eurotransplant).54
Pga. organmangelen er det ikke mulig å gi transplantasjonsbehandling til alle som kunne tenkes å ha nytte av det. Seleksjonskriteriene må ta hensyn til at flest mulig leveår bør vinnes ved behandlingen. Da kan det vanskelig forsvares å transplantere et donorhjerte til en pasient med liten overlevelsessjanse. Det er svært viktig at pasienten er motivert og i stand til å gjennomføre et livslangt medisinsk regime etter transplantasjonen. Tidligere var det en 60-årsgrense for transplantasjon, men opphevingen av denne har ikke ført til noen særlig økning i andelen eldre pasienter.55
Pasientene må bruke immundempende medisiner resten av livet. Avstøtning er det største problemet etter transplantasjon både på kort og lang sikt. Etter hjemreise kontrolleres pasientene livet ut hos fastlegen og hos hjertespesialist på henvisende sykehus, samt ved sjeldnere kontroller på Oslo universitetssykehus, Rikshospitalet. Nesten 90 % av pasientene lever mer enn ett år, vel 80 % mer enn fem år (Figur 4.3) og halvdelen mer enn 12 år etter transplantasjonen.56 Mottakerens og donors alder påvirker overlevelsen. Yngre pasienter (< 50 år) har den signifikant beste prognosen uansett donors alder, mens kombinasjonen eldre pasient (> 50 år) og eldre donor (> 35 år) gir dårligst overlevelse. Transplantasjonsresultatene i Norge holder internasjonalt toppnivå.
Hjertetransplantasjon er ressurskrevende. DRG-taksten (2010) var 885 000 kroner.57 Årlige kostnader i langtidsoppfølgningen varierer betydelig og er avhengig blant annet av immunsuppresjonen pasienten får og eventuelle komplikasjoner. En mulig fremtidig alternativ behandling med mekanisk pumpe er i dag vanskelig å kostnadsberegne, men blir neppe billigere.
Enkelte hjertelidelser kompliseres med lungeskade. I slike tilfelle er samtidig transplantasjon av både hjerte og lunger eneste mulighet for langtids overlevelse.58 Dette er et stort og komplisert inngrep fortrinnsvis for yngre pasienter. 26 pasienter er behandlet siden 1986 (en i 2010), og overlevelsen er i de senere år nær nivået etter hjertetransplantasjon.5960
4.1.2.4 Lungetransplantasjon
Lungetransplantasjon er eneste mulighet for langtids overlevelse når lungene ødelegges av sykdom slik at utvekslingen av oksygen og karbondioksyd i lungene ikke lenger kan opprettholde livet.
Siden starten i 1990 er det utført 313 lungetransplantasjoner i Norge (Figur 4.1). De fleste pasientene ble behandlet for kronisk obstruktiv lungelidelse, lungefibrose eller cystisk fibrose (en medfødt kronisk lidelse). De første årene ble de fleste pasientene transplantert med en lunge; senere har transplantasjon av begge donorlungene vist seg å være et bedre tilbud for de fleste pasientene.61
Pasientene henvises til og undersøkes ved Oslo universitetssykehus, Rikshospitalet til vurdering for lungetransplantasjon. Antall henvisninger har øket sterkt til mer enn hundre årlig. Ikke alle er medisinsk egnet for transplantasjonsbehandling. Selv om man har kunnet strekke aldersgrensen oppad, blir resultatene dårligere, særlig over 55-60 år. I Norge har man av flere grunner hittil ikke transplantert lunger til barn. Tilbudet av donorlunger til transplantasjon er sterkt begrenset. De fleste avdøde givere har lungeskade enten som følge av respiratorbehandling før døden inntrådte, av røyking og/eller er i en donoralder hvor lungene egner seg dårlig til transplantasjon. Organtilbudet er altfor lite til at alle som kanskje kunne ha nytte av det kan transplanteres. Seleksjonskriteriene må ta hensyn til antall leveår som kan vinnes ved behandlingen. Antall transplantasjoner og antall pasienter på ventelisten har vært forholdsvis stabil de senere år (Figur 4.1 og 4.4). Pasientene settes på venteliste når forventet levetid uten transplantasjon vurderes som mindre enn 1-2 år. Likevel dør 4-10 pasienter årlig mens de venter (Figur 4.4). I 2010 ble det utført 32 lungetransplantasjoner, 42 stod på ventelisten, og 4 døde på ventelisten.6263
Etter hjemreise følges pasientene opp hos egen lege og ved henvisende sykehus, men også ved jevnlige kontroller ved Oslo universitetssykehus, Rikshospitalet. Avstøtning, også i en kronisk form lang tid ut i forløpet, er det største problemet. Resultatene etter lungetransplantasjon var derfor internasjonalt lenge dårligere enn etter annen organtransplantasjon. De senere år har dette rettet seg noe, og viser i Norge nå en overlevelse på vel 85 % etter ett år og vel 70 % etter fem år (se Figur 4.3). Det norske behandlingstilbudet er godt i internasjonal sammenheng,64 men begrenses av mangelen på organer. Forhåpentligvis kan bedre preservering og restituering av donorlunger gi resultater i fremtiden; likeså tiltak for å øke antall organdonasjoner fra avdøde.
Lungetransplantasjon er et ressurskrevende behandlingstilbud. DRG-refusjonen for sykehusoppholdet knyttet til transplantasjonen, er 567 000 kroner. I tillegg kreves betydelig innsats til undersøkelse og vurdering av henviste pasienter, samt til livslang oppfølging av pasientene etter transplantasjonen.
4.1.2.5 Transplantasjon av bukspyttkjertel (Pankreas)
Diabetes skyldes enten autoimmun sykdom som ødelegger de insulinproduserende cellene i bukspyttkjertelen (type 1 diabetes, «ungdomsdiabetes»), eller andre tilstander som gir dårlig effekt av insulinproduksjonen (type 2 diabetes, «aldersdiabetes», «fedmediabetes»). Sykdommen behandles vanligvis med tilpasset kosthold kombinert med insulinsprøyter ved type 1 og tabletter (eller insulin) ved type 2. Ved dårlig sykdomskontroll tilstøter komplikasjoner på lang sikt (hjerte-karsykdom, nyresvikt, blindhet, koldbrann i armer og bein o.a). Selv om slike komplikasjoner langt på vei kan unngås ved moderne insulinbehandling og nøyaktig oppfølging, forekommer de fortsatt.
Siden 1983 (i Norge) har transplantasjon av bukspyttkjertelen (som inneholder kroppens insulinproduserende celler) vist seg å være et godt alternativ til insulinbehandling ved type 1 diabetes.65 Kjertelen transplanteres fra en avdød giver. Pasientens sukkerstoffskifte normaliseres meget raskt etter transplantasjon, og resultatene så langt tyder på at (videre-) utvikling av diabeteskomplikasjoner i stor grad unngås.66 Pasientene kan leve tilnærmet «normalt» og slipper kostrestriksjoner og en for mange slitsom insulinbehandling. På den annen side må de bruke immundempende medisiner for å unngå avstøtning, med den risiko for komplikasjoner det gir. Transplantasjon har derfor stort sett vært brukt til å behandle diabetikere med nyresvikt som komplikasjon til sykdommen. De trenger behandling med nyretransplantasjon og ledsagende immundempende behandling uansett, og får transplantert både nyre og bukspyttkjertel fra samme avdøde giver ved inngrepet.67 Ledende sykehus i USA foretar – pga. desperat organmangel– slike transplantasjoner med en del av bukspyttkjertelen fra en levende giver (foreldre til syke barn). Alvorlige komplikasjoner hos giveren er rapportert, og metoden brukes ikke i Norge.
Enkelte unge pasienter uten nyresvikt, men med svært vanskelig regulerbar diabetes (og gjentatte «sukkerslag» og «insulinsjokk»), behandles med transplantasjon av bukspyttkjertel alene. Behovet for denne type transplantasjon er økende som følge av gode resultater.
De siste 10 årene er det utviklet en alternativ transplantasjonsmetode for slike pasienter. Ettersom insulin bare produseres i bukspyttkjertelens såkalte «øyceller» (som utgjør ca. 2 % av kjertelen), har man isolert disse øycellene fra resten av kjertelen (gjøres i et spesiallaboratorium i Uppsala eller på Oslo universitetssykehus) og transplantert disse. Selve transplantasjonen er et mye mindre (men teknisk avansert) inngrep med mindre risiko enn konvensjonell transplantasjon. Pasientene må imidlertid bruke immundempende behandling, og effekten er ikke så god/langvarig som ved transplantasjon av hele bukspyttkjertelen.68
Pasientene blir henvist til og innlagt på Oslo universitetssykehus, Rikshospitalet for undersøkelse og vurdering for transplantasjon med bukspyttkjertel. Ikke alle tilbys transplantasjon, oftest fordi allerede utviklede diabeteskomplikasjoner, særlig hjerte-kar sykdom, medfører at pasienten ikke er tjent med slik behandling. Kombinert nyre-pankreastransplantasjon er adskillig mer komplisert enn nyretransplantasjon alene, og sykehusoppholdet er mer langvarig. Øycelle-transplantasjon krever derimot bare noen få dager. Etter hjemreise følges pasientene opp av fastlege og leger på henvisende sykehus, samt ved Oslo universitetssykehus, Rikshospitalet.
Totalt er det (t.o.m. 2010) utført 262 transplantasjoner av bukspyttkjertel (hvorav 235 kombinert med nyretransplantasjon) og 51 transplantasjoner av øyceller.69 I 2010 var tallene 14 og 6, en pasient fikk bare pankreas (helorgan).70 Fire pasienter ventet på kombinert transplantasjon og 19 på øycelletransplantasjon.71
Både pga. kirurgiske komplikasjoner og større avstøtningstendens var resultatene i mange år dårligere etter brukspyttkjerteltransplantasjon enn etter nyretransplantasjon. Nyrene som ble transplantert ved kombinert transplantasjon, har derimot hatt samme «overlevelse» som når bare nyre transplanteres. De senere år har forbedret teknikk og immundempende behandling bedret resultatene. Ved kombinerte transplantasjoner er nå ca. 85 % av pasientene uten behov for insulinbehandling etter ett år og ca. 75 % etter fem år.72 I internasjonal sammenheng har Norge i mange år ligget i fremste rekke.73
Etter øycelletransplantasjon blir diabetessykdommen langt lettere å regulere. To-tre transplantasjoner er oftest nødvendig før all insulinbehandling kan avsluttes. Ca. 80 % er uten behov for slik behandling etter ett år, men bare 20 % etter fem år.74 Likevel er dette et godt tilbud for pasientene. Behandlingen krever imidlertid mange donororganer, hvilket begrenser tilbudet. Metoden er i stadig utvikling, og kan kanskje bli en behandlingsmulighet for flere diabetikere enn i dag. Som kjent er diabetes en sykdom i sterk økning også i vårt land.
Transplantasjon av bukspyttkjertel (enten alene eller kombinert med nyre) er mer ressurskrevende enn nyretransplantasjon. Alle disse former for transplantasjon refunderes etter en DRG-takst som i 2010 var kr. 316 000.
4.1.2.6 Transplantasjon av hornhinne
Hornhinnetransplantasjon er aktuelt for de fleste tilfeller som medfører uklarheter i hornhinnen, og prognosen for bedring er god. Transplantasjoner utføres ved Oslo universitetssykehus (Ullevål), Haukeland sykehus og ved St. Olavs Hospital.
St. Olavs Hospital dekker Helse Midt og Helse Nord. På grunn av at sykehuset har spesialfelt keratoproteser,75 dekkes også noen få pasienter fra Helse Vest og Helse Sør/Øst. Det benyttes kun importerte hornhinner (USA, Holland og Sverige).76 I Trondheim er det et halvt til ett års ventetid for behandling, og det står mellom 30-40 pasienter på venteliste til enhver tid. Det blir utført ca. 50-60 hornhinnetransplantasjoner hvert år. Pr. november 2010 er det transplantert 63 pasienter.
Haukeland sykehus har en ventetid på 8 uker for utredning og 32 uker for innleggelse. Det ble utført 19 transplantasjoner i 2009.77
Oslo universitetssykehus, Ullevål står for ca. halvparten av alle hornhinnetransplantasjoner i Norge og er det eneste sykehus som har en hornhinnebank. I 2009 ble det utført 174 transplantasjoner, hvorav 169 med importerte hornhinner. I 2010 ble det utført 110 transplantasjoner, hvorav 97 med importerte hornhinner. Andelen hornhinner fra norske donorer er økende, og pr august 2011 ble det transplantert 58 hornhinner fra norske donorer. Ventelisten i dag er på ca. 4-5 mnd.
4.1.2.7 Transplantasjon av blod- og immunstamceller («Benmargtransplantasjon»)
Ved transplantasjon av blod- og immunstamceller transplanteres celler med evne til å produsere nye blodceller og immunceller. Slike stamceller, som utgjør færre enn 1 % av benmargens celler, doneres bare fra levende givere. Fra starten ble slike stamceller suget ut fra benmargen i en frisk givers hoftekam v.h.a. grove nåler, noe som krevde narkose. Behandlingen ble derfor tidligere kalt benmargtransplantasjon. Senere har det vist seg at man kan få slike stamceller fra giverens sirkulerende blod dersom han/hun på forhånd behandles med visse medikamenter. Donasjonen krever da ikke narkose, men giveren kobles til en maskin som separerer ut stamcellene og gir resten av blodet tilbake. Denne metoden egner seg dårlig når giveren er et barn. Også blod som tappes fra navlestrengen (etter avklemming etter fødselen) inneholder mange stamceller som kan brukes til transplantasjon, men brukes lite i Norge.78
Behandlingen er i dag aktuell for flere pasientgrupper:79
Noen former for blodkreft (leukemi) og lymfekreft (lymfom). De fleste barn behandles i dag vellykket med cytostatika («cellegift»). Hos voksne svikter slik behandling ofte fordi man ikke kan bruke stor nok dose til å drepe kreftcellene uten også å drepe benmargens stamceller. Ved stamcelletransplantasjon kan man se bort fra denne begrensning og bruke en ellers dødelig cytostatikadose (i starten brukte man røntgen eller radioaktiv bestråling). Etter kreftbehandlingen får pasienten nye stamceller fra en frisk giver.
Visse blodsykdommer, hos barn og voksne.
Visse medfødte/arvelige lidelser med sviktende utvikling av immunsystemet og tidlig død pga infeksjon, eller sviktende produksjon av blodceller og tidlig død.
Enkelte sjeldne genetiske, oftest arvelige stoffskiftelidelser som gir utvikling av bl.a. hjerneskade og ofte tidlig død.
Etter ulykker med ioniserende stråling (radioaktivitet, røntgen) eller kjemikalier som dreper benmargen.
Den første vellykkede stamcelletransplantasjon ble utført i USA i 1963. Transplantasjon av stamceller viste seg biologisk mer komplisert enn organtransplantasjon: 1) Problemet med avstøtning er større (unntatt hos barn med immunsvikt som mangler evne til avstøtning). Ved transplantasjon til kreftpasienter ødelegger imidlertid kraftig forutgående kreftbehandling (vanligvis) pasientens immunfunksjon, og avstøtning unngås. Ved alle stamcelletransplantasjoner kreves imidlertid stor HLA-vevstypelikhet mellom giver og mottager. 2) Mens et transplantert organ vanligvis begynner å fungere raskt etter transplantasjonen, kan det ta uker til de transplanterte stamcellene produserer nok blod- og immunceller. I denne periode er pasienten sterkt infeksjonstruet og mangler blodproduksjon. Plagsomme og ofte farlige bivirkninger av cytostatikabehandlingen er vanlig. Pasientene trenger derfor i ukevis omfattende sykepleie i beskyttende isolat, intravenøs ernæring, blodtransfusjoner og omfattende infeksjonsdiagnostikk og -behandling. 3) Visse immunceller fra giveren kan reagere immunologisk mot pasienten, en slags omvendt avstøtningsprosess som kan forårsake såkalt transplantat mot vert («graft versus host») sykdom (GvHd). Den kan være dødelig. For å unngå dette gis immundempende behandling. GvHd forekommer hyppigere ved transplantasjon fra andre givere enn HLA-identiske søsken. Vanligvis skjer det en gradvis immunologisk tilpasning, hvor pasientens immunfunksjon helt eller delvis «slukner» og erstattes av giverens. Stamcelletransplantasjon kan således utføres på tvers av blodgrupper. I motsetning til organtransplanterte, kan stamcelletransplanterte som regel avslutte den immundempende behandlingen etter et halvår. Noen pasienter sliter imidlertid med vedvarende GvHd og må fortsette slik behandling. Andre får tilbakefall av blodkreftsykdommen tross vellykket transplantasjon. Pasienter med GvHd får imidlertid sjeldnere tilbakefall, noe som i dag er gjenstand for omfattende forskningsinnsats og klinisk utprøving (såkalt RIC-transplantasjon).80
Den første stamcelletransplantasjon i Norge i 1968 lyktes fordi giveren var en enegget tvilling.81 I 1981 startet man med stamcelletransplantasjoner fra HLA-identiske søsken på Rikshospitalet (i samarbeid med Radiumhospitalet som ga røntgenbestrålingen). De første årene behandlet man stort sett pasienter med langtkommet sykdom, og resultatene bar preg av det.82 Senere transplanterte man tidligere i sykdomsutviklingen, og kunne ta i bruk en rekke nye behandlingsmetoder. Flere enn halvdelen av pasientene ble helbredet, og stadig flere pasienter ble henvist til transplantasjon.
Behandlingskapasiteten ble i mange år sterkt begrenset av mangel på isolater og lønns- og driftsmidler. Tross utredning fra Helsedirektoratet i 1989 og henstilling med fremdriftsplan fra et samlet norsk fagmiljø i 1990 uteble bevilgningene.83 Med færre enn ti årlige transplantasjoner økte ventelisten, og pasienter døde mens de ventet. Flere pasienter dro utenlands for egen regning. Dette ble det mediebråk av. Det ble det også når politikere, endog helseministre, blandet seg inn i den medisinske prioritering av enkeltpasienter. Noen pasienter ble bekostet sendt utenlands til eksperimentell behandling i håp om at det skulle hjelpe, mens andre pasienter med gode overlevelsesmuligheter ikke fikk behandling. Det endte med at pasienter ble sendt utenlands – på Oslo universitetssykehus, Rikshospitalets regning, og til en pris som var langt høyere enn det en utvidet norsk behandlingskapasitet ville ha kostet.84
Spesialister i blodsykdommer ved landets universitetssykehus etablerte «Nasjonal rådgivningsgruppe for benmargtransplantasjon», som møttes jevnlig for å vurdere og prioritere søknader om transplantasjon av enkeltpasienter og vurdere resultatene. De fulgte vitenskapelig dokumenterte kriterier som ble revidert i henhold til den medisinske utvikling. Dette var desto mer nødvendig fordi det internasjonalt stadig ble tilbudt udokumentert eksperimentell stamcelletransplantasjon som man i ettertid kunne se ofte hadde feilet, og snarere hadde forkortet enn forlenget livet. Rådgivningsgruppen kunne ha vært et banebrytende tiltak i norsk helsevesen, men ble bare i begrenset grad fulgt opp helsepolitisk. Men gruppen driver fortsatt sitt arbeid, som sikrer faglig forsvarlig behandling og nasjonalt rettferdig fordeling av behandlingskapasiteten.85
Utover 1990årene og senere har medisinske fremskritt gjort det mulig å behandle stadig flere pasienter. Dels kan pasienter opp mot 60 år nå tåle slik behandling. Dels kan andre slektninger enn HLA-identiske søsken gi stamceller hvis det er stor HLA-likhet med pasienten. Fremfor alt kan stamceller nå transplanteres fra en ubeslektet giver med HLA-vevstyper svært lik pasientens. Transplantasjonssentre i mange land rekrutterte blodgivere som også sa seg villige til å gi stamceller ved behov. Dette ble også gjort i Norge (Norsk Benmarggiverregister på Oslo universitetssykehus, Rikshospitalet i samarbeid med landets blodbanker). Fordi man ved internasjonalt samarbeid kan lete etter en egnet giver blant mange millioner mulige givere, kan man i dag finne en giver til nesten alle pasienter som ikke har en giver i sin familie. I noen få tilfelle hvor det ikke lykkes å finne en egnet giver, kan det når det er mulig, transplanteres stamceller fra navlestrengsblod fra ubeslektet giver (tilgjengelig fra enkelte utenlandske store transplantasjonssentre). Stamceller kan lagres lenge nok til å kunne transporteres til en pasient hvor som helst i verden. Omtrent 60 % av norske transplantasjoner utføres med slike stamceller. På den annen side har andre medisinske fremskritt redusert behovet for stamcelletransplantasjon. Ved noen leukemiformer gir nye (og kostbare) medikamenter nå like gode resultater med mindre risiko enn transplantasjon. Transplantasjonskapasiteten kunne etter 1996 økes. I 2007 startet Haukeland universitetssykehus transplantasjon av stamceller fra HLA-identiske søsken (ca. 15 voksne pasienter i året). 86
Pasientene utredes i henhold til nasjonale protokoller før eventuell stamcelletransplantasjon av spesialister i blodsykdommer ved medisinske avdelinger og av barneleger på landets større sykehus. Der utredes det også om det finnes en stamcellegiver i familien. Blodprøver sendes Oslo universitetssykehus, Rikshospitalet for vevstyping. For donasjon av benmarg stilles generelt samme helse- og alderskrav som for blodgivere. I tillegg aksepteres mindreårige, med de tilleggskrav lovgivingen stiller. En stor del av stamcelledonasjonene til barn er gitt av HLA-identiske mindreårige søsken, helt ned til toårsalder. Generelt har familiegivere stilt opp ved behov. Søknad om stamcelletransplantasjon sendes Oslo universitetssykehus, Rikshospitalet, hvor de vurderes i henhold til vedtatte kriterier (se tidligere). Pasient (og eventuelt giver) blir så innlagt for transplantasjon med god tid for planlegging. Sykehusoppholdet varer vanligvis minst en måned, og kan ved komplikasjoner bli langvarig. Etter utskrivelse følges pasientene opp hos fastlege og hematolog eller barnelege på lokalsykehuset. Stamcelledonasjon i narkose (barn) gjøres etter sykehusinnleggelse, med utskrivelse dagen etter. Ellers foregår donasjonen som ved blodgiving. Giverne etterkontrolleres av fastlegen.87
I 2000-2009 ble det ved Rikshospitalet stamcelletransplantert 486 pasienter, hvorav 27 % barn. Bortsett fra noen få med langvarige ryggsmerter har giverne ikke meldt om helseproblemer. De voksne pasientene ble behandlet for blod- og lymfekreft (74 %), og annen blodsykdom. Barna ble behandlet for blodkreft (60 %), aplastisk anemi (5 %) og medfødte/arvelige/genetiske sykdommer. 62 % av alle pasientene var i live etter ett år og 55 % etter fem år. Tilbakefall av den opprinnelige kreftsykdom, GvHd og infeksjon var de vanligste dødsårsaker. Resultatene er noe bedre for barn og unge og for de som får stamceller fra HLA-identisk søsken. Generelt kan man si at de fleste pasienter som overlever det første året, vender tilbake til et tilnærmet normalt liv med god livskvalitet og rehabilitering.88
Behandlingskapasiteten for barn har like fra starten vært noe nær tilstrekkelig. De senere år har man også kunnet behandle de fleste voksne pasienter som den nasjonale rådgivningsgruppen har ment ville være best tjent med stamcelletransplantasjon. Noen få er henvist til behandling i utlandet. Internasjonalt er det ikke full enighet om behandlingsindikasjonene. Den norske rådgivningsgruppen har kanskje mer konsekvent enn andre krevd vitenskapelig dokumentasjon for at forsøksbehandling skal «oppgraderes» til anbefalt behandling, og ressursene har i liten grad muliggjort forsøksbehandling. En norsk ekspertgruppe konkluderte således i 2008 at færre pasienter stamcelletransplanteres i Norge enn i våre naboland, og at kapasiteten bør økes for å nå skandinavisk nivå.89
4.1.2.8 Andre
Transplantasjon av tynntarm, evtl. kombinert med transplantasjon av lever, er i USA og flere europeiske land inkl. Sverige akseptert som standardbehandling. Slike transplantasjoner utføres ikke i Norge, men dekkes av norsk helsevesen etter reglene for behandling i utlandet. Siden 2000 er sju norske pasienter (et barn og seks unge voksne) behandlet i utlandet, fem i Gøteborg og to i USA, i henhold til slik søknad. Alle var henvist via Oslo universitetssykehus, Rikshospitalet. Pasientene hadde fått ødelagt tynntarmen pga. medfødt eller ervervet sykdom, hadde hatt utallige sykehusopphold, overlevd bl.a. ved hjelp av intravenøs ernæring til dels i årevis, og hadde også utviklet leversvikt. Fire pasienter er i dag i live med normalt næringsinntak og leverfunksjon.90 Behovet for tarmtransplantasjon er i Norge så lite (1-4 pasienter pr. år) og behandlingen så komplisert at det norske fagmiljø har ment at det ikke kan utvikles og opprettholdes forsvarlig kompetanse i Norge. Det er derfor inngått avtale om behandling av norske pasienter ved Sahlgrenska sjukhuset i Gøteborg, som er eneste nordiske sykehus med pasientvolum og kompetanse for slik behandling. Behandlingen er svært komplisert og ressurskrevende, og kostbar (minimum NOK 3 millioner).91
Transplantasjon av ansikt og transplantasjon av hånd utføres i USA, England og Frankrike, men må pr i dag ansees som utprøvende behandling, og dekkes derfor ikke av norsk helsevesen. Så vidt vites er ingen norsk pasient behandlet.
Xenotransplantasjon er forbudt, og status pr. i dag er at utviklingen ikke har kommet videre siden forbudet ble innført (se nærmere kapittel 8.12).
4.1.2.9 Prinsipper for fordeling av organer
For organdonasjon er det utarbeidet protokoller med nærmere retningslinjer for bruk av ulike organer til transplantasjon. Disse protokollene gir nærmere kriterier for om organer fra en avdød giver kan aksepteres for transplantasjon. I tillegg gir protokollene retningslinjer for utredning av pasienter med tanke på organtransplantasjon, og etter hvilke kriterier organer skal tildeles:
Nyrer:
Blodgruppeforlikelighet. Blodgruppe O gis bare til blodgruppe O og B
Vevstypeforlikelighet (har betydning for langtidsoverlevelse av transplantatene)
Hastegrad på ventelisten. Pasienter med vedvarende antistoffer mot vevstypeantigener gis etter en viss tid på ventelisten høyere prioritet, da det er vanskelig å finne nyrer som «passer». Dette gjelder ventelisten for hele Scandiatranspant. Barn får høy prioritet (svært sjelden på venteliste, som regel transplantasjon med nyre fra levende giver)
Tid på ventelisten
Aldersmatching (eldre nyrer til eldre mottakere)
Størrelsestilpasning (nyrer fra små givere til små mottakere)
Det er ikke laget noen algoritme for utvelgelse, der de ulike faktorene gis poeng, og der summen bestemmer hvem som blir mottaker. Dette praktiseres enkelte steder med store ventelister. Med relativt få pasienter på venteliste har en slik ordning vært ansett som unødvendig.
Pancreas:
Transplanteres som regel sammen med nyrer. Antallet egnede givere er få. Vevstypeforlikelighet betyr mindre og vektlegges lite.
Blodgruppeforlikelighet. Blodgruppe O gis bare til blodgruppe O og B
Tid på ventelisten
Lever:
Hastegrad på ventelisten (Grad av leversvikt)
Blodgruppeforlikelighet (intet absolutt krav i kritiske situasjoner)
Størrelsestilpasning
Årsak til leversvikt (prioritet for cancer)
Ventetid
Aldersmatching
Hjerte/lunger:
Blodgruppeforlikelighet
Størrelsestilpasning (høyde, vekt, form på thorax)
Hastegrad på ventelisten
Alderstilpasning
Ventetid
CMV-status (lungemottakere)
Vevstypeforlikelighet
Geografisk tilhørighet tillegges ikke vekt. Over tid viser våre data at forholdet mellom meldte pasienter til venteliste for nyretransplantasjon og gjennomførte transplantasjoner er likt for de forskjellige nefrologiske sentre.
4.1.3 Gjennomføring av donasjon fra levende donor
Mange donasjoner gjøres fra levende giver. I praksis gjelder dette hovedsakelig donasjon av nyrer, stamceller og benvev.
Donasjon av organ (nyre)
I Norge er det hvert år 80-90 levende givere av nyre, som utgjør 30-40 % av alle nyretransplantasjonene. I internasjonal sammenheng er dette et meget høyt tall, og i mange land har denne praksis lenge vært sett på som uetisk. Argumentene mot å bruke levende donor er blant annet knyttet til faren for at donor kan bli utsatt for press fra familie eller mottakers lege, press på mottaker (recipient) til å involvere familie og venner, og helsepersonells plikt til ikke å volde skade.92
Norsk nyremedisinsk forening (NNMF) har utarbeidet veiledende retningslinjer for hvordan man tilnærmer seg potensielle givere og hva slags informasjon som skal gis. I protokollen beskrives fremgangsmåten ved seleksjon av levende giver som følger:
Recipienten må først gi uttrykk for og avklare om han/hun aksepterer levende giver, og om det er noen som ikke ønskes som donor. Etter adekvat informasjon skal «recipientens ønske» selvsagt respekteres.
For å unngå unødig press på recipient og donor, skal recipienten ikke selv være aktiv i arbeidet med å utrede muligheten for levende giver. Det vil likevel ofte være naturlig at recipienten informerer familie om behovet for nyre, og om at mulige givere vil bli kontaktet av nefrolog. Recipientens videre medvirkning bør begrense seg til å levere opplysninger om aktuelle pårørende. Dette skjer hensiktsmessig ved at recipienten leverer en navneliste til utredende nefrolog. Prosessen må skje i full åpenhet.
Utredende nefrolog skal ha ansvaret gjennom hele prosessen. Som hovedregel bør familien forholde seg til den samme nefrologen hele tiden.
Som donor aksepteres den nærmeste familie (foreldre, søsken, barn over 18 år, ektefeller, stabile samboere og besteforeldre). Når det gjelder ektefeller og samboere, bør forholdet være av en viss varighet (skjønnsmessig over 3-5 år). I enkelte tilfeller aksepteres også søskenbarn og onkler/tanter men bare når disse melder et spontant giverønske. Nære venner aksepteres etter spesielle retningslinjer og omfattes heller ikke av den gruppe som man aktivt tilnærmer seg med informasjon. Ektefeller i separasjon eller skilsmisse aksepteres ikke.
En første samtale med alle aktuelle kandidater, samlet eller enkeltvis, er å anbefale. Det er en fordel om også recipienten deltar dersom man har en innledende fellessamtale. Invitasjon til slik informasjonssamtale kan skje skriftlig og forslag til standardisert invitasjonsbrev vil bli utarbeidet. Kontakten med de aktuelle kandidatene kan også skje per telefon dersom dette føles naturlig. Under samtalen orienteres det om recipientens sykdom, behandlingsalternativer og prognose. En foreløpig informasjon om donornefrektomi gis, og informasjonsbrosjyre om hva det innebærer å være nyredonor, deles ut (www.nephro.no). Kandidatene må informeres om at donasjonen skal være bygget på frivillighet, og at en potensiell giver kan trekke seg når som helst i prosessen før inngrepet.
Det er viktig at avgjørelsen tas av den enkelte alene. Det kan være en fordel å be dem notere sine tanker og sende sine refleksjoner til nefrologen innen ca. 3 uker. Det kan da være lettere å få frem motforestillinger, noe som vil være til stede i alle familier.
Uansett hvilken fremgangsmåte en velger, kan man ofte ikke unngå at «familiemedlemmene» føler et visst press. Det er nefrologens oppgave å bidra til at presset blir så lite som mulig. Det kan være klokt å presisere at nefrologen har ansvar for å gi «best mulig behandling» til både recipient og potensiell donor. Fastlegen kan være en «utenforstående» diskusjonspartner for aktuelle kandidater.
Innen 3-4 uker vil en oftest vite om det er noen kandidater å gå videre med. De aktuelle kandidatene kontaktes av nefrologen, og ny samtale avtales med hver enkelt. Etter disse samtalene vil en kanskje få mistanke om at det foreligger et press til tross for all forsiktighet. Kandidater som er under åpenbart press, bør avslås som givere. Medisinske opplysninger om potensielle givere er konfidensielle, og begrunnelsen overfor recipienten for å avslå vedkommende donor må være nøytral, dette bør potensielle donores informeres om slik at de ikke behøver å blottlegge seg for eksempel ved manglende motivasjon.
Det er utredende nefrologs ansvar å forsikre seg om at den potensielle giver har en genuin motivasjon. Det må ikke foreligge utenforliggende momenter som utilbørlig press fra recipient eller øvrige familie, økonomiske momenter eller lignende. Dette sikres best ved gjentatte samtaler. Ved mistanke om labilitet eller psykisk sykdom bør psykiater/psykolog delta i prosessen.
Dersom recipient og potensiell giver bor så langt fra hverandre at behandlende nefrolog ikke kan gi informasjon, må kontakten skje via nefrolog på den potensielle donors hjemsted. Recipientens nefrolog er ansvarlig for at nefrologen som skal informere om muligheten for donasjon, er orientert om recipientens sykdom og helsetilstand. Innkalling til informasjonssamtale skjer når potensiell giver er orientert av recipientens nefrolog om at han/hun vil bli innkalt til samtale.
Når det er klart at den/de potensielle giverne er motivert, og det ikke foreligger åpenbar somatisk eller psykisk kontraindikasjon mot donasjon, bør det foretas blodtyping, vevstyping og evt. orienterende screening-undersøkelser. Når utredning av donor og resipient skjer ved forskjellige sentra, er det resipientens sykehus som har ansvar for koordinering av vevstyping.
Hvis det foreligger mer enn én potensiell donor, bør man på et tidlig tidspunkt finne frem til den best egnede, slik at man unngår parallell utredning av flere. Den best egnede bør selekteres ut ifra følgende kriterier.
1. AB0-forlikelighet
2. Donors motivasjon
3. Relative medisinske kontraindikasjoner hos donor
4. Resipientens ønsker
5. HLA-kompatibilitet
Når man har funnet en motivert donor som er blodtypekompatibel, gjennomføres de undersøkelser som er obligatoriske før donasjon (eget donorskjema). Undersøkelsene planlegges slik at giver unngår unødvendig fravær fra jobb eller studier. Potensiell giver innkalles til ny samtale når alle undersøkelser er gjennomført og før papirene sendes til Rikshospitalet, eventuelt gis tilbakemelding til giver etter hvert som svar foreligger. Donor informeres om at de kan komme med ønsker i forhold til tidspunkt for donasjon. Unngå å estimere tid for innleggelse før Rikshospitalet har gitt tilbakemelding. Epikrise sendes til fastlegen.
Etter nefrektomi skal giver til kontroll etter 6 uker og videre etter 3,6 og 12 mnd. Deretter årlige kontroller de første fem årene og videre hvert 5. år. Giver bør få innkalling til kontrollene. Som regel skal kontrollene foregå hos legen som har utredet donor.93
Det fremgår videre av protokollen at forutsetninger for å kunne være nyregiver, er for det første at potensiell donor har fått tilstrekkelig informasjon, både muntlig og skriftlig, og at potensiell donor har forstått informasjonen. I tillegg skal donasjonen være fullt ut altruistisk motivert. Donor må være psykisk og fysisk helt frisk og må gjennomgå standard donorundersøkelse som foretas av nefrolog eller lege med tilknytning til nyremedisin.
Etter at inngrepet er over, får giver en samtale med transplantasjonskoordinator om hvordan det kan være å komme hjem. Koordinator ringer til dem 3-4 uker etter at de har kommet hjem, for å høre hvordan det går med dem. I tillegg sendes det ut oppfølgingsskjema etter ett år, og deretter hvert femte år etter donasjonen både til nyrelegen og til den som har vært giver. De opplysningene som kommer frem her, blir bl.a. brukt til oppdatering av informasjonsbrosjyre til fremtidige levende givere av nyre og til kvalitetssikring av donorprogrammet. Oslo universitetssykehus og Nyremedisinsk forening har utarbeidet et informasjonshefte til potensielle givere hvor mange aspekter ved donasjon, både positive og negative, blir berørt.94 Det er også utarbeidet en nasjonal veileder for organdonasjon fra levende giver (Helsedirektoratet).
Donasjon av immun- og bloddannende stamceller
Fra voksne doneres stamcellene vanligvis fra perifert blod ved en prosedyre som likner en del på vanlig blodgivning. Giveren forbehandles i fem dager med et medikament (stamcelle-stimulerende vekstfaktor, G-CSF). Fra barn hentes stamcellene fra hoftekammens benmarg i narkose (uten bruk av slik forbehandling).
Donasjon av stamceller skjer enten ved at en person i nær familie donerer, eller ved at ordinære blodgivere registrerer seg i benmargsgiverregisteret. Det er bare blodgivere som kan bli registrert som stamcelledonor, og skal følgelig oppfylle de samme helsemessige krav som blodgivere. Når man er registrert i benmargsgiverregisteret, er det bare aktuelt å donere dersom det finnes en pasient som har en vevstype som passer med givers. Giver blir i så fall spurt om å gi ny blodprøve for en utvidet vevstyping. Dersom vevstypen fortsatt passer, blir giveren spurt om å komme til samtale og helseundersøkelse. I samtalen blir det diskutert om donasjonen skal gjøres ved tapping av benmarg i narkose eller fra perifert blod.
En annen måte å skaffe immun- og bloddannende stamceller på er å tappe blod fra den del av navlestrengen som etter fødsel og avklemming vanligvis destrueres. Dette navlestrengsblodet kan lagres nedfrosset i mange år. Metoden brukes i Norge hvor et søsken av det nyfødte barnet trenger behandling med stamcelletransplantasjon. Prosedyren planlegges i god tid før fødselen med skriftlig informert samtykke fra moren. Utenlands donerer mødre på samme måte, navlestrengsblod til spesielle navlestrengsblodbanker. Disse vevstyper blodet og lagrer det i nedfrosset tilstand. Navlestrengsblod kan senere tines opp og transplanteres til pasienter, gitt at det er tilstrekkelig vevstypelikhet mellom mottakeren og navlestrengsblodet. I Norge transplanteres årlig 1-3 pasienter med navlestrengsblod fra utenlandske navlestrengsblodbanker og inntil én pasient med navlestrengsblod fra et søsken.95
Donasjon av benvev
I rundskriv IK-17/2001 fra Statens helsetilsyn er det gitt retningslinjer for donasjon av benvev. Her fremgår at donor skal informeres og gi samtykke. Samtykket skal enten være skriftlig, eller det skal dokumenteres i pasientjournalen.
De helsemessige kravene tilsvarer i hovedsak de krav som stilles til blodgivere.
Donor er som oftest en pasient som skal inn til primære hofteproteser, og uttaket tilsvarer det benvevet som fjernes for å sette inn protesen.
4.1.4 Gjennomføring av donasjon fra avdød donor
4.1.4.1 Innledning
Fra avdød giver benyttes blant annet hjerte, lunger, lever, bukspyttkjertel, hornhinner og nyrer til transplantasjon. Hvilke organer, vev og celler som er medisinsk egnet for transplantasjon, vurderes ut fra organ/vevsfunksjonen i hvert enkelt tilfelle. I Norge ble det i 2010 donert organer fra 102 avdøde donorer, og 353 pasienter fikk behandling med transplantasjon av organ eller øyceller (fra donasjon av bukspyttkjertel). Tallet er økende, og pr. 30.9.2011 var det donert organer fra 102 avdøde donorer, og 314 pasienter fikk transplantasjon av organ eller øyceller.96 Når det gjelder hornhinnedonasjon, er det et stadig økende antall hornhinner som kommer fra norske donorer. Redegjørelsen i 4.1.4.2 og 4.1.4.3 omhandler organdonasjon, mens kapittel 4.1.4.4 gjelder hornhinnedonasjon.
4.1.4.2 Aktørene i prosessen
Donasjon av organer og transplantasjonsvirksomheten består pr. i dag av følgende elementer:
Donorsykehus: Et sykehus som er godkjent for å utføre organdonasjon etter transplantasjonsloven § 2. Sykehuset skal disponere over det nødvendige medisinske utstyr og fagpersonell for å kunne gjennomføre en forsvarlig donasjonsprosess av organer fra avdøde donorer. 28 av landets sykehus er godkjent som donorsykehus. Alle donorsykehusene skal ha oppnevnt en donoransvarlig lege.97
Transplantasjonsvirksomhet: Organtransplantasjon, det vil si transplantasjon av hjerte, lunger, lever, bukspyttkjertel og nyrer, er en landsfunksjon som er plassert ved Oslo universitetssykehus, Rikshospitalet. Når det gjelder benmargtransplantasjon, er dette en flerregional tjeneste som også gis ved Haukeland universitetssykehus. Det er bred enighet i det medisinske fagmiljøet om at organtransplantasjonen skal konsentreres på ett sted. Begrunnelsen er at ett senter gir faglige, driftsmessige og økonomiske stordriftsfordeler, og at det er lettere å organisere både organdonasjonsprosessen og transplantasjonsvirksomheten som ledd i en total omsorg. Oslo universitetssykehus, Rikshospitalet har i dag et av verdens største sentra for nyretransplantasjon. Det store antall transplantasjoner har dannet grunnlag for klinisk forskning, og dermed gjort fagmiljøet attraktivt som samarbeidspartner internasjonalt.
Transplantasjonskoordinator: Pr. 2011 er det ansatt seks transplantasjonskoordinatorer ved Oslo universitetssykehus, Rikshospitalet. De er bindeleddet mellom de 28 donorsykehusene og transplantasjonsteamet på Oslo universitetssykehus. I tillegg fungerer transplantasjonskoordinatorene som veiledere for donorsykehusene og koordinerer og tilrettelegger gjennomføringen av organuttaket. Koordinatene er ansatt ved Kirurgisk klinikk hvor transplantasjon av lever, bukspyttkjertel og nyrer utføres, men bistår også ved hjerte- og lungedonasjon. Vakthavende transplantasjonskoordinator har døgnvakt og er tilgjengelig via Oslo universitetssykehus sitt sentralbord 24 timer i døgnet.
Donorteam: Oslo universitetssykehus, Rikshospitalets donorteam foretar uttaket av organer. Teamet består av transplantasjonskoordinator, operasjonssykepleiere, anestesileger og kirurger som er spesialister på de ulike organene. De aller fleste organene tas ut på sykehuset der donor er, og transporteres deretter til Oslo.
4.1.4.3 Organisering av donasjonsprosessen
Donorsykehusenes oppgave er å kartlegge og følge opp alle mulige organgivere. Organgiver er en person som dør av en erkjent hjerneskade eller en annen tilstand som medfører opphevet blodsirkulasjon i hjernen, men hvor hjerte- og åndedrettsfunksjonen kan opprettholdes kunstig ved hjelp av respirator og medikamenter etter at pasienten er diagnostisert som død.
Etter innføring av hjernedødsbegrepet (død på bakgrunn av total ødeleggelse av hjernen) på 70-tallet, ble det kun tatt organer fra donorer der organfunksjonen kan opprettholdes på kunstig vis. På grunn av det økende behovet for organer, har man de siste årene (særlig etter ca. 2000) reist spørsmål om man bør benytte donorer også der sirkulasjonen er opphørt, såkalt DCD-donasjon (donation after cardiac death). Dette gjøres i en del andre land. Se nærmere avsnitt 7.2.6.
Spørsmål om organdonasjon er bare aktuelt når alle tegn tyder på at pasienten ikke vil overleve. Mens pasienten er koblet til respirator, og legen formoder at pasienten er død, informeres pårørende om mistanken. Legen utfører et sett kliniske undersøkelser for å søke bekreftelse om at pasienten er død (klinisk dødsdiagnostikk).98 Dødsdiagnostikken er regulert i egen forskrift, og de påbudte undersøkelsene er nærmere beskrevet i Oslo Universitetssykehus Rikshospitalets protokoll for organdonasjon, rettet mot donorsykehusene.99
I denne protokollen er oppfølgingen av potensielle donorer nærmere omtalt – herunder avklaring av samtykke, organpreservasjon og uttak av organer.
Donorsykehuset bør ta kontakt med transplantasjonskoordinator ved Oslo universitetssykehus før de kliniske tester er gjennomført, for å avklare om vedkommende kan godkjennes som organgiver. Denne første kontakten vil alltid være med et forbehold om endelig bekreftelse av død, påvist opphevet sirkulasjon til hjernen (cerebral angiografi), og at avdøde ikke har stilt seg negativ til organdonasjon. Donorsykehuset må fra et tidlig tidspunkt i prosessen iverksette tiltak for organpreservasjon. En forutsetning for å kunne benytte organer til transplantasjon er at organfunksjon opprettholdes ved hjelp av respirator, væske og medikamenter. Dette krever kontinuerlig overvåking.100
Transplantasjonskoordinator er bindeledd mellom donorsykehus og transplantasjonsenheten ved Oslo universitetssykehus, Rikshospitalet. Vakthavende transplantasjonskoordinator mottar meldingen om en potensiell organgiver og samler inn medisinske data for å vurdere hvilke organer som eventuelt kan benyttes. Opplysningene videreformidles til vakthavende transplantasjonskirurg som gjør en medisinsk vurdering og godkjenner organene for transplantasjon. Donorsykehuset sender deretter blodprøver for blodgruppe- og vevstyping til Immunologisk institutt ved Oslo universitetssykehus (dette skjer tidlig i prosessen, som regel uten at pårørende er informert, og uten at donasjonsspørsmålet er avklart). I tillegg til intensivbehandling og diagnostikk har personalet ved donorsykehuset også ansvar for å avklare spørsmål om organdonasjon med de pårørende. NORODs anbefaling er at man avklarer samtykke til organdonasjon når de kliniske funn viser at pasienten er død, men før man har utført cerebral angiografi/arkografi. Slik røntgenundersøkelse er unødvendig dersom organdonasjon avslås. Denne anbefalingen følges ved de fleste donorsykehus.
Det er etablert praksis at pårørende involveres i spørsmål om organdonasjon. Dersom avdødes holdning til organdonasjon er kjent, bør denne respekteres. Oftest kjenner pårørende ikke avdødes holdning, og i slike tilfeller må en spørre om avdødes sannsynlige holdning til organdonasjon. Pårørende skal også opplyses om at de kan motsette seg organdonasjon. Informasjon til pårørende skal gis på en hensynsfull og tillitsfremmende måte, og man skal sikre seg at pårørende har forstått informasjonen og hva den innebærer. Spørsmålet om organdonasjon skal stilles med et positivt svar som mål, noe som oppnås lettest dersom den som spør, selv er positiv til organdonasjon. I tillegg skal den som spør, ha kunnskap om kommunikasjon og evner til empati. Det er imidlertid viktig at spørsmålet stilles slik at de pårørende forstår at deres holdning blir respektert uavhengig av hva svaret blir.101
Spørsmålet om organdonasjon kommer ofte overraskende på de pårørende. Forskning viser at måten pårørende blir møtt med, har stor betydning for utfallet, og at sjansen for at de stiller seg positive til donasjon er større dersom pårørende hadde fått mer tid. Pårørende har ofte liten kunnskap om hva donasjon innebærer, og er derfor usikre, for eksempel om donasjonen vil føre til at avdøde endrer utseende. I tillegg er det ofte slik at pårørende ikke kjenner avdødes holdning til organdonasjon. Denne usikkerheten kan føre til at pårørende motsetter seg donasjon.102, 103 Det skjer også at pårørende motsetter seg donasjon til tross for at avdøde har sagt ja.
Når samtykke til organdonasjon foreligger, foretas en røntgenfotografering av hjernens blodårer (cerebral angiografi) for å få bekreftet den kliniske diagnosen. Undersøkelsen skal dokumentere opphevet hjernesirkulasjon og er pr. i dag et ufravikelig krav for å gjennomføre en organdonasjon. Det er imidlertid et problem å finne røntgenleger med kompetanse i å utføre cerebral angiografi, fordi denne ikke lenger kreves for spesialisering i radiologi. På dette tidspunkt får vakthavende transplantasjonskoordinator beskjed om at donasjon kan finne sted. Transplantasjonskoordinator informerer donorteamet. Transplantasjonskirurg velger de best egnede mottakere fra ventelisten og innkaller disse. Det legges stor vekt på å finne mottakere til alle organer som er aktuelle for transplantasjon.
Donorteamet reiser straks ut til donorsykehuset for uttak av organer. Norge er et langstrakt land, og ofte må donorteamet benytte fly for at organene ikke skal være for lenge uten sirkulasjon. Transplantasjonskoordinator organiserer transporten ut til sykehuset. Når teamet er klart til å reise, gir transplantasjonskoordinator beskjed til behandlende lege på donorsykehuset om når de ankommer. Operasjonspersonalet på donorsykehuset gjør klar organgiveren på operasjonsstua, slik at man er klar til operasjon når teamet fra Oslo universitetssykehus ankommer.
Ved ankomst har transplantasjonskoordinator ansvar for å kontrollere at «Spesiell legeerklæring om dødsfall» er riktig fylt ut, og at donors blodgruppe stemmer. Under organuttaket er koordinator praktisk tilrettelegger og administrator, og gir fortløpende tilbakemelding til Oslo universitetssykehus slik at transplantasjon kan planlegges. Retur til Oslo universitetssykehus må organiseres slik at organene kommer frem uten forsinkelser.
Mens teamet er ute og henter organene, planlegges transplantasjonene på Oslo universitetssykehus. Pasientene som har fått tilbud om organer, kommer til sykehuset og blir tatt imot på de ulike avdelingene. Det er mange forberedelser som må gjøres, og det blir foretatt en siste medisinsk vurdering og godkjenning før operasjonen. Når organene er ankommet Oslo universitetssykehus, blir transplantasjonene gjennomført snarest mulig.
Når organuttaket er gjennomført og organene er blitt transplantert til mottakere fra ventelisten, er transplantasjonskoordinator ansvarlig for registrering både i nasjonale registre og register tilknyttet Scandiatransplant, som er en nordisk sammenslutning for utveksling av organer (www.scandiatransplant.org). De nasjonale databasene er pasientregistre, aktivitetsregistre og organspesifikke registre. Her registreres donorsykehus, alder, blodgruppe, dødsårsak og hvilke organer som kunne benyttes. I registeret tilknyttet Scandiatransplant, registreres data om donor, og hvilke pasienter som fikk de ulike organene.
Det er viktig og nødvendig at de pårørendes behov for oppfølging ivaretas også etter at spørsmålet om organdonasjon er avklart. Undersøkelser viser at pårørende ofte har behov for å vite hvordan organene er brukt – om de «er kommet vel frem».104 På grunn av dette anbefaler NOROD at de pårørende får en ettersamtale hvor det kan informeres om hvilke organer som ble transplantert, og hvordan transplantasjonene forløp. Oslo universitetssykehus sender ut et takkebrev til pårørende via donoransvarlig lege på donorsykehuset. Dette kan overrekkes i ettersamtalen, eller sendes til de pårørende etter en telefonsamtale.105
Oslo Universitetssykehus har samlet pårørende til tidligere organdonorer til felles sammenkomst året etter organdonasjonen. Sammenkomsten er arrangert 3 ganger siden 2008. Hensikten er at pårørende skal få møte andre i samme situasjon, få møte en representant for de transplanterte og enda en gang få takk for at de aksepterte organdonasjon i en situasjon fylt av tap og sorg. Oppslutningen og tilbakemeldingene tyder på at arrangementet åpenbart fyller et behov til pårørende til organgivere. Dette behovet belyses og kommer tydelig fram i A.M.B. Jensens nylig publiserte doktorgradsarbeid.106
4.1.4.4 Særlig om hornhinnedonasjon
Ved donasjon av organer og visse typer vev (stamceller) må organene/vevet være sirkulert når de opereres ut. Selv om det ikke er blodkar i hornhinnen, er den også «sirkulert». Kammervann som sirkulerer i fremre del av øyet ernærer hornhinnens endotel, og dette kammervannet produseres fra blod som sirkulerer i strålelegemet. En hornhinne kan doneres etter sirkulasjonsstans og fungere etter transplantasjon, men tiden for uttak post mortem bør være så kort som mulig. Det er derfor fordelaktig med uttak innen 3-8 timer post morten, og 24 timer anses som maksimum.107
Hornhinner anses som vev og omfattes derfor av celleforskriften. Frem til 2008 ble uttak av hornhinner gjort i forbindelse med obduksjoner uten at det ble innhentet konkret samtykke til donasjonen. Norge var derfor selvforsynt med hornhinner, bortsett fra ved Haukeland universitetssjukehus som importerte hornhinner. I 2008 instruerte Helse- og omsorgsdepartementet at helseforetakene skulle innhente samtykke i tråd med gjeldende praksis for organdonasjon. I oppdragsdokumentene for 2009 til de regionale helseforetakene ble det i tillegg forutsatt at virksomhet knyttet til donasjon av hornhinner skal organiseres adskilt fra annen organdonasjon.108 Dette førte til at tilgangen på donorhornhinner tok slutt, og hornhinner måtte derfor importeres. Hornhinnedonasjoner er ikke samordnet med annen organdonasjon og heller ikke omfattet av gjeldende donorkort. Det er bred oppfatning i øyefagmiljøet at dette bør endres. De fleste land tilknyttet European Eye Bank Assosiation (EEBA) har da også inkludert hornhinnedonasjon i den ordinære donasjonsprosessen. Dette er et meget viktig bidrag til å øke kvaliteten på donorvev. Flere studier har vist at kvalitet på donorvev reduseres med post mortem-tid. Ved å inkludere hornhinner i ordinær organdonasjon, vil kvaliteten på hornhinnetransplantasjon bli forbedret.
På Oslo universitetssykehus, Ullevål ble det våren 2009 ansatt en egen donoransvarlig (for hornhinnedonasjon) sykepleier på heltid. Arbeidsoppgavene har blant annet bestått i å bygge opp egne rutiner for uttak, preparering og bevaring av hornhinner. På Ullevål er det nå (pr august 2011) opprettet et samarbeid med fire av seks intensivavdelinger, lungemedisinsk avdeling og Kreftsenteret som tar kontakt når de har en mulig kandidat for hornhinnedonasjon. Tilsvarende samarbeid er opprettet med lungemedisinsk avdeling på Akershus universitetssykehus. Det blir arbeidet med kontinuerlig påminnelse og undervisning/kursing av helsepersonell for å øke donasjonsraten. Det er likevel problematisk å få leger og sykepleiere til å tenke på og vurdere hornhinnedonasjon som en mulighet ved dødsfall i avdelingen, selv om donasjonsviljen blant pårørende er stor, når de blir spurt. Erfaringene fra Oslo universitetssykehus, Ullevål viser at 84,5 % har gitt samtykke til hornhinnedonasjon.
Ved Oslo Universitetssykehus er prosedyren ved hornhinnedonasjon som følger: 109
Ved dødsfall/avsluttende behandling i avdelingen vurderes egnethet for hornhinnedonasjon
Mulig donor meldes til ansvarlig ved Hornhinnebanken, som avklarer med kliniker om eventuelle kontraindikasjoner. Behandlende helsepersonell spør pårørende om samtykke. Hvis pårørende samtykker, fraktes donor til avdeling for patologi for uttak. Nødvendige blodprøver må være tatt senest 24 timer etter døden.
Hornhinnene prepareres i Hornhinnebanken og legges i et lagringsmedium. Etter 2-3 dager ser man på hornhinnen i mikroskop for å vurdere kvalitet og celleantall. Bakteriell prøve tas også av lagringsmedium og sendes til mikrobiologisk avdeling for dyrkning. Lagringsmedium byttes ukentlig frem til transplantasjon.
Transplantasjon skjer senest 28 dager etter uttaket.
Donors etterlatte mottar et takkebrev fra Oslo Universitetssykehus, øyeavdelingen, 5-6 uker etter dødsfall.
Grunnet manglende tilgang på hornhinner fra norske donorer har Øyeavdelingen ved Oslo universitetssykehus, Ullevål opparbeidet et samarbeid med San Diego Eye Bank, USA, som distribuerer øyevev nasjonalt og internasjonalt. Kostnadene som tilfaller, innbefatter uttak, prosessering, bevaring og transport av hornhinner for transplantasjon til norske mottakere.
Det arbeides kontinuerlig med å øke tilgangen på norske donorer, men per i dag er det mangel på tilstrekkelig ressurser for drift av Hornhinnebankvirksomheten. I tillegg til selve driften er det nødvendig med døgnkontinuerlig beredskap for å betjene henvendelser fra avdelinger som har en mulig donor. Det er også av stor betydning å ha bemanning som kan arbeide opp mot de kliniske avdelinger på sykehus som naturlig bør være med i et hornhinnedonasjonsprogram (sykehus hvor enten hornhinnetransplantasjon foregår eller sykehus i nær lokalisasjon). Det må derfor påses at avdelingene bevilges midler for utvidelse av denne virksomheten.
4.1.4.5 Forholdet til rettsmedisinsk obduksjon
Dersom det er aktuelt med rettsmedisinsk obduksjon, er det nå utarbeidet retningslinjer for hvordan slik obduksjon eventuelt kan kombineres med donasjon.110 Retningslinjene lyder som følger:
1. Såfremt det ikke har noen betydning for bevissikringen, bør ikke politiet i forbindelse med sakkyndige/rettsmedisinske likundersøkelser motsette seg uttak av organer til transplantasjon.
Oppstår det motstrid mellom hensynet til bevissikring og behovet for å ta ut organer til transplantasjonsformål, skal saken forelegges påtalemyndigheten til avgjørelse.
2. Det må vurderes hvorvidt det er påkrevet at politiet er tilstede og sørger for nødvendig fotografisk dokumentasjon i forbindelse med organuttak, forut for den sakkyndige likundersøkelse.
4.1.5 Samarbeidsorganisasjoner – nasjonalt
4.1.5.1 Norsk Intensivregister (NIR)
Norsk Intensivregister ble etablert i 1998 og inneholder et sett basisopplysninger om pasienter behandlet ved norske intensivenheter. Registeret henter sine opplysninger fra 42 av landets intensivavdelinger, herunder informasjon fra alle donorsykehus. Registeret har konsesjon fra Datatilsynet etter personopplysningsloven § 33 til å behandle helseopplysninger uten krav om samtykke, men pårørende til den registrerte har reservasjonsrett mot registrering. Helse- og omsorgsdepartementet har gitt dispensasjon fra taushetsplikten i helsepersonelloven til innhenting av opplysninger.
Registrering av potensielle donores i norske intensivavdelinger startet i 2007. Hensikten er å få en nasjonal oversikt over potensialet for donasjoner, kartlegge årsakssammenheng i ikke fullførte donasjonsprosesser og utføre forbedrende arbeid samt øke fokus på kunnskap og holdninger til organdonasjon blant helsepersonell. Det ble utarbeidet skjema for registrering til bruk i intensivavdelingene. Underveis er det registrert et gjennomgående problem i tallmaterialet fra NIR med manglende opplysninger på grunn av ikke fullstendig registrering, samt at tallmaterialet frigis for gjennomlesning for sent til at donoransvarlige leger kan nyttiggjøre seg dette på kort sikt. Fra januar 2011 har NIR startet registrering av data via helsenettet i en ny forbedret elektronisk løsning (MRS).
Ifølge NIR er en registrert pasient også potensiell donor når det er mistenkt eller påvist en potensielt dødelig hjerneskade hos pasienten, I slike tilfeller blir det en tilleggsregistrering som skal kartlegge hvordan oppfølgingen mot donasjon har foregått.
Registreringen for 2011 er regnet som et pilotår, og det gjenstår å se om registreringen gir et entydig bilde av situasjonen. For eksempel er det ingen entydig definisjon av hva begrepene mistenkt eller påvist potensielt hjerneskade utgjør klinisk. Praksis for når man omdefinerer en pasient til å være en potensiell donor varierer. Det samme gjelder videre oppfølging mot donasjon.
4.1.5.2 Særlig om donorsykehusene
Som nevnt i 4.1.5.2 skal donorsykehusene først og fremst vurdere hvem som er mulige organgivere, dernest bidra til at så mange som mulig blir realisert. De viktigste årsakene er at donor avvises av medisinske grunner, eller at avdøde/pårørende har motsatt seg donasjon. Det kan også stilles spørsmål ved om alle potensielle donorer blir fulgt godt nok opp på donorsykehusene. Med utgangspunkt i tallene for 2007 registrert i NIR kan disse skjematisk settes opp som følgende, se figur 4.6.
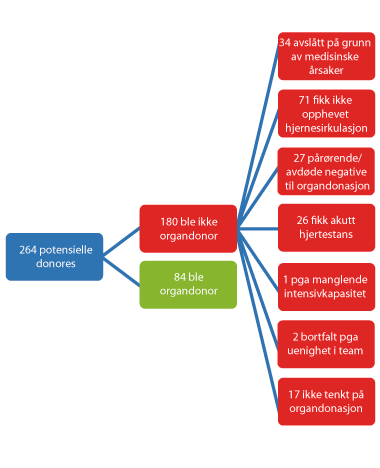
Figur 4.6
27 pårørende/pasienter var negative til organdonasjon. Dette kan muligens reduseres ved hjelp av mer opplysning til publikum og bedre samtaleteknikk når helsepersonellet informerer om at pasienten er død, og at det finnes to alternativer videre: Enten frakobling av respirator og begravelse, eller at pasienten blir donor. Utfallet er avhengig av kommunikasjonen mot pårørende, kunnskapen de pårørende har om avdødes oppfatning, og hva de generelt vet om organdonasjon.
26 pasienter døde av hjertestans. Dette kan tyde på at kompetansen ved sykehusene ikke er god nok til å ivareta pasienter som får opphevet hjernesirkulasjon eller at de ikke er villige til å behandle hvis hjertestans oppstår hos denne pasientgruppen. Dette kan bedres ved hjelp av skolering og holdningsendringer av helsepersonellet.
20 pasienter ble ikke donorer på grunn av organiseringen på sykehusene (manglende intensivkapasitet, uenighet i team, ikke tenkt på organdonasjon). Tallene tyder på at dette ikke skyldes intensivkapasitet, men mangel på kunnskap/årvåkenhet. Uenighet i team, for eksempel om intensivbehandling skal opprettholdes eller igangsettes, kan føre til at donors eventuelle ønske om å bli donor ikke blir fulgt opp. 17 potensielle donorer ble ikke vurdert som organgivere. Dette kan skyldes at en ikke tenker organdonasjon i en hektisk hverdag, og at helsepersonell i mange sykehus ikke har fokus på organdonasjon. Noe av årsaken til dette kan også være at donorsykehusene ikke følger opp pålegget om å ivareta donortilgang. I 2009 var det fortsatt ca. 1/3 av oppnevnte donoransvarlig lege som ikke hadde funksjonsbeskrivelse. Det er i liten grad øremerket ressurser til dette, og et flertall (ca. 65 %) av de stedlige donoransvarlige har funksjonen i tillegg til vanlig jobb.
Det er verdt å merke seg at dersom alle hadde blitt fulgt opp, og halvparten hadde blitt donorer, kunne det ha gitt livreddende behandling til opp mot 50-60 pasienter i 2007. Det er også verdt å merke seg at det er gitt pålegg til de Regionale helseforetak om å avsette tilstrekkelig ressurser til donoransvarlig lege.111
4.1.5.3 Norsk ressursgruppe for organdonasjon (NOROD)
NOROD er en tverrfaglig gruppe som har som formål å etablere et program for opplæring av personell som arbeider med donasjonsprosessene på donorsykehusene. Målsetningen er:
Å øke tilgangen på organer for transplantasjon ved å bevisstgjøre helsepersonell og øke deres kunnskap om organdonasjon, herunder
å sikre ivaretakelse av mulige organgivere (potensielle donorer) og deres pårørende på en best mulig måte,
å bidra til gode rutiner ved donorsykehusene slik at organdonasjon kan gjennomføres når det er aktuelt,
å redusere belastningen på behandlingspersonalet.
Å bistå helsemyndighetene med faglige råd og kompetansehevende tiltak knyttet til organdonasjon.
NOROD har siden 1992 hatt et utdannelsesprogram for personalet ved landets 28 donorsykehus. Det tilbys et todagers seminar med ca. 20 deltagere pr seminar, som arrangeres fire-fem ganger pr. år. I tillegg er det, i samarbeid med Oslo universitetssykehus, Rikshospitalet utarbeidet en protokoll for organdonasjon. Den blir oppdatert med jevne mellomrom og tar for seg donasjonsprosessens alle faser og fungerer som en veileder og håndbok for donorsykehusene. Protokollen foreligger både i papirversjon og elektronisk versjon på Internett.
Transplantasjonskoordinatorene har sekretariatsfunksjonen i NOROD.
4.1.5.4 Nasjonalt fagråd for organdonasjon
I 2005 ble det i Sosial- og helsedirektoratet opprettet en deltidsstilling som nasjonal koordinator for organdonasjon for å bidra til økt antall organdonasjoner. I 2008 fikk Helsedirektoratet i oppdrag å følge opp en rapport fra departementet med anbefalinger for å styrke arbeidet med organdonasjon i donorsykehusene og å opprette og ha sekretariatsfunksjon for et nasjonalt fagråd for organdonasjon. Til oppdraget ligger også oppfølging av de involverte helseforetak og innspill med faglig rådgivning til Helse- og omsorgsdepartementet.
Nasjonalt fagråd for organdonasjon skal bistå Helsedirektoratet i oppfyllelse av målsettingen om å øke tilgang av organdonorer i Norge. Dette må ligge til grunn for alle aktiviteter i rådet.
Fagrådet skal behandle saker innenfor alle deler av donasjonsvirksomheten:
Regelverk
Tilpasning til internasjonalt regelverk
Faglige retningslinjer
Utdanningsaktiviteter for donoransvarlige leger og donorkoordinatorer
Vurdere informasjonstiltak til befolkningen
Fagrådet skal gi råd til Helsedirektoratet i spørsmål som omhandler organdonasjon fra avdød giver. Helsedirektoratet legger fagrådets tilrådinger til grunn for sitt arbeid innenfor transplantasjonsfeltet, og det vil være anledning til å forelegge rådet saker som omhandler transplantasjon og bruk av levende giver.
4.1.5.5 Stiftelsen Organdonasjon
Stiftelsen Organdonasjon ble opprettet i 1997, først som privat stiftelse, deretter som en stiftelse med offentlig stadfestelse i 2003. Bak stiftelsen står fem pasientorganisasjoner:
Landsforeningen for hjerte- og lungesyke (LHL)
Landsforeningen for Nyrepasienter og Transplanterte (LNT)
Foreningen for hjerte- og lungetransplanterte (FHLT)
Foreningen for hjertesyke barn (FFHB)
Norsk forening for cystisk fibrose (NFCF)
Stiftelsens formål er å bidra til å bedre tilgangen på organer for transplantasjoner. Med dette formålet for øye driver stiftelsen utstrakt informasjonsarbeid mot allmennheten om hva organdonasjon er, og hvor viktig det er å ta stilling til organdonasjon.
I tillegg til «tradisjonelle» kommunikasjonskanaler har stiftelsen i utstrakt bruk benyttet nye kanaler som sosiale medier og digital kommunikasjon, og bygget opp høy kompetanse på dette området. Stiftelsen står bak donorkortet, som gir folk mulighet for å dokumentere sitt standpunkt til donasjon. Dette er nå også kommet som egen applikasjon til Smarttelefoner. I tillegg til informasjonsvirksomhet rettet mot allmennheten, arbeider stiftelsen bl.a. med pressearbeid, politisk arbeid samt undervisning i videregående skole.
Stiftelsen mottar størsteparten av sine midler gjennom statsbudsjettet, og har et godt samarbeid både med fagmiljøet, Helse- og omsorgsdepartementet og Helsedirektoratet. Stiftelsen er også representert i Nasjonalt fagråd for organdonasjon.
4.1.6 Samarbeid med internasjonale organisasjoner
4.1.6.1 Norden – Scandiatransplant
Bakgrunnen for opprettelsen av Scandiatransplant de nordiske helseministrenes henvendelse til Nordisk råd i 1969, (se kapittel 3.1.1). Dette nordiske samarbeidet regulerer ventelister og utveksling av organer til transplantasjon. Fra norsk side var immunologen Erik Thorsby og kirurgen Audun Flatmark pådrivere. Det ble tidlig opprettet en felles datasentral i Århus, hvor alle transplantasjonssykehusene i Norden rapporterer sine pasienter og sine organgivere. Organer fra avdøde utveksles i henhold til vedtatte kriterier, som endres i samsvar med den medisinske utvikling. De første 10-15 årene ble mange nyrer utvekslet. Etter hvert som bedre immundempende medisiner ble utviklet, kunne man lempe noe på de immunologiske kravene, slik at det ble lettere å finne egnete pasienter på egen venteliste. De senere år har derfor bare 5-7 % av donornyrene blitt utvekslet. Til gjengjeld begynte man fra 1980-tallet å utveksle også andre organer til transplantasjon, og samarbeidet i Scandiatransplant ble desto viktigere.112
Scandiatransplant omfatter Norge, Sverige, Danmark, Finland og Island, og er nå den formelle samarbeidsorganisasjonen for transplantasjonsvirksomheten i Norden. Organisasjonens formål er å organisere utveksling av og fremme tilgangen på menneskelige organer og vev til bruk ved transplantasjon, samt administrere ventelisteregister for samtlige medlemsland. Scandiatransplant har et styre med ett medlem fra hvert av medlemslandene, samt et representantskap. Samarbeidet er etablert for å få en optimal organutnyttelse med best mulig resultat for mottakerne. Utvekslingen av nyrer fra avdøde skjer etter bestemte kriterier. Nyrer som utveksles i samsvar med disse kriteriene skal «tilbakebetales», om mulig innen seks måneder. For andre organer har man i Norden et system med «urgent» påmelding etter bestemte kriterier. Dersom et av landene har et organ som passer til denne pasienten, har de forpliktet seg til å prioritere den «urgent»-påmeldte pasienten. Enkelte ganger er det av ulike grunner ikke mulig å benytte organene i eget land. Samarbeidspartnere i Skandinavia vil da bli tilbudt organet/organene, men uten krav om «tilbakebetaling». På samme grunnlag mottar Norge organer fra de andre nordiske land.113
Ved årlige møter i Scandiatransplant diskuteres og utarbeides felles retningslinjer, spesielt kriteriene for organutveksling og infeksjonskontroll, samt felles forskningsprosjekter. Scandiatransplant var et tidlig og banebrytende forbilde for internasjonalt forpliktende samarbeid innen medisinen og er et viktig konkret resultat av Nordisk råds virksomhet.
Norske transplantasjonskoordinatorer samarbeider med transplantasjonskoordinatorene i de andre skandinaviske landene. Det er også samarbeid med andre transplantasjonsorganisasjoner i Europa, men ikke så nært som innen Skandinavia.
4.1.6.2 Europeiske transplantasjonsorganisasjoner114
I Europa finnes en rekke transplantasjonsorganisasjoner. Norge og de øvrige medlemmene i Scandiatransplant har i hovedsak forholdt seg til de vesteuropeiske organisasjonene.
Eurotransplant er en sammenslutning av transplantasjonssentre i Tyskland, Belgia, Nederland, Luxembourg og Østerrike.
United Kingdom Transplant Support Service Authority omfatter alle transplantasjonssentre i Storbritannia.
Det finnes tilsvarende organisasjoner i Polen, Sveits, Italia, Frankrike, Spania og i Baltikum. Norge har ingen formelle utvekslingsregler med disse sammenslutningene, men Scandiatransplant har inngått samarbeidsavtale med Balttransplant Foundation, Eurotransplant, Poltransplant, UK Transplant, Ètablissement Français des Greffes og Swisstransplant.
Når det ikke finnes mottakere i Skandinavia, tilbys organene primært til Eurotransplant eller United Kingdom Transplant, eventuelt til andre europeiske transplantasjonsorganisasjoner. På samme grunnlag mottar Scandiatransplant tilbud om organer fra disse organisasjonene.
4.2 Medisinsk obduksjon
4.2.1 Innledning
Obduksjoner er en medisinsk undersøkelse som foretas for å vurdere dødsårsak og sykdomsutviklingen hos den avdøde. I tillegg er obduksjon en viktig kilde til generell kunnskap om kroppens reaksjoner på behandling og sykdom, og om sykdommer i befolkningen.
Obduksjon utføres ved at kroppen undersøkes både utvendig og innvendig. Først undersøkes kroppen utvendig for å se etter ulike ytre tegn, arr etter tidligere inngrep eller eventuelle skader. Det kan være aktuelt å ta prøver av blod eller andre væsker for kjemisk analyse. Deretter åpnes kroppen og de indre organer (hjerne, hals- bryst- og bukorganer ) undersøkes. For at denne indre granskingen skal bli nøyaktig, må organene tas ut og åpnes.115 Ofte er det nødvendig å ta ut biter av vev og hele organer for å ta prøver av dem. I de aller fleste tilfeller legges organene tilbake i kroppen etter obduksjonen. Enkelte ganger er det nødvendig med mer tidkrevende undersøkelser. I slike tilfeller vil aktuelle organer beholdes også etter obduksjonen. Etter avsluttet undersøkelse blir tilbakeholdte organer kremert og asken nedsatt på minnelund.116
I tillegg til obduksjonen, kan også andre handlinger bli foretatt på den avdøde. Organer med sykdom kan være viktige for undervisning av medisinstudenter og annet helsepersonell. Organer som er normale, kan være egnet til undervisning i normal anatomi ved de anatomiske institutter. Den avdødes kropp vil også kunne bli brukt til inntrening av prosedyrer og operasjonsmetoder. Slike øvelser foregår innenfor rammen av de inngrep som selve obduksjonen innebærer og fører sjelden til ytterligere skade på legemet.
4.2.2 Kort historikk
I førhistorisk/tidlighistorisk tid hadde likåpning først og fremst en magisk funksjon, men Herofilus (ca. 300 f.Kr.) dissekerte kadavre og navnga bl.a. prostata og duodenum. Romersk rett hadde visstnok bestemmelser om rettslige likundersøkelser (det sies at Julius Cæsar ble obdusert). Arabiske leger gjorde disseksjoner. Obduksjon med et medisinsk formål ble utført på tolvhundretallet, da man ønsket å finne årsaken til pest. Det har vært gjort systematiske undersøkelser av lik fra det 16. århundre. Fra det 18. århundre ble undersøkelse av lik innført som undersøkelses- og undervisningsmetode for medisinere ved flere europeiske universitet. Skillet mellom anatomisk disseksjon for å lære om normal anatomi og obduksjon i den hensikt å studere sykdomsprosesser var den gang uklart. Patologisk institutt ved Oslo universitetssykehus, Rikshospitalet har fra midten av det 19. århundre vært et anerkjent lærested for studenter og leger. I 1866 ble det opprettet et professorat i generell patologi og patologisk anatomi ved Rikshospitalet. Senere har mange av de norske sykehusene opprettet patologisk anatomiske avdelinger.
Rundt 1970 ble bare de som døde på sykehus, obdusert. Totalt ble 90 % av de døde obdusert dersom de døde på et sykehus med en patologiavdeling.117
Fra midten av 80-tallet og frem til i dag har antall medisinske obduksjoner i Norge falt fra 6153 obduksjoner i 1983 til 1770 obduksjoner i 2010.118
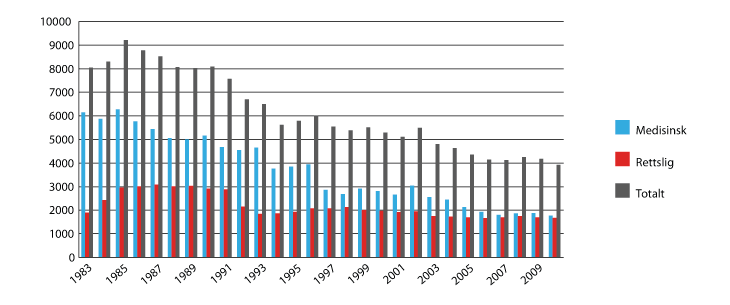
Figur 4.7 Oversikt over obduksjoner 1984-2010
Kilde: Tall fra Den norske patologforening
Figur 4.8 Andel foster/nyfødt av medisinske obduksjoner (%)
Kilde: Tall fra Den norske patologforening
Figur 4.7 og 4.8119 viser antall medisinske obduksjoner (både i og utenfor sykehus), rettslige obduksjoner og fosterobduksjoner. I statistikken fra Den norske patologforening registreres i gruppen «fosterobduksjoner» både obduksjoner av fostre, spedbarn og barn inntil 2 års alder. Majoriteten av obduksjonene i denne gruppen er av fostre fra 12. til 30. svangerskapsuke. Tidligere ble undersøkelse av fostre registrert som histologisk undersøkelse og var derfor ikke underlagt obduksjonsregelverket. Da ultralydundersøkelse i uke 18 ble innført i standard svangerskapsoppfølging, ble det vanlig å obdusere fostre som ble abortert som følge av påviste misdannelser. Fosterobduksjoner blir ikke meldt til Dødsårsaksregisteret.
4.2.3 Praksis
4.2.3.1 Prosedyre
Obduksjon blir rekvirert av lege og utføres på sykehus av lege, fortrinnsvis patologer. Patologer er leger med spesiell kompetanse i sykelige forandringer i celler og vev. Faget beskjeftiger seg med sykdommenes årsak, mekanismer (patogenese) og forandringer av struktur i og funksjoner i organer, vev og celler under sykdom.
Rutinene for begjæring av sykehusobduksjoner varierer mellom de enkelte sykehus. Det finnes ikke noen standardrutiner for når obduksjoner skal begjæres, og de enkelte helseforetak har egne skjema for begjæring av obduksjon. Skjemaene viser at rutinene for hvem som rekvirerer, og hvorfor obduksjon bør rekvireres er lite enhetlig.120 Ulike journalsystemer kan være en forklaring på forskjellene i skjemaer brukt til obduksjonsrekvirering.
Normalt er det klinikerne som rekvirerer obduksjon for å få klarlagt dødsårsaken. Det er imidlertid ingen fast rutine for når man skal rekvirere obduksjon, og som regel er det opp til den enkelte lege å avgjøre om pårørende skal kontaktes for samtale om eventuell reservasjon mot obduksjon osv. Medisinsk obduksjon kan i henhold til transplantasjonsloven § 7 bare gjøres av medisinske grunner. Loven definerer ikke hvem som har rekvisisjonskompetanse, men i praksis er det bare leger som står som rekvirenter. En obduksjonsrapport er å anse som en del av avdødes sykejournal, og er underlagt samme personvernhensyn som sykejournalen.
I umiddelbar tilslutning til obduksjonen blir det ved de fleste patologiavdelinger skrevet en foreløpig obduksjonsrapport med beskrivelse av de makroskopiske funn, dvs. de funn som var synlige for det blotte øyet. Den endelige obduksjonsrapporten tar lenger tid. Prøver fra organene må fremføres og mikroskoperes og eventuelle væskeprøver eller andre spesialundersøkelser analyseres. Som regel tar det 1-2 måneder innen den endelige rapporten er ferdig.121
4.2.3.2 Prosess mot pårørende
Det var til å begynne med ikke vanlig å innhente samtykke eller å informere pårørende om obduksjonen i forkant av obduksjonen. Man baserte seg på den generelle informasjonen som ble gitt i forbindelse med innleggelse. Denne praksisen har vært begrunnet med at obduksjon er et følsomt område, og man ønsket ikke å legge ytterligere belastninger på pårørende som har mistet en nærstående.
Undersøkelser som Helsetilsynet gjennomførte i 1984 og 2001 viste en endring i denne praksisen. Pårørende fikk i større grad konkret informasjon om obduksjon ved dødsfall i 2001 enn i 1984. Undersøkelsen viste videre at de sykehus som informerte om aktuelle obduksjoner, i liten grad fikk nei fra pårørende.122
Obduksjonsforskriften av 2004 satte en endelig stopp for praksisen med å basere seg kun på presumert samtykke. Forskriften påla virksomhetene å informere pårørende om obduksjon der denne var planlagt. I tillegg skulle pårørende informeres om hva obduksjon innebar, og at de hadde reservasjonsrett for obduksjonsundersøkelsen og for eventuell bruk av biologisk materiale til undervisning og forskning.
Normalt er det klinikere som tar opp spørsmålet om obduksjon med pårørende. Det er varierende hvor omfattende informasjon pårørende ønsker og mottar. Patologene som utfører obduksjon, får beskjed om det foreligger reservasjon mot for eksempel bruk av organer i undervisning/opplæring gjennom klinikerens opplysninger/avkryssing på obduksjonsbegjæringen. Patologene tar bare unntaksvis selv direkte kontakt med pårørende om obduksjonsbegjæringen. Det er ikke utarbeidet noen veiledning eller rutiner for hvordan helsepersonell bør tilnærme seg pårørende med tanke på obduksjon.
Ved medisinsk obduksjon av fostre/nyfødte foreligger ved de fleste forespurte fødeavdelinger skriftlige og godt definerte rutiner. Begge foreldre informeres og spørres om obduksjon hvis de er tilstede, men mors ønske tillegges størst vekt. Konflikt mellom mor og far i samtykkeproblematikken er ikke et praktisk problem. Noen avdelinger ønsker skriftlig samtykke, som da gis i form av underskrift på et informasjonsskriv om obduksjonen. Far kan underskrive hvis han er tilstede, men hans samtykke og signatur er ikke nødvendig. Begrunnelsen for dette er at far ikke alltid er tilstede eller er ukjent, og at dette anses som mors avgjørelse.
Én fødeavdeling har erfart dissens hvor far ønsket obduksjon, men ikke mor, og rettet seg da etter mors ønske. Det hender at mor eller et foreldrepar ombestemmer seg. I slike tilfeller dreier det seg som regel om tilbaketrekking av samtykke av religiøse grunner.
Samtidig med samtale om fosterobduksjon informeres mor/foreldreparet ofte også om begravelsesrutiner for fostre. Et sykehus ønsker signatur (fra mor) på at slik informasjon er mottatt, og om det er ønsket kremering med askenedsettelse på anonym minnelund eller begravelse.
Mor eller foreldrene blir alltid informert om resultatet av obduksjonen. Hvis resultatet ikke foreligger på første etterkontroll, avtales tid for ny samtale når obduksjonsresultatet foreligger. Ofte er det flere konsultasjoner, en sjelden gang med patolog til stede. Det er ikke uvanlig at mor eller foreldrene får med kopi av obduksjonsjournalen, blant annet fordi fosterobduksjonene ofte er del av vurderingsgrunnlaget for klagesaker og lignende.
Ved uventet død i forbindelse med fødsel og av barn anses dødsfallene oftest som meldepliktige og samtykkereglene følger påtaleinstruksen. Ved medisinsk obduksjon av fullbårne fostre og barn er praksis som beskrevet for fostre.
Ingen av de forespurte patologiavdelinger obduserer fostre eller barn uten skriftlig bemerkning fra rekvirerende lege om at foreldresamtykke foreligger.
4.2.3.3 Omfang av obduksjoner i dag
Det store flertall av de som obduseres, er døde i sykehus. Obduksjon av personer som ikke døde i eller på vei til sykehus, sykestuer, fødestuer og sykehjem er ikke regulert i transplantasjonsloven. Dersom pårørende ved slike dødsfall ønsker obduksjon, blir dette likevel normalt etterkommet så sant det er kapasitet. Transport av avdøde til patologiavdeling og obduksjonen dekkes også i slike tilfeller av det offentlige.123 Av det totale antall medisinske obduksjoner i 2009 var 11,7 % obduksjoner av personer som døde utenfor helseinstitusjon.124 Mange av dødsfallene er unaturlige dødsfall som er meldepliktige, men som påtalemyndigheten ikke etterforsker.
En nøyaktig beregning av andelen obduksjoner i forhold til totalt antall døde i Norge er ikke mulig, da andelen undersøkte fostre i forhold til dødfødte eller levendefødte barn ikke differensieres i patologforeningens statistikk. De aller fleste av de såkalte fosterobduksjoner gjelder fostre opp til 30. svangerskapsuke. Trekker man fra fosterobduksjonene, utgjør andelen obduserte (rettslige og medisinske) i 2010 8,3 % av alle dødsfall.125
4.2.3.4 Finansiering
De totale kostnader til obduksjonsvirksomheten er usikre. Utgifter til obduksjoner på sykehus inngår i rammefinansieringen. Nyere kostnadsoverslag over virksomheten foreligger ikke.
Egne takster126 godtgjøres av trygden i de tilfelle der dødsfallet har skjedd utenfor sykehus når obduksjonen er rekvirert av lege, men takstene har ikke vært justert vesentlig på mange år. Ved polikliniske obduksjoner benyttes takst 705h kr.1062) for obduksjon uten hjerneundersøkelse, og takst 705i (kr. 480) for separat nevropatologisk undersøkelse. Til sammen utgjør dette en maksimal RTV-refusjon på kr. 1542 pr. poliklinisk undersøkelse. Fra 2009 innførte Folkehelseinstituttet (FHI) et analysegebyr på kr. 1300 for rettstoksikologisk undersøkelse av materiale fra medisinske obduksjoner. Ved medisinske obduksjoner er rettstoksikologisk undersøkelse først og fremst aktuelt ved obduksjon av døde utenfor sykehus, der legemiddalanamnesen ofte er ukjent, og der selvmord eller forgiftning ikke kan utelukkes som dødsårsak. Innføringen av et slikt gebyr uten samtidig justering av polikliniske takster for obduksjon gjør at den polikliniske obduksjonsvirksomheten i praksis utføres uten at sykehusene får dekket sine reelle kostnader.
Salærene for rettslige obduksjoner er på kr. 2155, men benyttes ulikt. Noen undersøkelser krever flere sakkyndige. I tillegg kommer eventuelle hjerneundersøkelser, som betales pr. time, og eventuelle særskilte adminstrasjonsgebyrer. Kostnadene for rettsmedisinske undersøkelser varierer derfor sterkt.
Ifølge Den norske patologforenings arbeidsnormer utgjør 260 obduksjoner ett spesialistårsverk.127 I tillegg kommer undersøkelse av hjernene (ca. 1 spesialistårsverk) samt lønn til obduksjonstekniker og annet personale. Lønnsutgiftene alene tilsier derfor en minimums kostnad pr. obduksjon på mellom kr 10000-15000. De totale utgiftene vil være avhengig blant annet av hvilket omfang eventuelle spesialundersøkelser har i det enkelte kasus.
En begrensende faktor for den polikliniske obduksjonsvirksomheten har vært utgiftene til transport av lik. Endring i båreforskriften fra 2004 gjør at slik transport nå dekkes av folketrygden såfremt obduksjonen er rekvirert av lege. I rundskriv til forskriften presiseres at obduksjon som bare er krevet av de etterlatte, ikke gir grunnlag for dekning av båretransport. Denne presiseringen er uten praktisk betydning, da det i praksis bare er lege som rekivirerer medisinske obduksjoner.
4.2.3.5 Obduksjonsteknikere
Obduksjonsteknikere (også kalt laboranter, preparanter, autopsiteknikere) er en gruppe helsearbeidere som er helt sentrale i obduksjonsvirksomheten. I tillegg til å bistå ved selve obduksjonen, noe som ved medisinske obduksjoner som regel innebærer å klargjøre og åpne liket, ta ut organer, utføre enkel prøvetaking samt å avslutte obduksjonen (gjensying, vasking), har obduksjonsteknikeren også ansvar for hygienen på salen, protokollføring og organisering av likkjeller. Ved rettslige obduksjoner bistår obduksjonsteknikeren også politiet. Etter avtale med begravelsesbyråene står obduksjonsteknikeren ofte for det meste av arbeidet med pynting og nedleggelse av de døde i kiste. I tillegg kommer spesialoppgaver som balsamering og kisteforsegling. Obduksjonsteknikeren organiserer og bistår ved syninger, og har derfor mer kontakt med pårørende enn legene ved patologiavdelingene. Slik sett er obduksjonsteknikeren obduksjonsenhetens ansikt utad og hans eller hennes kunnskap og oppførsel av vesentlig betydning for obduksjonens omdømme i allmennheten.
Tradisjonelt sett har yrkesgruppen vært uten spesialutdanning og har vært lært opp på den enkelte patologiavdeling. Arbeidet er fysisk tungt og psykisk belastende, og foregår ofte adskilt fra mye av den øvrige virksomheten i patologiavdelingene.
4.2.4 Hva er årsaken til nedgangen i obduksjonsfrekvensen?
4.2.4.1 Fallende obduksjonsfrekvens ikke bare i Norge
Som tidligere nevnt har det vært en nedgang i antall medisinske obduksjoner i de fleste land. Mange steder obduseres rundt 10 % eller enda færre av de som dør i sykehus. For de som dør utenfor sykehus, er andelen enda lavere. Sannsynligvis er det flere overlappende faktorer til denne nedgangen. Grovt sett kan disse deles i tre grupper: De som er knyttet til legene som rekvirerer obduksjoner, de som er knyttet til samfunnet og de pårørende, og de som er knyttet til patologer og patologiavdelinger.
4.2.4.2 Sviktende tillit til obduksjon som diagnostisk verktøy
Det har vært en rivende utvikling av diagnostiske metoder i medisinen, ikke minst innen billeddannende diagnostikk, slik som ulike varianter av røntgenundersøkelser, MR og ultralyd. Mange leger kan ha en oppfatning av at en pasient som dør, er blitt undersøkt «godt nok» gjennom slike metoder, og at det er ikke mer å finne ved en obduksjon. Dette er en oppfatning som kun delvis holder mål. En lang rekke undersøkelser viser at det ofte gjøres uventede funn ved obduksjon. (Se kapittel 9.1.2.2.)
Et beslektet argument er at obduksjonen er primært en visuell undersøkelse. Det kan være vanskelig å påvise sykdomsprosesser som ikke gir mange synlige organforandringer, men som hovedsakelig viser seg ved endringer i funksjon. Typiske eksempler på slike prosesser er forstyrrelser i hormonproduksjon og stoffskifte. I de tilfeller der behandlende lege mistenker en slik type sykdom, vil en tradisjonell obduksjon ofte ikke oppfattes som en relevant undersøkelse.
4.2.4.3 Tidspress i klinikken
Mange leger føler et stort tidspress. Dette kan føre til at det blir vanskelig å sette av tid til samtaler med pårørende for å informere om obduksjon. Hvis legene ikke har mulighet til å reflektere over resultatet av en obduksjon og sammenligne obduksjonsfunnene med pasientens sykdomshistorie og funnene som ble gjort mens hun eller han levde, faller også noe av hensikten med obduksjon bort.
4.2.4.4 Risikoen for å bli «avslørt»
Ingen liker å ta feil; med utviklingen av pasientrettigheter de senere år, er det gitt et større fokus på sykehusfeil. Dette kan føre til at klinikere nøler med å rekvirere obduksjon fordi det kan avsløre feil fra deres side. En studie fra USA har undersøkt sammenhengen mellom obduksjon og risikoen for å bli saksøkt av pårørende, men det ble ikke funnet noen korrelasjon. Snarere kan åpenhet og vilje til ettersyn tenkes å forebygge rettslige konflikter.128
4.2.4.5 Innstramming av vilkår for obduksjon
Det blir hevdet at obduksjonsforskriften av 2004 har ført til en betydelig reduksjon av obduksjonsfrekvensen, og i tillegg begrenser muligheten til bruk av materialet som tas ut ved obduksjoner til opplæring og utdanning av helsepersonell. En undersøkelse fra Haukeland universitetssykehus i Bergen viser at da ny obduksjonsforskrift ble innført i 2004, gikk det årlige antall obduserte ned fra 432 (39 %) til 332 (31 %) av alle som døde på sykehuset. Nedgangen var dels en følge av at informasjon til pårørende ikke ble gitt, dels en følge av økt antall nektelser. Antall reservasjoner fra pårørende økte fra 258 (23 %) til 373 (35 %).129 To år senere var antall reservasjoner sunket til 31 %, men obduksjonsfrekvensen likevel redusert ytterligere til 29 %. Andelen pårørende som ikke ble kontaktet med tanke på obduksjon i 2006, var 30 %.
Det er imidlertid ikke gitt at det er de skjerpede kravene i ny obduksjonsforskrift som har hatt avgjørende betydning for nedgangen i obduksjonsfrekvensen. Statistikken over obduksjoner i perioden 1985 – 2007 viser en relativt jevn nedgang i hele perioden. Se figur 4.7.
Undersøkelser viser dessuten at én forklaring på nedgangen i obduksjonsfrekvensen etter innstrammingen av forskriften er at leger vegrer seg mot å informere pårørende om at det er ønskelig med obduksjon.
4.2.4.6 Ressursmangel
Mangel på patologer og økende antall vevsundersøkelser er årsaker som har ført til en restriktiv rekvireringspraksis. Patologenes arbeid dreier seg i hovedsak om diagnostisk arbeid rettet mot levende personer. Vevs- og celleundersøkelser fra pasienter øker, noe som går på bekostning av obduksjonsvirksomheten.
Det er en rekke eksempler fra patologiavdelinger der obduksjoner systematisk har vært avvist med begrunnelse i manglende kapasitet. Selv om kapasitetsproblemene ofte bare har vært midlertidige, er de resulterende fall i obduksjonsfrekvensene ofte vanskelige å reversere. To likelydende undersøkelser av obduksjonspraksis som Helsetilsynet gjennomførte for sykehus som hadde patologiavdeling i 1984 og 2001, viste tydelig endring i begrunnelsen for begjæring av obduksjon. I 1984 begrunnet sykehusene sin rekvireringspraksis med uklar dødsårsak ønske om å få mer kunnskap om sykdommer, ønske om å kunne vurdere effekt av behandling og verifisere sykdomsutbredelse, vurdere trekk ved medfødte misdannelser og lære av egne feil. I 2001 oppga sykehusene kun uklar dødsårsak som rekvireringsgrunn.130
Årsaken til denne endringen kan ligge i at obduksjonspraksis og lovgivningen i begynnelsen av åttiårene ble heftig diskutert, noe som bl.a. resulterte i NOU 1985:37, og at indikasjonene for obduksjon således var godt kjent og presentert i erindringen til de forespurte. Forskjellen mellom 1984 og 2001 kan også representere en holdningsendring, eventuelt en innsnevring av indikasjonene for begjæring, men studien tillater ingen sikre utsagn om dette. Forfatterne av studiene var spesielt bekymret for det manglende aspektet av behov for kontroll med egen praksis. Det er imidlertid usikkert om endret begjæringsindikasjon har bakgrunn i ressursmangel ved patologiavdelingene.
4.2.4.7 Lang svartid for obduksjonsrapporter
Obduksjon blir også nedprioritert av patologene selv, noe som viser seg i lang behandlingstid for obduksjonsrapporter. I undersøkelsen til Berget mfl. (se kapittel 4.2.4.5) ble det også sett på om purring på obduksjonsrapporten samt endring av obduksjonsrutinene kunne påvirke rekvisisjonshyppigheten for obduksjon. Undersøkelsen viste at månedlig purring reduserte median svartid fra 58 dager til 38 dager. Endringen i obduksjonsrutine ga median svartid på 14 dager, mot 46 dager i samme periode året før.
Den lange svartiden tyder også på at obduksjonstjenesten mange steder kan være dårlig organisert. Tjenesten er ofte ikke seksjonert. og det endelige ansvaret for besvarelsene er ofte spredt på mange leger.
Lange svartider gjør at klinikere ofte ikke kan benytte svarene fra obduksjon verken i epikriser eller pårørendesamtaler. Om obduksjonsresultatene ikke kan benyttes i den kliniske hverdagen, vil det å begjære obduksjon ikke ha noen praktisk nytte.
Det har vært skrevet mye om obduksjonens betydning for kvalitetsforbedring i helsevesenet, men langt mindre om kvaliteten av selve obduksjonsarbeidet. Hvis arbeidet med obduksjoner nedprioriteres av patologene, kan det føre til at undersøkelsene, både med det blotte øye og av vevsprøver i mikroskop, ikke blir nøyaktig nok. Det samme gjelder bruk av ulike typer supplerende undersøkelser, for eksempel av blodprøver eller for påvisning av sykdomsfremkallende bakterier. For at en obduksjon skal være av god kvalitet, må patologen også kunne sammenligne obduksjonsfunnene med opplysninger om pasientens sykehistorie og kliniske funn, og den må gi svar på behandlende leges spørsmål. En norsk undersøkelse av kvaliteten på foster- og barneobduksjoner viste at 23 % av obduksjonsrapportene ikke hadde akseptabel kvalitet.131
4.2.5 Rettsmedisinsk obduksjon
Både ved medisinske og rettsmedisinske/rettslige obduksjoner er hovedhensikten å påvise dødsårsak og andre unormale funn, som misdannelser, skader og andre sykdommer, men det er også viktige forskjeller. Mens en medisinsk obduksjon rekvireres av lege, gjøres en rettsmedisinsk obduksjon på oppdrag fra politi eller påtalemyndighet som et ledd i etterforskningen av et mulig unaturlig dødsfall. I større grad enn ved medisinske obduksjoner forventes det at en rettsmedisiner skal bidra til å avklare de ytre omstendigheter (hendelsesforløpet) omkring dødsfallet. Det tilgrunnliggende spørsmålet er om dødsfallet kan knyttes til en straffbar handling. Selv om dette kan avkreftes, vil resultatet av rettsmedisinske undersøkelser kunne være viktig, for eksempel for å belyse hendelsesforløpet ved en ulykke. Rettsmedisinske obduksjoner bidrar også til at dødsårsaksstatistikken blir mer pålitelig.132
Den som utfører rettsmedisinske obduksjoner, må være skolert i påvisning, dokumentasjon og tolkning av funn relatert til ytre påvirkning (skader, giftstoffer), samt ha god kunnskap om forandringer som skjer etter døden.133 Rettsmedisin er ingen egen legespesialitet i Norge, og de fleste leger med denne kompetansen er spesialister i patologi. Ved Avdeling for rettspatologi og klinisk rettsmedisin i Oslo (tidligere Rettsmedisinsk institutt/RMI) har også flere ikke-patologer ansvar for rettsmedisinske obduksjoner. Dette har sin forklaring i at RMI har hatt sin selvstendige basis i universitetet og ikke vært inkorporert i en patologiavdeling.
Dersom dødsfallet anses som mulig unaturlig, skal legen som stadfester døden og vurderer dødsårsaken, underrette politiet, jf. helsepersonelloven § 36. I slike tilfeller kan det iverksettes etterforskning som tilsier rettslig obduksjon. Ifølge forskriftene til helsepersonelloven § 36 skal et dødsfall anses som unaturlig dersom det skyldes
drap eller annen legemskrenkelse,
selvmord eller selvvoldt skade,
ulykke som forlis, brann, skred, lynnedslag, drukning, fall, trafikkulykke og lignende,
yrkesulykke eller yrkesskade,
feil, forsømmelse eller uhell ved undersøkelse eller behandling av sykdom eller skade,
misbruk av narkotika,
ukjent årsak når døden har inntrådt plutselig og uventet.
Som unaturlig meldes også dødsfall i fengsel eller under sivil eller militær arrest og funn av ukjent lik.
Pårørende vil i mange tilfeller svært gjerne vite hva deres nærmeste døde av og hva som kan ha hendt i tiden før dødens inntreden. Rettsmedisinere får stadig henvendelser fra pårørende som ønsker å få visshet i slike spørsmål. Undersøkelsesresultatet og den skriftlige rapporten er imidlertid oppdragsgiverens (politiets) eiendom og kan ikke utleveres til andre (pårørende, behandlende lege) uten politiets godkjennelse, uansett hvor legitim vedkommendes interesse for saken er. I praksis vil politiet ofte tillate at pårørende får kjennskap til resultatet av obduksjonen, og den vil på denne måten kunne være til nytte også for de pårørende.
Ca. 10 % av obduksjonene ved Rettsmedisinsk institutt er nå saker hvor dødsfallet er meldt til politiet med spørsmål om «feil, forsømmelse eller uhell ved medisinsk undersøkelse og behandling». Fra 2007 har det vært en stor økning i antall slike meldinger til Helsetilsynet. I 2007 ble det sendt 271 meldinger, i 2009 var antall meldinger steget til 442. Tallmessig har imidlertid obduksjoner som følge av etterforskning av denne type dødsfall ligget på i overkant av 100 obduksjoner pr. år.134 En stadig større andel av slike unaturlige dødsfall blir følgelig ikke etterforsket. Mange av de medisinske obduksjonene som utføres i dag, er dødsfall som burde vært underlagt rettsmedisinsk obduksjon, men som ikke blir prioritert av påtalemyndigheten.
På begynnelsen av nittitallet ble betalingsordningen for rettsmedisinske obduksjoner endret. Dette førte til et fall i antall rettsmedisinske obduksjoner. I perioden 1985-1991 ble det utført ca. 3000 rettsmedisinske obduksjoner pr år. I 1992 ble det bare utført i overkant av 2000 rettsmedisinske obduksjoner. I dag er tallet nede på ca. 1700 rettslige obduksjoner pr. år.
Nedgangen gir grunn til bekymring, og da ikke bare på grunn av at risikoen for at straffbare forhold overses. Færre avklaringer av dødsfall av ukjent årsak utenfor institusjon vil svekke grunnlaget for oppdatert kunnskap om sykdomsmønster. Rettsmedisinske obduksjoner var tidligere et viktig supplement til statistikken og for opplysninger om folkehelsen. Etter omleggingen av finansieringsordningen til det enkelte politidistrikt i 1991 begjæres i enkelte politidistrikt meget få rettsmedisinske obduksjoner.
4.2.6 Alternativer til obduksjon
Parallelt med den medisinsk-tekniske utviklingen og nedgangen i antall obduksjoner har det kommet forslag til alternativer til tradisjonell obduksjon. Begrunnelsen har delvis vært å bedre dokumentasjonen av skader og sykelige forandringer, dels å ha mulighet til å gjennomføre en obduksjon i tilfeller der det av ulike grunner ikke er mulig å utføre en vanlig obduksjon. For eksempel der dette strider mot livssynet til den avdøde eller de pårørende.
4.2.6.1 Partiell obduksjon
Ved en partiell obduksjon er utførelsen prinsipielt som ved en «vanlig» obduksjon, men den begrenses til ett organ eller organsystem. For eksempel kan en ved mistanke om hjertesykdom nøye seg med kun å ta ut og undersøke hjertet. Noen ganger kan dette være lettere å akseptere for pårørende, men undersøkelsen blir selvsagt ikke så fullstendig som den ellers kunne ha blitt.
4.2.6.2 Mini-invasiv obduksjon
Ved en mini-invasiv obduksjon undersøkes kroppshulene med utstyr for «kikkhullskirurgi» (laparoskopi/torakoskopi) gjennom et antall små hull i huden. Med disse instrumentene er det også mulig å ta ut vevsprøver for undersøkelse i mikroskop. En slik undersøkelse kan gi brukbar oversikt over overflaten på mange indre organer, men er mindre god for å finne forandringer lenger inn i organene. Utvalget er ikke kjent med at denne undersøkelsesformen er brukt i Norge.
4.2.6.3 Ikke-invasiv obduksjon/virtuell obduksjon
Ved denne typen undersøkelse gjøres det billeddannende undersøkelse, vanligvis datatomografi (CT) eller magnettomografi (MR), av den avdøde. Mye av erfaringen med disse teknikkene er fra rettsmedisinske undersøkelser, med aktive fagmiljøer tilknyttet rettsmedisinske institutter blant annet i København og Bern/Zürich.135 Erfaringen viser at slike metoder ofte er svært gode til å påvise og dokumentere skader, slik som brudd- og skuddskader, mens de er mindre gode til å undersøke dødsfall som skyldes sykdom. CT og MR (og i mindre omfang vanlig røntgenundersøkelse) brukes i et visst omfang i Norge som et supplement til rettsmedisinsk obduksjon. En fordel ved å ta CT eller MR av den døde er at en får en permanent dokumentasjon som ved behov kan tas frem og vurderes på nytt, for eksempel i forbindelse med en rettssak. Sverige har i lengre tid hatt et sterkt forskningsmiljø rundt virtuell obduksjon også for påvisning av sykdom og med lovende resultater.136
4.2.6.4 Biokjemisk/molekylær obduksjon
Med dette menes at man bruker materiale som er hentet ut ved obduksjon til biokjemisk eller genetisk analyse, særlig for å påvise medfødte stoffskifteforstyrrelser eller arvelige sykdommer. Dette gjøres i en viss utstrekning, fremfor alt ved undersøkelse av plutselige og uforklarlige dødsfall hos barn og unge personer. Som oftest er dette et tillegg til vanlig obduksjon. Et eksempel kan være påvisning av arvelig betinget hjerterytmeforstyrrelse (lang QT-tidsyndrom), en gruppe tilstander som kan gi plutselig hjertedød hos unge mennesker uten at en ved vanlige metoder kan påvise sykelige forandringer.
4.3 Avgivelse av lik
4.3.1 Kort historikk
Disseksjon av lik har lagt grunnlaget for den moderne anatomi. Det mest kjente verket, De humani corporis fabrica (menneskekroppens bygning), ble utgitt i 1543 av den flamske anatomen Andreas Vesalius. Verket kom ut i sju bind og var den første presise beskrivelsen av menneskekroppen. Dessuten ble den utgitt på en tid da boktrykkerkunsten var tatt i bruk, og kunne trykkes i tusenvis av eksemplarer og spres utover Europa. Verket var rikt illustrert. Menneskekroppen var avbildet i naturlige stillinger, og spesielt musklene var gjengitt svært naturtro.137
Under den franske revolusjonen ble pariserskolen grunnlagt av anatomen Xavier Bichat (1771-1802). Bichat trakk medisinstudentene inn i disseksjonsrommet og anatomi ble på denne måten en del av den medisinske utdanningen.138
I Norge ble disseksjon av menneskelik først utført ca. 1750. En lege i Bergen og en i Oslo fikk kongelig tillatelse til å «anatomere bortdøede schlaver» for belæring av kirurger og jordmødre. Øvelser i kirurgisk operasjonsteknikk gjøres først på lik og deretter eventuelt på levende dyr før man kunne operere mennesker (uten narkose).
På grunn av manglende muligheter for konservering, hadde man stort behov for lik. Tilgangen besto blant annet av mennesker som døde i fengsel eller som ble henrettet. Den store etterspørselen etter lik førte også til kriminell virksomhet som likrøveri og i enkelte tilfeller drap. Det var ikke alltid at de anatomiske instituttene stilte for nærgående spørsmål om hvor liket kom fra.139
4.3.2 Dagens praksis
I dag utføres disseksjon av lik først og fremst som en del av undervisningen av medisinstudentene i faget anatomi. Dette faget er en grunnleggende del av legeutdannelsen, og kan ikke læres utelukkende ved hjelp av bøker. Gjennom disseksjon av menneskekroppen får studentene nødvendig forståelse av organenes form, beliggenhet, konsistens og funksjon. I tillegg gis undervisning til fysioterapi-, ergoterapi- og mensendieckstudenter. Disseksjon foregår også ved kurs for leger og sykepleiere i videre- og etterutdannelse. Det er derfor helt nødvendig at universitetene har tilstrekkelig tilgang på legemer for å kunne gi denne undervisningen.
Lik som skal benyttes i undervisning blir balsamert kort tid etter dødsfallet. Balsameringen gjør at de kan oppbevares over lang tid
Tilgang til lik kommer fra avdøde som har avgitt skriftlig ønske om å avgi sitt legeme til medisinsk forskning og undervisning. Et slikt ønske oppnås ved at man fyller ut et særskilt skjema som fås ved de Anatomiske avdelinger ved universitetene.
Det er fire universitet som tar imot lik til anatomiundervisningen:
Universitetet i Oslo (UIO), Institutt for medisinske basalfag, Avdeling for anatomi.
UIO mottar ca. 40-50 lik pr år. Tilgangen dekker behovet og er såpass god at universitetet kan videresende noen lik til de øvrige universitetene, forutsatt at avdøde har gitt godkjennelse til dette.
Universitetet i Bergen (UIB), Biomedisinsk institutt, Makroanatomisk avdeling.
UIB mottar ca. 9 lik pr. år. Det er ikke tilstrekkelig for å dekke behovet og UIB får derfor tilsendt lik fra Universitetet i Oslo i den grad dette er godkjent av avdøde. UIB antar at de har behov for 16-20 lik pr år.
Universitetet i Trondheim (NTNU), Institutt for laboratoriemedisin, barne- og kvinnesykdommer – Instituttgruppe for anatomi, patologi og rettsmedisin.
NTNU mottar ca. 9 lik pr. år, og er som UIB avhengig av å få tilsendt lik fra Universitetet i Oslo. De siste fem årene har universitetet fått tilsendt 53 legemer fra Oslo. Behovet for lik og organer til forskning og utdanning ved NTNU er minst dobbelt så stort som tilgangen. Dette har ført til dårligere kvalitet på utdannelsen, i tillegg til at kursvirksomheten ved universitetet har blitt sterkt redusert i omfang.
Universitetet i Tromsø (UIT), anatomisk avdeling.
UIT mottar 15-20 donerte lik pr. år. Dette dekker behovet ved universitetet.
I samråd med de pårørende fraktes legemet til Anatomisk avdeling ved det universitet avdøde har donert legemet til. Avdelingen må motta legemet i løpet av 2-3 dager etter dødsfallet for at det skal bli godt balsamert.140 Før forsendelse til universitetet holdes seremoni hvis det var avdødes ønske, eller om de pårørende ønsker det. Dersom avdøde er obdusert, eller det er foretatt organdonasjon, kan legemet ikke mottas fordi det ikke kan gjennomføres en ordentlig balsamering på kroppen. Det er vanlig praksis at både obduksjon og donasjon får prioritet foran avgivelse av legeme til forskning og undervisning.
Når et donert legeme er på et universitet, vil avdødes navn bare være kjent for et fåtall personer. Alle personopplysninger blir oppbevart med streng adgangskontroll og er underlagt taushetsplikt. Ved selve disseksjonen blir bare den del av legemet som studeres, blottlagt under arbeidet, mens resten av legemet tildekkes.
Et donert legeme beholdes i 1-3 år. Legemet kremeres etter bruk, og asken sendes deretter tilbake til de pårørende for urnenedsettelse på vedkommendes hjemsted.141 Undervisning som omfatter disseksjon av lik, er ressurskrevende. Kostnadene med å motta legemer varierer. Den største variabelen er transportkostnadene, i tillegg kommer kostnader for balsamering og oppbevaring og kostnader til kremasjon. I tillegg kommer drift av areal og infrastruktur. I følge opplysninger fra UIT koster hver donasjon, fra mottak til utsendelse, i snitt kr. 30 000. Ved Universitetet i Oslo koster driften av disseksjonssal og oppbevaringsavdeling ca. en halv million kroner pr. år, ikke medregnet lønnskostnader og leie av lokale.
Alle universitetene har informasjon om donasjon av legeme på sine nettsider. Ved UIT og NTNU kan skjema for donasjon også lastes ned.142
Et donert legeme benyttes ikke til disseksjon dersom medisinske årsaker tilsier det (smittsomme sykdommer, åpne sår, amputasjoner, større kvestelser ved ulykker etc.). Dersom avdøde skal være organdonor, prioriteres dette før legemedonasjon.
Fotnoter
Thorsby E: Fra drøm til virkelighet. Den tidlige utvikling av transplantasjonsmedisinen. I Pfeffer P & Albrechtsen D (red): En gave for livet. Historien om organtransplantasjon i Norge s. 17. Norsk transplantasjonsmedisinsk forlag 2011
Thorsby E: Fra drøm til virkelighet. Den tidlige utvikling av transplantasjonsmedisinen. I Pfeffer P & Albrechtsen D (red): En gave for livet. Historien om organtransplantasjon i Norge s. 18. Norsk transplantasjonsmedisinsk forlag 2011
Thorsby E: Fra drøm til virkelighet. Den tidlige utvikling av transplantasjonsmedisinen. I Pfeffer P & Albrechtsen D (red): En gave for livet. Historien om organtransplantasjon i Norge s. 24. Norsk transplantasjonsmedisinsk forlag 2011
Albrechtsen D & al. Et nasjonalt prosjekt. Nyretransplantasjon. I Pfeffer P & Albrechtsen D (red): En gave for livet. Historien om organtransplantasjon i Norge s. 47. Norsk transplantasjonsmedisinsk forlag 2011
Albrechtsen D & al. Et nasjonalt prosjekt. Nyretransplantasjon. I Pfeffer P & Albrechtsen D (red): En gave for livet. Historien om organtransplantasjon i Norge s. 39. Norsk transplantasjonsmedisinsk forlag 2011
Morris P: Results of transplantation.I Morris P (red): Kidney Transplantation. Grune & Statton, London 1984
Brekke IB & al. Tidsskr Nor Lægeforen 1995; 115: 703-5
Simonsen S. & al. Tidsskr Nor Lægeforen 1999; 119: 3447-50
Scholz T & al. Tidsskr Nor Legeforen 2009; 129: 2587-92
Brekke IB & al. Tidsskr Nor Lægeforen 1995; 115: 703-5
Geiran OR & Bjørtuft Ø. Tidsskr Nor Lægeforen 1999; 119: 3451-4
Lien B & al. En gave til livet. Organdonasjon fra avdøde givere. I Pfeffer P & Albrechtsen D (red): En gave for livet. Historien om norsk Transplantasjonsmedisin s. 203, Norsk transplantasjonsmedisinsk forlag 2011
Transplantasjoner i Norge. Helsedirektoratets utredningsserie 1-89 1989
Albrechtsen D & al. Et nasjonalt prosjekt. Nyretransplantasjon. I Pfeffer P & Albrechtsen D (red): En gave for livet. Historien om organtransplantasjon i Norge s. 210. Norsk transplantasjonsmedisinsk forlag 2011
Lien B & Brekke IB. Tidsskr Nor Lægeforen 1999; 119: 3610-4
Lien B & Brekke IB.: Hvordan sikre best mulig tilgang på organer til transplantasjon? Tidsskr Nor Lægeforen 1999; 119: 3610-4
Bakkan PA & al. Årsrapport Organdonasjon og transplantasjon 2010, Oslo universitetssykehus, Rikshospitalet
Bakkan PA & al. Årsrapport Organdonasjon og transplantasjon 2010, Oslo universitetssykehus, Rikshospitalet
Bell A & al. Bedret organtilgang til transplantasjoner. Statens Helsetilsyn 1995
Lien B & al. En gave til livet. Organdonasjon fra avdøde givere. I Pfeffer P & Albrechtsen D (red): En gave for livet. Historien om norsk Transplantasjonsmedisin s. 290, Norsk transplantasjonsmedisinsk forlag 2011
Fikse O, Iversen Ø & Mathisen T. Et viktig bindeledd. Pasientforeninger og interesseorganisasjoner. I Pfeffer P & Albrechtsen D (red): En gave for livet. Historien om norsk organtransplantasjon s. 273. Norsk transplantasjonsmedisinsk forlag 2011.
Council of Europe: Newsletter Transplant: International figures on donation and transplantation 2009, 2010
Bakkan PA & al. Årsrapport Organdonasjon og transplantasjon 2010, Oslo universitetssykehus, Rikshospitalet
Pressemelding 24.9.2007 http://www.regjeringen.no/nb/dep/hod/pressesenter/pressemeldinger/2007/antall-organdonasjoner-skal-okes--flere-.html?id=481608
Council of Europe: Newsletter Transplant: International figures on donation and transplantation 2009, 2010
Albert Kolstad (1979). Organ cultured donor material for penetrating corneal grafts.
Acta Ophthalmol (Copenh): 57:742-749.
Lass JH, Gal RL, Dontchev M, Beck RW, Kollman C, Dunn SP, Heck E, Holland EJ, Mannis MJ, Montoya MM, Schultze RL, Stulting RD, Sugar A, Sugar J, Tennant B and Verdier DD (2008). Donor age and corneal endothelial cell loss 5 years after successful corneal transplantation. Specular microscopy ancillary study results. Ophthalmology 115(4):627-632
Moffatt SL, Cartwright VA and Stumpf TH (2005). Centennial review of corneal transplantation. Clin Experiment Ophthalmol 33(6):642-57
McCarey BE and Kaufman HE (1974). Improved corneal storage. Invest Ophthalmol 13(3):165-173
Otto Johansen (1978): Øyelegekunstens historie i Norge (Universitetsforlaget) p. 229 - 231
Rama P, Matuska S, Paganoni G, Spinelli A, De Luca M and Pellegrini G (2010). Limbal stem-cell therapy and long-term corneal regeneration. N Engl J Med 363(2):147-155
Van Meter WS, Katz DG, White H and Gayheart R (2005). Effect of death-to-preservation time on donor corneal epithelium.
Trans Am Ophthalmol Soc 103:209-222
Yildiz EH, Hoskins E, Fram N, Rapuano CJ, Hammersmith KM, Laibson PR and Cohen EJ (2010). Third or greater penetrating keratoplasties: indications, survival, and visual outcomes. Cornea 29(3):254-259
Hartmann A al. Nyrer som skapt til å dele. Organdonasjon fra levende giver. I Pfeffer P &Albrechtsen D (red): En gave for livet. Historien om organtransplantasjon I Norge s. 216. Norsk Transplantasjonsmedisinsk forlag 2011
Albrechtsen D & al. Et nasjonalt prosjekt. Nyretransplantasjon. I Pfeffer P & Albrechtsen D (red): En gave for livet. Historien om organtransplantasjon i Norge s. 56. Norsk transplantasjonsmedisinsk forlag 2011
Norsk Nyremedisinsk Forening. Informasjon til potensiell levende giver til nyretransplantasjon. Veileder for utredende nefrolog. 2005
Leivestad T: Venteliste og ventetid ved transplantasjon i Norge 2010. Norsk nyreregister 2011
Hartmann A & al. Nephrol Dial Transplant 2003;18: 871-3
Albrechtsen D & al. Et nasjonalt prosjekt. Nyretransplantasjon. I Pfeffer P & Albrechtsen D (red): En gave for livet. Historien om organtransplantasjon i Norge s. 76. Norsk transplantasjonsmedisinsk forlag 2011
Albrechtsen D & al. Et nasjonalt prosjekt. Nyretransplantasjon. I Pfeffer P & Albrechtsen D (red): En gave for livet. Historien om organtransplantasjon i Norge s. 76. Norsk transplantasjonsmedisinsk forlag 2011
Årsrapport fra Norsk nyreregister 2009.
Albrechtsen D & al. Et nasjonalt prosjekt. Nyretransplantasjon. I Pfeffer P & Albrechtsen D (red): En gave for livet. Historien om organtransplantasjon i Norge s. 77. Norsk transplantasjonsmedisinsk forlag 2011
Albrechtsen D & al. Et nasjonalt prosjekt. Nyretransplantasjon. I Pfeffer P & Albrechtsen D (red): En gave for livet. Historien om organtransplantasjon i Norge s. 77. Norsk transplantasjonsmedisinsk forlag 2011
Albrechtsen D & al. Et nasjonalt prosjekt. Nyretransplantasjon. I Pfeffer P & Albrechtsen D (red): En gave for livet. Historien om organtransplantasjon i Norge s. 79. Norsk transplantasjonsmedisinsk forlag 2011
Leivestad T: Venteliste og ventetid ved transplantasjon i Norge 2010. Norsk nyreregister 2011
Antall dialysepasienter i Norge øker; hvordan møte denne utviklingen best mulig i årene fremover? Rapport fra arbeidsgruppe nedsatt av HOD 2006
Scholz T & al. Tidsskr Nor Lægeforen 2009; 129: 2587-92
Foss A & al. Man lever ikke uten lever. Levertransplantasjon. I Pfeffer P & Albrechtsen D (red): En gave for livet. Historien om norsk organtransplantasjon s. 173-76. Norsk transplantasjonsmedisinsk forlag 2011
Leivestad T: Venteliste og ventetid ved transplantasjon i Norge 2010. Norsk nyreregister 2011
Council of Europe: Newsletter Transplant: International figures on donation and transplantation 2009, 2010
Foss A & al. Man lever ikke uten lever. Levertransplantasjon. I Pfeffer P & Albrechtsen D (red): En gave for livet. Historien om norsk organtransplantasjon s. 180-83. Norsk transplantasjonsmedisinsk forlag 2011
Scholz T & al. Tidsskr Nor Lægeforening 2009; 129: 2587-92
Foss A & al. Man lever ikke uten lever. Levertransplantasjon. I Pfeffer P & Albrechtsen D (red): En gave for livet. Historien om norsk organtransplantasjon s. 180-83. Norsk transplantasjonsmedisinsk forlag 2011
Foss A & al. Man lever ikke uten lever. Levertransplantasjon. I Pfeffer P & Albrechtsen D (red): En gave for livet. Historien om norsk organtransplantasjon s. 182. Norsk transplantasjonsmedisinsk forlag 2011
Scholz T & al. Tidsskr Nor Lægeforening 2009; 129: 2587-92
Foss A & al. Man lever ikke uten lever. Levertransplantasjon. I Pfeffer P & Albrechtsen D (red): En gave for livet. Historien om norsk organtransplantasjon s. 183. Norsk transplantasjonsmedisinsk forlag 2011
Geiran OR & al. Fra sensasjon til rutinetilbud. Hjerte- og kombinert hjerte- lungetranspantasjon. I Pfeffer P & Albrechtsen D (red): En gave for livet. Historien om norsk organtransplantasjon s. 144. Norsk transplantasjonsmedisinsk forlag 2011
Geiran OR & al. Fra sensasjon til rutinetilbud. Hjerte- og kombinert hjerte- lungetranspantasjon. I Pfeffer P & Albrechtsen D (red): En gave for livet. Historien om norsk organtransplantasjon s. 142 og 148-49. Norsk transplantasjonsmedisinsk forlag 2011
Bakkan PA & al. Årsrapport Organdonasjon og transplantasjon 2010, Oslo universitetssykehus, Rikshospitalet
Council of Europe: Newsletter Transplant: International figures on donation and transplantation 2009, 2010
Simonsen & al. Tidsskr Nor Legeforen 2007; 127:865-8
Årsrapporter: Organdonasjon og transplantasjon i Norge 2001-2010, Oslo universitetssykehus, Rikshospitalet
Simonsen & al. Tidsskr Nor Legeforen 2007; 127:865-8
Regelverk for innsatsstyrt finansiering 2010. Helsedirektoratet.
Geiran OR & al. Fra sensasjon til rutinetilbud. Hjerte- og kombinert hjerte- lungetranspantasjon. I Pfeffer P & Albrechtsen D (red): En gave for livet. Historien om norsk organtransplantasjon s. 150. Norsk transplantasjonsmedisinsk forlag 2011
Bakkan PA & al. Årsrapport Organdonasjon og transplantasjon 2010, Oslo universitetssykehus, Rikshospitalet
Geiran OR & al. Fra sensasjon til rutinetilbud. Hjerte- og kombinert hjerte- lungetranspantasjon. I Pfeffer P & Albrechtsen D (red): En gave for livet. Historien om norsk organtransplantasjon s. 150. Norsk transplantasjonsmedisinsk forlag 2011
Bjørtuft Ø & Geiran OR. Når luften ikke når frem. Lungetransplantasjon. I Pfeffer P & Albrechtsen D (red): En gave for livet. Historien om norsk Organtransplantasjon s. 164. Norsk transplantasjonsmedisinsk forlag 2011
Bjørtuft Ø & Geiran OR. Når luften ikke når frem. Lungetransplantasjon. I Pfeffer P & Albrechtsen D (red): En gave for livet. Historien om norsk Organtransplantasjon s. 164-65. Norsk transplantasjonsmedisinsk forlag 2011
Bakkan PA & al. Årsrapport Organdonasjon og transplantasjon 2010, Oslo universitetssykehus, Rikshospitalet
Council of Europe: Newsletter Transplant: International figures on donation and transplantation 2009, 2010
Brekke IB & al. Tidsskr Nor Lægeforen 1995; 115: 703-5
Brekke IB & al. Tidsskr Nor Lægeforen1995; 115: 703-5
Øyen O & al. Transplantasjon av bukspyttkjertel. I Pfeffer P & Albrechtsen D (red): En gave for livet. Historien om norsk organtransplantasjon s. 112. Norsk transplantasjonsmedisinsk forlag 2011
Øyen O & al. Transplantasjon av bukspyttkjertel. I Pfeffer P & Albrechtsen D (red): En gave for livet. Historien om norsk organtransplantasjon s. 125-26. Norsk transplantasjonsmedisinsk forlag 2011
Øyen O & al. Transplantasjon av bukspyttkjertel. I Pfeffer P & Albrechtsen D (red): En gave for livet. Historien om norsk organtransplantasjon s. 119 og 127. Norsk transplantasjonsmedisinsk forlag 2011
Bakkan PA & al. Årsrapport Organdonasjon og transplantasjon 2010, Oslo universitetssykehus, Rikshospitalet
Bakkan PA & al. Årsrapport Organdonasjon og transplantasjon 2010, Oslo universitetssykehus, Rikshospitalet
Øyen O & al. Transplantasjon av bukspyttkjertel. I Pfeffer P & Albrechtsen D (red): En gave for livet. Historien om norsk organtransplantasjon s. 119-20. Norsk transplantasjonsmedisinsk forlag 2011
Council of Europe: Newsletter Transplant: International figures on donation and transplantation 2009, 2010
Øyen O & al. Transplantasjon av bukspyttkjertel. I Pfeffer P & Albrechtsen D (red): En gave for livet. Historien om norsk organtransplantasjon s. 127-28. Norsk transplantasjonsmedisinsk forlag 2011
Keratoprotese = «kunstig hornhinne», gjennomsiktig protese som implanteres i en uklar kornea når korneatransplantasjon ikke kan gi synsforbedring
Redegjørelse fra Karin Aasly MD, Øyeavd, St. Olavs Hospital, Trondheim
http://www.frittsykehusvalg.no/start/ - oversikt over statistikk pr 12.10.2011 Helse Vest
Albrechtsen D & al. Når benmargen svikter og immunapparatet må skiftes ut. Stamcelletransplantasjon. I Pfeffer P & Albrechtsen D (red): En gave for livet. Historien om norsk organtransplantasjon s. 100. Norsk transplantasjonsmedisinsk forlag 2011
Albrechtsen D & al. Når benmargen svikter og immunapparatet må skiftes ut. Stamcelletransplantasjon. I Pfeffer P & Albrechtsen D (red): En gave for livet. Historien om norsk organtransplantasjon s. 83. Norsk transplantasjonsmedisinsk forlag 2011
Albrechtsen D & al. Når benmargen svikter og immunapparatet må skiftes ut. Stamcelletransplantasjon. I Pfeffer P & Albrechtsen D (red): En gave for livet. Historien om norsk organtransplantasjon s. 85 og 102. Norsk transplantasjonsmedisinsk forlag 2011
Thorsby E: Fra drøm til virkelighet. Den tidlige utvikling av transplantasjonsmedisinen. Pfeffer P & Albrechtsen D (red): En gave for livet. Historien om organtransplantasjon i Norge s. 27. Norsk transplantasjonsmedisinsk forlag 2011
Albrechtsen D & al. Tidsskr Nor Lægeforen 1987; 107:2222-4
Transplantasjoner i Norge. Helsedirektoratets utredningsserie 1-89 1989
Albrechtsen D & al. Når benmargen svikter og immunapparatet må skiftes ut. Stamcelletransplantasjon. I Pfeffer P & Albrechtsen D (red): En gave for livet. Historien om norsk organtransplantasjon s. 96-7. Norsk transplantasjonsmedisinsk forlag 2011
Albrechtsen D & al. Når benmargen svikter og immunapparatet må skiftes ut. Stamcelletransplantasjon. I Pfeffer P & Albrechtsen D (red): En gave for livet. Historien om norsk organtransplantasjon s. 96-7. Norsk transplantasjonsmedisinsk forlag 2011
Albrechtsen D & al. Når benmargen svikter og immunapparatet må skiftes ut. Stamcelletransplantasjon. I Pfeffer P & Albrechtsen D (red): En gave for livet. Historien om norsk organtransplantasjon s. 103. Norsk transplantasjonsmedisinsk forlag 2011
Albrechtsen D & al. Når benmargen svikter og immunapparatet må skiftes ut. Stamcelletransplantasjon. I Pfeffer P & Albrechtsen D (red): En gave for livet. Historien om norsk organtransplantasjon s. 94-5. Norsk transplantasjonsmedisinsk forlag 2011
Albrechtsen D & al. Når benmargen svikter og immunapparatet må skiftes ut. Stamcelletransplantasjon. I Pfeffer P & Albrechtsen D (red): En gave for livet. Historien om norsk organtransplantasjon s. 104. Norsk transplantasjonsmedisinsk forlag 2011
Albrechtsen D & al. Når benmargen svikter og immunapparatet må skiftes ut. Stamcelletransplantasjon. I Pfeffer P & Albrechtsen D (red): En gave for livet. Historien om norsk organtransplantasjon s. 99-101 og 104. Norsk transplantasjonsmedisinsk forlag 2011
Bentdal Ø. Tarmtransplantasjon. I Pfeffer P &Albrechtsen D (red): En gave for livet. Historien om organtransplantasjon I Norge s. 188-189. Norsk Transplantasjonsmedisinsk forlag 2011
Bentdal Ø. Tarmtransplantasjon. I Pfeffer P &Albrechtsen D (red): En gave for livet. Historien om organtransplantasjon I Norge s. 191-92. Norsk Transplantasjonsmedisinsk forlag 2011
Hofmann B. Tidsskr Nor Legeforen 2007;127: 2964-6
Protokoll for nyretransplantasjon og pancreastransplantasjon – kapittel 1.1.
Oslo universitetssykehus – Radiumhospitalet HF, Nyremedisinsk forening 2007: «Til deg som er spurt om å gi en nyre»
Informasjon fra Torstein Egeland og Anders Glomstein, Oslo universitetssykehuset, Rikshospitalet
http://www.scandiatransplant.org/ - statistikk fra 2010 og 1-3. kvartal 2011.
Instruks i styringsdokument for 2003 til de regionale helseforetakene
FOR 1977-06-10 NR 02: Forskrifter og dødsdefinisjonen i relasjon til lov om transplantasjon, sykehusobduksjon og avgivelse av lik m.m. http://www.lovdata.no/cgi-wift/ldles?doc=/sf/sf/sf-19770610-0002.html
Protokoll for organdonasjon - http://www.rikshospitalet.no/ikbViewer/Content/409465/protokoll-for-organdonasjon-i.pdf
Protokoll for organdonasjon – kapittel 7
Rundskriv HOD I-2008-6
Alnæs AH. Organ donation and medical modernity's difficult decisions. Doktoravhandling, Universitetet I Oslo, 2001
Orøy AJ. Døden i livets tjeneste. Hovedfagsoppgave. Universitetet i Bergen, 2007
Alnæs AH. Organ donation and medical modernity's difficult decisions. Doktoravhandling, Universitetet i Oslo, 2001
Protokoll for organdonasjon
Jensen AMB, Orchestrating an Exeptional death. Donor family experiences and organ donation in Denmark Ph.D series no 69, University of Copenhagen, 2011
Kolstad A. Acta Ophthalmol (Copenh). 1979;;57:742-9
Rundskriv I-2008-6
Linn Lillevold - Donoransvarlig sykepleier ved Oslo Universitetssykehus
Brev av 22.9.1999 fra Kripos
Oppdragsdokument 2009 til Regionale helseforetak
Albrechtsen
Protokoll organdonasjon
Protokoll organdonasjon
Om obduksjon. Når noen dør. Orientering fra Den norske patologforening. http://legeforeningen.no/id/119197.0
Brosjyre fra Den norske patologforening: Obduksjon. Den siste legeundersøkelsen. http://legeforeningen.no/id/136139.0
Innstilling fra transplantasjonskomiteen 8.2.1971
Fosterobduksjoner er holdt utenfor. I 2010 ble det utført 459 fosterobduksjoner i tillegg til de ordinære
Tall fra Den norske patologforening
Rekvisisjoner om obduksjon; Helse Bergen, Sørlandets sykehus HF, Helse Stavanger
Om obduksjon. Når noen dør. Orientering fra Den norske patologforening. http://legeforeningen.no/id/119197.0
Hoddevik GH, Schou P, Holmboe J. Tidsskr Nor Lægefor 2002; 122: 2815
Forskrift nr 216 av 11.03.97 om dekning av utgifter til båretransport i Norge.
Data fra Dødsårsaksregisteret
Basert på SSB – Totalt antall døde > 1 år var 41 257 i 2009, 41 328 i 2010.
Forskrift 2007-12-19 nr 1761: om godtgjørelse av utgifter til helsehjelp som utføres poliklinisk ved statlige helseinstitusjoner og ved helseinstitusjoner som mottar driftstilskudd fra regionale helseforetak.
http://legeforeningen.no/id/154950.0
Nichols L ete.al. Am J Clin Pathol 1998;110:210-218
E Berget & al. Tidsskr Nor Lægeforen, 2007; 127: 2800-2
Hoddevik GH, Schou P, Holmboe J. Tidsskr Nor Lægefor 2002; 122: 2815
Bjugn R, Berland J. APMIS. 2002; 110: 746-52
http://www.med.uio.no/rmi/rettspatologi/obduksjon
http://www. med.uio.no/rmi/rettspatologi/obduksjon/ - Rettsmedisinsk institutt, seksjon for rettspatologi
Årsmeldinger fra Den rettsmedisinsk kommisjon
www.virtopsy.com
Center for Medical Image Science and Visualization. http://www.cmiv.liu.se/search?SearchableText=autopsy
Store Norske Leksikon - nettutgave
Skålevåg SA. Tidsskr Nor Legeforen 2010; 130: 2512-3
Holck P. Tidsskr Nor Lægeforen 2004; 124: 3242-4
Ifølge rutinene ved Oslo Universitetssykehus er fristen for å motta lik til balsamering 24 timer.
I følge forskrift til lov om kirkegårder, kremasjon og gravferd (gravferdsloven), skal det som begraves være nedbrytbart. Et balsamert legeme er behandlet for å unngå forråtnelse og kan derfor normalt sett ikke begraves. http://lovdata.no/for/sf/fa/ta-19970110-0016-004.html
UIO: http://www.med.uio.no/imb/tjenester/publikum/testatorordningen/
UIB: http://org.uib.no/legemedonasjon/
NTNU: http://www.ntnu.no/lbk/legemedonasjon
UIT: http://www2.uit.no/ikbViewer/page/ansatte/organisasjon/artikkel?p_menu=42374&p_lang=2&p_document_ id=90754&p_dimension_id=88126