Plan for å motvirke antibiotikaresistens
Historisk arkiv
Publisert under: Regjeringen Bondevik I
Utgiver: Sosial- og helsedepartementet
Plan/strategi | Dato: 06.07.1998
Plan for å motvirke antibiotikaresistens
Prosjektgruppa for å utarbeide en plan for å motvirke antibiotikaresistens. Plan for å motvirke antibiotikaresistens.
Oslo: Statens institutt for folkehelse, Oslo, 1999.
Henvendelser om dette heftet kan rettes til
Statens institutt for folkehelse
Pb 4404 Torshov
0403 OSLO
ISBN 82-7364-138-4
Til Sosial- og helsedepartementet
Prosjektgruppa for å utarbeide en plan for å motvirke antibiotikaresistens ble oppnevnt av Sosial- og helsedepartementet i brev av 6. juli 1998.
Gruppa legger med dette fram sin innstilling. Gruppas innstilling er enstemmig.
Oslo, 29. januar 1999
Bodolf Hareide
leder
| Nina Krefting Aas | Arvid Bjørneklett |
| Petter Brandtzæg | Kåre Fossum |
| Ellen Marie Grande | Stig Harthug |
| Asbjørn Haugsbø | Per Hjortdahl |
| Kristian Ingebrigtsen | Bjørn-Tore Lunestad |
| Kirsten Myhr | Anita Myrmæl |
| Birgit D Nielsen | Signe Holta Ringertz |
| Claus Ola Solberg | Martin Steinbakk |
| Per Leiv Svarva | Lars H Vorland |
| Gro Ramsten Wesenberg | |
| Preben Aavitsland | |
| E Arne Høiby |
Innhold
- Mandat
- Oppnevning, organisering og arbeidsgrunnlag
- Fortolkning av mandatet
- Ordbruk
- Oppbygging av rapporten
- 1.1 Innledning
- 1.2 Antibiotika-tidsalderen
- 1.3 Bakgrunn for antibiotikas virkning og for utvikling av resistens
- 1.4 Utvikling av resistens over tid internasjonalt og nasjonalt
- 1.5 Bruk av antibiotika til mennesker i Norge
- 1.6 Bruk av antibiotika til dyr i Norge
- 1.7 Er antibiotikabruk årsak til resistens, og kan utviklingen snus?
- 1.8 Antibiotikaresistens som folkehelseproblem
- 1.9 Litteratur
Del 2: Hva er gjort til nå i Norge?
- 2.1 Innledning
- 2.2 Overvåking og kartlegging av resistens
- 2.3 Overvåking av antibiotikabruk
- 2.4 Mikrobiologisk diagnostikk og resistensbestemmelse
- 2.5 Riktigere bruk av antibiotika: Samarbeid med rekvirenter
- 2.6 Riktigere bruk av antibiotika: Kommunikasjon med publikum
- 2.7 Andre smitteverntiltak
- 2.8 Forskning, utvikling og utredning
- 2.9 Forvaltning og tilsyn
- 2.10 Litteratur
Del 3: Internasjonale planer og anbefalinger
- 3.1 Innledning
- 3.2 Verdens helseorganisasjon (WHO)
- 3.3 Den europeiske union (EU)
- 3.4 USA
- 3.5 United Kingdom (UK)
- 3.6 Norden
- 3.7 Litteratur
Del 4: Hvordan kan vi motvirke resistens?
- 4.1 Innledning
- 4.2 Overvåking og kartlegging av resistens
- 4.3 Overvåking av antibiotikabruk
- 4.4 Mikrobiologisk diagnostikk og resistensbestemmelse
- 4.5 Riktigere bruk av antibiotika: Samarbeid med rekvirenter
- 4.6 Riktigere bruk av antibiotika: Kommunikasjon med publikum
- 4.7 Andre smitteverntiltak
- 4.8 Forskning, utvikling og utredning
- 4.9 Forvaltning og tilsyn
- 4.10 Litteratur
- Overordnet mål
- Hovedmål
- Innsatsområde 1 - Overvåking av resistens
- Innsatsområde 2 - Overvåking av antibiotikabruk
- Innsatsområde 3 - Forskning, utvikling og utredning
- Innsatsområde 4 - Rekvirering
- Innsatsområde 5 - Kommunikasjon med publikum
- Innsatsområde 6 - Smittevern
- Innsatsområde 7 - Mikrobiologisk diagnostikk og resistensbestemmelse
- Innsatsområde 8 - Forvaltning og tilsyn
- Vedlegg 1. Når de ulike antibiotika ble oppdaget eller tatt i bruk
- Vedlegg 2. Antibiotika til mennesker
- Vedlegg 3. Antibiotika til dyr
- Vedlegg 4. Virkningsmekanismer for antibiotika
- Vedlegg 5. Mekanismer for resistens mot antibiotika
- Vedlegg 6. Smittemåter
- Vedlegg 7. Utvikling av antibiotikaresistens hos noen viktige sykdomsframkallende bakterier
Sammendrag
Sosial- og helsedepartementet oppnevnte 6. juli 1998 ei prosjektgruppe som skulle lage en koordinerende plan for å motvirke antibiotikaresistens i landet. Gruppa har hatt med representanter fra myndigheter og fagmiljøer og la fram sin plan 29. januar 1999.
Del 1 Problemet
Del 1 av planen beskriver resistensproblemet og dets årsaker. Antibiotika er legemidler som dreper eller hemmer veksten av mikrober (bakterier, virus og andre). Før antibiotika kom, var mange infeksjonssykdommer langvarige og førte ofte til alvorlige følgetilstander eller død. Moderne antibiotikabehandling innebar en revolusjon i kampen mot sykdom og død forårsaket av smittestoffene. Antibiotika bidro til å redusere forekomsten av sykdommene, følgetilstandene og dødeligheten. I tillegg gir antibiotika-behandling nedsatt smittepress ved å redusere smittebærer-tilstanden og derved redusere smittespredning.
Denne situasjonen kan nå være truet. Mange mikrober får endret sitt arvestoff slik at de kan motstå angrep fra antibiotika. De er blitt resistente. Gjennom det naturlige utvalg vil disse mikrobene etterhvert dominere i et miljø med mye antibiotikabruk. Økende forekomst av resistente mikrober skyldes økt forbruk av antibiotika og økt spredning av slike mikrober, for eksempel på grunn av sviktende sykehushygiene.
Antibiotikaresistens kan få alvorlige konsekvenser:
- Det blir vanskeligere å velge et virksomt antibiotikum ved start av behandlingen, for eksempel hos kritisk syke pasienter der man ikke har tid til på vente på laboratorieundersøkelsene.
- Liggetiden i sykehus, antibiotikaforbruket, kostnadene og dødeligheten vil øke.
- Man må benytte dyrere og kanskje mer giftige antibiotika.
- I verste fall kan noen infeksjonssykdommer bli uhelbredelige; ingen antibiotika virker lenger.
Internasjonalt har man sett en akselererende økning av forekomsten av resistente, sykdomsframkallende mikrober hos dyr og mennesker. Utviklingen ses også i Norge, men problemet er foreløpig mindre her enn de fleste andre steder. Likevel møter sykehusleger daglig antibiotikaresistens som et problem i behandlingen av pasienter.
Antibiotikaforbruket i Norge har vært i gledelig nedgang de siste årene. I 1997 ble det hvert døgn i gjennomsnitt brukt 17,2 doser antibiotika per 1000 nordmenn. Dette tilsvarer at nesten 2% av befolkningen hver dag tok en normaldose antibiotika, eller at nesten alle nordmenn hadde en antibiotikakur i løpet av året.
Antibiotikabruken til husdyr er redusert med 29% fra 1995 til 1997. Antibiotikabruk til oppdrettsfisk er redusert fra 49 tonn i 1987 til 3/4 tonn i 1997, som følge av utbredt vaksinering av fisken og hygieniske tiltak.
Fremdeles brukes det likevel mye antibiotika unødvendig. Dette skyldes blant annet kompliserte forhold i samspillet mellom lege og pasient eller veterinær og dyreeier. Legens utfordring er å finne - blant mange pasienter med tilsynelatende uskyldige infeksjonssykdommer - dem som skal ha antibiotika og deretter å velge det riktige antibiotikum. Det er en vanskelig oppgave. Vi må påvirke dette samspillet for å forbedre antibiotikabruken slik at resistensutviklingen kan bremses.
Del 2 Hva er gjort til nå i Norge?
Del 2 gir en oversikt over de tiltak som ulike etater og sektorer allerede har satt i verk eller er i ferd med å sette i verk. Norske myndigheter og fagmiljøer har i lang tid vært klar over det truende problemet og satt i verk gode tiltak. Dette har utvilsomt bidratt til Norge hittil har klart å beholde en gunstigere situasjon enn mange andre land.
Del 3 Internasjonale planer og anbefalinger
Del 3 gir sammendrag og utdrag fra de nyeste og viktigste utredninger og resolusjoner om resistens fra land vi kan sammenlikne oss med og fra internasjonale organer.
Verdenshelseforsamlingen vedtok i mai 1998 en resolusjon der man oppfordret medlemslandene til blant annet å overvåke antibiotikaforbruk og resistensforekomst, utdanne helsepersonell og publikum om antibiotikaresistens og styrke smittevernet. Liknende oppfordringer kom i den såkalte Københavnerklæringen fra blant annet helseministrene og helsedirektørene i EU. I erklæringen oppfordres Den europeiske union og medlemslandene til å anerkjenne at antibiotikaresistens er et stort europeisk og globalt problem.
Folkehelseinstituttet i USA har resistens som et innsatsområde i sin smittevernplan. Instituttet har sammen med barnelegeforeningen satt i gang en informasjonskampanje for leger og publikum for å bedre antibiotikabruken. Overvåkingen av resistens skal styrkes.
I UK har to utredninger, en fra overhuset og en fra helsedepartementet, pekt på behovet for overvåking av resistens og antibiotikabruk, økt forskning, og økt informasjon til befolkningen.
I Danmark har myndighetene iverksatt et overvåkingssystem som integrerer resistens og antibiotikabruk hos både mennesker og dyr. I Sverige er det dannet strategigrupper for fornuftig antibiotikabruk i alle fylkene. I Finland samarbeider de medisinsk mikrobiologiske laboratoriene i et forsknings- og overvåkingsnettverk.
Del 4 Hvordan kan vi motvirke resistens?
Del 4 gir anbefalinger om tiltak med begrunnelser. Tiltakene gjentas i selve handlingsplanen. Anbefalingene rettes til statlige, fylkeskommunale og kommunale myndigheter, til rekvirenter av antibiotika og annet helsepersonell, til næringsorganisasjoner, legemiddelindustri, fagforeninger og frivillige organisasjoner, til utdanningsinstitusjoner, og til publikum. Resistens må bli et tema for alle.
Handlingsplan
Handlingsplanen har som overordnet mål å bevare antibiotika som gode og virksomme legemidler mot infeksjonssykdommer i det 21. århundre gjennom å motvirke utvikling og spredning av antibiotikaresistens.
Planens hovedmål for perioden 1999-2003 er at
- vi skal oppnå bedre kunnskaper om:
- antibiotikabruk,
- forekomst av resistente mikrober hos mennesker og dyr og i matvarer og miljø
- årsaker til utvikling og spredning av resistente mikrober
- bruken av antibiotika til mennesker og dyr skal forbedres, og
- smittevernet for mennesker og dyr skal forbedres.
I handlingsplanen skisseres ei rekke tiltak. Blant tiltakene er å:
- Etablere et Norsk overvåkingssystem for resistens hos mikrober (NORM).
- Iverksette den planlagte nasjonale reseptbaserte legemiddelstatistikken.
- Etablere et femårig forskningsprogram under Norges forskningsråd om resistens.
- Bygge flere enerom med nødvendige sanitærinstallasjoner ved sykehusene.
- Oppnevne en antibiotikaansvarlig person eller -komité ved alle sykehus.
- Vurdere å opprette et senter for antibiotikabehandling i allmennpraksis
- Stimulere allmennleger til å benytte reseptstatistikk i diskusjon med kolleger om sin praksis.
- Iverksette en informasjonskampanje rettet mot småbarnsforeldre.
- Etablere et eldrevaksinasjonsprogram for alle innbyggere over 65 år og tilby gratis vaksine mot influensa og pneumokokksykdom.
- Fortsette ei streng linje vedrørende markedsføringstillatelser for nye antibiotika.
- Gjøre det veterinærmedisinske senteret for produsentuavhengig legemiddelinformasjon permanent.
- Vurdere å overføre tilsyn med veterinærers rekvirering til Statens dyrehelsetilsyn.
Innledning og bakgrunn
Mandat
I brev av 6.7.1998 til Statens institutt for folkehelse (Folkehelsa) skrev Sosial- og helsedepartementet:
"Regjeringen har nå bestemt at det skal lages en koordinerende plan for å motvirke antibiotikaresistens i landet. (...) Mandatet for prosjektgruppens arbeide vil fremgå av følgende målsetting og strategier:
Hovedmålsettingen for arbeidet med bekjempelsen av antibiotikaresistens vil være:
1. Mindre og riktigere bruk av antibiotika fordi all bruk av antibiotika øker risikoen for resistensutvikling.
2. Prioritering av forebyggende tiltak for å begrense opptreden av infeksjoner.
3. Hindre at antibiotikaresistens spres via forflytning av biologisk materiale.
Det er følgende strategier for å nå disse målene:
- Bedre løpende oversikt over forbruket av antibiotika til mennesker og dyr.
- Bedre løpende oversikt over forekomsten av resistente bakterier hos mennesker og husdyr og i mat.
- Bedre kunnskap om hvorledes resistens oppstår og spres mellom bakterier.
- Bedre kunnskap om kvalitative og kvantitative forhold vedrørende spredning av resistens ved forflytning av biologisk materiale.
En samlet plan må beskrive nærmere hvordan disse strategiene kan operasjonaliseres og koordineres. Planen vil omhandle følgende elementer:
- Overvåking og kartlegging (...)
- Standardisering og kvalitetssikring i laboratoriene (...)
- Forskning (...)
- Formidling (...)
- Forvaltning og tilsyn (...)."
Oppnevning, organisering og arbeidsgrunnlag
Oppnevning
I brev av 6.7.1998 til Folkehelsa skrev Sosial- og helsedepartementet:
"Planen skal utarbeides av en prosjektgruppe som skal ledes av direktøren for Statens institutt for folkehelse som også vil fungere som sekretariat for prosjektgruppen. Det skal videre opprettes en interdepartemental styringsgruppe som skal ledes av statssekretæren i SHD."
Departementet oppnevnte så et antall personlige medlemmer av gruppa. I tillegg ble flere statlige direktorater, tilsyn og institutter bedt om å oppnevne representanter.
Sammensetning
Prosjektgruppa fikk denne sammensetningen:
- Fiskeridirektoratet
ved Bjørn-Tore Lunestad, seksjonsleder dr. scient.
- Norges veterinærhøgskole
ved Kristian Ingebrigtsen, professor dr. med. vet.
- Statens dyrehelsetilsyn
ved Birgit D Nielsen (vikar for Eivind Liven)
- Statens forurensningstilsyn
ved Anita Myrmæl (vikar for Kari R T Løkken)
- Statens helsetilsyn
ved Kirsten Myhr, rådgiver og
Berit Olsen, avdelingsdirektør (erstattet av Asbjørn Haugsbø, avdelingsdirektør)
- Statens institutt for folkehelse
ved Bodolf Hareide, direktør, leder
- Statens landbrukstilsyn
ved Ellen Marie Grande
- Statens legemiddelkontroll
ved Gro Ramsten Wesenberg, seniorrådgiver, dr. odont.
- Statens næringsmiddeltilsyn
ved Nina Krefting Aas
- Veterinærinstituttet
ved Kåre Fossum, professor dr. med. vet.
- Arvid Bjørneklett, overlege dr. med., Rikshospitalet
- Petter Brandtzæg, overlege professor dr. med., Ullevål sykehus, Universitetet i Oslo
- Stig Harthug, avdelingsoverlege førsteamanuensis, Haukeland sykehus, Universitetet i Bergen
- Per Hjortdahl, professor dr. med., Universitetet i Oslo
- Signe Holta Ringertz, avdelingsoverlege professor dr. med., Aker sykehus, Universitetet i Tromsø
- Claus Ola Solberg, overlege professor dr. med., Haukeland sykehus, Universitetet i Bergen
- Martin Steinbakk, overlege, Sentralsykehuset i Akershus
- Per Leiv Svarva, overlege, Regionsykehuset i Trondheim
- Lars H Vorland, avdelingsoverlege, Regionsykehuset i Tromsø
Prosjektgruppas sekretariat har bestått av hovedsekretær overlege Preben Aavitsland og sekretær overlege E Arne Høiby, Folkehelsa. Ellers har professorene L Oddvar Frøholm og Arve Lystad, Folkehelsa og assistentlege Bjørn G Iversen, Folkehelsa, deltatt i sekretariatet.
Organisering og arbeidsgrunnlag
Prosjektgruppa har hatt seks møter. Utkast til innstillingens ulike deler ble skrevet på grunnlag av skriftlige innspill og drøftingene i møtene. Utkastene ble så sendt ut før neste møte.
Styringsgruppas leder, prosjektgruppas leder og ett medlem samt hovedsekretæren deltok ved konferansen The Microbial Threat i København 9.-10. september 1998.
Skriftlige innspill fra deltakerne
Alle deltakerne ble innledningsvis bedt om å levere et skriftlig notat der de kort og punktvis gjorde rede for eget, institusjonens, eller etatens tidligere, nåværende og planlagte engasjement på området. Notatene ble satt sammen med de eksterne bidragene (se nedenfor) til en statusrapport som seinere utviklet seg til innstillingens del 2. Bidragene var også en del av grunnlaget for forslagene om nye tiltak i innstillingens del 4.
Skriftlige innspill fra andre etater og foreninger
I august 1998 sendte lederen ut brev til ei rekke etater og foreninger. I brevet het det blant annet:
"Under planarbeidet er det viktig med en oversikt over de aktiviteter som allerede er satt i verk. Videre er det nødvendig å vite hva de ulike sektorer mener er de viktigste utfordringene og hvordan disse skal møtes. Jeg vil derfor med dette invitere institusjoner, foreninger og andre som ikke er med i prosjektgrup-pa, til å bidra til en statusrapport og idédugnad.
Gjør som deltakerne i prosjektgruppa: Skriv et notat på inntil et par sider som kort og punktvis gjør rede for institusjonen eller foreningens tidligere, nåværende og planlagte engasjement på området. Innled notatet med en kort beskrivelse av hva dere ser på som de viktigste utfordringe-ne vedrørende resistens innen deres interesseområde. Legg gjerne ved eventuelle relevante utredninger, handlingspla-ner, brosjyrer mv. som dere står bak."
Gruppa mottok innspill fra følgende:
- Arbeidsgruppen for antibiotikaspørsmål
- Den Norske Veterinærforening
- Den norske tannlegeforening
- Det medisinske fakultet, Universitetet i Bergen
- Det odontologiske fakultet, Universitetet i Oslo
- Farmasiforbundet
- Folkhälsoinstitutet, Finland
- Forbrukerrådet
- Nasjonalforeningen for folkehelsen
- Norges forskningsråd
- Norges landbrukshøgskole
- Norges Apotekerforening
- Norsk Homøopatisk Pasientforening
- Norske Homeopaters Landsforbund
- Norske Kvinners Sanitetsforening
- Regionalt legemiddelinformasjonssenter (RELIS) Helse-region 5
- Regionalt legemiddelinformasjonssenter (RELIS) Helseregion 4
- Senter for internasjonal helse, Universitetet i Bergen
- Smittskyddsinstitutet, Sverige
- Statens helseundersøkelser
- Statens Serum Institut, Danmark
- Sundhedsstyrelsen, Danmark
Gruppa savnet innspill fra Den norske lægeforening, Legemiddelindustriforeningen, naturvernorganisasjonene og enkelte andre foreninger.
Forholdet til styringsgruppa
Styringsgruppa ved lederen, Sosial- og helsedepartementet og Landbruksdepartementet ble holdt løpende orientert om arbeidet i prosjektgruppa gjennom kopier av utsendinger og referater, gjennom telefonsamtaler med prosjektgruppas leder og gjennom hans deltaking i styringsgruppas møter. Styringsgruppas signaler ble brakt videre til prosjektgruppa av prosjektgruppas leder. Styringsgruppas leder deltok i første del av prosjektgruppas siste møte.
Prosjektgruppas opprinnelige frist den 31.12.1998 ble etter forespørsel til styringsgruppa forlenget med én måned til 29.1.1999.
Fortolkning av mandatet
Prosjektgruppa har sett det som sin oppgave å lage
- en statusrapport over arbeidet for å motvirke resistens i Norge, og
- en plan som regjeringen kan benytte i prioriteringen av tiltak for å motvirke resistens.
Målet har vært å lage en innstilling som kan få bred oppslutning i forvaltning og fagmiljøer, og som integrerer arbeidet på flere sektorer, nemlig overfor mikrober fra mennesker, dyr, mat og miljø.
Prosjektgruppa har, i tråd med oppnevningsbrevet, ikke sett det som sin oppgave å kostnadsberekne de foreslåtte tiltakene.
Ordbruk
Vi har forsøkt å unngå for mange faguttrykk i instillingen. Målet er at den skal kunne leses av personer uten helsefaglig bakgrunn. Ei ordliste fins som vedlegg. Fire ord må forklares allerede her:
Antibiotika
Antibiotika er naturlige substanser som produseres av mikrober, og som hemmer veksten av eller dreper andre mikrober. Kjemoterapeutiske stoffer er kunstig framstilte stoffer med de samme egenskaper. Ordet antimikrobielt middel har vært definert som ethvert stoff - naturlig, semisyntetisk eller syntetisk - som dreper eller hemmer veksten av en mikrobe og samtidig gjør liten eller ingen skade på det individet som får stoffet. For enkelthets skyld lar vi i denne innstillingen ordet antibiotika dekke både de egentlige antibiotika og antimikrobielle midler. (For ytterligere forklaring, se 1.1.1.)
Antibiotikaresistens
Med antibiotikaresistens menes en mikrobes evne til å motstå antibiotika. For enkelthets skyld benytter vi flere ganger bare betegnelsen resistens. I tråd med ordbruken ovenfor betyr resistens resistens mot både de egentlige antibiotika og antimikrobielle midler.
Mikrobe
Med mikrobe menes enhver organisme som er så liten at den ikke er synlig med det blotte øye, for eksempel virus, bakterier, sopp og protozoer (encellete dyr). Noen ganger benyttes ordet mikroorganisme som betyr det samme. Innstillingen dreier seg først og fremst om bakterier.
Rekvirering
Rekvirering er muntlig, skriftlig eller elektronisk bestilling av legemiddel ved respet eller rekvisisjon. En rekvirent er en person med rett til å rekvirere legemidler, i denne forbindelse oftest lege, tannlege eller veterinær.
Oppbygging av rapporten
Generelt
Rapporten er delt i fire deler, hver med flere kapitler. Delene nummereres 1-4. Kapitlene nummereres innefor hver del, for eksempel er 2.4 det fjerde kapitlet i del 2. Det siste kapitlet i hver del er ei litteraturliste.
Etter del 4 følger så selve handlingsplanen og deretter flere vedlegg.
Del 1. Problemet
I denne delen beskriver vi resistensproblemet og dets årsaker. Etter en kort historisk oversikt beskriver vi det biologiske grunnlaget for resistens mot antibiotika. Deretter gir vi noen data om utviklingen av resistens hos bakterier fra mennesker og dyr i Norge og i andre land. I de to neste kapitlene gjennomgår vi statistikken over antibiotikabruk for mennesker og dyr i Norge. Vi diskuterer deretter i hvilken grad antibiotikabruk er årsaken til resistens, og om utviklingen kan snus. Til slutt konkluderer vi at resistens er et folkehelseproblem.
Del 2. Hva er gjort til nå i Norge?
I denne delen gir vi en oversikt over de tiltak som ulike etater og sektorer allerede har satt i verk eller er i ferd med å sette i verk. Denne delen bygger i hovedsak på innspill etter en forespørsel til aktuelle etater og foreninger. Del 2 er delt i de samme ni kapitler som del 4. I del 2 beskrives hva som er gjort til nå; i del 4 beskrives gruppas anbefalinger for hva som bør gjøres i framtida.
Del 3. Internasjonale planer og anbefalinger
I denne delen gir vi et sammendrag av og utdrag fra de nyeste og viktigste utredninger og resolusjoner om resistens fra land vi kan sammenlikne oss med og fra internasjonale organer. Vi forsøker ikke å gi noen fullstendig oversikt over de enkelte lands ulike strategier, programmer, systemer og tiltak, men gjengir noen som vi mener kan ha særlig relevans for norske forhold. Kapitlene er om Verdens helseorganisasjon, Den europeiske union, USA, United Kingdom og Norden.
Del 4. Hvordan kan vi motvirke resistens?
I denne delen gir vi forslag til tiltak med begrunnelser. Gruppas forslag tar utgangspunkt i foreliggende tiltak og strukturer, gruppas oppfatninger, den vitenskapelige litteraturen og anbefalinger i andre land. Kapittelinndelingen er den samme som i del 2.
Anbefalingene rettes til statlige, fylkeskommunale og kommunale myndigheter, til rekvirenter av antibiotika og annet helsepersonell, til næringsorganisasjoner, fagforeninger og frivillige organisasjoner, til utdanningsinstitusjoner, og til publikum. Vi oppfordrer dem til å støtte handlingsplanen gjennom deres virke, for eksempel ved ressursprioriteringer, prosedyrer, planer, myndighetsutøvelse og personlig atferd. Resistens må bli et tema for alle.
Handlingsplan
I denne delen gir vi, med bakgrunn i del 4, planens mål og innsatsområder kort og punktvis.
Lagt inn 4. februar 1999 av Statens forvaltningstjeneste, ODIN-redaksjonenDel 1: Problemet
1.1 Innledning
1.1.1 Forløpet av infeksjoner før antibiotika ble tilgjengelige
Infeksjonssykdommene har i historisk tid alltid vært av stor betydning for menneskene [1]. Mange faktorer har til sammen ført til redusert forekomst av infeksjoner i løpet av de siste 150 år. Innsikt i smittestoffenes egenskaper og smittemekanismer, og derav følgende fornuftige smitteverntiltak, har gitt lavere smittespredning. Bedret boligstandard med lavere beboertetthet, bedre ernæring som gir bedret generell motstandsdyktighet, og renere vann og mat har gitt store gevinster i kampen mot infeksjonssykdommene. Desinfeksjon har redusert reservoaret av smittestoff og hemmet spredning av smittestoff. Vaksinasjon har bidratt til å øke befolkningens immunitet og ytterligere redusert forekomsten av mange infeksjonssykdommer. I tillegg har antibiotika vært et betydelig framsteg.
Antibiotikabehandling innebar en revolusjon i kampen mot sykdom og død forårsaket av smittestoffene. Antibiotika forandret mange alminnelige, men alvorlige infeksjoner fra å ha høy dødelighet, høy forekomst av følgetilstander og langvarig sykelighet til å bli mer hverdagslige hendelser som stort sett forløper gunstig og med kortvarig sykdom [2].
Utbrudd av en så alminnelig sykdom som skarlagensfeber (forårsakes av gruppe A-streptokokker) i Norge i siste halvdel av forrige århundre medførte opptil 10% dødelighet blant rammete barn [3,4]. I dag er alvorlige følger av tilsvarende gruppe A-streptokokkinfeksjoner minimale i forhold til dette. Dødeligheten ved ekte blodforgiftning (septikemi) på grunn av samme bakterie i tiden før antibiotika kom, var nær 80 % og selv unge mennesker med god allmenntilstand døde [5].
Dødeligheten av vanlig bukhinnebetennelse, for eksempel etter en blindtarmsbetennelse, var heile 30-50%. Kirurgisk inngrep, som i dag er livreddende, var dengang svært farlig fordi man ikke hadde antibiotika å gi under operasjonen. Inngrep førte svært ofte til en livstruende blodforgiftning [6].
Tilsvarende var sjansen for overlevelse ved bakteriell hjernehinnebetennelse svært lav (<10%), og de som overlevde hadde nesten alle betydelige hjerneskader som følge av infeksjonen.
Moderne antibiotikabehandling har helt endret dette bildet. Forekomsten av sykdommene er betydelig redusert, følgetilstandene er blitt færre, dødeligheten er redusert, og levealderen har økt. I tillegg gir antibiotikabehandling nedsatt smittepress ved å redusere smittebærertilstanden og derved redusere smittespredning.
1.1.2 Antibiotika
Et antibiotikum er et stoff som produseres av mikrober og dreper eller hemmer veksten av andre mikrober. Ordet antibiotikum ble første gang brukt i 1942 av streptomycinets oppdager - den amerikanske forskeren Selman A. Waksman.
Antibiotika ble opprinnelig framstilt av "ufarlige" mikroorganismer - vanligvis sopp fra jordbunnen - for å bekjempe de "farlige" mikroorganismene, dvs. dem som forårsaker sykdom hos mennesker og dyr. Etter hvert som den kjemiske strukturen til stoffene ble klarlagt, har det imidlertid lykkes å framstille en hel rekke antibiotika i laboratoriene ad kjemisk (syntetisk) vei. Det har dessuten vært mulig å framstille stadig nye antibiotika ved å foreta små kjemiske forandringer av de gamle stoffene. I tillegg er det etter hvert også utviklet syntetiske stoffer som ikke finnes fra før i naturen.
Det korrekte navn er kjemoterapeutika, dvs. kjemisk framstilte stoffer som brukes i behandlingen av infeksjoner forårsaket av virus, bakterier, sopp og prozoer (éncellete dyr). Antimikrobielle midler benyttes som fellesbetegnelse på antibiotika og kjemoterapeutika.
Ordet antibiotikum har nå vært i bruk i over 50 år og er innarbeidet i folks bevissthet ved å bli brukt i stedet for antimikrobielt middel og omfatter både naturlig framstilte og syntetiske midler. For enkelthets skyld lar vi i denne innstillingen ordet antibiotika dekke både de egentlige antibiotika og de øvrige antimikrobielle midler.
Det har vært vanskeligere å finne stoffer som virker godt mot virus (antivirale midler) enn mot bakterier og sopp. Dette er fordi virus har sparsomt eget biokjemisk utstyr og er avhengige av vertscellenes biokjemiske apparat. Derfor vil midler som virker på virus, også lettere kunne skade pasienens egene celler. Imidlertid er det de siste årene kommet mange viktige syntetiske antivirale midler også.
1.2 Antibiotika-tidsalderen
Neppe noen medikamentgruppe har imponert menneskene mer enn antibiotika. Da sulfonamidene kom på markedet midt på 1930-tallet, innledet de en helt ny epoke i behandlingen av en så vanlige sykdommer som lungebetennelse som årlig tok livet av tusener av friske unge mennesker, urinveisinfeksjoner, rosen, alvorlig halsbetennelse, gonoré og til og med hjernehinnebetennelse, som nesten alltid var dødelig.
Ingen ante på 1930-tallet at det i løpet av mindre enn 10 år skulle åpnes helt nye veier som skulle få behandling med sulfonamider til å fortone seg som vandring på gjengrodde stier. Men nettopp det var det som skjedde da det første egentlige antibiotikum (oppdaget av Sir Alexander Fleming alt i 1929 [7]) - penicillinet - i 1943-44 ble framstilt i en slik form at det kunne sprøytes inn på pasienter som behandling for alvorlige infeksjoner.
I løpet av noen få år deretter fulgte oppdagelsen av flere antibiotika som streptomycinet, tetracykliner og kloramfenikol. Da var alt flere bakterier blitt upåvirkelige (resistente) av sulfonamidene. Gonokokkene var de første bakteriene som utviklet resistens - et fenomén som skulle komme til å spille en avgjørende rolle ved bruk av alle antibiotika - ja, så avgjørende at mange har spurt om antibiotikaæraen nå snart er over.
Vedlegg 1 viser når de ulike antibiotika ble tatt i bruk. Vedlegg 2 og 3 viser når de enkelte medikamentene ble markedsført i Norge.
I dag vet vi at økende forekomst av resistente mikrober skyldes økt forbruk av antibiotika og økt spredning av slike mikrober, for eksempel på grunn av sviktende sykehushygiene. I flere tiår har oppdagelse av nye antibiotika i praksis stort sett holdt tritt med resistensutviklingen - som vi nå vet har foregått hele tiden. Den farmasøytiske industrien har berget oss rimelig bra ut av mange resistens-problemer ved å framstille stadig nye og til dels bedre antibiotika. Nå synes imidlertid den tid være kommet at det er blitt svært vanskelig og ikke minst urimelig kostbart å framstille nye antibiotika med nye egenskaper.
I stedet for stadig nye antibiotika mot infeksjoner forårsaket av mer resistente mikroorganismer, må vi derfor snarest satse i motsatt ende av problemet, nemlig å bruke mindre antibiotika så resistensutviklingen reduseres og bruke de antibiotika vi har på en bedre måte.
1.3 Bakgrunn for antibiotikas virkning og for utvikling av resistens
1.3.1 Virkningsmekanismer for antibiotika
Antibiotika må kunne utøve giftvirkning på bakterier, sopp, virus mv. uten i vesentlig grad å skade cellene i kroppen til individet som tar antibiotika. Dette kalles selektiv toksisitet (utvelgende giftighet). Slik virkning har antibiotika dersom de virker på strukturer eller stoffskifteprosesser som mikroben, men ikke vertscellene har, eller som er svært ulike hos mikrobe og vertscelle. En oversikt over virkningsmekanismene for antibiotika er vist i vedlegg 4.
Bakteriecelleveggen
Bakteriene har en cellevegg bestående av makromolekylet peptidoglykan som er et nettverk av aminosukkerkjeder koplet sammen med små peptider. Celleveggen er heilt forskjellig fra celleveggen hos dyrs og menneskers celler og er derfor et et egnet angrepsmål for antibiotika. Mange viktige antibiotika virker ved å hindre syntese av celleveggens byggesteiner eller ved å hindre sammenkoplingen av komponentene til makromolekyl. Da celleveggen er helt nødvendig for bakteriene, vil disse stoffene ofte være bakteriedrepende. Viktige eksempler på slike stoffer er:
- betalaktamer (med undergruppene penicilliner, cefalosporiner, monobaktamer og karbapenemer)
- glykopeptider (med stoffene vankomycin og teikoplanin).
Proteinsyntesen
Da bakteriene har noe annerledes konstruerte ribosomer (cellenes proteinfabrikker som leser av genenes koder og lager proteiner) enn høyerestående celler, har det vist seg mulig å finne stoffer som selektivt hemmer bakterienes proteinsyntese. I denne gruppen er aminoglykosider bakteriedrepende; de andre er stort sett bakteriehemmende. Eksempler på slike stoffer er:
- aminoglykosider (stoffene streptomycin, gentamicin etc.)
- tetracykliner (stoffene tetracyklin, doksycyklin etc.)
- makrolider (erytromycin etc)
- linkosamider (klindamycin)
- kloramfenikol.
Hemming av stoffskifteprosesser (hemmer ulike enzymer)
Bakteriene har et stoffskifte som kan være så forskjellige fra dyreceller at man kan hemme dem uten å skade vertscellene alvorlig. Her finner man både bakteriostatisk og baktericid virkende stoffer. Eksempler på slike er:
- trimetoprim
- sulfonamider
- kinoloner
- fusidinsyre.
1.3.2 Resistens og evolusjon
Resistensutvikling er endringer i bakteriene som gjør dem i stand til å overleve under nye miljøbetingelser (adaptasjon). Bakterier er fra naturens side svært tilpasningsdyktige. De er tilpasset alle slags økologiske nisjer, og når nye muligheter for vekst byr seg, vil noen bakterier etter hvert ha evne til å tilpasse seg de nye betingelsene.
Sett fra mikrobenes side vil antibiotika (som altså hindrer deres vekst eller dreper dem) være miljøfaktorer som er ugunstige for dem. Blant mikrobene er det imidlertid stor variasjon i egenskaper. Variasjonen bunner i mutasjoner og overføringer av arvestoff mellom bakterier (se 1.3.3). Med utgangspunkt i denne variasjonen vil det skje et naturlig utvalg av de mikrober som har resistens mot det aktuelle antibiotikum. Disse utvalgte mikrobene har altså større overlevelsesevne under de nye betingelsene.
Observasjoner gjort i antibiotikaæraen viser til fulle at mikrobene har stor evne til å overleve ved tilpasning til nye miljøer etter rent darwinistiske prinsipper. Undersøkelser av bakterier som ble funnet i prøver fra syke mennesker fra tida før antibiotika kom i bruk, bekrefter at ervervet resistens mot disse antibiotika da var fraværende [8,9].
Som mekanismer for tilpasning kan det dreie seg om at naturlig resistente mikrober får fortrinn slik at følsomme mikrober fortrenges. Naturlig resistente bakterier er medfødt motstandsdyktige ved at de mangler de egenskaper eller strukturer som antibiotikumet angriper, ved at antibiotikum ikke trenger inn til målmolekylene (permeabilitetsbarrierer) eller ved at mikroben naturlig har antibiotikanedbrytende enzymer.
Følsomme mikrober kan også miste sin følsomhet (erverve resistens) ved at det skjer genetiske forandringer hos dem. Dette har foregått i sterk grad de siste vel 60 år.
1.3.3 Hvordan blir bakteriene resistente?
Bakterier og dyrecellers arvemateriale består av deoksyribonukleinsyre (DNA). Bakteriene har ett enkelt kromosom, men kan i tillegg ha arvestoff utenfor kromosomene i form av plasmider. Ervervet resistens kan oppstå på to ulike måter.
Mutasjon
Mutasjon er spontan endring i bakteriearvestoffet (DNA) uten tilførsel av nytt genmateriale utenfra. Slike endringer oppstår kontinuerlig. Konsekvensen av mutasjoner er at enkelte slike endringer kan gjøre at et antibiotikum mister noe av sin virkning overfor bakterien. Dette gir bakteriene et fortrinn i et miljø der antibiotikum finnes. Slik endring vil deretter nedarves til neste generasjon av bakterier (vertikal overføring av egenskaper).
Overføring av nytt DNA
Opptak av nytt genmateriale fra omgivelsene (horisontal overføring) skjer på flere ulike måter:
Transformasjon
Transformasjon er endring av bakteriene ved at fritt DNA (fra nabobakterier) tas opp og bygges inn i bakteriens eget DNA. Dette kan da medføre en fordelaktig endring i bakteriens egenskaper. Transformasjon er utbredt i naturen og kan gi langsom endring av bakterienes egenskaper - som på litt lengre sikt kan bli svært viktige. Slike endringer som gir resistens, er for tiden særlig viktig hos pneumokokker, Haemophilus influenzae og neisserier, bakterier som kan gi blant annet hjernehinnebetennelse.
Transduksjon
Dette uttrykket brukes om overføring fra bakterie til bakterie av gener ved hjelp av bakterievirus (altså virus som kan smitte mellom bakterier). Mest kjent er dette fenomenet som mekanisme for overføring av penicillinresistens (ved enzymet betalaktamase) mellom stafylokokker.
Konjugasjon
Overføring av arvestoff ved direkte kontakt mellom to bakterier kan skje mellom nært eller fjernere beslektede organismer.
Genelementer som brukes til overføring av arvemateriale
Overføring av genetisk informasjon kan skje ved hjelp av genetiske elementer kalt plasmider og transposoner.
Plasmider
Plasmider er separate DNA-elementer som kan inneholde gener både for egen formering og egen overføring til nabobakterier. Noen plasmider har ikke dette fulle apparatet, men kan utnytte andre, mer komplette plasmider til dette formålet.
Transposoner
Transposoner, eller hoppegener, er betegnelsen på DNA-elementer som er i stand til å bevege seg fra en organisme til en annen eller fra et kromosom til et plasmid innen én enkelt bakterie.
Integroner er avanserte hoppegener som har en mekanisme for å innføre (integrere) gener som koder for resistens mot ulike antibiotika, desinfeksjonsmidler og tungmetaller, i arvestoffet til andre bakterier.
Bakteriestammer som er blitt resistente mot ett antibiotikum, erverver ofte resistens mot flere. Hoppegener og plasmider kan være en forklaring på dette fenomenet.
Etter at genmateriale som gir økt antibiotikaresistens er tatt opp i en bakterie, kan det gjennomgå mutasjoner med ytterligere økt resistens som resultat.
1.3.4 Kilder til resistensgener
Svært mange antibiotikaresistensgener har ukjent opprinnelse, f.eks. genet for meticillinresistens hos stafylokokker. Likevel har man klarlagt noen flere kilder for disse genene nå enn for få år siden. Mikrobene som har produsert antibiotika selv, har lenge vært antatt å være en svært viktig kilde. De ville ha begått selvmord om de ikke hadde metoder for å forsvare seg. Det viser seg at denne antakelsen er riktig [10,11]. Både betalaktamasegener og gener for glykopeptidresistens og for andre viktige stoffgrupper har sannsynligvis slik opprinnelse.
Det er også eksempler på at bakteriene kan lage stoffer som modifiserer antibiotikas giftighet for bakteriene. Det gjør bakteriene ved å utnytte gener som koder for enzymer som opprinnelig hadde andre funksjoner i cellen. Gener eller deler av gener fra mikrober som er naturlig resistente, vil kunne tas opp av følsomme bakterier som er utsatt for trusselen om utryddelse fra antibiotika [10,11]. Veiene slike gener vandrer, er stegvise, kompliserte (antakelig med mellomverter) og i høy grad ukjente.
1.3.5 Biokjemisk grunnlag for resistensutvikling
Nedsatt virkning av antibiotika på en mikrobe kan skyldes tre prinsipielt ulike endringer eller kombinasjoner av dem (se også vedlegg 5). Man kan se:
- Endringer i målmolekylet for et middel slik at det ikke lenger bindes så effektivt (endringen fører til nedsatt tiltrekningskraft, nytt, mindre påvirkelig målmolekyl eller økt mengde av målmolekyl).
- Inaktivering av midlet (ved nedbrytning eller kjemisk endring som tilkopling til antibiotikamolekylet av ny kjemisk gruppe som nedsetter effekten).
- Nedsatt konsentrasjon av midlet ved målmolekylet: Dette kan enten skyldes nedsatt gjennomtrengelighet eller aktiv utpumping (effluks) av midlet.
1.3.6 Økologi og seleksjonspress
Bakterier er den dominerende livsform på vår planet. Alle flercellete organismer har på sine eksterne og interne overflater et stort antall bakterieceller. Den største mengde finnes som regel i tarmkanalen. Mennesket har i sin tarm ca ti ganger så mange bakterieceller som det har egne celler i hele organismen. I tarmen har vi et komplekst økosystem med minst 500 bakteriearter. Etter som vi ikke lever i et sterilt miljø, både tilføres og avgir dette økosystemet kontinuerlig en stor mengde mikrobeceller. Det er antagelig mest korrekt å betrakte det enkelte individs "normalflora" som en ikke-isolert lomme i den omgivende biosfære.
Når et antibiotikum gis til én enkelt person, får det følgelig virkninger ikke bare for dette ene individets mikrobiologiske økosystem, men også for de andre som ferdes i hans eller hennes nære omgivelser. Dette er trolig den viktigste forklaring på at antibiotika-bruk hos relativt få individer i et miljø kan føre til resistensutvikling blant mikrober i hele nærmiljøet. Denne spredningen av resistensegenskaper hos ett individs bakterier til bakteriene hos et annet individ synes å skje raskere jo tettere miljø man befinner seg i, eksempelvis i institusjoner.
Mikroorganismer har et stort potensial for å tilpasse seg nye betingelser i miljøet. I naturen (i miljøet og i dyr og menneskers normalflora) finnes det et svært omfattende tilfang av resistensgener. Utstrakt bruk av antibiotika i jordbruk, i veterinærmedisinsk og ikke minst i humanmedisinsk behandling har skapt et betydelig seleksjonspress der de bakteriene som er best i stand til å tilpasse seg, vil overleve. Miljøer med høyt antibiotisk seleksjonstrykk kombinert med høy frekvens av mikrobeutveksling, vil innebære stor risiko. Mange utviklingstrekk i moderne medisin bidrar til dette (satsing på avansert transplantasjonsmedisin, behandling av multitraumatiserte pasienter, behandling av svære brannskader og immunsupprimerte og andre som trenger avansert behandling over lang tid osv). I særlig grad vil antibiotikaprofylakse, særlig antibiotikaprofylakse som pågår lenge, være risikabelt.
De faktiske enkelthendinger på mikrobenivå vet vi altså ikke nok om [10,11]. Uheldige endringer for resistensutviklingen kan være svært sjeldne både i tid og sted, og de kan foregå i økologiske nisjer vi ikke kjenner nok til. Om en endring skal få stor betydning på sikt, avgjøres av hvor vellykket den fungerer som tilpasning til seleksjonspresset. Selv en sjelden, men særlig vellykket endring av bakterien, kan få stor betydning i det lange løp. Slik er det at viktige mekanismer, som f.eks. den som førte til meticillinresistens hos stafylokokker, eller den som ga vankomycinresistens hos enterokokker, kan ha skjedd bare noen få ganger. Likevel har bakterier med disse resistensmekanismene spredd seg og er nå hyppige over hele kloden.
1.3.7 Spredning av resistensgener
Spredning av resistensgener kan skje vertikalt eller horisontalt. Ved vertikal spredning skjer direkte nedarving til bakterienes avkom, mens horisontal spredning skjer til andre bakterier uten at bakteriene nødvendigvis formerer seg. Denne siste spredningen kan skje både til nært beslektede bakterier og (sjeldnere) til mer fjerntstående arter. I sykehus er man særlig opptatt av sistnevnte mekanisme.
I de senere år er man blitt mer og mer klar over at normalfloraen både hos mennesker og dyr, foruten miljøet (jord, vann, omgivelser) er et stort reservoar for allerede resistente bakterier.
For å hindre oppsamling og spredning av resistens i sykehus og andre helseinstitusjoner, er det nødvendig med en bevisst og rasjonell antibiotikapolitikk, bedret hygiene og god overvåking og oppfølging av sykdomsutbrudd. Vi vet ikke nå hvilke tiltak som best kan hindre resistensutvikling i miljøet. Det ser ut til at bruk av antibiotika og antibiotikaliknende stoffer, men også enkelte desinfeksjonsmidler og tungmetaller, kan bidra til økt antibiotikaresistens hos bakterier [11].
1.3.8 Spredning av resistente bakterier
Bakterier spres på mange måter (se også vedlegg 6). Dels kan mikrobene spres direkte eller indirekte mellom mennesker som har helt nær kontakt med hverandre (kontaktsmitte) Kontaktsmitte kan være direkte eller indirekte eller via dråper. Noen få tilstander smitter over noe lengre avstander med dråpekjerner og luftbårne partikler (luftsmitte) som tuberkulose, vannkopper og meslinger. Stafylokokker kan i noen tilfeller spres med luft til særlig mottakelige individer, som brannskadete personer og personer under operasjon.
Ellers ligger det et svært potensiale i vehikkelsmitte (smittestoffet bringes med et vehikkel for eksempel mat eller vann); fordi denne mekanismen kan treffe svært mange mennesker og dyr samtidig. Tendenser i moderne matproduksjon, der få kilder forsyner store populasjoner, innebærer betydelig risiko. Matvarer og fôr kommer også oftere enn før fra andre land, ikke minst fra land med helt annen økologi og antibiotikafølsomhet hos mikrobefloraen [12,13].
Økt reising med turister, flyktninger, innvandrere, adoptivbarn etc. sørger også for samband med bærerflora (inklusive patogene mikrober) fra helt andre forhold enn hos oss [14]. Det er klare eksempler på at enkeltkloner av resistente og virulente bakterier kan spres, langsomt eller raskt, fra kontinent til kontinent via slike mekanismer.
Også personell og pasienter som har oppholdt seg i helseinstitusjoner utenlands kan bringe med seg resistente bakterier. Slike bakterier vil sjelden gi sykdom i første omgang hos bæreren. Likevel kan de overføres som hele bakterier til andre verter, eller deres resistensmekanisme kan smitte til andre mikrober i indre eller ytre miljø. Dels kan en slik resistent bakterie være del av normalfloraen hos et individ og først vise seg på et senere tidspunkt; når seleksjonspresset gir den en fordel. Slik kan en mikrobe som er etablert i normalfloraen, på et tidspunkt først uker og måneder seinere bidra til en viktig klinisk infeksjon (f.eks. en bukhinnebetennelse, urinveisinfeksjon eller septikemi).
1.3.9 Sykehusinfeksjoner
Med sykehusinfeksjoner menes infeksjoner som oppstår under eller etter et sykehusopphold, og som er en følge av oppholdet. Sykehusinfeksjoner skyldes relativt ofte resistente bakterier. Det er i Norge gjennomført fire landsomfattende under-søkelser av sykehusinfeksjoner i perioden 1979-1997 [15-18]. Disse undersøkelsene var såkalte pre-valensundersøkelser, dvs. undersøkelser der man registrerte alle sykehusinfeksjoner hos pasientene som lå i sykehusene en gitt dag. Andelen (prevalensen) av pasienter som hadde en sykehusinfeksjon har i disse undersøkelsene ligget omkring seks til sju prosent.
De hyppigste sykehusinfeksjonene har i alle disse undersøkelsene vært urinveisinfeksjoner (35-40%), postoperative (kirurgiske) sårinfeksjoner (18-25%) og luftveisinfeksjoner (18-20%).
Hyppigheten av sykehusinfeksjoner varierer avhengig av hvilke pasientkategorier det dreier seg om. De mest utsatte er infeksjonsømfintlige pasienter i intensivavdelinger. Disse utgjør en stigende andel av innlagte pasienter.
Økende satsing på hjemmebaserte tjenester vil også medføre at en del av de tradisjonelle sykehusinfeksjonene overføres til primærhelsetjenesten og sykehjemmene.
1.3.10 Hvordan angi forekomsten av resistens?
Særlig ved kartlegging og overvåking av resistens er det nødvendig å angi forekomsten av resistente bakterier på en enkel og gyldig måte. Dersom resultatene skal sammenliknes med resultater fra andre land eller med tidligere år, er det viktig at utvalget og metodene er like.
Utvalget av de bakterier som skal undersøkes, må være klart definert og representativt. Metode for prøvetaking, innsending, dyrkning og resistensbestemmelse er helt avgjørende for resultatet. Det er vanskelig å gjøre dette riktig og likt fra gang til gang.
Selve målingen av resistens i laboratoriet gir en tallverdi på en skala. For å forenkle tolkningen av målingen, særlig for den behandlende legen, deles verdiene langs skalaen i tre grupper: resistent, moderat følsom og følsom. Arbeidsgruppen for antibiotikaspørsmål (se 2.4.1) anbefaler i Norge hvor på skalaen grensene for de tre gruppene går, og disse anbefalingene følges av laboratoriene.
For overvåkingsformål er det vanligvis selve tallverdiene som er interessante. Likevel angis ofte andelen resistente isolater. Da går man glipp av mye informasjon, for eksempel hvor stor andel som er like under grensa for resistens. I tillegg må man ved sammenlikninger med andre land være sikker på at samme skalainndeling er benyttet.
Indikatorer er de resultater overvåkingen skal framskaffe. Det er indikatore-ne som skal sammenliknes fra år til år og angi utviklin-gen; de skal indikere endringer. Indikatorene er som regel antall resistente isolater per antall innbyggere per år (insidens) eller andel resistente isolater blant de undersøkte (prevalens).
For resistensfenomener som er sjeldne i Norge, og som nesten alltid blir diagnostisert, kan man oppgi en insidens. Det gjelder for eksempel hyppigheten av tuberkulose forårsaket av resistente bakterier. Her kan man imidlertid også ha nytte av å oppgi andel resistente bakterier blant alle tuberkelbakterier. Eller man kan oppgi gjennomsnittet (eller heile fordelingen) av resistensmålingene av alle tuberkelbakteriene.
For hyppigere resistensformer er det vanlig å oppgi andelen resistente isolater blant alle undersøkte isolater. Man bør imidlertid også her heller beskrive fordelingen av følsomhet over heile måleskalaen.
1.4 Utvikling av resistens over tid internasjonalt og nasjonalt
1.4.1 Innledning
I dette kapitlet omtales hovedsakelig resistens hos bakterier fra mennesker. Avsnitt 1.4.11 og 1.4.12 handler om bakterier fra henholdsvis dyr og næringsmidler.
Internasjonalt har man sett en akselererende økning av forekomsten av resistente, sykdomsframkallende bakterieisolater (se vedlegg 7). Fenomenet har vært særlig tydelig de siste 20 år. Utviklingen har også skjedd i Norge og ellers i Norden, selv om den foreløpig har vært mindre uttalt her enn de fleste andre steder.
I dag vet vi at økende forekomst av antibiotikaresistente bakterier skyldes et komplisert samspill mellom bakteriene og virkningen av antibiotika. Antibiotika vil gi bakterier som påvirkes minst, en fordel framfor dem som er fullt følsomme for midlene: De resistente selekteres.
Økt forekomst skyldes økt forbruk av antibiotika og økt spredning av motstandsdyktige mikroorganismer, for eksempel på grunn av sviktende sykehushygiene.
At utviklingen av resistens oftest skjer langsomt, og derfor kan undervurderes en tid, kan dels forklares ved at prosessene, som kan bestå av flere små steg eller av sjeldne hendinger, bruker tid på å bli tydelige [11].
1.4.2 Enterobakterier
Bakteriegruppen enterobakterier som Escherichia coli, Klebsiella og Enterobacter er en del av normalfloraen i tarmen hos mennesker og dyr. De er samtidig svært hyppige årsaker til infeksjoner hos mennesket, for eksempel urinveisinfeksjoner, sårinfeksjoner etter kirurgi, bukhinnebetennelser og blodforgiftning (septikemi). Normalfloraen vår byttes jevnlig delvis ut ved vår kontakt med omverdenen gejnnom matinntak og kontakt med andre mennesker. Forekomst av enterobakterier i mat og vann er en god indikator på forurensing med avføring og avspeiler også muligheten for overføring av resistens [12,13].
Mens mange slike bakterier var følsomme for ampicillin da dette medikamentet ble markedsført for 30 år siden, er resistensen nå økt betydelig. I dag er 30-40% av alle E coli-isolater ampicillinresistente mot langt under 10% før 1980 [19,20]. På 1970-tallet var samme art også svært følsom for trimetoprim-sulfa; i dag er forholdene i ferd med å bli som for ampicillin.
Den farmasøytiske industrien har svart med å lage mer bredspektrete medikamenter (blant annet andre- og tredjegenerasjons cefalosporiner og bredspektrete penicilliner). Enterobakteriene har deretter forbausende raskt tilpasset seg og utviklet resistens i stigende grad mot de nye stoffene i mange land. I Norden og Nederland har slik utvikling hittil vært moderat, mens den i Sør-Europa (Hellas, Italia, Frankrike og Spania) og USA har vært meget fremtredende.
1.4.3 Stafylokokker
Meticillinresistens hos stafylokokker innebærer at man ikke kan bruke noe betalaktam-antibiotikum til å behandle infeksjoner med disse bakteriene. Slik resistens ble første gang beskrevet 1961. Hos gule stafylokokker ( Staphylococcus aureus) har problemet i Norge, unntatt et relativt stort utbrudd midt i 1970-årene i Trondheim, vært lite. Meticillinresistente gule stafylokokker (MRSA) er særlig et sykehus- og sykehjemsproblem. Mens det har vært om lag 20 tilfeller i Norge per år, er opptil 50% av alle stafylokokkinfeksjoner i enkelte sykehusavdelinger i USA og Sør-Europa forårsaket av slike stammer. Imidlertid har vi i 1998 både i Norge og Sverige sett en tydelig økning. Antallet infeksjoner med MRSA meldt til MSIS fra 1995 til 1998 er henholdsvis 21, 17, 25 og ca 50.
Selv om hvite stafylokokker er typiske opportunistiske bakterier, er de problematiske i mange situasjoner i moderne medisin, særlig i samband med protesekirurgi. Meticillinresistente hvite stafylokokker (MRSE) har i løpet av de siste 20 år blitt et uttalt problem også i Norge (over 40-60% MRSE i enkelte sykehus).
Økt forekomst av meticillinresistente stafylokokker i sykehus kan føre til økt bruk av vankomycin. Dette legger grunnlaget for resistensutvikling mot vankomycin hos stafylokokkene selv og andre bakterier, særlig enterokokkene.
1.4.4 Enterokokker
Enterokokkene viser internasjonalt i økende grad resistens mot ampicillin og vankomycin særlig på sykehus i land med generelle resistensproblemer. Det kan se ut som at problemet bl.a. tiltar ved økt bruk av intensivenheter, men spres så til de andre avdelingene. I Norge er problemet med vankomycinresistente enterokokker (VRE) foreløpig begrenset til noen få sykehus. VRE-infeksjoner er overvåket i MSIS fra 1996, da fem tilfeller ble påvist. I 1997 fant man ingen og i 1998 ble tre tilfeller meldt [21,22].
Mange forhold kan ha bidratt til at VRE oppsto. I USA, der problemet er aller størst, mener man at årsaken er bruk av store mengder vankomycin mot meticillinresistente stafylokokker og mot diaré forårsaket av Clostridium difficile kombinert med sviktende sykehushygiene.
Avoparcin, et vankomycinliknende antibiotikum, har i mange land vært brukt som vekstfremmende tilsetning til dyrefôr, særlig for fjørfe. Dette har ført til at VRE har oppstått hos fjørfe og siden blitt overført til fjørfebønder (se 1.6.4 og 1.7.3).
1.4.5 Pneumokokker
Pneumokokkene er viktige årsaker til bl.a. mellomørebetennelser, lungebetennelser, hjernehinnebetennelser og blodforgiftninger både i og ikke minst utenfor sykehus. Pneumokokker med nedsatt penicillinresistens er et stort problem i noen deler av verden. Det er spesielle kloner (bakterier med samme egenskaper og felles opprinnelse) av pneumokokkbakteriene som har vist en forbausende evne til internasjonal spredning gjennom alminnelig kontakt mellom individer. I Skandinavia har problemet hittil vært reknet som lite, selv om det har økt på 1990-tallet. Island har imidlertid hatt betydelige problemer med resistente pneumokokker som på grunn av sannsynlig import fra Spania med turister [24].
I Norge ble den første pasienten med blodforgiftning med pneumokokker med nedsatt penicillinfølsomhet diagnostisert i 1983. Seinere år har forekomsten vært godt under 1% av isolatene fra blod og spinalvæske [24]. I 1998 er forekomsten imidlertid ca. 2% slike stammer.
MSIS-overvåkingen har i årene 1995 - 1998 registrert henholdsvis 4, 3, 1 og 5 infeksjonstilfeller med penicillinresistente stammer.
1.4.6 Hemofilus
Hemofilus har mange varianter og er viktig årsak til lungeinfeksjoner hos voksne og øvre luftveisinfeksjoner i alle aldre. Varianten serotype b har vært en hyppig og viktig årsak til hjernehinnebetennelse hos barn. Dette problemet er heldigvis nesten eliminert takket være bruk av en nyutviklet vaksine. Viktig er det at denne nye vaksinen også har ført til at nesten ingen er smittebærere av serotype b-kloner, uansett antibiotikafølsomhet. Alvorlig serotype b-sykdom er i mange land praktisk talt eliminert gjennom systematisk barnevaksinasjon; i Norge fra 1992 [25]. Derved er man kvitt et betydelig resistensproblem knyttet til alvorlig sykdom hos barn.
Likevel har andre varianter av hemofilus enn serotype b i økende grad blitt resistente mot penicillin (betalaktamase og endringer i penicillinbindende proteiner) de siste 25 år, slik at det mange steder i dag er 30-40% av stammene som ikke kan behandles med penicillin. I Norge er penicillinresistensen også økt til ca. 20% av invasive hemofilusstammer [26].
1.4.7 Gonokokker
Gonokokkene er fra 1976 blitt tiltakende penicillinresistente. I 1998 var heile 25% av gonorétilfellene meldt til MSIS forårsaket av penicillinresistente gonokokker. Det gjør at penicillinpreparater ikke lenger kan benyttes som standardbehandling. Nåværende standardbehandling er fluorokinoloner [27], men det er allerede observert resistente stammer importert med norske menn fra Thailand og Filippinene [28]. Dette gjør at utviklingen må følges nøye, og den enkelte pasient må følges inntil han er helbredet og smittefri.
1.4.8 Tuberkelbakterier
Tuberkulose har, med nitid oppfølging med anerkjent strategi, i flere tiår vært under kontroll i de fleste industrilandene. I utviklingsland og i tidligere Sovjetrepublikker har situasjonen lenge vært alvorlig og ute av kontroll mange steder. Økonomiske problemer, manglende vilje eller evne til oppfølging av svake grupper og økt antall immunsvekkete individer, særlig HIV-infiserte, har ført til betydelige problemer selv i land der situasjonen tidligere har vært under rimelig kontroll.
Resistensutvikling
Tuberkelbakteriene ( Mycobacterium tuberculosis) har større evne enn de fleste andre bakterier til rask resistensutvikling. Resistensutvikling skyldes mutasjoner, og ikke horisontal genoverføring. Hos alle pasienter, selv før antibiotikabehandling starter, er det derfor alltid noen bakterier som er resistente mot hvert enkelt av de aktuelle medikamentene. Dersom behandlingen starter med bare ett medikament, f.eks. isoniazid, vil alle bakteriene dø unntatt de som er isoniazidresistente. Disse resistente bakteriene vil overleve og formere seg, og dermed er pasienten raskt infisert med resistente bakterier (ervervet resistens) som han så kan smitte videre (mottakeren av denne nye smitten vil da ha primær resistens). Det er bakgrunnen for at det er så viktig fra første stund å behandle tuberkulose med flere medikamenter samtidig. Da vil de få isoniazidresistente bakteriene bli drept av andre medikamenter, for det er ingen bakterier som i utgangspunktet er resistente mot flere enn ett medikament. Pasienter med primær resistent tuberkulose kan imidlertid, gjennom samme mekanisme som ovenfor, utvikle resistens mot nok et medikament og få ervervet polyresistens.
Tabell 1. Andel resistente isolater av Mycobacterium tuberculosis mot henholdsvis minst ett og minst to medikamenter, og andel med resistens mot hovedmedikamentene isoniazid og rifampicin (multiresistens) i 1994-97. Med primær resistens menes resistens hos en pasient som aldri har vært behandlet for tuberkulose. Med ervervet resistens menes resistens oppstått under eller etter behandling. Utvalg fra [31].
| Land | Primær resistens (%) | Ervervet resistens (%) | ||||
| _ 1 | _ 2 | Multi | _ 1 | _ 2 | Multi | |
| Botswana | 3,7 | 0,2 | 0,2 | 14,9 | 7,9 | 6,1 |
| Brasil | 8,6 | 2,1 | 0,9 | 14,4 | 7,1 | 5,4 |
| Cuba | 8,3 | 1,0 | 0,7 | 91,3 | 26,1 | 13,0 |
| Dominikanske rep. | 40,6 | 14,9 | 6,6 | 52,1 | 29,9 | 19,7 |
| Estland | 28,2 | 16,9 | 10,2 | 46,2 | 38,5 | 19,2 |
| Frankrike | 8,2 | 2,6 | 0,5 | 21,5 | 9,2 | 4,1 |
| Latvia | 34,0 | 26,5 | 14,4 | 73,7 | 68,9 | 54,4 |
| Romania | 9,8 | 4,3 | 2,8 | 36,3 | 19,6 | 14,4 |
| Russland (Ivanovo) | 28,2 | 12,9 | 4,0 | 100,0 | 54,5 | 27,3 |
| Russland (Arkhangelsk og Murmansk)* | - | 26,2 | 4,8 | - | 68,1 | 29,8 |
| Sør-Korea | 10,4 | 3,5 | 1,6 | 52,9 | 38,6 | 27,5 |
* Egen undersøkelse i samarbeid mellom Folkehelsa og helsemyndighetene i Murmansk og Arkhangelsk [32].
Lang behandling
Tuberkulosepasienter må behandles i flere måneder. Dersom behandlingen ikke gjennomføres riktig, f.eks. fordi det ikke fins nok medisiner, pasientene slurver eller helsetjenesten ikke følger pasientene nøye opp, er det altså stor fare for resistensutvikling. Dette er et stort problem i land der tilførselen av medikamenter ofte svikter. Hjørnesteinen i forebyggingen av resistens ved tuberkulose er et nasjonalt program som sikrer tidlig diagnose, effektiv behandling og overvåking av sykdommen og tuberkulosebakteriene.
Norge
I Norge har situasjonen vært stabil, men krever stadig påpasselighet. Tuberkulosesmittete innvandrere kommer regelmessig til landet, noen med resistente bakterier. På grunn av flytting rundt i landet og manglende koordinert oppfølging er det også sett tilfeller av rask utvikling til multiresistens her hjemme. I 1995, 1996 og 1997 var henholdsvis 0,7%, 2,8% og 0,7% av nyisolerte tuberkelbakteriestammer (ca. 150 per år) multiresistente [29,30]. Multiresistens defineres som resistens mot de to viktigste midlene isoniazid og rifampicin.
Internasjonalt
I verden for øvrig er situasjonen helt annerledes, selv om nøyaktig statistikk mange steder mangler. Verdens helseorganisasjon rapporterte nylig resultater fra en verdensomspennende kartlegging av resistens ved tuberkulose (tab 1). Her kom det fram at problemet fantes over heile verden, men at Estland og Latvia var blant de absolutt verst stilte. Norsk-russiske undersøkelser viser at det er høy grad av resistens hos tuberkelbakterier fra pasienter i Nordvest-Russland også (tab 1).
1.4.9 Sopp
Stammer fra alvorlige soppinfeksjoner har fra 1991 vært systematisk undersøkt i Norge, noe som er uten sidestykke internasjonalt. Vi kan derfor si at vesentlig resistens foreløpig ikke foreligger [33]. Innføring av nye midler og behandling av stadig flere pasienter med sterkt nedsatt immunforsvar vil sannsynligvis kunne føre til endringer.
1.4.10 Virus
Det er nå kjent at bruk av en rekke antivirale midler kan føre til utvikling av resistens [34]. Resistens er påvist hos herpes simplex virus (HSV) mot acyklovir, hos cytomegalovirus (CMV) mot ganciklovir og foscavir og hos humant immunsviktvirus (HIV) mot alle de antivirale midlene som i dag anvendes i behandlingen.
Resistensproblemene ved HIV-infeksjon øker relativt raskt. Det har allerede ført til behandlingssvikt hos enkeltpasienter. I framtiden kan det også bli et problem for dem som smittes ved at viruset er resistent allerede ved smittetidspunktet.
1.4.11 Resistens hos bakterier fra dyr i Norge
Bakterier som gir jurbetennelser
Hvert år resistensbestemmes over 15 000 isolater fra melkeprøver hos storfe [35]. I 1996 utgjorde gule stafylokokker 52%, koagulasenegative (hvite) stafylokokker 27% og streptokokker 18%. 5,6% av de gule stafylokokkene var resistente mot penicillin, 6,5% mot streptomycin og 1,6% mot tetracyklin. Blant de koagulasenegative (hvite) stafylokokkene var 29,2% resistente mot penicillin, 15,9% mot streptomycin og 6,0% mot tetracyklin. Blant Streptococccus dysgalactiae var 0,3% resistente mot penicillin, 1,1% mot streptomycin og 1,8% mot tetracyklin. Det var ingen store forskjeller mellom data fra 1992 og 1996.
Bakterier fra hudbetennelser hos hund
Blant stafylokokker isolert fra hudbetennelser hos hund i 1986-87 og 1993-94 har det vært en økning i resistens mot de fleste antibiotika [36]. I 1993-94 var 58% av stafylokokkene penicillinresistente, 25% erytromycinresistente, 20% klindamycinresistente og 28% tetracyklinresistente. Det var en økning i andel multiresistente stammer. Økning i makrolid- og linkosamidresistens skyldes trolig økt bruk av disse midlene i behandlingen av hunder.
E coli fra gris
E coli fra gris er undersøkt ved Veterinærinstituttet i perioden 1992-96 [37]. Det har ikke vært noen økning i resistens overfor de vanligste antibiotika i perioden. I 1996 var andelen resistente isolater 40% mot sulfa, 18% mot trim-sulfa, 47% mot tetracykliner, 15% mot enrofloxacin, 33% mot ampicillin og 55% mot neomycin.
1.4.12 Resistens hos bakterier fra næringsmidler
Statens næringsmiddeltilsyn kartlegger forekomsten av resistens hos indikatorbakterier i norsk og utenlandsk slakt. I en undersøkelse ved Veterinærinstituttet vinteren 1997-98 ble blant annet 100 E coli- og 100 enterokokkisolater fra norsk fjørfekjøtt undersøkt [38].
Trettifire av de 100 E coli-isolatene var resistente mot ett eller flere av de undersøkte antibiotika; to var multiresistente. Man fant følgende antall resistente isolater: sulfa 24, tetracyklin 13, streptomycin 4, trimetoprim 3, kanamycin 1 og nalidiksinsyre 1.
Femtito av de 100 enterokokkisolatene var resistente mot ett eller flere av de undersøkte antibiotika; fem var multiresistente. Man fant følgende antall resistente isolater: tetracyklin 17, erytromycin 11, pristinamycin 18, virginiamycin 40, streptomycin 2 og penicillin 2.
En liknende undersøkelse av importerte animalske næringsmidler høsten 1997 viste også at det var mye resistens i indikatorbakterier fra fjørfekjøtt [39]. I bakterier fra skalldyr, storfekjøtt, antilopekjøtt og ost var forekomsten av resistens ubetydelig.
1.5 Bruk av antibiotika til mennesker i Norge
1.5.1 Innledning
For å kunne sammenlikne legemiddelforbruket fra land til land og fra år til år benyttes en teknisk måleenhet som kalles definerte døgndoser, og disse angis gjerne per 1000 innbyggere per døgn (DDD/1000 innbyggere/døgn). DDD er den antatt gjennomsnittlige døgndosen hos voksne for et legemiddel brukt på dets hovedindikasjonen. Følgelig betyr for eksempel 50 DDD per 1000 innbyggere per døgn et forbruk som tilsvarer at 5% av innbyggerne til enhver tid bruker legemidlet i den vanligste doseringen.
1.5.2 Totalforbruket
Forskjeller i Norden
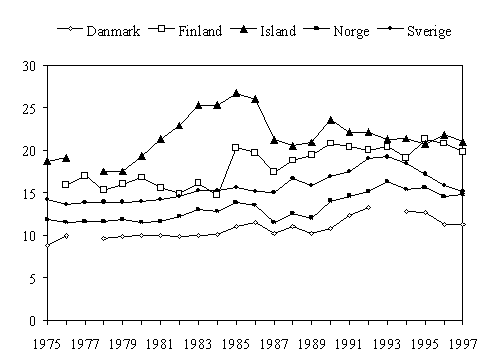
Forbruk av antibiotika i Norden, basert på salg fra grossist til apotek, har vært tilgjengelig i mer enn 20 år. Forbruket i de nordiske land viser store forskjeller gjennom hele denne perioden med Danmark og Norge med lavest forbruk, Finland og Island med høyest (fig 1). Det er grunn til å undersøke om Danmarks forbruk er adekvat, og om det finnes årsaker til at resten av Norden skal ha et annet forbruk. Det er mulig at det i alle andre land enn Danmark er et overforbruk. Den store forskjellen kan jevnes ut litt fordi sykehusforbruket ikke er inkludert i statistikken fra Danmark, men den utgjør trolig ikke mer enn 15%. Det er verdt å merke seg at man også i Danmark arbeider med å få ned antibiotikaforbruket ytterligere, og at de seinere årenes innsats i Sverige har gitt store resultater.
Figur 1. Forbruket av antibiotika (J01) til systemisk bruk i Norden 1975-1997, angitt i DDD/1000 innb/døgn. (For Danmark er bruk i sykehus ikke med.)
Forbruket i Norge
I Norsk Medisinaldepots grossiststatistikk over legemiddelforbruket i Norge kan vi lese at totalforbruket (antibiotika, midler mot sopp og virus, urinveisantiseptika) økte fra 12,8 DDD/1000 innb/døgn i 1973 til topp på 18,3 i 1993 [40,41]. Deretter har det vært en svak nedgang til 17,2 i 1997 (tab 2). Dette svarer til om lag fire millioner ukeskurer med antibiotika per år eller til at hele befolkningen har fått én kur à 5-7 dagers varighet i året.
Sykehusenes forbruk er lavere enn 15% av totalen, men fordi sykehusene bruker mer spesialiserte antibiotika som er dyre, representerer antibiotika en stor kostnad for sykehusene, ca. 25-40% av deres totale legemiddelkostnader.
De totale kostnadene til antibiotika har økt forholdsvis mer enn den rekvirerte mengden. Omsetningen i kroner til forbruker var i 1980 129 millioner kroner og i 1997 524 millioner kroner. Det er særlig utgiftene til cefalosporiner, makrolider, kinoloner og antivirale midler som har økt. I 1997 utgjorde de typiske sykehusmidlene cefalosporinene (inkludert karbapenemer og monobaktam) 2% av de gitt dosene, men 21% av kostnadene (109 millioner kroner). Til sammenlikning utgjorde vanlige penicilliner 33% av dosene, men bare 15% av kostnadene.
Tabell 2. Forbruket av antibiotika til systemisk bruk i Norge 1980-1997, angitt i DDD/1000 innb/døgn.
| Gruppe | 1980 | 1985 | 1990 | 1995 | 1997 | |
| J01A | Tetracykliner | 2,9 | 4,0 | 4,0 | 4,1 | 3,6 |
| J01B | Amfenikoler | 0,01 | 0,01 | 0,01 | 0,005 | 0,005 |
| J01C A | Penicilliner, utvidet sp, | 0,9 | 1,0 | 1,4 | 1,7 | 1,9 |
| J01C EFR | Penicilliner, smalsp, | 3,5 | 4,0 | 4,7 | 5,6 | 5,6 |
| J01D A | Cefalosporiner | 0,05 | 0,2 | 0,3 | 0,4 | 0,4 |
| J01E A | Trimetoprim | 0,003 | 0,5 | 0,9 | 1,0 | 0,9 |
| J01E B C | Sulfonamider | 1,3 | 0,4 | 0,06 | 0,006 | 0,003 |
| J01E E | Trimetoprim-sulfa | 2,0 | 2,0 | 1,2 | 0,8 | 0,55 |
| J01F A | Makrolider | 0,5 | 1,2 | 1,3 | 1,5 | 1,5 |
| J01M | Kinoloner | - | - | 0,01 | 0,25 | 0,27 |
| J01X D | Imidazoler | 0,01 | 0,05 | 0,04 | 0,05 | 0,05 |
| Øvrige antibiotika | 0,07 | 0,08 | 0,09 | 0,1 | 0,2 | |
| Sum J01 | Antibiotika | 11,2 | 13,3 | 14,0 | 15,6 | 14,8 |
| J02 | Antimykotika | 0,01 | 0,02 | 0,07 | 0,09 | 0,08 |
| J05 | Antivirale midler | - | - | 0,04 | 0,06 | 0,26 |
| G04A | Urinveisantiseptika | 2,3 | 2,0 | 1,7 | 1,7 | 2,0 |
| Sum totalt | 13,5 | 15,3 | 15,8 | 17,4 | 17,2 |
1.5.3 Bruk av de enkelte antibiotikagruppene
Det er forskjeller mellom de nordiske landene i hvilke antibiotika som er de mest brukte. I Danmark brukes mer smalspektrete midler enn i Norge, noe som må anses å være gunstig. For eksempel bruker vi i Norge mer enn dobbelt så mye tetracykliner i andel av totalforbruket som det Danmark gjør (i 1995 25% mot 12%). Vi bruker også mer makrolider og trimetoprim-sulfa.
Tallene nedenfor er hentet fra grossist- og reseptstatistikken slik de er presentert i boken Legemiddelforbruket i Norge [41], i publikasjoner fra Møre- og Romsdalsstudien [42] og fra Norge for øvrig [43] og i publikasjoner fra Nordisk legemiddelnemnd.
Betalaktamantibiotika
Det er ønskelig med et høyere forbruk av smalspektrete penicilliner (vanlig penicillin og betalaktamasestabile penicilliner) enn av bredspektrete penicilliner ved moderate infeksjoner. Cefalosporiner bør reserveres for alvorlige infeksjoner. Norge har et gledelig lavt forbruk av cefalosporiner (tab 2). Dette kan nok delvis tilskrives at vi hittil ikke har tatt i bruk tredjegenerasjons perorale midler.
Siste tilgjengelige data fra diagnose-reseptstatistikk, dvs. fra 1995 [40], samt fra Møre og Romsdalsstudien [42], viser at det benyttes mye bredspektrete midler hos eldre pasienter. Videre brukes det for mye antibiotika ved luftveisinfeksjoner som akutt bronkitt der antibiotika ikke er indisert.
Karbapenemer og monobaktamer er typiske sykehuspreparater og brukes lite; under 0,01 DDD/1000 innb/døgn.
Makrolider
Luftveisinfeksjoner er den vanligste grunnen til at det benyttes makrolider. Makrolider anvendes ofte som alternativ til penicilliner ved mistanke om penicillinallergi, noe det sjelden er grunnlag for. Preparatene brukes også som førstehåndsmiddel til små barn, trolig fordi smaken på miksturer er bedre enn på penicillinmikstur. At makrolider foretrekkes fremfor penicilliner, har flere ulemper. Bivirkningene for makrolider er større, de har mindre god effekt mot Haemophilus influenzae, og det er stor risiko for resistensutvikling hos nettopp de bakterier der vi trenger et oralt alternativ ved penicillinallergi.
Figur 2. Forbruket av makrolider (J01F) til systemisk bruk i Norden 1984-1997, angitt i DDD/1000 innb/døgn. (For Danmark er bruk i sykehus ikke med.)
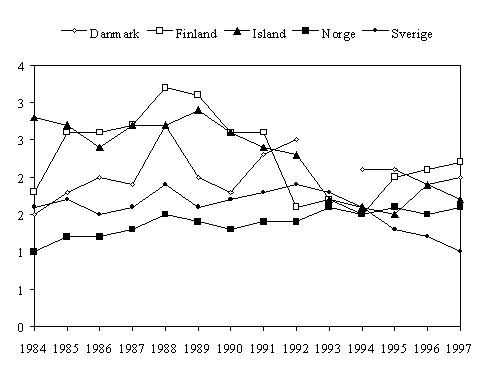
Resistensutvikling er veldokumentert både for gruppe A-streptokokker og for stafylokokker. I Finland steg forbruket av makrolider kraftig og lå i 1990 langt over de øvrige nordiske land. Samtidig økte resistensen hos gruppe A-streptokokker til foruroligende 13%. Med hjelp av nasjonale retningslinjer for bruk av makrolider, og publisitet omkring problemet har det lykkes å redusere forbruket kraftig [50]. Man fikk da en reduksjon i resistensnivået fra toppen i 1993 med 19% til 8,6% i 1996 (fig 2). Også i Sverige har man sett problemet med erytromycinresistens hos streptokokker, og man har også der lykkes i å få ned forbruket.
Norge har inntil 1994 hatt det laveste forbruket av makrolider i Norden, og resistensnivået har også vært lavt. Flere nye makrolider er introdusert. Markedsføringen er aktiv og nye indikasjonsområder er tilført slik at man kan risikere at makrolidforbruket øker ytterligere (tab 1). Det er viktig å slå vakt om dagens antibiotikapolitikk, og redusere bruken av makrolider ved luftveisinfeksjoner.
Tetracykliner
Tetracykliner er bredspektrete antibiotika, men deres indikasjonsområde er meget smalt. De er førstehåndsmedikamenter ved infeksjoner forårsaket av Mycoplasma og Chlamydia, men ved andre infeksjoner skal andre antibiotika velges, særlig penicilliner. Til tross for dette brukes tetracykliner ved alle former for luftveisinfeksjoner.
Figur 3. Forbruket av tetracykliner (J01A) til systemisk bruk i Norden 1984-1997, angitt i DDD/1000 innb/døgn. (For Danmark er bruk i sykehus ikke med.)
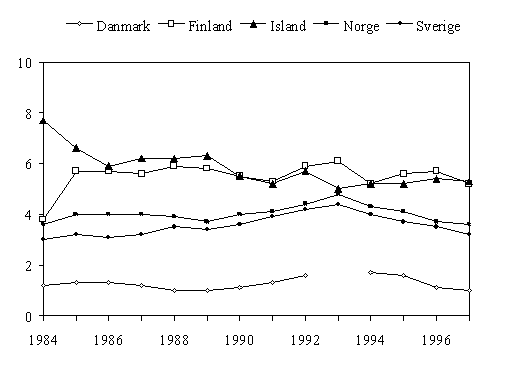
Den hyppigste indikasjonen for tetracyklin var i 1993 bronkitt, og et slikt stort forbruk er ikke medisinsk motivert. En viss reduksjon har skjedd de siste årene, trolig på grunn av opplysningsvirksomhet, men forbruket bør reduseres ytterligere (fig 3, tab 2).
Trimetoprim og sulfa
Disse midlene brukes vesentlig ved urinveisinfeksjoner. Trimetoprim-sulfa brukes i stor utstrekning i utviklingsland istedenfor penicillin pga. sin lave pris.
Forbruket av trimetoprim har vært temmelig stabilt fra 1990 til 1997, mens de tidligere så livsviktige sulfonamidene nærmest er forsvunnet fra markedet (tab 2). De viktigste årsakene til nedgangen er økt resistensutvikling og overgang til midler med færre alvorlige bivirkninger.
Forbruket av trimetoprim-sulfa er også betydelig redusert. Dette skyldes nok delvis hyppige bivirkninger (til dels alvorlige og dødelige), delvis resistensutvikling og informasjon om riktig bruk. For bare 12 år siden var hver femte antibiotikaresept til barn på et trimetoprim-sulfapreparat. Bruken til barn synes å ha avtatt de siste årene.
Kinoloner
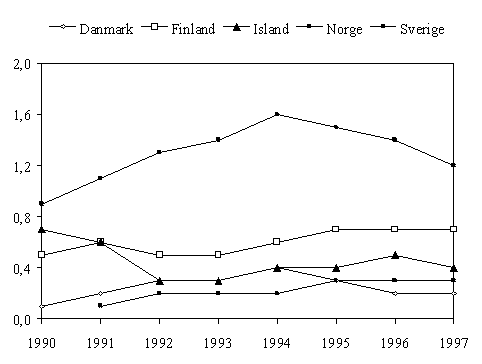
Kinoloner kom i bruk i Norge først fra 1991 (fig 4, tab 2). De brukes ved kompliserte urinveisinfeksjoner, alvorlige tarminfeksjoner og enkelte mer spesielle infeksjoner. Forbruket har økt langsomt. I land med høyt forbruk har resistensutvikling blitt et betydelig problem innenfor mange grupper av bakterier. I Norden har Sverige det høyeste forbruket, og der skjer det en resistensutvikling hos Pseudomonas og urinveispatogener. Innsatsen for å minske bruken har i Sverige gitt 25% reduksjon i forbruket. Det er meget viktig at vi fortsatt bruker kinoloner bare ved få og klare indikasjoner.
Figur 4. Forbruket av kinoloner (J01M) til systemisk bruk i Norden 1990-1997, angitt i DDD/1000 innb/døgn. (For Danmark er bruk i sykehus ikke med.)
Aminoglykosider
Aminoglykosidene brukes vesentlig i kombinasjon med et annet antibiotikum ved alvorlige og livstruende infeksjoner, ofte før man vet hvilken bakterie som har forårsaket infeksjonen, eller ved infeksjoner der bakteriene er resistente mot de fleste antibiotika. Vi har et lavt forbruk som har holdt seg stabilt gjennom mange år (tab 2). I land hvor disse midlene brukes mer ukritisk og også utenfor sykehus, er resistensutvikling et stort problem.
Midler mot soppinfeksjoner
Forbruket av soppmidler har økt fra 0,01 DDD/1000 innb/døgn i 1982 til 0,082 i dag (tab 2). Alvorlige soppinfeksjoner opptrer hyppig hos pasienter som har svekket immunforsvar. Forbruksøkningen skyldes i stor grad det stadig økende antall pasienter med nedsatt immunforsvar, f.eks. kreftpasienter, pasienter som har fått transplantert et organ og HIV-positive. Forbruket er foreløpig moderat, men det bør følges nøye da resistensutvikling kan bli et problem.
Midler mot virusinfeksjoner
I de senere år er det kommet en rekke lovende midler mot virusinfeksjoner, ikke minst for behandling av HIV-infiserte pasienter. Resistens har vist seg å kunne utvikles raskt hos den enkelte pasient. Det eneste som i noen grad har vist seg å kunne forhindre dette, er samtidig bruk av minst tre effektive medikamenter.
1.6 Bruk av antibiotika til dyr i Norge
1.6.1 Innledning
Det finnes ingen nøyaktig oversikt over antibiotikaforbruket i tradisjonelt norsk husdyrhold. De beste oversiktene er basert på legemiddelgrossistenes statistikk over salg til apotek. Antibiotikabruk til oppdrettsfisk og som fôrtilsetning er bedre overvåket.
En arbeidsgruppe oppnevnt av Landbruksdepartementet leverte i oktober 1997 innstillingen Vurdering av antibiotikabruk til dyr. Innstillingen gir en omfattende beskrivelse av antibiotikabruken til dyr. Nedenfor refereres noen hovedpunkter fra innstillingen og noen oppdateringer med data fra 1997. Det er anslått at samlet bruk av antibiotika til dyr utgjør 20% av totalforbruket i Norge.
1.6.2 Husdyr
Her omtales antibiotika som benyttes til behandling av syke dyr og til forebygging av infeksjonssykdommer hos dyr.
De største mengdene antibiotika til husdyr benyttes til å behandle jurbetennelse (mastitt), børbetennelse og forskjellige diarésykdommer [35,44]. Storfe står for noe over halvparten av antibiotikaforbruket, og i halvparten av tilfellene er det jurbetennelser som behandles. I gjennomsnitt behandles om lag hver fjerde ku for jurbetennelse minst ei gang i året. Om lag 10% av forbruket går til griser. Her er det særlig diarésykdommer som fører til antibiotikabehandling, men også jur- og børbetennelser er viktige indikasjoner. Om lag 10% av forbruket går til sauer, og her er jurbetennelse den vanligste indikasjonen. Fjørfe står for bare 1% av forbruket. Forbruket av koksidiostatika har imidlertid økt de siste årene. Dette skyldes økt forekomst av en viss type alvorlig tarminfeksjon (nekrotiserende enteritt) etter at avoparcin ble forbudt som fôrtilsetning i 1995.
Til familiedyr og hest blir det til en viss grad også benyttet antibiotika som er beregnet for mennesker. Det er derfor vanskelig å anslå totalforbruket til disse dyregruppene. Til familiedyr blir det iblant valgt antibiotika som det fra et humanmedisinsk synspunkt er betenkelig å benytte som førstevalg. Det blir sjelden utført resistensbestemmelse ved start av behandling.
I 1991 ble det solgt 10 860 kg antibiotika målt som aktiv substans til husdyr i Norge. I 1995 var tallet bare redusert til 10 156 kg, men så begynte en betydelig nedgang: I 1996 var tallet 8 720 kg og i 1997 7 250 kg. Dette er en reduksjon på 29% fra 1995 til 1997.
I hovedsak er de antibiotika som benyttes i veterinærmedisinen, de samme eller kjemisk like dem som benyttes i humanmedisinen. I 1996 fordelte bruken (målt som kg aktiv substans) seg omtrent slik på de ulike gruppene: Smalspektrete penicilliner 40%, aminoglykosider 24%, sulfapreparater 13%, trimetoprim-sulfa 12%, tetracykliner 4% og bredspektrete penicilliner 2%. Det var svært lavt forbruk av kinoloner og makrolider. Utviklingen går i retning av mer smalspektrete preparater.
1.6.3 Fisk
Tabell 3. Forbruket av antibiotika til behandling av oppdrettsfisk i Norge 1987-97, angitt i kg aktiv substans. Data fra Norsk Medisinaldepot og Norges veterinærhøgskole.
| År | Forbruk (kg) | Mest brukte legemidler |
| 1987 | 48 570 | Oksytetracyklinklorid (56%), nifurazolidin (33%) |
| 1988 | 32 470 | Oksytetracyklinklorid (56%), oksolinsyre (29%) |
| 1989 | 19 350 | Oksolinsyre (65%), oksytetracyklinklorid (26%) |
| 1990 | 37 432 | Oksolinsyre (74%), oksytetracyklinklorid (17%) |
| 1991 | 26 798 | Oksolinsyre (43%), oksytetracyklinklorid (21%) |
| 1992 | 27 485 | Flumekin (36%), oksolinsyre (28%), trim-sulfa (21%) |
| 1993 | 6 144 | Oksolinsyre (42%), flumekin (35%) |
| 1994 | 1 396 | Oksolinsyre (58%), oksytracyklinklorid (24%), flumekin (16%) |
| 1995 | 3 116 | Oksolinsyre (90%), flumekin (6%) |
| 1996 | 1 037 | Oksolinsyre (81%), flumekin (10%) |
| 1997 | 746 | Oksolinsyre (68%), florfenikol (16%) |
Antibiotika i fiskeoppdrett er de siste ti årene hovedsaklig blitt brukt til å behandle laks med sykdommene kaldtvannsvibriose ( Vibrio salmonicida) og furunkulose ( Aeromonas salmonicida). Forbruket er blitt sterkt redusert (tab 3) etter at man tidlig på nittitallet begynte å vaksinere mot disse sykdommene [45] samtidig som andre smitteforebyggende tiltak ble satt i verk. Det høyeste forbruket var i 1987.
1.6.4 Fôrantibiotika (vekstfremmere)
Fôrantibiotika er antibiotika som blir tilsatt fôret og gitt husdyr i doser som er for små til å behandle sykdom, men som likevel fremmer veksten av dyra (tab 4). Mekanismen for vekstfremmingen er ikke avklart. I Norge er det et generelt forbud mot å tilsette antibiotika i dyrefôr. Statens landbrukstilsyn har imidlertid gitt enkelte tillatelser etter søknad. (Se også 2.9.2)
Etter at svineprodusentene i 1995 påla seg selv forbud mot bruk av fôrantibiotika, var det bare fjørfenæringen som benyttet fôrantibiotika. Etter at avoparcin i 1995 ble forbudt som fôrantibiotikum, vedtok også fjørfenæringen generelt å avstå fra bruk av fôrantibiotika. Virginiamycin ble forbudt i 1998. I dag er det således bare sinkbacitracin som er tillatt brukt i enkelte blandinger. Det er imidlertid ikke registrert forbruk av dette stoffet de tre første kvartalene i 1998.
Tabell 4. Forbruket av fôrantibiotika til gris og fjørfe i Norge 1991-97, angitt i kg aktiv substans. Data fra Statens landbrukstilsyn.
| Legemiddel | 1991 | 1992 | 1993 | 1994 | 1995 | 1996 | 1997 |
| Avoparcin | 754 | 779 | 865 | 982 | 419 | - | - |
| Virginiamycin | 3 | - | - | - | - | - | - |
| Sinkbacitracin | 667 | 408 | 292 | 234 | 129 | 64 | 27 |
For å forebygge parasittsykdommen koksidiose tilsettes kraftfôrblandinger midler som hemmer veksten av disse, såkalte koksidiostatika. Flere av disse virker imidlertid også mot bakterier. Det viktigste middelet er narasin, som det i 1996 ble brukt 3 500 kg av.
1.6.5 Konklusjon
Forbruket av antibiotika til dyr er betydelig redusert siden 1991 (tab 5). Dette er et resultat av felles innsats fra myndigheter, forskningsinstitusjoner, næringen og veterinærene. Tiltakene har vært vaksinasjon og andre smitteverntiltak og nye behandlingsstrategier. I Norge brukes det lite antibiotika i forhold til dyretallet sammenliknet med de andre nordiske landene.
Tabell 5. Forbruket av antibiotika og koksidiostatika i norsk husdyrhold 1991-96, angitt i kg aktiv substans [35].
| År | Til behandling av dyr (utenom fisk) | Til behandling av fisk | Fôr-antibiotika | Koksidio-statika | Totalt |
| 1991 | 10 860 | 26 798 | 1 424 | 4 903 | 43 985 |
| 1996 | 8 720 | 1 037 | 64 | 5 022 | 14 843 |
| Endring | - 20% | - 96% | - 95% | 2% | - 66% |
1.7 Er antibiotikabruk årsak til resistens, og kan utviklingen snus?
1.7.1 Antibiotikabruk fører til resistens
Det er sterke holdepunkter for at antibiotikabruk virkelig er en årsak til resistenstutvikling blant bakterier. Dette gjelder uansett om bruken skjer til mennesker, dyr eller planter og uansett om bruken er riktig eller ikke. Holdepunktene er blant annet [46]:
- I bakterier fra før antibiotikaæraen finner man ikke ervervet resistens [8].
- Gang på gang har man observert resistensutvikling mot nye antibiotika kort tid etter at de er tatt i bruk.
- Personer som under antibiotikabehandling får en tilleggsinfeksjon med en bakterie fra deres egen normalflora (f.eks. en nyoperert pasient som behandles for lungebetennelse og deretter får en urinveisinfeksjon), er oftere enn andre pasienter infisert med resistente bakterier [47,48].
- Resistens er vanligst der hvor antibiotika brukes mest [47-49]. Dette gjelder både ved sammenlikning mellom land og ved sammenlikning mellom sykehusavdelinger. Resistensproblemene er som regel mye mer alvorlige i intensivavdelinger enn for eksempel i øyeavdelinger.
1.7.2 Kan resistens motvirkes?
De siste 50 år har menneskene tilført vårt økosystem store mengder antibiotika. Dette har ført til et seleksjonspress på mange viktige mikrober. Resistente mikrober er dermed naturlig blitt valgt ut til å overleve.
De mikrober som har eller kan bli tilført gener som koder for resistens for det aktuelle antibiotikum, får en fordel og overlever. Hvordan vil det så gå når antibiotikapresset opphører?
Det koster ekstra energi for bakterier å være resistente. Man kan derfor tenke seg at de resistente bakteriene har liten sjanse i kampen mot sine ikke-resistente artsfrender. De resistente bakteriene risikerer derfor å dø ut. Imidlertid kan de klare å overleve dersom det skjer ytterligere endringer i arvestoffet som kompenserer for den økte energibruken.
Det er sett i enkelte studier [46,50,51], hovedsakelig fra sykehus, at resistensproblemet er blitt mindre etter at antibiotikabruken ble redusert. Slike vitenskapelige studier er vanskelig å utføre fordi man ikke kan ha kontroll over alle de faktorer som kan påvirke resistensproblemet. For eksempel vil en intervensjon som tar sikte på å endre antibiotikabruken i en sykehusavdeling, ofte ledsages av forbedrete hygienerutiner. Det er da vanskelig å avgjøre hva som forårsaket en eventuell nedgang i resistens.
1.7.3 Hva betyr resistente bakterier i dyr og næringsmidler for folkehelsa?
Zoonoser er sykdommer og infeksjoner som kan overføres mellom menneske og andre virveldyr [52]. I Norge er de viktigste zoonosene de som spres med næringsmidler, og som skyldes bakteriene Salmonella, Campylobacter, Yersinia og EHEC [53]. Det viktigste reservoaret for disse bakteriene er mage-tarmkanalen hos friske dyr. Under slakting kan avføring fra dyra forurense kjøttet og dermed smitte menneskene som spiser kjøttet. Andre muligheter for smitte til menneske er at avføring fra dyra forurenser drikkevann eller frukt og grønnsaker, for eksempel ved gjødsling eller vanning.
Det er vanligvis ikke nødvendig med antibiotikabehandling for de nevnte sykdommene hos mennesker. Resistens kan imidlertid være et problem i den andelen av tilfeller der behandling er nødvendig.
På liknende måte kan det overføres fra dyr til menneskers tarm resistente bakterier som vanligvis ikke gir sykdom hos mennesker. Et mye fokusert eksempel er vankomycinresistente enterokokker (VRE) [21,22]. Enterokokker hos dyr kan bli resistente når dyra får fôrantibiotikumet avoparcin. Avoparcin benyttes ikke til mennesker, men likner så mye på det viktige antibiotikumet vankomycin at avoparcinresistente bakterier er resistente mot begge. Så lenge enterokokkene befinner seg i tarmen, gir de ikke sykdom hos mennesker. Enterokokkene er imidlertid en vanlig årsak til urinveisinfeksjon og til sårinfeksjoner, ofte etter operasjoner. Personer som steller dyr som får antibiotika, har oftere enn andre personer resistente bakterier i tarmen.
Moderne husdyrproduksjon innebærer at husdyra i flere land ofte får antibiotika oralt for å forebygge eller behandle sykdom. Dessuten får dyr i mange land antibiotika som vekstfremmende middel. I Danmark ble det i 1994 benyttet 44 tonn antibiotika til behandling av mennesker, 90 tonn til forebygging og behandling av sykdom hos dyr og 120 tonn som vekstfremmende middel [35]. Tilsvarende tall for Nederland var henholdsvis 80, 300 og 300 tonn i 1990. I Norge ble det i 1997 benyttet bare 10 tonn til behandling av sykdom hos dyr og praktisk talt ingenting til vekstfremming (tab 5).
Det er grunn til å anta at en vesentlig del av resistensutviklingen hos zoonosebakterier skyldes antibiotikabruk hos dyr og i mindre grad bruk av antibiotika ved behandling av mennesker. Dette gjelder bl.a. for den multiresistente varianten av Salmonella Typhimurium (DT104).
1.7.4 Konklusjon
Det foregår en kontinuerlig utveksling mellom dyr og mennesker av bakterier og deres arvestoff, dels direkte og dels indirekte. Sammenhengen mellom antibiotikabruk til dyr og mennesker og økt resistens er sikker. Følgende faktorer antas å ha stor betydning for økning i forekomst av resistente bakterier hos mennesker:
- Antibiotikabruk til mennesker i Norge.
- Antibiotikabruk til dyr i Norge.
- Import av resistente bakterier med mennesker.
- Import av resistente bakterier med dyr.
- Import av resistente bakterier med matvarer.
- Manglende smitteverntiltak, inkludert sviktende sykehushygiene.
De fleste forskere antar at den første faktoren er klart viktigst selv om den forholdsmessige betydningen av faktorene varierer fra mikrobe til mikrobe. En faktor som er viktig for forekomsten av resistens hos en bakterie, kan være mindre viktig hos en annen. Redusert forbruk vil likevel oppnå det viktigste, nemlig å bremse utviklingen av ny resistens og utvelging av den allerede foreliggende resistensen.
Muligheten for å redusere et allerede foreliggende resistensproblem gjennom å redusere antibiotikabruken varierer trolig også fra mikrobe til mikrobe. Det er nok godt mulig å oppnå reduksjon i forekomsten for noen former for resistens hos noen bakterier, men ikke for alle. Uansett er det viktig med forbedret smittevern for å bremse spredningen av bakterier som er blitt resistente.
1.8 Antibiotikaresistens som folkehelseproblem
Før antibiotika var til vår disposisjon var bakteriesykdommene under svært dårlig kontroll. De hadde høy forekomst, og dødeligheten var mye høyere enn i dag blant pasienter med infeksjoner. I tillegg er nye behandlingsformer kommet til som øker risikoen for å få infeksjoner. Effektiv behandling av infeksjoner er derfor også nødvendig for å kunne gjennomføre mange moderne medisinske former for behandling uten uakseptable komplikasjoner i form av infeksjoner. Betydelig økt antibiotikaresistens medfører at vi i mange situasjoner vil være uten effektive antimikrobielle midler. Dette vil kunne føre til vidtrekkende endringer for enkeltindividene og i større perspektiv for folkehelsa på mange ulike områder også i vårt land. Noen momenter skisseres:
1.8.1 Direkte konsekvenser av resistens
Antibiotikaresistente bakterier er som regel ikke mer smittsomme eller sykdomsframkallende enn andre bakterier. Infeksjoner med resistente bakterier er imidlertid vanskeligere å behandle og kan derfor få et lengre og alvorligere forløp. Vellykket antibiotikabehandling mot følsomme bakterier fører oftest til at smittebæring hos pasientene minsker relativt fort. Hvis behandlingseffekten blir dårlig , vil de syke kunne skille ut bakteriene i større mengder og over lengre tid. Dette øker risikoen for spredning av disse bakteriene.
Økt antibiotikaresistens vil med høy sannsynlighet ha konsekvenser for mange infeksjonssykdommer og deres følger for samfunnet. Dette vil ikke bare gjelde de spesielle sykdommene som vi ofte tenker på som infeksjonssykdommer, som pneumokokkmeningitt, streptokokksykdom ol, men også mange svært vanlige tilstander med mer blandet årsak der infeksjonskomponenten likevel er av svært stor betydning for om tilstanden kan behandles med vellykket resultat. Dette gjelder for eksempel infeksjoner etter kirurgi, som sårinfeksjoner og bukhinnebetennelser, lungebetennelser hos intensivpasienter og muligheten for å sette inn proteser i ortopedi og karkirurgi.
Mulige konsekvenser av økt antibiotikaresistens kan bli:
- Lengre sykdomsvarighet for både alvorlige og ikke-alvorlige infeksjoner vil føre til behov for lengre sykehusopphold.
- Flere komplikasjoner og dødsfall ved alvorlige infeksjoner, og infeksjoner vi i dag ikke regner som alvorlige vil oftere kunne utvikle seg i ugunstig retning.
- Flere komplikasjoner og dødsfall ved noen typer avansert medisinsk behandling for andre grunn-tilstander, f.eks. avansert kirurgi, immunsvekkende behandling, cytostatikabehandling og transplantasjoner.
- Nedsatt effektivitet av antibiotikaprofylakse ved kirurgi vil føre til flere komplikasjoner.
- Økt behov for å bruke nyere antibiotika, som kan være dyrere, mer giftige og ha dårligere økologisk profil.
- Større vansker med å velge antibiotikum for behandling av pasienter med akutte alvorlige infeksjoner før mikrobiologisk diagnose er kjent. Dette vil oftere kunne føre til ikke-optimalt førstevalg oftere enn før.
- Behov for hyppigere sykehusinnleggelser.
- Lengre smitteførende periode for noen infeksjoner.
- Økt behov for smitteisolering i sykehus, noe som stiller økte krav til bygningsmessige fasiliteter og krever mer personalinnsats enn standardregimer.
1.8.2 Indirekte konsekvenser av resistens
Blant noe mer indirekte konsekvenser må også nevnes:
- Økt behov for tilgang til spesialisttjenester i poliklinikker og utenfor sykehus for akutte infeksjoner, dvs. akutt-funksjon med kort ventetid.
- Økt behov for spesialisttjenester i medisinsk mikrobiologi, infeksjons-medisin, farmakologi, farmasi og sykehushygiene i sykehusene.
- Behov for bedret diagnostikk av infeksjoner både i allmennpraksis og i sykehus.
- Økt utdanningsbehov i infeksjonsmedisin, hygiene og mikrobiologi for primær-leger og alle kliniske spesialister som behandler infeksjoner, men også andre grupper helsepersonell.
- Skjerpede krav til hygienetiltak i samfunnet generelt.
- Behov for strenge restriksjoner for antibiotikabruk i husdyrhold, landbruk, matvareproduksjon o.l.
- Behov for økte restriksjoner på antibiotikarekvirering og bruk i klinisk praksis.
- Kartlegging av når og hvorfor antibiotika brukes og årsaker til valg av spesielle antibiotika - for å kunne påvirke rasjonelle valg.
- Økt satsing på terapi og forebygging uten bruk av antibiotika.
- Økt satsing på vaksiner (og evt. passiv immunisering) der slike kan minske sykdomsforekomst eller alvorlighet av infeksjoner. Selv om vaksiner er svært viktige midler med god økologisk profil, kan de imidlertid neppe løse problemet for annet enn utvalgte mikrober - fordi mange av mikro-bene som er vanlige sykdomsårsaker har så høy grad av antigen variasjon.
1.9 Litteratur
1. Diamond J. The third chimpanzee. The evolution and future of the human animal. New York: HarperCollins Publishers, 1992. 2. Greenwood D. Historical introduction. I: O'Grady F, Lambert HP, Finch RG, Greenwood D, red. Antibiotic and chemotherapy. Anti-infective agents and their use in therapy. 7. utgave. New York: Churchill Livingstone, 1997: 2-9. 3. Johannessen A. Die epidemische Verbreitung des Sharlachsfieber in Norwegen. Kristiania: Jacob Dybwads forlag, 1884. 4. Tschudi Madsen T. Scarlet fever and erysipelas in Norway during the last hundred years. Infection 1973; 1: 73-6. 5. Keefer CS, Ingelfinger FJ, Spink WW. Significance of hemolytic streptococcal bacteremia. A study of two hundred and forty-six patients. Arch Intern Med 1937; 60: 1084-97. 6. Gorbach SL. Intraabdominal infections. Clin Infect Dis 1993; 17: 961-5. 7. Fleming A, red. Penicillin. Its practical application. London: Butterworth & Co, 1946: 1-380. 8. Hughes VM, Datta N. Conjugative plasmids in bacteria in the "pre-antibiotic era". Nature 1983; 302: 725-6. 9. Datta N, Hughes VM. Plasmids of the same Inc groups before and after the medical use of antibiotics. Nature 1983; 306: 616-7. 10. Davies J. Inactivation of antibiotics and the dissemination of resistance genes. Science 1994; 264: 375-82. 11. Davies J, Webb V. Antibiotic resistance in bacteria. I: Krause RM, red. Emerging infections. Biomedical reports. San Diego, London: Academic Press 1998: 239-73. 12. Kapperud G, Rørvik LM, Hasseltvedt V, Høiby EA, Iversen BG, Staveland K, Johnsen G, Leitao J, Herikstad H, Andersson Y, Langeland G, Gondrosen B, Lassen J. Outbreak of Shigella sonnei infection traced to imported iceberg lettuce. J Clin Microbiol 1995; 33: 609-14. 13. Høiby EA, Kapperud G, Rørvik L. The tip of the iceberg. American Society for Microbiology News 1995. 14. Høiby EA, Jenum P, Sandven P. Antibiotikaresistens hos pneumokokker. MSIS-rapport -1985; 13: 19-20. 15. Hovig B, Lystad A, Opsjøn H. A prevalence survey of infections among hospitalized patients in Norway. Natl Inst Publ Health Annals 1981; 4: 49-60. 16. Lystad A, Stormark M. A national prevalence survey of hospital acquired infections in Norway. I: Acts from the International Symposium on the Control of Hospital Infections 1987 April 27-29; Rome. Florence: Edizione Riviste Scientifiche, 1987. 17. Aavitsland P, Stormark M, Lystad A. Hospital-acquired infections in Norway: A national prevalence survey in 1991. Scand J Infect Dis 1992; 24: 477-83. 18. Scheel O, Stormark M. National prevalence survey on hospital infections in Norway. J Hosp Infect 1999; i trykken. 19. Digranes A, Solberg CO, Sjursen H, Skovlund E, Sander J. Antibiotic susceptibility of blood culture isolates of Enterobacteriaceae from six Norwegian hospitals 1991-1992. APMIS 1997; 105: 854-60. 20. Høiby EA, Sandven P, Lassen J, Kvaløy S, Vorkinn E, Holte H, Aas N, Giercksky K-E, Danielsen S, Wæhre H, Rindal R, Aune H, Kongsgaard U, Kristensen G, Slørdal L, Vilberg A, Hov A, Nordal H. Antimikrobielle midler. Grunnlag for fornuftig bruk. Oslo: Det Norske Radiumhospital og Statens institutt for folkehelse, 1997: 1-224. 21. Haarr E, Simonsen G, Olsvik Ø, Sundsfjord A, Harbo K, Natås O. Første infeksjon med vankomycinresistente enterokokker type VanA i et norsk sykehus. Tidsskr Nor lægeforen 1998; 118: 1188-90. 22. Harthug S, Langeland N, Digranes A, Simonsen GS, Olsvik Ø, Sundsfjord A, Natås OB, Haarr E, Gaustad P, Høiby EA, Svarva PL. Infeksjoner forårsaket av multireistente enterokokker i Norge. Tidsskr Nor Lægeforen 1998; 118: 4070-3. 23. Kristinsson KG. Penicillinresistens hos pneumokokker. Nord Med 1996; 82: 837-42. 24. Høiby EA, Hasseltvedt V, Lystad A. Pneumokokksykdom og antibiotikafølsomhet. MSIS-rapport 1994; 22: 38. 25. Peltola H, Aavitsland P, Hansen KG, Jónsdóttir KE, Nøkleby H, Romanus V. Perspective: a five-contry analysis of the impact of four different Haemophilus influenzae type b conjugates and vaccination strategies in Scandinavia. J Infect Dis 1999; 179: 223-9. 26. Høiby EA, Lermark G. Betalaktamasedannende systemiske Haemophilus influenzae type b i Norge 1991-1992. MSIS-rapport 1992; 20: 49. 27. Aavitsland P, Høiby EA. Behandling av ukomplisert gonoré hos voksne. Nye anbefalingr fra arbeidsgruppen mot gonoré. Tidsskr Nor Lægeforen 1996; 116. 1577-80. 28. Aavitsland P, Lassen J. PPNG i Norge 1975-96. Resistens 1997; 1: 2. 29. Heldal E. Tuberkuløs sykdom i Norge 1995-96. MSIS-rapport 1997; 25: 44. 30. Det sentrale tuberkuloseregister, Statens helseundersøkelser. Tuberkuløs sykdom i Norge 1996-97. MSIS-rapport 1998; 26: 21. 31. WHO Global Tuberculosis Programme. Anti-tuberculosis drug resistance in the world. Geneve: World Health Organization, 1997. 32. Sandven P, Caugant DA. Tuberkulose i Arkhangelsk og Murmansk. Resistens 1997; 1: 3. 33. Sandven P, Bevanger L, Digranes A, Gaustad P, Haukland HH, Steibakk M, The Norwegian Yeast Study Group. Constant low rate of fungemia in Norway, 1991 to 1996. J Clin Microbiol 1998; 36: 3455-9. 34. Pillay D, Zambon M. Antiviral drug resistance. BMJ 1998; 317. 660-2. 35. Landbruksdepartementets arbeidsgruppe for vurdering av antibiotikabruk. Vurdering av antibiotikabruk til dyr. Innstilling. Oslo: 1997. 36. Kruse H, Hofshagen M, Thoresen SI, Bredal WP, Vollset I, Søli NE. The antimicrobial susceptibility of Staphylococcus species isolated from canine dermatitis. Vet Res Comm 1996; 20: 205-14. 37. Fossum K. Antibiotikaresistens hos Escherichia coli i feces fra slaktegris. Nor Vet Tidsskr 1995; 107: 837-44. 38. Kruse H. Kartlegging av forekomst av antibiotikaresistente bakterier i norsk kjøtt og kjøttprodukter. Oslo: Veterinærinstitutet, 1998. 39. Løvseth A, Kruse H. Kartleggingsprogram - importerte næringsmidler høsten 1997. Oslo. Veterinærinstituttet, 1997. 40. Norsk Medisinaldepot. Legemiddelforbruket i Norge 1989-1993. Oslo: Norsk Medisinaldepot, 1994. 41. Norsk Medisinaldepot. Legemiddelforbruket i Norge 1993-1997. Oslo: Norsk Medisinaldepot, 1998. 42. Straand J, Rokstad KS, Sandvik H. Prescribing systemic antibiotics in general practice. A report from the Møre og Romsdal prescription study. Scand J Prim Health Care 1998; 16: 121-7. 43. Andrew M, Solberg CO. Forbruk av antimikrobielle midler i Norge 1980-92. Tidsskr Nor Lægeforen 1994; 114: 169-73. 44. Grave K, Rønning M. Forskrivningen av antibakterielle midler til dyr redusert med 23% fra 1995 til 1997. Nor Vet Tidsskr 1998; 110: 52-53. 45. Markestad A, Grave K. Reduction of antibacterial drug use in Norwegian fish farming due to vaccination. Develop Biol Stand 1997; 90: 365-9. 46. Standing Medical Advisory Committee, Sub-Group on Antimicrobial Resistance. The path of least resistance. London: Department of Health, 1998. 47. Chow JW, Fine MJ, Shlaes DM, Quinn JP, Hooper DC, Johnson MP, Ramphal R, Wagener MM, Miyashiro DK, Yu VL. Enterobacter bacteremia: clinical features and mergence of antibiotic resistance during therapy. Ann Intern Med 1991; 115: 585-90. 48. Muder RR, Brennen C, Drenning SD, Stout JE, Wagener MM. Multiple antibiotic resisant gram-negative bacilli in a long-term care facility: a case-control study of patient risk factors and prior antibiotic use. Infect Control Hosp Epidemiol 1997, 18: 809-13. 49. Huovinen P, Seppälä H, Kataja J, Klaukka T. The relationship between erythromycin consumption and antibiotic resistance in Finland. Finnish Study Group for Antimicrobial Resistance. Ciba Found Symp 1997; 207: 36-41. 50. Seppälä H, Klaukka T, Vuopio-Varkila J, Muotiala A, Helenius H, Lager K, Huovinen P and the Finnish Study Group for Antimicrobial Resistance. The effects of changes in the consumption of macrolide antibiotics on erythromycin resistance in group A streptococci in Finland. N Engl J Med 1997; 337: 441-6. 51. Betts RF, Valenti WM, Chapman SW, Chonmaitree T, Mowrer G, Pincus P, messner M, Robertson R. Five-year surveillance of aminoglycoside usage in a university hospital. Ann Intern Med 1984; 100: 219-22. 52. Palmer SR, Soulsby EJL, Simpson DIH, red. Zoonoses. Oxford: Oxford University Press, 1998. 53. Hasseltvedt V. Zoonoserapporten 1997. MSIS-rapport 1997; 26: 44. Lagt inn 4. februar 1999 av Statens forvaltningstjeneste, ODIN-redaksjonenDel 2: Hva er gjort til nå i Norge?
2.1 Innledning
Her gis en oversikt over tiltak som ulike etater og sektorer allerede har satt i verk eller planlegger å sette i verk i den nærmeste framtid. Hvert tiltak eller hver aktivitet beskrives kort. Ytterligere opplysninger kan fås hos de ansvarlige for tiltakene. Oversikten er ikke uttømmende.
Resistensproblemet i Norge er mindre enn i de fleste andre land. Det betyr at vi antakelig gjør mange riktige ting. Det er behov for å dokumentere hva vi gjør, og finne ut hvilke av tiltakene som er særlig viktige. Det kan være av betydning for andre land som ser på Norge og de andre nordiske landene som modeller på dette området.
Ei rekke av tiltakene omtales igjen i del 4 der prosjektgruppa gir anbefalinger om hvilke tiltak som særlig bør fortsette.
2.2 Overvåking og kartlegging av resistens
2.2.1 Bakgrunn
Med overvåking av antibiotikaresistens menes vedvarende, systematisk innsamling, analyse og tolkning av data om mikrobers resistensforhold og deres betydning for folkehelsa til bruk i planlegging, implementering og evaluering av folkehelsetiltak. Overvåkingen kan bidra til å øke forståelsen av sammenhengen mellom antibiotikaforbruk og smitteverntiltak på den ene siden og utvikling av resistens på den andre. I tillegg kan overvåkingen veilede valget av legemiddel ved empirisk behandling (dvs. behandling før mikroben og dens resistensmønster er kjent).
Overvåking i denne betydningen må skilles fra enkeltstående, tidsbegren-sete kartleggingsprosjekter som også måler forekomsten av resistens. Disse kan noen ganger være del av et overvåkingssystem. Nedenfor nevnes også enkelte kartleggings-prosjekter.
2.2.2 Bakterier fra mennesker. Nasjonale overvåkingssystemer.
Meldingssystem for smittsomme sykdommer (MSIS)
Meldingssystem for smittsomme sykdommer (MSIS) mottar meldinger om tilfeller av sykdom forårsaket av følgende resistente mikrober: meticillinresistente gule stafylokokker (MRSA), vankomycinresistente enterokokker (VRE), betalaktamase-produserende gonokokker (PPNG) og pneumokokker med nedsatt følsomhet for penicillin. Resultatene blir jevnlig rapportert i MSIS-rapport, Resistens og SHE-nytt [1-3]. Folkehelsa planlegger å foreslå overfor Statens helsetilsyn å inkludere flere resistensforhold (særlig fluorokinolonresistens) ved melding til MSIS om gonoré.
Kontinuerlige innsamlinger av bakterieisolater
Tuberkulose er meldingspliktig i MSIS. Resistensforhold hos tuberkelbakteriene bestemmes i referanselaboratoriet ved Folkehelsa og resultater sendes til Det sentrale tuberkulose-registeret i Statens helseundersøkelser for innlemming i den offisielle tuberkulosestatistikken [4]. Resistensforhold kan sammenholdes med kliniske og epidemiologiske opplysnin-ger i registeret.
De fleste bakterieisolater identifiseres og resistensbestemmes ved de medisinsk mikrobiologiske avdelinger og laboratorier i fylkene. Noen isolater samles ved Folkehelsa for referanseundersøkelse. Så langt kapasiteten tillater det, gjentas da de viktigste resistensundersøkelsene, og bakteriene karakterieres videre (serotyping, genetiske undersøkelser mv.). Det gjelder enteropatogene mikrober, meningokokker, Haemophilus influenzae (systemiske), Legionella, Listeria, pneumo-kokker (systemiske), gruppe A streptokokker (systemiske og lokaliserte) og sopp. Det foregår stort sett ingen systematisk offentliggjøring av resultatene.
Episodiske innsamlinger av bakterieisolater
Regionsykehuset i Tromsø og Telelab samarbeider om episodisk kartlegging av resistens hos bakterier som er vanlige årsaker til øvre luftveisinfeksjoner ( Haemophilus influenzae, Streptococcus pneumoniae og Streptococcus pyogenes). Isolater samles fra fem mikrobiologiske avdelinger i to tidsperioder hvert tredje år og undersøkes ved Nordland sentralsykehus.
Isolater av gramnegative stavbakterier fra sykehusinnlagte pasienter blir hvert sjette år samlet inn ved Haukeland sykehus for felles resistensbestemmelse [5].
Norsk overvåkingssystem for resistens hos mikrober (NORM)
Planleggingen av et Norsk overvåkingssystem for resistens hos mikrober (NORM) startet i 1997 ved Folkehelsa og har i 1998 skjedd i samarbeid med fagmiljøene i medisinsk mikrobiologi og infeksjonsmedisin og med Statens helsetilsyn [6]. Flere statlige etater og fagmiljøer vil bli involvert i den videre planleggin-gen med tanke på start i 1999. Se mer om NORM i 4.2.3.
Lokal overvåking
En rekke sykehus benytter data fra de rutinemessige kliniske undersøkelsene til overvåking av resistensforhold i sykehuset og i allmennpraksis i sykehusets opptaksområde. Noen eksempler er:
- Mikrobiologisk avdeling ved Regionsykehuset i Tromsø registrerer resistensforhold for alle isolater som resistensundersøkes rutinemessig. Kommune-legene får hvert år en rapport om situasjonen i sitt eget fylke.
- Regionsykehuset i Trondheim produserer halvårlige statistikker over resistensforhold hos alle kliniske isolater som er blitt testet.
- Resistensforhold for alle bakterieisolater i prøver fra pasienter i sykehuset og i allmennpraksis er i mer enn 20 år blitt registrert ved Avdeling for mikrobiologi og immunologi ved Haukeland sykehus. Statistisk bearbeidede rapporter har regelmessig vært utarbeidet og distribuert til rekvirentene.
2.2.3 Bakterier fra mennesker. Internasjonale overvåkingssystemer med norsk deltaking.
Det fins ei rekke internasjonale systemer for resistensovervåking. Mange av dem er i regi av eller finansiert av legemiddelindustrien. Internasjonale faglige sammenslutnin-ger har satt i gang flere systemer.
Den europeiske union
Norge deltar i tre europeiske systemer. Det første (Enter-Net) finansieres av forskningsprogram-met BIOMED2 under EU-kommisjonens tolvte generaldirektorat mens de to andre finansieres av folkehelseprogrammet om AIDS og andre smittsom-me sykdommer under EUs femte generaldirektorat. Norge er fullt betalende deltaker i disse to programmene.
Enter-Net overvåker salmonelloser og EHEC-infeksjoner i Europa og vil fra 1999 også inkludere resistensforhold hos Salmonella og EHEC. Systemet koordineres av smitteverninstituttet i England og Wales, og Folkehelsa er det norske kontaktpunktet.
European Antimicrobial Resistance Surveillance System (EARSS) [7,8], som startet 1.10.98, skal foreløpig overvåke resistens hos bare to mikrober:
- Prevalens av penicillin- og ciprofloxacinresistens hos pneumokokker fra blod og cerebrospinalvæske.
- Forekomst av meticillinresistente gule stafylokokker i blod hos pasienter innlagt i sykehus: Antall i forhold til antall innleggelser, totalt antall pasientdøgn og totalt antall isolater av gule stafylokokker.
Systemet koordineres av folkehelseinstituttet i Nederland. Folkehelsa er det norske kontakt-punktet.
EuroTB vil fra 1999 samle opplysninger om tuberkulosetilfeller, inkludert resistensforhold. Systemet koordineres av det europeiske senteret for overvåking av AIDS i Frankrike. Statens helseunder-søkelser er det norske kontakt-punktet.
Verdens helseorganisasjon
Verdens helseorganisasjon har et Antimicrobial Resistance Monitoring (ARM) program som bl.a. skal bedre den nasjonale standarden for resistensbestemmelse og drive internasjonal overvåking av resistens. Programmet gir ut et dataprogram WHONET for registrering av resistensforhold.
2.2.4 Bakterier fra dyr
Statens dyrehelsetilsyn vurderer å gjøre infeksjoner med visse typer resistente bakterier meldings-pliktige på linje med smittsomme dyresykdommer.
Bakterier isolert fra infeksjoner hos produksjons- og kjæledyr blir rutinemessig undersøkt for antibiotikaresistens ved Veterinærin-sti-tuttet, de regionale laboratorier og Norges veterinærhøg-skole. Bakterier isolert fra melkekyr med mastitt, hunder med hudinfeksjoner og griser med enteritt blir undersøkt for resistens med overvåking som et delmål.
Norges veterinærhøg-skole foretar også en viss overvåking av resistens hos fiskepatogene mikrober. Veterinærinsti-tuttet, Norges veterinær-høgskole og Universitetet i Tromsø har samarbeidet om å kartlegge forekomsten av vankomycinresistente enterokokker i norsk kylling og svin og hos fjørfeprodusenter (se 2.8.4).
Et nordisk nettverk for å koordinere overvåking av antibiotikaresistens hos bakterier fra dyr er under opprettelse etter initiativ fra Veterinærinstituttet.
2.2.5 Bakterier fra næringsmidler
Ei rekke kartleggingsprogrammer for forekomst av resistente bakterier i matvarer er initiert av Statens næringsmiddeltilsyn. I 1997 undersøkte man resistensforhold hos E coli, Enterococcus spp og Salmonella fra importerte animalske matvarer [9]. Samme år undersøkte man også E coli og Enterococcus spp fra norsk kjøtt og kjøttprodukter [10]. Undersøkelsene er utført av Veterinærinstituttet. I 1998 er kartleggingen utvidet til flere produkter.
SNT har også initiert en kartlegging av resistensforhold hos bakterier i starter-kulturer som benyttes i meieriindustrien. Undersøkelsen utføres av Veterinærinstitut-tet i samarbeid med det kommunale næringsmiddeltilsynet for Midt-Rogaland og Rogalandsforskning. Videre undersøker man forekomst av resistens hos Listeria fra mat (Veterinærinstituttet og Norges veterinærhøgskole).
Ei rekke isolater av enteropatogene bakterier fra dyr, næringsmidler og fôr samles fra landets mikrobiologiske laboratorier ved Folkehelsa for referanseundersøkelse. Så langt kapasiteten tillater det, bestemmes da også de viktigste resistensforholdene. Resultatene kan sammenholdes med undersøkelsene av tilsvarende isolater fra mennesker.
Det er for øvrig ulike former for nordisk samarbeid på dette området i regi av Nordisk Ministerråd, Nordisk Embetsmannskomité for næringsmiddelspørsmål samt Nordisk Kontaktorgan for Jordbruksforskning.
2.3 Overvåking av antibiotikabruk
2.3.1 Bakgrunn
Med overvåking av antibiotikabruk menes vedvarende, systematisk innsamling, analyse og tolkning av data om bruk av antimikrobielle legemidler brukt til mennesker og dyr, og bruk av disse opplysningene i planlegging, implementering og evaluering av tiltak for optimalisering av antibiotikabruken. Overvåkingen kan bidra til å øke forståelsen av sammenhengen mellom antibiotika-forbruk og smittevern-tiltak på den ene siden og utvikling av resistens på den andre. Statens helsetilsyn har ansvar for å overvåke legemiddelmarkedet.
Overvåking i denne betydningen må skilles fra enkeltstående, tidsbegren-sete kartleggingsprosjekter som også måler forbruket av antibiotika. Disse kan noen ganger være del av et overvåkingssystem. Nedenfor nevnes også enkelte kartleggings-prosjekter.
2.3.2 Grossistbasert statistikk
Problemer med dagens overvåking
Dagens statistikk over antibiotikabruk er lite detaljert og presist og består stort sett av statistikk fra de tre store grossistenes salg av legemidler til apotek og sykehus. Den gir verdifull informasjon om totalomsetnin-gen av legemidler, men detaljeringsnivået er svært lavt.
Antibiotika til mennesker
Estimater for befolkningens legemiddelforbruk skjer ved å fordele grossistsalg på alle innbyggere i et fylke eller i hele landet. Statistikken gir ikke mulighet for å følge den enkelte leges rekvirering og heller ikke informasjon om legemiddel-bruk relatert til individ eller sykdom. Videre skiller den ikke mellom legemiddel-bruk i institusjon og primærhelsetjeneste og gir ikke et korrekt kostnads-bilde.
Antibiotika til dyr
Ved å bruke grossistdata som kilde vil man bare kunne registrere forbruket til dyr av de preparatene som kun er registrert til veterinærmedisinsk bruk. Humanpreparater som blir brukt til dyr, vil bli registrert som solgt til human bruk. Videre gir ikke grossistdata (med få unntak) noen informasjon om hvilke dyrearter preparatene er brukt til, eller på hvilke indikasjoner. Statistikken gir heller ikke opplysninger om den enkelte veterinærs rekvirering.
Norsk medisinaldepots rolle
Norsk medisinaldepot (NMD) hadde tidligere monopol som legemiddelgrossist i Norge. NMD leverte på oppdrag fra myndighetene salgsstatistikk på grossistnivå, og publiserte i bokform data over salg i kroner og definerte døgndoser for alle legemiddel-grupper. Etter at monopolet opphørte, er det nå tre fullsortimentsgrossister i Norge.
Firmaet Farmastat (som eies av legemiddelbransjen) kjøper salgsstallene fra de tre fullsortimentsgrossistene, og selger data videre til NMD slik at det fortsatt kan publiseres grossistsalgstall for hele landet. Statistikken lager NMD fortsatt på oppdrag fra myndighetene, og det er ikke umiddelbart innlysende at de øvrige grossistene fortsatt vil levere sine data til NMD. Statistikk over salg av legemidler/legemiddelgrupper (ATC, DDD, kr) fra grossist, totalt og med fylkes-fordeling, publiseres årlig i form av boken Legemiddelforbruket i Norge. Siste utgave som dekker 1993-1997 ble publisert i mai 1998 [11].
NAF-Stat
Norges Apotekerforening har siden 1993 drevet en database, NAF-Stat, over legemiddel-omsetning ved 22 representative apoteker. Opplysningene ekstrapoleres til nasjonale data som stilles til rådighet for Rikstrygdever-ket. Dataene publiseres ikke, men vil kunne kjøpes av myndighetene.
2.3.3 Reseptbasert legemiddelstatistikk
Norsk reseptstatistikk
Reseptopplysninger finnes i det enkelte apotek og kan benyttes til legemiddelforbruks-studier lokalt, herunder profiler av legers rekvirering hvis apotekets nedslagsfelt er vel avgrenset i forhold til naboapotek.
For å få informasjon om legemiddelforbruk på individnivå ble Norsk reseptstatistikk startet i april 1990. Den ble basert på innsamling av resepter fra et utvalg av om lag 250 leger hvert halvår. NMD hadde vansker med å rekruttere leger; rundt 70% av de spurte takket nei til å delta. Innsamlet informasjon omfattet legemidler som ble brukt, diagnose og pasienters alder og kjønn.
Siden 1990 er hvert år en legemiddelgruppe blitt gjenstand for nærmere analyse vedrørende diagnosestillinger og rekvireringsmønster i allmennpraksis. I 1993 ble antibiotikaforskrivningen analysert, og i boken som kom ut i 1998 har man en mindre, detaljert analyse ut fra data fra første periode 1996.
NMD innledet samarbeid med firmaet International Medical Statistics (IMS), som overtok registrering og statistisk bearbeidelse av materialet. Det har ikke vært tilfredsstillende at data på denne måten har gått ut av hendene på myndighetene, og ikke vært fritt tilgjengelig for forskning og analyse for fagmiljøet i Norge. Data og programvare har vært til salgs. IMS har også solgt grossistdata for legemidler på tilsvarende måte som Farmastat.
Avtalen mellom NMD og IMS om at NMD rekrutterer leger og IMS utfører registrering og bearbeidelse av data, ble sagt opp av IMS i 1997. Begrunnelsen var at IMS ville rekruttere leger gjennom journaldatasystem slik at data kunne innhentes direkte fra pasientjournal uten ekstra arbeid for rekvirerende lege. IMS har imidlertid hatt store problemer med journaldatasystemet og har måttet legge prosjektet på is. De siste data som finnes fra reseptstatistikk i Norge er dermed fra første del av 1996. Nå er vi tilbake til tida før 1990. Vi har grossistdata som gir bilde av utvikling over tid og viser fylkesvise forskjeller, men på individnivå og koblet til diagnoser finnes ikke statistikk.
En nasjonal reseptbasert legemiddelstatistikk
Med en nasjonal reseptbasert legemiddelstatistikk menes en statistikk basert på apotekenes salg av legemidler etter resept og rekvisisjon med tillegg av salg av legemidler gjennom andre kanaler enn apotek. Statistikken kan i dag forholdsvis enkelt baseres på apotekenes datasystemer som allerede inneholder de fleste aktuelle opplysninger om salg av legemidler etter resept og rekvisisjon. Alle rekvirenter har et unikt nummer i Helsepersonellregisteret som sikrer entydig registrering av data.
En slik statistikk vil kunne gi helsemyndighetene, helsevesenet og forskningsmiljøene en mulighet til å følge opp bruken av antibiotika systematisk etter registrering både i og utenfor institusjon, for å øke kunnskapen om hvordan antibiotika brukes. Se nærmere om dette i 4.3.2.
Tuberkulosemedikamenter
Forbruket av rifampicin overvåkes nøye ved at preparatet (inkludert kombinasjons-preparater) bare utleveres fra Rikshospitalets apotek. Statens helseundersøkelser skal godkjenne utleveringen. Andre tuberkulostatika må også utleveres fra Rikshospitalets apotek dersom de rekvireres for Folketrygdas rekning.
2.3.4 Sykehusinterne systemer
Alle sykehus har statistikk over salg fra apotek eller farmasøytisk avdeling til de enkelte avdelinger eller poster. Ved mange sykehus samarbeider apoteket og sykehusets legemiddelkomité eller antibiotikakomité om overvåking av forbruket av antibiotika. Ofte benyttes overvåkingen direkte i rådgivningen overfor sykehusets leger.
Data er det enkelte sykehus' eiendom, og det har kun unntaksvis vært laget sammenliknende statistikker. Det finnes ikke offentlig tilgjengelig sammenliknbar statistikk over legemiddelbruk i landets sykehus. På initiativ fra Rikshospitalet er det gjort en undersøkelse av antibiotika-bruk ved barneavdelingene i Helseregion II i årene 1990-95.
2.3.5 Antibiotika til oppdrettsfisk, i dyrefôr og i næringsmidler
Antibiotika til oppdrettsfisk
Resept på alle legemidler (inkludert medisinfôr) til oppdrettsfisk skal skrives på særskilt blankett som fastsettes av Statens helsetilsyn. Rekvirerende veterinær plikter å sende kopi av alle resepter til Fiskeridirektoratets kontrollverk som har ansvaret for å kontrollere at oppdrettsfisk til konsum er fri for helsefarlige legemiddelrester. Reseptkopiene registreres i en database, og data fra denne basen anvendes til overvåking av antibiotikabruk i fiskeoppdrettsnæringen.
Antibiotika i dyrefôr
Statens landbrukstilsyn fører tilsyn med bruk av antibiotika i fôr til husdyr. Det føres statistikk over mengde brukt per år. Gjennom internkontroll og stikkprøver kontrollerer man at det ikke forekommer ulovlig tilsetting.
Antibiotika i næringsmidler
Overvåking av forekomsten av antibiotikarester i slakt har siden 1988 pågått i regi av Statens næringsmiddeltilsyn. Man undersøker restmengder av antibiotika i utvalgte slakt. Programmet har omfattet blant annet sulfonamider, nitrofuraner, tetracykliner, enrofloxacin og kloramfenikol. I denne perioden har ingen av de analyserte prøvene av storfe, gris, sau eller fjørfe vist rester av antibiotika over fastsatte grenseverdier. Fra 1999 skal også honning, melk, egg og fisk inkluderes i denne overvåkingen. Melk fra melketanker er i lang tid blitt jevnlig undersøkt for antibiotikarester.
I tillegg gjennomfører det kommunale næringsmiddeltilsynet stikkprøvekontroll for bakteriehemmende stoffer i nyrene til normalslakt. Fra 1994 til 1997 er det funnet rester av bakteriehemmende stoffer i 0,06-0,51% av de analyserte prøvene. Analyser av kjøtt fra de samme dyra har imidlertid ikke vist rester over de fastsatte grenseverdiene.
Fisk som har vært behandlet med antibiotika, blir rutinemessig undersøkt med hensyn på restkonsentrasjoner. Analysene utføres ved ett av Fiskeridirektoratets fire laboratorier. Det blir ikke gitt tillatelse til slakting dersom rester av antibiotika kan påvises. I tillegg gjennomfører Fiskeridirektoratet på stikkprøvebasis kontroller av fisk etter slakting. Systemet sikrer på en effektiv måte konsumentene mot å bli eksponert for rester av antibiotika fra fisk.
2.4 Mikrobiologisk diagnostikk og resistensbestemmelse
2.4.1 Bakterier fra mennesker
Mikrobiologisk primærdiagnostikk og resistensbestemmelser skjer i de fylkeskommunale og statlige medisinsk mikrobiologiske laboratoriene og ved enkelte private laboratorier i Østlandsområdet.
De mikrobiologiske avdelingene ved flere av regionsykehusene, ved Telelab og ved Folkehelsa har mulighet til påvisning av gener som koder for antibiotikaresistens. Det er forskjeller i repertoar og erfaring.
Ved Det odontologiske fakultet i Oslo og ved Telelab gjøres resistensbestemmelser av bakterie-isolater fra odontogene infeksjoner.
Standardisering
Arbeidsgruppen for antibiotikaspørsmål (AFA) ble oppnevnt i 1978 av Norsk forening for medisinsk mikrobiologi. Denne foreningen utnevner fire medlemmer og Norsk forening for infeksjonsmedisin utnevner to medlemmer til gruppa. Gruppas mandat er blant annet å anbefale brytningspunkter (se 1.3.10) for de enkelte antibiotika og valg av antibiotika for rutineundersøkelsene basert på norsk behandlingstradisjon. Videre skal gruppa kontinuerlig vurdere nye antibiotika og nye metoder for resistensbestemmelser.
AFAs nyeste anbefalinger om resistensbestemmelser for bakterier og sopp kom i 1997 [12] og benyttes ved de fleste norske medisinsk mikrobiologiske laboratorier.
Kvalitetssikring
Alle de medisinsk mikrobiologiske laboratoriene deltar i Program for ekstern kvalitets-sikring i bakteriologi og mykologi ("ringtester") som koordineres fra Folkehelsa. Resultatene fra det norske programmet gis i rapporter og i strategimøter for de medisinsk mikrobiologiske laboratoriene. Regionsykehuset i Tromsø deltar også i tilsvarende system fra Public Health Laboratory Service i Colindale, UK.
Internasjonalt samarbeid
Regionsykehuset i Tromsø samarbeider med laboratorier i Murmansk om undersøkelser av difteribakterier. Universitetet i Oslo samarbeider med helsemyndighetene i Botswana om diagnostikk ved øvre luftveisinfeksjoner.
Folkehelsa er supranasjonalt referanselaboratorium (WHO) for tuberkelbasiller for Mosambik og Arkhangelsk med resistensbestemmelse av isolater derfra [13] og veiledning av lokale mikrobiologiske laboratorier. Instituttet er også WHO Collaborating Centre for Meningococci med resistensbestemmelse av isolater fra bl.a. Afrika og veiledning av afrikanske mikrobiologiske laboratorier.
2.4.2 Bakterier fra dyr
Norges veterinærhøgskole dekker diagnostikk og resistensundersøkelser fra egne avdelinger. Veterinærinstituttet og de regionale laboratorier dekker det øvrige behovet for diagnostikk og resistensundersøkelser i Norge. Disse to er sammen med Folkehelsa referanselaboratorier for næringsmiddeltilsynets laboratorier. Veterinærinstituttet og Norges veterinærhøgskole foretar resistensundersøkelser av fiskepatogene mikrober.
2.4.3 Norsk senter for kvalitetssikring av laboratorievirksomhet utenfor sykehus (NOKLUS)
NOKLUS skal bidra til høy kvalitet i de klinisk kjemiske og medisinsk mikrobiologiske undersøkelser som utføres på allmennlegekontorer og andre steder utenfor sykehus. NOKLUS er knyttet til Seksjon for allmennmedisin, Universitetet i Bergen og finansieres av staten og Den norske lægeforening. NOKLUS har et faglig råd med spesialister i blant annet medisinsk mikrobiologi, allmennmedisin og klinisk kjemi. NOKLUS startet i 1992. 96% av landets primærleger er nå tilknyttet NOKLUS. Virksomheten er todelt: veiledning og ekstern kvalitetssikring ("ringtester").
Hvert fylke har ansatt 0,5 til 1,5 laboratoriekonsulent som reiser rundt og veileder ved de enkelte legekontorene. Hvert fylke har i tillegg en ansvarlig avdelings-overlege og et fylkesutvalg med allmennpraktikere og en medisinsk mikrobiolog.
Fra sentralen i Bergen mottar deltakerne jevnlig standardprøver for analyse. Svarende sendes NOKLUS som rapporterer tilbake med det korrekte svaret og kommentarer. En kopi går til fylkeskonsulenten som dermed kan veilede legekontorene ved behov.
Repertoaret av prøver har økt og inkluderer blant annet måling av C-reaktivt protein, et tegn på infeksjon. De to siste årene har man også inkludert mikrobiologiske prøver: hurtigtester for streptokokker og mononukleose og dyrking av bakterier fra urin. Man har også inkludert sykehistorier med relevante kliniske problemstillinger som legene blir bedt om å løse.
2.5 Riktigere bruk av antibiotika: Samarbeid med rekvirenter
2.5.1 Grunnutdanningen
Leger
Ved de medisinske fakultetene er resistens et tema særlig i undervisningen i medisinsk mikrobiologi. Temaet kommer igjen i den kliniske undervisningen i infeksjonsmedisin og i enkelte av de andre kliniske fagene. Med problembasert læring kan antibiotikabehandling og resistens behandles med flere fagområder som innfallsport.
Tannleger
Ved Det odontologiske fakultet ved Universitetet i Oslo får studentene preklinisk undervisning om mikrober og resistens i fagene mikrobiologi, cytologi og farmakologi. Kunnskapene utvikles videre i den senere kliniske undervisningen. Antibiotika og resistens blir særskilt behandlet i kliniske seminarer og temauker. Her inngår øvelser i mikrobiologisk prøvetaking, rekvirering, tolkning av laboratorienes svar og valg av terapi. Fakultetets intensiverte undervisning i klinikkhygiene skal bidra til å forebygge sykdom og dermed minske behovet for antimikrobiell behandling.
Veterinærer
Resistens og bruk av antimikrobielle midler har en viktig plass i Norges veterinær-høgskoles utdanning av veterinærer, særlig innen fagene farmakologi, mikrobiologi og næringsmiddelhygiene. Den forskningsbaserte undervisningen har som ett av sine holdningsmål å utdanne veterinærer "som skal lære å søke ny kunnskap og tilpasse sin yrkesutøvelse i takt med skiftende krav". Undervisningen i forebyggende sykdomsarbeid skal sette veterinærene i stand til bedre å forebygge sykdom og dermed minske behovet for antimikrobiell behandling.
2.5.2 Sykehus og andre helseinstitusjoner
Tverrfaglige antibiotikagrupper fins ved noen sykehus mens andre har ansatt en egen person som antibiotikaveileder. Noen sykehus har begge deler. Eksempler på ordninger er:
- Regionsykehuset i Trondheim har en gruppe på fem medlemmer som er et underutvalg av legemiddelkomitéen. Sykehuset har også ansatt en lege som såkalt antibiotika-veileder med oppgaver å samarbeide med sykehusets leger om riktigere rekvirering av antibiotika.
- Haukeland sykehus har opprettet en stilling for infeksjonsmedisiner som antibiotikaveileder for ytterligere å styrke veiledningen fra sykehusets infeksjons-spesialister.
- Rikshospitalet har en velfungerende antibiotikakomité. Den sammenholder løpende avdelingsvise statistikker over forbruket av antimikrobielle midler og resistensforhold. Man gir løpende konsulentveiledning til legene ved de kliniske avdelingene og arrangerer sykehusinterne konsensusmøter om behandling. Transplantasjonsvirksomheten ved sykehuset betyr at mange pasienter er sterkt immunsvekket i lange perioder under oppholdet. De er dermed særlig utsatt for infeksjoner med bl.a. resistente bakterier. Sykehuset har klart å utføre transplantasjo-nene med færre infeksjoner og mindre bruk av antimikrobielle midler enn tilsvarende sykehus i utlandet.
2.5.3 Allmennpraksis
Sats
Sats er et smågruppebasert etterutdanningsopplegg i regi av legeforeningens kvalitetsarbeid og med godkjenning som videre- og etterutdanning i allmennmedisin. Sats skal støtte allmennleger i å sette mål for sin virksomhet og vise om målene blir nådd. Hensikten er å gi de deltakende allmennlegene
- erfaring med å vurdere og forbedre egen praksis ut fra enkle registreringer,
- et utgangspunkt for effektiv læring av et klinisk område, og
- en ramme for faglig og sosialt fellesskap med kolleger.
Små grupper med 6-10 allmennleger etablerer seg og får tilsendt fra Sats temahefter for det valgte emnet og en rapportdiskett til bruk i journalsystemet. Under perioden registreres praksis som en del av den vanlige journalføringen. Til møtene tas det ut rapporter over visse praksisindikatorer. Gruppa reflekterer så sammen over deltakernes resultater, drøfter behov for og planer for endringer og følger opp med ny registrering. Ett av de fire temaene i Sats til nå har vært sår hals [14]; andre infeksjonstema er aktuelle.
Regionale legemiddelinformasjonssentre (RELIS)
RELIS er et tilbud til helsepersonell om produsentuavhengig legemiddelinformasjon. I tillegg til løpende veiledning, skal RELIS samarbeide med legemiddelkomitéer og andre om utarbeiding, implementering og evaluering av retningslinjer for behandling. Sentrene driver også forskning.
Bidrag fra apotekene
Apotek-lege informasjonssamarbeid (ALIS) er et prosjekt som enkelte apotek og Norges apotekerforening har gjennomført for å bedre rekvireringen av bl.a. antimikrobielle midler i allmennpraksis. De deltakende legene får informasjon og personlig tilbakemelding fra apotekene om sin rekvirering av antimikrobielle midler. I et forsøk i Drammen var det en betydelig forbedring av de deltakende legenes rekvirering (mindre tetracyklin og trimetoprim, mer penicillin) i forhold til byens øvrige leger.
Legemiddelkomitéer er opprettet også utenfor sykehus i mange kommuner. Flere apotek ønsker å delta i slike komitéer og kan bidra med reseptstatistikk som grunnlag for personlig tilbakemelding og med legemiddelinformasjon.
2.5.4 Veterinærmedisinen
Dyrehelsetilsynets distriktsveterinærer har meget god kontakt med praktiserende veterinærer og dyreeiere. Veterinærer i Norge har tradisjonelt vært svært lojale i forhold til styringssignaler fra myndighetene. Dette sammen med distriktsveterinærenes kontinuerlige informasjonsarbeid bidrar til å optimalisere bruken av antibiotika. Imidlertid er det sett eksempler på utglidning ved utlevering av legemidler direkte fra veterinærer til husdyrprodusenter. Derfor bør veiledning og tilsyn styrkes.
Veterinærforeningen samarbeider med landbruksorganisasjonene og Helsetjenestene for storfe og svin om å redusere forbruket av antibiotika til produksjons-dyr. Målet på 25% reduksjon ble praktisk talt nådd etter bare to år, men prosjektet fortsetter.
Veterinærmedisinsk legemiddelinformasjonssenter (VETLIS)
Produsentnøytral informasjon kan være et viktig virkemiddel for å oppnå riktig legemiddelbruk i veterinærmedisinen. Norges Apotekerforening har finansiert et treårig prøveprosjekt med hovedmålsetning å etablere og utprøve drift av et informasjonssen-ter for legemiddel-bruk til dyr.
Målsetningen for VETLIS er å styrke, samordne og kvalitetssikre informa-sjon om legemiddelbruk til dyr, og å formidle produsentuavhengig informasjon om veterinær-medisinsk bruk av legemidler. De viktigste målgruppene er farmasøyter i apotek og praktiserende veterinærer. VETLIS er organisert som en egen driftsenhet under Rikshospitalets apotek, men med fysisk plassering ved Norges veterinærhøgskole.
Prøveperioden har så langt vist at det er et stort behov for produsentnøytral legemiddelinformasjon innen veterinær-medisinen. Prøveprosjektet VETLIS har driftsmidler frem til 1. juli 1999. Ved etableringen av prøveprosjektet forutsatte Norges Apotekerforening at en eventuell permanent drift måtte finansieres av det offentlige. Det ble i denne forbindelse nedsatt en gruppe som skulle arbeide for å finne en finansierings-modell for fortsatt drift. Så langt har ikke denne gruppa lykkes i sine bestrebelser med å få de aktuelle myndigheter til å bevilge midler til et permanent senter. Også Veterinærforeningen og Statens dyrehelse-tilsyn har bidratt til etableringen av prosjektet.
2.5.5 Videre- og etterutdanningen
Leger
Haukeland sykehus arrangerer et årlig kurs om bruk av antimikrobielle midler som ledd i legers videre- og etterutdanning. Leger ved sykehuset foreleser også i en rekke kurs arrangert av andre. Også i Oslo arrangeres et årlig kurs om antibiotikabehandling.
Statens helsetilsyn, Folkehelsa og andre har holdt kurs i sykehushygiene for relevant personale i kommune- og institusjonshelsetjenesten. Statens helsetilsyn planlegger i samarbeid med fylkeslegene og landets sykehus å holde kurs i 1999-2000 om resistens og antibiotikabruk for leger i allmennpraksis og sykehusleger.
Veterinærer
I den organiserte videre- og etterutdanningen for veterinærer har det vært arrangert flere sentrale og regionale kurs med antibiotikaresistens som hovedtema.
2.5.6 Veiledere i antibiotikabruk
Flere sykehus har laget egne veiledningshefter for antibiotikabruk. Det gjelder blant annet Regionsykehuset i Trondheim [15], Aker sykehus, Haukeland sykehus [16] og Radiumhospitalet (sammen med Folkehelsa) [17]. I tillegg kommer Felleskatalogen, Legemiddelhåndboka, anbefalingene fra Statens legemiddelkontrolls terapiverksteder og hefter og bøker utgitt av legemiddelindustrien eller forlag.
Statens legemiddelkontroll gjennomfører hvert år flere terapiverksteder i samarbeid med svenske legemiddelmyndigheter. Disse resulterer i produsentuavhengig informasjon og anbefalinger om legemidler og deres bruksområde. Anbefalingene sendes gratis til alle leger. Flere av terapiverkstedene har handlet om behandling av infeksjoner.
I 1998 ble samarbeidet mellom Statens legemiddelkontroll og Läkemedelsverket utvidet til også å omfatte veterinærmedisinske terapiverksteder. Statens dyrehelse-tilsyn og Veterinærforeningen deltok også i dette samarbeidet på norsk side. Anbefalinger om bruk av anti-bakterielle midler til produksjonsdyr [18] ble utgitt i 1998 etter et verksted med deltaking fra norske og svenske fagmiljøer, bl.a. Norges veterinærhøgskole og Veterinærin-stitut-tet. Man planlegger nye, årlige terapiverksted også på veterinær-området.
Statens helsetilsyn har under utgivelse en veileder om bruk av antibiotika i sykehus og har satt i gang arbeidet med en tilsvarende veileder for allmennpraksis.
2.5.7 Annen veiledning
Statens helseundersøkelser
Motvirkning av resistensutvikling er en stor utfordring under den langvarige behandlin-gen av tuberkulose. Statens helseundersøkelser gir gjennom heftet Kontroll av tuberkulose [19] og gjennom telefonisk rådgivning og kurs veiledning i behandling av tuberkulose. Videre følger man opp behandlingen og registrerer behandlingsresultat.
Folkehelsa
Meldingsbladet Resistens sendes gratis fra Folkehelsa til nær 5000 personer innen helsetjenesten, næringsmiddeltilsynet og pressen og gir aktuelle informasjon om resistens og resultater fra nyere forskning om effekt av antibiotikabehandling. Instituttet gir veiledninger i bl.a. MSIS-rapport, SHE-nytt og Tidsskrift for Den norske lægefore-ning om behandling av infeksjoner med meningokokker, gonokokker og gruppe A-strepto-kokker og profylakse mot malaria; resistensforhold for Haemophilus influenzae, gruppe A streptokokker, pneumokokker mv.
Det verdensomspennende Cochrane-samarbeidet lager systematiske oversikter over randomiserte studier av effekt av antibiotikabehandling på ulike infeksjoner. Folkehelsa bidrar i betydelig grad til samarbeidet, blant annet gjennom utarbeiding av veiledningsheftet om metoder for systematiske oversikter.
Odontologi
Det odontologiske fakultet ved Universitetet i Oslo har nasjonalt kompetansesenter for odontologisk farmakologi og farmakoterapi. Man bidrar her til veiledning om bruk av antimikrobielle midler innen odontologien.
2.6 Riktigere bruk av antibiotika: Kommunikasjon med publikum
Et faktaark om antibiotikaresistens ble i 1997 utgitt av Statens forurensningstil-syn etter samarbeid med flere andre etater. Arket forklarer på fire sider de viktigste forhold og problemer vedrørende resistens og hvilke tiltak ulike myndigheter har satt i verk. Faktaarket ble distribuert til mange adressater deriblant alle norske under-visnings-institusjoner fra videregående skoler til universite-ter.
Diverse brosjyrer om infeksjonssykdommer (meningokokksykdom, Lyme sykdom, reiseråd) er utgitt av Folkehelsa som også har passiv pressekontakt i forbindelse med oppfølging av notiser i MSIS-rapport, Resistens mv. Instituttet planlegger en kampanje med vekt på infeksjo-ner og antibioti-kabruk hos barn.
2.7 Andre smitteverntiltak
2.7.1 Sykehushygiene
I 1996 trådte Forskrift om smittevern i helseinstitusjoner - sykehusinfeksjoner i kraft, og Folkehelsa og Statens helsetilsyn utarbeidet en veileder til forskriften [20]. Forskriften, som er gitt av Sosial- og helsedepartementet med hjemmel i smittevernloven, har som formål å forebygge og begrense forekomsten av infeksjoner i sykehus og andre helseinstitusjoner.
Forskriften setter krav til at alle helseinstitusjoner skal ha et infeksjonskontrollprogram som blant annet skal inneholde et opplegg for infeksjonsovervåking og en samling av retningslinjer og prosedyrer for infeksjonsforebygging, herunder bruk av antibiotika.
Videre pålegger forskriften institusjonene å ha nødvendig personell med utdanning og innsikt i sykehushygiene. Regionsykehusene skal ha en enhet for sykehushygiene som skal ledes av en heltids ansatt sykehushygieniker. Enheten skal kunne fungere som kompetansesenter for regionen. Folkehelsa skal blant annet holde oversikt over sykehusinfeksjoner i landet, tilby assistanse ved oppklaring av utbrudd, holde kurs og utarbeide bakgrunnsmateriale for retningslinjer. Folkehelsa har gjennom mange år utdannet hygienesykepleiere og nylig også sterilsentralledere.
Sammen med andre forhold har forskriften ført til en ny giv i det sykehushygieniske arbeidet i regi av blant andre regionsykehusene, Folkehelsa, Statens helsetilsyn og Norsk forum for sykehushygiene.
Statens helsetilsyn har tatt initiativ til og laget utkast til forskrift om forhånd-undersøkelse av helsepersonell - antibiotikaresistente bakterier, fastsatt av Sosial- og helsedepartementet. Helsetilsynet har gitt retningslinjer til forskriften. Helsetilsynet har videre gitt ut rundskrivet Forhåndsundersøkelse av pasienter - smittsomme sykdommer. Råd for anvendelse av smittevernloven § 3-3. Sykehusene har innarbeidet disse forskriftene og rådene i sine infeksjonskontrollprogram.
2.7.2 Sykdomsforebygging i husdyrproduksjonen
Veterinærforeningen arbeider med næringsorganisasjonene for å forbedre det forebyggende helsearbeidet blant storfe og svin slik at dyra blir sunnere og behovet for antibiotika mindre. Veterinærinstituttet og Norges veterinærhøgskole bidrar med det faglige grunnlaget for sykdomsforebyggende tiltak.
2.7.3 Vaksinasjon
Vaksinasjon kan forebygge sykdom og dermed bidra til at behovet for antibiotikabehandling blir mindre. Folkehelsa importerer, distribuerer og gir veiledning om vaksiner [21,22]. Særlig arbeider man med å øke bruken av influensavaksine og pneumokokkvaksine blant eldre. I mange land er pneumokokker resistente mot en rekke antimikrobielle midler.
Immunprofylakse i form av vaksinasjon og serumbehandling har i betydelig grad bidratt til å redusere bruken av antibiotika i norsk husdyrhold. Gode eksempler er vaksine mot furunkulose og kaldtvannsvibriose i norsk fiskeoppdrett og mot diaré hos smågris.
2.8 Forskning, utvikling og utredning
Nedenfor gis en del eksempler på norsk forskning som er relevant for resistensproblemet. Oversikten er ikke uttømmende. De fleste forskningsprosjektene er tverrfaglige. Klassifiseringen kan derfor være noe arbitrær.
2.8.1 Bakteriologi
Norges forskningsråd
Norges forskningsråd finansierer flere prosjekter om antibiotikaresistens under ulike programmer.
Medisin og helse
Området Medisin og helse sitt Program for Celle- og genteknologi har molekylær mikrobiologi som et av sine prioriterte forskningsområder og finansierer fire prosjekter hvor studiet av antibiotikaresistens står sentralt. Programmet Miljø-forurensning og helse har eksponeringsforskning som et prioritert forskningsområde, og har i sin portefølje to prosjekter innen feltet human eksponering for antibiotika-resistente mikrober.
Bioproduksjon og foredling
Området Bioproduksjon og foredling har flere prosjekter knyttet til antibiotika-resistens under de tre programmene Fiske- og dyrehelse, Nærings-middelin-dustri og Bioteknologi i landbruket. Fiskehelseforskningen har bidratt til den positive nedgangen i antibiotikabruk i oppdrettsnæringen. Sentrale faktorer er utviklingen av vaksiner, bedre drift av oppdrettsanlegg og forvaltningstiltak. Hovedmålet for prosjektet under Nærings-middelprogrammet har vært å studere i hvilken grad næringsmidler som er tilsatt industrielle bakteriekulturer bidrar til spredning av antibiotikaresistens til human-patogene bakterier.
Bioproduksjon og foredling vil etablere et nytt Program for bioteknologi fra år 2000. I programplanen er det lagt vekt på å utvikle alternative seleksjonsmetoder i stedet for bruk av markørgen for antibiotikaresistens, og til muligheten for å fjerne markørgen for antibiotikaresistens etter kloning av et gen.
Naturvitenskap og teknologi
Området Naturvitenskap og teknologis program Grunnleggende bioteknologi har et prosjekt hvor naturlig antibiotikaresistens hos bakterier fra laks og kveite studeres for å bedre helsa hos oppdrettsfisk.
Miljø og utvikling
Området Miljø og utvikling har programmet Biologisk mangfold - dynamikk, trusler og forvaltning som støtter et prosjekt om genmodifiserte organismer som er relevant for antibiotikaresistens.
Norsk medisinsk bakteriologisk forskning
Ifølge Norges forskningsråd står norsk medisinsk bakteriologisk forskning og rekruttering i en relativt svak stilling. Innsikt i moderne immunkjemiske metoder og genteknologi kombinert med grundig celle-fysiologisk kompetanse er absolutte krav for å følge den forsknings-messige utviklingen på området. Områdestyret for Medisin og helse har utredet stimuleringstiltak for forskning i medisinsk bakteriologi og kartlagt status for forskning og rekruttering innen norsk medisinsk bakteriologi. Man ønsker nå å styrke disse områdene med en ekstra satsing for en periode på fem år, 1999 - 2004, med mulighet for forlengelse etter vurdering av videre organisering. Det årlige budsjettet foreslås i størrelsesorden 3 mill kroner, hvorav 1/3 fra Kirke-, undervis-nings- og forskningsdepartementet og 2/3 fra Sosial- og helsedepartementet.
Eksempler
Her er noen eksempler på forskningsprosjekter:
- Ved Norges veterinærhøgskole har det siden 1988 vært arbeidet med molekylærbiologiske metoder for å klarlegge hvordan fiskepatogene bakterier utvikler og sprer antibiotika-resistens gjennom flytting av resistensgener. De siste årene har slike studier også vært gjennomført med bakterier som forårsaker mastitt hos melkekyr.
- Pneumokokker, som er hyppige årsaker til luftveisinfeksjoner og blodforgiftning, kan ta opp nakent DNA (arvestoff) fra omgivelsene og innlemme dette i eget DNA. Dette er en mulighet for overføring av resistens mellom bakterier. Basale studier på disse mekanismene foregår ved Norges landbrukshøgskole.
- Peptidsekvensen av de penicillinbindende proteinene som gir nedsatt følsomhet for penicillin hos pneumokokker er undersøkt ved Regionsykehuset i Tromsø. Videre har man sammenliknet vankomycinresistensgenene fra flere deler av verden.
- Forekomst av og helserisiko ved resistente bakterier i næringsmidler studeres ved Veterinærinstituttet og Norges veterinærhøgskole med finansiering fra Norges forskningsråd. Man vil undersøke forekomsten av antibiotikaresistente patogene bakterier og fekale indikatorbakterier i utvalgte norske og importerte næringsmidler av vegetabilsk og animalsk opprinnelse. Man vil videre studere hvilke resistensgener som koder for de typer resistens man eventuelt finner og i hvilken grad disse genene er overførbare til andre patogene bakterier.
2.8.2 Klinisk medisin
Ved sykehusene foretar man utprøving av nye medikamenter, farmakokinetiske studier og studier for å finne den rette dosering av antibiotika.
Ved de allmennmedisinske instituttene har man forsket i spørsmål som har relevans for antibiotikabruk i allmennpraksis. Særlig ved universitetene i Oslo, Bergen og Tromsø har man konsentrert seg om undersøkelser av diagnostiske hjelpemidler for vanlige infeksjoner [23,24] og om regimer for behandling av blant annet bihulebetennelse [25] og urinveisinfeksjoner [26].
En randomisert kontrollert undersøkelse av en intervensjon for endring av allmennlegers atferd, herunder antibiotikarekvirering, utføres ved Folkehelsa. En liknende studie ved Universitetet i Oslo undersøker om man kan endre legers rekvireringspraksis ved urinveisinfeksjoner ved hjelp av reseptregistreringer, tilbakemelding og diskusjon i kollegiale grupper.
Ved Det odontologiske fakultet ved Universitetet i Oslo forskes det på infeksjoner i munnhule. Man er særlig opptatt av anaerobe infeksjoner.
2.8.3 Helsetjenesteforskning
Legenes rekvireringsmønster ved akutt mellomørebetennelse forsøkes endret i et prosjekt ved Universitetet i Tromsø og Legevakten i Tromsø gjennom bruk av nye retningslinjer og ny reseptbruk.
Ved Universitetet i Bergen har man forsket på rekvireringsmønsteret for antibiotika hos leger i Møre og Romsdal [27,28].
Ved Folkehelsa utarbeides systematiske oversikter over randomiserte studier av tiltak for endring av legers atferd, herunder antibiotikarekvirering.
Ved Norges veterinærhøgskole studeres blant annet legemiddel-epidemio-logi, det vil si forbruk og forbruksmøn-ster for antibiotika.
2.8.4 Epidemiologi
Det er sterke holdepunkter for en sammenheng mellom bruk av avoparcin som fôrantibiotika til fjørfe og forekomst av vankomycinresistente enterokokker hos menneske. Forekomsten av vankomycinresistensgenet hos enterokokker fra fjørfe og fra dem som arbeider på gården [29] er blitt undersøkt og sammenliknet i samarbeid mellom Regionsykehuset i Tromsø, Norges veterinærhøgskole og Veterinærinstituttet, med finansiering blant annet fra Statens helsetilsyn. I samarbeid med Veterinærinstitut-tet og Norges veterinærhøgskole vil disse undersøkelsene i 1999 bli fulgt opp for å undersøke i hvor stor grad vankomycinresistente enterokokker forblir i fjørfe-populasjonen etter at avoparcin ble forbudt, og for å vurdere betydningen av fjørfereservoaret for forekomst av vankomycinresistente enterokokker hos mennesker.
Forekomsten av vankomycinresistens hos enterokokker fra sykehusinnlagte pasienter ble undersøkt i 1997 ved Regionsykehuset i Tromsø på isolater innsendt fra sju større sykehus [30], med finansiering fra Statens helsetilsyn.
Ved Haukeland sykehus studerer man kliniske og epidemiologisk forhold ved spredning av enterokokker i sykehus. Man vil også prøve ut strategier for å hindre smitteoverføring. Videre koordinerer man en studie i ni sykehus av epidemiologiske forhold ved multiresistente enterokokker, og en studie i flere sykehus av infeksjoner hos nøytropene pasienter, herunder resistensforhold, med finansiering fra Statens helsetilsyn.
Resistensforhold hos bakterier fra blodkulturer hos nyfødte er undersøkt ved nyfødtseksjonene ved Barneklinikken, Rikshospitalet for 1992-97. Sykehuset er også engasjert i studier av om probiotika kan forhindre at tarmen koloniseres med resistente bakterier.
Resistensforhold i visse blodkulturisolater fra hele landet, normalflora-isolater fra HIV-positive og i både innenlandsk og utenlandsk smittet S typhimurium og C jejuni studeres ved Folkehelsa.
Senter for internasjonal helse ved Universitet i Bergen er engasjert i forskning om utbredelsen av resistens hos bakterier fra sykehusinnlagte pasienter i Tanzania og Etiopia.
Ved Veterinærinstituttet og Norges Veterinærhøgskole utføres det samarbeidsprosjekter omkring forekomst og spredning av antibiotikaresistens hos bakterier som forårsaker jurbetennelse hos melkekyr.
2.8.5 Miljøforskning
Resistensfaktorene integroner kan finnes i miljøet og tas opp av bakterier der. Ved Folkehelsa utvikler man i samarbeid med Norges veterinærhøgskole metoder for påvisning og karakterisering av integroner i vann, kartlegge forekomsten av integroner i bl.a. drikkevann og sammenlikne integroner fra kliniske isolater og miljøisolater.
Antimikrobielle midler gitt til oppdrettsfisk kan løses i sjøvannet eller havne i slam på havbunnen. Stabiliteten av noen antibiotika i disse miljøene er undersøkt ved Fiskeridirektoratets Sentrallaboratorium i samarbeid med Havførskningsinstituttet [31-33].
Utbredelse av resistens i bakterier fra åkerjord, beitemark og kloakkslam undersøkes av Universitetet i Bergen på oppdrag av Statens forurensningstilsyn.
2.8.6 Utredning: Vurdering av antibiotikabruk til dyr
En arbeidsgruppe oppnevnt av Landbruksdepartementet utarbeidet i 1997 innstillingen Vurdering av antibiotikabruk til dyr [34]. I innstillingen gis ei rekke råd til Landbruksdepar-tementet om det videre arbeidet for å forebygge resistens blant dyr og helseproblemer blant mennesker som følge av dette:
Overvåking av antibiotikaforbruk
Om overvåking av antibiotikaforbruket heter det i innstillingen blant annet: "Arbeidsgruppen mener det er av vesentlig betydning at forbruket av antibiotika til dyr overvåkes fortløpende. Det er videre viktig at over-våkingen også omfatter bakterie-hemmende stoffer som blir tilsatt fôr-blandinger. Oversikten over forbruket er først og fremst nødvendig for å kunne evaluere om bruken er riktig med hensyn til farmakote-rapi, næringsmiddelhygiene og av hensyn til miljø og humanmedisinen. I tillegg er det stor interesse for slike data fra media og ikke minst fra forbrukerne. En effektiv overvåking av antibiotikaforbruket kan basere seg på data fra legemiddel-grossister, apotek og praktiserende veteri-nærer."
Overvåking av resistens
Om overvåking av antibiotikaresistens heter det i innstillingen blant annet: "Arbeidsgruppen mener det er svært viktig at det blir etablert et program for overvåking av antibiotikaresistens der innsamling av prø-ver koordineres og metodikk standardiseres. Det er, ut fra helse-messige og økologiske hensyn, nødvendig å følge med i resistens-situasjonen både blant sykdomsframkallende bakterier og indikator-bakterier i dyrepopulasjonene, i næringsmidler og i miljøet for øvrig. De gener som koder for antibiotikaresistens bør kartlegges for å finne ut i hvor stor grad det er de samme arveanlegg som ligger til grunn for antibiotika-resistens hos bakterier i de ulike økologiske nisjene. Det er viktig at det etableres ordninger slik at kostnadene ved analysene ikke forhindrer at nødvendige prøver blir sendt inn til mikrobiologisk labora-torium for resistensanalyse."
Om antibiotika til dyr og folkehelsa
Om veterinærmedisinsk antibiotikaforbruk og humanmedisinske resistensproblemer skriver gruppa blant annet: "Det er generell enighet om at bruk av antibiotika er årsaken til den økte forekomsten av antibiotikaresistens, men det er fortsatt uklart hvilken betydning bruk av antibiotika i veterinærmedisin har for forekomsten av antibiotikaresistens i humanmedisinen. Spesielt har antibiotika brukt i lave doser i fôrblandinger vært kilde for debatt."
"Det er umulig i dag å gi noe endelig svar på hva antibiotikabruken til husdyr betyr for fore-komsten av antibiotikaresistens i human-medisinen. Dette skyldes bl.a. den kompliserte mikrobiologiske økologien, og at dyr og mennesker lever i samme miljø og ofte behandles med de samme typer antibiotika. Nyere arbeider viser at man ikke kan betrakte veterinærmedisin og humanmedisin separat når det gjelder spørsmål om antibiotikaresistens. Det er vist at anti-biotika brukt i en del av økosystemet kan få kon-sekvenser for fore-komsten av antibiotika-resistens i en annen del av økosystemet. Av denne grunn bør det tilstrebes å holde poolen av resi-stente gener så liten som mulig, noe en bare kan oppnå ved å begrense bruken av antibiotika generelt."
Om riktigere antibiotikabruk
Om riktigere bruk av antibiotika skriver gruppa blant annet: "Arbeidsgruppen mener at riktig bruk av antibiotika til dyr bl.a. er avhengig av tilgang på vitenskapelig basert informasjon. Et viktig virkemiddel i denne sammenhengen vil være å etablere et produsent-nøytralt legemiddelinformasjonssenter i veterinærmedisinen på permanent basis etter samme modell som de sentra som er opprettet i humanmedisinen (RELIS). For øvrig må Norges veterinærhøgskole, via Institutt for farmakologi, mikrobiologi og næringsmiddelhygiene i samarbeid med de kliniske instituttene, fortsatt påta seg ansvar for informasjon, veiledning og oppdatering for riktig bruk av antibiotika hos veterinærstanden generelt.
Forskning vil kunne øke muligheten for å stille mer eksakte diagnoser og framskaffe bedre kunnskaper om riktig behandling av infeksiøse sykdommer. Eksakte diagnoser, anvendt kunnskap om aktuelt smittestoff og farmakokinetikk er viktige forutsetninger for at antibiotika skal bli brukt riktig i de forskjellige behandlings-situasjoner."
Om sykdomsforebyggende arbeid
Gruppa oppnevnt av Landbruksdepartementet gir også råd om forebyggende sykdomsarbeid generelt: "Arbeidsgruppen mener at det viktigste bidraget til fortsatt reduksjon av antibiotikaforbruket er økt satsning på forebyggende helsearbeid. Dette krever målrettet fokusering på forebyggende tiltak i forskning, undervisning og veiledning av veterinærer og produsenter. Det er videre viktig at det etableres økonomiske tiltak som kan motivere til økt forebyggende innsats hos de forskjellige aktørene i næringen.
Et viktig ledd i det sykdomsforebyggende arbeidet er tilgang på og bruk av effektive vaksiner og andre stoffer som stimulerer immun-forsvaret. Forskning som gir nye og mer effektive vaksiner og produkter som stabiliserer og potenserer normale forsvars-funksjoner vil kunne bidra til en dyrepopulasjon med en generell økt motstandskraft mot infeksiøse agens."
2.9 Forvaltning og tilsyn
2.9.1 Legemiddelforvaltning
Statens legemiddelkontroll (SLK) forsøker å være restriktive ved godkjenning av nye antimikrobielle midler, både på human- og veterinær-siden. Risiko for resistensutvikling inngår som en viktig del av vurdering av sikkerheten for et preparat, og flere preparater har ikke fått godkjenning eller bare begrenset godkjent bruksområde med henvisning til faren for økt resistens-utvikling. SLK legger også rekvireringsrestriksjoner på nye eller gamle preparater der det synes nødvendig for å motvirke unødvendig bruk. Videre er man restriktiv til spesielt godkjenningsfritak for antibiotika til veterinærmedisinsk bruk.
SLK søker råd hos sine rådgivende grupper i antibiotikaspørsmål og veterinærspørsmål (som har ett felles medlem) og hos Arbeids-grup-pen for antibiotikaspørsmål (AFA) under legeforeningen. Gruppa har utarbeidet en liste over antibiotika som ikke bør godkjennes til generell veterinær-medisinsk bruk av hensyn til faren for resistensutvik-ling på humansiden.
2.9.2 Tilsyn med smittevern og antibiotikarekvirering
Lov om statlig tilsyn med helsetjenesten pålegger Statens helsetilsyn og fylkeslegene å føre overodnet faglig tilsyn med helsetjenesten og helsepersonell, herunder med legers og tannlegers antibiotikarekvirering. Som et ledd i tilsynsvirksomheten har Statens helsetilsyn bestemt at fylkeslegene som felles tilsynsoppgave i 1999 skal føre tilsyn med smittevern i helseinstitusjoner. Erfaringene fra tilsynet vil gi grunnlag for rådgivning på området. Statens helsetilsyn har også en viktig funksjon som rådgiver for helsevesenet og utgir blant annet ei rekke veiledere som setter faglige standarder på ei rekke områder.
Med dagens lovverk vil Statens dyrehelsetilsyns muligheter for å påvirke og styre veterinære-nes rekvirering ligge i kunnskapsformidling og ved å gi føringer for hva Dyrehelse-tilsynet anser som "god veterinærskikk".
I forslaget til ny veterinærlov ligger det muligheter til å styre veterinærenes legemiddelbruk sterkere ved at Landbruksdeparte-mentet får muligheter til å
- gi forskrifter som regulerer veterinærers bruk av legemidler,
- forby rekvirering og bruk av enkelte legemidler, og
- muligheten til å frata en veterinær rekvisisjonsretten dersom rekvireringen er uforsvarlig eller i strid med lov eller forskrift.
Regelverket vedrørende fôrvarer er harmonisert med EUs regler, men Norge har unntak for bestemmelser om antibiotika, vekstfremmende stoffer, koksidiostatika og andre legemidler. Bare sinkbacitracin er nå godkjent for tilsetning til enkelte fôrblandinger i Norge, og det benyttes svært lite: 27 kg i heile 1997 og ingenting i de tre første kvartalene av 1998.
Avoparcin ble midlertidig forbudt som fôrtilsetning av Landbruksdeparte-mentet i 1995 og permanent fra 1996, etter innspill fra bl.a. Statens helsetilsyn. Virginiamycin ble midlertidig forbudt fra 1998 pga. mistanke om kryssresistens mot viktige human-medisinske antimikrobielle midler. Statens landbrukstilsyn følger situasjonen bl.a. i forhold til eventuell resistensutvikling ved bruk av koksidiostatika, og innhenter faglige råd fra Veterinærinstituttet.
Landbruksdepartementet har i januar 1999 sendt på høring en forskrift med forslag om forbud mot all bruk av antibiotika i fôr. Forslaget innebærer at det ikke vil bli gitt tillatelse til bruk av noen nye fôrantibiotika, at godkjenningen av sinkbacitracin blir trukket tilbake, og at det midlertidige forbudet mot virginiamycin gjøres permanent. Landbruksdepartementet har også bedt Veterinærinstituttet avgi en rapport om koksidiostatika innen utgangen av året.
2.9.3 Dyr og næringsmidler
EØS-avtalens vedlegg I ("veterinæravtalen")
Norge har forhandlet ferdig med EU en utvidelse av EØS-avtalens vedlegg I om handel med levende dyr og animalske næringsmidler. Utvidelsen trådte i kraft 1. januar 1999. Avtalen innebærer at blant annet at mulighetene for grensekontroll av animalske næringsmidler i det vesentligste falle bort.
Helsemessige konsekvenser
Ei gruppe under Statens næringsmiddeltilsyns vitenskapelige komité har vurdert de helsemessige konsekvenser av avtaleutvidelsen [35]. Gruppa mener bl.a. at kjøtt, melk og egg er de viktigste animalske næringsmidler som kan overføre resistente bakterier til mennesker. Resistente bakterier er vanligere hos husdyr i EU enn i Norge, men det er usikkert om forekomsten i næringsmidler er høyere. Det er videre høyere forekomst i EU av sykdom forårsaket av resistente bakterier, men det mangler epidemiologiske studier som kan si hvilken betydning importerte matvarer har. Gruppa konkluderer at det er "mulig" at endret importmønster kan endre smittepresset av resistente bakterier.
Antibiotika i husdyrholdet
Gruppa uttaler videre: "Bruk av antibiotika i husdyrholdet har ført til utvikling av resistens både hos bakterier som kan gi sykdom hos mennesker og hos bakterier i menneskets normalflora. Mens den medisinske betydningen av resistens hos sykdomsfremkallende bakterier (salmonellabakterier og andre) i næringsmidler er kjent, er betydningen av forekomst av resistente bakterier fra dyrs eller menneskers normalflora i næringsmidler ennå uklar. Undersøkelser gir grunnlag for å frykte at slike bakterier kan overføre sine resistensgener til tarmbakterier hos mennesker. Det er vist at overføring av slike gener lett skjer hvis forskjellige bakterier blandes."
Resistente bakterier hos dyr
"Vi vet at det er blitt importert mat som kan inneholde tarmbakterier med for oss uvanlige resistensmønstre. Dette ble dokumentert i forbindelse med shigellautbruddet i 1994, da det ble påvist varianter av E coli med resistensmønstre som tidligere ikke har vært påvist i vårt land. Det er delvis en svært omfattende bruk av antibiotika som vekstfremmende fôrtilsetningsmiddel i land utenom Norden. Også i Norge er det imidlertid problemer med resistente bakterier hos husdyr, særlig hos gris, mens situasjonen er god når det gjelder for eksempel mastittbakterier hos ku."
Resistente bakterier i næringsmidler
"Forekomsten av resistente bakterier i næringsmidler er neppe dokumentert skikkelig i noe land, men i Danmark er det startet et omfattende arbeid for å kartlegge dette. Foreløpige resultater indikerer en større forekomst av resistente bakterier i importerte enn i danske næringsmidler. Gruppen antar, men kan foreløpig ikke dokumentere, at forekomsten av antibiotikaresistente bakterier i næringskjeden er høyere i mange andre land enn i Norge."
Overvåkingsprogram
Statens næringsmiddeltilsyn har foreslått et overvåkingsprogram for antibiotikaresistente bakterier i ulike næringsmidler. Gruppa kommenterer dette slik: "Det er sterkt behov for en bedret kartlegging av situasjonen i Norge, både hos levende dyr og i næringsmidler. Metodikker m.m. er ikke avklart, og det vil ta tid før en kan danne seg et godt bilde av den reelle situasjonen. Det bør i første rekke legges mer innsats i kartlegging av situasjonen i våre egne husdyrbesetninger for å få en oversikt over situasjonen hos de dyr som danner grunnlaget for de næringsmidlene som finnes i det norske markedet. Ved undersøkelse i detaljleddet bør en starte med produkter der en antar at problemet kan være stort, og/eller der næringsmidler fra andre land kan antas å ha en høyere forekomst. Aktuelle eksempler er fjærfekjøtt og svinekjøtt."
Veterinærforeningen har engasjert seg sterkt mot utvidelsen av EØS-avtalen, blant annet fordi foreningen mener den vil øke risikoen for import av resistente bakterier til Norge med dyr eller animalske matvarer [36,37].
Genmodifiserte organismer
Stortinget vedtok i juni 1997 å forby produksjon, import og omsetning av alle genmodifiserte produkter som inneholder gener som koder for antibiotikaresistens og å arbeide for et internasjonalt forbud på dette området. Ifølge EØS-avtalen skal alle genmodifiserte produkter som er godkjent i EU, også kunne omsettes i Norge. Regjeringen har på grunnlag av stortingsvedtaket likevel besluttet å forby tre produkter som er godkjent i EU.
SNTs vitenskapelige komité har vurdert spørsmålet. Etter en risikovurdering konkluderer komitéen: "Overføring av antibiotikaresistens fra genmodifiserte matplanter til mikroorganismer kan ikke utelukkes. Konsekvensene av dette samt det forhold at det er mulig å fremstille genmodifiserte matplanter uten antibiotikaresistensgener, gjør at vi vil tilråde at genmodifiserte matplanter med antibiotikaresistensgener som gir resistens eller kryssresistens mot antibiotika som benyttes terapeutisk, prinsipielt ikke tillates. Mulig overføring av antibiotikaresistens fra mikroorganismer beregnet for mat representerer trolig en langt større risiko enn hva tilfellet er for genmodifiserte planter. Vi vil derfor tilråde at bruk av antibiotikaresistensgener i mikroorganismer beregnet for mat heller ikke tillates."
Statens forurensingstilsyn har fått utført undersøkelser som kan danne grunnlag for forvaltningen av spørsmål om utsetting av genmodifiserte organismer [38,39].
Statens forurensingstilsyn har satt i gang et arbeid om bruk av antibiotikaresistensmarkørgener i genmodifiserte mikrober. Dokumentet handler om risiko ved bruk av ulike markørgener og redegjør for bruk av alternative markørgener. Dokumentet skal etter planen bli en faglig anbefaling til EU-kommisjonen om hvordan søknad om utsetting av slike mikrober skal behandles.
Miljømyndighetene arbeider for forbud mot bruk av antibiotikaresistensmarkørgener på en rekke internasjonale arenaer, bl.a. i EU, OECD og under Biodiversitetskonvensjonen. Den siste tida har temaet vært kraftig debattert i EU. Østerrike og Frankrike har forbudt produkter med slike gener.
Annet
Forskrift om deklarering og merking av mikrobiologiske produkter ble vedtatt i 1998. Her stilles det bl.a. krav om at produsenter og importører av slike produkter skal gi opplysninger om mikroorganismene i de enkelte produktene er resistente mot visse antimikrobielle midler. Dersom mikroorganismene i slike produkter er resistente, vil Statens forurensningstilsyn med hjemmel i produktkontrolloven vurdere om produktet skal forbys.
Statens næringsmiddeltilsyn har gitt forskrifter som ikke tillater omsetning av næringsmidler ved funn av restmengder av antibiotika.
2.10 Litteratur
1. Hasseltvedt V. Infeksjoner forårsaket av penicillinresistente pneumokokker (PRP) og vankomycinresistente enterokokker (VRE). SHE-nytt 1998; 2: 6. 2. Hasseltvedt V, Lystad A. Sykdom forårsaket av MRSA i Norge, 1.1.95 - 15.10.98. MSIS-rapport 1998; 26. 42. 3. Aavitsland P, Nilsen Ø. Betalaktamaeproduserande gonokokkar (PPNG) i 1997. Resistens 1998; 2: 6. 4. Heldal E, Sandven P. Resistens ved tuberkulose i Norge 1995-96. Resistens 1998; 2: 3. 5. Digranes A, Solberg CO, Sjursen H, Skovlund E, Sander J. Antibiotic susceptibility of blood culture isolates of Enterobacteriaceae from six Norwegian hospitals 1991-1992. APMIS 1997; 105: 854-60. 6. Aavitsland P, Lystad A. Norsk overvakingssystem for resistens hos mikrobar (NORM). Resistens 1998; 2: 16. 7. www.earss.rivm.nl 8. Bronzwaer SLAM, Sprenger MJW. A surveillance system for Europe. BMJ 1998; 317: 615. 9. Løvseth A, Kruse H. Kartleggingsprogram - importerte næringsmidler høsten 1997. Oslo: Veterinærinstituttet, 1998. 10. Kruse H. Kartlegging av forekomst av antibiotikaresistente bakterier i norsk kjøtt og kjøttprodukter. Oslo: Veterinærinstituttet, 1998. 11. Norsk Medisinaldepot. Legemiddelforbruket i Norge 1993-1997. Oslo: Norsk medisinaldepot, 1998. 12. Bergan T, Bruun JN, Digranes A, Lingaas E, Melby KK, Sander J. Susceptibility testing of bacteria and fungi. Scand J Infect Dis 1997 (supplementum 103): 1-36. 13. Sandven P, Caugant D. Tuberkulose i Arkhangelsk og Murmansk. Resistens 1998; 1: 3. 14. Gruppe for kvalitetsutvikling i helsetjenesen. Sår hals - piller, trøst eller begge deler? Oslo: Allmennpraktiserende legers forening og Norsk selskap for allmennmedisin, 1999. 15. Legemiddelkomitéen. Veiledning i antibiotikabruk, Regionsykehuset i Trondheim. Trondheim: Regionsykehuset i Trondheim, 1998. 16. Legemiddelkomitéen. Veiledning i bruk av antibiotika. Bergen: Haukeland sykehus, 1996. 17. Høiby EA, Sandven P, Lassen J, Kvaløy S, Vorkinn E, Holte H, Aas N, Giercksky K-E, Danielsen S, Wæhre H, Rindal R, Aune H, Kongsgaard U, Kristensen G, Slørdal L, Vilberg A, Hov A, Nordal H. Antimikrobielle midler. Grunnlag for fornuftig bruk. Oslo: Det Norske Radiumhospital og Statens institutt for folkehelse, 1997: 1-224. 18. Statens legemiddelkontroll. Terapianbefalinger: bruk av antibakterielle midler til produksjonsdyr. Nytt om legemidler 1998; 21 (supplement 1): 1-71. 19. Bjartveit K, Eilertsen E, Heldal E, Sandven P, Øvreberg K. Kontroll av tuberkulose. Håndbok for kommunehelsetjenesten. 3. utg. IK-2551. Oslo: Statens helseundersøkelser og Statens helsetilsyn, 1996. 20. Statens institutt for folkehelse og Statens helsetilsyn. Smittevern i helseinstitusjoner - sykehusinfeksjoner. IK-2532. Oslo: Statens institutt for folkehelse og Statens helsetilsyn, 1996. 21. Nøkleby H, red. Veiledning om vaksinasjon, 1998. Oslo: Statens institutt for folkehelse, 1998. 22. Blystad H, red. Smittevernhåndbok for kommunehelsetjenesten 1999-2000. Oslo: Statens institutt for folkehelse, 1998. 23. Melbye H, Aaraas I, Fleten N, Kolstrup N, Mikalsen JI. Nytten av å teste C-reaktivt protein ved mulig nedre luftveisinfeksjon. Tidsskr Nor Lægeforen 1995; 115: 1610-5. 24. Lindbæk M, Hjortdahl P, Johnsen UL. Use of symptoms, signs, and blood tests to diagnose acute sinus infections in primary care: comparison with computed tomography. Fam Med 1996; 28: 183-8. 25. Lindbæk M, Hjortdahl P, Johnsen UL. Randomised, double blind, placebo controlled trial of penicillin V and amoxycillin in treatment of acute sinus infections in adults. BMJ 1996; 313: 325-9. 26. Bærheim A. Single-dose versus five-day treatment with trimethoprim for the acute dysuria/pyuria syndrome in women. Scand J Prim Health Care 1987; 5: 87-90. 27. Straand J, Rokstad K, Heggedal U. Drug prescribing for children in general practice. A report from the Møre & Romsdal Prescription Study. Acta Paediatr 1998; 87: 218-24. 28. Straand J, Rokstad KS, Sandvik H. Prescribing systemic antibiotics in general practice. A report from the Møre & Romsdal Prescription Study. Scand J Prim Health Care 1998; 16: 121-7. 29. Kruse H. The use of avoparcin as a feed additive and the occurrence of vancomycin resistant enterococcus spp. in poultry production. Oslo: Norges veterinærhøgskole og Veterinærinstituttet, 1995. 30. Simonsen GK, Olsvik Ø, Sundsfjord A. Punktprevalensundersøkelse av vankomycinresistente enterokokker. Resistens 1998; 2: 3-4. 31. Lunestad BT, Samulesen OB, Fjelde S, Ervik A. Photostability of eight antibacterial agents in seawater. Aquaculture 1995; 134: 217-25. 32. Samuelsen OB, Lunestad BT, Ervik A, Fjelde S. Stability of antibacterial agents in an artificial marine aquaculture sediment studied under laboratory conditions. Aquaculture 1994; 126: 283-90. 33. Samuelsen OB, Solheim E, Lunestad BT. Fate and microbiological effects of furazolidone in a marine aquaculture sediment. Sci Total Environ 1991; 108: 275-83. 34. Landbruksdepartementets arbeidsgruppe for vurdering av antibiotikabruk. Vurdering av antibiotikabruk til dyr. Oslo, 1997. 35. SNTs vitenskapelige komité. Helsemessige konsekvenser av en mulig utvidelse av EØS-avtalens vedlegg I. Oslo: Statens næringsmiddeltilsyn, 1997. 36. Skjerve E, Grønstøl H, Rimstad E, Sandvik O, Skulberg A. Matvarekvalitet, dyrehelse og internasjonal handel. Nor Vet Tidsskr 1996 (supplement 6B): 1-219. 37. Hellesnes I. Utvidelse av EØS-avtalens vedlegg I. Med en vurdering av foreslåtte endringer og kompensatoriske tiltak på næringsmiddelområdet. Oslo: Den norske veterinærforening, 1998. 38. Kruse H, Jansson J. The use of antibiotic resistance genes as marker genes in genetically modified organisms. 97:03. Oslo: Statens forurensingstilsyn, 1997. 39. Wiik R, Myhrvold AN, Larsen HS. Åpen bruk av naturlige og genmodifiserte mikroorganismer. Status og framtidsperspektiver. 97:17. Oslo: Statens foruren-singstilsyn, 1997. Lagt inn 4. februar 1999 av Statens forvaltningstjeneste, ODIN-redaksjonenDel 3: Internasjonale planer og anbefalinger
3.1 Innledning
Det siste tiåret har resistens vært tema for ei rekke utredninger og resolusjoner i land vi kan sammenlikne oss med og i internasjonale organer. Nedenfor gir vi et sammendrag av og utdrag fra (vår oversettelse) de nyeste og viktigste. Vi forsøker ikke å gi noen fullstendig oversikt over de enkelte lands ulike strategier, programmer, systemer og tiltak, men gjengir noen som vi mener kan ha særlig relevans for norske forhold.
3.2 Verdens helseorganisasjon (WHO)
3.2.1 Verdenshelseforsamlingen 1998
Verdenshelseforsamlingen drøftet resistens i 1995 og på ny i 1998. 16. mai 1998 vedtok Verdenshelseforsamlingen en resolusjon [1] der medlemslandene sterkt oppfordres til å:
"1 oppmuntre til utvikling av bærekraftige systemer for å oppdage antibiotikaresistente patogener og dermed øke oppmerksomheten om antibiotikaresistens, og monitorere volumet av og mønsteret for bruk av antibiotika og innvirkningen av kontrolltiltak;
2 utvikle utdanningsprogram for profesjonelle og lekfolk for å oppmuntre til riktig og kostnadseffektiv bruk av antibiotika;
3 forbedre praksiser for å forebygge spredning av infeksjoner og dermed spredning av resistente patogener og å fremme riktig antibiotikabruk i helseinstitu-sjoner og i samfunnet, og å redusere bruken av antibiotika til matproduserende dyr;
4 utvikle tiltak for å beskytte helsepersonell mot farene ved resistente patogener;
5 utvikle tiltak for å forby utlevering av antibiotika uten resept fra kvalifisert helsepersonell;
6 forsterke lovgivningen for å forebygge produksjon, salg og distribusjon av etterlikninger av antibiotika og hindre salg av antibiotika på det uformelle markedet;
7 sette i verk tiltak for å oppmuntre til redusert bruk av antibiotika til matproduserende dyr".
3.2.2 Antibiotika til matproduserende dyr
Dette var temaet på et ekspertmøte i WHOs regi i Berlin oktober 1997 [2]. Bakgrunnen for møtet var bekymring over bruken av antibiotika til matproduserende dyr, selv om det er uklart hvor stor betydning dette har for folkehelsa. Man slo fast at antibiotika brukes i utstrakt grad i husdyr-, fiske- og planteproduksjonen. Formålet med møtet var derfor todelt. Man skulle finne en internasjonal konsensus om de prioriterte medisinske problemer som følge av bruk av antibiotika i husdyrholdet, og man skulle gi WHO anbefalinger om de neste steg mot utvikling av retningslinjer for kontroll og avgrensning av utviklingen av medisinsk relevant resistens hos matproduserende dyr.
Møtet ga ei rekke anbefalinger om generelle forhold, resistensovervåking, antibiotikabruk og forskning, blant annet:
- "Bruk av antimikrobielle middel som vekstfremmer til dyr bør opphøre dersom middelet benyttes terapeutisk til mennesker, eller dersom det er kjent for å selektere for kryssresistens mot midler som benyttes i humanmedisinen.
- Landene bør undersøke og overvåke prevalensen av resistente bakterier i matproduserende dyrepopulasjoner og animalske næringsmidler.
- Overvåking bør starte med vakttårnsprosjekter av isolater som allerede samles inn i samband med andre sykdomskontrollprogrammer (f.eks. Salmonella), de større terapeutiske antibiotika og isolater fra svin og kylling.
- Overvåkingsprogrammer for antimikrobiell resistens hos isolater fra matdyr og animalske næringsmidler må gi mulighet for å sammenholde data fra dyr, mat og mennesker."
Rapporten gir så ei rekke detaljerte råd om utforming av de nasjonale overvåkingsprogrammer.
Rapporten foreslår at landene undersøker antibiotikabruken til dyr og utformer en nasjonal politikk. Denne må følges opp med utdanning av rekvirenter og bønder, rekvireringsregler, standarder for husdyrhold og tiltak som tar sikte på at regelverket håndheves.
3.2.3 Strategier for forebygging
I en artikkel i WHOs uketidsskrift i november 1997 [3] foreslår organisasjonen fire tiltak for å senke hastigheten i framvekst og spredning av antibiotikaresistens:
- "Overvåking for å definere utbredelsen av resistens blant ulike patogener og i ulike populasjoner for å kunne tilpasse behandlingsstrategier og nasjonal legemiddel-politikk, og for å kunne måle suksessen til intervensjonstiltak.
- Utdanning av beslutningstakere, rekvirenter, helsepersonell og publikum for å redusere overforbruk og misbruk av antibiotika.
- Lovregulering for å sikre maksimal tilgjengelighet og kvalitet av antibiotika i alle markeder i verden, tilskyndelse og overholdelse av patentlover, og kontroll med uetisk reklame for antibiotika.
- Forskning: Undersøkelse av kostnader forbundet med resistens og kostnadseffektivitet ved deteksjon av resistens. Sammenholding av laboratoriedata om resistens med behandlingsresultat. Utvikling av nye midler med nye virknings-mekanismer."
I februar 1998 fulgte lederen for smittevernavdelingen i WHO og hans medarbeider opp denne artikkelen med en ny artikkel i tidsskriftet Science [4]. Her legger de fram en strategi i tre punkter for kontroll med resistensproblemet:
- For det første må man få mer fornuftig bruk av antibiotika i medisinen. Laboratorie-ne må kunne isolere bakteriene, teste antibiotikafølsomhet og raskt formidle svaret til klinikeren. Laboratoriene bør delta i eksterne kvalitetssikringssystemer. Empirisk behandling, det vil si behandling før eller uten mikrobiologisk diagnose, må følge retningslinjer som blir oppdatert med jevne mellomrom. De må bygge på overvåking av de lokale resistensforholdene. Man må ha et system for å overvåke at helsepersonell følger retningslinjene.
- For det andre må man redusere bruken av antibiotika utenfor medisinen. Antibiotika må bare utleveres mot resept fra kvalifisert helsepersonell. Rekvirenten må ikke ha økonomiske interesser i salget av antibiotika. Man må bekjempe forfalskete og dårlige antibiotika og selvmedikasjon.
- For det tredje må man redusere spredningen av resistente mikrober. De samme smittevernprinsippene gjelder ved resistente bakterier som ved andre bakterier. Smitteverntiltak bør forsterkes i alle land.
Forfatterne innrømmer at denne strategien ikke er ny eller grensesprengende, og de peker på fem hjelpemidler for å implementere strategien:
- Utdanning av helsepersonell i korrekt bruk av antibiotika, publikum i generell hygiene og fordeler og ulemper ved antibiotika, og laboratoriepersonell i påvisning av bakteriene og resistenstesting.
- Innføring av tekniske nyvinninger, særlig forenklete diagnostiske tester som kan gi diagnosen mens pasienten er hos legen.
- Overvåking av resistens og antibiotikabruk.
- Lover som hindrer at helsepersonell tjener penger på rekvirering av antibiotika, som stopper reseptfritt salg av antibiotika, og som hindrer at antibiotika av dårlig kvalitet kommer på markedet.
- Forskning for blant annet å optimalisere bruken av antibiotika, for å utarbeide bedre retningslinjer, og for å utvikle tiltak som kan kontrollere resistens.
3.2.4 Resistensovervåking i Europa
WHO arrangerte i desember 1997 et møte i Verona om resistensovervåking i Europa [5]. De viktigste konklusjonene fra møtet var:
- " Kommunikasjonen mellom overvåkingsnettverk for resistens og nasjonale og regionale beslutningstakere må styrkes og utnyttes. Mye brukbar informasjon om antimikrobiell resistens blir allerede generert i Europa. Denne informasjonen når imidlertid ikke fram til de personene som er ansvarlige for å utvikle og implementere den nasjonale antibiotikapolitikken og andre retningslinjer for helsetjenesten.
- Et nøkkelelement i gode overvåkingsprogrammer for antimikrobiell resistens er vekten som legges på veldefinert og implementert kvalitetssikring for å sikre gyldighet, kvalitet og sammenliknbarhet av de genererte data. Det er behov for å harmonisere kvalitetssikringsstandarder i Europa.
- Det er nødvendig med tilstrekkelig støtte til utdanningsprogrammer i mikrobiolo-gi og epidemiologi, laboratorieinfrastruktur og dataanalyse og -kommunikasjon. Man kan gjøre fremskritt ved å utnytte de talenter og den kapasitet som allerede fins i Europa og ved å styrke denne kapasiteten gjennom utdanning og utvikling av regionale partnerskap under forutsetning av at økonomisk støtte er tilgjengelig.
- Utvikling og spredning av antimikrobiell resistens kan ikke håndteres av land eller grupper som arbeider isolert. Koordinering og samarbeid som omfatter heile Europa er kritiske elementer i effektive tilnærminger. Flere drøftinger er nødvendige for å utvikle samarbeid mellom eksisterende overvåkingsprogrammer for antimikrobiell resistens."
3.3 Den europeiske union (EU)
3.3.1 Københavnerklæringen
Etter et initiativ fra den dan-ske helsedirektøren anbefalte EUs helsedirektø-rer å styrke arbeidet mot resistens. Som en start på dette arbeidet arrangerte den danske regje-ringen en europeisk konfe-ranse i Køben-havn 7.-10. septem-ber 1998. Konferansens slutterklæring [6] og bakgrunnsdokumentene gir ei rekke anbefalinger. Hovedanbefalingene er:
- "Den europeiske union og medlemslandene må anerkjenne at antibiotikaresistens er et stort europeisk og globalt problem.
- Farmasøytiske firma bør oppfordres til å utvikle nye antibiotika, men disse vil ikke løse problemene i den nærmeste fremtid.
- Den europeiske union og medlemslandene bør sette opp et euro-peisk overvåkings-system for antibiotikaresistens.
- Den europeiske union og medlemslandene trenger å samle data om forsyning og forbruk av antibiotika.
- Den europeiske union og medlemslandene bør oppfordre til å ta i bruk en rekke tiltak for å fremme fornuftig bruk av antibiotika.
- Den europeiske union, medlemslandene og nasjonale forsk-ningsråd bør prioritere koordinert forskning om antibiotikaresistens.
- Man bør finne en måte å vurdere fremdriften i oppfølgingen av disse anbefalinge-ne og forslagene på."
Den danske helseministeren tar nå med seg dokumentet til sine kolleger i EUs ministerråd. Oppfølgingen vil skje blant annet i forhold til EU-kommisjonens forsknings- og folkehelseprogrammer. Det synes allerede klart at det tyske formannskapet (første halvår 1999) vil forsere arbeidet med å etablere et overvåkingssystem for antibiotikaforbruk.
Antakelig vil Københavnerklæringen markere et vendepunkt i EUs innstilling til resistensproblemene. Det er ventet at EU heretter vil legge mer vekt på resistens-problemene, bl.a. i forhold til regulering av legemidler og fôrantibiotika.
3.3.2 Arbeidsgruppe
I lys av blant annet Københavnerklæringen har EU-kommisjonens 24. generaldirektorat høsten 1998 satt ned ei tverrfaglig arbeidsgruppe på området bruk av antibiotika. Gruppa skal blant annet "foreta en vitenskapelig evaluering av den nåværende situasjonen vedrørende utbredelse og utvikling av antimikrobiell resistens og undersøke implikasjonene for humanhelse og dyrehelse, særlig vedrørende utvikling og håndtering av infeksjoner. Gruppa skal evaluere faktorer som forårsaker dagens situasjon, undersøke måter å influere eller kontrollere utviklingen av antimikrobiell resistens på og gi anbefalinger basert på vitenskapelige bevis. Gruppa skal også gi råd om overvåking av resultatene av de tiltak gruppa foreslår og ta hensyn til de implikasjoner rådene får.
3.3.3 Den økonomiske og sosiale komité
Den økonomiske og sosiale komitéen skal representere forbrukerne i EU-landene. Komitéen har ingen formell beslutningsmyndighet, men skal uttale seg om saker som behandles av myndighetsorganene i EU. I september 1998 vedtok komitéen en uttalelse om resistens som trussel mot folkehelsa [7]. Man forklarer her først fenomenet resistens og dets årsaker, beskriver de pågående initiativer for å bekjempe problemet og foreslår framtidige tiltak på nasjonalt nivå og unionsnivå. Blant anbefalingene er følgende:
Antibiotikabruk til mennesker og dyr: god praksis
- " Kommisjonen bør oppmuntre til og støtte utviklingen av retningslinjer i alle medlemslandene for fornuftig antibiotikabruk innen human- og veterinærmedisinen. Retningslinjene bør regelmessig oppdateres med bakgrunn i ny vitenskapelig kunnskap og klinisk erfaring og bør tilpasses den lokale antibiotikapolitikken og resistensforholdene. Selv om slike retningslinjer bare skal betraktes som anbefalinger og støtte for beslutninger heller enn strenge reguleringer som kunne innskrenke legers terapeutiske muligheter, er det viktig å overvåke hvor godt retningslinjene overholdes.
- Fornuftig bruk av antibiotika vil best sikres dersom reseptfritt salg unngås. Derfor bør man gå imot forsøk på å ta bort reseptstatus på antibiotika. Rekvirering må, med andre ord, fortsatt være en sak for leger og veterinærer.
- Bruk av antibiotika til dyr må begrenses til veletablerte veterinærmedisinske formål."
Overvåking av antibiotikabruk
- " Det er avgjørende med en vedvarende oversikt over volumet og mønsteret av antibiotikabruk. Følgelig må hvert medlemsland sette opp systemer som kan samle og analysere relevant informasjon."
- " I tillegg til nasjonale systemer, må det etableres et europeisk samlingspunkt for koordinering og utveksling av informasjon fra medlemslandene."
Overvåking av resistens
- " For å overvåke og analysere den nasjonale og den europeiske resistenssituasjonen må det etableres nasjonale overvåkingssystemer for resistens, jfr. de ovenfor foreslåtte systemene for overvåking av antibiotikabruk. Systemene bør inkludere data om resistens hos bakterier fra dyr. Resistens bør overvåkes i sykdomsframkallende bakterier, zoonotiske bakterier og indikatorbakterier. Samlet overvåking av resistensmønstre i mennesker og dyr kan legge til rette for større forståelse av samhandlingen mellom økologiske systemer og gi en plattform for forskningssamarbeid. Systemet må kunne gi et presist bilde av det nasjonale problemet og, med tanke på sammenlikninger, dekke ekstern kvalitetssikring av laboratoriemetoder. Ved utviklingen av systemet kan de første tiltakene for eksempel konsentreres om overvåking av meticillinresistente gule stafylokokker, vankomycinresistente enterokokker, penicillinresistente pneumokokker og multiresistente gramnegative bakterier fra blodkulturer. Medlemslandene bør rapportere om utviklingen i resistens minst ei gang i året."
- " I tillegg til de nasjonale overvåkingssystemene må det etableres et europeisk samlingspunkt som blant annet skal samle og analysere informasjon fra medlemslandene og sikre full sammenliknbarhet mellom de nasjonale data."
Smittevern i helseinstitusjoner
- " Alle medlemsland bør utvikle nasjonale standarder for smittevern i helseinstitusjoner. Dersom man allerede har slike, bør de gjennomgås med tanke på å minimalisere spredningen av resistente bakterier. I denne sammenheng bør man også vurdere kvalitetskontrollsystemer som inkluderer lokal overvåking av resistensmønstre, antibiotikabruk og opplæringsaktiviteter. Infeksjonskontrollprogrammer som inkluderer en velutdannet hygienekomité, bør være en sentral del av god sykehusdrift og bør få tilstrekkelige ressurser."
Forskning
- " Det er et presserende behov for bedre forståelse av de risikofaktorene som er involvert i framveksten og spredningen av antibiotikaresistens. Man bør prioritere forskning som:
- anslår risikoen for at de enkelte antibiotika skal miste sin effektivitet pga. resistens gjennom å gjøre kvantitative studier av utvikling av resistens i en bakteriepopulasjon og gjennom å forbedre utformingen av kliniske studier,
- forbedrer vår forståelse av smittsomheten av resistente bakterier i ulike økologiske nisjer, for eksempel i pasienter i og utenfor sykehus, i ulike dyrepopulasjoner og i miljøet,
- studerer innvirkningen av ulike antibiotikabruksvaner for utviklingen av resistens i de enkelte medlemslandene,
- resulterer i antibiotikaregimer (dose og varighet) som er optimale med tanke på å redusere risikoen for resistensutvikling,
- utvikler nye hurtigtester som setter allmennlegen i stand til enkelt å identifisere hvilken mikrobe som er årsak til sykdommen og til å bestemme dens resistens, og
- utvikler nye, effektive vaksiner mot bakterier."
Utdanning og andre tiltak
- " Én enkelt myndighet i EU ( European Medicines Evaluation Agency, EMEA, som inkluderer EØS-landene og de sentral- og østeuropeiske landene) må bli ansvarlig for søknader om markedsføringstillatelse for antibiotika for bruk til mennesker og dyr. Konseptet med en sentralisert prosedyre må utvides."
- " Antibiotikaresistens bør betraktes som en indirekte bivirkning av antibiotika. Etter at et legemiddel har fått markedsføringstillatelse, må resistensforholdene overvåkes som en spesifikk del av overvåkingen av manglende virkning av legemidlet."
- " Kommisjonen bør ta initiativ til og støtte en multimediakampanje i regi av medlemslandene for å informere publikum om infeksjoner, hygiene og antibiotika, slik at man styrker oppmerksomheten om antibiotika og gjør publikum (for eksempel foreldre, lærere og skolebarn) kjent med fakta.
- Medlemslandene bør aktivt støtte aktivitetene til smittevernavdelingen i Verdens helseorganisasjon og dens Antibiotic Resistance Monitoring-program."
3.4 USA
3.4.1 Institute of Medicine
Institute of Medicine er kongressens medisinske utredningsinstitutt. Instituttet har et Forum on Emerging Infections som i 1997 diskutere problemområder og mulige løsninger vedrørende resistens [8]. Bakgrunnen var at resistensproblemet i USA så ut til å øke stadig raskere samtidig som man hadde stadig færre virksomme antibiotika tilgjengelig. Innledningsvis peker rapporten fra arbeidsmøtet blant annet på følgende forhold i USA:
- Mer enn 90% av gule stafylokokk-stammer er resistente overfor penicillin og liknende antibiotika.
- Det er en alarmerende økning i hyppigheten av sykehusinfeksjoner med vankomycinresistente enterokokker.
- I noen områder av USA er heile 40% av pneumokokkstammer delvis eller fullstendig resistente overfor penicillin.
- Resistente bakterier medfører kostnader på 35 milliarder kroner årlig i USA.
Arbeidsmøtet diskuterer og gir forslag til mulige (og alternative) tiltak på flere områder:
- Overvåkingssystem for antibiotikaresistens og for antibiotikaforbruk må opprettes og ses i sammenheng.
- NCCLS-retningslinjene for resistensbestemmelser må distribueres videre og oppdateres oftere enn nå.
- Sammenhengen mellom antibiotikabruk i landbruket og resistens hos mennesker må studeres nærmere.
- Alle relevante fagmiljøer må gå sammen om å lage samlete retningslinjer for antibiotikabehandling. Disse må innføres vidt og jevnlig oppdateres.
- Man må ta i bruk ulike strategier for å påvirke holdninger og atferd til alle dem som er involvert i antibiotikaproblemet for å oppnå fornuftig bruk av antibiotika.
- Risikoen ved ufornuftig bruk av antibiotika må kvantifiseres.
- Det må forskes mer på effekten på behandlingsresultatet av kortere antibiotikakurer og andre doseringer som et grunnlag for å oppdatere retningslinjer og preparatomtaler.
3.4.2 Centers for Disease Control and Prevention (CDC)
Smittevernplan
CDC er USAs folkehelseinstitutt og har smittevern som en av sine hovedoppgaver. Instituttet er et nasjonalt og internasjonalt høyt respektert faginstitutt som ikke har vedtaksmyndighet fastsatt i lov, men som samarbeider med og gir råd til føderale og statlige myndigheter. I 1994 la CDC en plan for å gjenoppruste smittevernet i USA [9]. I oktober 1998 ble denne planen oppdatert med fase 2: Preventing emerging infectious diseases: a strategy for the 21st century [10].
I planen sees resistensproblemet i sammenheng med andre smittevernproblemer. Planen retter seg mot ni problemområder. Antibiotikaresistens nevnes som det første av disse. Blant de andre er næringsmiddelbårne sykdommer, zoonotiske sykdommer og sykdommer som overføres med blod. Planens hovedmål og delmål er:
Overvåking
"Hovedmål I: Overvåking og respons. Oppdag, etterforsk og overvåk framvoksende smittestoffer, sykdommene de forårsaker, faktorer som påvirker framveksten, og sett inn tiltak mot problemene etterhvert som de oppdages.
Delmål A: Styrk overvåkingen av smittsomme sykdommer og tiltakene mot dem.
Delmål B: Forbedre metodene for samling og vurdering av overvåkingsdata.
Delmål C: Sørg for at overvåkingsdata benyttes til å forbedre smittevernet og medisinsk behandling.
Delmål D: Styrk den verdensomspennende kapasiteten for overvåking og tiltak mot framvoksende smittsomme sykdommer.
Laboratorievitenskaper og epidemiologi
Hovedmål II: Integrer laboratorievitenskapene og epidemiologi for å optimalisere smittevernarbeidet.
Delmål A: Utvikle, evaluer og spred utstyr for å identifisere og forstå framvoksende smittsomme sykdommer.
Delmål B: Identifiser atferd, miljøfaktorer og vertsfaktorer som øker risikoen for smittsomme sykdommer og deres følgetilstander.
Delmål C: Utfør forskning for å utvikle og evaluere smittevernstrategier på de ni problemområdene.
Infrastruktur og utdanning
Hovedmål III: Infrastruktur og utdanning. Stryk den offentlige smitteverninfrastrukturen som støtte for overvåking, forskning og innføring av smitteverntiltak.
Delmål A: Styrk den epidemiologiske kapasiteten og laboratoriekapasiteten.
Delmål B: Forbedre CDCs muligheter til å kommunisere elektronisk med statenes og fylkenes helseråd, grensestasjonene, helsepersonell og andre.
Delmål C: Styrk landets muligheter til å iverksette tiltak mot komplekse smitteverntrusler i USA og internasjonalt, inkludert utbrudd som kan være forårsaket av bioterrorisme.
Delmål D: Tilby utdanningsmuligheter i infeksjonsepidemiologi og -diagnostisering i USA og i resten av verden.
Smittevern
Hovedmål IV: Smittevern. Sørg for rask innføring av smittevernstrategier og styrk kommunikasjonen med publikum om framvoksende smittsomme sykdommer.
Delmål A: Innfør, støtt og evaluer smittevernprogrammer mot framvoksende smittsomme sykdommer.
Delmål B: Utvikle, evaluer og markedsfør strategier for å hjelpe helsepersonell og andre til å atferd som fremmer smitte.
Delmål C: Støtt og markedsføre smittevern internasjonalt."
Overvåking
CDCs smittevernavdelinger er inndelt etter smittestoff. Hver avdeling overvåker også resistens hos "sin" mikrobe. Man overvåker resistens hos pneumokokker, gonokokker, tuberkelbakterier, matbårne mikrober, mikrober som gir sykehusinfeksjoner, malariaparasitten, humant immunsviktvirus (HIV) og herpes simplex virus.
Informasjonskampanje
CDC har sammen med USAs barnelegeforening iverksatt en informasjonskampanje for leger og publikum. Grunnlaget for kampanjen var blant annet forskning for å sette sammen den tilgjengelige forskningen vedrørende antibiotikabehandling ved luftveisinfeksjoner, og forskning om publikums og legers holdninger og atferd vedrørende antibiotika. Kampanjen består av blant annet følgende elementer:
- Vitenskapelige oversiktsartikler om antibiotikabehandling publisert i verdens største tidsskrift for barnemedisin [11].
- Énsides huskelapper på stivt papir for leger med følgende temaer: Diagnostikk og behandling av ørebetennelse, halsbetennelse, bihulebetennelse og bronkitt og hoste (en lapp hver pluss en oppsummeringslapp). Resistens og antibiotikabruk. Tips for god praksis.
- En generell brosjyre for småbarnsforeldre om antibiotika: "Ditt barn og antibiotika. Unødvendige antibiotika kan være skadelig."
- En standard sykdomsattest som fylles ut av legen, og som foreldrene kan gi til barnehagen. Her gis diagnosen, det forklares hvorfor barnet ikke trenger antibiotika og det anbefales at barnet kan komme tilbake i barnehagen når det ikke lenger har feber. Formålet er å komme i møte de barnehagene som krever at barn med feber må ha brukt antibiotika i noen dager før de kan komme tilbake i barnehagen.
- Énsides informasjonsark til foreldrene med spørsmål og svar om ørebetennelse og rennende nese.
- Informasjonslapp til foreldrene utformet som en resept med anbefalinger om hvilke tiltak (som mye drikke, febernedsettende medisin mv.) som foreldrene kan benytte for å lindre barnets plager.
3.4.3 American Society for Microbiology
Denne foreningen har 40 000 medlemmer fra ei rekke fagområder, hovedsakelig medisinsk mikrobiologi og hovedsakelig fra USA. Ei arbeidsgruppe i foreningen utredet i 1995 resistensproblemet [12] og ga tre hovedanbefalinger:
- " Et nasjonalt overvåkingssystem for antibiotikaresistens bør straks etableres.
- Utdanning av fagpersoner og publikum om smittsomme sykdommer og antibiotika må styrkes for å redusere unødvendig bruk av antibiotika.
- Det er umiddelbart behov for mer basalforskning med tanke på å utvikle nye antibiotika, effektive vaksiner og andre smitteverntiltak."
Blant de enkelte tiltakene under den tredje anbefalingen nevnes:
- " Det er nødvendig med mer basalforskning for å finne de genetiske og metabolske prosesser, inkludert reguleringsfaktorer, som bestemmer virulens og antibiotikafølsomhet i bakterier som er viktige innen human- og veterinærmedisinen."
- " Det trengs mer ressurser for å kunne sekvensere heile genomet til sykdomsframkallende mikrober i et forsøk på å identifisere felles mål for antibiotika.
- Det trengs mer grunnforskning for å bestemme spredningsmekanismene for smittestoffer, særlig i lukkete miljøer som sykehus, barnehager og matproduksjonssteder.
- Det trengs mer grunnforskning for bedre å forstå mikrobegenetikk og utviklingen av antibiotikaresistens, særlig hos sopp og nyoppdagete smittestoffer.
- Det trengs forskning for å utvikle pålitelige hurtigtester for spesifikke smittestoffer. Mer klinisk og epidemiologisk forskning er nødvendig for å bestemme den kliniske betydningen av infeksjoner med resistente smittestoffer og for å identifisere det optimale behandlingsvalget for resistente stammer. Mer klinisk forskning trengs for å klarlegge årsakene til ørebetennelser og luftveisinfeksjoner i alle aldersgrupper.
- Evolusjonslovene tilsier at mikrober før eller seinere vil bli resistente mot nesten alle antibiotika. Derfor trengs det mer grunnforskning for å tilrettelegge for utvikling av effektive vaksiner og andre smitteverntiltak. Vaksiner er de mest kostnadseffektive smittverntiltak for mange sykdommer."
3.5 United Kingdom (UK)
3.5.1 Overhuset
I mars 1998 avga vitenskapskomitéen i det britiske Overhuset en rapport om antibiotikaresistens [13]. I sin innledning skriver komitéen at undersøkelsen har vært en alarmerende opplevelse som har overbevist medlemmene om at antibiotikaresistens er en stor folkehelsetrussel som bør anerkjennes som dette i større grad enn i dag. Etter et innledende historisk og teknisk kapittel om resistens drøfter og foreslår komitéen tiltak innen områdene: fornuftig bruk av antibiotika til dyr og mennesker, sykehushygiene, overvåking av resistens, nye antibiotika og vaksiner, legemidler mot virus, internasjonale forhold og forskning. Komitéen avslutter med ei rekke anbefalinger innen de nevnte områdene, deriblant:
Fornuftig bruk av antibiotika til mennesker
- " For å oppnå mer fornuftig bruk av antibiotika bør helsemyndighetene styrke legenes faglige utvikling vedrørende antibiotikarekvirering, særlig gjennom praksisregistrering og tilbakemelding, konsulentbesøk og, for allmennleger, gjennom utdanning i kommunikasjonsteknikker for å unngå å gi etter for pasientenes krav om antibiotika.
- Regjeringen og helsemyndighetene må gjøre mer for å opplyse publikum om riktig bruk av antibiotika. Vi anbefaler særlig en kampanje rettet mot småbarnsmødre. Man må for all del ikke skremme folk fra å søke lege eller ta nødvendig medisin. Holdepunktene for at unødvendig antibiotikabruk har betydning for folkehelsa og øker risikoen for at ens neste infeksjon vil være med en resistent stamme, må imidlertid formidles til publikum."
- " Industrien og andre som finansierer forskning bør prioritere arbeid for billige hurtigtester for diagnose og resistens. Lovende oppfinnelser bør raskt markedsføres.
- Legemiddelkontrollen bør vurdere om markedsføringstillatelser kan benyttes mer effektivt for å fremme fornuftig bruk av antibiotika til beste for folkehelsa."
Fornuftig bruk av antibiotika til dyr
- " Fôrantibiotika som vekstfremmere, som for eksempel virginiamycin, som tilhører antibiotikaklasser som brukes eller er foreslått brukt til mennesker og derfor sannsynligvis kan bidra til resistensproblemer innen humanmedisinen, bør fases ut. Dette bør fortrinnsvis skje i et frivillig samarbeid mellom de involverte fagmiljøene og produsentene, men må om nødvendig skje ved lovregulering.
- Veterinærene må ta for seg problemet med overforbruk av fluorokinoloner og andre potente legemidler som er viktige i humanmedisinen. Veterinærstanden bør innføre retningslinjer for når slike antibiotika kan benyttes."
Sykehushygiene
- " De som betaler for sykehustjenester bør sette sykehushygiene i høysetet for styre og drift av sykehus og bevilge ressurser for å få dette til. Disse investeringene vil lønne seg. Ledelsen for den nasjonale helsetjenesten må forsikre seg om at alle sykehus er dekket av en godt utdannet hygienekomité."
Overvåking av resistens
- " Regjeringen bør involvere seg på en konstruktiv måte i arbeidet til den britiske antibiotikaforeningen og det britiske smitteverninstituttet for å gi overvåking en omfattende og strategisk basis og må finne ytterligere ressurser til dette. De som betaler for sykehustjenester og universitetene bør undersøke om de prioriterer sine mikrobiologiske laboratorier høyt nok.
- Helsedepartementet må revurdere kuttene i bevilgningen til smitteverninstituttet."
Vaksiner og legemidler mot virus
- " Vi gratulerer med opprettelsen av Edward Jenner-instituttet for vaksineutvikling. De tallrike etater som forsker for å finne effektive vaksiner må fortsette sitt gode arbeid.
- Etterhvert som nye midler mot virus kommer på markedet, må den nasjonale helsetjenesten allerede fra starten sørge for at de blir brukt fornuftig, og at resistensforholdene overvåkes. Det må gis nok ressurser til smitteverninstituttets referanselaboratorium for resistens hos virus."
Internasjonale forhold
- " Regjeringens eksemplariske støtte til smittevernavdelingen i Verdens helseorganisasjon bør fortsette. United Kingdoms regjerings eksempel bør inspirere andre land og etater til å bidra til dette viktige arbeidet. Vi støtter den resolusjonen som Verdenshelseforsamlingen skal behandle i mai 1998 og håper at den blir vedtatt."
3.5.2 Helsedepartementet
I juli 1997 ba den britiske helsedirektøren sitt faste medisinske fagråd om å undersøke området antibiotikaresistens. Rådet satte da ned et tverrfaglig underutvalg som leverte sin rapport høsten 1998 [14]. Utvalget gjennomgår resistensproblemet og kommer med ei rekke anbefalinger til helsedepartementet. Et liknende utvalg arbeider med resistensproblemet innen veterinærmedisinen. Blant utvalgets anbefalinger er:
- " Det bør lages en nasjonal kampanje for leger om antibiotikabehandling. Samtidig bør det lages en tilsvarende kampanje for publikum for å støtte initiativet i allmennpraksis. Et hovedbudskap i kampanjen må være å ta vare på sin normale bakterieflora. Videre støtte for riktig rekvirering i primærhelsetjenesten bør gis ved å utvikle og spre retningslinjer for håndtering av visse infeksjoner, i regi av National Institute for Clinical Excellence. Lokale retningslinjer bør ta utgangspunkt i de nasjonale. For å forenkle implementeringen av retningslinjene i daglig praksis, bør de integreres i legenes databaserte systemer for beslutningstøtte.
- Regjeringen må på alle måter søke å fremme i internasjonale fora, særlig EU, kampen mot resistens som et alvorlig folkehelseproblem som krever prioritert handling.
- En nasjonal strategi for overvåking av resistens må utvikles og innføres så fort som mulig og dekke heile UK.
- Forskning på antibiotikaresistens bør bli høyt prioritert av alle etater som støtter medisinsk forskning.
- Antibiotikarekvirering må få mer plass i grunnutdannningen av leger, tannleger, farmasøyter og sykepleiere. Undervisningen om antibiotika må integreres med undervisningen om de infeksjonene antibiotika brukes mot. Den samme styrkingen av utdanningen må fortsette i videre- og etterutdanningen. Det samme gjelder innen veterinærmedisinen. I tillegg til informasjonsmateriell for voksne, bør antibiotikaproblemet bli en del av det nasjonale grunnskolepensum.
- Man må vurdere om det bør lages retningslinjer for smittevern for sykehjem og aldershjem på samme måte som man har for sykehus.
- Bruken av antibiotika i veterinærmedisinen bør følge de samme prinsipper som innenfor humanmedisinen, nemlig at antibiotika bør benyttes bare der det er sannsynlig at de gir reell helsefremming. Det må utvikles alternative måter for husdyrproduksjon slik at bruken av antibiotika som vekstfremmere kan stoppe."
3.6 Norden
3.6.1 Danmark
Den danske regjeringen tok initiativet til og arrangerte konferansen The Microbial Threat som resulterte i Københavnerklæringen, se 3.3.1.
Danish Integrated Antimicrobial Resistance Monitoring and Research Programme (DANMAP)
DANMAP ble opprettet av Sundhedsministeriet og Fødevare-, landbrugs- og fiskeriministeriet i 1995 for å drive koordinert overvåking av og forskning vedrørende resistens i bakterier fra dyr, næringsmidler og mennesker mot antibiotika som benyttes til behandling og som fôrantibiotika [15,16]. Programmet drives i samarbeidet mellom Statens Serum Institut (det danske folkehelseinstituttet), Statens Veterinære Serumlaboratorium (det danske veterinærinstitutet) og Levnedsmiddelstyrelsen (det danske næringsmiddeltilsynet).
DANMAP har til formål:
- " at overvåge antibiotikaresistens blandt bakterier fra produktionsdyr, levendsmidler og mennesker;
- at overvåge brugen av antibiotika til behandling af mennesker og dyr og som vækstfremmere;
- at påvise sammenhænge mellem denne anvendelse og forekomst af resistens.
Resultaterne vil danne grundlag for anbefalinger vedrørende brug af vækstfremmere til dyr og antibiotika til behandling af dyr og mennesker."
DANMAP er det første slike integrerte overvåkingssystem. DANMAP har vakt stor oppsikt internasjonalt og fremheves ofte som et eksempel til etterfølgelse. DANMAP demonstrerer imidlertid at det ikke uten videre er enkelt å dokumentere sammenhenger mellom antibiotikaforbruk og resistensutvikling. Det er også vanskelig å vise sammenhenger mellom resistens hos bakterier fra dyr og næringsmidler og resistens hos mennesker. Fra DANMAPs fyldige årsrapport for 1997 [16] siteres følgende konklusjoner som viser bredden i overvåkingen:
"På antibiotikaområdet er forbruget til behandling af mennesker lavt og - fra et resistenssynspunkt - hensigtsmæssigt sammensat, idet hovedvægten ligger på smalspektrede penicilliner. Forbruget af de bredspektrede fluoroquinoloner har således været konstant faldende siden 1994."
"Gennem en dokumentation af udviklingen i forekomst af resistens overfor vækstfremmeren avoparcin har DANMAP kunnet påvise at forbuddet mod brug av avoparcin i maj 1995 har bevirket et fald i forekomst af resistens overfor dette stof. En delundersøgelse af kyllinger udtaget i detailleddet har dog samtidig vist at selv om resistensforekomsten har været faldende er de resistente bakterier stadig vidt utbredte."
"Rapporten viser at sammenligning af resistens mellem bakterier fra dyr og fra levnedsmidler der stammer fra de samme dyr ofte udviser afvigelser. Det afspejler det forhold, at der under håndtering og bearbejdning sker en overførsel af bakterier mellem levnedsmidler (krydskontamination), samt eventuellt det forhold, at der kan være forskelle i de forskellige bakteriestammers overlevelsesevne på levnedsmidlerne, hvorved de resistensmønstre, der er karakteristiske for dyrearterne udviskes noget. Undersøgelse af importerede levnedsmidler for Escherichia coli synes at vise at resistensforekomsten her er større end blandt tilsvarende levnedsmidler af dansk oprindelse.
Disse forhold er medvirkende til, at selv om en overførsel af antibiotikaresistens fra dyr til mennesker kan sandsynliggøres, bl.a. med baggrund i resultater fra DANMAP er den uhyre vanskelig at kvantitere."
Antibiotika. Kun når det er nødvendigt!
Sunhedsstyrelsen har for Sundhedsministeriet utarbeidet en publikumsbrosjyre som allmennleger kan dele ut til pasientene. Hovedbudskapet i brosjyren er: "Antibiotika skal kun gives, når der er grund til det. Antibiotika skal ikke gives for en sikkerheds skyld." Brosjyren stiller spørsmål og gir svar om antibiotika og resistens.
3.6.2 Sverige
Strategigruppen för rationell antibiotika-användning och minskad antibiotikaresistens (STRAMA)
STRAMA er et uformelt nettverk av eksperter fra ulike organisasjoner og myndigheter. STRAMA vil gjennom å fremme fornuftig bruk av antibiotika og gjennom epidemiologiske tiltak motvirke bakteriers utvikling av resistens mot antibiotika [17]. STRAMA har ingen egen økonomi, men deltakerne forventes å kunne involvere seg for sine arbeidsgiveres rekning.
Målsetting
STRAMA har som målsetting
- " att tillsammans med de regionala STRAMA-grupperna öka allmänhetens och hälso- och sjukvårdens kunskap om utveckling och spridning av antibiotikaresistens hos bakterier,
- att tillsammans med de regionala STRAMA-grupperna påverka allmänhetens och hälso- och sjukvårdens kunskaper om infektionssjukdomar och attityder till deras behandling,
- att tillhandahålla sammanställningar och utbildningsmaterial (exempelvis statistik över antibiotikaförskrivning, förekomst av resistenta bakterier) och presentera dessa bl a på Internet,
- att identifiera och beskriva sjukvårdsrelaterad antibiotikaresistens; att därvid framta förslag till handlingsprogram för förhindrande av vidare spridning av antibiotikaresistenta bakterier samt i detta sammanhang ta fram policydokument för en rationell antibiotikaanvändning,
- att bevaka och initiera forskning och studier kring problemet antibiotikaanvändning och resistensutveckling inom human- och veterinärmedicin
- att bistå regionala STRAMA-grupper med experthjälp, och
- att sprida information och resultat mellan regionala STRAMA-grupper."
Organisasjon
Ekspertise fra de følgende myndigheter og organisasjoner utgjør sammen nettverket STRAMA:
- " Svenska Läkaresällskapets Referensgrupp för Antibiotikafrågor (RAF)
- Smittskyddsinstitutet
- Smittskyddsläkarorganisationen
- Läkemedelsverket
- Socialstyrelsen
- Apoteksbolaget AB
- NEPI - Nätverk för Läkemedelsepidemiologi
- Statens Veterinärmedicinska Anstalt
- Representant för läkemedelskommittéer"
Regionale STRAMA-grupper
STRAMA oppfordrer til dannelse av regionale grupper. Det fins nå ei gruppe i hvert fylke. Fylkets smittevernlege har samordningsansvaret. I tillegg inngår gjerne følgende i gruppa: allmennlege, infeksjonsmedisiner, klinisk bakteriolog, sykehushygieniker, representant fra legemiddelkomitéen, øre-nese-halslege, barnelege og apoteker. Gruppene samarbeider med legemiddelkomitéer, lokale apotek og representanter for kommunal og privat helsetjeneste.
De regionale gruppene har samme mål som heile STRAMA. Et foreslått mål for fornuftig diagnostikk og behandling er formulert slik:
"Att med utgångspunkt från nationella konsensusrekommendationer för behandling av infektioner, samt med kännedom om resultat av diagnos/receptundersökningar och lokala förhållanden sätta upp mål för antibiotikaförbrukningen. För att kunna följas upp bör målen helst uttryckas i mätbara termer. Här nedan ges några tänkbara exempel på sådana mätbara delmål:
- Minskning av totalt antibiotikabruk framför allt av makrolider och kinoloner.
- < 20% av patienter med diagnoserna akut bronkit och öli behandlas med antibiotika.
- Vid akut sinuit bör i > 90% av diagnostiken vid diagnosen GAS tonsillit baseras på snabbtest eller odling.
- > 90% av GAS tonsilliter behandlas med penicillin V.
- 90% av antibiotikabehandlingen vid diagnoserna okomplicerad primär akut mediaotit och akut sinuit utgörs av penicillin.
- Akuta samhällsförvärvade pneumonier inom öppen vård behandlas ej med kinoloner.
- Ökat växelbruk av antibiotika vid okomplicerade nedre UVI.
- Användningen av kinoloner vid okomplicerade nedre UVI skall minska med minst 30% under 1998."
STRAMA foreslår å forankre de lokale målsettingene innen fylket. Eksempler på foreslåtte tiltak er:
- " Lokalt anpassa och genomföra nationella behandlingsrekommendationer avseende infektionssjukdomar.
- Utarbeta och införa lokala vårdprogram och liknande.
- Införa kvalitetssäkringssystem avseende diagnostik och behandling vid luftvägs- och urinvägsinfektioner. Detta kan bl a åstadkommas genom regelbunden registrering av diagnos, diagnostiska metoder/kriterier och terapi hos individuella patienter.
- Följa antibiotikaförsäljningen.
- Regelbundet återföra resultatet av kvalitetsanalysen avseende diagnostik och förskrivning, samt statistik avseende antibiotikaförsäljning och resistenssituation till förskrivare/förskrivargrupper.
- Öka allmänhetens kunskaper om och påverka dess attityder till infektionssjukdomar t ex genom olika former av informationsinsatser och sjukvårdsadministrativa åtgärder såsom fria återbesök i öpppen vård, förbättrad sjukvårdsupplysning."
Referensgruppen för Antibiotikafrågor (RAF)
RAF er ei tverrsektoriell referansegruppe som organiseres av Svenska Läkaresällskapet och Smittskyddsinstitutet. RAFs hovedoppgaver er å bestemme antibiotikas brytningspunkter for inndeling av deres følsomhet overfor antibiotika, og fremme en fornuftig bruk av antibiotika [18].
Sammensetning
"Svenska Läkaresällskapets föreningar för mikrobiologi (3 representanter), infektionssjukdomar (3), barnmedicin (1), klinisk farmakologi (1), otorinolaryngologi (1), allmänmedicin (1) utser representanter i enlighet med den angivna fördelningen. Av mikrobiologernas representanter är en självskriven (ordförande i RAF-M). Smittskyddsinstitutet utser tre representanter: vice ordförande, sekreterare (chefsmikrobiolog vid Bakteriologiska enheten, Smittskyddsinstitutet) samt ytterligare en representant. Varje förening/sektion har att bestämma huruvida särskild mandattid skall gälla för föreningens representanter. Då representant avgår meddelar RAF den aktuella föreningen som har att utse ersättare. RAF utser ordförande inom gruppen. Smittskyddsinstitutet svarar för medlemmarnas reguljära rese- och sammanträdeskostnader. Traktamente respektive sammanträdesarvoden utgår ej. RAF har ingen egen ekonomi varför kassör ej behövs. Det står RAF fritt att till sammanträden adjungera specialister eller representanter för myndigheter."
RAFs metodegruppe (RAF-M)
"RAF-M's huvuduppgift är att ange referensmetod för resistensbestämning av antibakteriella medel och att bistå RAF vid fastställandet av MIC-gränser och zonbrytpunkter för SIR-klassificering av bakterier. RAF-M skall vidare utveckla metoder för och medverka i kvalitetssäkring av resistensbestämning. RAF-M skall medverka i nationell utbildning och fortbildning av laboratoriepersonal inom området resistensbestämning.
Medlemmarna i RAF-M (6 - 7 stycken) utses av Svenska Läkaresällskapets förening för medicinsk mikrobiologi på ett sådant sätt att en geografisk representation erhålles och så att varje medlem har ett huvudansvar för resistensbestämning på det laboratorium vederbörande representerar. Gruppen utser inom sig ordförande. Sekreterare i RAF är automatiskt sekreterare i RAF-M. RAF-M's ekonomi revideras av föreningen för medicinsk mikrobiologi."
3.6.3 Finland
Den finske arbeidsgruppa for antibiotikaresistens (FiRe)
FiRe er et uavhengig nettverk av nesten alle de medisinsk mikrobiologiske laboratoriene i Finland. De samarbeider om overvåking av resistens og forskning. Samarbeidet er frivillig, men gir så mange fordeler (som kvalitetskontroll og vitenskapelig aktivitet) at det ikke er vanskelig å få laboratoriene til å delta.
FiRe har et styre på fem valgte medlemmer. Man har ikke noe eget budsjett, men mottar støtte fra legemiddelindustrien til møter. Man håper å kunne skaffe penger til å lønne en medisinsk mikrobiolog for å håndtere de nasjonale databasene. FiRe lager nå et system der resultatene av resistensbestemmelsene i alle laboratoreine samles i en database. Sentralt i FiRe står folkehelseinstituttets laboratorium for antibiotikaforskning.
FiRe har sitt eget kvalitetssikringsprogram som inkluderer internasjonale programmer. Videre har man laget en finsk standard for resistensbestemmelser.
FiRe har i perioden 1994-98 publisert tre medisinske doktorgrader [19-21] og 12 internasjonale vitenskapelige artikler, hvorav minst én, som ble publisert i et av verdens fremste medisinske tidsskrift New England Journal of Medicine [22], har vakt stor internasjonal oppmerksomhet. Man viste her at forekomsten av makrolidresistens hos gruppe A-streptokokker gikk tilbake etter at kampanjer overfor legene førte til mindre bruk av makrolider.
Program for god klinisk praksis
Under ledelse av legeforeningen Duodecim er det satt ned ekspertpaneler med representanter fra de ulike medisinske spesialiteter. Panelene skal i 1999 levere sine anbefalinger for retningslinjer for antibiotikabehandling av de hyppigste infeksjonene utenfor sykehus.
Strategier for antibiotikabruk i Finland (MIKSTRA)
Dette er et femårig (1998-2003) prosjekt som skal følge rekvireringen av antibiotikabruk i allmennpraksis før og etter innføring av retningslinjene nevnt ovenfor. Rekvireringen fra 30 helsesentre som dekker en befolkning på 600 000 vil bli fulgt. Prosjektet skal undersøke:
- Endringer i diagnostikk og behandling av infeksjoner i primræhelsetjenesten.
- Kostnader til behandling av infeksjoner i primærhelsetjenesten før og etter retningslinjene.
- Legers og pasienters holdninger til antibiotika.
- De ulike utdanningsprosessene som foregår under programmet.
- Utvikling i resistens blant bakterier som er vanlige i allmennpraksis.
- Kostnader og nytte av heile MIKSTRA-programmet.
Operasjon reine hender
Hygienetiltak er viktige for å redusere spredningen av resistente bakterier. Folkhälsoinstitutet forbereder sammen med Institutt for helsefremming en kampanje for å forbedre håndhygienen. Målgruppene vil bli barnehager, husholdninger, næringsmiddelbedrifter, restauranter og sykehus.
3.6.4 Nordisk legemiddelstatistikk
Salgstall på grossistnivå for legemidler i Norden ble tidligere publisert av Nordisk legemiddelnemnd (NLN). Siste utgaven av boken Nordic Statistics on Medicines, tall for 1993-1995, ble utgitt i 1996. Det er ikke planer om fortsatt utgivelse i bokform da kontinuerlig innsamling av data for Norden ikke pågår lenger. Det kan bestilles data fra NLN, og NLN sender ut forespørsel til hvert av landene etter søkerens spesifikasjoner.
En årsak til at det ikke lenger samles nordisk statistikk, er at de andre landene nå ikke vektlegger grossiststatistikk fordi de har reseptstatistikk i en eller annen form. Nordisk grossist-statistikk har ikke vært umiddelbart sammenliknbar fordi f.eks. tall fra danske sykehus ikke har vært med.
Alle nordiske land har tidligere hatt grossistdata som basis for legemiddelstatistikk. De nordiske land med unntak av Norge har etablert eller har under etablering offentlig, heldekkende reseptbasert statistikk på individ- eller personnivå. Danmark har hatt offentlig reseptbasert lege-middelstatistikk siden 1. januar 1994. Det satses betydelige ressurser på analyse og bruk av dataene overfor både myndigheter og helsetjenesten. Danmark har også to regionale reseptdatabaser (Odense, Nord-Jylland) med personidentifiserbare reseptdata som utgjør en viktig forskningsressurs.
Sverige har også i mange år hatt individbasert reseptstatistikk i visse områder og innfører nå en nasjonal reseptbasert statistikk som er personidentifiserbar. Påføring av diagnosekode krever pasientens samtykke. I Finland registreres alle resepter som betales over refusjonsordningen (i praksis de aller fleste) med person- og legenummer og det er nylig etablert et system med tilbakemelding til alle leger. Island har under etablering et tilsvarende system som Finland og vil bruke krypterte pasientopplysninger basert på personnummer.
3.7 Litteratur
1. Fifty-first World Health Assembly. Emerging and other communicable diseases: antimicrobial resistance. WHA 51.17. Geneve: Verdens helseorganisasjon, 1998. 2. World Health Organization. The medical impact of the use of antimicrobials in food animals. WHO/EMC/ZOO/97.4. Geneve: Verdens helseorganisasjon, 1997. 3. World Health Organization. Resistance to antimicrobial agents. Wkly Epidemiol Rec 1997; 72: 333-6. 4. Williams RJ, Heymann DL. Containment of antibiotic resistance. Science 1998; 279: 1153-4. 5. World Health Organization. The current status of antimicrobial resistance surveillance in Europe. WHO/EMC/BAC/98.1. Geneve: Verdens helseorganisasjon, 1998. 6. Ministry of Health and Ministry of Food, Agriculture and Fisheries. The Copenhagen recommendations. København: Sundhedsministeriet og Fødevare-, landbrugs og fiskeriministeriet, 1998. 7. Economic and Social Committee of the European Communities. Resistance to antibiotics as a threat to public health. Brussel: Den økonomiske og sosiale komité, 1998. 8. Forum on Emerging Infections of the Institute of Medicine. Antimicrobial resistance: issues and options. Washington DC: National Academy Press, 1998. 9. Centers for Disease Control and Prevention. Addressing emerging infectious disease threats: a prevention strategy for the United States. Atlanta, GA: US Department of Health and Human Services, Public Health Service, 1994. 10. Centers for Disease Control and Prevention. Preventing emerging infectious diseases. A strategy for the 21st century. Atlanta, GA: US Department of Health and Human Services, Centers for Disease Control and Prevention, 1998. 11. Dowell SF, red. Principles of judicious use of antimicrobial agents for pediatric upper respiratory tract infections. Pediatrics 1998; 101 (supplement): 163-84. 12. ASM Task Force On Antibiotic Resistance. Report. Washington DC: American Society for Microbiology, 1995. 13. Select Committee on Science and Technology of the House of Lords. Resistance to antibiotics and other antimicrobial agents. Session 1997-98. 7th report. London: The Stationery Office, 1998. 14. Standing Medical Advisory Committee, Sub-Group on Antimicrobial Resistance. The path of least resistance. London: Department of health, 1998. 15. Danish Integrated Antimicrobial Resistance Monitoring and Research Programme. Antibiotikaforbrug og overvågning af resistens hos bakterier fra produktionsdyr, levnedsmidler og mennesker i Danmark. København: Dansk Zoonosecenter, 1997. 16. Danish Integrated Antimicrobial Resistance Monitoring and Research Programme. DANMAP 97. Antibiotikaforbrug og overvågning af resistens hos bakterier fra produktionsdyr, levnedsmidler og mennesker i Danmark. København: Dansk Zoonosecenter, 1998. 17. www.strama.org 18. www.ltkronoberg.se/ext/raf/raf.htm 19. Seppälä H. Streptococcus pyogenes; erythromycin resistance and molecular typing. Annales Universitates Turkuensis Ser D 157. Turku: Turun Ylipisto, 1994. 20. Nissinen A. Antimicrobial resistance in four major respiratory bacterial pathogens, Streptococcus pyogenes, Streptococcus pneumoniae, Haemophilus influenzae, and Moraxella catarhalis. KTL A2/1995. Helsinki: Folkhälsoinstitutet, 1995. 21. Manninen R. Determination of antimicrobial resistance in five major clinical bacterial pathogens. KTL A4/1998. Turku: Folkhälsoinstiutet, 1998. 22. Seppälä H, Klaukka T, Vuopio-Varkila J, Muotiala A, Helenius H, Lager K, Huovinen P and the Finnish Study Group for Antimicrobial Resistance. The effects of changes in the consumption of macrolide antibiotics on erythromycin resistance in group A streptococci in Finland. N Engl J Med 1997; 337: 441-6. Lagt inn 4. februar 1999 av Statens forvaltningstjeneste, ODIN-redaksjonenDel 4: Hvordan kan vi motvirke resistens?
4.1 Innledning
4.1.1 Hvorfor må vi gjøre noe?
I mange land kan antibiotikaresistens uten videre karakteriseres som et folkehelseproblem. Som beskrevet i del 1, er resistens også i Norge blitt et problem, særlig i sykehus der legene daglig støter på dette problemet ved behandling av infeksjoner. Utenfor sykehus er resistens foreløpig ikke et like stort problem i behandlingen.
Utviklingen går også i Norge mot stadig mer resistens blant vanlige sykdomsframkallende bakterier. I tillegg er vi stadig utsatt for import av resistente bakterier med mennesker, dyr og næringsmidler.
Resistens kan utvikle seg til å bli et større folkehelseproblem i Norge. Vi har imidlertid muligheter til å bremse utviklingen gjennom å iverksette forebyggende tiltak.
4.1.2 Samlet innsats
Som beskrevet i del 2, foregår det i Norge allerede ei rekke aktiviteter som bidrar til å begrense resistensproblemet. Gruppa mener imidlertid at det er nødvendig med en større, koordinert innsats for å motvirke resistensproblemet i Norge. Som beskrevet i del 3, er det etterhvert nokså stor enighet internasjonalt om hvilke tiltak som er nødvendige.
Vi foreslår at arbeidet stimuleres gjennom en statlig handlingsplan over fem år, fra 1999 til 2003. I denne delen av rapporten følger gruppas forslag til tiltak med begrunnelser. Gruppas forslag tar utgangspunkt i foreliggende tiltak og strukturer, gruppas oppfatninger, den vitenskapelige litteraturen og anbefalinger i andre land.
Anbefalingene rettes til statlige, fylkeskommunale og kommunale myndigheter, til rekvirenter av antibiotika og annet helsepersonell, til næringsorganisasjoner, legemiddelindustri, fagforeninger og frivillige organisasjoner, til utdanningsinstitusjoner, og til publikum. Vi oppfordrer alle til å støtte handlingsplanen gjennom deres virke, for eksempel ved ressursprioriteringer, prosedyrer, planer, myndighetsutøvelse og personlig atferd. Resistens må bli et tema for alle.
4.1.3 Organisering og evaluering
Denne rapporten legger grunnlaget for en femårig handlingsplan. Vi mener det kan være nyttig med ei referansegruppe eller koordineringsgruppe for implementering av handlingsplanen. Vi foreslår at ei slik gruppe opprettes. Denne vil ha en rådgivende funksjon for departementene. Det kan også vurderes om gruppa bør ha en samordnende funksjon i forhold til enkelte av de tiltak som skisseres.
Mot slutten av perioden kan det vurderes å gjenopprette den nåværende prosjektgruppa med tanke på evaluering av innsatsen og forslag om eventuell videre innsats.
4.2 Overvåking og kartlegging av resistens
4.2.1 Bakgrunn
Med overvåking av antibiotikaresistens menes vedvarende, systematisk innsamling, analyse og tolkning av data om mikrobers resistensforhold og deres betydning for folkehelsa til bruk i planlegging, implementering og evaluering av folkehelsetiltak. Overvåkingen kan bidra til å øke forståelsen av sammenhengen mellom antibiotikabruk og smitteverntiltak på den ene siden og utvikling av resistens på den andre. Overvåkingen kan derfor også benyttes i evaluering av tiltakene i denne planen. I tillegg kan overvåkingen veilede valget av legemiddel ved empirisk behandling (dvs. behandling før mikroben og dens resistensmønster er kjent).
I Norge fins det i dag ikke noe nasjonalt overvåkingssystem for antibiotikaresistens. Det er imidlertid behov for et slikt system, og i del 2 er det vist til flere lokale, regionale og nasjonale elementer som man kan bygge videre på.
4.2.2 Meldingssystem for smittsomme sykdommer (MSIS)
MSIS måler insidensen av infeksjoner (dvs. antall nye tilfeller per tidsenhet og antall personer) forårsaket av visse resistente bakterier. MSIS egner seg derfor for overvåking av lite hyppige og klart definerte resistensforhold av særlig betydning.
Denne formen for overvåking i MSIS av meticillinresistente gule stafylokokker (MRSA), vankomycinresistente enterokokker (VRE), betalaktamaseproduserende gonokokker (PPNG) og pneumokokker med nedsatt følsomhet for penicillin bør fortsette. Det må løpende vurderes om nye tilstander skal gjøres meldingspliktige. Resultatene må som før rapporteres ukentlig i MSIS-rapport.
4.2.3 Norsk overvåkingssystem for resistens hos mikrober (NORM)
Planleggingen av NORM startet før denne prosjektgruppa ble nedsatt for å lage forslag til en plan for å motvirke antibiotikaresistens. Gruppa mener at et overvåkingssystem er et nødvendig tiltak og vil derfor støtte opprettelsen av NORM. Omtalen nedenfor bygger på de foreløpige vurderinger i NORM-samarbeidet.
Bakgrunn
Etter initiativ fra Folkehelsa og Statens helsetilsyn har representanter fra de medisinsk mikrobiologiske, infeksjonsmedisinske og sykehushygieniske avdelingene siden 1997 arbeidet med et forslag om NORM. Tre mindre arbeidsgrupper har utredet hvordan et system kan utformes. Det har også vært kontakt med veterinærmiljøene for å sikre koordinering. En samlet rapport fra arbeidet ventes tidlig på våren 1999 med tanke på prøvedrift av NORM i løpet av året og videre opptrapping i 2000.
Formål
Norsk overvåkingssystem for resistens hos mikrober skal
- regelmessig, vedvarende og på en valid måte måle utbredelsen av resistens mot visse antibioti-ka hos visse sykdomsframkallende mikrober, og
- gjennom en åpen og dokumentert arbeidsmåte framskaffe informasjon for handling og gjøre denne informasjonen tilgjengelig for dem som trenger den slik at nødvendige forebyggings- og kontrolltiltak kan settes i verk, og være tilgjengelig for andre.
NORM skal dermed både samle informasjon, bearbeide denne og så spre den. For en stor del er dette informasjon som allerede finnes spredt i flere laboratorier.
Overvåkingsopplegg
Overvåkingen av de enkelte mikrober i NORM legges opp etter en av følgende metoder:
- Episodisk (f.eks. én måned annethvert år) innsamling av data fra de deltakende laboratorier om resistensundersøkelser av visse utvalgte kliniske isolater, f.eks. alle pneumokokker
- Kontinuerlig innsamling av data fra de deltakende laboratorier om resistensundersøkelser av utvalgte mikrober, f.eks. alle enterobakterier isolert fra blod.
- Kontinuerlig innsamling av utvalgte mikrober, f.eks. alle meningokokker, fra alle landets laboratori-er til et sentralt laboratorium for resistensundersøkelse der.
Mikrober og antibiotika
I NORM arbeides det med å velge ut hvilke mikrober som skal overvåkes og hvilke antibiotika disse skal undersøkes mot. Det er nødvendig med en streng prioritering for å sikre et optimalt forhold mellom innsats, kostnad og nytteverdi.
Mikrober
Det er satt opp ei rekke kriterier for valg av mikrober som bør overvåkes. De detaljerte kriteriene er i fire grupper. Man vil overvåke blant annet:
- Klinisk viktige mikrober, f.eks. mikrober som ofte fører til sykdom, som gir særlig alvorlig sykdom eller som man har få antibiotika mot.
- Mikrober som man frykter vil bli resistente i nær framtid, eller som har utviklet resistens i andre land.
- Mikrober som kan forekomme i næringsmidler eller som ofte er importert.
- Mikrober som lett erverver resistens og dermed tidlig signaliserer at det foreligger et uheldig seleksjonspress, men som ikke nødvendigvis er sykdomsframkallende (indikatormikrober).
Antibiotika
Følgende antibiotika er valgt:
- Klinisk viktige antibiotika, dvs. antibiotika som vanligvis benyttes i empirisk behandling av infeksjoner med de aktuelle mikrobene, og som er representative for de aktuelle gruppene av antibiotika.
- Indikatorantibiotika, dvs. antibiotika som det ofte utvikles resistens mot tidlig eller som indikerer prinsipielt viktige resistensmekanismer.
Organisering og funksjoner
NORM foreslås som et frivillig samarbeid mellom medisinsk-mikrobiologiske laboratorier. Det er ønskelig at flest mulig laboratorier blir med i NORM. Det er tre funksjoner i NORM:
1 NORM-sentralen tar seg av drift av registeret inkludert veiledning av og kommunikasjon med de deltakende laboratorier. NORM-sentralen er også sekretariat for NORM og for systemets styringsgruppe. Sekretariatet bør ha nær kontakt med Arbeidsgruppen for antibiotikaspørsmål.
2 Lokallaboratorier skal resistensbestemme en del isolater, både episodisk og kontinuerlig, og rapportere resultatene til NORM-sentralen.
3 Sentrallaboratorier mottar og resistensbestemmer isolater som skal undersøkes ett sted, og rapporterer resultatene til NORM-sentralen.
Et laboratorium kan ha funksjon som både lokallaboratorium og sentrallaboratorium.
4.2.4 Kartlegging av antiviral resistens
Etter hvert som det kommer stadig nye antivirale midler, og stadig flere pasienter får disse midlene i lange perioder, vil antiviral resistens bli et klinisk viktig problem. Problemet er særlig aktuelt ved HIV-infeksjon. Man bør i Norge snarest ta i bruk metoder for å undersøke slik resistens, hovedsaklig for å veilede behandlingen av pasientene. Samtidig er det nødvendig å kartlegge utbredelsen av slik resistens i Norge. Internasjonalt er det enighet om å forsøke å etablere overvåkingssystemer for resistens hos HIV.
4.2.5 Internasjonale overvåkingssystemer
Norge bør delta i internasjonale offisielle systemer for resistensovervåking. Dette er viktig for å lære metoder og få informasjon om de internasjonale trendene. Det vil også gi informasjon om situasjonen i andre land som Norge har stor kontakt med gjennom reisevirksomhet og handel.
Særlig bør man søke deltaking i overvåkingsopplegg i regi av Verdens helseorganisasjon og av EU, som European Antimicrobial Resistance Surveillance System (EARSS), Enter-net ( Salmonella og EHEC) og EuroTB ( Mycobacterium tuberculosis).
4.2.6 Lokale sykehusinterne overvåkingssystemer
Sykehusene skal i henhold til Forskrift om smittevern i helseinstitusjoner - sykehusinfeksjoner overvåke sykehusinfeksjoner. Overvåkingen bør omfatte resistensforholdene ved de enkelte avdelinger. Dette gjelder i særlig grad ved avdelinger med høyt antibiotikaforbruk, som intensivavdelinger.
4.2.7 Mikrober fra dyr, næringsmidler og fôr
Meldingssystem for smittsomme sykdommer hos dyr (ANISTAT)
Statens dyrehelsetilsyn vurderer å gjøre påvisning av enkelte resistente mikrober meldingspliktige på linje med smittsomme dyresykdommer. Hensiktsmessigheten av en slik meldingsplikt må vurderes.
NORM
Veterinærsiden må komme aktivt med i arbeidet med NORM. Det er særlig zoonotiske bakterier isolert fra dyr og næringsmidler som er av interesse, slike som Salmonella, Yersinia, Campylobacter og EHEC.
Andre systemer
Kontinuerlig overvåking
I tillegg til at zoonotiske bakterier må overvåkes i NORM, kan det også være aktuelt å følge resistensutviklingen av spesielle dyrepatogene bakterier som f.eks. stafylokokker samt visse indikatorbakterier som f.eks. E coli og enterokokkker (eksempelvis vankomycinresistente enterokokker). Dette arbeid må ses i relasjon til funksjonen av den nye zoonoseenheten som skal etableres i et samarbeid mellom Veterinærinstituttet og Folkehelsa.
Materialtilgangen for en fortløpende overvåking i hver region og i landet som helhet vil øke betraktelig dersom veterinærene oppfordres til å sende inn det prøvematerialet som er faglig relevant, og undersøkelsene utføres uten kostnader for dyreeier og veterinær.
Episodisk overvåking
Man kan tenke seg lokale, tidsavgrensete prosjekter der man sammenholder veterinær reseptstatistikk og resistensundersøkelser. VETLIS kan hente inn data fra apotekene. Statens dyrehelsetilsyn kan være ansvarlige for uttak av prøver og Veterinærinstituttet for resistensundersøkelsene. Resultatene må formidles samlet til veterinærene av Dyrehelsetilsynet for å påvirke rekvireringen.
Kartleggingsprosjekter for næringsmidler
Kartlegging av forekomst av resistente bakterier i matvarer av norsk og utenlandsk opprinnelse bør fortsette slik at uheldig utvikling kan oppdages tidlig. Statens næringsmiddeltilsyn kan benytte Veterinærinstituttet og de kommunale næringsmiddeltilsyn til undersøkelsene.
4.3 Overvåking av antibiotikabruk
Omtalen nedenfor gjelder i hovedsak legers og tannlegers rekvirering. Langt på vei kan de samme forhold gjelde for veterinærer. Forhold som er spesifikke for veterinærer er omtalt under hvert avsnitt.
4.3.1 Bakgrunn
Bruk av antibiotika er den viktigste årsak til utviklingen av resistente mikrober. Viktige tiltak for å motvirke resistens er derfor å forbedre bruken av antibiotika, blant annet gjennom å redusere unødvendig bruk.
Selv om man vet at antibiotikabruk og resistensutvikling er to sider av samme sak, er det ikke tilstrekkelig kunnskap til å si hvilken forbruks-politikk som er gunstigst for å hindre resistensutvikling. Det er derfor meget viktig å følge både forbruket og resistensutviklingen i landet. Man bør kunne følge utviklingen av både totalforbruket og forbruket ved de forskjellige infeksjonssykdommer.
Som grunnlag for å optimalisere bruken av antibiotika, må vi overvåke antibiotikaforbruket. Med overvåking av antibiotikabruk menes vedvarende, systematisk innsamling, analyse og tolkning av data om bruk av antibiotika til mennesker og dyr til bruk i planlegging, implementering og evaluering av tiltak for optimalisering av bruken. Overvåkingen kan også bidra til å øke forståelsen av sammenhengen mellom antibiotika-forbruk og smittevern-tiltak på den ene siden og utvikling av resistens på den andre. Reseptbasert statistikk (se 4.3.2) gir et godt grunnlag for slik overvåking.
Medisinsk antibiotikabruk
Dessverre har overvåkingen av antibiotikabruk til mennesker siden 1995 vært utilstrekkelig, og betydelig dårligere enn i våre naboland. Denne situasjonen må forbedres dersom arbeidet for å motvirke resistens skal bli effektivt. Med den truende resistensutviklingen øker behovet for god antibiotikaovervåking for hvert år. Endringer i rekvireringsmønsteret kan skje fort, blant annet som følge av legemiddelindustriens markedsføring, nye vitenskapelige funn og introduksjon av nye preparater.
Totalforbruket av antibiotika til mennesker i Norge i dag er omtrent på linje med de andre nordiske landene (se 1.5.2), og betydelig mindre enn i de øvrige europeiske land og de fleste andre land. De diagnosebaserte reseptundersøkelsene fra 1991 til 1996 viste imidlertid at det var store rom for forbedringer. Fortsatt brukes mye antibiotika ufornuftig.
Veterinærmedisinsk antibiotikabruk
Kartleggingen av veterinærmedisinsk antibiotikabruk fra 1990 til 1998 har vist at tiltak iverksatt av produsentorganisasjonene og veterinærvesenet for å begrense forbruket har vært virksomme. Informasjon om utviklingen i forbruksmønsteret har vært en viktig motivasjonsfaktor for forbedring av antibiotikabruken til varmblodige dyr (se 1.6.3). Forbruket av antibiotika til fisk har i de senere år vist en dramatisk nedgang. Dette skyldes i hovedsak utvikling av virksomme vaksiner og satsing på generelle hygienetiltak i oppdrett. Overvåkingen av antibiotikaforbruket har vært en integrert del av dette arbeidet.
4.3.2 Reseptbasert legemiddelstatistikk
Bakgrunn
Med en nasjonal reseptbasert legemiddelstatistikk menes en samlet nasjonal overvåking av legemiddelforbruk basert på apotekenes salg av legemidler etter resept og rekvisisjon, med tillegg av salg av legemidler gjennom andre kanaler enn apotek.
Behovet for bedre og mer detaljert kunnskap om legemiddelforbruk og legemiddel-økonomiske utviklingstrekk, samt behov for bedre tilsynsverktøy nasjonalt og lokalt for å sikre rasjonell og riktig legemiddelbruk for den enkelte og for samfunnet, er fremmet flere ganger og har stått i Stasbudsjettet for både 1996-97 og 1997-98. Både NOU 1997:7 Piller, prioritering og politikk og NOU 1997:6 Rammevilkår for omsetning av legemidler omtaler betydningen av en bedre statistikk. Det er ennå ikke fattet endelig beslutning om opprettelse.
Veterinærmedisinsk antibiotikabruk
Overvåking av veterinærmedisinsk forbruk bør søkes integrert i den reseptbaserte legemiddelstatistikken slik at man får en permanent overvåking også av veterinærmedisinsk antibiotikabruk. Reseptbaserte data kan gi informasjon om rekvirering til den enkelte dyreart og om rekvirering av humanpreparater til dyr. Behandlingsdata fra helsekort og meldinger fra praktiserende veterinærer vil også kunne gi slik informasjon.
De formelle og praktiske forholdene rundt utarbeidelsen og driften av et slikt veterinærmedisinsk system må selvfølgelig utredes slik at systemet er tilpasset veterinærmedisinske forhold.
Bruk av antibiotika til oppdrettsfisk
Kopi av alle resepter på antibiotika til oppdrettsfisk sendes til Fiskeridirektoratets kontrollverk. Dette danner grunnlaget for en effektiv overvåking av antibiotikabruk i næringen. Systemet har vist sin nytte gjennom først å avsløre et stort forbruk fulgt av en kraftig nedgang etter at effektive tiltak ble iverksatt. Dette er et eksempel på overvåking i dets egentlige betydning: informasjon for handling. Dette systemet må fortsette og kan fungere som et eksempel for andre områder.
Bruk av statistikken
For arbeidet med å motvirke antibiotikaresistens vil den reseptbaserte overvåkingen av antibiotikaforbruket være særlig verdifull, i tillegg til og uavhengig av de legemiddeløkonomiske hensyn. Overvåkingen kan gi
- Totalforbruk av de enkelte typer antibiotika.
- Forbruket til den enkelte rekvirent.
- Forbruket til den enkelte pasient (som ikke er identifiserbar annet enn som et konstruert nummer).
- Forbruket fordelt på pasientenes kjønn, alder og kommune.
Fra denne statistikken kan det gis tilbakemeldinger til den enkelte rekvirent om egen rekvirering. Hver enkelt kan da se sin rekvirering i forhold til for eksempel et gjennomsnitt av kollegenes rekvirering. Dette gir mulighet for innsikt og refleksjon og kan benyttes i en pedagogisk prosess for å forbedre og kvalitetssikre antibiotikarekvireringen (se 4.5.1 og 4.5.4). En slik statistikk vil samtidig kunne gi helsemyndighetene, helsevesenet og forskningsmiljøene en mulighet til å studere antibiotikaforbruket blant annet for å få nok kunnskap til å målrette tiltak.
Registrering av diagnosekode
For antibiotikaovervåkingen er verdien av statistikken begrenset dersom det ikke knyttes en diagnosekode til hvert medikament. Det skyldes at antibiotika benyttes for ei rekke forskjellige tilstander. Vi trenger å vite for hvilke infeksjoner antibiotika skrives ut. Da kan vi få svar på viktige spørsmål, for eksempel:
- Fortsetter legene å rekvirere antibiotika unødvendig for ørebetennelser?
- Er legene i ferd med å gå over fra penicillin til makrolider for halsbetennelser forårsaket av gruppe A-streptokokker?
- Rekvireres det for mye antibiotika til behandling av fordøyelsesbesvær (dyspepsi)?
Den enkelte lege kan få stor innsikt i sitt eget rekvireringsmønster:
- Hva rekvirerer jeg vanligvis for urinveisinfeksjon hos voksne? Er dette i overensstemmelse med anbefalingene? Hvordan ligger jeg an i forhold til gjennomsnittet av mine kolleger?
- Hvor mye penicillin rekvirerer jeg for bronkitt i år i forhold til i fjor?
Det er stor interesse blant leger for et slikt tilbud om tilbakemelding. Tiltaket er også vist å være et effektivt tiltak for å forbedre praksis (se 4.5.1). Tilbudet må utvikles i samarbeid med legene selv, for eksempel i samarbeid med sentre for antibiotikabehandling i allmennpraksis (se 4.5.4).
I allmennpraksis benyttes et annet diagnosesystem enn i sykehus. Det er en viktig utfordring å lage et fungerende overvåkingssystem der denne forskjellen tas hensyn til.
Utvalgsundersøkelser
En reseptbasert legemiddelstatistikk med diagnosekode er så viktig for antibiotikaovervåkingen at det bør settes i verk egne utvalgsundersøkelser dersom den nasjonale statistikken ikke har med diagnosekoder.
Det er flere måter å gjøre slike utvalgsundersøkelser på. En vanlig måte er å registrere alle resepter som et utvalg frivillige leger utsteder. Enklest og best gjøres det innenfor reseptstatistikken, men opplysningene kan også hentes fra legenes edb-baserte journalsystemer. Ulempen med slike utvalg av leger er at de som sier seg villige til å delta, som regel ikke er representative for alle landets leger. Dermed er det stor fare for at man få et skjevt bilde av situasjonen.
4.3.3 Grossistbasert statistikk
Den grossistbaserte statistikken bygger på salgstallene til legemiddelgrossistene. Denne statistikken er nødvendig og utfyller den reseptbaserte statistikken. Statistikken deler forbruket på legemiddelgruppe og fylke og angir salget i definerte døgndoser og salgsverdi (kroner). Disse dataene har i mange år vært grunnstammen i overvåkingen av antibiotikaforbruket.
Den grossistbaserte statistikken kan videre gi totalforbruket av preparater som er registrert til veterinærmedisinsk bruk. Man får imidlertid ikke med humanmedisinske preparater som er benyttet til dyr. Videre gir ikke grossistdata informasjon om hvilke dyrearter preparatene er brukt til.
Grossistene er pålagt å levere salgsdata. Når NMD privatiseres, er det viktig å sørge for at oppgavene videreføres og opplysningene gjøres tilgjengelig for myndigheter og forskningsmiljøer
Bruk av fôrantibiotika
Statens landbrukstilsyns registrering av mengde antibiotika tilsatt i dyrefôr må fortsette. Statens næringsmiddeltilsyn overvåker restmengder av antibiotika i matvarer. Dette bør fortsette.
4.3.4 Sykehusinterne systemer
Sykehusene bør som del av sin antibiotikastrategi (se 4.5.3) overvåke bruksmønster for antibiotika. Data skaffes gjennom sykehusapotekenes registrering av salg til den enkelte post, eventuelt supplert med regelmessige undersøkelser av antiotikabruken til de enkelte pasientene på en gitt dag. Dataene må bearbeides av sykehusets antibiotikakomité og benyttes aktivt i arbeidet for å forbedre antibiotikabruken.
4.4 Mikrobiologisk diagnostikk og resistensbestemmelse
4.4.1 Mikrobiologisk diagnostikk
Smittevernet og arbeidet mot resistens er avhengig av at de mikrobiologiske laboratoriene opprettholder høy standard. Mikrobiologisk diagnostikk, dvs. identifisering av smittestoff i kliniske prøvematerialer og eventuelt videre karakterisering av smittestoffet, er en hjørnestein i et godt smittevern. Ny teknologi har de siste årene gitt muligheter for tidligere og bedre identifisering av mikrober. Mange mikrobiologiske laboratorier har behov for investeringer i nytt utstyr, rekruttering av kvalifisert personell og videreutdanning av eget personell.
Det er sannsynlig at også mange norske sykehuseiere i framtida vil velge å konkurranseutsette de medisinsk mikrobiologiske tjenestene. De medisinsk mikrobiologiske avdelinger kan bli utskilt fra sykehusene og bli stilt overfor helt nye krav til markedstilpasning. Før slike endringer iverksettes, er det nødvendig å finne ordninger som sikrer aktiviteter som ikke er knyttet til undersøkelsen av den enkelte pasientprøve. Dette gjelder særlig aktiviteter knyttet til smittevernet, som overvåking av infeksjonssykdommer og resistensforhold, samt forskning, rådgivning og undervisning.
4.4.2 Standardisering av resistensbestemmelser
Standardisering av resistensbestemmelser er et viktig arbeid der det offentlige bør ta et større ansvar. For å oppnå tilfredsstillende kvalitet i resistensbestemmelsene i laboratoriene, kan det bli nødvendig med investeringer i utstyr og økt bemanning.
Arbeidsgruppen for antibiotikaspørsmål (AFA)
Arbeidsgruppens primære arbeidsområde er standardisering av resistensbestemmelser for de medisinsk mikrobiologiske laboratoriene. Her er AFA uunnværlig for laboratoriene. AFA er nå utelukkende et frivillig, kollegialt samarbeid mellom laboratoriene. AFA-medlemmene oppnevnes av legeforeningens spesialforeninger for infeksjonsmedisin og medisinsk mikrobiologi. AFA må få en sterkere offentlig støtte og en formalisert tilknytning til Norsk overvåkingssystem for resistens hos mikrober.
4.4.3 Kvalitetssikring av resistensbestemmelser
Laboratoriene bør kvalitetssikre sine resistensbestemmelser i overensstemmelse med krav til akkreditering. Kostnaden for å oppnå akkreditering kan være betydelige mens kostnadene for ukentlig resistenskontroll etter akkreditering er relativt beskjedne i medisinsk mikrobiologiske laboratorier. Ved mindre laboratorier vil kostnadene relativt sett være betydelig høyere.
4.4.4 Spesial- og referansefunksjoner
Som i den kliniske medisinen er det innenfor medisinsk mikrobiologi behov for arbeidsdeling. En slik arbeidsdeling skjer vanligvis på basis av agens slik at et laboratorium undersøker flere egenskaper ved en bakterie gjennom f.eks. typing og markørundersøkelser.
Spesialfunksjoner
Med spesialfunksjoner menes pasientrettete undersøkelser som et laboratorium gjør på vegne av et annet. Mikroben blir sendt til et annet laboratorium for mer sofistikerte undersøkelser for å identifisere mikroben eller bekrefte det første laboratoriets funn. Slike undersøkelser må gjøres fortløpende da resultatet kan få betydning for behandlingen av den enkelte pasient.
Referansefunksjoner
Med referansefunksjoner menes samfunnsrettete undersøkelser med kartlegging og overvåking som formål. Alle isolater av en bakterie samles fra alle laboratoriene for å undersøke fordeling av visse egenskaper, for eksempel resistens, over tid. Slike undersøkelser kan gjøres samlet én eller flere ganger i året. Bakteriene oppbevares nedfrosset og kan undersøkes for nye egenskaper og med nye teknikker mange år seinere.
Tiltak
Innen medisinsk mikrobiologi er det behov for en større formalisering av de ordninger som i dag fungerer rimelig bra for spesial- og referansefunksjoner. Det er også nødvendig å utrede de økonomiske sider ved ordningene, både for de laboratorier som sender og for dem som mottar prøver til spesial- eller referanseundersøkelse.
4.4.5 Norsk senter for kvalitetssikring av laboratorievirksomhet utenfor sykehus (NOKLUS)
Prosjektgruppa ser positivt på at NOKLUS kvalitetssikrer allmennlegenes mikrobiologiske analyser, som hurtigtester for mononukleose og gruppe A-streptokokker og dyrkning av bakterier fra urin. Dette må utvides.
NOKLUS bør fortsette det nordiske samarbeidet om å vurdere validitet og anvendbarhet av nye infeksjonsrelaterte hurtigtester som grunnlag for råd til allmennlegene.
I kvalitetssikringsopplegget bør NOKLUS enda oftere inkludere klinisk relevante problemstillinger vedrørende infeksjoner. Dette kan gjerne skje i samarbeid med de foreslåtte sentre for antibiotikabehandling i allmennpraksis (se 4.5.4).
4.4.6 Legers prøvetaking
Riktig prøvetaking og mulighet for mikrobiologisk diagnostikk er viktig ved mange infeksjoner. Riktig prøvetaking betyr både at prøve tas i de riktige situasjonene, og at den tekniske utførelsen er så god som mulig, herunder at legen benytter riktig utstyr og sender prøven på riktig måte til laboratoriet. De enkelte medisinsk mikrobiologiske laboratorier og Folkehelsa har et ansvar for å veilede legene om den tekniske utførelsen av prøvetakingen. De kliniske fagmiljøene må sammen med laboratoriene lage retningslinjer for når det er god medisinsk praksis å ta prøver.
4.4.7 Veterinærers prøvetaking
Optimal diagnostikk er en forutsetning for optimal antibiotikabruk. Kunnskap om resistenssituasjonen lokalt er av stor betydning for veterinæren i klinisk praksis når behandlingen må settes i gang før mikrobiologisk prøvesvar foreligger.
Innsending av prøvemateriale til mikrobiologisk undersøkelse bekostes i dag av dyreeier. Husdyrnæringen driver under stramme økonomiske betingelser, og den enkelte dyreeier vil naturligvis vurdere kostnad opp mot nytte. I en slik situasjon vil dyreeier gjerne velge bort den ekstrakostnaden innsending av prøvemateriale er. Dette kan være uheldig for behandlingen i det enkelte tilfellet og særlig for overvåkingen av resistenssituasjonen.
Veterinærinstituttet må få mulighet til å utføre de mikrobiologiske undersøkelsene uten kostnad for dyreeier og veterinær. Veterinærene må gis insentiver for innsending av tilstrekkelig prøvemateriale. En kan også tenke seg at Statens dyrehelsetilsyn ved distriktsveterinærene står for et visst årlig prøveuttak på samme måte som nasjonale overvåkings- og kontrollprogrammer foregår i dag. Dette innebærer at staten dekker disse kostnadene eller at det etableres andre ordninger som sikrer god veterinærmedisinsk praksis.
4.5 Riktigere bruk av antibiotika: Samarbeid med rekvirenter
I dette kapitlet omtales først (4.5.1) bakgrunn og begrunnelse for valg av tiltak. Ut fra kunnskapsgrunnlaget som presenteres, gruppas vurderinger og norske tradisjoner foreslås tiltak for å forbedre rekvireringen av antibiotika i Norge. Vi anbefaler at nye tiltak som hovedregel bygger videre på de tiltak, organisasjoner, rutiner og strukturer som allerede fins. Hvert tiltak omtales i et eget delkapittel (4.5.2 - 4.5.8).
4.5.1 Bakgrunn og begrunnelse for valg av tiltak
Bakgrunn
Også i Norge anvendes mer antibiotika enn nødvendig. Antibiotika benyttes noen ganger på feil indikasjon og det velges feil antibiotikum, feil dose og feil behandlingstid. Bruken av antibiotika er ikke god nok ut i fra hensynet til den enkelte pasient eller resistenssituasjonen.
Særlig i behandlingen av øvre luftveisinfeksjoner utenfor sykehus, den hyppigste årsaken til antibiotikabehandling i Norge, er det store muligheter for riktigere bruk av antibiotika [1,2].
I sykehusene og andre helseinstitusjoner er det også muligheter for forbedringer. Sykehusene spiller en helt sentral rolle. Her behandles så og si alle pasienter med alvorlige infeksjoner som blodforgiftning, utbredte kirurgiske sårinfeksjoner, alvorlige lungebetennelser, hjernehinnebetennelse, betennelser i hjerteklaffer og ikke minst infeksjoner hos pasienter med nedsatt infeksjonsforsvar (pasienter med transplanterte organer, leukemi, HIV-infeksjon og andre). Dertil kommer at pasienter med en rekke mindre alvorlige infeksjoner (infeksjoner i hud, bein, ledd og underliv, mage-tarminfeksjoner, moderate lungebetennelser osv.) også behandles her. Endelig brukes antibiotika ofte til forebyggelse av kirurgiske sårinfeksjoner.
Alt dette fører til at sykehusene er storforbrukere av antibiotika. På flere avdelinger går inntil halvparten av medikamentbudsjettet med til innkjøp av antibiotika, ikke minst bredspektrete medikamenter med betydelig fare for resistensutvikling. Særlig gjelder dette intensivavdelinger, men også kirurgiske, indremedisinske og pediatriske avdelinger.
Videre er det ennå forbedringsmuligheter innen veterinærmedisinen.
Endring av denne situasjonen forutsetter blant annet endring av atferd hos rekvirentene av antibiotika, dvs. leger, tannleger og veterinærer. Farmasøyter, sykepleiere og andre helsepersonellgrupper har også viktige roller.
Omtalen nedenfor gjelder i hovedsak leger (og tannleger). Til en viss grad kan de samme forhold gjelde for veterinærer. Forhold som er spesifikke for veterinærer, er omtalt under hvert avsnitt.
Hindringer for optimal antibiotikarekvirering
Medisin
Legens utfordring er å finne - blant mange pasienter med tilsynelatende uskyldige infeksjonssykdommer - dem som skal ha antibiotika og deretter å velge det riktige antibiotikum. Det er en vanskelig oppgave.
Legens mangel på kunnskap om de rette indikasjoner for antibiotika kan i noen tilfeller være en forklaring på suboptimal bruk av antibiotika. Selv med oppdaterte kunnskaper, kan det imidlertid være en rekke årsaker til at legen ikke følger en god praksis. For eksempel kan følgende forhold gjøre at legen finner det enklere og mer bekvemt å gi pasienten antibiotika [3-5]:
- Klinisk usikkerhet om korrekt diagnose fordi diagnosen basert på vanlig klinisk undersøkelse ofte er vanskelig.
- Mangel på gode diagnostiske verktøy til bruk i klinisk praksis, som pålitelige hurtigtester.
- Redselen for å overse den sjeldne pasienten som har en begynnende alvorlig og kanskje livstruende sykdom som kan helbredes med antibiotika, blant de mange pasientene med uskyldige virussykdommer. I dette dilemmaet velger legen kanskje å behandle flere enn nødvendig med antibiotika "for sikkerhets skyld".
- Sor avstand mellom legekontor og pasienens bolig slik at en eventuell ny konsultasjon blir besværlig for pasienten eller rask forverring kan bli farlig for pasienten.
- Frykt for søksmål hvis antibiotika ikke gis og pasienten senere utvikler alvorlig sykdom.
- Tidspress og mindre forpliktende lege-pasientforhold under legevakt.
- Pasientens forventninger (og noen ganger krav) om antibiotika oppfylles av en lege som ikke ønsker å skuffe eller ødelegge forholdet til pasienten. Pasientens krav kan forsterkes av praktiske forhold som at det er dagen før eksamen eller utenlandsreise, eller at barnet ikke tillates i barnehagen før antibiotikabehandling er satt i gang.
- Rutinene på legekontoret eller sykehusavdelingen kan være mangelfulle.
- Administrative forhold. For eksempel kan legen ha dårlig tid i den aktuelle konsultasjonen. Videre kan legen ønske å unngå ny konsultasjon pga. tidspresset og fordi det vil påføre pasienten ytterligere kostnader.
I en nyere kvalitativ studie av walisiske allmennlegers antibiotikarekvirering for sår hals fant man at legene var klar over at de ikke fulgte god praksis, og de var ukomfortable med dette [4]. De prioriterte imidlertid hensynet til det langsiktige forholdet til pasientene, som forventet antibiotika, foran økologiske hensyn. Legene nevnte også tidspress som en grunn; det går fortere (og er mer bekvemt) å skrive ut en resept enn å forklare hvorfor antibiotika ikke er nødvendig. Frykt for søksmål ble også nevnt.
Vi kjenner ikke noen tilsvarende studie fra Norge, men kjenner til en viss grad igjen de samme trekkene. Intervensjoner for å endre atferd bør ta utgangspunkt i de hindringer som antas å ha særlig betydning for de aktuelle legene. Dette kan man finne ut ved studier av leger, f.eks. gjennom personlig intervju og gruppediskusjoner, og dette anbefales før intervensjoner.
Veterinærmedisin
I tillegg til at veterinærer møter mange av de samme hindringer for optimal antibiotikabruk som leger, kan følgende forhold utgjøre ytterligere hindringer:
- Økonomiske og geografiske forhold som gjør at veterinæren velger terapi som ikke er i tråd med gjeldende anbefalinger.
- Mangelfull tilgang på godkjente veterinærmedisinske preparater kan hindre optimal antibiotikaterapi. Eksempel: Ettersom Norge er et så lite marked, finner ikke legemiddelfirmaene det rekningssvarende å søke godkjenning for og holde på markedet så mange smalspektrete preparater med liten fortjenestemargin.
- Praktiske problemer som smak og formulering av legemidlet. Dette gjelder når dyreeier selv skal administrere legemidlet til for eksempel en katt.
Intervensjoner for å endre atferd
Intervensjoner basert på frivillighet er pedagogiske tiltak og kombinasjoner av positive og negative insentiver. Formålet er å få mange rekvirenter til å forbedre sine rekvireringsvaner litt heller enn å få noen få rekvirenter til å forandre vanene mye.
Intervensjoner for å endre allmenn- og sykehuslegers atferd deles gjerne i følgende grupper [6-8]. De fleste forsøk på å oppnå atferdsendring har inkludert elementer fra flere av intervensjonsmetodene.
- Veiledningsmateriell er trykte eller elektroniske retningslinjer og veiledere som kan leveres personlig eller sendes til den enkelte.
- Kurs inkluderer konferanser, forelesninger og diskusjonsgrupper utenfor legekontoret eller sykehuset.
- Lokale opinionsledere som av kolleger nevnes som innflytelsesrike, kan brukes til å oppnå atferdsendring hos sine kolleger.
- Pasientrettete intervensjoner tar sikte på å endre legens atferd indirekte gjennom at andre gir informasjon (muntlig eller skriftlig) til pasientene, for eksempel i form av offentlig helseopplysning.
- Praksisregistrering og tilbakemelding er en kvantitativ oppsummering av egen praksis over en periode, gjerne sammenliknet med andre legers gjennomsnitt i samme periode. Et eksempel er andel bronkittpasienter som fikk antibiotika. Tilbakemeldingen kan inkludere anbefalinger om kliniske forbedringer. Tilbakemeldingen kan diskuteres i kollegiale grupper, eventuelt med veileder.
- Påminnelser er enhver intervensjon, skriftlig, muntlig eller elektronisk, som minner legen om å utføre en viss handling. Et eksempel kan være små meldinger på skjermen ved inntasting av en viss diagnose: "Du har vel ikke tenkt å rekvirere antibiotika for denne pasienten med ørebetennelse?"
- Konsulentbesøk er veiledningsbesøk til legen på legekontoret av en person som er særlig utdannet i det aktuelle temaet. Metoden benyttes i utstrakt grad av legemiddelindustrien.
- Praksisbesøk er gjensidige ordninger der to eller flere leger gjensidig besøker hverandres legekontorer og observerer og diskuterer hverandres praksis.
Man kan også tenke seg intervensjon i form av tilsyn og regulering. Dette er nærmere omtalt i 4.9.1 og 4.9.2.
Effektivitet av intervensjoner
Det har vært utført få metodisk adekvate studier av effektivitet av intervensjoner for å endre helsepersonells atferd [6-13]. De fleste studiene er fra Nord-Amerika og gjelder leger. Bare i en håndfull studier har man undersøkt effekt på antibiotikarekvirering. Rekvirering av andre legemidler har vært undersøkt i noen flere studier. Studiene er likevel det beste kunnskapsgrunnlaget vi per i dag har for å velge de mest effektive intervensjoner for å endre legers, tannlegers og veterinærers antibiotikarekvirering.
Effektive intervensjoner
Praksisregistrering og tilbakemelding slik som i Sats (se 2.5.3) kombinert med andre intervensjoner ser ut til å være effektivt i å endre legers rekvirering av legemidler [9-10].
Konsulentbesøk og bruk av lokale opinionsledere, særlig når de tar utgangspunkt i kartlegging av hindringer for god praksis, ser ut til å være en lovende metode for å endre legers rekvirering av legemidler [11-12]. En norsk studie fra Regionsykehuset i Trondheim [14] var i overensstemmelse med dette. Bruk av en infeksjonsmedisiner som veileder for sykehusets andre leger og jevnlig tilbakemeldinger til klinikerne økte oppslutningen om behandlingsretningslinjene.
Påminnelser og kurs som inkluderer gruppediskusjoner av egen praksis (slik som ved gjensidige praksisbesøk) kan være effektivt.
Intervensjoner med ingen, liten eller usikker effekt
Veiledningsmateriell aleine har i beste fall en liten innvirkning på legers atferd [6-8,13]. Metoden er imidlertid i seg selv nokså billig og bør kombineres med andre intervensjoner.
Lokale opinionsledere aleine kan i noen tilfeller initiere atferdsendring, men effekten er uforutsigbar [6-8,12]. Pasientrettete intervensjoner og tradisjonelle kurs med forelesninger aleine ser ut til å være lite effektive [6-8].
4.5.2 Grunnutdanningen
Mye av grunnlaget for helsepersonells profesjonelle vaner legges i grunnutdanningen. Dette kan også gjelde vaner med rekvirering av antibiotika. Det er derfor nødvendig at problemstillinger knyttet til resistens blir integrert i undervisningen om infeksjoner i flere fag.
De medisinske fakultetene må gå gjennom sine studieplaner med tanke på å styrke undervisningen om resistens. Særlig bør resistens bli et tema også i relevante kliniske fag (særlig allmennmedisin, pediatri og øre-nese-halssykdommer), og ikke bare i mikrobiologi og infeksjonsmedisin. De samme anbefalinger gjelder de odontologiske fakultetene.
Det er videre ønskelig at Norges veterinærhøgskoles undervisning om antibiotikaresistens blir enda bedre integrert i de ulike fagdisiplinene i veterinærutdanningen. Problembasert læring er nylig vedtatt innført ved Veterinærhøgskolen og dette forventes å styrke grunnlaget for integrert undervisning.
Stadig flere leger og veterinærer som praktiserer i Norge, er utdannet i utlandet. Dette skyldes delvis at stadig flere nordmenn tar sin utdannelse i utlandet og delvis at utenlandske leger og veterinærer flytter til Norge for å arbeide. Mange har både utdanning og praksis fra land med til dels uheldig og liberal holdning til antibiotikabruk. Vi foreslår at antibiotika og resistens blir et enda viktigere tema ved undervisningen av utenlandsutdannete leger og veterinærer som skal praktisere i Norge. Påvirkningen hjemmefra av norske studenter i utlandet kan ta til allerede før de kommer hjem for å praktisere ved at norske myndigheter i samarbeid med de norske lærestedene sender materiell til studentene, f.eks. norske veiledningshefter om antibiotikabruk.
4.5.3 Sykehus og andre helseinstitusjoner
Antibiotikastrategi
Alle helseinstitusjoner skal ha skriftlige retningslinjer for bruk av antibiotika, jfr. Forskrift om smittevern i helseinstitusjoner - sykehushygiene §§ 2-1 og 2-2. Retningslinjene inngår i institusjonens infeksjonskontrollprogram og tilpasses institusjonens virksomhet og de lokale infeksjonsproblemer og resistensforhold.
Antibiotikastrategien må inneholde minst følgende elementer:
- Retningslinjer for behandling og forebygging med antibiotika. Slike retningslinjer kan ta utgangspunkt i eksisterende retningslinjer, som Statens helsetilsyns eller regionsykehusenes veiledere. Retningslinjene kan gjerne uttrykkes i et hefte. Det bør inneholde blant annet anbefalinger om førstevalgs- og alternative regimer for de aktuelle infeksjoner, kriterier for å avslutte behandling eller skifte antibiotikum og kriterier for å søke råd hos infeksjonsmedisiner eller medisinsk mikrobiolog. (Dette punktet er minimumskravet i forskriften.)
- Retningslinjer for prøvetaking, innsending av prøver og for svar fra det medisinsk mikrobiologiske laboratoriet.
- Antibiotikaliste.
- Overvåkingssystem for antibiotikaforbruk (se 4.3.4).
- Overvåkingssystem for resistensforhold (se 4.2.6).
Antibiotikakomité
Alle sykehus må ha en antibiotikaansvarlig person eller en antibiotikakomité som skal samarbeide med eller utgå fra sykehusets legemiddelkomité og hygienekomité. Komitéen kan, der slike spesialister er tilgjengelige, bestå av medisinsk mikrobiolog, infeksjonsmedisiner, farmasøyt og smittevernpersonell. Personen eller komitéen må få et sterkt og klart mandat fra sykehusledelsen til å koordinere utviklingen, iverksettingen og oppfølgingen av sykehusets antibiotikastrategi. Videre må komitéen eller personen overvåke resistensforhold og antibiotikaforbruk.
Ved behov kan antibiotikakomitéen iverksette tiltak for å fremme legers lojalitet mot antibiotikastrategien. Mulige tiltak er:
- Rekvireringsrestriksjoner, f.eks. at visse antibiotika kan rekvireres bare av overleger eller infeksjonsleger eller bare etter konferanse med antibiotikakomitéen.
- Intensivert registrering av forbruk og tilbakemelding for den enkelte lege, post og avdeling.
- Konsulentbesøk der medlemmer av antibiotikakomitéen har samtaler med den enkelte lege, gjerne i tilknytning til tilbakemelding på praksis.
- Gruppediskusjoner med utgangspunkt i konkrete problemstillinger, f.eks. på morgenmøte eller fagmøter.
- Krav om utvidet journalføring ved start av antibiotikabehandling som avviker fra antibiotikastrategien, eller ved start av all antibiotikabehandling.
- Rutiner for at all antibiotikabehandling som iverksettes, snarest skal gjennomgås av særlig kompetent person.
- Automatisk stopp og revurdering av antibiotikabehandling etter ei bestemnt tid.
- Komitéen skal delta når konsulenter fra legemiddelindustrien holder møter på sykehuset (se 4.5.7).
Sykehusene innen et fylke kan samarbeide om antibiotikastrategien og for eksempel ha en felles antibiotikakomité.
Andre helseinstitusjoner, særlig sykehjemmene, bør inngå avtaler med de fylkeskommunale sykehus om tjenester vedrørende antibiotikastrategi og -komité. Dette kan inngå i kommunenes smittevernplan.
Også sykepleierne, smittevernpersonell og annet personell i helseinstitusjoner må informeres om og støtte opp om antibiotikastrategien.
4.5.4 Allmennpraksis
Smågrupper
Stadig flere allmennleger deltar nå i smågrupper med veiledning av en erfaren kollega. Gruppearbeidet suppleres gjerne med gjensidige praksisbesøk og praksisregistreringer med tilbakemelding. Antibiotikarekvirering har vært tema for flere slike grupper, blant annet i regi av Sats (se 2.5.3) [16]. Både smågruppedeltaking og praksisbesøk er nå blitt obligatoriske i videreutdanningen til spesialist i allmennmedisin og i fornyingen av spesialiteten hvert femte år.
Allmennleger bør stimuleres enda sterkere til å delta i slike kvalitetsforbedrende pedagogiske opplegg. Gruppene bør prioritere resistens som tema. Det må utvikles moduler for de elektroniske journalsystemene slik at disse enkelt kan registrere praksis vedrørende antibiotikarekvirering. Alternativt kan man benytte data fra registreringene i det lokale apotek. Data fra reseptbasert legemiddelstatistikk egner seg godt for integrering i den samme pedagogiske prosessen. Smågruppene kan også samarbeide med det medisinsk mikrobiologiske laboratoriet, apoteket, NOKLUS og sykehusspesialistene om aktuelle temaer.
Konsulentbesøk
De legene som ikke deltar i smågrupper eller gjensidige praksisbesøk, kan være en viktig målgruppe for forsøk på forbedret antibiotikarekvirering. Trolig vil mange utenlandske leger være i denne kategorien. Konsulentbesøk kan egne seg for dem. Det bør utdannes et korps av antibiotikakonsulenter rekruttert blant interesserte leger og farmasøyter.
Påminnelser
De fleste allmennleger benytter elektronisk journalsystem fra én av tre leverandører. I disse programmene kan det legges inn muligheter for elektroniske påminnelser på skjermen ved inntasting av f.eks. visse diagnosekoder, visse antibiotika eller mange antibiotikaresepter til samme pasient.
Senter for antibiotikabehandling i allmennpraksis
Det må utredes å opprette et senter for antibiotikabehandling i allmennpraksis, for eksempel for en prøveperiode på fem år. Senteret knyttes til et allmennmedisinsk institutt. Senteret får ansvar for å
- bidra til at smågruppene inkluderer antibiotikabehandling og resistens i sitt arbeid blant annet gjennom å samordne utviklingen av informasjonsmateriell til dette etter SATS-modellen og holde kurs for veilederne,
- samarbeide med programvareleverandørene om å tilrettelegge for lokale praksisregistreringer og elektroniske påminnelser ved visse diagnoser,
- samle inn og distribuere kunnskapsbaserte data om diagnostikk og behandling av infeksjonssykdommer i primærhelsetjenesten,
- bidra til utredning og forskning om infeksjonsmedisin, antibiotikabehandling og resistens i allmennmedisin (se 4.8.2),
- organisere utdanning og utsending av antibiotikakonsulenter,
- samarbeide med Norsk overvåkingssystem for resistens hos mikrober (NORM) om hensiktsmessig overvåking av resistens,
- samarbeide med Statens helsetilsyn om hensiktsmessig bruk av den nasjonale reseptbaserte antibiotikastatistikken i praksisregistrering og tilbakemelding, og
- samarbeide med de ansvarlige for kampanjer om antibiotika (se 4.6.7)
- holde kontakt med de medisinsk mikrobiologiske, infeksjonsmedisinske og andre fagmiljøer ved sykehusene.
Dersom senteret blir vellykket, bør man utrede å opprette tilsvarende sentre ved alle universitetene.
Fastlegeordningen
Fastlegeordningen vil sannsynligvis bidra til bedre antibiotikabruk. Større kontinuitet i forholdet mellom lege og pasient kan gi legen bedre mulighet til å forklare ulempene med unødvendig antibiotikabruk.
I tillegg reduserer man problemet med at pasienten som ikke får en unødvendig antibiotikaresept, prøver på ny hos en annen lege. For legen kan det da bli enklere å si nei til unødvendige resepter fordi legen slipper å frykte at pasienten bare går videre til neste lege som kanskje gir resept og derfor kan bli oppfattet som både dyktigere og snillere.
Antibiotikabruk må være med som et moment i evalueringen av fastlegeordningen.
Gratis revurdering
I Sverige har man gode erfaringer med å tilby pasientene gratis revurdering hos legen innen få timer eller dager der legen er i tvil om antibiotika er indisert. Tanken er at dette skal gjøre det enklere for legen å la være å rekvirere antibiotika ved tvilstilfeller. Legen kan være sikrere på at de pasientene som opplever forverring av plagene virkelig kommer tilbake samtidig som de fleste ikke kommer tilbake fordi kroppen selv leger sykdommen.
Pasientene på sin side får kanskje mindre følelse av å gå tomhendt fra legens kontor etter venting på å komme inn og betaling av honorar. De er iallfall sikret en gratis konsultasjon dersom det skulle bli nødvendig.
Imidlertid er det ikke bare honoraret som gjør pasientene lite lystne på en ny konsultasjon dagen etter. Reise- og ventetida er også viktig. Ordningen kan derfor kanskje kombineres med prioritert plass i legevaktskøen.
Det kan være verdt å prøve ut en slik ordning i Norge, i første omgang for eksempel ved noen større legevakter. Pasienter der legen er i tvil om antibiotika er indisert, kan få nøye informasjon om muligheten for revurdering samt et fripass med gyldighet i 48 timer.
Utsatt resept?
En forenklet variant av dette tiltaket er såkalt utsatt resept. Det betyr at pasienten får resept med beskjed om å kjøpe og ta antibiotika bare dersom sykdommen vedvarer utover et visst tidsrom. Prosjektgruppa vil ikke generelt anbefale et slikt tiltak før det er grundig evaluert. Det må blant annet avklares hva pasientene virkelig gjør med slike utsatte resepter. Det er jo heller ikke slik at det er noen nødvendig sammenheng mellom sykdommens årsak (virus eller bakterie) og sykdommens varighet. Tiltaket har i tillegg potensielle uheldige virkninger:
- Det blir et påskudd for legen til ikke å følge anbefalt praksis. Hun tror hun følger en streng praksis, men i virkeligheten rekvirerer hun like mye som før.
- Pasienten kan spare resepten eller legemidlet og behandle seg selv eller andre ved et seinere sykdomstilfelle. Forbruket reduseres dermed ikke; det bare forskyves.
- Pasienten vender ikke tilbake til legen ved potensielt alvorlig forverring, men starter i stedet med antibiotika.
4.5.5 Veterinærmedisinen
Antibiotika er den legemiddelgruppen som hyppigst rekvireres til dyr. Innen veterinærmedisinen er det behov for tiltak for å optimalisere antibiotikabruken med hensyn til farmakoterapi, næringsmiddelhygiene, miljø og mulige konsekvenser for humanmedisinen.
Veterinærmedisinsk legemiddelinformasjonssenter (VETLIS)
Et veterinærmedisinsk legemiddelinformasjonssenter har fungert i en prøveperiode. Senteret er bygget opp etter modell av de humanmedisinske regionale legemiddelinformasjonssentre (RELIS). VETLIS har høstet viktige erfaringer og avdekket et behov blant veterinærene og apotekene for vitenskapelig basert og produsentuavhengig legemiddelinformasjon. Disse forholdene tilsier at VETLIS bør etableres på permanent basis.
Terapiverksteder
Terapiverksteder avholdes en gang årlig med veterinærmedisinsk tema. På norsk side samarbeider Statens legemiddelkontroll og Statens dyrehelsetilsyn om verkstedene. Anbefalingene som kommer fra disse verkstedene, sendes ut til alle norske veterinærer. Dyrehelsetilsynet fremmer anbefalingene overfor praktiserende veterinærer gjennom sin distriktsbaserte organisering, med 210 distriktsveterinærer fordelt over hele landet. Årlige terapiverksteder med veterinærmedisinsk tema bør videreføres.
Praksisregistrering og tilbakemelding
Rogalandsforskning planlegger i samarbeid med Norges veterinærhøgskole, Statens dyrehelsetilsyn og andre et prosjekt hvor veterinærers rekvirering av antibiotika undersøkes på regionalt nivå. Resepter vil bli registrert i apotekene. Veterinærene får tilbakemelding og kan sammenlikne sin egen praksis med gjennomsnittet for regionen. Formålet er å starte en pedagogisk prosess der veterinæren kan reflektere over egen praksis og korrigere denne.
Data fra en nasjonal reseptbasert legemiddelstatistikk som omfatter veterinærers rekvirering kan etterhvert integreres i slike prosjekter, eventuelt på permanent basis.
4.5.6 Videre- og etterutdanning
Muligheten for at resistens kan bli et alvorlig folkehelseproblem også i Norge gjør at synet i fagmiljøene på antibiotikabehandling har endret seg raskt. Dette nye synet og den nye kunnskapen er det nødvendig å formidle til allerede utdannete leger, veterinærer og tannleger. Vi foreslår derfor følgende tiltak:
- Fagforeningene og lærestedene for leger, tannleger, veterinærer og andre relevante faggrupper (særlig farmasøyter og sykepleiere) bør ytterligere prioritere resistens som tema for videre- og etterutdanningen.
- Resistens bør bli et tema i kurs og andre læringsformer for flest mulig kliniske medisinske spesialiteter og i særlig grad allmennmedisin.
- Kurs i antibiotika bør vurderes gjort obligatorisk for å oppnå spesialitetene medisinsk mikrobiologi og barnesykdommer slik det allerede er for spesialiteten infeksjonssykdommer. Kurs i antibiotika kan også vurderes gjort obligatorisk ved eventuell resertifisering innen disse og andre spesialiteter.
- Legeforeningen og dens Norsk forening for medisinsk mikrobiologi og Norsk forening for infeksjonsmedisin bør gjennom markedsføring og andre tiltak bidra til at en større andel enn normalt av de neste ti års store kull av leger velger å utdanne seg til medisinske mikrobiologer og infeksjonsmedisinere. Staten og fylkeskommunene bør bidra med å opprette flere utdanningsstillinger i fagene og ellers legge forholdene til rette for økt utdanning av spesialister. Nasjonalt råd for spesialistutdanning for leger bør likeledes bidra.
- Helsepersonell med særlig kompetanse bør bidra til å spre kunnskap om resistensproblemet og antibiotikabruk, f.eks. gjennom foredrag, fagtidsskrifter og nyhetsbrev.
4.5.7 Legemiddelindustriens rolle
Legemiddelindustrien har et legitimt ønske om å sikre størst mulig avkastning på de investeringer som er gjort i utviklingen av nye antibiotika. Utviklingskostnadene for nye antibiotika er svært store. Firmaet har kort tid på å oppnå avkastning etter som patentbeskyttelsen har begrenset varighet. Dette gjør at et firma normalt vil kunne fristes til å drive intensiv markedsføring av nye legemidler for å oppnå størst mulig salg.
Markedsføring
Markedsføringen av reseptbelagte legemidler kan bare skje overfor rekvirentene. Den tar gjerne følgende former:
- Legemiddelkonsulenter som besøker rekvirentene, i første rekke leger.
- Reklame i fagtidsskrifter, i brosjyrer og penner, blokker, kalendere mv. som sendes i posten og på Internett mv.
- Sponsing av kurs og kongresser og rekvirenters deltaking i disse.
- Utdeling av gratis prøvepakker av medikamenter.
- Utprøving av nye legemidler i forsøk som involverer mange leger (multisenterstudier).
Interessekonflikten
Legemiddelindustriens ønske om profitt kan kollidere med samfunnets ønske om fornuftig bruk av antibiotika. Vårt ønske om mindre bruk av mange antibiotika kan støte mot industriens ønske om større salg. I markedsføring av antibiotika vil derfor legemiddelindustrien i stor grad møte etiske dilemmaer; i verste fall spille en negativ rolle.
Helsepersonells, fagmiljøers og myndigheters bevisste holdning til legemiddelindustriens mål og midler er en forutsetning for korrekte relasjoner. Industriens virksomhet kan møtes med samarbeid, alternativer og lovregulering.
Samarbeid
To samarbeidsformer foregår allerede og bør fortsette:
- Helsepersonell deltar i utdanningen av legemiddelkonsulentene. Målet er å gjøre dem kjent med den norske tradisjonen og fagpolitikken på antibiotikaområdet. Disse kan skille seg betydelig fra det konsulenten har lært i den interne utdanningen som kanskje har foregått i firmaets hjemland.
- Legeforeningen foreslår deltakere til Legemiddelindustriforeningens Råd for vurdering av legemiddelinformasjon.
I tillegg kan norske spesialister tilby seg at industrien tester ut sine utenlandsk utformete reklame- og undervisningsopplegg på dem slike at oppleggene kan tilpasses den norske antibiotikatradisjon og resistenssituasjon.
Alternativer og kritisk holdning
Industriens markedsføring kan også møtes med bedre alternativer og en kritisk holdning:
- Produsentuavhengig veiledning om antibiotika (se 4.5.3 og 4.5.4) bør være bedre, mer relevant og mer tilgjengelig enn industriens markedsføring.
- Ved besøk av legemiddelkonsulenter i sykehus skal antibiotikakomitéen varsles og gis muligheten til å være til stede for blant annet å påpeke eventuelle misvisende utsagn og kommentere konsulentens budskap i forhold til sykehusets antibiotikastrategi.
- Smågruppene i allmennpraksis (se 4.5.4) bør drøfte legemiddelkonsulentenes virksomhet og drøfte deres budskap i forhold til legenes egen kunnskapsbaserte praksis.
- Helsepersonell bør oftere reagere på markedsføring. Benytt fagtidsskriftene til å imøtegå eventuell misvisende reklame. Ta ordet på møter. Advar kolleger mot feil markedsføring. Gi melding om brudd på industriens egne regler til Rådet for vurdering av legemiddelinformasjon. Gi melding om brudd på Forskrift om reklame for legemidler til Statens legemiddelkontroll.
- Leger, tannleger, veterinærer og farmasøyter bør prioritere og gis anledning til å delta i ikke-kommersielle kurs, veiledningsgrupper og andre aktiviteter og til lesing av ikke-kommersielt veiledningsmateriell.
4.5.8 Veiledere i antibiotikabruk
Slike faglige veiledere er viktige fordi de kan gi oversikt over anbefalte praksis, høyne kvaliteten på helsetjenester og bedre ressursutnyttelsen. Imidlertid har veiledere alene begrenset betydning for å oppnå endring i praksis [6-8,13].
Mange aktører
Veiledning om antibiotikabehandling, blant annet i form av egne hefter, gis av en rekke aktører: Statens legemiddelkontroll, Legeforeningen og Apotekerforeningen, legemiddelindustrien, sykehusene, RELIS, Folkehelsa, Statens helsetilsyn og andre. Innenfor veterinærmedisinen er det til sammenlikning få aktører som veileder praktiserende veterinærer om antibiotikabruk.
En del av veiledningen oppfyller ikke de krav som bør stilles til råd om medisinsk praksis [17]. Det er uklart hvor mange av dem som bygger på systematiske oversikter over tilgjengelig kunnskap. Flere blir ikke løpende oppdatert.
Samordning
De ulike utgivere av medisinske antibiotikaveiledere må i større grad samordne sine utgivelser. Dette kan motvirke motstridende anbefalinger og spare ressurser som heller kan benyttes til implementering av veilederne. Slik samordning er også nødvendig i møte med nye problemstillinger, som antibiotikabehandling av magesår og hjertesykdommer. De nye Retningslinjer for retningslinjer [17] gir anbefalinger for hvordan slike veiledere kan samordnes. Blant annet er det viktig å søke i Helsetilsynets database om det fins veiledere på det aktuelle området fra før.
Innenfor veterinærmedisinen kan en for eksempel tenke seg at Norges veterinærhøgskole, Den Norske Veterinærforening, Statens dyrehelsetilsyn, Statens legemiddelkontroll, Veterinærinstituttet, VETLIS og eventuelt andre aktører (næringsorganisasjonene) etablerer et felles organ hvor hovedlinjene i veiledningene forankres. Dermed kan de ulike organisasjonenes og etatenes muligheter for veiledning utnyttes optimalt.
Videre bør flere av veilederne rustes opp for å tilfredsstille de krav som vanligvis stilles til faglige veiledere [17].
4.6 Riktigere bruk av antibiotika: Kommunikasjon med publikum
4.6.1 Innledning
Forsøk på å endre rekvirentenes atferd må skje samtidig med forsøk på å påvirke publikums kunnskaper, holdninger og atferd. Dette må skje i et samlet opplegg, ikke som mange ukoordinerte småprosjekter. Nedenfor omtales først (4.6.2 - 4.6.5) kommunikasjon med publikum for å gjøre deres egen og pårørendes bruk av antibiotika riktigere. Deretter (4.6.6) omtales kommunikasjon med dyreeiere for å bidra til bedre antibiotikabehandling av dyr.
4.6.2 Bakgrunn for kommunikasjon med pasienter og pårørende
Pasienters holdninger og forventninger
Mange pasienter forventer å få antibiotika ved legebesøk for øvre luftveisinfeksjoner [18]. Forskningen har vist at pasienter som har slik forventning, har større sjanse for å få antibiotika [19]. Når legen fornemmer at pasienten forventer antibiotika, er det flere ganger så stor sjanse for at antibiotika faktisk blir rekvirert [20]. Imidlertid har legen en tendens til å overvurdere hvor mange av pasientene som faktisk forventer antibiotika [21]. Dermed oppstår forventningssirkler som fremmer unødvendig antibiotikabruk.
Om antibiotika blir rekvirert eller ikke, kan ha betydning for pasientens tilfredshet med konsultasjonen [22-25]. I en nyere kvalitativ studie av konsultasjoner for sår hals i walisisk allmennpraksis var det imidlertid også en rekke andre faktorer som spilte inn [18]. Pasientene ønsket først og fremst å bli tatt på alvor og ikke bli avfeid med utsagn som: "Dette er bare en virusinfeksjon som går over av seg selv". Pasientene ville ha forklart hvorfor de fikk infeksjonene, hvorfor antibiotika ikke var nødvendig, hvordan de skulle bli kvitt infeksjonen, og hva de kunne gjøre for å lindre plagene.
Mange pasienter ser ut til å misforstå legens forsøk på å begrense antibiotikarekvireringen. Noen pasienter oppfatter fremdeles antibiotika som et ubetinget gode. De tror legen vil holde det tilbake fra dem utelukkende av økologiske eller økonomiske grunner. Det kan derfor være nødvendig å legge mer vekt på at manglende effekt av antibiotika er hovedgrunnen til at det ikke skal benyttes ved noen alminnelig forekommende tilstander.
Misforståelser om antibiotika
Anekdotiske opplysninger fra allmennleger tyder på at de følgende misforståelsene er utbredt blant pasientene:
- "Jeg blir ikke frisk uten antibiotika." Det er utbredt mistro til kroppens evne til selv å helbrede infeksjoner. Forskning fra allmennpraksis i England viser at pasienter som får antibiotika for halsbetennelse, har større sjanse for å oppsøke lege ved en ny episode av halsvondt [26]. Pasientene læres opp til å assosiere helbredelse med antibiotika. Få pasienter kjenner til at kliniske studier viser svært moderat effekt av antibiotika ved de fleste øvre luftveisinfeksjoner.
- "Man blir resistent mot antibiotika." Noen tror at det er mennesket som blir resistent, og at man dermed kan forspille muligheten til senere å få effekt av antibiotikabehandling.
På den andre sida rapporterer nå mange leger om foreldre som motsetter seg legens foreslåtte antibiotikabehandling av barna. Det kan skyldes misforståelser som ovenfor. Dette illustrerer at budskapet må balanseres. Overdreven tro på antibiotika må ikke erstattes med antibiotikafrykt.
Selvbestemt antibiotikabruk
Utenfor sykehus er antibiotikabruk til en viss grad "selvbestemt". De største mengdene brukes for øvre luftveisinfeksjoner, og barn er storforbrukere [1,2]. Det er vitenskapelig grunnlag for å si at antibiotika har liten eller ingen effekt ved de fleste øvre luftveisinfeksjoner [27], som forkjølelse [28], bronkitt [29-31], rhinitt, ørebetennelse [32-35] og de fleste halsbetennelser [36].
De fleste leger er klar over dette og ønsker å unngå unødvendig rekvirering. Legenes ønske støter imidlertid mot foreldrenes forventninger, frykt og krav. Konsultasjonene kan få preg av forhandlinger der legene ofte gir seg fordi det er enklest der og da [18]. Mange leger ønsker hjelp til å forrykke forhandlingsbalansen, dels ved å ha sterkere offentlig støtte i ryggen (f.eks. i form av plakater og bro-sjyrer) og dels ved at foreldrene på forhånd har fått det samme budskapet fra andre, gjerne respekterte fagfolk og offentlige etater med godt omdømme.
Den informerte pasient
Flere faktorer bidrar til at lege- og pasientrollene er i endring [37]:
- Økt tilgjengelighet av medisinsk informasjon. På Internett kan alle finne de nyeste forskningsresultater om enhver sykdom.
- Redusert autoritetsfrykt.
- Økt vekt på forbrukermakt og pasientrettigheter.
Pasienten kan nå ha mer informasjon (om enn ikke mer kunnskap) enn legen og være mer krevende i samhandlingen med legen. Pasienten har lest på Internett hva slags behandling han skal ha, og han er klar over og står på sine rettigheter. Han vil ha reell medinnflytelse på avgjørelsene om sin egen behandling i et tilnærmet egalitært pasient-lege-forhold.
I denne situasjonen kan ikke og ønsker ikke legen å ha monopol på informasjon som så kan porsjoneres ut til pasienten i passende doser. Legen kan uansett aldri ha oversikt over all informasjon på Internett. I stedet må legen hjelpe pasienten å tolke og sette informasjonen inn i rett sammenheng. Legen blir like mye pasientens veileder, pedagog og diskusjonspartner som en medisinsk-faglig autoritet. Da kan pasienten ikke bare være informert, men også bli reflektert. Etterhvert møter legen stadig oftere "den reflekterte pasient".
Kommunikasjonsstrategi
Kommunikasjon med publikum må ta hensyn til blant annet forholdene nevnt ovenfor. Dette kan være en fordel. Informasjonen om den begrensete betydningen av antibiotika for helbredelse av de fleste infeksjoner i øvre luftveier må deles med pasientene. Det samme gjelder ulempene, både for den enkelte og for samfunnet, med feil bruk av antibiotika. Det må komme fram at det faktisk har skjedd en betydelig endring i synet på antibiotika innen medisinen de siste årene.
Kommunikasjonsstrategien bør utformes i tråd med moderne kommunikasjonsteori og med bistand fra informasjonsfaglig ekspertise.
4.6.3 Mål og målgrupper
Den primære målgruppa for kommunikasjonen er småbarnsforeldre. Målet er å
- øke deres kunnskap om antibiotika og resistens,
- endre deres holdninger til antibiotikabruk,
- påvirke deres atferd i forhold til å be legen om antibiotika for seg selv og barna, og
- påvirke deres atferd i forhold til å bli dyktigere til å lindre plagene til syke barn.
Den sekundære målgruppa er alle andre enn småbarnsforeldrene.
Kommunikasjonens budskap og virkemidler vil bli endelig utformet etter grundig kartlegging av målgruppas kunnskap, holdninger, atferd og ønsker, blant annet med utgangspunkt i forholdene ovenfor.
Slik kartlegging kan skje med kvalitative forskningsmetoder, f.eks. diskusjoner i grupper av henholdsvis småbarnsforeldre, allmennleger og helsesøstre, gjennom innringingsdager for publikum og gjennom intervju- eller spørreskjemaundersøkelse av et landsomfattende utvalg av småbarnsforeldre.
Det er nødvendig å kartlegge om noen grupper småbarnsforeldre, som innvandrerforeldre og aleneforeldre, har andre kunnskaper, holdnin-ger, atferd og ønsker.
4.6.4 Tiltak
Vi anbefaler at det, samtidig med tiltakene rettet mot helsepersonell, settes i verk følgende tiltak:
- Kampanje i helsestasjonene rettet mot småbarnsforeldre.
- Informasjonsmateriell til bruk ved legekontorer, legevakter og apotek.
- Styrket tilbud til massemedier om bistand til redaksjonelt stoff.
- Styrket undervisning i skolen.
- Oppfordringer til frivillige organisasjoner.
Kampanje for småbarnsforeldre
Helsestasjonen er trolig den mest sentrale arena for kampanjen fordi helsestasjonen møter alle barna og deres foreldre allerede kort tid etter fødselen, og fordi personellet er vant til helseopplys-ning og har tradisjon for smitteverninformasjon, bl.a. i tilknytning til vaksinasjonene.
Helsesøstrene blir de mest sentrale formidlere av informasjon. De må derfor motiveres og rekrutteres og forberedes på kampanjen gjennom fylkesvise kurs (jfr. kursene om vaksinasjon med få års mellomrom). Muligens bør det også i kampanjeperioden opprettes en daglig telefonsørvis for helsesøstrene slik det er på vaksinasjonsområdet. Her kan de få ytterligere hjelp til kommunikasjonen med foreldrene.
Materiell til bruk ved legekontorer og apotek
Mange leger etterlyser offentlig utgitte plakater og brosjyrer til bruk på legekontorer og legevakts-sentraler. Videre kan man vurdere ferdigtrykte sykdomsspesifikke brosjyrer, gjerne utformet som "liksomresepter" med informasjon om sykdommen og hva foreldrene kan gjøre for å lindre barnas plager. I utformingen bør man vurdere materiell fra Alliance for Prudent Use of Antibiotics, Centers for Disease Control and Prevention (se 3.4.2) og andre. Herfra kan man kanskje hente elementer, men disse må tilpasses norske forhold.
Andre tiltak
Man bør stimulere til redaksjonelt stoff i helsespaltene i blader, aviser og TV. Stoff kan tilrettelegges bl.a. for leger som skriver legespalter. Aktuelle medier er også ukepressen, særlig bladene som retter seg mot småbarnsforeldre.
Det er positivt at stadig flere nyhetsredaksjoner lar journalister spesialisere seg i helsespørsmål. Det øker muligheten for flere innsiktsfulle reportasjer om et så komplekst tema som resistens. Helsepersonell bør hjelpe til i utdanningen av journalister i helsespørsmål, f.eks. gjennom kurs arrangert av Foreningen for helsejournalister.
Resistens er et konkret eksempel på hvordan evolusjonen virker. Temaet kan egne seg godt for undervisningen i naturfag i ungdomsskolen. Vi ønsker ikke å lage egne kampanjer eller undervisningsopplegg for skolen, men vil stimulere lærebokforlag og -forfattere til å inkludere resistens i de ordinære lærebøkene.
Frivillige organisasjoner som Norske kvinners sanitetsforening og Nasjonalforeningen for folkehelsen bør oppfordres til å finne sin naturlige plass i forebyggingen av resistens som folkehelseproblem.
4.6.5 Budskap
Det endelige budskapet for tiltakene må justeres etter forarbeidet. En viktig avveining er balansen mellom å advare mot antibiotika uten samtidig å gjøre folk så skeptiske at de nekter behandling når det virkelig er indisert. Vi må heller ikke komme i den situasjonen at foreldre ikke lenger synes det er noe poeng å oppsøke lege med potensielt alvorlig syke barn fordi foreldrene ikke tror legen vil skrive ut resept på antibiotika. Videre må det nøye vurderes om det økologiske budskapet i det heile tatt er mulig å kommunisere.
Kampanjen bør gi kunnskap om resistensproblemet, dets årsaker og hva den enkelte kan gjøre for å forebygge problemet. Noen hovedbudskap kan være:
- Antibiotika er legemidler som kan redde liv. De skal ikke brukes i utide.
- Antibiotika har liten eller ingen virkning ved mange infeksjoner (forkjølel-se, hoste, bronkitt, ørebetennelse, de fleste halsbetennelser), og kan ha bivirkninger.
- Du kan lindre egne eller ditt barns plager mens kroppen selv bekjemper infeksjonen.
- For mye antibiotikabruk gjør bakteriene resistente, og det er uheldig for andre barn og ditt eget barn.
- Bakterier er nødvendig for deg. Ta vare på din normalflora; den beskytter deg mot infeksjoner utenfra.
4.6.6 Kommunikasjon med dyreeiere
Næringsorganisasjoner
Ei viktig målgruppe er næringsorganisasjonene, hvor medlemmene er dyreeiere som har dyr som produksjonsfaktor. Det nåværende samarbeidet mellom veterinærene og næringsorganisasjonene har allerede ført til store forbedringer i antibiotikabruken til oppdrettsfisk og husdyr. Dette samarbeidet må videreføres.
Hobbydyreeiere
Den andre viktige målgruppa er eiere av kjæledyr og hobbydyr. De kan nok dra nytte av mye av den informasjonen som gis for øvrig, for eksempel til småbarnsforeldre. I tillegg kan man tenke seg kampanjer i samarbeid mellom statlige etater og interesseorganisasjoner, som Norsk Kennel Klub, Norsk Rasekattforening, travlag, hesteavlsorganisasjoner og andre. Materiell kan utformes for dyreklinikker og dyrebutikker, og man kan tilby redaksjonelt stoff til blader om dyr.
4.6.7 Organisering
Informasjonsopplegget bør forankres i en statlig institusjon med veiledning av Statens informasjonstjeneste og i samarbeid med andre relevante instanser som det foreslåtte Senter for antibiotikabehanding i allmennpraksis. Det er nødvendig med bred enighet om kampanjens budskap. Helsesøstrene, allmennlegene og barnelegene er sentrale medspillere.
Kommunikasjonsinnsatsen må evalueres underveis med tanke på justeringer.
4.7 Andre smitteverntiltak
4.7.1 Bakgrunn
Alt smittevern kan bidra til forebygging av resistens ved at det reduserer antallet infeksjoner og dermed behovet for antibiotikabehandling, og ved at det reduserer smitte også med resistente bakterier. Dette gjelder både dyr og mennesker.
Smitteverntiltak tar gjerne utgangspunkt i smittekjeden, som er en seksleddet modell for å beskrive smittestoffenes spredning. Smittestoffet fins i en smittekilde og skilles ut gjennom en utgangsport for å ta en smittevei til en inngangsport hos smittemottaker. Smitteverntiltakene tilpasses den enkelte infeksjon og rettes gjerne inn mot smittekildene, smitteveiene og smittemottakerne:
- Tiltak mot smittekilder: Oppsporing av smittekilder, sanering av smitten, isolering, atferdsendring.
- Tiltak mot smitteveiene: Desinfeksjon, sykehushygiene, generell hygiene, næringsmiddelkontroll.
- Tiltak mot smittemottaker: Styrking av generelt infeksjonsforsvar, vaksinasjon, skjerming, atferdsendring og, hvis smittefare har oppstått, eventuelt kjemoprofylakse og behandling.
For forebygging av resistens kan alle disse tiltakene være aktuelle. Nedenfor fremhever vi dem som er særlig relevante.
4.7.2 Sykehushygiene
Mange mennesker med svekket helse og dermed øket mottakelighet for infeksjoner er samlet i helseinstitusjoner. Det brukes også relativt mye antibiotika og mer bredspektrete antibiotika i sykehus. Selv om antibiotikaresistens kan oppstå utenfor sykehus, er det i sykehus resistensproblemene kommer til syne først. Det er en betydelig risiko for spredning av bakterier, inkludert resistente bakterier, i sykehus.
Problemets størrelse
Med bakgrunn i studier av forekomsten av sykehusinfeksjoner i Norge (se 1.3.9) [38,39] kan vi rekne med at 50 000 av pasientene som hvert år innlegges i sykehus, får en sykehusinfeksjon. Denne vil i gjennomsnitt forlenge oppholdet med fire dager, til sammen 200 000 dager. De direkte kostnadene ved sykehusene for dette er om lag en halv milliard kroner. I tillegg kommer sykepenger, tapt arbeidsfortjeneste, produksjonstap mv. Kostnadene vil stige etter hvert som resistente bakterier blir en hyppigere årsak til sykehusinfeksjoner.
Inntil halvparten av sykehusinfeksjonene kan forebygges. Det betyr at flere titusener liggedager og flere hundre millioner kroner kan spares gjennom bedre sykehushygiene.
Ansvar og standarder
Tiltak for å hindre spredning av resistente bakterier må derfor omfatte generelle og spesifikke infeksjonsforebyggende tiltak. Ansvaret for at sykehushygieniske tiltak iverksettes går fram av Forskrift om smittevern i helseinstitusjoner - sykehusinfeksjoner. Det er likevel nødvendig med noen nye tiltak for å redusere risikoen for spredning av resistente bakterier.
Tradisjonelle og enkle, generelle infeksjonforebyggende tiltak har på grunn av effektivisering, rasjonalisering og andre forhold i helseinstitusjonene i stor grad gått tapt. Et eksempel på dette er bruk av stellefrakk. Selv håndvask kan det bli slurvet med når arbeidspresset blir for stort.
Det er derfor nødvendig å utarbeide nasjonale retningslinjer for å sette minimumsstandard for pleie og behandling i helseinstitusjoner, såkalte standardtiltak ( standard precautions). Slike retningslinjer er nylig vedtatt for sykehus i USA [40]. Retningslinjene må følges opp med tilstrekkelig bemanning og stor innsats i opplæring og andre intervensjonstiltak.
Gjeldende forskrift bør også følges opp med konkrete retningslinjer spesielt for sykehjem og tilsvarende institusjoner. Ved innføring av fastlegeordningen må det sikres at kommunelegen med ansvar for smittevern får tilstrekkelige muligheter til å utføre sine smittevernoppgaver i de kommunale helseinstitusjonene.
Sengeplasser
Trengsel og stort antall korridorpasienter ved mange sykehus representerer en ekstra risiko for spredning av infeksjoner fordi det under slike forhold er vanskelig å gjennomføre adekvate smitteforebyggende tiltak. Det må derfor etableres styringsrutiner som sikrer bedre samsvar mellom behovet for akuttinnleggelser og sengeplasser i sykehus. På mange sykehus er det særlig mangel på sengeplasser ved medisinske avdelinger. Norge har færre senger og langt færre innleggelser ved de medisinske avdelingene enn de andre nordiske landene.
Isoleringsrom og desinfeksjon
Sykehusene har i dag for få enerom som er egnet til smitteisolering når det er påkrevet. De fleste infeksjoner overføres ved kontaktsmitte. Ved de fleste sengeposter er det behov for flere enerom med nødvendige sanitærinstallasjoner for å kunne gjennomføre forsvarlig kontaktsmitteisolering. Kostbare luftsmitteisolater er først og fremst nødvendig ved sykehus som forventes å behandle pasienter med multiresistent tuberkulose [40,41]. Det arbeides for tiden med en veileder om isolering i sykehus. Denne kan sammen med overvåkingsdata om forekomst av de aktuelle smittsomme sykdommene danne utgangspunkt for vurderinger av antall og type isoleringsrom som er nødvendige ved de enkelte sykehus.
Bakterier kan bli resistente også mot kjemiske desinfeksjonsmidler. I tillegg er gener som koder for slik resistens i noen tilfeller koplet til gener som koder for antibiotikaresistens. Varmedesinfeksjon bør derfor erstatte kjemisk desinfeksjon i alle tilfeller der dette er mulig.
Det er nødvendig med økte ressurser for å få tilstrekkelig antall enerom og effektive isolasjonsforhold ved sykehusene og for å sikre adekvat desinfeksjon av utstyr.
Operasjonsrom
I moderne medisin er implantasjon av fremmedlegemer som leddproteser, karproteser og hjerteventiler rutineinngrep. Implantasjon av fremmedlegemer innebærer risiko for infeksjon med opportunistiske bakterier som ofte er særlig antibiotikaresistente. Ettersom konsekvensene av fremmedlegemeinfeksjoner oftest er svært alvorlige, anvendes bredspektrete antibiotika profylaktisk i slike tilfeller. Eventuelle infeksjoner som likevel oppstår, krever som regel langvarig antibiotikabehandling og i verste fall ny operasjon med fjerning av protesen.
Behovet for antibiotikabehandling under og etter kirurgisk innsetting av fremmedlegemer kan reduseres ved å styrke hygienetiltak ved slike operasjoner. Fremmedlegemeimplantasjoner må foregå i ultrareine operasjonsrom. I praksis betyr dette at det må sikres at sykehus som implanterer kritiske fremmedlegemer, har nødvendig operasjonskapasitet til dette på operasjonsrom der den mikrobiologiske luftkvaliteten tilfredsstiller visse minimumskrav (< 10 cfu/m 3> luft).
4.7.3 Generell hygiene
Barnehager
Infeksjonsrisiko i barnehager
Flere epidemiologiske undersøkelser (blant annet fra Finland) har vist at barn som går i barnehager har økt forekomst av luftveisinfeksjoner [42-49]. Noen studier har også vist økt forekomst av gastrointestinale infeksjoner [46,50]. Undersøkelsene har tatt for seg til dels forskjellige infeksjoner og sykdommer og benyttet forskjellige definisjoner av infeksjoner og barnetilsynsordninger. Dette gjør det vanskelig å gi en samlet vurdering av resultatene. De fleste har vist økt infeksjonsrisiko blant barn yngre enn to-tre år og oftest for nedre luftveisinfeksjoner og ørebetennelser. En finsk undersøkelse viste en dobling av risikoen for invasiv pneumokokkinfeksjon blant 0-2 år gamle barnehagebarn [44].
For eldre barn har sammenhengen vært mindre uttalt. En ny norsk undersøkelse tyder på en viss økt risiko for øvre luftveisinfeksjoner blant 4-5 års gamle barnehagebarn (ca. 20% økt risiko for forkjølelse og ca. 50% for ørebetennelse) [51]. Få norske barn passes utenfor hjemmet første leveår. Norske undersøkelser har vist at 0-1 år gamle barn har økt risiko for nedre luftveisinfeksjoner og ørebetennelser hvis de har søsken som er i barnepass utenfor hjemmet [52-53]. For de få barna som hadde begynt i barnepass utenfor hjemmet før ett års alder, var, som i flere utenlandske undersøkelser, risikoen for nedre luftveisinfeksjoner og ørebetennelse økt.
Tiltak i barnehager
Det er foreløpig mangelfull kunnskap om hvilke faktorer ved barnehagene som bidrar til økt forekomst av infeksjoner. Dette studeres for tida i barnehager i Oslo og resultater ventes i løpet av et par år. Det antas at følgende faktorer kan ha særlig betydning for luftveisinfeksjoner:
- Persontetthet innendørs, dvs. antall barn per arealenhet.
- Andel innetid av total oppholdstid i barnehagen.
- Ventilasjon.
- Regler for utestengning av syke barn.
- Eksponering for tobakksrøyk.
Uten sikrere kunnskapsgrunnlag er det imidlertid ikke riktig å anbefale kostbare tiltak i barnehagene med tanke på infeksjonsforebygging.
Skoler
Studiene av barnehagebarn viser at forskjellene i infeksjonshyppighet mellom barnehagebarn og andre barn utjevnes med økende alder og er svært små allerede ved fireårsalder. Det betyr antakelig at forskjellene er utjevnet ved skolealder. Det skulle bety at skolegang i seg selv betyr lite for spredning av infeksjoner. Studier som sammenlikner infeksjonsforekomst blant skolebarn og barn som ikke går i skole er vanskelige å gjennomføre da så å si alle barn går i skole.
Hjemmene
Generelle hygieneregler som at man skal vaske hendene etter toalettbesøk og før matlaging og ikke skal drikke av samme flaske mv. er av betydning. Videre må kjøkkenhygienen i mange hjem forbedres. Statens næringsmiddeltilsyns kampanje om trygg matlaging ("Ikke nok å være god kokk") bør fortsette.
Stadig flere eldre og syke pleies hjemme av hjemmesykepleien. Disse pasientene er særlig utsatt for infeksjoner. Helsepersonell i hjemmesykepleien må opprettholde gode hygienerutiner og gi god informasjon om antibiotika.
4.7.4 Næringsmiddelhygiene
Næringsmiddelregelverket, som først og fremst er ment å virke forebyggende, stiller strenge krav til hygiene og internkontroll (herunder kontroll med kritiske punker) i virksomhetene. Produsenter og de som frambyr matvarer må fortsatt bidra til god næringsmiddelhygiene slik at matbåren smitte med blant annet resistente bakterier forebygges.
4.7.5 Sykdomsforebygging og -kontroll i husdyrproduksjon
Et viktig bidrag til fortsatt reduksjon av antibiotikaforbruket i husdyrproduksjonen er økt satsing på forebyggende helsearbeid. Dette krever målrettet fokusering på forebyggende tiltak i forskning, undervisning og veiledning av veterinærer og produsenter. Det vil videre være av stor betydning at det etableres økonomiske tiltak som kan motivere til økt forebyggende innsats hos de forskjellige aktørene i næringen.
Tilgang på og bruk av effektive vaksiner og andre produkter som stimulerer immunforsvaret utgjør et viktig ledd i det sykdomsforebyggende arbeidet. Økt forskningsinnsats for å utvikle nye og mer effektive vaksiner og produkter som stabiliserer og potenserer normale forsvarsfunksjoner vil kunne bidra til økt motstandskraft mot infeksiøse agens i dyrepopulasjonen.
Økt satsing på forskning for å forbedre dyrepopulasjonens genetiske forutsetninger for å motstå sykdom og større vektlegging av helse som del av avlsmålet forventes å bidra til reduksjon av antibiotikaforbruket.
Behovet for kunnskap om effekten av behandlingsmetoder som ikke inkluderer anvendelse av antibiotika betinger økt forskningsinnsats.
Kontrolltiltak som nedslakting av en besetning kan bli aktuelt ved opptreden av smittsom dyresykdom, herunder sykdom forårsaket av resistente bakterier.
4.7.6 Vaksinasjon
De fleste infeksjonssykdommer rammer små barn og eldre mennesker hardest. Begge disse gruppene har dårligere forsvar, både spesifikt og uspesifikt, mot smittsomme sykdommer. For barn fins et offentlig organisert og offentlig betalt vaksinasjonsprogram.
Barnevaksinasjonsprogrammet
Barnevaksinasjonsprogrammet er viktig for det nasjonale smittevernet. Vaksinasjon mot alvorlig invasiv sykdom forårsaket av Haemophilus influenzae type b (Hib) er et godt eksempel. Etter innføring av vaksinasjon i 1992 har antallet tilfeller falt fra rundt 200 til under ti per år [54]. Dermed har resistens hos H influenzae mye mindre alvorlige konsekvenser enn den ellers ville ha fått.
Også vaksiner mot virussykdommer kan ha betydning:
- Vaksinene forebygger indirekte bakterieinfeksjoner som kommer som ettersykdommer til virussykdommen, og som krever antibiotikabehandling.
- Vaksinene reduserer antallet antibiotikakurer som feilaktig blir gitt ved virussykdommer hos barn.
Resistensforhold er ett element når nye vaksiner vurderes inkludert i barnevaksinasjonsprogrammet. Vaksiner mot meningokokksykdom, vannkopper og pneumokokksykdom kan bli aktuelle for programmet. Vaksiner mot ørebetennelse forårsaket av pneumokokker er under utprøving. Disse vaksinene kan få stor betydning også i et resistensperspektiv etter som penicillinresistens hos pneumokokker kan være i ferd med å bli et problem også i Norge.
Vaksinasjon av eldre
Eldre har stor overdødelighet av infeksjonssykdommer. Influensa og pneumokokksykdom er de viktigste. Begge disse sykdommene kan man vaksinere mot. Vi foreslår et eldrevaksinasjonsprogram som pålegger kommunen å tilby visse statlig betalte vaksiner til alle innbyggere over 65 år. Tilbudet kan gis gjennom helsestasjonene eller allmennlegene.
Foreløpig er det bare to vaksiner som kan være aktuelle å inkludere i et slikt program, influensavaksine og pneumokokkvaksine. Målgruppene for disse vaksinene er stort sett de samme: alle over 65 år pluss personer med alvorlige hjerte- og lungesykdommer og visse andre lidelser.
I dag lar 25-30% av denne målgruppa seg vaksinere mot influensa før hver sesong, mens under 10% av målgruppa har fått pneumokokkvaksine noen gang. Høyere vaksinasjonsdekning kan redusere hyppigheten av pneumokokksykdom, av influensa og av bakterielle infeksjoner (herunder pneumokokksykdom) som kan opptre i tilslutning til influensa når man er svekket på forhånd.
Vaksinasjon av produksjonsdyr og fisk
Immunprofylakse i form av vaksinasjon eller serumbehandling har i betydelig grad bidratt til å redusere bruken av antibiotika i norsk dyrehold. Et godt eksempel er bruk av vaksiner mot visse infeksjonssykdommer i fiskeoppdrettet [55]. Bruk av vaksiner vil fortsatt være viktig i arbeidet med å forebygge sykdom. Optimalisert bruk av eksisterende vaksiner, økt bruk av vaksiner som er tilgjengelige i andre land og utvikling av nye vaksiner mot bestemte sykdommer kan representere et potensial for reduksjon i antibiotikaforbruket.
4.7.7 Internasjonale utfordringer
Nesten alle land har større resistensproblemer enn Norge, både i og utenfor sykehus, og sannsynligvis også i næringskjeden og husdyrbruket. Det betyr at utviklingen i Norge avhenger av hvor effektivt vi motvirker resistensutvikling her hjemme, hvor effektivt resistensutvikling motvirkes i andre land og hvor effektivt import av resistente mikrober kan forebygges.
Norske reisende
Norske reisende kan bringe med seg resistente bakterier tilbake etter reiser i utlandet og eventuelt spre disse videre her i landet. Eksempelvis er de fleste tilfeller av gonoré forårsaket av penicillin- og kinolonresistente gonokokker og diagnostisert i Norge ervervet av norske menn på reise i Sørøst-Asia [56]. Det har videre vært en økning i antallet tilfeller av tyfoidfeber hos barn som har besøkt foreldrenes hjemland, særlig Pakistan [57]. Det er bare et tidsspørsmål før det importeres tilfeller forårsaket av resistente Salmonella typhi.
Dette kan forebygges gjennom veiledning og vaksinasjon av norske reisende. Dette forutsetter at publikum er oppmerksom på de aktuelle farene. Særlig Folkehelsa har et ansvar for fortsatt å sikre oppmerksomhet om disse problemene og veilede leger og helsesøstre om smittevern på reiser. For eksempel er det nødvendig å styrke veiledningen og tyfoidfebervaksinasjon av personer som besøker Pakistan som sitt tidligere hjemland.
Innvandrere til Norge
Innvandrere og adoptivbarn kan, som hjemvendte norske turister, bringe med seg resistente bakterier. Det er særlig grunn til å være oppmerksom på tuberkulose. Prosjektgruppa vil minne om viktigheten av tuberkulosescreening av innvandrere i henhold til Forskrift om tuberkulosekontroll § 2-4.
Pasienter som overflyttes fra utlandet
Statens helstilsyn har gitt råd i henhold til smittevernloven § 3-3 om forhåndsundersøkelse for visse resistente bakterier hos pasienter som overflyttes fra eller nylig har vært behandlet ved helseinstitusjoner i utlandet (se 2.7.1). Alle sykehus må i sine infeksjonskontrollplaner ha med retningslinjer for håndtering av slike pasienter.
Prosjektgruppa minner også om forskriften om forhåndundersøkelse av norsk helsepersonell som har arbeidet i helsevesenet i utlandet (se 2.7.1). Retningslinjer for undersøkelse av disse er gitt av Statens helsetilsyn og må inngå i sykehusenes infeksjonskontrollprogram. De nevnte forskrifter og retningslinjer må løpende vurderes i forhold til aktuelle infeksjonstrusler.
Prosjektgruppa vil advare mot at frykt for resistente bakterier fører til at Norge ikke lenger følger opp sine humanitære forpliktelser overfor alvorlig syke pasienter fra andre land.
Undersøkelse av resistensforholdene og smittevernet ved sykehus i utlandet må bli et viktig punkt i vurderingen av sykehusenes egnethet som mottaker av norske gjestepasienter for kirurgiske inngrep.
Dyr og næringsmidler
Resistens kan spres mellom land og regioner gjennom fôr, næringsmidler og levende dyr. Spredningen kan skje direkte ved at resistente zoonosebakterier eller mikrober fra normalfloraen smitter mennesker fra næringsmidler. Dette er det sett mange eksempler på med Salmonella. Spredningen kan også være indirekte ved at arvestoff fra ikke-sykdomsframkallende bakterier i næringsmidler tas opp av mottakerens egne tarmbakterier.
Økt import til Norge av fôr, næringsmidler og levende dyr fra land med større resistensproblemer enn Norge, kan forsterke spredningen av resistens. Derfor vil de ulike overvåkingsprogrammer som er satt i verk, blant annet som følge av veterinæravtalen med EU, ta hensyn til resistensproblemet.
Internasjonal bistand
Moderne internasjonalt smittevern legger vekt på samarbeid om å bekjempe smittsomme sykdommer der de forekommer framfor å forsøke å stoppe dem ved grensene [58]. Norge har et betydelig ansvar for å støtte det internasjonale arbeidet mot infeksjonssykdommene og mot resistensproblemet.
Norges støtte til Verdens helseorganisasjons smittevernarbeid må styrkes. Samarbeidet med Russland om forebygging av tuberkulose i Arkhangelsk må videreføres. Det samme gjelder samarbeidet i regi av Nordisk ministerråd for styrking av smittevernet i Nordens nærområder.
Norske deltakere må også i relevante internasjonale avtaler, sammenslutninger og konferanser arbeide for fornuftig bruk av antibiotika.
4.8 Forskning, utvikling og utredning
4.8.1 Bakgrunn
Selv om vi kjenner mange ulike resistensmekanismer og begynner å forstå hvordan antimikrobiell resistens kan utvikles og spres, mangler vi vesentlig kunnskap som grunnlag for å velge de riktige og nødvendige tiltakene for å få kontroll med det truende resistensproblemet. Videre er det få tiltak man virkelig har målt effekten av. Det er derfor et umiddelbart behov for å styrke forskningsinnsatsen på dette området, også i Norge.
Forskningen skal gi grunnlag for bedre forebygging og motvirkning av resistens. Det er flere grunner til at vi må foreta undersøkelser også i Norge og ikke bare utnytte andre lands forskning:
- Norge må ha frontlinjeforskere slik at vi kan oppdage, tolke og nyttiggjøre oss internasjonale forskningsresultater.
- Den norske resistensproblemene har særtrekk som kan studeres bare i Norge. Resultater fra andre land kan ikke uten videre overføres til norske forhold.
- Forskningen vil bidra til å gjøre undervisning og klinisk praksis mer kunnskapsbasert.
- Norge har en forpliktelse til å bidra til den internasjonale kunnskapsbasen.
4.8.2 Forskningsområder
Forskningsressursene i Norge er begrenset. Vi må derfor nøye vurdere hvor ressursene skal benyttes. I valg av forskningsområder kan følgende faktorer ha betydning:
- Norges naturlige fortrinn bør utnyttes. Vi har en liten, homogen og oversiktlig befolkning som er velegnet for epidemiologiske studier.
- De miljøer som allerede har vist seg konkurransedyktige, bør stimuleres.
- Områder der overføringsverdien fra utenlandsk forskning er vanskelig, bør prioriteres. Det gjelder f.eks. innen klinisk forskning der det er nødvendig å undersøke diagnostiske rutiner og behandlingsopplegg som er relevante for norske forhold.
- Områder der de forebyggende og behandlingsmessige tiltak har størst virkning, bør prioriteres.
- Områder der kunnskapen er minst, må prioriteres.
- Det bør tilstrebes tverrfaglig samarbeid og balanse mellom basalforskning og mer anvendt forskning.
Det er også nødvendig med forskning og utredninger til støtte for forvaltningen, blant annet i samband med nasjonale forskrifter og internasjonale avtaler. For eksempel trengs det mer kunnskaper om næringsmidlers betydning for spredning av resistens og om koksidiostatikas betydning for utvikling av resistens.
Nedenfor er de prioriterte forskningsområdene for oversiktens skyld klassifisert etter fag. I de fleste forskningsområdene er det selvfølgelig nødvendig med samarbeid mellom flere faggrupper. Klassifiseringen kan derfor være noe tilfeldig.
Bakteriologi
Innenfor bakteriologisk grunnforskning gir bioteknologi store muligheter til å karakterisere resistensgener og avdekke de genetiske mekanismene for resistens, persistens av resistens, mulig reversibilitet av resistens, spredning av resistensgener (inkludert fra miljø og dyr til mennesker), seleksjon av resistente bakteriekloner og resistensepidemiologi. Det er også nødvendig å studere de eventuelle sammenhenger mellom bakteriers resistens og virulens.
Disse kunnskapene kan også brukes i studier av nye prinsipper for behandling og forebyggelse av infeksjoner hos mennesker og dyr, for eksempel probiotika, resistensinhibitorer, immunmodulatorer, immunglobuliner mv.
Antibiotikas virkning på menneskers og dyrs normalflora bør studeres nærmere. Videre må man bedre kartlegge effektene av antibiotika midler som brukes til andre formål enn behandling og forebygging av infeksjoner hos mennesker, f.eks. til behandling av produksjonsdyr, familiedyr og oppdrettsfisk.
Klinisk medisin
I sykehus
Det foregår utstrakt bruk av antibiotika i sykehus. Her behandles blant annet pasientene med de alvorligste infeksjonene som blodforgiftning, utbredte kirurgiske sårinfeksjoner, alvorlige lungebetennelser, hjernehinnebetennelse, betennelser i hjerteklaffer og ikke minst infeksjoner hos pasienter med svekket immunforsvar.
Likevel har vi mangelfull kunnskap om behandling av pasienter med infeksjoner, særlig dem med alvorlige infeksjoner og nedsatt infeksjonsforsvar. Det er behov for mer kunnskap om riktig valg av antibiotika, dosering og varighet for å oppnå hurtig helbredelse og minst mulig resistensutvikling, om dosering og om behandlingens lengde. For å bedre behandlingsresultatene og redusere resistensutviklingen på sykehus, er det av helt sentral betydning å støtte forskning som tar sikte på å optimalisere bruk av antibiotika på sykehus.
Dette gjelder også forskning om forebyggende antibiotikabehandling under kirurgiske inngrep for å forebygge infeksjoner etter operasjonen. Endel forskning om forebygging, særlig ved tykktarmskirurgi, er utført ved norske sykehus. Fremdeles blir imidlertid mange forebyggingsregimer tatt i bruk uten at de er adekvat dokumentert, og særlig ikke i forhold til det mikrobemiljø som fins i norske sykehus.
Nye antibiotika må gjennomgå omfattende kliniske undersøkelser før de kan markedsføres. Flere avdelinger ved norske sykehus har lange tradisjoner når det gjelder slike undersøkelser. Undersøkelsene fokuserer særlig på virkningen av medikamentene ved forskjellige infeksjoner, omsetningen av medikamentene i kroppen, konsentrasjon i forskjellige organer mv. Dessverre fokuseres lite på medikamentenes innvirkning på bakteriefloraen, for eksempel resistensutvikling. Dette gjelder også medikamenter som benyttes i lokalbehandling. Vi har derfor mangelfull kunnskap om de forskjellige medikamentenes evne til å forårsake resistensutvikling og bidra til spredning av resistente bakterier i sykehus. Følgelig er det et betydelig behov for å styrke forskningsinnsatsen på dette feltet.
Antibiotikaresistente bakterier spres lett i sykehus. Spredningen kan foregå ved direkte eller indirekte kontakt mellom mennesker. I noen tilfeller som ved tuberkulose, spres bakteriene ved hjelp av dråpekjerner gjennom luften. Mange infeksjonsforebyggende tiltak, som bruk av luftsmitteisolater er kompliserte og kostbare. Ofte iverksettes tiltak uten at det er tilstrekkelig dokumentert at disse er effektive. Det er derfor nødvendig med ytterligere undersøkelser for å klarlegge hvilke faktorer som fører til økt risiko for smittespredning, og hvordan man kan forebygge spredningen. Det er nødvendig med så vel mikrobiologiske som kliniske undersøkelser samt helsetjenesteforskning for å belyse disse problemstillingene.
I allmennpraksis
Infeksjoner i øvre luftveier (øre, neser, bihuler, hals, luftrør) er de hyppigste årsakene til antibiotikabehandling, og pasientene er oftest barn. De fleste slike infeksjoner er forårsaket av virus. Legenes problem er at det er svært vanskelig å skille mellom virale og bakterielle infeksjoner. Derfor trengs bedre metoder for å stille riktig diagnose under konsultasjonen. Kan sykdomstegn som feber, belegg på tunge og tonsiller og smerter mv. hjelpe legen til å avgjøre om pasienten har en virus- eller en bakterieinfeksjon? Hvordan skal man diagnostisere og behandle akutt bronkitt hos barn?
Det er også nødvendig å utvikle og evaluere hjelpemidler som ultralyd, infeksjonsrelaterte hurtigtester av blod og andre prøver (f.eks. måling av CRP, hvite blodceller og senkningsreaksjonen) og hurtigtester for påvisning av det aktuelle smittestoffet (for eksempel tester for gruppe A-streptokokker). Er disse testene pålitelige? Hvilken betydning kan bruken av dem ha for valg av og resultat av behandlin-gen?
Nyere systematiske oversikter har vist at antibiotika har nokså begrenset eller ingen nytte ved hyppige infeksjoner som ørebetennelse [32-34], bihulebetennelse [59], bronkitt [29,30] og halsbetennelse [36]. Oversiktene har også avslørt at det fins for få gode studier der antibiotika sammenliknes med placebo ved blant annet disse tilstandene. Disse kunnskapshullene bør fylles med flere gode studier fra norsk allmennpraksis [60]. Studiene må være tilpasset medisinsk praksis utenfor sykehus. For eksempel bør det drøftes å gjennomføre en placebokontrollert studie av penicillinbehandling av infeksjoner som allmennlegen mener er gruppe A-streptokokk-tonsilitter (på bakgrunn av f.eks. hurtigtest for gruppe A-streptokokker). Videre bør man forsøke å avklare om det er noen grupper av pasienter som har nytte av antibiotika ved de nevnte tilstandene. Det bør også avklares om det er mulig å skaffe vitenskapelig dokumenterbar og anvendbar kunnskap om alternativ behandling (alternativ medisin) av infeksjoner.
Klinisk veterinærmedisin
Det er behov for utvikling av pålitelige diagnostiske hjelpemidler til bruk i klinisk praksis. Dette vil bedre grunnlaget for et optimalt preparatvalg samtidig som det vil medføre at sykdomstilstander som ikke krever antibakteriell terapi, raskt kan utelukkes.
Videre vil forskning vedrørende årsakene til ulike sykdommer kunne medføre endrete behandlingsrutiner som kan redusere behovet for antibiotikaterapi.
Det må undersøkes om det er mulig å skaffe vitenskapelig dokumenterbar og anvendbar kunnskap om alternative behandlingsmetoder (alternativ veterinærmedisin) for infeksjoner hos dyr.
Helsetjenesteforskning
Medisin
Vi vet allerede at det er store variasjoner i rekvirering og bruk av antibiotika mellom leger, pasienter, sykehus, kommuner og fylker. Det er nødvendig med ytterligere beskrivelser av disse forskjellene og forskning for å finne årsakene til dem. Hvilke faktorer ved legene, sykdommene, pasientene og lege-pasient-forholdet kan forklare ulikheter i antibiotikabruk? Er det mer rekvirering ved legevakt enn i vanlig kontortid? Hvordan er tilgjengeligheten av legetjenester ved infeksjoner? Hvordan er rekvireringen i sykehjem?
Videre er det nødvendig å lære mer om hva som skjer i kommunikasjonen mellom lege og pasient. Hvilke faktorer er det som fører til unødvendig rekvirering av antibiotika? Hvilke hindringer møter legen som ønsker å endre rekvireringspraksis? I hvilken grad blir antibiotika ikke gitt når det burde ha vært gitt? Med denne kunnskapen er det mulig å utvikle og prøve ut intervensjoner med sikte på å endre uheldig rekvireringspraksis hos leger og bedre pasientenes medvirkning i behandlingen.
I denne planen foreslås ei rekke tiltak for å redusere antibiotikarekvirering. Det er nødvendig med forskning for å evaluere effekt og kostnadseffektivitet av slike tiltak. Videre må generelle smitteverntiltak, særlig i sykehus, evalueres.
Veterinærmedisin
Også innen veterinærmedisinen er det nødvendig med forskning for å beskrive forskjeller i rekvireringspraksis og finne årsaker til dem. Det er videre nødvendig å finne ut hvilke faktorer i forholdet mellom veterinær og dyreeier som eventuelt bidrar til uheldige rekvireringsvaner.
Epidemiologi
Sammenhengen mellom antibiotikabruk og resistensutvikling er ikke tilstrekkelig klarlagt [3]. Sammenhengen kan studeres på ulike nivåer: pasient, sykehusavdeling, sykehjem, sykehus, kommune, fylke og land. Sannsynligvis har andre faktorer enn antibiotika-bruk betydning. Det er ønskelig å identifisere uheldige faktorer som kan påvirkes i gunstig retning. Slike studier er særlig aktuelle for å avdekke årsaker til infeksjoner med resistente gramnegative staver, penicillinresistente pneumokokker, meticillin-resistente gule stafylokokker og vankomycinresistente enterokokker. Hva er det som gjør at slike infeksjoner er hyppigere ved noen sykehus-avdelinger enn ved andre?
Fra andre land foreligger endel forskningsresultater som viser sammenheng mellom økende bruk av visse antibiotika over kort tid fulgt av tilsvarende resistensutvikling mot disse antibiotika. Det er også vist at utviklingen kan gå tilbake dersom man begrenser bruken av de samme antibiotika. Det bør også i våre sykehus etableres forskning omkring eksisterende resistensproblemer, forholdet til antibiotikabruk og spredningsmønsteret innenfor sengeposter og mellom avdelinger. Dersom tiltak iverksettes, bør man legge til rette for evaluering av effekten.
I forlengelsen av slike studier er det også viktig å studere hvilken betydning resistens har for infeksjonssykdommer hos dyr og mennesker. Hvor mye mer alvorlig blir sykdommen når behandlingsmulighetene blir færre, og hvor mye mer koster behandlingen?
De epidemiologiske studiene kan forbedres ved å benytte molekylærbiologiske metoder i karakterisering av risikofaktorer og smittestoffer.
Både for mennesker og dyr er det nødvendig å finne ut mer om miljørelaterte risikofaktorer for infeksjonssykdommer. Dersom slike faktorer kan identifiseres og fjernes, kan man redusere hyppigheten av infeksjonssykdommer i noen grad og dermed behovet for antibiotikabehandling.
Miljøforskning
Det er mange uavklarte problemer vedrørende forekomst og betydning av resistente bakterier, resistensgener og antibiotikarester i miljøet. For eksempel vet man ikke betydningen av utslipp nær norskekysten av ballastvann fra land med høy forekomst av resistens. Kan det finnes resistente sykdomsframkallende bakterier i vannet, og kan disse true havbruksnæringen og fiskeriene? Hva er effektene av bruk av biosider som borekjemikalier i oljeutvinningen?
Annen forskning
Mye annen forskning kan ha betydning for resistensproblemene uten at dette problemet alene er begrunnelsen for forskningen. Det gjelder en rekke forskningsområder innen bakteriologi, infeksjonsepidemiologi, immunologi, vaksineutvikling og sykehushygiene.
4.8.3 Organisering og finansiering
Forskningsprogram
Prosjektgruppa foreslår et femårig program (1999-2003) i regi av Norges forskningsråd for å styrke forskningen om resistens etter prioriteringene ovenfor. Programmet er relevant for de fleste av Forskningsrådets områder, herunder Medisin og helse, Miljø og utvikling, Bioproduksjon og foredling og Naturvitenskap og teknologi.
Programmet bør komme i tillegg til Forsknings-rådets nåværende programmer og bevilgninger. Det betyr at forskningsprosjekter der resistens er et deltema, også må kunne konkurrere om midler fra andre områder og program-mer under Forskningsrå-det. Programmet foreslås i tillegg til den satsingen på medisinsk bakteriologisk forskning som Norges forskningsråd allerede har foreslått. Denne satsingen vil ha resistens bare som et mindre deltema.
Programmet bør ha et tverrfaglig sammensatt styre som blant annet vurderer fordelingen mellom vanlig prosjektstøtte og miljøstøtte. Det bør stimuleres til samarbeid mellom humanmedisinske, veterinærmedisinske og andre forskningsmiljøer.
Internasjonalt samarbeid
For Norges små forskningsmiljøer er internasjonalt samarbeid viktig. Dette er også en forutsetning for internasjonal finansiering, f.eks. fra EUs ulike forsknings-programmer. I lys av Københavnerklæringen [61] ventes resistens å bli prioritert i det femte rammeprogrammet for forskning i EU.
Nordisk forskningssamarbeid må videreføres, bl.a. på næringsmiddelområdet.
Samarbeid med industrien
Samarbeid med industrien er særlig aktuelt ved utvikling og evaluering av hurtigtester og andre diagnostiske teknikker. Samarbeidet er nødvendig for å bringe eventuelle nyvinninger ut i praktisk bruk.
Også med legemiddelindustrien er det aktuelt med samarbeid. Her må man imidlertid nøye vurdere om aktørene har felles interesser. For eksempel kan en produsent være mer interessert i å sammenlikne sitt nye medikament mot ørebeten-nelse med penicillin enn å finne ut om antibiotikabe-handling ved denne tilstanden i det hele tatt er nødvendig. Industrien kan også ha interesse av å involvere mange allmennleger i studier av nye medikamenter for å lære dem opp til å benytte dette medikamentet (såkalte seeding studies). Dette er studier som ikke bør prioriteres fra det offentlige og fagmiljøene.
4.9 Forvaltning og tilsyn
4.9.1 Legemiddelforvaltning
Markedsføringstillatelse
Etter at EØS-avtalen trådte i kraft og behovsparagrafen ble opphevet, har Statens legemiddelkontroll (SLK) fått færre muligheter til å nekte godkjenning av antibiotika. Det er likevel nødvendig at SLK så langt som mulig fortsetter sin strenge linje med sterk støtte i fagmiljøet.
Risiko for resistensutvikling må fortsatt inngå som en viktig del av vurdering av sikkerheten for et preparat slik at preparater kan nektes godkjenning eller få bare begrenset godkjent bruksområde med henvisning til faren for økt resistens-utvikling.
Videre bør man fortsatt være restriktiv til spesielt godkjenningsfritak for antibiotika til veterinærmedisinsk bruk.
Det må utredes om det i samband med godkjenning av nye antibiotika er mulig å kreve dokumentasjon for preparatets virkning på resistensutviklingen. Ved fornyet godkjenning etter fem år bør det kreves at produsenten legger fram data om effekten av preparatets bruk på resistensforholdene.
Gjennom den kommende utvidelsen av EØS-avtalen på legemiddelområdet vil Norge få delta i det legemiddelfaglige arbeidet i EØS-området samtidig som vi forplikter oss til å ta de samme avgjørelsene som EU vedrørende godkjenning av nye legemidler.
Det er ventet at legemiddelmyndighetene i EU i lys av blant annet Københavnerklæringen vil innta en stadig strengere holdning til godkjenning av antibiotika. Utviklingen går heilt klart i mer restriktiv retning; EU nærmer seg Nordens antibiotikapolitikk, ikke omvendt. Her kan blant annet Norge, de andre nordiske landene, Storbritannia og Nederland være viktige pådrivere.
Rekvireringsbegrensninger og utleveringsbestemmelser
For enkelte antibiotika er det særlig ønskelig å unngå unødvendig bruk og begrense totalforbruket. Det kan være antibiotika som er de eneste som virker mot visse bakterier, for eksempel vankomycin mot methicillinresistente gule stafylokokker. For å oppnå dette kan det være nødvendig å legge restriksjoner på rekvireringen ved at legemidlet kan utleveres bare for bruk i sykehus eller bare av leger med visse spesialiteter. Statens legemiddelkontroll må fortsatt, med støtte i fagmiljøene, føre en restriktiv politikk på dette området.
Det må vurderes om det kan bidra til mer bevissthet blant leger om antibiotika dersom de pålegges å føre generisk navn på reseptene.
Antibiotika bør som hovedregel fortsatt være reseptpliktige.
Trygderefusjon
I Danmark oppnådde man en betydelig og ønsket vridning i antibiotikaforbruket gjennom en gradert endring av trygdas refusjon for visse antibiotika. I Norge gis det vanligvis ikke trygderefusjon for antibiotika. Det største unntaket er ved behandling av "pyogene kroniske eller stadig residiverende infeksjoner i lunger/bronkier eller nyrer/urinveier", jfr. § 9 punkt 19 i Forskrift om stønad til dekning av utgifter til viktige legemidler og spesielt medisinsk utstyr. § 4 og § 9 punkt 38 kan også under visse betingelser hjemle refusjon for antibiotika. Det er grunn til å undersøke hvordan disse paragrafene benyttes og eventuelt endre dem dersom de stimulerer til unødvendig bruk av antibiotika.
Reklame for legemidler
Statens legemiddelkontroll må fortsatt nøye overvåke at Forskrift om reklame for legemidler overholdes. Prosjektgruppa vil særlig peke på forskriften § 3 som slår fast at "reklame for legemidler skal være nøktern og saklig", "fremme rasjonell bruk i henhold til gjeldende forskrivningsregler" og "ikke føre til bruk av legemidlet som ikke er medisinsk begrunnet". Statens legemiddelkontroll må ved overtredelser benytte de sanksjonsmuligheter som forskriften gir hjemmel for, jfr. § 10.
Antibiotika som vekstfremmere i dyrefôr
Statens landbrukstilsyn bør fortsette sitt tilsyn med bruk av antibiotika i fôr til husdyr. Gjennom internkontroll og stikkprøver må man kontrollere at det ikke forekommer ulovlig tilsetting.
4.9.2 Tilsyn med smittevern og antibiotikarekvirering
Helseinstitusjoner
Lov om statlig tilsyn med helsetjenesten pålegger Statens helsetilsyn og fylkeslegene å føre tilsyn med helsetjenester og helsepersonell. Som et ledd i tilsynsvirksomheten skal fylkeslegene i 1999 føre tilsyn med sykehusenes smittevern i henhold til blant annet Forskrift om smittevern i helseinstitusjoner - sykehusinfeksjoner og Lov om statlig tilsyn med helsetjenesten. Tilsynsmyndigheten bør legge vekt på forhold omtalt i denne innstillingen, herunder sykehushygieneforskriftens krav til skriftlige retningslinjer for bruk av antibiotika.
Allmennpraksis
Tilsyn med allmennnlegers antibiotikarekvirering kan avdekke avvikende rekvirering, for eksempel mye høyere volum enn gjennomsnittet. Det vil antakelig ha svært begrenset effekt på det store antallet leger som rekvirerer innenfor forsvarlige rammer. Derfor er tilsyn trolig en mindre effektiv intervensjon enn de frivillige tiltak som er beskrevet i 4.5.4.
Veterinærmedisinen
Forvaltningens utforming av og tilsyn med lover og forskrifter som regulerer dyrs livsvilkår har sannsynligvis innvirkning på behovet for antibiotikabehandling. Det er av stor betydning at forvaltningen gis slike økonomiske betingelser at utforming og særlig tilsyn med og informasjon om det aktuelle regelverket, kan gis tilstrekkelig høy prioritet.
Hjemmel for å føre tilsyn med veterinærenes rekvirering ligger i dag under Sosial- og helsedepartementet. En kan tenke seg at tilsynet utføres av Landbruksdepartementets underliggende etat, Statens dyrehelsetilsyn.
Et optimalt tilsyn med veterinærenes rekvirering betinger god oversikt over antibiotikaforbruk og resistensutvikling. Det er en rekke praktiske og formelle forhold som må utredes og avklares før tilsyn med veterinærers rekvirering kan bli et godt virkemiddel i arbeidet med å redusere risikoen for resistensutvikling.
Dersom den nye veterinærloven vedtas slik den er foreslått, vil veterinærmyndighetene med hjemmel i lov kunne styre rekvireringen.
4.9.3 Næringsmidler
Det offentlige næringsmiddeltilsynet skal bidra til at maten er og oppleves som trygg. Den skal være fri for sykdomsframkallende mikrober, inkludert slike som har ervervet resistens. Videre bør den ikke inneholde antibiotikarester utover de aksepterte grenseverdier.
Codex Alimentarius har nedsatt ei arbeidsgruppe som skal vurdere betydningen av antibiotikaresistente bakterier i næringsmidler. Norge bør delta aktivt i dette arbeidet.
4.9.4 Genmodifiserte organismer (GMO)
Arbeidet for å etablere et internasjonalt forbud mot antibiotikaresistensmarkørgener i genmodifiserte organismer må videreføres. Det vil være viktig at Norge opptrer med en enhetlig holdning i dette spørsmålet i alle de ulike fora der GMO er tema. Det gjelder både der næringsmidler, fôr, medisiner og andre produkter som består av eller inneholder GMO blir diskutert, enten i form av etablering, revidering eller håndheving av regelverk eller avtaler.
I desember 1998 ble det i næringsmiddelloven innført hjemmel til å fastsette forskrifter for å regulere nærmere - herunder forby - produksjon, import og frambud av næringsmidler med antibiotikaresistensmarkørgener. en slik forskrift skal utarbeides i 1999.
4.9.5 Bruk og spredning av mikroorganismer
Regelverk som omfatter bruk og spredning av mikroorganismer må utformes og håndhe-ves slik at det i minst mulig grad brukes og spres mikroorganismer med overførbar antibiotikaresistens.
4.10 Litteratur
1. Straand J, Rokstad K, Heggedal U. Drug prescribing for children in general practice. A report from the Møre & Romsdal Prescription Study. Acta Paediatr 1998; 87: 218-24. 2. Straand J, Rokstad KS, Sandvik H. Prescribing systemic antibiotics in general practice. A report from the Møre & Romsdal Prescription Study. Scand J Prim Health Care 1998; 16: 121-7. 3. Standing Medical Advisory Committee, Sub-Group on Antimicrobial Resistance. The path of least resistance. London: Department of Health, 1998. 4. Butler CC, Rollnick S, Pill R, Maggs-Rapport F, Stott N. Understanding the culture of prescribing: qualitative study of general practitioners' and patients' perceptions of antibiotics for sore throat. BMJ 1998; 317: 637-42. 5. Belongia EA, Schwartz B. Strategies for promoting judicious use of antibiotics by doctors and patients. BMJ 1998; 317: 668-71. 6. Oxman AD, Thomson MA, Davis Da, Haynes RB. No magic bullets: a systematic review of 102 trials of interventions to improve professional practice. Can Med Assoc J 1995; 153: 1423-31. 7. Davis DA, Thomson MA, Oxman AD, Haynes RB. Changing physician performance: a systematic review of the effect of continuing medical education strategies. JAMA 1995; 274: 700-5. 8. Grimshaw J, Freemantle N, Wallace S, Russell I, Hurwitz B, Watt I, Long A, Sheldon T. Developing and implementing clinical practice guidelines. Qual Health Care 1995; 4: 55-64. 9. Thomson MA, Oxman AD, Davis DA, Haynes RB, Fremmantle N, Harvey EL. Audit and feedback to improve health professional practice and health care outcomes (part I) (Cochrane review). I: The Cochrane Library, utgave 4, 1998. Oxford: Update Software, 1998. 10. Thomson MA, Oxman AD, Davis DA, Haynes RB, Fremmantle N, Harvey EL. Audit and feedback to improve health professional practice and health care outcomes (part II) (Cochrane review). I: The Cochrane Library, utgave 4, 1998. Oxford: Update Software, 1998. 11. Thomson MA, Oxman AD, Davis DA, Haynes RB, Fremmantle N, Harvey EL. Outreach visits to improve health professional practice and health care outcomes (Cochrane review). I: The Cochrane Library, utgave 4, 1998. Oxford: Update Software, 1998. 12. Thomson MA, Oxman AD, Davis DA, Haynes RB, Fremmantle N, Harvey EL. local opinion leaders to improve health professional practice and health care outcomes (Cochrane review). I: The Cochrane Library, utgave 4, 1998. Oxford: Update Software, 1998. 13. Freemantle N, Harvey EL, Wolf F, Grimshaw JM, Grilli R, Bero LA. Printed educational materials to improve the behaviour of health care professionals and patient outcomes. I: The Cochrane Library, utgave 4, 1998. Oxford: Update Software, 1998. 14. Myhr K. Use of anti-infectives and impact of surveillance and guidelines on prescribing of anti-infectives. Tromsø og Oslo: 1996. 15. Statens helsetilsyn. Retningslinjer for håndtering av antimikrobielle midler. IK-2568. Oslo: Statens helsetilsyn, 1997. 16. Gruppe for kvalitetsutvikling i helsetjenesen. Sår hals - piller, trøst eller begge deler? Oslo: Allmennpraktiserende legers forening og Norsk selskap for allmennmedisin, 1999. 17. Den norske lægeforening, Funksjonshemmedes Fellesorganisasjon, Kommunenes Sentralforbund, Norske Fysioterapeuters forbund, Norsk sykepleierforbund, Universitetet i Oslo, Statens helsetilsyn og Statens institutt for folkehelse. Retningslinjer for retningslinjer. IK-2563. Oslo: Statens helsetilsyn, 1998. 18. Butler CC, Rollnick S, Pill R, Maggs-Rapport F, Stott N. Understanding the culture of prescribing: qualitative study of general practitioners' and patients' perceptions of antibiotics for sore throat. BMJ 1998; 317: 637-42. 19. Vinson DC, Lutz LJ. The effect of parental expectation on treatment of children with a cough: a report from ASPN. J Fam Pract 1997; 37: 23-7. 20. Cockburn J, Pit S. Prescribing behaviour in clinical practice: patients' expecta-tions and doctors' perceptions of patients' expectations - a questionnaire study. BMJ 1997; 315: 520-3. 21. Virji A, Britten N. A study of the relationship between patients' attitudes and doctors' prescribing. Fam Pract 1991; 8: 314-9. 22. Little P, Williamson I, Warner G, Gould C, Gantley M, Kinmonth A. Open randomised trial of prescribing strategies in managing sore throat. BMJ 1997; 314: 722-7. 23. Hamm RM, Hicks RJ, Bemben DA. Antibiotics and respiratory infections: are patients more satisfied when expectations are met? J Fam Pract 1996; 43: 56-62. 24. Kai J. What worries parents when their preschool children are acutely ill, and why: a qualitative study. BMJ 1996; 313: 983-6. 25. Kai J. Parents' difficulties and informations needs in coping with acute illness in preschool children: a qualitative study. BMJ 1996; 313: 987-90. 26. Little P, Gould C, Williamson I, Warner G, Gantley M, Kinmonth AL. Re-attendance and complications in a randomised trial of prescribing strategies for sore throat: the medicalising effect of prescribing antibiotics. BMJ 1997; 315: 350-2. 27. Dowell SF, red. Principles of judicious use of antimicrobial agents for pediatric upper respiratory tract infections. Pediatrics 1998; 101 (supplement): 163-84. 28. Arroll B, Kenealy T. Antibiotics versus placebo in the common cold (Cochrane review). I: The Cochrane Library, utgave 4, 1998. Oxford: Update Software, 1998. 29. Fahey T, Stocks N, Thomas T. Quantitative systematic review of randomised controlled trials comparing antibiotic with placebo for acute cough in adults. BMJ 1998; 316: 906-10. 30. Becker L, Glazier R, McIsaac W, Smucny J. Antibiotics for acute bronchitis. (Cochrane review). I: The Cochrane Library, utgave 4, 1998. Oxford: Update Software, 1998. 31. Lindbæk M. Akutt bronkitt i allmennpraksis skal sjelden behandles med antibiotika. Resistens 1998; 2: 9. 32. Mar CD, Glasziou P, Hayem M. Are antibiotics indicated as initial treatment for children with acute otitis media? A meta-analysis. BMJ 1997; 314: 1526-9. 33. Froom J, Culpepper L, Jacobs M, Demelker RA, Green LA, van Buchem L, Grob P, Heeren T. Antimicrobials for acute otitis media? A review from the Internatio-nal Primary Care Network. BMJ 1997; 315: 98-102. 34. Kozyrskyj AL, Hildes-Ripstein E, Longstaffe SEA, Wincott JL, Sitar DS, Klassen TP et al. Treatment of acute otitis media with a shortened course of antibiotics. A meta-analysis. JAMA 1998; 279: 1736-42. 35. Kværner KJ, Mair IWS. Akutt og residiverende akutt otitis media. Profylakse og behandling i lys av nyere kunnskap. Tidsskr Nor Lægeforen 1997; 117: 4096-8. 36. Del Mar CB, Glasziou PP. Antibiotics for the symptoms and complications of sore throat (Cochrane review). I: The Cochrane Library, utgave 4, 1998. Oxford: Update Software, 1998. 37. Hjortdahl P. Informerte pasienter - til glede eller besvær. Tidsskr Nor Lægeforen 1997; 117: 2604. 38. Stormark M, Scheel O. Den landsomfattende prevalensundersøkelsen 23. oktober 1997 - foreløpige resultater. SHE-nytt 1997; 1: 7-8. 39. Statens institutt for folkehelse og Statens helsetilsyn. Smittevern i helseinstitusjoner - sykehusinfeksjoner. IK-2532. Oslo: Statens institutt for folkehelse og Statens helsetilsyn, 1996. 40. Garner JS, Hospital Infection Control Practices Advisory Committee. Guidelines for isolation precautions in hospitals. Am J Infect Control 1996; 24: 24-52. 41. Centers for Disease Control and Prevention. Guidelines for preventing the transmission of tuberculosis in health-care facilities, 1994. Morbid Mortal Wkly Rep 1994; 43(RR-13): 1-132. 42. Marbury MC, Maldonado G, Waller L. Lower respiratory illness, recurrent wheezing, and day care attendance. Am J Respir Crit Care Med 1997; 155: 156-61. 43. Louhiala PJ, Jaakkola N, Ruotsalainen R, Jaakkola JJK. Form of day care and respiratory infections. Am J Public Health 1995; 85: 1109-12. 44. Takala AK, Jero J, Kela E, Rønnberg PR, Koskenniemi K, Eskola J. Risk factors for primary invasive pneumococcal disease among children in Finland. JAMA 1995; 273: 859-65. 45. Holberg CJ, Wright AL,Martinez FD, Morgan WJ, Taussig LM, and GHMA. Child day care; smoking by caregivers, and lower respiratory tract illness in first 3 years of life. Pediatrics 1993; 91: 885-92. 46. Hurwitz ES, Gunn WJ, Pinsky PF, Lawrence B, Schonberger B. Risk of respiratory illness associated with day-care attendance: a nationwide study. Pediatrics 1991; 87: 62-9. 47. Wald ER, Guerra N, Byers C. Frequency and severity of infections in day care: three-year follow-up. J Pediatr 1991; 118: 509-14. 48. Anderson L, Parker R, Strikas R et al. Day-care center attendance and hospitalization for lower respiratory tract illness. Pediatrics 1988; 82: 300-8. 49. Hardy AM, Glenn Fowler M. Child care arrangements and repeated ear infections in young children. Am J Public Health 1995; 83: 1321-5. 50. Louhiala,PJ, Jaakkola N, Ruotsalainen R, Jaakkola JJK. Day-care centers and diarrhea: a public health perspective. J Pediatr 1997; 131: 476-9. 51. Nafstad P, Hagen JA, Øie L, Magnus P, Jaakkola JJK. Day-care centers and respiratory health. Pediatrics 1999; i trykken. 52. Nafstad P, Jaakkola JJK, Hagen JA, Botten G. Lower respiratory tract infections among Norwegian infants with siblings in day care. Am J Public Health 1996; 86: 1456-60. 53. Kværner KJ, Nafstad P, Hagen JA, Mair IWS, Jaakkola JJK. Early acute otitis media and siblings' attendance at nursery. Arch Dis Child 1996; 55: 338-41. 54. Peltola H, Aavitsland P, Hansen KG, Jónsdóttir KE, Nøkleby H, Romanus V. Perspective: A five-country analysis of the impact of four different Haemophilus influenzae type b conjugates and vaccination strategies in Scandinavia. J Infect Dis 1999; 179: 223-9. 55. Markestad A, Grave K. Reduction of antibacterial drug use in Norwegian fish farming due to vaccination. Develop Biol Stand 1997; 90: 365-9. 56. Aavitsland P, Lassen J. PPNG i Norge 1975-96. Resistens 1997; 1: 2. 57. Lassen J, Hasseltvedt V, Hoel T. Økt insidens av tyfoidfeber hos personer smittet i Pakistan og India (Punjab). MSIS-rapport 1998; 26: 38. 58. Aavitsland P. En plass for karantene? Tidsskr Nor Lægeforen 1998; 118. 3582. 59. deFerranti Sd, Ioannidis JPA, Lau J, Anninger WA, Barza M. Are amoxycillin and folate inhibitors as effective as other antibiotics for acute sinusitis? A meta-analysis. BMJ 1998; 317: 632-7. 60. Lindbæk M, Hjortdahl P, Johnsen UL. Randomised, double blind, placebo controlled trial of penicillin V and amoxycillin in treatment of acute sinus infections in adults. BMJ 1996; 313: 325-9. 61. Ministry of Health and Ministry of Food, Agriculture and Fisheries. The Copenhagen recommendations. København: Sundhedsministeriet og Fødevare-, landbrugs og fiskeriministeriet, 1998. Lagt inn 4. februar 1999 av Statens forvaltningstjeneste, ODIN-redaksjonenHandlingsplan
Å bevare antibiotika som verktøy for behandling av mennesker og dyr også i neste århundre krever innsats på flere områder. Det er allerede gjort mye i Norge, og noen av tiltakene nedenfor er i gang. Det er likevel mange huller og mangel på koordinering. Derfor trengs en overordnet plan.
Målene nedenfor bygger på del 4 og sammenfatter handlingsplanen for å motvirke antibiotikaresistens. Hovedmålene gir uttrykk for planens siktemål. For å nå hovedmålene er det definert åtte innsatsområder, hver med sitt delmål. Tiltakene er konkrete virkemidler for å oppnå målene.
Overordnet mål
Bevare antibiotika som gode og virksomme legemidler mot infeksjonssykdommer i det 21. århundre gjennom å motvirke utvikling og spredning av antibiotikaresistens.
Hovedmål
- I løpet av perioden 1999-2003 skal vi oppnå bedre kunnskaper
om:
- antibiotikabruk,
- forekomst av resistente mikrober hos mennesker og dyr og i matvarer og miljø, og
- årsaker til utvikling og spredning av resistente mikrober. - I løpet av perioden 1999-2003 skal bruken av antibiotika til mennesker og dyr forbedres.
- I løpet av perioden 1999-2003 skal smittevernet for mennesker og dyr forbedres.
Innsatsområde 1 - Overvåking av resistens
Delmål
Overvåke og kartlegge forekomsten og utviklingen av resistente mikrober fra mennesker, dyr og matvarer.
Tiltak
- Etablere et Norsk overvåkingssystem for resistens hos mikrober (NORM) som også inkluderer zoonotiske bakterier.
- Fortsette overvåkingen i Meldingsystem for smittsomme sykdommer (MSIS) av infeksjoner forårsaket av visse resistente bakterier.
- Etablere overvåking av resistensutviklingen ved de enkelte avdelinger i sykehusene.
- Samordne overvåkingen av resistensutviklingen hos visse bakterier som gir sykdom hos dyr.
- Videreføre og utvide kartleggingen av resistente bakterier i matvarer av norsk og utenlandsk opprinnelse.
- Kartlegge utbredelsen av resistens hos humant immunsviktvirus (HIV) i Norge.
- Fortsette deltakingen i offisielle internasjonale systemer for resistensovervåking.
Innsatsområde 2 - Overvåking av antibiotikabruk
Delmål
Overvåke all bruk av antibiotika.
Tiltak
- Iverksette den planlagte reseptbaserte legemiddelstatistikken og arbeide for at den så raskt som mulig kan inkludere diagnosekode og veterinærers rekvirering.
- Etablere en løpende overvåking av et representativt utvalg av legers resepter, med diagnosekode (inntil den landsomfattende reseptbaserte legemiddelstatistikken med diagnosekode er i gang).
- Fortsette overvåking av antibiotikasalg basert på grossistenes opplysninger inntil reseptbasert overvåking er vel etablert.
- Fortsette og styrke overvåking av antibiotikabruk ved de enkelte avdelinger i sykehusene.
- Fortsette den reseptbaserte overvåkingen av antibiotikabruk til oppdrettsfisk.
- Fortsette overvåkingen av antibiotikabruk som vekstfremming til dyr.
- Fortsette overvåking av restmengder av antibiotika i matvarer.
Innsatsområde 3 - Forskning, utvikling og utredning
Delmål
Styrke kunnskapene om årsakene til utvikling og spredning av resistente mikrober og forbedre kunnskapsgrunnlaget for valg av tiltak for å motvirke resistens.
Tiltak
- Etablere et femårig program (1999-2003) med et tverrfaglig styre i Norges forskningsråd for å styrke forskningen om resistens.
- Samarbeide med forskningsmiljøer i andre land og oppnå finansiering fra blant andre EUs forsknings-programmer.
- Støtte forvaltningen med forskningsbasert kunnskap til bruk i forvaltningsstrategi og internasjonale avtaler.
- Forske innen flere fagområder og oppnå bedre samarbeid mellom fagområder som bakteriologi, klinisk medisin og veterinærmedisin, helsetjenesteforskning, epidemiologi og miljøforskning.
Innsatsområde 4 - Rekvirering
Delmål
Forbedre legers, tannlegers og veterinærers rekvirering og bruk av antibiotika.
Tiltak
- Lage en lokalt tilpasset antibiotikastrategi, som blant annet inkluderer de forskriftspålagte skriftlige retningslinjer for bruk av antibiotika, ved alle helseinstitusjoner.
- Oppnevne en antibiotikaansvarlig person eller en antibiotikakomité ved alle sykehus.
- Stimulere allmennleger til å delta i kvalitetsforbedrende pedagogiske opplegg, som smågrupper, gjensidige praksisbesøk og praksisregistreringer med tilbakemelding.
- Tilby allmennleger besøk av produsentuavhengige antibiotikakonsulenter.
- Vurdere å opprette et senter for antibiotikabehandling i allmennpraksis for en prøveperiode på fem år.
- Evaluere antibiotikabruk i fastlegeordningen.
- Prøve ut, ved noen større legevakter, en ordning med gratis revurdering av pasienten der legen er i tvil om antibiotika er indisert.
- Gjøre det veterinærmedisinske senteret for produsentuavhengig legemiddelinformasjon (VETLIS) til et permanent tiltak.
- Videreføre årlige terapiverksteder med veterinærmedisinsk tema.
- Integrere temaet antibiotikaresistens i de kliniske fagene i grunnutdanningen av leger, tannleger, veterinærer og farmasøyter.
- Påvirke utenlandsutdannete leger og veterinærer som skal praktisere i Norge til riktig bruk av antibiotika så tidlig som mulig, helst før de starter å praktisere.
- Prioritere resistens som tema for videre- og etterutdanning av leger, tannleger, veterinærer, farmasøyter og andre relevante faggrupper (særlig sykepleiere).
- Utdanne flere medisinske mikrobiologer og infeksjonsmedisinere.
- Skape balanse mellom legemiddelindustriens markedsføring av antibiotika og ikke-kommersielle alternativer og stimulere til kritisk holdning hos rekvirenter, annet helsepersonell og publikum.
- Samordne kvalitetssikringen av antibiotikaveiledere.
Innsatsområde 5 - Kommunikasjon med publikum
Delmål
Påvirke publikums og dyreeieres kunnskaper, holdninger og atferd vedrørende antibiotika slik at de bidrar til mer fornuftig antibiotikabruk og samtidig søker medisinsk hjelp ved mulig alvorlig sykdom.
Tiltak
- Iverksette en informasjonskampanje på helsestasjonene rettet mot småbarnsforeldre.
- Produsere informasjonsmateriell til bruk ved legekontorer, legevakter og apotek og til bruk for kjæle- og hobbydyreiere.
- Videreføre samarbeidet mellom veterinærene og næringsorganisasjonene innen dyreproduksjonen.
- Stimulere til redaksjonelt stoff i helsespaltene i blader, aviser og TV.
- Stimulere lærebokforlag og -forfattere til å inkludere temaet antibiotikaresistens i de ordinære lærebøkene for grunnskolen.
- Oppfordre de frivillige organisasjonene til å finne sin naturlige plass i forebyggingen av antibiotikaresistens som folkehelseproblem.
Innsatsområde 6 - Smittevern
Delmål
Forbedre smittevernet for mennesker i og utenfor sykehus og for dyr og dermed redusere antallet infeksjoner (også med resistente mikrober) og minske behovet for antibiotikabehandling.
Tiltak
- Utvikle og implementere standardtiltak for smittevern ved pleie og behandling i helseinstitusjoner.
- Lage lokalt tilpassete retningslinjer for smittevernet i sykehjem og tilsvarende institusjoner og sikre kommunelegens muligheter til å utføre sine smittevernoppgaver i de kommunale helseinstitusjonene.
- Arbeide for å redusere overbelegg i sykehus gjennom å etablere styringsrutiner som sikrer bedre samsvar mellom behovet for akuttinnleggelser og antallet sengeplasser i sykehus, for å unngå koridorpasienter.
- Bygge flere enerom med nødvendige sanitærinstallasjoner ved sykehusene for å kunne gjennomføre forsvarlig kontaktsmitteisolering.
- Erstatte kjemisk desinfeksjon med varmedesinfeksjon så langt det er mulig.
- Styrke hygienetiltak ved operasjoner, blant annet ved å sikre at sykehus som implanterer infeksjonsutsatte fremmedlegemeproteser, har operasjonsrom med tilfredsstillende mikrobiologisk luftkvalitet.
- Iverksette smitteverntiltak i barnehager så snart kunnskapsgrunnlaget for tiltakene er klart.
- Forbedre befolkningens hånd- og kjøkkenhygiene.
- Opprettholde høy oppslutning om barnevaksinasjonsprogrammet.
- Etablere et eldrevaksinasjonsprogram for alle innbyggere over 65 år og tilby gratis vaksine mot influensa og pneumokokksykdom.
- Styrke smittevernveiledning og vaksinasjon av norske reisende.
- Etablere økonomiske ordninger som motiverer veterinærer og dyreprodusenter til økt sykdomsforebyggende innsats, herunder vaksinasjon, i husdyrholdet.
- Ta hensyn til resistensproblemene ved eventuell økt import av dyr og mat.
- Støtte det internasjonale smittevernarbeidet i regi av Verdens helseorganisasjon og støtte smittevernet i Nordens nærområder spesielt.
Innsatsområde 7 - Mikrobiologisk diagnostikk og resistensbestemmelse
Delmål
Ta prøver av dyr og mennesker med infeksjoner i de rette situasjonene og på en korrekt måte og forbedre laboratorienes identifisering av den sykdomsskapende mikroben og bestemmelse av dens resistensforhold.
Tiltak
- Gi Arbeidsgruppen for antibiotikaspørsmål sterkere offentlig støtte og formalisert tilknytning til Norsk overvåkingssystem for resistens hos mikrober.
- Bidra til at laboratoriene kvalitetssikrer sine resistensbestemmelser i overensstemmelse med krav til akkreditering.
- Formalisere ordningene for spesial- og referansefunksjoner innen medisinsk mikrobiologi.
- Videreføre Norsk senter for kvalitetssikring av laboratorievirksomhet utenfor sykehus (NOKLUS) og dets veiledning om klinisk relevante problemstillinger vedrørende infeksjoner.
- Gi veterinærene insentiver for innsending av tilstrekkelig prøvemateriale ved infeksjoner i tråd med god veterinærmedisinsk praksis, og gi Veterinærinstituttet mulighet til å utføre de mikrobiologiske undersøkelsene uten kostnad for dyreeier og veterinær.
Innsatsområde 8 - Forvaltning og tilsyn
Delmål
Gjennomgå og forbedre regelverk, gjøre vedtak og føre tilsyn som bidrar til streng antibiotikapolitikk og fornuftig bruk av antibiotika.
Tiltak
- Fortsette ei streng linje vedrørende markedsføringstillatelser for nye antibiotika blant annet gjennom å la risiko for resistensutvikling fortsatt inngå som en viktig del av vurdering av sikkerheten for et preparat.
- Videreføre bruken av rekvireringsbegrensninger og utleveringsbestemmelser for å forbeholde bruken av visse viktige antibiotika til særlige situasjoner.
- Opprettholde reseptplikt for antibiotika.
- Samarbeide med andre land om å påvirke EUs legemiddelmyndigheter til å innta en strengere holdning til godkjenning av antibiotika.
- Undersøke hvordan trygderefusjon for antibiotika fungerer og eventuelt stramme inn ordningene dersom de stimulerer til unødvendig bruk av antibiotika eller til bruk av mindre heldige midler.
- Nøye overvåke reklame for antibiotika og gripe inn mot overtredelser.
- Fortsette tilsyn, blant annet gjennom stikkprøver, med bruk av antibiotika i fôr til husdyr.
- Føre tilsyn med sykehusenes smittevernarbeid, herunder særlig deres anibiotikastrategi.
- Utrede om tilsyn med veterinærers rekvirering skal overføres til Statens dyrehelsetilsyn.
Vedlegg
Vedlegg 1. Når de ulike antibiotika ble oppdaget eller tatt i brukVedlegg 2. Antibiotika til menneskerVedlegg 3. Antibiotika til dyrVedlegg 4. Virkningsmekanismer for antibiotikaVedlegg 5. Mekanismer for resistens mot antibiotikaVedlegg 6. SmittemåterVedlegg 7. Utvikling av antibiotikaresistens hos noen viktige sykdomsframkallende bakterierVedlegg 1. Når de ulike antibiotika ble oppdaget eller tatt i bruk
| Antibiotikum | Tid | Kilde* |
| Kinin | Brukt i Sør- Amerika før europeerne kom | Cinchona bark |
| Emetin | Ipechuanha rot | |
| Salvarsan | 1909 (Ehrlich) | Syntetisert |
| Sulfa (Prontosil) | 1935 (Domagk) | Syntetisert |
| Penicillin G | 1929-1940 (Fleming) | Penicillum notatum |
| Tyrotricin
(Gramicidin + Tyrocidin) | 1939 | Bacillus brevis |
| Griseofulvin | 1939 | P. griseofulvum |
| Streptomycin | 1944 | Streptomyces griseus |
| Bacitracin | 1945 | Bacillus licheniformis |
| Kloramfenikol | 1947 | Streptomyces venezuelae |
| Polymyxin | 1947 | Bacillus polymyxa |
| Klortetracyklin | 1948 | Streptomyces aureofaciens |
| Cephalosporin C, N og P | 1948 | Cephalosporium sp. |
| Neomycin | 1949 | Streptomyces fradiae |
| Oksytetrascyklin | 1950 | Streptomyces rimosus |
| Nystatin | 1950 | Streptomyces noursei |
| Erytromycin | 1952 | Streptomyces erythreus |
| Oleandomycin | 1954 | Streptomyces antibioticus |
| Spiramycin | 1954 | Streptomyces ambofaciens |
| Novobiocin | 1955 | Streptomyces spp. |
| Cycloserin | 1955 | Streptomyces spp. |
| Vankomycin | 1956 | Amycolaatopsis (Streptomyces) orientalis |
| Rifamycin | 1957 | Streptomyces mediterranei |
| Kanamycin | 1957 | Streptomyces kanamyceticus |
| Fucidinsyre | 1960 | Fusidium coccineum |
| Spectinomycin | 1961-62 | Streptomyces flavopersicus |
| Nalidixinsyre | 1962 | Syntetisert |
| Linkomycin | 1962 | Streptomyces lincolnensis |
| Gentamicin | 1963 | Micromonospora purpurea |
| 1.-generasjons cefalosporiner | 1964 | Kjemisk endring |
| Tobramyin | 1968 | Streptomyces tenebraeus |
| 2. generasjons cefalosporiner | 1973- | Kjemisk endring |
| 3. generasjons cefalosporiner | 1977- | Kjemisk endring |
| Monobaktamer | 1980- | Chromobacterium violaceum |
| Fluorokinoloner | 1980- | Syntetisert |
| Karbapenemer | 1980- | Streptomyces cattleya |
| Mupirocin | 1980- | Pseudomonas fluorescens |
| Penicillin + betallaktamaseinhibitor | 1980- | Streptomyces clavuligenus |
| Nye makrolider | 1990-92 | Kjemisk endring |
| Orale cefalosporiner 2.- og 3.-generasjon | 1990- | Kjemisk endring |
| Penicillin + betalaktamaseinhibitor | 1990-92 | Kjemisk endring |
| Teikoplanin | 1990-92 | Actinoplanes teicomyceticus |
| Ceftriaxon | 1993-95 | Kjemisk endring |
*Mange midler er naturlige stoffer som er kjemisk modifisert
Vedlegg 2. Antibiotika til mennesker
Tabellen viser legemidlenes hovedgruppe, undergruppe, navn, dato for registrering i Norge og antall forskjellige preparater av det enkelte legemidlet.
| ANTIBAKTERIELLE MIDLER TIL SYSTEMISK BRUK (J 01) | |||
| A Tetracykliner | |||
| Tetracyklin | mar 1953 | 2 | |
| Oksytetracyklin | sep 1953 | 1 | |
| Lymecyklin | jun 1962 | 1 | |
| Doksycyklin | okt 1967 | 5 | |
| B Amfenikoler | |||
| Kloramfenikol | des 1952 | 2 | |
| C Betalaktamantibakterielle midler: penicilliner | |||
| A Penicilliner med utvidet gramnegativt spektrum | |||
| Ampicillin | feb 1962 | 2 | |
| Pivampicillin | feb 1971 | 1 | |
| Amoksicillin | nov 1976 | 5 | |
| Azlocillin | aug 1983 | ||
| Pivmecillinam | des 1986 | 1 | |
| Mecillinam | 1 | ||
| E Betalaktamaseømfintlige penicilliner | |||
| Benzylpenicillin | jan 1949 | 1 | |
| Fenoksymetylpenicillin | jul 1955 | 6 | |
| F Betalaktamaseresistente penicilliner | |||
| Kloksacillin | apr 1964 | 1 | |
| Dikloksacillin | sep 1968 | 1 | |
| R Kombinasjon av penicillin og betalaktamasehemmer | |||
| Amoksicillin og klavulansyre | aug 1995 | 1 | |
| D Andre betalaktamantibakterielle midler | |||
| A Cefalosporiner og liknende substander | |||
| Cefalotin | aug 1965 | 1 | |
| Cefaleksin | jul 1970 | 2 | |
| Cefoksitin | jul 1981 | 1 | |
| Cefotaksim | mar 1983 | 1 | |
| Ceftazidim | okt 1986 | 1 | |
| Ceftriakson | feb 1996 | 1 | |
| F Monobaktamer | |||
| Aztreonam | apr 1998 | 1 | |
| H Karbapenemer | |||
| Imipenem | aug 1988 | 1 | |
| Meropenem | apr 1997 | 1 | |
| E Sulfonamider og trimetoprim | |||
| Sulfa | jan 1947 | 1 | |
| Sulfametoksazol og trimetoprim | apr 1971 | 2 | |
| Trimetoprim | okt 1980 | 3 | |
| F Makrolider og linkosamider | |||
| A Makrolider | |||
| Erytromycin | des 1952 | 3 | |
| Spiramycin | jan 1959 | 1 | |
| Klaritromycin | apr 1994 | 1 | |
| Azitromycin | sep 1994 | 1 | |
| F Linkosamider | |||
| Linkomycin | jun 1966 | 1 | |
| Klindamycin | okt 1971 | 1 | |
| G Aminoglykosider | |||
| Streptomycin | jan 1950 | 0 | |
| Gentamicin | mar 1970 | 2 | |
| Tobramycin | aug 1976 | 1 | |
| Netilmicin | feb 1983 | 1 | |
| M Kinoloner | |||
| Ciprofloksacin | okt 1990 | 1 | |
| Ofloksacin | nov 1991 | 1 | |
| X Andre antibakterielle midler | |||
| A Glykopeptidantibakterielle midler | |||
| Vankomycin | mar 1959 | 2 | |
| Teikoplanin | aug 1994 | 1 | |
| B Polymyksiner | |||
| Colistin | des 1963 | 1 | |
| C Steroidantibakterielle midler | |||
| Fusidinsyre | mar 1964 | 1 | |
| D Imidazolderivater | |||
| Metronidazol | mar 1961 | 3 | |
| ANTIMYKOTIKA TIL SYSTEMISK BRUK (J 02) | |||
| A Antimykotika til systemisk bruk | |||
| A Antibiotika | |||
| Amfotericin | 2 | ||
| B Imidazolderivater | |||
| Ketokonazol | okt 1987 | 1 | |
| C Triazolderivater | |||
| Flukonazol | des 1990 | 1 | |
| Itrakonazol | des 1995 | 1 | |
| X Andre mykotika til systemisk bruk | |||
| Flucytosin | aug 1976 | 1 | |
| ANTIMYKOBAKTERIELLE MIDLER (J 04) | |||
A Midler til behandling av tuberkulose | |||
B Antibiotika | |||
| Rifampicin | jan 1969 | 1 | |
C Hydrazider | |||
| Isoniazid | jan 1952 | 1 | |
| B Midler til behandling av lepra | |||
| A Midler til behandling av lepra | |||
| Dapson | aug 1984 | 1 | |
| ANTIVIRALE MIDLER TIL SYSTEMISK BRUK (J 05) | |||
A Midler som virker direkte på virus | |||
B Nukleosider og nukleotider | |||
| Aciklovir | mai 1983 | 2 | |
| Zidovudin | mar 1987 | 1 | |
| Zalcitabin | mar 1987 | 1 | |
| Didanosin | nov 1992 | 1 | |
| Valaciclovir | des 1996 | 1 | |
| Lamivudin | mar 1997 | 1 | |
| Ganciclovir | mar 1997 | 1 | |
E HIV-proteasehemmer | |||
| Indinavir | apr 1997 | 1 | |
| Saquinavir | jun 1997 | 1 | |
D Fosfonsyrederivater | |||
| Foscarnet | feb 1990 | 1 | |
X Andre antivirale midler | |||
| Stavudin | mai 1997 | 1 | |
Vedlegg 3. Antibiotika til dyr
Tabellen viser legemidlenes hovedgruppe, undergruppe, navn, dato for registrering i Norge og antall forskjellige preparater av det enkelte legemidlet.
| ANTIBAKTERIELLE MIDLER TIL SYSTEMISK BRUK (JO1) | |||
| A Tetracykliner | |||
| Oksytetracyklin | mar 1956 | 6 | |
| Doksycyklin | mar 1995 | 3 | |
| B Amfenikoler | |||
| Florfenikol | apr 1994 | 1 | |
| C Betalaktamantibakterielle midler: penicilliner | |||
| A Penicilliner med utvidet gramnegativt spektrum | |||
| Ampicillin | apr 1977 | 2 | |
| Pivampicillin | 1 | ||
| Amoksicillin | jul 1993 | 3 | |
| E Betalaktamaseømfintlige penicilliner | |||
| Prokainpenicillin | mar 1950 | 3 | |
| Benzylpenicillin | 2 | ||
| Fenoksymetylpenicillin | 4 | ||
| Pentamathydrojodid | okt 1966 | 1 | |
| E Sulfonamider og trimetoprim | |||
| Sulfa | aug 1949 | 2 | |
| Sulfa og trimetoprim | mai 1972 | 4 | |
| Sulfa og bakviloprim | jul 1994 | 3 | |
| Trimetoprim | okt 1980 | 3 | |
| F Makrolider og linkosamider | |||
| A Makrolider | |||
| Spiramycin | des 1969 | 1 | |
| F Linkosamider | |||
| Linkomycin | jun 1982 | 1 | |
| M Kinoloner | |||
| A Fluorokinoloner | |||
| Enrofloxacin | mai 1992 | 1 | |
| Flumekin | mai 1994 | 2 | |
| Andre kinoloner | |||
| Oksolinsyre | sep 1991 | 1 | |
| R Kombinasjoner av antimikrobielle midler | |||
| A Kombinasjoner av antimikrobielle midler | |||
| Penicillin og dihydrostreptomycin | apri 1955 | 4 | |
| X Andre antibakterielle midler | |||
| Tiamulin | des 1983 | 1 | |
| ANTIBAKTERIELLE MIDLER TIL INTRAMAMMÆR BRUK (J51) | |||
| A Tetracykliner | |||
| Oksyktetracyklin | mar 1956 | 1 | |
| C Betalaktamantibakterielle midler, penicilliner | |||
| Ampicillin og kloksacillin | des 1992 | 2 | |
| Penatamathydrojodid | 1 | ||
| RC Kombinasjoner av antibakterielle midler til intrammamær bruk | |||
| Prokainpenicillin og dihydrostreptomycin | jun 1956 | 5 | |
| Penatamathydrojodid og dihydrostreptomycin | mai 1968 | 1 | |
Vedlegg 4. Virkningsmekanismer for antibiotika
| Antibiotikum | Målmolekyl i bakteriene |
| Antibiotika som hindrer oppbygging av bakterienes cellevegg | |
| Penicilliner | Transpeptidase |
| Cefalosporiner | Transpeptidase |
| Bacitracin | Isoprenylfosfat |
| Glykopeptider | Acyl-D-alanyl-D-alanin |
| Cycloserin | Alaninracemase/syntetase |
| Fosfomycin | Puruvyltransferase |
| Antibiotika som hemmer bakterienes proteinproduksjon (ribosomhemmere) | |
Kloramfenikol | Peptidyltransferase |
Makrolider | Translokasjon |
Linkosaminer | Peptidyltransferase |
Fsidinsyre | Elongeringsfaktor G |
Tetracycliner | Ribosomalt A sted |
Aminoglykosider | Initieringskompleks, translasjon |
Antibiotika som hemmer funksjonen til bakterienes arvestoff | |
Kinoloner | DNA-gyrase (alfaenhet) |
Novobiocin | DNA-gyrase (betaenhet) |
Rifampicin | DNA-avhengig RNA-polymerase |
5-nitroimidazoler | DNA-trådene forstyrres |
Nitrofuraner | DNA-trådene forstyrres |
Antibiotika som skader bakteriecellemembranen | |
Polymyksin | Fosfolipider |
Antibiotika som hemmer bakteriens vitaminproduksjon | |
Sulfonamider | Pteroatsyntetase |
Diaminopyrimidiner | Dihydrofolatreduktase |
Vedlegg 5. Mekanismer for resistens mot antibiotika
| Antibiotikum | Mekanisme for resistensutvikling* |
Bakteriemolekylet som antibiotikumet skal virke på, er endret | |
Aminoglykosider | Endret ribosomalt protein |
Betalaktamantibiotika | Endrede, nye, eller økt mengde av penicillinbindende proteiner |
Erytromycin og klindamycin | Metylering av 23S ribosomalt RNA (rRNA) og skjerming av målmolekyl ved nytt protein |
Kinoloner | Endret DNA-gyrase |
Rifampicin | Endret RNA-polymerase |
Sulfonamider | Ny, insensitiv dihydropteroat syntase, økt mengde enzym |
Trimetoprim | Ny, insensitiv dihydrofolat reduktase og økt produksjon av målmolekyl |
Tetracykliner | Ribosomal skjerming |
Vankomycin | D-lactat terminus i stammepeptidet i petidoglykanet |
Bakterien produserer enzymer som gjør antibiotikumet virkningsløst | |
Aminoglykosider | Acetyltransferase, nukleotidyltransferase, fosfotransferase |
Betalaktamantibiotika | Betalaktamaser |
Kloramfenikol | Acetyltransferase |
Bakterieveggen er blitt mindre gjennomtrengelig for antibiotikumet | |
Betalaktamantibiotika inklusive imipenem, kloramfenikol, kinoloner, tetracykliner, trimetoprim | Bortfall av yttermembranproteiner (poriner) |
Antibiotikumet pumpes ut igjen fra bakterien | |
Erytromycin Tetracyclin Fluorokinoloner Karbapenemer | Nytt membrantransportsystem i bakterie-membranen |
* Flere mekanismer kan forekomme samtidig og forsterke hverandre.
Vedlegg 6. Smittemåter
| Smittemåte | Smitte overføres ... | Forklaring og eksempler |
Kontaktsmitte | ||
-direkte | ...ved direkte kontakt mellom hud eller slimhinner | Sex, kyss, hudkontakt |
-indirekte | ...via felles berøringspunkt eller via mellomperson | Via helsepersonells hender, dørvridere, leketøy, felles brusflaske, medisinske instrumenter |
-nærdråpesmitte | ...med relativt store dråper av spytt eller snørr | Hosting på kort rekkevide (under 1 m) |
Luftbåren smitte | ...med små, inntørkete dråpekjerner eller med støv | Kan virke over mange meter; gjelder bare noen få sykdommer, som vannkopper, meslinger og tuberkulose |
Inokulasjonssmitte | ...direkte gjennom hud eller slimhinner og inn i vev eller blod | Smitteførende kroppsvæske (oftest blod) overføres med nål, kanyle eller kniv |
Smitte ved svangerskap og fødsel | ...gjennom morkaken eller under fødselen fra mor til barn | |
Felles vehikkelsmitte | ..fra mat, vann eller annet til mange personer | Brønn som er forurenset med avføring, puss fra verkefinger i maten |
Vektorbåren smitte | ...via insekter mv. | Kontakt eller bitt |
Vedlegg 7. Utvikling av antibiotikaresistens hos noen viktige sykdomsframkallende bakterier
Tabellen viser noen milepæler i resistensutvikling hos noen bakterier mot visse antibiotika.
Tid | Haemophilus influenzae | Neisseria meningitidis | Neisseria gonorrhoeae | Enterobakterier | Stafylokokker | Pneumokokker | Enterokokker |
| 1940- | Penicillin | ||||||
1950- | Endrete PBP | ||||||
1960- | Sulfa (1965) | Penicillin (1963) E coli | Methicillin (MRSA) | Endrete PBP i USA og Ny Guinea | |||
1970- | Pencillin (1974) | Penicillin (1976) | Økende ampicillinresistens | Methicillin (MRSA) i Norge | Penicillin i Sør-Afrika | ||
1980- | Kloramfenikol (1981) | Endrete PBP | ESBL (1983) Klebsiella | Penicillin i USA, spania, Ungarn | Aminoglykosid
Vankomycin (VRE) | ||
1990- | Kloramfenikol | Fluorokinolon | Vankomycin (VRSA)? | Penicillin i Island 3. generasjon cefalosporiner | Vankomycin (VRE) i Norge (1995) | ||
*PBP er penicillinbindende proteiner. Når de endrer seg, er det tegn på begynnende resistens mot penicillin.
Lagt inn 4. februar 1999 av Statens forvaltningstjeneste, ODIN-redaksjonen