Del I
Bakgrunn
2 Innledning
Å prioritere er å rangere noen eller noe foran noen andre eller noe annet med utgangspunkt i anerkjente mål. I helse- og omsorgstjenesten betyr det at tiltak for pasientgrupper eller enkeltpasienter veies og rangeres mot andre tiltak for andre pasienter. Prioriteringer innebærer dermed at noen får, mens andre ikke får. Det kan være legitim uenighet om hva som er riktige prioriteringer, både om hvem som skal få prioritet, og hvordan vi bestemmer dette. Alt dette betyr at prioriteringer er etisk utfordrende.
Det har vært bred enighet om at det er nødvendig å prioritere. Prioritering har vært tema i flere utredninger og stortingsmeldinger (Meld. St. 38 (2020–2021); Meld. St. 34 (2015–2016); NOU (1997: 18); NOU (1987: 23)) Det er rimelig å anta at prioriteringer vil bli både viktigere og vanskeligere i årene framover. Befolkningen vokser, og det blir flere eldre og flere som lever med kompleks sykdom. Flere behandlingsmetoder blir tilgjengelige, blant annet avanserte terapier som genterapier og celleterapier. Prisen på disse behandlingene er ofte svært høy. Fagmiljøene og befolkningen ønsker å ta nye metoder i bruk, og generelt øker forventningene i befolkningen til hva helse- og omsorgstjenesten kan gjøre.
Helse- og omsorgstjenestene har imidlertid et definert og avgrenset budsjett, og dette må balanseres mot andre sektorer, som for eksempel utdanning og forsvar. Det er ikke nok ressurser tilgjengelig til å tilby alle pasientene og brukerne alle tiltak og behandlinger som potensielt kan gi bedre helse. Dette handler om kroner og øre, men også om kvalifisert helsepersonell, utstyr, areal og tid. En bærekraftig helse- og omsorgstjeneste kan ikke tilby alle behandlingsmuligheter som finnes (se kapittel 2.1 i Meld. St. 34 (2015–2016) og NOU 2023: 4). Prioriteringer er derfor uunngåelige. Da er det ønskelig at prioriteringer skjer bevisst og åpent, heller enn ubevisst og skjult.
Prioriteringer skjer på alle nivåer i helsetjenesten: fra den kommunale helse- og omsorgssektoren til høyspesialiserte avdelinger på universitetssykehus. Fra klinikerens møte med enkeltpasienter, via avdelingens prioriteringer og utvikling av retningslinjer, til budsjettplanlegging på foretaksnivå. Helseprioriteringer foregår også utenfor helsesektoren, for eksempel når kommune- og statsbudsjett planlegges. Innføring av nye legemidler i helsetjenesten er altså bare en liten del av et stort system hvor ulike former for prioriteringer skjer hver eneste dag.
Dersom vi bruker ressurser på ett tiltak, kan ikke de samme ressursene brukes en gang til på noe annet. Verdien av det beste alternativet som blir valgt bort, kalles alternativkostnaden. Penger man bruker på kreftlegemidler, kunne også ha blitt brukt på psykosebehandling eller fallforebygging. Det prioriteringssystemet vi har i dag, er lagt opp til å ha alternativkostnaden i fokus for å oppnå mest mulig helse for hver krone.
Prioriteringer innebærer å ikke tilby behandlinger eller tjenester som kan ha en positiv helseeffekt. Dette skiller prioriteringer fra for eksempel behandlingsbegrensninger og reduksjon av tiltak som ikke har påvist helseeffekt, og fra tiltak som kan gjøre tjenesten mer effektiv uten å måtte redusere tilbudet.
2.1 Legitimitet og tillit
For at prosesser for helseprioriteringer skal oppfattes som rettferdige, bør de ha legitimitet, og befolkningen bør kunne ha tillit til at avgjørelsene er gjennomtenkte og bygger på verdiene våre. For de som opplever at deres helsebehov ikke blir prioritert, er det ekstra viktig å vite at dette ikke var en tilfeldig eller skjult beslutningsprosess. Tillit og legitimitet henger sammen. Legitimitet betyr at prosessen har et tilstrekkelig grunnlag i lov, og at avgjørelser som tas, er innenfor den myndigheten som er gitt ved lov. Legitimitet kan også knyttes til at en beslutning eller prosess oppfattes som rettmessig eller rettferdig, gjerne fordi den stemmer med moralske oppfatninger i samfunnet. Tillit innebærer blant annet at de avgjørelsene som tas, oppfattes som godt begrunnet, riktige og rettferdige.
Verdiene legitimitet og tillit refererer til både de prosessene som leder fram til helseprioriteringer, og de konkrete avgjørelsene som treffes. Viktige virkemidler for å fremme disse verdiene er åpenhet og innsyn, sammen med etterprøvbarhet, kunnskap og kompetanse. En prosess som har et tydelig grunnlag i lov og er strukturert, med klare rammer for kompetanse og beslutningsmyndighet og tydelige kriterier for å treffe avgjørelser, vil føre til rettferdige og konsistente avgjørelser. Dette i seg selv fremmer legitimitet og tillit. Åpenhet om slike rammer for prosesser bidrar til at avgjørelser kan etterprøves, og til at samfunnet kan ha tillit til at avgjørelsene er legitime og riktige.
Utviklingen av nye legemidler og behandlinger går stadig raskere. Men også regelverk og prosesser for godkjenning av nye legemidler utvikler seg, noe som betyr at flere legemidler godkjennes raskere for bruk, men på et mindre omfattende dokumentasjonsgrunnlag. Det ligger derfor til rette for at prioriteringsbeslutninger blir hyppigere, tydeligere og mer kompliserte. I den situasjonen er det særlig viktig å ha åpenhet og mekanismer som sikrer legitimitet og tillit til prioriteringsprosessene og beslutningene. Som samfunn må vi kunne håndtere at det er ulike interesser knyttet til disse beslutningene, og at ikke alle vil være enige i alle beslutninger som tas. Åpenhet er et element både i å etablere robuste prosesser for å arbeide praktisk med prioritering på system- og individnivå og i å legge til rette for offentlig debatt om prioritering.
Oppsummert vil åpenhet kunne brukes som middel for å fremme legitimitet og tillit og bidra til rettferdige prioriteringsprosesser. Det er relevant i alle former for prioriteringsbeslutninger – fra statsbudsjett, via planlegging og drift av helseforetak, sykehus og avdelinger, og helt ned til hver enkelt klinisk beslutning om hver enkelt pasient.
2.2 Rettferdige prioriteringsprosesser
Prioritering innebærer både en prosess og et resultat. Rettferdige prioriteringer handler derfor både om en rettferdig prosess og om rettferdige utfall. I Norge brukes tre prioriteringskriterier: nytte, ressursbruk og alvorlighet. Sammen skal kriteriene sikre en effektiv og rettferdig fordeling av helse. Mye av innholdet i de offentlige dokumentene (Meld. St. 38 (2020–2021); Meld. St. 34 (2015–2016); NOU 2014: 12) om prioriteringer og de påfølgende samfunnsdebattene har handlet om kriteriene og hvorvidt de fører til rettferdige resultater. Dette er svært viktig. Likevel faller det i hovedsak utenfor denne ekspertgruppens arbeid. Et annet poeng som er relevant å ta med seg, er at selv om det norske systemet for prioritering har kommet svært langt, også sett i et internasjonalt perspektiv, er det legitime grunner til å være uenig i resultatet av prioriteringene. Selv når kriteriene og prosedyrene for prioritering er velbegrunnede og godt forankret, er det mulig å være uenig i resultatet.
Det er altså en tett sammenheng mellom det at prioriteringer oppfattes som resultat av en rettferdig prosess, og at prosessen har legitimitet og tillit.
2.3 Kriterier for å sikre en rettferdig prosess
I NOU 2014: 12 Åpent og rettferdig – prioriteringer i helsetjenesten (heretter Norheim-utvalget) argumenterte utvalget for mer åpenhet i prioriteringsprosessene. Utvalget pekte på rammeverket som Norman Daniels og James Sabin har utviklet: «Ansvar for rimelige beslutninger» (Accountability for Reasonableness), ofte kalt A4R. Bakgrunnen for rammeverket er at dersom det er enighet om at beslutningsprosessen har vært legitim og rettferdig, så øker sannsynligheten for at beslutningene aksepteres, selv om man er uenig i utfallet (Daniels & Sabin 2008). A4R-rammeverket setter opp konkrete kriterier for at en prioriteringsprosess skal kunne oppfattes som legitim og rettferdig.
Rammeverket legger vekt på fire kriterier for en rettferdig prosess:
- tilgjengelige begrunnelser for prioriteringsbeslutninger
- relevante argumenter
- klageadgang og mulighet for revisjon
- en regulering og institusjonalisering av de tre første kriteriene
Rammeverket har blitt mye gjengitt og brukt i ulike internasjonale organer, som blant annet NICE i England og Prioriteringscentrum i Sverige, og også her i Norge. Samtidig har det også blitt kritisert, blant annet for ikke å vektlegge deltakelse og medbestemmelse nok og for ikke å angi tydelig hvordan kriteriene skal operasjonaliseres.
Med utgangspunkt i tidligere teoretisk arbeid, som A4R, og erfaringer fra ulike prioriteringsprosesser har Verdensbanken presentert en rapport som blant annet gir anbefalinger for å sikre gode prosesser for rettferdige helseprioriteringer (videre omtalt som verdensbankrapporten): Open and Inclusive: Fair Processes for Financing Universal Health Coverage (Verdensbanken 2023). Arbeidet ble ledet av forskere fra Folkehelseinstituttet og professor Ole Frithjof Norheim ved Bergen senter for etikk og prioritering ved Universitetet i Bergen. I rapporten vises det til empiri som bekrefter at en rettferdig prosess styrker legitimiteten til prosessen, bygger tillit, øker oppslutningen og også kan gjøre at beslutningene fører til bedre og mer rettferdige resultater. Dette er noe man bør strebe mot, uten at man går på akkord med lokale systemer, lovverk og andre forhold som har betydning. I praksis må også kravene til en mest mulig rettferdig prosess ofte veies mot andre krav som effektivitet, ressursbruk, hva som er organisatorisk mulig, og så videre.
Rapporten påpeker også at konseptene kan forstås ulikt i ulike land, og at summen av forslag i rapporten ikke må anses som en overordnet universell oppskrift på en rettferdig prosess.
Verdensbankrapporten har som mål å gi overordnede råd for land i ulike faser av prioriteringsarbeid. Basert på omfattende tverrfaglig litteratur, foreslår rapporten prinsipper og kriterier for en rettferdig prosess. Den presenterer tre kjerneprinsipper som danner fundamentet for en rettferdig prosess: likhet, upartiskhet og konsistens over tid. I denne konteksten handler likhet om at alle skal ha like muligheter til å tilegne seg informasjon og uttrykke sine meninger i diskusjoner og beslutninger. Upartiskhet betyr at enkelte parter ikke skal ha urimelig stor innflytelse på beslutningene, mens konsistens over tid betyr at kriteriene og prosedyrene for prioriteringsbeslutningene må være stabile over tid. Til sammen er det rimelig å si at disse tre kjerneprinsippene tilstreber likebehandling: at like tilfeller skal behandles likt, og at det skal være likebehandling over tid. Dette harmoniserer godt med målet til det norske prioriteringssystemet.
På bakgrunn av disse overordnede prinsippene foreslår rapporten sju mer konkrete kriterier som kan bidra til en rettferdig prioriteringsprosess. Ekspertgruppen har oversatt kriteriene og beskrivelsen av dem til norsk i samarbeid med forfatterne av Verdensbankens rapport. Se tabell 2.1. Disse kriteriene må ikke forstås som binære, de er altså ikke enten oppfylte eller helt fraværende. I stedet er de ment å gi rom for å forbedre og utvikle systemet. Et tiltak kan også ha effekt på flere kriterier, noe som vil tydeliggjøres senere i rapporten når ulike tiltak drøftes og foreslås.
Tabell 2.1 Kriterier for en rettferdig prioriteringsprosess
Domene | Kriterium | Kort forklaring |
|---|---|---|
Informasjon og kommunikasjon | Transparens | Informasjon må være tilgjengelig og forståelig, inkludert detaljer om beslutningsprosessen, argumentene i diskusjonen og begrunnelsene for beslutningene som blir fattet. |
Godt kunnskapsgrunnlag | Beslutningene skal være basert på grundig og nyanserte informasjonskilder som omfatter ulike perspektiver, meninger og dokumentasjon. | |
Begrunnelse | Beslutningstakerne må kunne rettferdiggjøre beslutningene til de som er berørt av dem. Det innebærer at uenighet må avklares ut fra at begrunnelser blir utvekslet, lyttet til og akseptert eller avvist av frie og uavhengige personer. | |
Mulighet til å bli hørt | Inkludering | Mekanismer som sikrer at ulike syn og hensyn blir vurdert, må være på plass. Spesiell oppmerksomhet bør vies til å inkludere erfaringene og perspektivene til grupper som vanligvis ikke deltar i det offentlige ordskiftet eller beslutningstaking. Dette gjelder også i de tilfellene hvor de berørte partene ikke kan delta direkte. |
Medvirkning | Medlemmer av befolkningen må få mulighet til å få tilgang på informasjon, uttrykke meningene sine og aktivt engasjere seg i beslutningsprosessen. | |
Oversikt og kontroll | Revurdering | Dersom det tilkommer ny informasjon, som ny kunnskap eller ny forståelse av den aktuelle problemstillingen, kan en revurdering av beslutningen være nødvendig. Det må derfor være mekanismer som gir muligheter for de som er uenig i beslutningen, til å utfordre den opprinnelige beslutningen, og som oppfordrer beslutningstakerne til å svare på ny informasjon og vurdere om den opprinnelige beslutningen bør endres. |
Oppsyn | Det må være lover, reguleringer og oppsynsmekanismer som sikrer at kriteriene for en rettferdig prosess er ivaretatt, og at prioriteringsbeslutningen faktisk blir implementert. |
Kilde: Verdensbanken (arbeidet ledet av forskere fra Folkehelseinstituttet og Bergen senter for etikk og prioritering ved Universitetet i Bergen).
Ekspertgruppen tar utgangspunkt i disse kriteriene når den vurderer dagens praksis og mulige tiltak. Ekspertgruppen har i hovedsak vurdert praksis og tiltak knyttet til prioriteringsprosessene for Nye metoder. Se figur 2.1 for fremstilling av overordnet prosessflyt, nærmere beskrivelse kommer i kapittel 4. Hensikten er å få fram tiltak som i sterkere grad enn dagens praksis ivaretar kriteriene og kan medvirke til større tillit og legitimitet til prioriteringsprosessene. Hvordan dette blir gjort, beskrives og drøftes underveis i rapportens del III og IV.

Figur 2.1 Overordnet prosessflyt for nye legemidler og indikasjoner
Kilde: Tilpasset av ekspertgruppen basert på prosesskart på nyemetoder.no.
3 Pris, prisdannelse og konfidensielle priser og betalingsvilje
Ekspertgruppen skal i henhold til mandatet vurdere problemstillinger knyttet til åpenhet om priser og prisdannelse, herunder oversikt over utviklingskostnader. Ekspertgruppen er videre bedt om å se hen til initiativer for internasjonalt samarbeid. Dette er beskrevet i kapittel 7. I dette kapittelet beskrives praksisen rundt prisinformasjon, prisdannelse og betalingsvilje.
3.1 Åpenhet om priser
3.1.1 Historisk utvikling
Fram til 2016 var prisene som legemiddelselskapene tilbød, i hovedsak offentlig tilgjengelige. Det var mulig å be om konfidensialitet for nye patenterte legemidler (i bytte mot høyere rabatter) også i denne perioden, men dette var ikke hovedregelen. I mars 2016 varslet de regionale helseforetakene (RHF) etter en gjennomgang av egne rutiner at enhetspriser på legemidler var å regne som forretningshemmeligheter på lik linje med andre anskaffelser og dermed måtte unntas offentlighet. Den endrede regelforståelsen medførte en overgang til en ny praksis hvor prisene som tilbys i anbudskonkurransene, er konfidensielle.
Endringen fra åpne priser til mer bruk av konfidensielle priser har vært drøftet ved flere anledninger, blant annet i høringsrunden til de regionale helseforetakene, i enhetsprisrapporten, prioriteringsmeldingen og i forbindelse med lovendringen om samtidige rabatter under folketrygden (Arbeidsgruppe for enhetspriser 2018). Diskusjonene konkluderer med at full åpenhet er å foretrekke, men at fordelene ved å tillate konfidensielle rabatter kan være større enn ulempene.
Figur 3.1 viser utviklingen i maksimalpriser og rabattnivå for sykehusfinansierte legemidler fra 2012 til 2022. Samlet rabatt for legemidler finansiert av helseforetakene økte fra 17 prosent i 2012 til 25 prosent i 2016. Etter at enhetsprisene ble konfidensielle, har samlet rabatt økt fra 29 prosent i 2017 til over 50 % i 2023. Mange nye legemidler kommer med svært høy maksimalpris, og det trengs betydelige rabatter for å kunne ta legemiddelet i bruk. I alle forhandlingene krever leverandørene at de rabatterte enhetsprisene er konfidensielle. Enhetsprisene og prismodellen ved bruk av alternative avtaler ses på som forretningshemmeligheter.
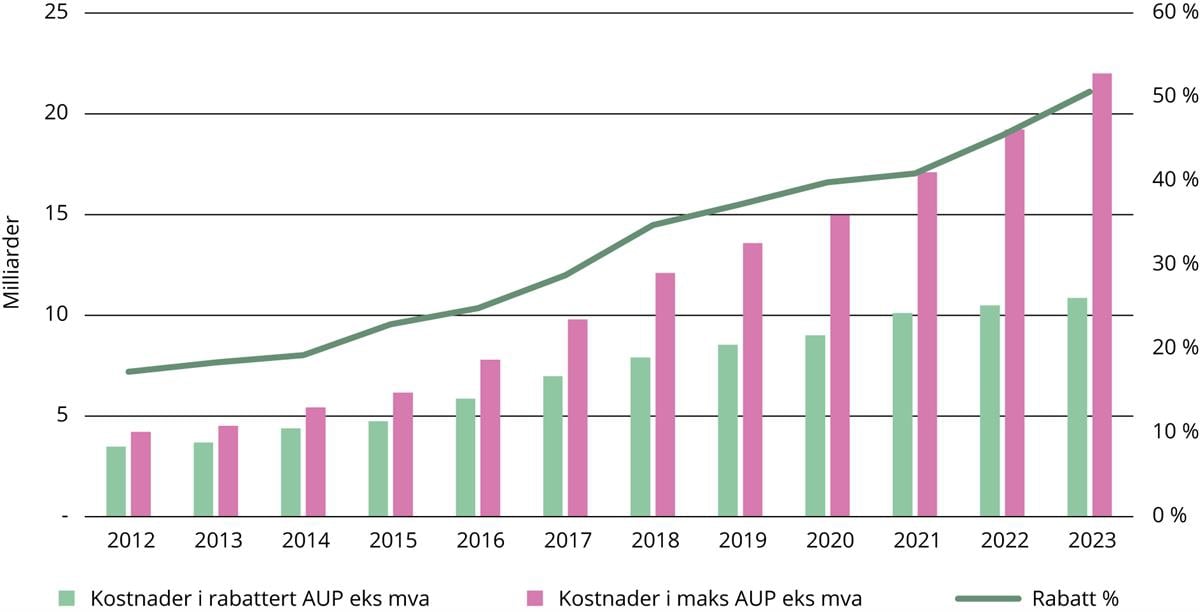
Figur 3.1 Utvikling i maksimalpriser og rabattnivå for sykehusfinansierte legemidler
Kilde: Sykehusinnkjøp HF.
3.1.2 Sykehusfinansierte legemidler
Anskaffelse av nye legemidler der helseforetakene har finansieringsansvaret, foregår i to trinn. Første trinn er forhandling på metodevurderingsstadiet og beslutning om finansiering i Beslutningsforum. Det er dette trinnet som er mest sentralt for denne rapporten fordi det er her det tas beslutninger om tilgang basert på konfidensiell informasjon. Neste trinn er anskaffelse som del av anbudskonkurranse blant allerede innførte legemidler.
I dag praktiseres åpenhet rundt prisinformasjon ulikt avhengig av legemiddelets plassering i livssyklusen. Figuren nedenfor framstiller legemiddelet i ulike faser. Det er et viktig skille mellom fase 1–3 og 4–6.
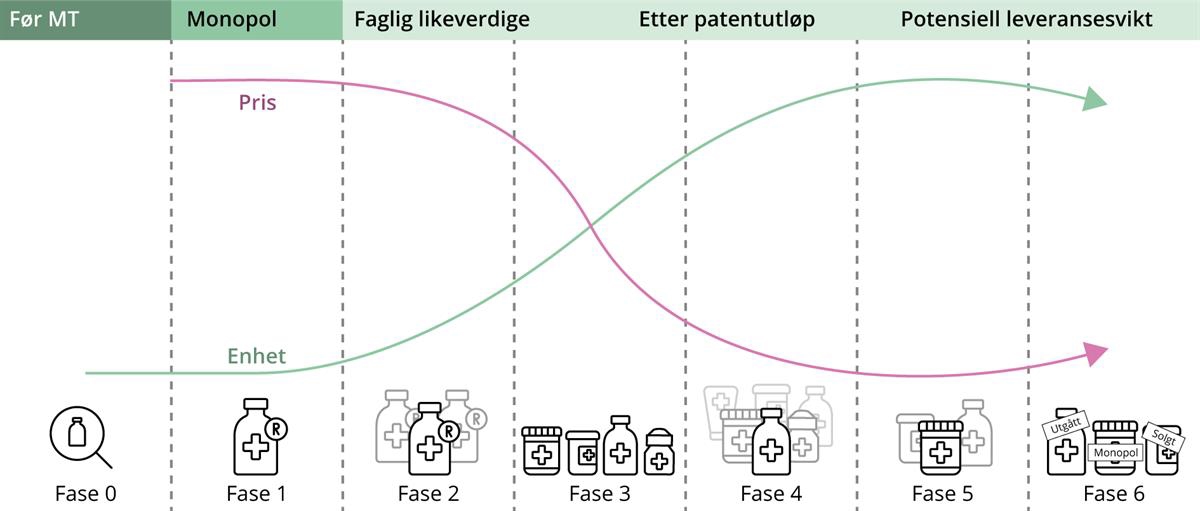
Figur 3.2 Legemiddelets livssyklus
Kilde: Sykehusinnkjøp HF.
I fase 1–3 blir et nytt, patentert legemiddel innført. Dagens praksis legger til grunn at konfidensielle priser framforhandlet av Nye metoder samt tilbud til anskaffelsene fører til at leverandørene tilbyr større rabatter, som reduserer kostnader for samfunnet. I denne fasen er leverandørene svært opptatt av å beskytte sine konfidensielle priser. Fase 4–6 handler om å sikre tilgangen til legemidlene med hensyn til både pasientsikkerheten og forsyningssikkerheten. Sykehusinnkjøp tilrettelegger i denne fasen for at leverandørene blir i det norske markedet, og opprettholder markedsføringstillatelser på virkestoff med etablert generisk eller biotilsvarende konkurranse.
Nye legemidler og indikasjoner – forhandling og alternative avtaler
Når nye legemidler skal opp til beslutning for innføring i Beslutningsforum, forhandler Sykehusinnkjøp lavere pris dersom prioriteringskriteriene ikke var oppfylt. Når Sykehusinnkjøp forhandler med leverandøren, er et av målene å ha en effektiv prosess for å oppnå kostnadseffektiv pris. Det innebærer at leverandørene får veiledning om hvilket nivå prisene bør ligge på for at legemidlene skal bli innført i Beslutningsforum. Rabattert pris er konfidensiell, og svært få har innsikt i enhetsprisen på legemiddelet ettersom alle dokumenter som er en del av beslutningsgrunnlaget til Beslutningsforum, sladdes for forretningshemmelig informasjon. I noen tilfeller inngås en alternativ avtale for å sikre tilgang med individuelt forhandlede vilkår. Det gjelder tilfeller der flat rabatt ikke er tilstrekkelig.
Legemidler inngår i anbud (fase 1–3)
Når et legemiddel inngår i anbud (fase 1–3), behandles prisene som konfidensielle fra oppstart av konkurransen og gjennom hele avtaleperioden.
Sykehusinnkjøp har ansvaret for nasjonale anskaffelser av legemidler til de offentlige sykehus i Norge. Det norske markedet kan dermed betegnes som en kjøper.
I økonomifaget kalles dette for monopsoni og medfører kjøpermakt på etterspørselssiden. På tilbudssiden er det en rekke leverandører, men både patentsystemet og de høye etableringskostnadene gjør at det kan være begrenset konkurranse på mange diagnoseområder. Vinneren i en anbudskonkurranse får ikke en eksklusiv rett, men blir foretrukken leverandør innenfor et terapiområde, noe som medfører at sykehuslegene må forskrive dette legemiddelet til pasienter med mindre det foreligger medisinske grunner for å avvike. Den forventede markedsandelen vil imidlertid påvirke leverandørenes pristilbud.
Et særtrekk ved offentlige anskaffelser av legemidler er kravet om at prisen på et produkt skal være lik på tvers av terapiområder. Mange legemidler er godkjent for flere indikasjoner og deltar derfor i ulike anbudskonkurranser eller andre anskaffelser, hvor konkurransesituasjon, helseeffekt og markedsstørrelsen kan variere stort. Sykehusinnkjøp organiserer separate anbudskonkurranser innenfor et terapiområde, men krever at leverandørene må ta en lik pris på tvers av alle anbudskonkurransene. En leverandør med et legemiddel som er godkjent for mange indikasjoner, må dermed balansere prisingen på tvers av de ulike terapiområdene, og en prisreduksjon vil medføre et margintap innenfor mange markeder. Det kan svekke konkurransen sammenlignet med en situasjon hvor det var mulig å tilby ulike priser i ulike markeder.
Opprettholde deltakelse ved generisk konkurranse (fase 4–6)
I fase 4–6 har vedvarende priskonkurranse ført til at prisene har falt og flere leverandører ikke lenger deltar i anskaffelsene. Resultatet blir færre tilbud i anskaffelser, noe som øker risikoen for svekket forsyningssikkerhet til Norge. Et virkemiddel for å unngå dette er en mer åpen tilnærming til prisinformasjon som gis i anbudskonkurranse for legemidler i fase 4–6. Å synliggjøre prisene kan bidra til å opprettholde konkurransen på disse legemidlene fordi det gir leverandørene forutsigbarhet. Derfor har Sykehusinnkjøp HF de siste årene lagt inn i konkurransegrunnlaget til flere anskaffelser for legemidler i livssyklusfase 5 og 6 at prisene kan deles når gjeldende avtaleperiode utløper. Offentliggjøring av prisene til leverandørene vil tidligst skje 24 måneder etter tilbudsfrist i forbindelse med planlegging av ny anbudskonkurranse. Etter medgått tid i denne markedsituasjonen vurderes altså enhetsprisen ikke lenger å være av konkurransemessig betydning, og dermed er det ikke plikt til å holde den hemmelig etter reglene i lov 10. februar 1967 nr. 10 om behandlingsmåten i forvaltningssaker (forvaltningsloven) § 13 første ledd og lov 19. mai 2006 nr. 16 om rett til innsyn i dokument i offentleg verksemd (offentleglova) § 13 første ledd.
Hvilke priser er unntatt offentligheten?
Konfidensielle priser kan gjøres kjent for de som har tjenstlig behov, men forutsetter taushetsplikt, jf. blant annet forvaltningsloven § 13 b nummer 2. Tabell 3.1 viser ulike priser og hvem som har tilgang til prisinformasjon. Hvordan prisene reguleres i Norge, er nærmere beskrevet i kapittel 3.2.1. Maksimal AUP er den maksimale utsalgsprisen fra apoteket etter listeprisen som er offentlig tilgjengelig. Maksimal AIP er den høyeste prisen apotekene kan kjøpe legemiddelet inn for. Folketrygd AIP er prisen for inngåtte refusjonsavtaler på folketrygdens område. Beslutningsforum AUP (BF-AUP) er utsalgsprisen basert på tilbud og er prisen som må innfris for at Beslutningsforum skal godta den. BF-AUP er den maksimale betalingsvillighetsprisen i spesialisthelsetjenesten og er som regel konfidensiell fordi det er gitt rabatt. Et legemiddel kan ha blitt innført basert på flere ulike BF-AUP-er på ulike indikasjoner. Imidlertid er det den laveste BF-AUP-en som fungerer som ny maksimalpris, og det kan kun være én gjeldende konfidensiell pris i selve anskaffelsen på tvers av alle indikasjoner.
Tabell 3.1 Priser og tilgang til prisinformasjon
Pris | Konfidensialitet | Hvem kjenner prisen |
|---|---|---|
Maksimal AUP | offentlig | alle |
Beslutningsforum AUP | konfidensiell | Sykehusinnkjøp HF, DMP, Helfo, HF, Nye metoder, grossister, apotek, |
Folketrygd AIP | konfidensiell | Sykehusinnkjøp HF, DMP, Helsedirektoratet, leverandør |
Kilde: Ekspertgruppen.
Det er viktig at prisinformasjonen er lett tilgjengelig for ansatte som har et tjenstlig behov. At de har kunnskap om prisen, bidrar til at avtalene etterleves bedre. Prisinformasjonen må håndteres på en riktig måte.
De administrerende direktørene i RHF-ene har gitt sin tilslutning til følgende prinsipper for håndtering av enhetspriser for legemidler:
- Helseforetakene plikter å sikre at alle grupper av ansatte som har tjenstlig behov har tilgang til informasjon om legemidler. Informasjonen skal være lett tilgjengelig.
- Det er arbeidsgivers ansvar å avgjøre hvilke grupper ansatte som har tjenstlig behov og som dermed skal ha tilgang. Det er påkrevd at de som har tjenstlig behov behandler enhetsprisene konfidensielt i henhold til gjeldende lovverk.
- Helsepersonell og annet personell med tjenstlig behov kan bare gi informasjon om enhetspriser til andre ansatte med tjenstlig behov.
- Helsepersonellet kan opplyse pasienter om omtrentlig størrelsesorden på prisforskjeller mellom ulike behandlingsmetoder. Dog må ikke konkrete enhetspriser eller prisforskjeller angis. Dette for å sikre at en ikke kommer i konflikt med taushetsplikten. (Helsedirektoratet 2018b)
Det finnes ikke noen konkrete estimater på hvor mange som har tjenstlig behov. Enhetsprisrapporten henviste til 100 000 personer i spesialisthelsetjenesten. I tillegg kommer ansatte på apotekene, på sykehusapotekene, hos legemiddelgrossister, i Folkehelseinstituttet, i Direktoratet for medisinske produkter, i Helsedirektoratet og i Helfo. Siden det er ulike innsynsregler i de enkelte helseforetakene og hver kliniker har behov for å vite kun et fåtall priser, er antallet som kjenner den enkelte prisen, langt lavere enn estimatet på 100 000. Det har vært noen tilfeller hvor konfidensielle priser har blitt tilgjengelig ved uhell, med mye mediedekning og rettssak. Med bakgrunn i disse tilfellene og det store antallet som har tjenstlig behov for å kjenne konfidensielle priser, er det gjort rutineendringer i hvordan priser distribueres til helseforetakene, for å sikre at prisene holdes konfidensielle.
3.1.3 Folketrygdfinansierte legemidler
Fram til 1. januar 2017 var det ikke mulig å forhandle fram konfidensielle priser på blåreseptlegemidler. Dersom en leverandør tilbød en lavere pris enn maksimal utsalgspris, ble dette den nye offentlige maksimalprisen. Dette medførte i noen tilfeller at leverandører ikke ville senke prisen til kostnadseffektivt nivå. Stortinget vedtok høsten 2016 endring i lov 4. desember 1992 nr. 132 om legemidler mv. (legemiddelloven) § 6 sjette ledd for å åpne opp for etterskuddsvise rabatter. Med etterskuddsvise rabatter menes det at rabatten forhandles på apotekenes innkjøpspris, men at legemiddelet selges fra apotekene til maksimal utsalgspris. Deretter faktureres leverandøren for differansen. Etter at endringen trådte i kraft, ble det inngått refusjonsavtaler med konfidensiell pris for kolesterolsenkende legemidler og for migrenelegemidler. Anbudspiloten for kolesterolsenkende legemidler legger også til grunn at prisen er konfidensiell. Den konfidensielle prisen vises ikke i rekvirentenes systemer ettersom nåværende oppgjørsordning innebærer at det betales tilbake i etterkant. Alle legemidler med konfidensiell pris har spesialistrekvirering, og informasjon om eventuell behandlingsrekkefølge formidles gjennom refusjonsvilkår. Direktoratet for medisinske produkter har fått i oppdrag å utarbeide en permanent oppgjørsløsning som kan håndtere konfidensielle priser.
3.1.4 Medisinsk utstyr
Medisinsk utstyr og andre metoder kan gå gjennom Nye metoder på lik linje med legemidler. Det er et begrenset utvalg metoder som gjennomgår denne prosessen i dag, men det er kommunisert at systemet for medisinsk utstyr skal forbedres. Prosedyrene for å innføre nytt medisinsk utstyr er ikke like etablert som for legemidler. Bransjen er heller ikke like organisert og regulert som legemiddelbransjen. Medisinsk utstyr kan anskaffes lokalt, regionalt eller nasjonalt. Det er heller ikke automatikk i at utstyret blir en del av tilbudet på hvert enkelt sykehus, selv om det er besluttet innført i Beslutningsforum. Enhetspriser brukes i forbindelse med evaluering når tilbud fra ulike leverandører skal sammenlignes, og avtalepriser ligger tilgjengelig i innkjøpssystemene til helseforetakene, men er ikke offentlig tilgjengelig.
Erfaringen er at hemmelighold av pris på medisinsk utstyr ikke utløser like mye debatt, behov for innsyn og etterprøving av beslutninger. Det kan være flere grunner til dette. Beslutninger rundt medisinsk utstyr har tradisjonelt ikke vært gjenstand for like grundige vurderinger og nasjonale beslutninger som legemidler. Det er også mindre offentlig kommunikasjon om disse prosessene på systemnivå. På klinisk nivå oppstår relevante valgsituasjoner som regel sjeldnere og krever sjelden at pasienten må «bytte behandling».
En annen viktig årsak er at leverandørene av medisinsk utstyr sjelden har patent og dermed monopol på en gitt type utstyr eller utstyrsfunksjonalitet. Dermed har utstyr heller ikke den samme prisutviklingen som patenterte legemidler som kun leveres av en monopolist. I motsetning til den sprangvise utviklingen man ser på legemiddelområdet, der det kommer genuint nye virkestoffer som kan ha en lang levetid, er utviklingen av medisinsk utstyr preget av gradvise forbedringer og oppgraderinger. Dermed er det vanskelig å si når en metode er ny og bør metodevurderes.
3.2 Utviklingskostnader og prisdannelse
Problemstillinger som gjelder åpenhet om utviklingskostnader og prisdannelse, er en del av ekspertgruppens mandat.
3.2.1 Prisdannelse
Dette delkapittelet beskriver ulike momenter og virkemidler som påvirker prisdannelse av legemidler.
Leverandøren fastsetter pris og lanseringsstrategi
Legemiddelselskaper er vanligvis internasjonale børsnoterte selskaper. Målet om å maksimere fortjenesten for selskapet og for selskapets eiere er sentralt for virksomheten. Prisen settes ikke etter et prinsipp om kostnadsdekning for utvikling og produksjon, supplert med en fortjenestemargin, men etter hva som er den maksimale prisen man kan oppnå i de ulike markedene. Når et selskap har monopol på et virkestoff eller et behandlingsprinsipp som er det eneste eller det klart beste ved en gitt alvorlig sykdom, gir dette selskapet mulighet for stor fortjeneste. Kun kjøpernes betalingsvilje vil kunne begrense prissettingen.
Leverandørene i hvert enkelt land følger morselskapets internasjonale prisstrategi. Prisstrategien henger tydelig sammen med det enkelte landets betalingsvilje og går blant annet ut på å kartlegge legemiddelets bruksområde, effekt, markedssituasjon, nyhetsgrad, størrelse på pasientgruppe, alvorlighet, og forventet kostnadseffektivitet. Leverandørene gjennomfører også prispaneler og spørreundersøkelser blant framtredende leger og betalingsinstitusjoner. Dette resulterer i en prisliste som definerer for hvert enkelt land: maksimalpris, ønsket konfidensiell pris, lavest akseptabel åpen pris og lavest akseptabel konfidensiell pris. Hvilken pris legemiddelet til slutt får, avhenger av det enkelte landets system for innføring av nye legemidler, markedsstørrelse og mekanismer for prisregulering og prisforhandling.
Leverandøren posisjonerer seg strategisk globalt
Leverandøren utarbeider en lanseringsstrategi som henger sammen med prisstrategien, hvor formålet er å oppnå høyest mulig fortjeneste og høyest mulig pris i de største og viktigste markedene. Dette gjøres ved å lansere legemiddelet i en planlagt rekkefølge mellom de ulike landene. Legemidlene lanseres ofte først i land med liberal prissetting. Leverandøren tar også hensyn til hvilke land som er et referanseland for andre lands fastsettelse av maksimalpris.
Slik tar leverandørene høyde for både internasjonal referanseprising mellom land og en forventning om rabattkrav. De følger kontinuerlig med på prisendringer og tilstreber størst mulig koordinering av prisendringer mellom land. I noen tilfeller kan leverandøren velge å tape et marked til fordel for et annet. Det betyr at det kan være mer lønnsomt samlet sett å ikke få tilgang i et land med lavt prisnivå fordi konsekvensen i et annet land vil bli for stort. Lanseringsstrategien til leverandørene påvirker dermed når pasienter i ulike land kan forvente å få tilgang til legemiddelet.
Leverandørens lanseringsstrategier kan stå i konflikt med landenes legemiddelpolitiske målsetting om raskest mulig tilgang til lavest mulig pris hvor prioriteringskriteriene er oppfylt. Denne konflikten er vanskelig for myndighetene å håndtere ettersom de ikke kan påvirke leverandørens lanserings- og prisstrategi.
Prisregulering i Norge
Prisfastsettelse av legemidler er regulert i forskrift 18. desember 2009 nr. 1839 om legemidler til mennesker (legemiddelforskriften) kapittel 12 og 14. Det fastsettes maksimalpriser for reseptpliktige legemidler til mennesker med markedsføringstillatelse. Priser for reseptfrie legemidler og for legemidler til dyr fastsettes ikke av myndighetene og kan dermed settes fritt av aktørene. Direktoratet for medisinske produkter fastsetter legemidlers maksimale innkjøpspris til apotek og fra apotek. Ved fastsettelse av prisen tar direktoratet utgangspunkt i referansepriser på legemiddelet i Sverige, Danmark, Finland, Storbritannia, Irland, Tyskland, Østerrike, Belgia og Nederland. Prisen fastsettes ved å beregne gjennomsnittet av de tre laveste offentlige prisene. Prisen rapporteres inn av leverandørene selv og er i tillegg som regel tilgjengelige prisdatabasen EURIPID.
Maksimale utsalgspriser offentliggjøres hver måned på direktoratets hjemmeside og leveres til internasjonal prisdatabase EURIPID slik at myndigheter i andre land enkelt kan få tilgang til prisene. Norge brukes som referanseland for prisfastsettelse i flere land, blant annet Danmark, Nederland og Canada.
Unntaket fra ovennevnte regel for prisfastsettelse gjøres i praksis dersom prisnivået tilsier at det er reell fare for at legemiddelet ikke lenger blir tilgjengelig på markedet. I slike situasjoner kan det fastsettes en høyere maksimalpris hvor det tas hensyn til dokumenterte produksjonskostnader.
Når et legemiddel finansiert av folketrygden eller pasienten selv får konkurranse fra generiske eller biotilsvarende legemidler, sikrer regelverket gjennom trinnvise priskutt at prisnedgangen som følger av konkurransen, også kommer kjøperen til gode, jf. legemiddelforskriften kapittel 12. Fastsatte trinnpriser er offentlig tilgjengelig.
3.2.2 Sammenheng mellom pris og leverandørkostnader
Prisnivået for nye legemidler oppfattes ofte som urimelig høyt. Ofte begrunner leverandøren høye legemiddelpriser med kostnader til FoU, men de reelle kostnadene til FoU for et legemiddel er ikke offentlig kjent. Videre skiller vi mellom kostnadene som går til produksjon av legemidlene, og kostnadene forbundet med å utvikle legemidlene.
Sammenhengen mellom produksjons- og distribusjonskostnader og pris
Produksjons- og distribusjonskostnader er avhengig av produsert volum og effektiv produksjon. Produksjonskostnader varierer og er blant annet avhengig av om det er et kjemisk eller biologisk produsert legemiddel. Kostnaden for å produsere kjemiske legemidler er noe avhengig av hvor stort og komplekst virkestoffet som produseres, er. Når produktet ikke lenger har patent, kan det produseres generisk. Erfaring fra Sykehusinnkjøp er at generiske legemidler har vært tilbudt med svært høy rabatt, noen ganger på omtrent 98 prosent av maksimalprisen på originalproduktet. Det må antas at prisen normalt likevel dekker produksjons- og distribusjonskostnadene for generikaprodusenten, da produsenten ellers vil lide et tap på kontrakten.
Biologiske legemidler inneholder virkestoff som er framstilt av levende organismer, og er nå en veletablert og rutinepreget produksjon. Små molekyler, som i insulin, kan produseres av sopp eller E. coli-bakterier, som er en hurtig og rimelig prosess. Store molekyler, som i monoklonale antistoffer, krever mer utviklede cellekulturer til produksjon. Det er en lengre og noe mer kostbar prosess. Dette beskrives noen ganger i mediene og fra legemiddelindustrien som grunnlag for høy pris.
Når patentet utløper, kan produsenter av biotilsvarende legemidler tilby konkurrerende legemidler. Biotilsvarende store molekyler har vært tilbudt med rundt 90 prosent rabatt fra maksimalpris på originalproduktet (Hovland 2021). Rabattstørrelsen for småmolekylære biotilsvarende er på over 90 prosent. Med så store rabatter er det rimelig å konkludere med at prisen på legemidlene ikke fastsettes kun ut fra produksjonskostnadene.
Sammenhengen mellom forsknings- og utviklingskostnader og pris
Oslo Medicines Initiative (OMI) har undersøkt graden av transparens om legemiddelkostnader på tvers av 48 land (Vogler 2022). Kostnader for forskning og utvikling (FoU) var ikke offentlig tilgjengelig i noen av landene.
Legemiddelindustrien bruker ofte FoU-kostnader som et argument for egen prisfastsettelse:
Prisen på legemidler henger sammen med at legemiddelindustrien er en bransje som investerer store beløp i forskning og har høy risiko for å mislykkes. (LMI 2023)
Det er lite kjent hvilke kostnader legemiddelselskapene har i forbindelse med utvikling og produksjon av et legemiddel, og det er lite åpenhet om sammenhengen mellom konkrete utviklings- og produksjonskostnader og fastsettelsen av prisen for legemiddelet. Dette medfører en informasjonsasymmetri mellom leverandør, brukere og myndigheter. Brukerne har verken innsyn i eller innflytelse på disse prosessene.
FoU-kostnader er faste kostnader som ikke står i direkte sammenheng med produksjonskostnadene eller det produserte volumet av legemiddelet. FoU-kostnadene er heller ikke alltid spesifikke for ett enkelt legemiddel, men omfatter også kostnader forbundet med legemiddelutvikling som ikke når markedet. LMI sier følgende om FoU:
Nye medisinske gjennombrudd krever nå mer avansert forskning enn tidligere og er ofte rettet mot en mindre pasientgruppe. Dersom utviklingskostnadene for nye legemidler skal fordeles på færre pasienter enn før, blir også prisen per pasient høyere. Det er viktig å huske at inntektene fra et nytt legemiddel ikke kun skal dekke utgiftene for å utvikle dette legemiddelet alene, men at inntektene også skal dekke all forskningen på prosjekter som ikke får suksess. (LMI 2023)
Flere har prøvd å undersøke om høye legemiddelkostnader er relatert til utviklingskostnader, uten å finne en slik sammenheng. En studie som forsøker å beregne et valid estimat på FoU-kostnadene ved utvikling av nye legemidler, er DiMasi mfl. (2016). Styrken til denne studien er at man gjør et tilfeldig uttrekk fra et representativt utvalg av legemidler og legemiddelselskaper og basert på dette benytter regnskapsdata fra de enkelte selskapene til å estimere størrelsen på FoU-kostnadene. Andre studier har fokusert på et selektert utvalg av legemidler (eksempelvis kreftlegemidler) og legemiddelselskaper (eksempelvis mindre bioteknologiselskaper) og da gjerne benyttet offentlige kilder for å estimere selskapenes utviklingskostnader.
Tay-Teo mfl. (2019) har gjort funn som indikerer at fortjenesten fra kreftlegemidler er langt over FoU-kostnadene. Wouters mfl. (2022) har undersøkt sammenhengen mellom FoU-kostnader og behandlingskostnad for nye legemidler som ble godkjent i perioden 2009 til 2018. De fant ingen sammenheng mellom hva legemiddelselskaper brukte på FoU, og hvilken pris de beregnet for nye legemidler. De fant heller ingen sammenheng mellom pris og terapeutisk verdi. Tay-Teo mfl. (2019) viser også til flere som har beskrevet hvordan selskaper i etterkant reduserer sin egen risiko i markedet (de-risking) ved å fokusere på duplisering og marginale indikasjonsutvidelser med en forventning om at markedet vil opprettholde det høye prisnivået uavhengig av innovasjonsgraden. Tay Teo mfl. (2019) konkluderer med at slik aktivitet kan forhindre meningsfull innovasjon.
Industriens påstand om at høye legemiddelpriser er nødvendige for å opprettholde verdifull medisinsk innovasjon, ble drøftet av Angelis mfl. (2023) Artikkelen bygger delvis på data fra Wouters mfl. (2022) og ender opp med de samme konklusjonene: Det er ikke sammenheng mellom pengene brukt på forskning og utvikling og prisen på legemidlene, og det er heller ikke sammenheng mellom legemidlenes pris og terapeutiske verdi.
Begrunnelsen om at høye legemiddelpriser dekker kostnadene til FoU, tar heller ikke hensyn til store offentlige investeringer i oppdagelse og utvikling av legemidler. Artikkelen til Angelis tar opp dette og ser også at utviklingen går mot at stadig færre nye legemidler forskes fram av legemiddelindustrien selv. I stedet skjer forskning i offentlige og private institusjoner som ikke arbeider for økonomisk vinning, som for eksempel sykehus og universiteter. Lovende produkter kjøpes så opp av legemiddelselskaper. Når myndighetene senere kjøper det ferdig utviklede legemiddelet, har de allerede bidratt økonomisk til utviklingen. Det har vært argumentert for at det bør være større åpenhet rundt disse forsknings- og utviklingskostnadene, hvem som har gjort grunnforskningen, og hvordan finansieringen og prisfastsettelsen har vært.
Direktør i DMP Audun Hågå sa det samme i intervju publisert i Dagens Medisin 27. oktober 2023:
Prisen på patenterte legemidler reflekterer ikke kostnader til utvikling, produksjon og distribusjon. Ulikhet i pris mellom ulike land er særlig knyttet til betalingsevne og vilje i de ulike markedene.
3.3 Betalingsvilje
Ekspertgruppen skal i tråd med mandatet vurdere problemstillinger ved økt åpenhet om norske myndigheters betalingsvilje i prioriteringsbeslutninger. Åpenhet om myndighetenes betalingsvilje for legemidler kan bestå av to deler. Den første er myndighetenes betalingsvilje i hver enkeltbeslutning om å ta i bruk et nytt legemiddel eller ikke. Den andre er om myndighetene skal operere med eksplisitte, offentlig tilgjengelige grenseverdier for myndighetenes betalingsvilje.
Det er i dag ikke offentlig kjent hva myndighetenes faktiske betalingsvilje er. Dette er en direkte konsekvens av konfidensielle priser, som gjør at den inkrementelle kostnadseffektivitetsratioen (IKER) er konfidensiell, og dermed at betalingsviljen er konfidensiell. Det vil si at klinikere og pasienter ikke har innsyn i hvilken IKER myndighetene beslutter ja eller nei om, og de har derfor begrenset informasjon om myndighetenes beslutninger og ressursbruk. Industrien erfarer likevel over tid omtrent hva den faktiske betalingsviljen er.
Boks 3.1 IKER
Inkrementell kostnadseffektivitetsratio (IKER) er en brøk som beskriver legemiddelets kostnadseffektivitet som framkommer i metodevurderingen, og kalkuleres som differansen i kostnader mellom ny og gammel behandling dividert med differansen i effekt mellom behandlingene. Effekten måles som kvalitetsjusterte leveår.
Sammenhengen mellom prioriteringskriteriene og alternativkostnaden setter føringer for myndighetenes betalingsvilje. I Meld St. 34 (2015–2016) skisseres beslutningsregelen slik:
Prioriteringskriteriene skal vurderes samlet og veies mot hverandre. Jo mer alvorlig en tilstand er eller jo større nytte et tiltak har, jo høyere ressursbruk kan aksepteres. Lav alvorlighet og begrenset nytte av et tiltak kan bare forsvares hvis ressursbruken er lav. (Meld. St. 34 (2015–2016), 127)
Videre følger det at IKER skal vurderes opp mot tiltakets alternativkostnad. Alternativkostnaden sier noe om nytten vi kunne fått ved å bruke de samme ressursene på et annet tiltak, altså det tiltaket som blir fortrengt dersom vi innfører den nye metoden. Hvis et tiltaks IKER er høyere enn alternativkostnaden, er det høy risiko for at helsetjenesten mister mer nytte enn vi får fra det nye tiltaket.
Norheim-utvalgets og Magnussen-gruppens anslag på alternativkostnad legges til grunn for prioriteringsbeslutninger på gruppenivå, det vil si 275 000 kroner per gode leveår (definert som kvalitetsjustert leveår (QALY)). Norheim-utvalgets og Magnussen-gruppens anslag er basert på arbeider fra England av Claxton mfl. (2013), som utarbeidet et estimat på alternativkostnaden for den offentlige helsetjenesten i England (NHS). Claxtons estimat på alternativkostnad er basert på omfattende forskning samt store mengder data og er et resultat av en rekke variabler, blant annet NHS-kostnader, budsjettkonsekvenser, priser og endringer i dødelighet og livskvalitet som følge av helsetiltak (effektiviteten av helsetiltak). Ettersom et slikt arbeid vil kreve store mengder empiri og data over kostnadene og produktiviteten i helsetjenesten som ikke er tilgjengelig i Norge, har man valgt å basere seg på modellen fra England.
IKER skal vektes med alvorlighetsgraden og sier da noe om hvor mye mer vi er villige til å betale for å behandle pasienter med mer alvorlige helsetilstander. Denne vektingen medfører at Norge har et større spenn for betalingsvilje enn England, ettersom de ikke praktiserer en slik vekting av alvorlighetsgrad på samme måte som Norge. Vektingen er en skjønnsmessig vurdering som må gjøres for hvert enkelt legemiddel som vurderes innført. Det er ingen automatikk i beslutningene. Disse er omtalt i boks 3.2.
I tillegg til at den faktiske betalingsviljen i hver enkelt sak ikke er offentlig kjent, er det heller ikke offentlig kjent hva myndighetene er villige til å betale for et godt leveår. I prioriteringsmeldingen (Meld. St. 34 (2015–2016)) ble det gjort en vurdering av om Norge skulle operere med eksplisitte øvre grenser for innføring av nye metoder. Norheim-utvalget og Magnussen-gruppen hadde foreslått eksplisitte grenser. I prioriteringsmeldingen beskrives tre grunner til at eksplisitte grenser ikke burde fastsettes:
- Metodevurdering medfører ikke beslutningsautomatikk. Skjønnsmessig vurdering som kvalitet og usikkerhet ved dokumentasjon og samlede budsjettkonsekvenser skal inngå i en totalvurdering.
- Eksplisitte grenser kan stimulere til uheldige prisstrategier fra industrien, med referanse til England.
- Det vil være krevende å fastsette prinsipper for prioritering, totale budsjettrammer fastsatt av Stortinget og eksplisitte kostnadsgrenser som ikke kommer i konflikt med hverandre.
Prioriteringsmeldingen la føringer om at det ville bli opp til Beslutningsforum og Statens legemiddelverk å danne seg en felles oppfatning av alternativkostnad og vektingen av alvorlighetsgrad. Denne felles oppfatningen er ikke offentlig kjent. Stortinget har sluttet seg til anbefalingene gitt i meldingen (Innst. 57 S (2016–2017)). Stortingets vedtak er førende for dagens praksis innenfor Nye metoder og Blåreseptordningen.
Boks 3.2 Skjønnsmessig vurdering ved vurdering av tiltak
«Basert på metodevurderinger skal skjønnsmessige vurderinger inngå i en totalvurdering av tiltak. Dette er særlig knyttet til vurderinger av:
- kvalitet og usikkerhet ved dokumentasjon. Stor usikkerhet knyttet til dokumentasjon og beregningsmetoder skal, alt annet likt, gi lavere prioritet.
- samlede budsjettkonsekvenser av et tiltak.
Ved vurdering av tiltak rettet inn mot små pasientgrupper med alvorlig tilstand hvor det er vanskelig å gjennomføre kontrollerte studier av effekt, kan et lavere krav til dokumentasjon aksepteres.
Ved vurdering av tiltak rettet inn mot særskilt små pasientgrupper med svært alvorlig tilstand, eksempelvis barn med medfødte genetiske sykdommer, der det ofte ikke finnes god dokumentasjon av nytten, kan det aksepteres en høyere ressursbruk enn for andre tiltak.»
Kilde: Meld. St. 34 (2015–2016), 13.
4 Åpenhet og transparens på nasjonalt nivå
Ekspertgruppen skal i tråd med mandatet vurdere konsekvenser av økt åpenhet og, dersom det er hensiktsmessig, foreslå tiltak som kan styrke åpenheten og etterprøvbarheten i prioriteringsbeslutningene på systemnivå. I det følgende kapittelet beskrives beslutningsprosessen ved innføring av Nye metoder, dokumentasjonsgrunnlaget i Nye metoder, bruker- og kliniker-involvering og oversikt over hvordan beslutninger under folketrygden skiller seg fra Nye metoder.
4.1 Beslutningsprosessen ved innføring av nye metoder
Nye metoder er et prioriteringssystem som tar stilling til innføring og utfasing av metoder i spesialisthelsetjenesten. Fra 1. januar 2020 ble det lovfestet at de regionale helseforetakene i fellesskap skal beslutte hvilke metoder som skal tilbys, basert på de tre prioriteringskriteriene nytte, ressursbruk og alvorlighet. Beslutninger om nye metoder og legemidler skal tas etter en grundig vurdering av nytte for pasientgruppen, ressursbruken som metoden beslaglegger, og alvorligheten av tilstanden. Systemet drives som et samarbeid mellom de fire regionale helseforetakene, Helsedirektoratet, DMP (ansvar for metodevurderinger av legemidler og fra 1. januar 2024 for medisinsk utstyr), FHI, Direktoratet for strålevern og atomsikkerhet (DSA), Sykehusinnkjøp HF og brukerrepresentanter. RHF-ene oppnevner også klinikere til å delta i prosessen.
De fleste saker gjelder legemidler, men systemet skal også kunne brukes til å vurdere utstyr og diagnostiske eller terapeutiske prosedyrer. Vanligvis vil den enkelte sak dreie seg om bruk av en metode til en definert pasientgruppe eller på en bestemt medisinsk indikasjon. Når metodevurderinger er gjennomført og godkjent, vil den enkelte sak legges fram for Beslutningsforum til avgjørelse.
Beslutningsprosessen og dokumentasjonsgrunnlaget i Nye metoder og under folketrygden skal være godt beskrevet, og det er mekanismer som skal sørge for dokumentasjon og tilgjengelige opplysninger om prosess og innhold. Viktigheten av åpenhet om beslutningsgrunnlag og prosess ble omtalt i prioriteringsmeldingen:
For å gi beslutninger som omfatter ikke-offentlige priser legitimitet i befolkningen er det samtidig viktig med gode og åpne prosesser for prioritering. (…) Beslutningsgrunnlaget må i størst mulig grad være åpent tilgjengelig for alle. (Meld St. 34 (2015–2016), 174)
Evalueringen av Nye metoder, utført av Proba samfunnsanalyse i 2021, viser blant annet til at det foreligger omfattende skriftlig dokumentasjon av beslutningene, og at de store linjene i prosessen blir loggført og offentliggjort. I samme evaluering problematiserer Proba at deler av Nye metoder er utilgjengelig og ukjent. Proba beskriver at disse delene av prosessene foregår i en «svart boks». I litteraturen viser «svarte bokser» i prioriteringsbeslutninger til prosesser som mangler transparens og legitimitet, og som derfor kan svekke tilliten til systemet (Hasman & Holm 2005).
4.1.1 Sammenstilling av informasjon om Nye metoder
Den viktigste kilden til informasjon om saker som behandles i Nye metoder, er nettstedet www.nyemetoder.no. Her finnes generell informasjon om systemet, informasjon om hvilke metoder som er eller har vært til behandling, beslutninger som er tatt, og status i saker som ikke er ferdigbehandlet. Det finnes også informasjon om innvilgede gruppeunntak.
Saksdokumentene til møtene i Beslutningsforum blir lagt ut på nettstedet. Disse ble tidligere publisert som lange, samlede PDF-filer som dekker alle sakene som ble behandlet i det aktuelle møtet. Nettsiden ble oppdatert ved utgangen av 2023 og er betydelig forbedret, der det nå er en PDF med alle saksdokumenter for hver enkelt sak. Det er lagt planer om å utvikle nettsiden videre samt å utvikle verktøystøtte som vil kunne integreres med helseforetakenes interne informasjonsside.
På nettsidene til Nye metoder finnes det et prosessdiagram som viser hovedledd i prosessen og involverte aktører. Diagrammet gir imidlertid ikke en utfyllende beskrivelse av prosessen. Ekspertgruppen har gjennom dialog med sekretariatet for Nye metoder utarbeidet en oversikt over hva som skjer i «den svarte boksen» beskrevet i 4.1.2, som ikke fullt framkommer av figur 4.1. Dette arbeidet har tydeliggjort hvor det er lite informasjon tilgjengelig og/eller krevende å forstå informasjonen, og blir et grunnlag for å vurdere eventuelle tiltak.
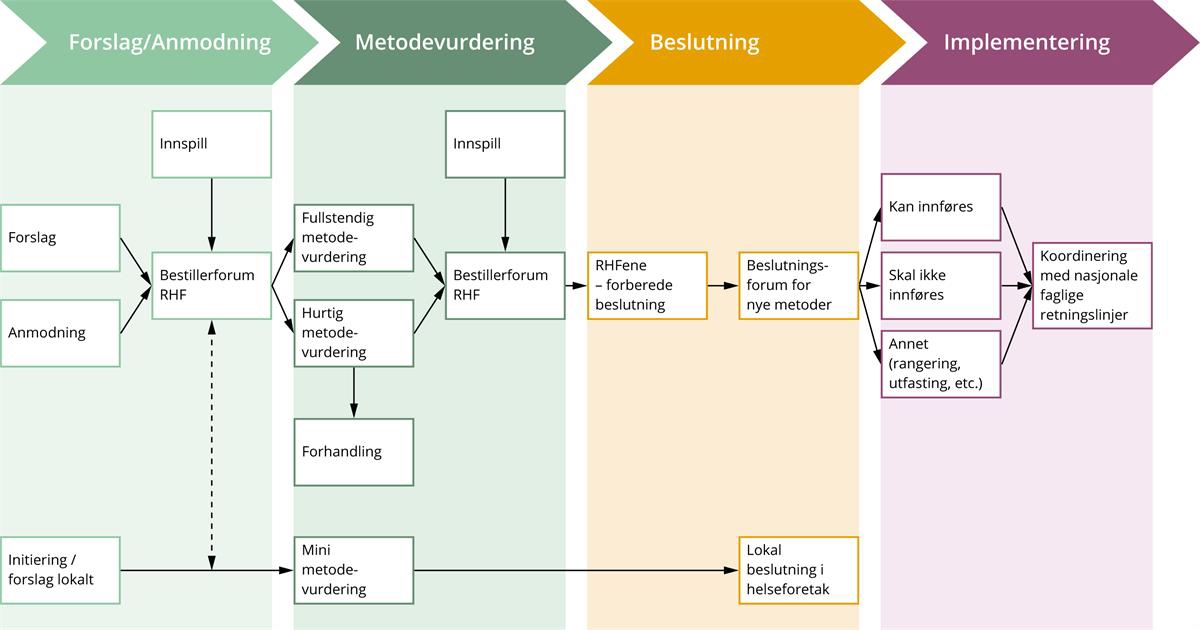
Figur 4.1 Prosesskart Nye metoder
Kilde: Tilpasset av ekspertgruppen basert på prosesskart på nyemetoder.no.
4.1.2 Beskrivelse av saksforberedelse og møtevirksomhet i Nye metoder
Anmodning og tidlig vurdering av sammenlignbarhet: Leverandører som ønsker et legemiddel vurdert for innføring i norsk spesialisthelsetjeneste, må anmode om vurdering til Nye metoder. Alle andre kan foreslå en metodevurdering. Der Sykehusinnkjøp har en relevant spesialistgruppe for det aktuelle terapiområdet, tar de kontakt med de aktuelle spesialistene for en rask tidlig faglig vurdering av sammenlignbarhet med allerede innførte legemidler til samme indikasjon. Dersom legemiddelet blir vurdert sammenlignbart med ett eller flere allerede innførte legemidler, kan Bestillerforum beslutte at det er tilstrekkelig å gi oppdrag om et prisnotat fra Sykehusinnkjøp for den videre prosessen i Nye metoder. Resultatet av spesialistgruppenes vurdering av sammenlignbarhet publiseres sammen med sakspapirene fra møtene i Bestillerforum.
Det kan anmodes om å få en tidligere beslutning vurdert på nytt dersom det foreligger nye kliniske data.
Nettverksmøte: Består av en RHF-koordinator (seniorrådgivere) fra hver av de fire RHF-ene, sekretariatet for Nye metoder, Sykehusinnkjøp og DMP. Dette er et ukentlig møte hvor status på metodevurderinger, som snart skal til beslutning, diskuteres som en kvalitetssikring og forberedelse til å utforme forslag til fagdirektørnotat. Noen ganger kan behov for ytterligere innspill til saken bli diskutert i dette møtet.
Forberedelser til Bestillerforum – innspill til metodene/sakspapirene: Alle anmodninger om vurdering, forslag og anmodninger om revurdering publiseres på nyemetoder.no. Det er mulighet for alle å gi innspill basert på de publiserte anmodningene/forslagene. Sekretariatet for Nye metoder henter aktivt inn innspill fra RHF-ene og Legeforeningens fagmedisinske foreninger (FMF) til anmodninger/forslag i forkant av møtene i Bestillerforum. Disse blir en del av grunnlaget i egnethetsvurderingene. Innhentede innspill fra fagpersoner (RHF og FMF) og andre blir del av sakspapirene. Det blir sendt ut nyhetsbrev til abonnenter om hvilke saker som kommer opp på neste møte.
Formøte til Bestillerforum med utgangspunkt i ferdigstilte sakspapirer: Består avDMP, Sykehusinnkjøp og sekretariatet. I dette møtet diskuteres og foreslås det hvilken type oppdrag (metodevurdering og/eller kun prisnotat) Bestillerforum gir bør gi oppdrag om. Diskusjonen er basert på innkomne anmodninger/forslag/innspill for hver enkelt sak som skal opp i Bestillerforum. Noen ganger presenteres flere alternativer til beslutning.
Formøte i regi av sekretariatet med utgangspunkt i ferdigstilte sakspapirer: Sekretariatet for Nye metoder har et møte med leder av Bestillerforum før møtet i Bestillerforum. I tillegg til fagdirektørsekretariatet deltar brukerrepresentanter i Bestillerforum. I formøtet går man gjennom sakspapirene og forslagene til protokoll som SHI, DMP og FHI har sendt inn. Eventuelle spørsmål til sakene og innspill fanges opp her slik at de kan tas videre til møtet i Bestillerforum. Formøtet er ment å sikre at alle er best mulig forberedt til å effektivt legge fram sakene i Bestillerforum og diskutere sakene i selve møtet.
Bestillerforum: Forumet består av seks beslutningstakere. Dette er de fire regionale fagdirektørene og to representanter fra Helsedirektoratet. Ytterligere fire aktører er representert. Disse er FHI, DMP, SHI og DSA. I tillegg deltar to brukerrepresentanter, RHF-koordinatorer fra de fire regionene og fem personer fra sekretariatet for Nye metoder.
Bestillerforum har som oppgave å behandle anmodninger, forslag og metodevarsler (fra FHI). Bestillerforum beslutter om det skal gis oppdrag om metodevurdering og/eller prisnotat, og eventuelt beslutte hvilken type metodevurdering som skal utføres. Forumet kan også avbestille og endre oppdrag om metodevurderinger. Bestillerforum har i tillegg ansvar for å videreutvikle Nye metoder.
Interregionalt fagdirektørmøte: består av de fire regionale fagdirektørene,møtesekretær og eventuelle spesielt innkalte. Dette møtet er ikke i regi av Nye metoder.Fagdirektørmøte har imidlertid mandat til å kunne ta enkelte beslutninger på vegne av Beslutningsforum, for eksempel i saker hvor leverandør ikke har levert dokumentasjon, om søknad om markedsføringstillatelse ikke er innvilget, eller om konseptgodkjenning slik at SHI kan gå videre i forhandlinger om en volumavtale.
Utarbeidelse av fagdirektørnotat: Saksnotatene utarbeides basert på ferdigstilt metodevurdering fra DMP og prisnotat fra Sykehusinnkjøp. Innholdet kvalitetssikres av medlemmer i nettverksmøtet før det går til de fire regionale fagdirektørene.
I enkelte saker kan det være behov for ytterligere dialog eller innspill fra fagmiljøer, for eksempel når det skal utarbeides inklusjons- eller stoppkriterier. I utgangspunktet tas kontakt med fagpersoner som har deltatt i metodevurderingene eller spesialistgruppene til Sykehusinnkjøp. Eventuelt har fagdirektørene dialog i egen linje.
De fire fagdirektørene gjennomgår og godkjenner saksnotatene og fremmer forslag til beslutning til hver sin administrerende direktør. De må bli enige om beslutningene, slik at likeverdige helsetjenester til alle pasienter ivaretas.
Formøte til Beslutningsforum: Formøtet består av leder av Beslutningsforum, leder av Bestillerforum, medieansvarlig, to personer fra sekretariatet for Nye metoder, en person fra fagdirektørsekretariatet og en person fra SHI. I dette møtet diskuteres og forberedes sakene til kommende møte i Beslutningsforum. I møtet identifiseres eventuelle saker som kan være ekstra utfordrende.
Det arrangeres et formøte med brukerrepresentanter før Beslutningsforum. Her deltar medisinsk rådgiver fra sekretariatet og brukerrepresentantene som er med i Beslutningsforum. Møtet holdes for å hjelpe brukerrepresentantene til å forstå sakene. Sakspapirene til Beslutningsforum er sendt ut før dette møtet.
Beslutningsforum: Forumet består av fire beslutningstakere. Dette er de fire administrerende direktørene fra RHF-ene. Det er tre observatører: en fra Helsedirektoratet og to personer oppnevnt fra de regionale brukerutvalgene. Ti personer er bisittere. Disse er: de fire fagdirektørene, DMP, FHI, SHI, sekretariatet for Nye metoder (2), og fagdirektørsekretariatet (1).
Formålet med møtet er å gjennomgå hver enkelt sak og bli enige om en nasjonal beslutning. Det er her beslutningene fattes. Avgjørelser i Beslutningsforum kan medføre større eller mindre nye utgifter. De administrerende direktørene handler på fullmakt fra sine styrer når de tar sine avgjørelser.
Dersom det kommer innspill til saken etter Bestillerforum, går innspillene til sekretariatet, som vurderer og lenker innspillet med sakspapirene til Beslutningsforum. Innspill som kommer inn etter Bestillerforum, rutes dit saken er i prosessen. Innspill publiseres på metodesiden.
Beslutningsforum fatter beslutninger som ikke er ansett som enkeltvedtak, og som derfor ikke kan påklages etter reglene i forvaltningsloven, jf. forvaltningsloven § 2 første ledd bokstav a og lov 2. juli 1999 nr. 61 om spesialisthelsetjenesten m.m. (spesialisthelsetjenesteloven) § 4-4 tredje ledd.
Dialogarena for brukermedvirkning: Dialogarenaen ble opprettet i 2023 og består av brukerrepresentanter i Nye metoder (som sitter i Bestillerforum og Beslutningsforum), Kreftforeningen, Funksjonshemmedes Fellesorganisasjon (FFO) og utrederinstansene (DMP og FHI). I dette møtet skal utfordringer og forbedringsområder for brukermedvirkning i Nye metoder diskuteres. Møtet holdes én til to ganger i halvåret.
Referansegruppe: Det finnes en referansegruppe for legemidler og en for ikke-legemidler. Gruppen brukes ikke i forbindelse med etablert saksbehandlingsprosess for nye metoder, men gir råd og innspill om videreutviklingen av prosesser og inkluderes når det foreslås endringer i systemet. Nytt mandat for referansegruppene ble godkjent av Beslutningsforum i møte 22. januar 2024. Mandatet er nå mer detaljert og presiserer «Referansegruppene skal være rådgivende organ for Nye metoder og et forum for diskusjoner og innspill på overordnet strategisk nivå, som blant annet skal sikre god tillit til systemet Nye metoder»
4.2 Dokumentasjonsgrunnlag i Nye metoder
Metodevurdering
I en metodevurdering samles og systematiseres kjent kunnskap som er relevant for å vurdere den relative effekten og kostnadene av den nye metoden sammenlignet med det mest brukte alternativet i klinisk praksis. Retningslinjene for metodevurderingen og verktøyene som brukes for å vurdere prioriteringskriteriene, har til hensikt å sikre likebehandling og sammenlignbarhet på tvers av ulike pasientgrupper og metoder. Ofte har studiene kort oppfølgingstid, slik at man må bruke statistiske metoder for å estimere effekter inn i framtiden. Når dokumentasjonen har lav kvalitet, for eksempel studier av liten størrelse, eventuelt at det mangler sammenligning med relevante behandlingsalternativer, og kort oppfølgingstid, vil det være større usikkerhet ved estimatene.
Tradisjonelt munner en metodevurdering ut i IKER og en beregning av alvorlighetsgrad for at man skal vurdere om prioriteringskriteriene er oppfylt. Det er standard å involvere klinikere og å innhente innspill fra brukere i metodevurderingen. I tillegg får leverandøren legge ved egen kommentar til metodevurderingsrapporten. Metoderapporten publiseres i sin helhet, med noen unntak, så snart den er godkjent fra Bestillerforum. Unntakene skyldes at man i enkelte tilfeller har brukt upubliserte data som må holdes konfidensielt fram til dataene blir publisert. Tidligere var standarden for publisering at prisen, IKER og budsjettkonsekvensen var sladdet. På grunn av at det nå er vanlig med en forhandlingsprosess, angis disse tre i et eget vedlegg, og rapporten oppgir utregningene gjort med offentlig tilgjengelige maksimalpriser. Selv leverandøren kan ofte ikke få informasjon om IKER til sine egne produkter fordi dette kan avsløre grossistavansen eller enhetsprisen til sammenligningsalternativet.
Usikkerhet og uenighet om premissene i metodevurderingen
Metodevurderingen beskriver de mest sentrale usikkerhetselementene, og det utføres sensitivitets- og scenarioanalyser. Det er i dag diskusjon mellom akademia og industri om hvordan usikkerhet best bør belyses i metodevurderingene, og på hvilken måte usikkerhet bør tas hensyn til når beslutninger fattes. Det vises til at usikkerhet ofte er en del av begrunnelsen for avslag. Et av argumentene i diskusjonen er at det bør skilles mellom usikkerhet i dokumentasjonsgrunnlag og beslutningen (Dalen mfl. 2021).
Når det er stor usikkerhet ved faktagrunnlaget og overførbarheten fra studier til klinisk praksis, kan det være legitim faglig uenighet om hvordan dette skal håndteres. Det kan være ulike oppfatninger om hvordan metodevurderingen bør utføres.
Innsendt dokumentasjon til metodevurdering
Det er en klar utvikling at flere legemidler nå blir godkjent av EMA med svakere effektdokumentasjon. Utviklingen skjer i alle europeiske land, ikke bare Norge. Den kan føre til at åpenhet og transparens om beslutningsgrunnlaget og selve beslutningen blir svekket.
En konsekvens av dette er at flere behandlinger blir vurdert i Nye metoder uten helseøkonomisk analyse med en tilhørende IKER. Det er sannsynlig at denne utviklingen fortsetter, gitt utviklingen av persontilpasset medisin og trenden med raskere godkjenningsprosesser for markedsføringstillatelser hos EMA.
Prisnotat
Prisnotatet fra Sykehusinnkjøp beskriver prisen for de aktuelle formuleringene, pakningsstørrelsene/dosene for legemidlene, IKER og budsjettkonsekvensene med forhandlet pris. Videre inneholder notatet anskaffelsesmessige vurderinger. Prisnotatet bidrar med informasjon om prosessen rundt forhandlinger av pris og vil indikere hvor stor avstand det har vært mellom myndighetenes betalingsvilje gitt kostnadseffektivitet avveid mot alvorlighetsgraden og leverandørens prissetting. Prisnotatet blir publisert etter beslutningen er fattet. Alle kostnadsoverslag som inneholder rabattert pris eller annen informasjon som kan informere om denne, er sladdet i dette dokumentet.
Alternative prisavtaler
I tillegg til flate rabatter, som er standard praksis når det forhandles om pris på legemidler, kan det inngås alternative avtaler med en kompleks oppbygning. Den komplekse oppbygningen kan også gjøre det vanskelig for den enkelte – både pasient og kliniker – å forstå hva den reelle prisen er for den aktuelle pasienten, og hvordan avtalen påvirker reelle kostnader og dermed forholdet mellom kostnader og nytte. Disse konsekvensene ville gjelde også dersom prisen var åpen. I tillegg til informasjon om priser inneholder disse avtalene ofte annen informasjon som er ansett som forretningshemmeligheter. Selve avtalen blir et bilag til rammeavtalen og blir ikke offentliggjort. Avtalens innhold som ikke anses som forretningshemmeligheter, blir omtalt i prisnotatet.
Fagdirektørnotat
Fagdirektørnotatet inneholder en beskrivelse av metode, aktuelle indikasjon(er), en vurdering og forslag til beslutning. Beslutningen vil ofte være mer omfattende enn et ja eller et nei, da det kan ligge premisser til grunn for forslaget som legges fram, og for den kommende bruken av metoden. Selv om prisene som omtales i notatet, er sladdet, vil avveiningene og begrunnelsen for beslutningen komme fram. Fagdirektørenes notat, der eventuelle forretningshemmeligheter er sladdet, blir publisert i sakspapirene etter beslutningen er fattet. Slik nettsidene til Nye metoder har vært organisert til nå, har det ikke vært tydelig merket hvor man kan finne dette notatet, og det kan være vanskelig å finne det om man ikke kjenner godt til prosessene.
Beslutning og offentliggjøring
Beslutningen som fattes i Beslutningsforum, publiseres på nettsiden til Nye Metoder, i tillegg til at den kommer fram i anbefalingen i fagdirektørnotatet. Beslutningene er ofte utformet med standardiserte formuleringer og er relativt korte dersom man ser bort fra oppsummeringen fra metodevurderingen og prisnotatet som også medfølger.
Det fattes mange beslutninger, de fleste av dem ja-beslutninger. I årsrapporten til Beslutningsforum 2022 rapporteres 144 beslutninger, og i 100 av disse ble beslutningen ja. I 2022 var beslutningen ja i 60 av 98 saker.1 Dette er viktige prioriteringsbeslutninger, men det er ikke disse beslutningene som får oppmerksomhet. Alle beslutningene om innføring har en alternativkostnad som implisitt er en del av beslutningen, men denne alternativkostnaden blir sjelden skissert konkret på beslutningstidspunktet, verken på systemnivå, eller på klinisk nivå.

Figur 4.2 Eksempel på resultat i prisnotat og beslutningstekst fra Beslutningsforum
Kilde: Nyemetoder.no (sak: Yescarta ID2022_020).
4.3 Brukermedvirkning
Brukermedvirkning i helsesektoren reguleres både i lov 2. juli 1999 nr. 63 om pasient- og brukerrettigheter (pasient- og brukerrettighetsloven), i lov 24. juni 2011 nr. 30 om kommunale helse- og omsorgstjenester m.m. (helse- og omsorgstjenesteloven) og i lov 15. juni 2001 om helseforetak m.m. (helseforetaksloven). Pasientrettighetsloven slår fast at pasient eller bruker har rett til å medvirke ved gjennomføring av helse- og omsorgstjenester.
Brukermedvirkning i helsesektoren kan skje på tre nivåer: individnivå, pasientgruppenivå, og overordnet beslutningsnivå. Individnivået dreier seg om brukerens medvirkning til egen helsehjelp i møte med helsepersonell. Pasientens preferanser og erfaring skal hensyntas. Pasientgruppenivået dreier seg om erfaringsbasert kunnskap som kan bidra til bedre utforming av helsetjenester. Det er primært systemnivået som er relevant i Nye metoder. På systemnivå skal brukermedvirkning bidra med helhetstenkning, og det innebærer et medansvar for rettferdig fordeling (NOU 2014: 12, 171).
Brukermedvirkning på systemnivå
Brukermedvirkningen på systemnivå omtaler Norheim-utvalget slik:
Utvalget er opptatt av at det for brukerrepresentanter på dette nivået, enten det er på kommunalt, RHF- eller nasjonalt nivå, må utvikles gode opplæringsopplegg. Et hovedformål med en slik opplæring bør være å utvikle en rolleforståelse og et blikk hos representanten som innebærer evne til og ferdigheter i å se utover seg selv og sin egen sykdomsgruppe. Videre er det viktig å sørge for at forståelse for systematisk prioriteringstenkning blir en helt sentral del av opplæringen. I dette ligger alt fra en forståelse av prioriteringens plass og funksjon i helsetjenesten, prioriteringskriterier, til hvordan man på gruppenivå kan prioritere i praksis. Denne opplæringen bør settes i system og foregå i samarbeid mellom utvalgte akademiske institusjoner og pasient- og brukerorganisasjoner. (NOU 2014: 12, 171)
Brukermedvirkning på systemnivå forstås her som involvering av brukerrepresentanter som utpekes gjennom sine brukerorganisasjoner, og som skal representere gruppens samlede erfaringer og synspunkter. I litteraturen om helseprioriteringer er brukermedvirkning mye diskutert, og en sentral artikkel er Sandman mfl. (2020). Overordnet ser Sandman mfl. fire hovedargumenter for at brukermedvirkning i prioriteringsbeslutninger på systemnivå er et gode:
- Brukerperspektivet styrker og gjør vurderingene mer relevante.
- Brukerperspektivet styrker og myndiggjør brukerne.
- Brukerperspektivet er med på å legitimere beslutningene.
- Brukerperspektivet demokratiserer beslutningene.
Som Sandman mfl. diskuterer, så er det likevel ingen automatikk i at brukermedvirkning styrker prosessen og beslutningene på denne måten. Det er nødvendig å gjøre noen avklaringer rundt brukermedvirkning, slik de tre spørsmålene nedenfor fra artikkelen til Sandman mfl. er ment å gjøre:
Har brukerne en pasient- eller lekpersonsrolle? Pasientrepresentanter er typisk forventet å kunne bidra med sykdomsspesifikt innsyn og perspektiver, mens lekpersonsrollen i større grad er mer overordnet med tanke på hvor hen bidrar med generelle perspektiver.
Er de medlemmer eller konsulenter? Ofte sitter brukerrepresentanter som medlemmer i grupper og beslutningsorganer, mens Sandman mfl. foreslår en mer målrettet og et mer spesifikt bidrag til prosessen. Dette kan ses på som en forlengelse av forskjellen på pasientrollen og lekmannsrollen.
Har de stemmerett eller bare en talerett? I mange organer har brukerne bare observatørstatus og talerett, slik som i Beslutningsforum. Man kan da spørre seg om det innebærer reell medvirkning, eller om de trenger stemmerett på lik linje med andre medlemmer.
Dagens situasjon: brukermedvirkning i vurderings- og beslutningsprosessen
I utgangspunktet kan alle gi innspill til hvilke metoder som skal metodevurderes i forkant av en bestilling. Underveis i prosessen for Nye metoder kan alle gi innspill til den publiserte metodevurderingen i forkant av Beslutningsforum, men det hentes ikke inn systematisk.
I metodevurderingen er det pasientperspektivet som er sentralt for vurderingen. Dette perspektivet blir innhentet via spørreskjema fra pasientorganisasjoner i utvalgte saker.
I Bestillerforum og Beslutningsforum sitter to brukerrepresentanter med observatørstatus. Disse blir rekruttert fra de regionale brukerutvalgene, som får oppnevnt sine medlemmer fra Funksjonshemmedes Fellesorganisasjon (FFO) Samarbeidsforumet av funksjonshemmedes organisasjoner (SAFO), Kreftforeningen og organisasjoner som representerer brukere innenfor tverrfaglig spesialisert behandling av ruslidelser (TSB). Det blir gitt grunnleggende opplæring ved oppnevning, og det er ikke spesielle krav til kompetanse. I formøtene til Bestiller- og Beslutningsforum kan de diskutere og forberede seg. De får tilgang til alle de samme dokumentene som andre aktører i prosessen. Brukerrepresentantene har talerett og forslagsrett og har som rolle å overvåke om prosessene er rettferdige, og om prioriteringskriteriene blir fulgt. Forslagsretten innebærer ikke representasjon i selve innstillingen til beslutninger og gir ikke mulighet til omkamper om beslutninger i Beslutningsforum. Brukerrepresentantene kan videreformidle innspill fra pasientorganisasjoner, men dette skjer ikke systematisk. De kan heller ikke diskutere saken før fagdirektørnotatet er publisert, som er noe sent i prosessen ettersom Nye metoder etterstreber medvirkning så tidlig i prosessen som mulig.
Brukerrepresentanter deltar i referansegruppen til Nye metoder og i den nyopprettede dialogarenaen beskrevet i 4.1.2. Det pågår en del arbeid i Nye metoder for å styrke brukermedvirkningen. Målet med brukermedvirkning i Nye metoder er å «bidra til å sikre at saksbehandlingen skjer på en ryddig og konsistent måte, og at pasientgrupper, saker og innspill behandles likeverdig (Nye metoder u.å.)
Helsefrivilligheten og brukerorganisasjonene
I Norge er det en politisk målsetting at helsetjenestene skal være brukerorienterte, og at pasientenes behov skal være styrende for utformingen av helse- og omsorgstjenestene (Müller 2015).
Interesseorganisasjoner har lang tradisjon for å både supplere og utfylle den offentlige helse- og omsorgstjenesten. Med færre ansatte per pasient vil interesseorganisasjoner kunne ha en viktig rolle. Helsepersonellkommisjonen peker blant annet på at helsefrivilligheten må utnyttes bedre for å håndtere framtidige utfordringer på helseområdet (NOU 2023: 4).
Finansiering av brukerorganisasjonene
Brukerorganisasjonene på helsefeltet finansieres av flere ulike kilder. Staten bidrar med betydelige midler for å støtte organisasjonenes formål. For mange organisasjoner utgjør offentlige midler en vesentlig andel av inntektene, sammen med medlemskontingent, arv og donasjoner (se figur 11 om finansiering til interesseorganisasjoner i Oslo Economics 2023, 13).
Offentlig finansiering kan skje gjennom øremerkede tilskudd i statsbudsjettet, eller gjennom statlige tilskuddsordninger. En andel av de offentlige midlene går til tidsbegrensede prosjekter eller tiltak. Mange av organisasjonene på helsefeltet søker årlig om prosjektmidler fra andre kilder, og noen av de største organisasjonene har betydelige inntekter fra eget innsamlingsarbeid.
Det finnes mer enn 130 landsdekkende demokratiske interesseorganisasjoner for ulike diagnosegrupper. Ett av formålene til interesseorganisasjonene er å lære opp egne medlemmer. Slik opplæring kan handle om å styrke egen helsekompetanse eller inneholde skolering av lekpersoner og/eller erfaringskonsulenter.
Etterspørselen etter brukerrepresentanter til råd og utvalg i helsetjenesten har vokst betydelig de siste årene. Selv om brukermedvirkning i helsetjenesten er tydelig nedfelt, har ikke myndighetene bidratt med finansiell styrking av organisasjonene for at de skal kunne ivareta denne spesifikke oppgaven.
Å skolere brukerrepresentanter er en relativt fersk oppgave for organisasjonene, og skolering av brukerrepresentanter håndteres svært ulikt. Mange brukerorganisasjoner har ikke egne midler til å kunne drive et systematisk opplæringstilbud. Her finnes det et stort potensial for å sikre at representantene har rolleforståelse og nødvendig kompetanse til å kunne fylle rollen som brukerrepresentant i ulike organer i den offentlige helsetjenesten.
De regionale helseforetakene har etablert et eget system for å skolere sine oppnevnte brukerrepresentanter. Brukerrepresentanter som oppnevnes til råd og utvalg i HF eller RHF-strukturen, får honorar for arbeidet. Honorarsatsene er vedtatt av de regionale helseforetakene.
Særinteresser og habilitet
Saksbehandlingsreglene i Nye metoder skal blant annet sikre at særinteresser ikke får uforholdsmessig stort gjennomslag. Regler om habilitet og andre forvaltningsrettslige saksbehandlingsregler gjelder for saksbehandlingen i Nye metoder-systemet. Habilitetsreglene vil utelukke at noen med en konkret personlig interesse i sakens utfall er forhindret fra å delta i saksbehandlingen, jf. forvaltningsloven § 6. Disse reglene er imidlertid ikke egnet til å balansere mellom de ulike og iblant motstridende interessene til ulike pasient- og brukergrupper. Opplæringen og involveringen av brukerrepresentantene må skje på en måte som tar høyde for at de har ulik kunnskap om andre bruker- og pasientgrupper. På den ene siden har det fordeler å oppnevne representanter fra store pasient- og brukerorganisasjoner fordi de kan ha større erfaring med avveining mellom ulike interesser, men på den andre siden gjør det at små pasientgrupper sjelden er representert i beslutningsprosessene. Det er et viktig hensyn at særinteresser ikke får verken for stor eller for liten vekt i beslutningsprosessene. Denne avveiningen kan ikke overlates til brukerrepresentantene alene, men må støttes gjennom opplæring og utforming av prosessen.
4.4 Klinikerinvolvering
Dagens situasjon: klinikerinvolvering i vurderingsprosessen
Alle klinikere kan gi innspill til anmodninger om metodevurdering og foreslå en metode selv. Videre i prosessen kan alle klinikere gi egne innspill til saken i Nye metoder-systemet før den går til beslutning, også etter metodevurderingsrapporten er publisert. Håndteringen av slike innspill har etter ekspertgruppens mening blitt organisert bedre med årene, men det kommer ikke fram godt nok på hvilken måte og når innspillene blir håndtert.
I alle metodevurderinger rekrutteres klinikere for å gi innspill og belyse sentrale spørsmål. Dette gjelder både for Nye metoder og folketrygden. Når en kliniker er rekruttert til en metodevurdering, vil klinikeren få mulighet til å opplyse saken i form av spørsmål, møte og ved innspillsrunde når det foreligger et ferdig utkast til metodevurderingen. Dette innebærer at avsnittene i vurderingen hvor klinikerinnspill er avveid i rapporten, blir markert, og at klinikeren kan bekrefte at de har blitt riktig forstått. Vurderingene gjengis i rapporten som blir publisert. Det er imidlertid ikke åpent hvilke spørsmål klinikeren har mottatt, og hvilke eksakte svar den enkelte klinikeren har gitt. Klinikerinvolvering har ikke en standardisert prosess og kan variere i noen grad.
Det sitter ingen representanter som kliniker i Beslutningsforum, men de er involvert i hele prosessen som standard eller ved behov fram til Beslutningsforum.
Noen etablerte utfordringer
En utfordring er at det ikke er fullt åpent for offentligheten hvilke spørsmål som stilles, og hvilke svar som gis i forbindelse med metodevurdering. Noen ganger kan flere klinikere gi ulike innspill, og DMP må legge sin faglige vurdering til grunn i avveiningene. Selv om metodevurderingsrapporten gir en oppsummerende avveining, ser vi flere eksempler i mediene på at klinikere ikke føler seg godt nok hørt.
Utfordringen med rekrutteringen og ressursbruken til dette arbeidet blir trukket fram av både klinikere og DMP. Det å rekruttere de riktige klinikerne til prosessen er ofte en flaskehals i systemet. Det er også utfordrende for klinikerne å sette av nok tid til å sette seg inn i problemstillingene.
Det finnes mange eksempler hvor det er vanskelig å finne en kliniker og saker står på vent i påvente av at RHF-ene skal finne en egnet kliniker. Vurderinger om habilitet ser ut til å være en av årsakene til at det i noen tilfeller er utfordrende å rekruttere klinikere. Klinikere som involveres i metodevurdering, kan ha flere roller og bindinger som påvirker deres habilitet. Norge er et lite land der det innenfor mange medisinske fagområder er et begrenset antall spesialister. Til det enkelte legemiddelet kan det være bare noen få av disse som har særlig kompetanse på akkurat dette området.
Klinikere kan være involvert på flere områder:
- De kan være fageksperter ved metodevurderinger.
- De kan delta i spesialistgrupper i forbindelse med anbud på legemidler innenfor det aktuelle område.
- De kan ha et ønsket samarbeid med et legemiddelselskap om studier for å undersøke det aktuelle legemiddelets nytte og egenskaper eller for å undersøke andre legemidler fra samme legemiddelselskap. Det er i tråd med det overordnede politiske målet om å øke antallet kliniske studier.
- De kan delta i ulike typer nasjonale og internasjonale advisoryboards.
- De kan ha aksjer i selskaper som samarbeider med det aktuelle legemiddelselskapet, eller som kan være aktuelle for å bli kjøpt opp av dette selskapet.
For klinikere som har en rolle i saksbehandlingen i Nye metoder, gjelder de generelle reglene om habilitet, jf. forvaltningsloven § 6. En kliniker vil være inhabil til å delta i en sak når det foreligger forhold «som er egnet til å svekke tilliten til hans upartiskhet», blant annet om avgjørelsen i saken kan innebære «særlig fordel, tap eller ulempe for ham selv eller noen som han har nær personlig tilknytning til». En kliniker vil kunne være inhabil i en sak om innføring av et nytt legemiddel eller metode fra et legemiddelselskap som hen er i posisjon til å få støtte til forskning eller til kliniske studier fra i en nokså nær framtid. Klinikeren kan også være inhabil dersom hen har aksjer i et legemiddelselskap eller aksjer i et selskap som kan bli kjøpt opp av legemiddelselskapet.
Sterkt engasjement for egen pasientgruppe vil normalt ikke føre til inhabilitet, ei heller involvering i enkeltstående kliniske studier. Et langvarig forhold til et legemiddelselskap vil kunne medføre inhabilitet. Habilitetsreglene skal sikre at det ikke foreligger forhold som gjør at man ikke kan ha tillit til saksbehandlingen, og dermed til at avgjørelsen er truffet på et riktig grunnlag. Det er ikke et formål å unngå enhver mulighet for at involverte har interesser knyttet til saksområdet. I små spesialistmiljøer som i Norge er det viktig at habilitetsreglene ikke praktiseres unødvendig strengt.
Regler om habilitet vil derfor ikke fange opp alle interesser eller forbindelser som en kliniker kan ha i forbindelse med en sak i Nye metoder. Habilitetsreglene skal heller ikke tas i bruk dersom klinikere leverer inn innspill på eget initiativ uten å være en del av saksbehandlingen, eller når de deltar i offentlig debatt i mediene. Det er likevel viktig at informasjon om interesser eller forbindelser blir gjort kjent, selv om de heller ikke fører til inhabilitet, nettopp for å skape tillit til at beslutninger tas etter en ryddig og grundig prosess.
4.5 Hvordan folketrygden skiller seg fra Nye metoder
I hovedsak er de mest sentrale elementene i folketrygden og Nye metoder like, men det er noen forskjeller. Under folketrygden er utarbeidelsen av metodevurdering og hva som er åpent, likt som i Nye metoder med unntak av noen praktiske forskjeller. I spesialisthelsetjenesten er det å delta i metodevurdering definert som en del av arbeidsoppgavene. Innenfor folketrygden kan de motta honorar for tiden sin.
I folketrygden er prosessen mindre komplisert ettersom det er DMP som fatter beslutningen så lenge den er innenfor fullmaktsgrensen på 100 millioner kroner hvert av de fem første årene etter innføring på blåresept i budsjettkonsekvenser. Beslutningen fattes i form av et enkeltvedtak, og ved klage kan Helse- og omsorgsdepartementet vurdere vedtakets lovmessighet. Når fullmaktsgrensen overskrides, sendes saken til Helse- og omsorgsdepartementet, og saken blir vurdert som en del av de ordinære budsjettprosessene.
5 Åpenhet og muligheter for etterprøvbarhet når beslutninger tatt på systemnivå implementeres
I motsetning til beslutningsprosesser på systemnivå og prioriteringsdilemmaer på klinisk nivå finnes det svært lite dokumentasjon om hva som skjer i implementeringsfasen etter en avgjørelse er tatt på systemnivå (Hipgrave mfl. 2014; Sandman & Arvidsson 2023). Dette gjør at vi har mindre å støtte oss på, både når det gjelder beskrivelser av hva som skjer i praksis etter beslutninger er tatt, og når det gjelder hvordan det oppfattes av de som skal forholde seg til beslutningen. Vi vet derfor også mindre om hva som er de mest effektive og tillitvekkende måtene å gjøre dette på. Videre i kapittelet gir vi en overordnet oversikt fra avgjørelsene er tatt i Beslutningsforum, til konsultasjonen med pasienten.
5.1 Implementering av Nye metoders beslutninger i helseforetakene
Hvert enkelt RHF har ansvar for å informere sine helseforetak innad om de beslutningene som er fattet. Kjennskapen til ja-beslutninger skjer gjerne først ved at involverte klinikere og andre med direkte interesse i enkeltmetodene følger med på nettsiden etter Beslutningsforums møter. I tillegg sender sekretariatet for Nye metoder ut nyhetsbrev, som man kan abonnere på.
Dersom det innføres legemidler som overskrider det som det er tatt høyde for i budsjettene i foretakene, må ressurser omprioriteres internt. Selv om dette oftest dreier seg om kostnader for legemidler, vil det også kunne dreie seg om kostnader i forbindelse med mer bruk av kompetent personell, spesielt utstyr og større eller forlenget behov for medisinsk oppfølging når den nye behandlingen blir brukt. Ressurser som skal brukes til den nye metoden, vil ikke kunne brukes til andre formål, inkludert eksisterende behandlingstilbud. Samlet sett vil en ja-beslutning dermed ha en økonomisk, personellmessig og infrastrukturell alternativkostnad.
Når ja-beslutninger i Nye metoder medfører behov for omprioritering, er utfordringene ikke prinsipielt annerledes enn når man må finne dekning for andre ikke-budsjetterte kostnader eller økte kliniske behov som oppstår gjennom året i foretakene. Figur 5.1 viser i en skjematisk framstilling hvordan helseforetakene typisk arbeider med driftsbudsjett. Som figuren illustrerer, legges kostnader til fjorårets ramme for å gjennomføre beslutninger i Nye metoder til driftsbudsjettene (rød firkant). På samme måte legges andre kostnader (strømpriser, økt tilbud av andre behandlinger osv.) til (grønn firkant). Siden selve rammen for foretakene ikke øker vesentlig, vil det være nødvendig å sikre inndekning gjennom å kutte andre kostnader for å holde seg innenfor den tildelte rammen (grå firkant). Inndekningen i den grå boksen kan gjøres ved å øke aktiviteten og inntjeningen og/eller effektivisere driften, ved aktivt å nedprioritere eller ved å gjennomføre en kombinasjon av disse.
Figur 5.1 Skjematisk beskrivelse av helseforetakenes driftsbudsjett
Kilde: Andrea Melberg (innspill til ekspertgruppen i november 2023).
Ja-beslutninger for nye metoder er basert på tilgjengelig og mest mulig oppdatert kunnskap om nytte, ressurs og alvorlighet. For mange eksisterende metoder, der bruken kan bli redusert som følge av omprioritering, er ikke samme type kunnskapsgrunnlag tilgjengelig. Dette gjelder særlig for komplekse og lite spesifikke tiltak. I budsjettarbeid vil det derfor være begrensede opplysninger om hvordan fortynning eller fortrenging av behandlingstilbud i forbindelse med kutt vil påvirke prioriteringene. Dermed er det i praksis vanskelig å bruke prioriteringskriteriene for å stille ulike tiltak og beslutninger opp mot hverandre. Siden ulike typer behandling kan være sentralisert og dermed ikke foregå i alle helseforetak, kan konsekvensene av den enkelte ja-beslutning slå svært ulikt ut mellom de enkelte helseforetakene. I noen foretak vil det være relativt mange pasienter, mens i andre er det få eller ingen pasienter som kan være aktuelle for behandlingen. Hva som skal rammes av omprioriteringer, vil også måtte tilpasses situasjonen i det enkelte helseforetaket.
Det man likevel vet, er at nesten alle kostbare metoder som vurderes innført av Nye metoder, er innenfor somatisk medisin. De store kostnadene knyttet til innføring av nye metoder i somatikken var en av grunnene som helseledere og byråkrater trakk fram som gjorde at «den gylne regel» ikke ble innfridd. «Den gylne regel» var en helt eksplisitt føring som fordret at rus og psykiatri skulle prioriteres framfor somatikken (Melberg & Miljeteig 2023). Riksrevisjonen (2021) kom med sterk kritikk mot Helse- og omsorgsdepartementet etter funnene som viste at til tross for en eksplisitt overordnet prioritering av rus og psykiatri, hadde det ikke skjedd en høyere relativ vekst i ressursbruken.
5.2 Implementering av beslutninger på avdelingsnivå
Legemiddelkostnader budsjetteres og kostnadsføres ulikt i helseforetakene med hensyn til hva som føres lokalt på de enkelte avdelingene, og hva som håndteres i sentrale poster. Det å håndtere en stor del av utgiftene gjennom avdelingenes budsjetter, også til høykostlegemidler, vil kunne stimulere til lokal oppslutning om å etterleve avtaler, følge anbefalingene etter anbud og prioritere bevisst. Men hvis Beslutningsforum i løpet av året derimot innfører kostnadskrevende metoder som det ikke er tatt høyde for, vil effekten av disse kunne velte de enkelte avdelingenes budsjetter.
I dag finnes det ikke noen standard for hvordan en avdeling skal prioritere egne ressurser. Ekspertgruppen har ikke hatt anledning til å utføre en større kartlegging av hvordan det arbeides med slike problemstillinger i ulike helseforetak i landet, men har hentet inn erfaringer fra blant annet lungeavdelingen ved Haukeland Universitetssjukehus i Helse Bergen. Avdelingen ble valgt ut fordi de har en kompleks pasientgruppe med alvorlige kroniske sykdommer, kreft og genetiske sykdommer som nylig har fått tilgang til nye metoder. Denne avdelingen har også uttrykt tydelig at de arbeider systematisk med å forbedre praksis og være åpen om prioriteringer.
Boks 5.1 Kontinuerlig arbeid med prioritering. Eksempel fra lungeavdelingen i Helse Bergen
- Etikk og kommunikasjon. Seminarserie. Månedlige lunsjmøter for legegruppen. Månedlig samtalegruppe på sykepleiere på lungepoliklinikk.
- Forskningsprosjekt om prioriteringer og samvalg ved avdelingen.
- Internundervisning møteserie med prioriteringsproblematikk: Pasientforløp i poliklinikk, kontrollhyppighet, avslutning av oppfølging, prioriteringsveilederen brukes ved vurdering av henvisninger.
- Arenaer i arbeidshverdagen: Morgenmøter og undervisningsmøter. Daglige diskusjoner om kloke valg, behandlingsbegrensing, medisinsk overaktivitet og behandlingsbegrensing.
- Beslutningsstøtte i poliklinikk. Supervisjonsoverlege poliklinikk som konfereres med hver virkedag. Innrettet mot LIS2/3.
- Partssammensatte møter mellom avdelingsledelse og tillitsvalgte. Prioritering som fast punkt.
Kilde: Presentert for ekspertgruppen i november 2023 av avdelingsdirektør Sverre Lehmann.
5.3 Implementering av beslutninger på klinisk nivå
Ved ja-beslutninger for en metode betyr det at spesialisthelsetjenesten kan bruke metoden på den eller de indikasjonene beslutningen gjelder. Det betyr ikke at metoden skal brukes, kun at metoden blir tilgjengelig. Metoden kommer da i samme situasjon som tallrike andre metoder og virkemidler spesialisthelsetjenesten allerede bruker. Hvorvidt den enkelte pasient skal tilbys metoden, forutsetter ikke bare at pasienten har den tilstanden eller diagnosen som den nye metoden er innført for, men avhenger også av hvordan pasientens øvrige helsetilstand er, for eksempel når det gjelder komorbiditet, sviktende organfunksjon, skrøpelighet, kognitiv svikt eller manglende evne til å gjennomføre behandlingen. Denne vurderingen skiller seg ikke fra tilsvarende vurderinger som inngår i kliniske beslutninger som gjelder bruk av andre inngripende behandlingsformer, men blir ekstra satt på spissen ved bruk av kostbar behandling av en stadig eldre befolkning med stadig mer multisykelighet (Orstad mfl. 2023). Hvor skal grensen gå?
For klinikeren vil intensjonen bak disse vurderingene i all hovedsak være å gjøre det som er til pasientens beste. Det innebærer å vurdere om nytten er stor nok eller for liten veid opp mot bivirkninger og andre ulemper for pasienten. Intensjonen vil ikke være å spare penger. For at pasienter og pårørende skal ha tillit i slike beslutninger, er det avgjørende at behandlerne klarer å kommunisere godt og begrunne beslutningene (Walczak mfl. 2013; Heyland mfl. 2006). Forskning viser at en del klinikere opplever at disse samtalene er krevende, og at beslutningen kan bli utsatt eller aldri tatt fordi man frykter konflikt eller å frata pasienten og pårørende håpet (Clarke mfl. 2015; Helsedirektoratet 2018a). Erfaring tyder på at det kan være ekstra krevende å ikke tilby den aktuelle behandlingen til pasienten hvis pasienten og de pårørende har fått forventninger til en ny behandling som er godkjent i Beslutningsforum.
Dagens kliniske retningslinjer og handlingsprogrammer er i stor grad ment å avklare hvilke grupper av pasienter som kan eller bør behandles med hvilke metoder, og hvordan disse behandlingene bør gjennomføres. Retningslinjene og handlingsprogrammene sier i mindre grad noe om hvilke andre forhold ved pasienten utover diagnosen eller tilstanden som bør tilsi at den aktuelle behandlingen ikke bør tas i bruk, eller hva som skal være kriterier for å slutte med denne behandlingen. Dette gjelder alle behandlinger, men behovet for å være åpen om hva som er de eksplisitte inklusjons- og stoppkriteriene for behandlingen, blir særlig viktig når behandlingen er svært ressurskrevende (Rasmussen mfl. 2023).
Hvis behandlingen ikke har blitt innført av Beslutningsforum, kan det bli klinikeren som må formidle dette til pasienten. Forskning viser at pasienter kan oppleve det som vanskelig å erfare at de utsettes for eksplisitt rasjonering, og klinikere opplever etiske og praktiske barrierer for å tydeliggjøre prioriteringsbeslutninger selv om de støtter idealet om åpenhet i klinikerrollen (Owen-Smith mfl. 2010). En studie fra England har vist at de viktigste faktorene for hvordan britiske pasienter reagerer på å ikke bli prioritert, er opplevelsen deres av å ha rettigheter i helsevesenet og holdningene helsepersonellet har i møtet med dem (Owen-Smith mfl. 2009).
Ekspertgruppen erfarer at dersom behandlingen ikke har fått ja i Beslutningsforum, men er tilgjengelig i private tjenester, er det ulik praksis om klinikeren informerer uoppfordret om det private tilbudet eller ikke. Enkeltleger kan også vurdere dette ulikt avhengig av om nytten av den nye behandlingen oppfattes å være stor, eller om den kun gir en moderat eller liten forbedring. Ofte er pasienten kjent med det private tilbudet, men ikke alltid. Noen klinikere formidler at de informerer om den private muligheten slik at pasienten selv kan velge om de vil betale for det. Andre har formidlet at de er lojale til den beslutningen som er tatt, og ikke vil medvirke til at pasienten føler seg presset til å bruke mye penger på behandling som er vurdert til å ha for lite nytte i forhold til kostnadene. De sier at de ikke tar dette opp uoppfordret, men svarer hvis pasienten spør dem direkte. Flere har også uttrykt at de synes dette er en vanskelig problemstilling. Kommunikasjon og åpenhet om nei-beslutningene kan derfor skape en etisk utfordring for den enkelte kliniker.
6 Gjeldende rett
6.1 Innledning
I dette kapittelet gis en oversikt over regelverk som er relevante for spørsmålene som ekspertgruppen vurderer. Der ekspertgruppens vurderinger reiser spørsmål om tolkningen av og rekkevidden av rettsregler, er dette diskutert i de enkelte kapitlene.
Utgangspunktet er åpenhet om saksdokumenter i offentlig forvaltning, jf. offentleglova § 3. Noen dokumenter er imidlertid unntatt fra regelen om åpenhet, blant annet opplysninger om forretningshemmeligheter. Dette får betydning for muligheten til å gi innsyn i enhetspriser for legemidler og utstyr som myndighetene kjøper inn. Slik informasjon kan være underlagt lovbestemt taushetsplikt. Prinsippet i offentleglova innebærer at det ikke fritt kan inngås avtaler som pålegger konfidensialitet utover det som følger av forvaltningsloven eller særlovene.
Når ekspertgruppen skal belyse problemstillingene som gjelder vurderinger og beslutningsprosesser i Nye metoder og under folketrygden, er mandatet begrenset til å foreslå tiltak innenfor gjeldende regelverk. Ekspertgruppen har i vurderingene påpekt begrensninger i lovverket, men ikke gjort omfattende utredninger av mulige lovendringer.
6.2 Spesialisthelsetjenesteloven
6.2.1 Sørge-for-ansvaret og sykehusenes formål
Staten skal sørge for at innbyggerne får både øyeblikkelig og nødvendig helsehjelp, jf. spesialisthelsetjenesteloven §§ 21 og 31. Sykehusene som er organisert i helseforetak, har som formål å yte gode og likeverdige spesialisthelsetjenester til alle som trenger det, når de trenger det, uavhengig av alder, kjønn, bosted, økonomi og etnisk bakgrunn, jf. helseforetaksloven § 1. Det regionale helseforetaket skal innrette sitt tjenestetilbud i tråd med prioriteringskriteriene: nytten av tiltak i pasientbehandling, ressursbruk som tiltak legger beslag på, og alvorlighetsgraden til de tilstandene som skal behandles, jf. spesialisthelsetjenesteloven § 21 a andre ledd, se også helseforetaksloven § 1, jf. § 2a. Prioriteringskriteriene er dermed grunnlaget for all prioritering i spesialisthelsetjenesten og ikke kun begrenset til vurderingen av nødvendig helsehjelp.
6.2.2 Nye metoder
Spesialisthelsetjenesteloven § 4-4 bestemmer at de regionale helseforetakene skal sørge for et felles system for å beslutte hvilke metoder som kan tilbys i spesialisthelsetjenesten. Loven har ingen bestemmelser om den nærmere organiseringen, og det er heller ikke gitt forskrifter.
I systemet «tas det stilling til om metoder skal gjøres tilgjengelig for bruk i spesialisthelsetjenesten». I pasient- og brukerrettighetsloven er det presisert i § 2-1 b andre ledd siste punktum at den individuelle retten til nødvendig helsehjelp «gjelder de tjenestene som spesialisthelsetjenesten har ansvaret for å yte og finansiere», jf. spesialisthelsetjenesteloven §§ 21 a og 44. Ordningen med Nye metoder er et verktøy og system for prioritering i spesialisthelsetjenesten for å sikre mest mulig rettferdig fordeling av ressursene. Systemet tar ikke stilling til om metoder «skal brukes overfor konkrete pasienter eller pasientgrupper, men om det skal åpnes for at metoden kan brukes i den offentlige spesialisthelsetjenesten» (Prop. 55 L (2018–2019)).
Beslutningsforum er et forum hvor de administrerende direktørene i de fire RHF-ene møtes for å bli enige om hvilke beslutninger de hver på sin kant skal fatte i sine virksomheter, og som deretter skal danne rammene for virksomheten i helseforetakene. Systemet er at de møtes etter å ha fått fullmakter fra sine respektive styrer. Nødvendige vedtak med virkning for det enkelte RHF-et skal enten fattes av RHF-et i det konkrete tilfellet eller iverksettes i tråd med generell fullmakt. Etter loven er det RHF-ene som selv skal organisere et felles system for beslutninger. De velger selv hvem som skal delta, og hvordan man skal treffe beslutninger. Det er de administrerende direktørene med ansvar for daglig ledelse av RHF-ene som har ansvar for beslutningen, jf. helseforetaksloven § 37. Hver administrerende direktør treffer beslutninger for sitt RHF, men det er enighet om at alle RHF-ene skal tilbys tilgang til nye metoder, for å ivareta plikten til lik behandling av pasienter.
Da spesialisthelsetjenesteloven § 4-4 ble tatt inn i loven og dermed uttrykkelig lovfestet en plikt for RHF-ene til å arbeide innenfor et felles system, framhevet departementet at sammenhengen mellom budsjettansvaret og sørge-for-ansvaret var viktig for gode prioriteringsbeslutninger:
Etter departementets vurdering bør systemet for å beslutte hvilke metoder som skal tilbys i spesialisthelsetjenesten være innrettet slik at den som har ansvaret for tjenesten og å sikre et faglig forsvarlig tjenestetilbud, også har ansvaret for finansiering og for å foreta prioriteringer innenfor de tildelte rammer. Departementet er av den oppfatning at det er en god løsning at de fire regionale helseforetakene fatter beslutninger om innføring og utfasing av metoder i spesialisthelsetjenesten i felleskap og innenfor deres sørge-for-ansvar. (Prop. 55 L (2018–2019), 41)
Dette var bakgrunnen for valget om å legge beslutningsmyndigheten for hvilket behandlingstilbud som tilbys i den norske spesialisthelsetjenesten, til RHF-ene ved deres daglige ledere.
Avgjørelser som tas i Nye metoder om tilgang til legemidler på gruppenivå som innebærer at en metode kan brukes i den offentlige spesialisthelsetjenesten, har ikke vært ansett som enkeltvedtak, se blant annet SOM-2017-2104. Dette er nå lovfestet, jf. spesialisthelsetjenesteloven § 4-4 tredje ledd og Prop. 55 L (2018–2019), og betyr at det ikke er klageadgang på vedtak fra Beslutningsforum. Det gjelder alle beslutninger, enten de går ut på at en behandling tas inn eller ikke tas inn.
Tilgangsbeslutninger på individnivå, altså beslutninger om hvilken konkret behandling som skal tilbys en enkelt pasient, kan derimot påklages til statsforvalteren i tråd med bestemmelsene i pasient- og brukerrettighetsloven kapittel 7.
6.2.3 Folketrygdloven og blåreseptordningen
Tilgang til legemidler som finansieres av folketrygden, er regulert med hjemmel i lov 28. februar 1997 nr. 19 om folketrygd (folketrygdloven). Etter § 5-14 ytes stønad til viktige legemidler, spesielt medisinsk utstyr og forbruksmateriell. Nærmere regler finnes i forskrift 28. juni 2007 nr. 814 om stønad til dekning av utgifter til viktige legemidler mv. (blåreseptforskriften) og i legemiddelforskriften kapittel 14. Etter blåreseptforskriften kan det gis stønad til legemidler både som forhåndsgodkjent refusjon og ved individuell stønad, jf. blåreseptforskriften §§ 2 og 3. For slike tilgangsbeslutninger gjelder prioriteringskriteriene, jf. legemiddelforskriften § 14-5 og blåreseptforskriften § 3.
Når det vurderes om et legemiddel skal godkjennes for refusjon, tar vurderingen utgangspunkt i legemiddelets maksimalpris. For noen legemidler er det inngått individuelt forhandlede refusjonskontrakter hvor prisen er konfidensiell. I slike tilfeller beholder legemiddelet sin maksimalpris, men det gis etterskuddsvise rabatter, jf. legemiddelloven § 6 andre ledd. Dette har styrket tilgangen som følge av at produsenten har kunnet tilby en større rabatt som gjør legemiddelet kostnadseffektivt, eller at refusjon kan innvilges av DMP innenfor fullmaktsgrensen i legemiddelforskriften § 14-7. Forsøk med bruk av anbudskonkurranse under refusjonsordningen har vist at når det har vært mulig å beholde konfidensialitet og dermed taushetsplikt om enhetsprisene, er det gitt rabatter som har gjort at legemidler kunne tilbys en større pasientgruppe enn før. Det er ikke gitt nærmere forskrifter om refusjonskontrakter.
Det er klageadgang på beslutninger om refusjon under folketrygdloven. DMPs generelle beslutning om å føre opp et legemiddel på refusjonslisten innenfor fullmaktsgrensen i legemiddelforskriften § 14-7, er et enkeltvedtak som kan påklages etter legemiddelloven § 6 femte ledd. Kommer DMP til at fullmaktsgrensen overskrides, anses det ikke som et enkeltvedtak, men saksbehandlingsfeil kan påklages, jf. legemiddelforskriften § 14-7. En individuell beslutning om refusjon etter blåreseptforskriften § 3 tas av HELFO og kan påklages til Nasjonalt klageorgan for helsetjenesten med videre ankeadgang til Trygderetten, jf. folketrygdloven § 21-12.
6.3 Immaterialrettigheter
6.3.1 Patent
Nye og innovative legemidler er patentbeskyttet. Patentretten innebærer et forbud mot at andre produserer og selger kopier av legemiddelet, og patenthaveren får dermed en faktisk monopolstilling så lenge beskyttelsen varer. Eneretten etter patentet varer i 20 år fra søknadsdatoen, jf. lov 15. desember 1967 nr. 9 om patenter (patentloven) § 40. Patent søkes gjerne så snart det aktuelle virkestoffet er framstilt eller en ny indikasjon for et legemiddel er funnet, men det kan likevel ta lang tid før legemiddelet kommer ut i markedet. Legemidler som er beskyttet av patent og har markedsføringstillatelse, kan derfor få eneretten forlenget med inntil fem år etter reglene om supplerende beskyttelsessertifikater i patentloven kapittel 9a.
Patentretten er et økonomisk virkemiddel som skal stimulere til innovasjon. For legemidler skal den stimulere til utvikling av innovative legemidler. Kostnadene til forskning og utvikling kan være svært høye, og eneretten gir selskapene mulighet til å tjene inn igjen disse kostnadene. For at patentet skal stimulere til utvikling der resultatet ikke er kjent, og for at inntektene fra vellykket innovasjon også skal dekke kostnader med mislykkede utviklingsforsøk, er det ikke noen kobling mellom vilkårene for å få patent eller enerettens omfang og de konkrete utviklingskostnadene til et legemiddel.
Først når patentet, og et eventuelt supplerende beskyttelsessertifikat, utløper, har generikaprodusenter anledning til å tre inn på markedet med like, konkurrerende legemidler. Generika er legemidler som konkurrerer med enten legemidler som ikke er patentbeskyttet, eller legemidler der patentbeskyttelsen har løpt ut. Prisene synker da vesentlig fra det som ofte er et veldig høyt nivå satt av selskapene i patenttiden. Som beskrevet i kapittel 3.2.2 kan prisen synke med over 90 prosent.
Legemiddelregelverket har også regler om dokumentbeskyttelse for originalprodusenter som kan forlenge enerettsposisjonen. Disse reglene hindrer generikaprodusenter i å sende inn forenklet søknad om markedsføringstillatelse før originalproduktet har vært på markedet i EØS-området i minst åtte år. Markedsføringstillatelse gitt til en generikaprodusent kan først benyttes til salg av konkurrerende generika tidligst ti år etter at den første tillatelsen for originalproduktet ble gitt.
De sentrale reglene om patent er harmonisert i internasjonale traktater som Norge er bundet av. Reglene om supplerende beskyttelsessertifikater og dokumentbeskyttelse er gjennomført i Norge under EØS-avtalen. Dermed er det lite rom for å endre disse reglene kun i Norge. EU-kommisjonen la i april 2023 fram forslag til nytt direktiv om legemidler til mennesker (COM(2023) 193 final). EU-kommisjonen foreslår blant annet å korte ned dokumentbeskyttelsesperioden til seks år som hovedregel. For å skape insentiver til utvikling av legemidler mot sjeldne sykdommer foreslås en mulighet for lengre dokumentbeskyttelse. Endringene viser en trend mot et mer fleksibelt regulatorisk system, med et uttrykt mål om at generika skal kunne tre raskere inn på markedet. Det er usikkert om forslaget blir vedtatt i sin nåværende form. Når det er vedtatt, vil det bli tatt inn i EØS-avtalen, men det vil antakelig ta noe tid før dette blir gjeldende rett i Norge.
6.3.2 Forretningshemmeligheter
I 2020 ble lov 27. mars 2020 nr. 15 om vern av forretningshemmeligheter (forretningshemmelighetsloven) vedtatt. For at noe skal være en forretningshemmelighet etter loven, må det være tale om opplysninger som ikke er allment kjent eller lett tilgjengelige, som har kommersiell verdi fordi de er hemmelige, og som innehaveren har truffet rimelige tiltak for å holde hemmelig, se forretningshemmelighetsloven § 2. Det er klart at enhetspriser på legemidler og/eller størrelsen på rabatter omfattes av definisjonen så lenge disse opplysningene ikke er allment kjent, og så lenge selskapet krever at enhetsprisene holdes hemmelig. Dette har vært grundig utredet i forbindelse med rapporten Håndtering av enhetspriser for legemidler og prinsipper for rutiner for prisinformasjon.2Definisjonen rommer også opplysninger om utviklingskostnader på produktnivå som regelmessig ikke er synlige i ellers tilgjengelige regnskaper, eller andre opplysninger om priser og kostnader som viser selskapenes marginer.
Reglene om forretningshemmeligheter har i denne sammenhengen betydning for hvilke opplysninger som omfattes av taushetsplikt, og forretningshemmelighetsloven har egne regler om blant annet erstatningsansvar ved brudd på loven. Forretningshemmelighetsloven gjennomfører direktiv (EU) 2016/947 om forretningshemmeligheter. Det innebærer at disse reglene er like i hele EØS-området.
6.4 Regler om taushetsplikt
6.4.1 Innledning
Lovgivningen har ulike, og til dels overlappende, regler om taushetsplikt som er relevante for de spørsmålene ekspertgruppen vurderer. Legemiddelloven, forvaltningsloven, offentleglova og reglene om offentlige anskaffelser har bestemmelser som kan kreve taushetsplikt for opplysninger om priser på legemidler og prisdannelse. Disse reglene er noe ulike, men slik de tolkes og anvendes, har de stort sett lik rekkevidde for denne typen opplysninger i de situasjonene som ekspertgruppen har sett på. Reglene om taushetsplikt samsvarer med reglene om beskyttelse av forretningshemmeligheter i loven om forretningshemmeligheter fra 2020. Sammen innebærer disse reglene at alle som er engasjert til å utføre arbeid for det offentlige, har taushetsplikt om opplysninger som utgjør forretningshemmeligheter. I det følgende gis en kort oversikt over de enkelte reglene.
6.4.2 Forvaltningsloven
Forvaltningsloven gjelder etter lovens § 1 for all offentlig virksomhet. Etter helseforetaksloven § 5 gjelder forvaltningsloven også for helseforetakene. Forvaltningsloven § 13 første ledd nr. 2 har en regel om taushetsplikt som er relevant for opplysninger om pris for legemidler:
Enhver som utfører tjeneste eller arbeid for et forvaltningsorgan, plikter å hindre at andre får adgang eller kjennskap til det han i forbindelse med tjenesten eller arbeidet får vite om:
(…)
2. tekniske innretninger og fremgangsmåter samt drifts- eller forretningsforhold som det vil være av konkurransemessig betydning å hemmeligholde av hensyn til den som opplysningen angår.
Taushetsplikten gjelder for opplysninger som er hemmelige, altså at de ikke er allment kjent eller allment tilgjengelige andre steder. Opplysningene må også være av en slik art at det er naturlig å regne med at man i vedkommende virksomhet anser dem som en hemmelighet. I tillegg må det være av konkurransemessig betydning for virksomheten å holde opplysningene hemmelige. Det vil ha en slik betydning dersom det kan føre til økonomisk tap for virksomheten om opplysningene blir kjent. Etter at loven om forretningshemmeligheter trådte i kraft i 2020, blir regelen i forvaltningsloven § 13 første ledd nr. 2 tolket i samsvar med reglene i forretningshemmelighetsloven. Det innebærer ingen egentlig endring. Det må uansett gjøres en konkret vurdering av den konkurransemessige betydningen for virksomheten av at opplysningene holdes hemmelig. Det er ikke alle opplysninger det vil ha økonomisk betydning å holde hemmelig, det må vurderes konkret.
Når det gjelder priser, er det i en rekke uttalelser fra Sivilombudet og avgjørelser fra KOFA lagt til grunn at enhetspriser i et anbud er å regne som opplysninger som er omfattet av taushetsplikt, mens taushetsplikten normalt ikke omfatter totalprisen i et innkjøp/anbud. Innsyn i de totale kostnadene vil ligge i kjernen av formålet med offentleglova.
For enhetspriser eller rabatter i en kontrakt, må det vurderes om innsyn i disse har slik konkurransemessig betydning for virksomheten at det kan medføre økonomisk tap om opplysningene blir kjent. Det kan for eksempel være fordi konkurrerende virksomheter vil kunne tilpasse sin enhetspris og dermed stå bedre rustet i konkurranse.
For patenterte legemidler er situasjonen at patenthaveren er alene om å kunne tilby legemiddelet i det norske markedet. På kjøpersiden er norske myndigheter alene. I denne situasjonen foregår det ingen konkurranse i Norge før patentet løper ut. Det kan imidlertid måtte tas hensyn til at åpenhet om forhandlede enhetspriser og rabatter har betydning for selskapets posisjon i internasjonal konkurranse. Legemiddelprodusenter konkurrerer i stor grad internasjonalt, slik at vurderingen av om det vil kunne føre til økonomisk tap om opplysningene blir kjent, også må ta hensyn til produsentens stilling på et internasjonalt marked.
En del markeder forandrer seg raskt, slik at det etter noe tid ikke lenger vil ha konkurransemessig betydning å holde for eksempel prisopplysninger hemmelig. Et eksempel er Sivilombudets uttalelse i sak SOMB-2009-1960, som gjaldt innsyn i enhetspriser for influensavaksine:
Den tiden som er gått vil imidlertid kunne føre til at opplysninger om enhetspriser ikke lenger etter sin art kan nyttiggjøres på en måte som kan føre til økonomisk tap eller redusert gevinst for virksomhetene. Dersom enhetsprisen gjelder produkter på et marked i hyppig endring, vil nok det kunne tale for at opplysningen ikke anses underlagt taushetsplikt. På den annen side må man her se hent til i hvilken grad offentliggjøring av enhetspris er egnet til å avsløre strategiske forhold som vil kunne utnyttes av andre, også på et senere tidspunkt.
Et slikt strategisk forhold kan være de rabattene som gis, også rabattnivå over tid. Hvis det over tid viser seg at Norge får 50 prosent rabatt i sine vaksineavtaler, kan det skape utfordringer for virksomheten når den skal forhandle med andre land som inngår tilsvarende innkjøpsavtaler.
Som nevnt i kapittel 6.2.2 er beslutninger om hvilken konkret behandling som skal tilbys en enkelt pasient, et enkeltvedtak som kan påklages etter pasient- og brukerrettighetsloven kapittel 7. Spørsmålet er da om pasienten har fått nødvendig helsehjelp etter samme lovs § 2-1b i samme lov. Det kan oppstå spørsmål om innsyn i enhetspris er nødvendig for klageretten, da pris kan være et avgjørende moment i vurderingen av hvilken behandling pasienten tilbys. Forvaltningsloven gjelder for klagebehandling etter pasient- og brukerrettighetsloven, og i utgangspunktet gjelder taushetsplikten etter forvaltningsloven § 13 første ledd nr. 2 også i klagesaker. Dette har vært kritisert. Ekspertgruppen har ikke gått nærmere inn på dette, da åpenhet i denne sammenheng først og fremst er et virkemiddel for effektiv klagerett.
6.4.3 Legemiddelloven
I legemiddelloven reguleres taushetsplikt i § 30:
Enhver som i medhold av stilling eller verv etter loven får kjennskap til drifts- eller forretningshemmelighet skal med de begrensninger som følger av hans gjøremål etter loven, tie med det han slik får vite. Ingen må i ervervsvirksomhet gjøre bruk av det han slik får vite. Taushetsplikten gjelder også etter at vedkommende har sluttet i stillingen eller vervet. Departementet kan samtykke i unntak fra taushetsplikt etter denne bestemmelse når sterke samfunnsmessige hensyn taler for at opplysningene gis. Taushetsplikten skal likevel ikke være til hinder for utveksling av informasjon (samordning) som forutsatt i lov om Oppgaveregisteret. Forvaltningslovens §§ 13 til 13 e og 13 g gjelder ikke.
Taushetsplikten etter denne bestemmelsen er etter ordlyden strengere enn forvaltningsloven § 13. Bestemmelsen har likevel vært forstått slik at den har samme innhold som taushetsplikten etter forvaltningsloven § 13 første ledd nr. 2. Det betyr at det bare er taushetsplikt for opplysninger som det vil være av konkurransemessig betydning å holde hemmelig. Det er ikke nok at opplysningene ikke er kjent utenfor foretaket, men det må føre til økonomisk tap eller redusert gevinst for foretaket om opplysningene røpes, enten direkte eller indirekte ved at konkurrenter utnytter opplysningene. Dette er det samme som nå følger av loven om forretningshemmeligheter fra 2020.
Departementet kan gi samtykke til å gjøre unntak fra taushetsplikten etter legemiddelloven § 30 når «sterke samfunnsmessige interesser» taler for at opplysningene gis. Det må gjøres en konkret vurdering i det enkelte tilfellet. Sivilombudet har lagt til grunn at unntak kan tenkes der offentligheten har behov for kunnskap om legemidlers virkninger og bivirkninger (SOMB-2007-8). Ordlyden utelukker ikke at unntak kan gis for informasjon om enhetspriser og rabatter, men siden det kreves sterke samfunnsmessige interesser, antas terskelen å være svært høy.
6.4.4 Offentleglova
Hovedregelen i offentlig forvaltning er som nevnt åpenhet om saksdokumenter, se offentleglova § 3. Det følger imidlertid av offentleglova § 13 at det ikke skal gis innsyn i opplysninger som er omfattet av lovbestemt taushetsplikt. Dette er en konsekvens av reglene om taushetsplikt iblant annet forvaltningsloven og legemiddelloven. Reguleringen i offentleglova innebærer at det i kontrakter ikke kan inngås bestemmelser om taushetsplikt utover det som følger av lovgivning. Reglene om taushetsplikt gjelder konkrete opplysninger, og resten av dokumentene vil være offentlige.
Offentleglova § 23 gir hjemmel for å unnta opplysninger fra innsyn av hensyn til det offentliges forhandlingsposisjon. Etter § 23 tredje ledd kan det gjøres unntak fra innsyn for tilbud og protokoll etter anskaffelsesregelverket inntil det er valgt en leverandør. Etter at leverandøren er valgt, kan det ikke lenger nektes innsyn etter denne bestemmelsen. Etter omstendighetene kan § 23 første ledd gi grunnlag for å nekte innsyn av hensyn til forvaltningsorganets posisjon i senere konkurranser. Mer praktisk er det at reglene om taushetsplikt er til hinder for innsyn etter valg av leverandør, jf. offentleglova § 13.
For leverandørene kan det ha konkurransemessig betydning å holde opplysninger om pris hemmelige dersom de er aktuelle i en ny konkurranse som holdes innen rimelig tid, eller dersom leverandøren opptrer i et internasjonalt marked og opplysningene fra den norske konkurransen kan påvirke prisen i andre markeder.
6.4.5 Reglene om offentlige anskaffelser
Åpenhet er også utgangspunktet der legemidler kjøpes inn under reglene om offentlige anskaffelser, jf. forskrift 12. august 2016 nr. 974 om offentlige anskaffelser (anskaffelsesforskriften) § 7-3. Etter forskriftens § 7-4 gjelder også reglene i forvaltningsloven, inkludert § 13 om taushetsplikt. Reglene om åpenhet og taushetsplikt om forretningshemmeligheter er derfor de samme for innkjøp av legemidler under anskaffelsesreglene som ellers. Det avgjørende er altså om det er av konkurransemessig betydning for leverandøren at opplysningene holdes hemmelig. Innenfor anskaffelsesregelverket er taushetsplikten om forretningshemmeligheter viktig for å sikre både at flere leverandører ønsker å delta i konkurranser arrangert av det offentlige, og at leverandører skal gi korrekte og fullstendige opplysninger i tilbudene sine. Taushetsplikt om forretningshemmeligheter er derfor et virkemiddel for å oppnå konkurranse, jf. lov 17. juni 2016 nr. 73 om offentlige anskaffelser (anskaffelsesloven) § 5. Dette er også vektlagt av EU-domstolen i en lang rekke avgjørelser om tolkningen av de tilsvarende reglene i EU.
6.5 Taushetsplikt og avtaler
I norsk rett er det avtalefrihet om forretningshemmeligheter. Partene kan altså bli enige om at det skal være full åpenhet rundt priser og rabatter i en kontrakt.
Dersom kontraktene ikke selv har bestemmelser om hemmelighold og taushetsplikt, kan taushetsplikt likevel følge direkte av lov der kontrakten inneholder opplysninger som utgjør forretningshemmeligheter. Som omtalt ovenfor er det lovpålagt taushetsplikt om forretningsmessige opplysninger som det har konkurransemessig betydning at holdes hemmelig. Ovenfor er det vist til at dette for eksempel kan være enhetspriser eller rabatter som er gitt i kontrakten. Loven om forretningshemmeligheter krever at den som innehar en forretningshemmelighet, treffer tiltak for å holde opplysningene hemmelig. Dersom leverandøren ikke krever at enhetspriser eller rabatter holdes hemmelig, kan det tilsi at det ikke er tale om hemmelige opplysninger som er dekket av taushetsplikten. Dette må imidlertid vurderes konkret siden legemiddelloven og forvaltningsloven ikke inneholder noe vilkår om slike tiltak. Når kontrakten har bestemmelser om hemmelighold, gjelder taushetsplikten etter kontrakten ved siden av taushetsplikten etter loven. Dette får bare betydning for hvilke sanksjoner som er tilgjengelige ved eventuelt brudd på taushetsplikten.
7 Andre land og internasjonale initiativer
7.1 Internasjonalt arbeid
Lite transparent legemiddelmarked internasjonalt
Over flere år har det blitt rettet mer oppmerksomhet mot manglende åpenhet, høye priser og konsekvensene av dette (Webb mfl. 2022; Barrenho & Lopert 2022). Den globale bekymringen handler om hvordan man kan sikre universell dekning av legemidler til bærekraftige priser, og hvordan man sikrer at offentlig betalere ansvarliggjøres. Det er etablert flere internasjonale initiativer som sikter på å forbedre transparens om pris og kostnader i markedet. Det har likevel i liten grad ført til åpenhet om rabatterte priser. World Health Assembly-resolusjonen fra 2019 oppfordrer til å forbedre åpenheten i markeder for legemidler, vaksiner og andre medisinske produkter. For å bidra til å følge opp resolusjonen tok Norge initiativ til å etablere Oslo Medicines Initiative (OMI). OMIs arbeid i perioden 2020–2022 ble avsluttet på den 72. sesjonen til WHOs regionale komité for Europa i Tel Aviv i Israel i september 2022. Arbeidet munnet ut i en intensjonserklæring om å etablere en plattform for samarbeid der man skal bli enige om løsninger og forbedre pasienttilgangen til nye, kostbare legemidler. Access to Novel Medicines Platform (NMP) er en samarbeidsplattform som sikter mot å gjøre det mulig for WHO-medlemsland, ikke-statlige aktører og andre partnere å samarbeide for å forbedre pasientenes tilgang. NMP har nedsatt fire arbeidsgrupper som jobber med problemstillinger innenfor solidaritet, bærekraft, transparens og antimikrobiell resistens i perioden 2024–2025.
Kartlegging av transparens i markedet
Oslo Medicines Initiative har kartlagt transparens i legemiddelmarkedet på tvers av 48 land. Vanlig praksis er at prisene er konfidensielle når det inngås avtaler for å få tilgang til legemiddelet. Som vist i figur 7.1. nedenfor fant OMI kun ett tilfelle med åpen pris. Dette var på Island.
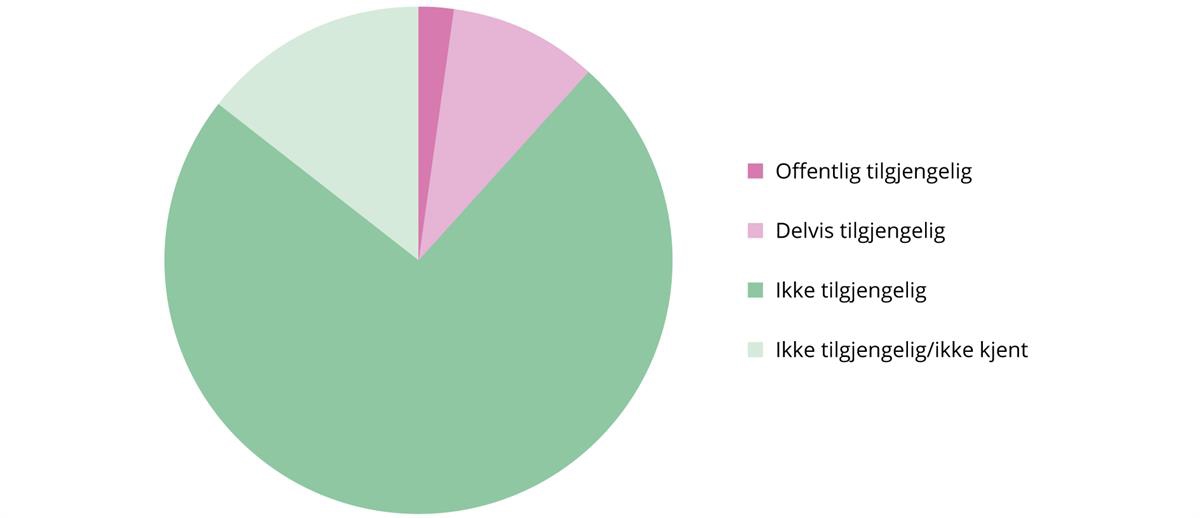
Figur 7.1 Funn fra kartleggingen av åpenhet om rabatterte priser i 42 land
Informasjon var delvis tilgjengelig i Tyskland, Norge, Polen og Sveits hvor noen avtaler om forhandlede priser ikke var konfidensielle. «Ikke relevant» gjelder noen land i øst-Europa og sentral-Asia som ikke har forhandlet avtaler.
Kilde: Oslo Medicines Initiative. Vår oversettelse.
Kartleggingen til Oslo Medicines Initiative avdekket at det generelt er åpen og tilgjengelig informasjon om maksimalpriser, markedsføringstillatelse og salgsstatistikk. Mindre åpent er informasjon om resultater fra kliniske studier. Her er det en rapporteringsskjevhet i at negative resultater ofte ikke blir rapportert, og det er ofte vanskelig å få oversikt over studier. Kartleggingen fant videre lavest grad av åpenhet om kostnader og rabatterte priser.
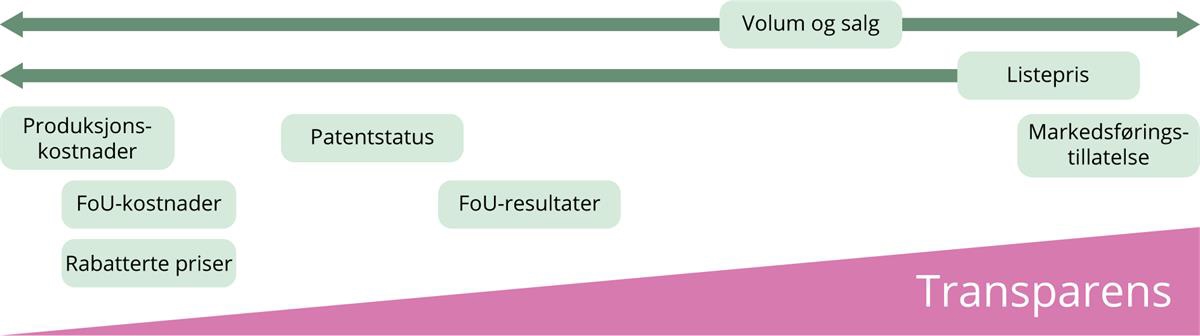
Figur 7.2 Funn fra kartleggingen av tilgang til annen informasjon
Kilde: Oslo Medicines Initiative. Vår oversettelse.
Det er en internasjonal praksis at nettopriser og alternative avtaler for legemidler holdes konfidensielt. Denne praksisen har ført til at det nå er lite nytteverdi i ekstern referanseprising basert på maksimalpriser. Industrien ønsker prisdiskriminering mellom land. Utfordringen er at man ikke vet hvordan dette praktiseres, og hvor store forskjellene er. Det finnes også eksempler på at lavinntektsland i noen tilfeller betaler en høyere pris enn høyinntektsland (OECD). Dette står i strid med hva man tenker er rettferdig prisdiskriminering. Det internasjonale idealet ser ut til å være full, eller mest mulig åpenhet. På den andre siden kommer også bekymringen om hvordan dette vil påvirke prisnivå og tilgang til legemidler for de ulike landene, til uttrykk. Den internasjonale litteraturen viser at det finnes svært lite kunnskap om konsekvensene av transparente priser i dagens legemiddelmarked. Faktiske erfaringer, økonomiske simuleringer og evidens fra andre industrier gir uklare og sprikende svar og har lav overføringsgrad til legemiddelmarkedet (Webb mfl. 2022; Barrenho & Lopert 2022).
Internasjonal litteratur skisserer usikre konsekvenser av åpne priser
European Observatory oppsummerer at i teorien vil åpne nettopriser mellom land føre til lavere priser gjennom mer effektive forhandlinger kombinert med praktisering av ekstern referanseprising. Andre økonomiske teorier taler for at åpenhet vil føre til høyere priser, mindre innovasjon og svekket tilgang, særlig for land med lave budsjettrammer. Ved at man har innsyn i de faktiske prisene på det tidspunktet man fastsetter prisen i eget land, kan prisene bli likere på tvers av land. Resultatet kan være at prisene blir lavere enn betalingsviljen i høyinntektsland og høyere enn betalingsviljen i lavinntektsland. Dette kan føre til forsinket tilgang i lavinntektsland (Ridley 2005, Berdud mfl. 2019). Leverandører analyserer det globale markedet kontinuerlig. Dersom de ser framtidig inntjening som svekket, kan det være en rasjonell handling å kutte i FoU-investeringer (Webb mfl. 2022).
Noen leverandører har uttrykt bekymring over at praksisen med verdibasert prissetting knyttet til metodevurdering, som gjelder i mange land, vil falle bort dersom åpne nettopriser kombinert med ekstern referanseprising innføres (Riccaboni 2020). Dette kan igjen føre til endringer i lansering og prisstrategi fra leverandørene som kan gi forsinket tilgang (Kyle 2007). Det kan også bli rasjonelt for flere myndigheter å avvente med å anskaffe til prisene har blitt lavere, noe som vil forsinke tilgangen.
Full åpenhet vil også kunne ha konsekvenser for generikamarkedet. Kombinert med ekstern referanseprising vil det kunne føre til at prisene blir for lave i noen land, noe som vil kunne medføre at leverandører trekker seg ut og sjeldnere går inn i generikamarkedet (Webb mfl. 2022).
Internasjonale anbefalinger om åpenhet
Med mange usikre faktorer rundt full åpenhet om nettopriser kan man vurdere andre grader av åpenhet selv om full åpenhet ikke er mulig. For eksempel kan informasjon om at det finnes konfidensielle avtaler, synliggjøres tydeligere (OECD 2018). Dette kan være nyttig informasjon for både betalere i andre land og offentligheten. Prisdeling mellom land kan også gjøres innenfor forhåndsdefinerte intervaller som ikke vil avsløre enhetsprisen. Webb mfl. (2022) foreslår å offentliggjøre rabatter og statistikk på aggregert nivå for å kunne gi offentligheten mer innsyn i hvor mye ressurser som brukes på legemidler. De foreslår også prisveiledning når det kommer konkurrerende legemidler, noe som er praksis i Norge. Til sist foreslås det også å gjøre andre deler av prosessen utenom selve prisen mer åpne. Norge etterstreber åpenhet i beslutningsprosessen generelt. Dette blir beskrevet nærmere i kapittel 11 og 12.
European Observatory kommer med noen overordnede anbefalinger om at politiske endringer og tiltak innenfor legemiddelsektoren bør ha tre mål: i) sikre tidsriktig og prisgunstig tilgang, ii) stimulere til innovasjon og iii) sikre finansielt bærekraftig prisnivå innenfor framtidens helsebudsjetter. For å oppnå dette må Europa samarbeide med sikte på felles forhandling og rettferdig prissetting. En nødvendig følge av transparente nettopriser er at det må etableres en rettferdig prispolitikk som tar hensyn til de ulike lands økonomi og kompetanse på området (Webb mfl. (2022).
Både European Observatory og OECD peker på flere sentrale punkter for å sikre utvikling på dette området:
- Utviklingen i felles initiativer og tiltak igangsatt i enkelte land for å nærme seg transparente priser må overvåkes nøye på tvers av landegrensene for å generere evidens.
- Tiltak for økt åpenhet bør være differensierte mellom ulike faser av legemiddelets livssyklus.
- Åpne priser vil endre forholdene og gi insentiver til økt aktivitet knyttet til parallell handel – dette må håndteres.
- Det trengs mer klarhet i hva åpne priser skal oppnå, og om det finnes andre løsninger som er mindre risikofylte.
- Man må bli enige om hvilken informasjon langs legemiddelkjeden det bør være åpenhet om.
- Det må undersøkes hvilken prisinformasjon som kan deles mellom land.
7.2 Internasjonale samarbeidsinitiativer
Det er etablert flere samarbeidsinitiativer mellom nasjonale myndigheter som skal styrke samarbeidet på området. Enkelte initiativer tar for seg informasjons- og erfaringsutveksling samt deling av offentlig prisinformasjon mellom landene, mens andre sikter på felles innkjøp og forhandlinger på utvalgte behandlingsområder. Et utvalg av initiativene er presentert i dette kapittelet.
European Integrated Price Information Database (EURIPID)
European Integrated Price Information Database (EURIPID) er en database etablert på tvers av land for å dele priser. Denne databasen har blant annet forenklet prosessen med å fastsette maksimalpriser basert på referansepriser ved å tilgjengeliggjøre og standardisere offentlig prisinformasjon. Norge benytter seg også av informasjon fra EURIPID i arbeidet med å fastsette maksimalpris. Det er imidlertid kun offentlige priser og volumtall som er en del av EURIPID-databasen. Det har foreløpig ikke vært mulig å inkludere konfidensielle priser i denne databasen.
Pharmaceutical Pricing and Reimbursement (PPRI)
PPRI var opprinnelig et forskningsprosjekt, medfinansiert av EU-kommisjonen. Det pågikk fra 2005 til begynnelsen av 2008. I løpet av prosjektet ble PPRI-nettverket etablert. Det er utviklet indikatorer knyttet til pris- og refusjonsinformasjon som kan sammenlignes mellom 27 PPRI-medlemsland. Landene har videre skrevet egne rapporter med landsspesifikk informasjon om det nasjonale legemiddelmarkedet (PPRI Pharma Profiles). Både disse og ulike kartlegginger og forskningsartikler er offentlig tilgjengelig.
I dag er PPRI et nettverks- og informasjonsdelingsinitiativ som tar for seg aktuelle spørsmål om legemiddelpolitikk. PPRI-nettverket inkluderer representanter fra rundt 90 institusjoner, nasjonale myndigheter fra 52 land (hovedsakelig europeiske land, inkludert alle 27 EU-medlemslandene) i tillegg til europeiske og internasjonale organisasjoner, blant annet EU-kommisjonen, OECD, WHO og Verdensbanken. PPRI er tilknyttet farmakoøkonomiavdelingen i Østerrikske nasjonale folkehelseinstitutt (Gesundheit Österreich GmbH – GÖG). Avdelingen er også WHOs samarbeidssenter for farmasøytisk prissetting og refusjonspolitikk (WHO Collaborating Centre for Pharmaceutical Pricing and Reimbursement Policies).
Nordisk samarbeid – felles prisforhandlinger og anbud
Et styrket nordisk samarbeid på legemiddelområdet ble foreslått i Könberg-rapporten fra 2014 Det framtida nordiskahälsosamarbetet. For å følge opp forslaget besluttet ministrene i 2015 å sette ned en nordisk arbeidsgruppe som skulle kartlegge erfaringene i de nordiske landene på legemiddelområdet og se på eventuelle samarbeidsmuligheter framover. Arbeidsgruppen ble ledet av Danmark.
Noe av bakgrunnen for at flere ønsket et tettere samarbeid på legemiddelområdet, er at legemiddelmarkedet har utviklet seg i retning av å ha svært høye priser, og at industrien i mange tilfeller er villige til å forhandle for å redusere prisene, men krever at eventuelle rabatter er konfidensielle.
Under Norges formannskap i Nordisk ministerråd i 2017 ble det vedtatt en nordisk arbeidsgruppe for informasjons- og erfaringsutveksling om pris og refusjon på legemiddelområdet (WGEMA). Det ble opprettet grupper for horizon scanning, prissammenligninger, risikodeling samt legemiddelberedskap/legemiddelmangel under WGEMA.
I 2018 og 2019 ble det inngått intensjonsavtaler mellom Norge, Danmark og Island. Avtalene er ment å styrke det nordiske legemiddelsamarbeidet, sikre forsyningen av etablerte forsyningskritiske legemidler og sørge for at nye effektive legemidler innføres raskt til en rimelig pris.Avtalen åpner for at landene kan føre felles forhandlinger eller ha felles anbud. Med utgangspunkt i intensjonsavtalene er det gjennomført to nordiske anbud. Anbudene omfattet legemidler i fase 5 og 6 av legemiddelets livssyklus, der hvor det er monopol eller så få leverandører at man er på vei inn i en monopolsituasjon. Nordisk legemiddelforum ble stiftet i 2015 med medlemslandene Island, Norge, Sverige, Finland og Danmark. Forumet har blant annet en felles strategi om innovativt samarbeid om anskaffelser og felles nordiske anskaffelser og deler kunnskap innenfor flere områder. Forumet har laget felles retningslinjer for hvordan pris på nye legemidler skal forhandles sammen. Undergruppen Nye dyre legemidler har til nå gjennomført to felles prisforhandlinger gjennom FINOSE.
Valletta Declaration
Valletta Declaration er en avtale mellom noen søreuropeiske land med intensjon om å dele nettopriser, uten å oppgi hvilket land som har hvilken pris.
Forordning (EU) 2021/2282 om metodevurderinger
Forordning (EU) 2021/2282 gir regler om europeisk samarbeid om metodevurderinger for legemidler og medisinsk utstyr. Det legges blant annet opp til en felles vurdering av klinisk relativ effekt for legemidler med nye virkestoffer og innenfor nye terapiområder som godkjennes gjennom sentral prosedyre, og for noen typer medisinsk utstyr i de høye risikoklassene, jf. forordningens artikkel 1. I forordningens fortale framheves transparens og offentlighetens kunnskap om prosessene som avgjørende. Forordningen framholder likevel at forretningshemmeligheter skal beskyttes, se fortalens punkt 29 og 41.
Utfordringer med internasjonalt samarbeid
Initiativer for felles forhandlinger og anskaffelser møter barrierer i form av nasjonale lovverk, ulikheter i standardbehandling og klinisk praksis mellom landene, system for metodevurdering, finansieringsløsninger og betalingsvilje. Det er utfordrende å samarbeide om pris siden konfidensialiteten står så sterkt i alle land, og fordi de ulike landene kan ha ønske om ulike beslutninger basert på like vilkår. I felles forhandling innenfor Nordisk legemiddelforum står det i retningslinjene at det skal framforhandles én pris. Beslutninger om finansiering tas nasjonalt, noe som kan medføre at et land ønsker å si ja og et annet land ønsker å takke nei til finansiering av legemiddelet til den framforhandlede prisen. De fleste initiativer handler derfor om å samle og dele erfaringer, legge felles strategi og ha kjennskap til hverandres systemer for vurdering og beslutning.
7.3 Erfaringer fra andre land
Ekspertgruppen har hatt samtaler med representanter fra flere land og alle opplever tilsvarende utfordringer som Norge. De forteller om utfordringer med konfidensielle priser og konsekvensen av dette, utfordringer med svakere dokumentasjonsgrunnlag og debatt rundt prosess og medvirkning. De ulike landene har ulike organisatoriske løsninger for å sørge for en åpen og transparent prosess, uten at vi kan peke på noen spesifikk løsning som det aller beste alternativet.
I landsanalysen og samtaler med representanter fra andre land trekkes det fram at slik situasjonen er med konfidensielle priser, blir det svært viktig å ta i bruk andre tilnærminger for å styrke legitimiteten og oppnå tillit. I flere land har mange særlig prioritert å inkludere brukernes eller innbyggernes erfaringer og perspektiver i vurderingene og i beslutningsprosessen. Ekspertgruppen har fått utført en landsanalyse for å synliggjøre ulike alternativer og grad av åpen deltakelse, som er beskrevet i vedlegget.
Danmark
Medicinrådet er et uavhengig råd som gir anbefalinger om hvilke nye legemidler det skal være mulig å bruke som standardbehandling i sykehusene i Danmark. Medicinrådet blir oppnevnt av de fem danske regioner. De utarbeider behandlingsveiledninger og anbefalinger for bruk av legemidler i danske sykehus, med anbefalinger om valg mellom likeverdige legemidler, basert på pris.
Rådet utgjør den øverste ledelsen av Medicinrådet og består av 17 medlemmer og 4 observatører. Rådet vurderer om det er et rimelig forhold mellom den kliniske verdien og kostnadene ved behandling med legemiddelet. De fleste rådsmedlemmene er leger i ledende stillinger i sykehus. Rådet har også to helseøkonomer, to kliniske farmakologer, to pasientrepresentanter og en representant for sykehusapotekene. De 17 medlemmene har stemmerett. Rådet har som mål i hver sak å komme fram til konsensus. Rådets anbefalinger er endelige og kan ikke ankes eller prøves av en annen administrativ myndighet. Etter anbefaling er det opp til hver enkelt region å implementere anbefalingene.
De to pasientrepresentantene utpekes av Danske Patienter, som er en paraplyorganisasjon som de fleste danske pasientorganisasjonene er medlem i. Pasientrepresentantene opptrer i henhold til de samme vurderingskriterier som de øvrige medlemmene.
Det finnes svært mange faste fagutvalg som er underlagt rådet (p.t. 55) og dekker ulike medisinske fagområder. Fagutvalgene deltar i å utrede de enkelte sakene Medicinrådet skal ta stilling til, og i å utarbeide behandlingsveiledninger.
Medicinrådet har besluttet at alt arbeid i rådet, inkludert arbeidet i fagutvalg, som et minimum er underlagt samme habilitetsregler som beskrevet i forvaltningsloven.
I 2016 besluttet det daværende Sundheds- og Ældreministeriet at det skal være størst mulig åpenhet i prosessene, metodene, kriteriene og det materialet som utarbeides for å vurdere legemidler. Anskaffelser av legemidler gjøres gjennom det offentlig eide innkjøpsselskapet Amgros. Selskapet åpner for at man kan behandle åpenhet/fortrolighet ulikt avhengig om det dreier seg om anbudsprosesser eller direkte anskaffelse av nye og innovative legemidler:
Som hovedregel anser Amgros ikke avtalepriser i inngåtte avtaler om kjøp av legemidler etter anbud som konfidensielle. Gjeldende avtalepriser blir dermed publisert på Amgros’ leverandør- og anbudsportal. Leverandøren kan likevel be om at prisene ikke blir offentliggjort, og da gjør Amgros en vurdering av det konkrete tilfellet. Ved direkte anskaffelser av nye og innovative legemidler er konfidensialitet en del av forhandlingene om prisnivå og kontraktsforhold.
I Danmark hadde de en periode med åpne priser. Amgros beskriver det slik:
I 2013 og 2014 begyndte de nye og dyrere lægemidler at bliver introduceret i Danmark. Amgros blev udfordret i den dialog der var med firmaerne. Ved at tilbyd «ikke offentliggjorte priser» kunne vi får væsentlig bedre rabatter end hvis priserne var tilgængelige på Amgros leverandør portal. Derfor blev der indført forhandlede aftaler baseret på en profylaksebekendtgørelse § 80,3 med ikke offentliggjorte priser (uttalelse til ekspertgruppen fra Amgros, 2023).
England og Wales
I England er det The National Insititute for Health and Care Excellence (NICE) som har ansvaret for metodevurderinger og retningslinjer. Selve metodevurderingen utføres av uavhengige komitéer (Technology Appraisal Committee), som også har beslutningsmyndighet innenfor gitte rammer. De må forholde seg til prioriteringskriteriene og en fastsatt betalingsvilje som er offentlig kjent. Komiteen etterstreber konsensus, men kan stemme dersom det er nødvendig. National Health Service (NHS) i England er forpliktet til å implementere beslutningene innen tre måneder.
Komiteens medlemmer oppnevnes for tre år om gangen og rekrutteres fra NHS, pasient- og brukerorganisasjoner, akademia og industrien. Det er 24 medlemmer i en komité, og det finnes fire komiteer om gangen. De har en konsulterings- og kommenteringsrunde hvor andre aktører inviteres til å gi bidrag og kommentere på evidensgrunnlaget. De som er definert som konsulterende organisasjoner, kan anke komiteens beslutninger. Ankemuligheten er strengt regulert og gjelder kun for to bestemte grunnlag:
- NICE har
- ikke opptrådt rettferdig, eller
- overskredet sine fullmakter
- Anbefalingen er urimelig i lys av dokumentasjonsgrunnlaget.
Det holdes virtuelle møter som offentligheten kan observere.
England har også Citizen Council (NICE u.å), som består av brukere eller innbyggere som bringer sine perspektiver, erfaringer og innsikt til diskusjoner og beslutningsprosesser knyttet til helsetjenester. Formålet med disse rådene er å involvere innbyggerne i evalueringen av helseteknologier, behandlinger og tjenester og å sikre at offentlige meninger og verdier tas i betraktning når de gir anbefalinger eller tar beslutninger om helsepolitikk og praksis. Medlemmer av Citizen Councils deltar i diskusjoner, deler sine synspunkter og gir innspill om helseproblemer for å hjelpe NICE med å komme med mer informerte og inkluderende anbefalinger.
Generelt er England mer restriktive i sin kommunikasjon om priser og IKER enn Norge. Under forhandlinger har de mindre konkret veiledning om den faktiske IKER til leverandøren det gjelder, og klinikerne har som regel ikke innsyn i prisene. England har også en mer komplisert prismodell enn Norge, noe som gjør det krevende å holde oversikt.
England kan sies å ha en mer åpen prosess og bredere representasjon i beslutningene enn Norge. De rapporterer om gode erfaringer med dette.
Skottland
I Skottland er det The Scottish MedicinesConsortium (SMC) som metodevurderer nye legemidler og gir råd til NHS Scotland. De holder åpne virtuelle møter hvor publikum kan observere møtene der gruppen vurderer nye legemidler for bruk innenfor NHS Scotland (NHS u.å).Vanligvis kan enkeltpersoner eller representanter fra pasientgrupper, farmasøytiske selskaper, helsepersonell eller andre interessenter som er interessert i resultatet av disse evalueringene, be om virtuell observasjonstilgang. De oppgir selv at virtuell observasjon bidrar til å fremme åpenhet, slik at interessenter kan forstå begrunnelsen bak SMC-beslutninger og hensynene involvert i å godkjenne eller avvise nye legemidler. Det gir også en mulighet for større engasjement og bevissthet blant interesserte parter om evalueringsprosessen av nye legemidler av SMC.
Nederland
I Nederland er det Zorginstituut Nederland (ZN) som utfører metodevurderinger og til slutt gir regjeringen råd om legemiddelet bør inkluderes i standard helseforsikringspakke. Scientific Advisory Board (WAR) er et rådgivende organ som består av 50 uavhengige eksperter som gir råd til ZN når de utfører metodevurderinger. Det er regjeringen som beslutter om legemidler skal innføres eller ikke, og beslutningen må i tillegg godkjennes av parlamentet. Under metodevurderingsprosessen arrangeres et offentlig møte hvor utvalgte interessenter kan gi innspill. Hensikten er å sikre at relevante hensyn tas med i vurderingen. Når det gjelder priser, er de mindre transparente enn Norge. Klinikere har ikke innsyn i prisene. Likevel har man i enkelte tilfeller gått ut offentlig med et konkret motbud til leverandører når forhandlinger om krevende saker har stoppet opp.
Sverige
I Sverige er det Tandvårds- ochläkemedelsförmånsverket (TLV) som utfører metodevurderinger, og Rådet för nya terapier (NT-rådet) som gjennomfører prisforhandlinger og gir veiledning om innføring av legemidler til de 20 regionale landstingene. I Sverige har de et Prioriteringscentrum ved Linköpings universitet, som finansieres av departementet. Dette er et tverrfaglig miljø som arbeider aktivt for åpen prioritering i helsetjenesten. De holder konferanser, er med i debatten og kan bistå lokale institusjoner ved prioriteringsspørsmål. De har utviklet flere modeller for å understøtte gode prioriteringer. Dette arbeidet har ført til større oppslutning på konferanser og har bidratt til å rette oppmerksomhet mot prioritering i det offentlige rom og blant helsepersonell.