Del 2
Kriterier og måling
7 Overordnede kriterier for prioritering
Et prioriteringskriterium beskriver hvordan ulike tiltak bør rangeres når det gjelder å få ressurser for å bli gjennomført. Et prioriteringskriterium er med andre ord en type regel, og iblant brukes begrepene prinsipp eller vilkår synonymt med kriterium. Et overordnet kriterium er ment å være anvendbart på mange områder og i mange ulike situasjoner og kan begrunne mer spesifikke kriterier.
Selv om et kriterium regnes som relevant, trenger det ikke å være absolutt og veie tyngre enn alle andre hensyn.
7.1 Dagens overordnede kriterier
Mandatet ber utvalget «vurdere om kriteriene fra Lønning II tilfredsstiller dagens prioriteringsutfordringer». De kriteriene som i dag gjelder for prioritering i norsk helsetjeneste, er:
Nyttekriteriet
Alvorlighetskriteriet
Kostnads-effektivitetskriteriet
Lønning II-utvalget foreslo at disse kriteriene skulle gjelde for hele helsetjenesten. I dag er kriteriene imidlertid bare lov- og forskriftsfestet på visse områder av helsetjenesten, slik det er beskrevet i kapittel 5.
7.2 Nye og konkrete kriterier
Utvalget mener dagens kriterier i hovedsak er gode. Utvalget mener like fullt at prioriteringsarbeidet i norsk helsetjeneste kan styrkes av ny terminologi og oppdeling, noe endret innhold og mye større grad av konkretisering av hva kriteriene skal bety i praksis.
Utvalget foreslår følgende overordnede kriterier:
Helsegevinstkriteriet
Ressurskriteriet
Helsetapskriteriet
Disse hovedkriteriene bør alltid ses i sammenheng med hverandre og er ment å være relevante for hele helsetjenesten. Dette betyr at de er ment å danne utgangspunkt for prioritering i svært ulike beslutningssituasjoner. Blant annet er de ment å kunne veilede både beslutningstakere på nasjonalt ledelsesnivå og helsepersonell i deres kliniske arbeid. Kriteriene er videre ment å kunne bistå i vurderingen av både nye og eksisterende tiltak. Når kriteriene skal anvendes, er det svært viktig med god dokumentasjon. Dette blir diskutert separat.
Utvalget mener de tre foreslåtte kriteriene dekker de relevante hensyn i de fleste beslutningssituasjoner. For å sikre likebehandling og konsistens på tvers av beslutningssituasjoner, bør kriteriene brukes gjennomgående. Kriteriene dekker imidlertid ikke alle relevante hensyn i alle situasjoner. I enkelte tilfeller kan det være riktig å gå utover det de tre hovedkriteriene anfører. Det er da viktig at dette ikke gjøres på en måte og med en hyppighet som fører til vilkårlig forskjellsbehandling.
7.2.1 Terminologi
De tre kriteriene er ment å framstå som klart avgrenset fra hverandre. Blant annet kan det bidra til å unngå forvirring og problemer rundt forholdet mellom et nyttekriterium og et kostnads-effektivitetskriterium. Ved å erstatte begrepene nytte og kostnadseffektivitet er også hvert enkelt kriterium ment å framstå som mer forståelig, særlig for helsepersonell og for folk flest. Utvalget mener helsegevinst er mer gjenkjennelig enn nytte, og at store deler av befolkningen ikke er fortrolig med det tekniske begrepet kostnadseffektivitet. I tillegg forbindes kostnad gjerne med penger, noe som legger for liten vekt på betydningen av ikke-finansielle ressurser som tid, helsepersonell, sengeplasser og medisinsk utstyr. Et ressurskriterium kan derfor framstå som aktuelt for en større andel av faktiske prioriteringsbeslutninger. Når det gjelder helsetapskriteriet, er helsetap mindre brukt enn alvorlighet, men er mer dekkende for det innhold kriteriet blir gitt nedenfor. Alvorlighet kan også virke forvirrende når man vurderer prognose ut fra dagens eksisterende behandling. Alvorlighet, slik det ofte blir forstått, fanger normalt heller ikke opp betydningen av forebyggende tiltak mot tilstander som kan gi stort helsetap.
Kriteriene må ha navn som oppleves som relevante for det innhold, den begrunnelse og den funksjon de har. Utvalget mener dessuten at i valg av terminologi bør man velge begreper som er lett forståelige, og som oppleves som relevante også for beslutningstakere på klinisk nivå og i befolkningen. Disse gruppene, sammenliknet med beslutningstakere på politisk og administrativt nivå, har gjerne mindre tid til å sette seg inn i prioriteringsfeltet, mindre kjennskap til helseøkonomiske begreper og ser ofte ikke på kostnader som umiddelbart relevante for prioriteringsbeslutninger.
7.2.2 Behovet for konkretisering
Siden Lønning II-utvalget leverte sine anbefalinger for sytten år siden, har helsetjenesten og samfunnet endret seg mye. I løpet av disse årene har flere utfordringer ved dagens tre overordnede kriterier blitt tydelige. De samme utfordringene gjelder for de tre kriteriene som utvalget foreslår, og de er knyttet til følgende tre hovedspørsmål:
Hvordan bør hvert av de tre kriteriene konkretiseres? Her er det særlig to underspørsmål som melder seg:
Hvordan bør det sentrale begrepet i kriteriet forstås og måles? Med andre ord, hvordan bør vi spesifisere og måle helsegevinst, ressursbruk og helsetap?
Hva bør være det presise forholdet mellom den valgte spesifikasjonen og prioritet? Med andre ord, hvordan bør tiltakets prioritet endres, når henholdsvis helsegevinst, ressursbruk og helsetap endres?
Hvordan bør de ulike kriteriene avveies mot hverandre?
Hvilke andre kriterier, om noen, er relevante?
De to første hovedspørsmålene vil langt på vei bli forsøkt besvart i dette kapittelet, mens det tredje blir drøftet i kapittel 8. Spørsmål knyttet til måling mer direkte blir behandlet i kapittel 10. Hvordan kriteriene kan brukes i ulike konkrete situasjoner, vil bli nærmere beskrevet i kapittel 9.1
7.3 Helsegevinstkriteriet
Tiltak i helsetjenesten har som mål å bedre folks helse og velferd. Velferdsgevinsten et individ får fra bedret helse kan kalles en helsegevinst. Tiltak i helsetjenesten kan gi velferdsgevinster også på andre måter.
Ifølge helsegevinstkriteriet øker et tiltaks prioritet med forventet helsegevinst (og annen relevant velferdsgevinst fra tiltaket). Det betyr at desto større disse gevinstene er, desto høyere blir tiltaket prioritert, annet likt. Helseforbedringer og helsegevinster er vektlagt også innenfor dagens rammeverk for prioritering, ofte ved bruk av begrepene effekt eller nytte. Lønning II-utvalget vektla nytte i nyttekriteriet og i kostnadseffektivitetskriteriet, eller det som også kan kalles kostnad-effektkriteriet. Videre påpeker pasientrettighetsloven at en pasient har rett til nødvendig helsehjelp fra spesialisthelsetjenesten bare dersom «pasienten kan ha forventet nytte av helsehjelpen, og kostnadene står i rimelig forhold til tiltakets effekt». Prioriteringsforskriften viser til de samme kravene og slår fast at med forventet nytte menes «at det foreligger god dokumentasjon for at aktiv medisinsk eller tverrfaglig spesialisert behandling kan bedre pasientens livslengde eller livskvalitet med en viss varighet, at tilstanden kan forverres uten behandling eller at behandlingsmuligheter forspilles ved utsettelse av behandlingen».
Utvalget mener at det i formuleringen av overordnede kriterier er hensiktsmessig å vektlegge helsegevinst, blant annet fordi nytte har svært mange ulike konnotasjoner, og fordi ordet er vanskelig å forstå for mange. Det er også flere grunner til at beslutningstakeren gjerne kan vurdere helsegevinstkriteriet først av de tre hovedkriteriene. Helsegevinster er blant annet helt sentralt i helsetjenestens målsetninger, og det finnes ofte nokså presis faglig kunnskap om forventet helsegevinst fra ulike tiltak. Det er også et grunnleggende krav om at forventet helsegevinst må være større enn null for at tiltaket skal kunne bli anbefalt gjennomført. Dersom dette ikke er tilfelle, trenger ikke beslutningstakeren å gå videre og vurdere andre aspekter ved tiltaket som ressursbruk og helsetap.
7.3.1 Helsegevinst som overordnet begrep
Helsegevinstkriteriet er opptatt av virkningene eller effektene av et tiltak, dvs. det som følger av gjennomføringen av et tiltak. Mer spesifikt er kriteriet opptatt av velferdsvirkningene av tiltak. Begrepet velferd har blitt tillagt ulike betydninger og blir regnet som tett knyttet til blant annet levekår, livskvalitet, velvære og lykke, og knyttes også ofte helt eller delvis til preferansetilfredsstillelse (Griffin 1986; Sen 1987; Dolan og Kahneman 2008). Siden ulike individer kan ha ulike preferanser når det gjelder helseforbedringer, brukes gjerne gjennomsnittlige preferanser i beregningen av helsegevinster, samtidig som andre typer variasjon blir tatt hensyn til (Gold et al. 1996; Drummond et al. 2005; Brazier et al. 2007). I dette kapittelet vil en slik framgangsmåte bli lagt til grunn.
Helsegevinsten fra et tiltak er den velferdsøkningen individer får som følge av at de selv får bedret helse. Siden tiltak i helsetjenesten i hovedsak påvirker velferd gjennom helseforbedringer, bør helsegevinster stå sentralt ved prioritering. Slike gevinster skapes særlig via to konsekvenser av bedret helse: økt levetid og økt livskvalitet.
Levetid
Den økningen i levetid som skriver seg fra et tiltak, kan beskrives i antall ekstra leveår, eventuelt måneder eller dager, som kommer til. Anslag om økt levetid er som regel basert på kunnskap om absolutt risikoreduksjon for død i en gitt periode. Slik risikoreduksjon står sentralt både i klinikernes bevissthet og i vitenskapelig studier.
Livskvalitet
Mange av tiltakene som gjennomføres i helsetjenesten, har ikke som primært mål å forlenge levetiden, men derimot å bedre livskvalitet gjennom bedre helse. Slike helseforbedringer inkluderer både bedring i fysisk og psykisk funksjon og reduksjon i visse symptomer, inkludert smerte. Økning i livskvalitet som følger av endring i helse, beskrives gjerne som økning i helserelatert livskvalitet.
Begrepene helseforbedring og helserelatert livskvalitet kan reise spørsmål om den presise definisjonen av helse. Definisjonene av helse og sykdom har vært mye diskutert i flere tiår uten at det har resultert i noen bred enighet (Murphy 2008). Utvalget tar utgangspunkt i en forståelse av helse som er smalere enn Verdens helseorganisasjons (WHO) definisjon: «Helse er en tilstand av fullkommen fysisk, psykisk og sosialt velbefinnende og ikke bare fravær av sykdom eller lyte» (WHO 1948). Dersom WHOs definisjonen legges til grunn, blir det uklart hvordan helse skiller seg fra begreper som velferd, velvære og livskvalitet generelt.
Ulike helsetilstander berører ulike helsedimensjoner, slik som mobilitet, hørsel, syn, smerte, angst og depresjon. En bedring i ett eller flere av disse forholdene vil utgjøre en helseforbedring. For å kunne sammenlikne ulike tiltak må vi som regel også kunne sammenlikne og eventuelt sammenstille ulike helseforbedringer. Et tiltak kan gi økt mobilitet og redusert smerte, mens et annet reduserer angst og depresjon. I slike tilfeller kan det være vanskelig eller umulig å si hvilket tiltak som gir den største endringen i helse per se, men man kan si noe om hvilken endring som normalt gir størst helsegevinst, dvs. størst velferdsøkning fra helseforbedringene.2
Sammenstilling av levetid og livskvalitet
Mange tiltak påvirker både levetid og livskvalitet. Behandling av kronisk hjertesvikt, for eksempel, øker gjerne både forventet levetid og mobilitet.
I mange situasjoner ønsker vi å sammenlikne tiltak, enten for én enkelt pasient eller pasientgruppe eller for ulike pasienter eller pasientgrupper. Ofte vil ikke alle tiltakene vi sammenlikner, kun påvirke levetid eller kun påvirke livskvalitet.3 I slike tilfeller er det svært hensiktsmessig med et generelt mål på helsegevinst som integrerer gevinster knyttet til levetid og livskvalitet. Gode leveår er en slik måleenhet.
Gode leveår er i seg selv et rommelig begrep og er ikke knyttet til en bestemt metode for å sammenstille gevinstene fra økt levetid og økt livskvalitet eller for å beregne antall gode leveår fra ulike tiltak. Mulige metoder beskrives nærmere i kapittel 10.
Det er flere kjente utfordringer knyttet til det å integrere gevinster fra økt levetid og økt livskvalitet i ett felles begrep eller mål (Brazier et al. 2007; Nord et al. 2009). Utvalget mener like fullt at gevinstene fra økt levetid og økt livskvalitet kan kombineres tilstrekkelig godt til at en sammenstilling vil være nyttig både i form av et generelt begrep og i form av spesifikke mål. Beslutningstakere i helsetjenesten har dessuten alltid foretatt, og vil alltid måtte foreta, avveininger mellom gevinster fra økt levetid og økt livskvalitet. Utvalget mener derfor at gode leveår bør være det overordnede begrepet for helsegevinst og et kjernebegrep i helsetjenesten. Samtidig er det viktig å være oppmerksom på begrensningene i begrepet og i de spesifikke målemetodene for gode leveår. Når gode leveår skal måles, er det mange detaljer knyttet til kombinasjonen av levetid og livskvalitet som er kontroversielle. Flere av disse detaljene er drøftet i kapittel 10.
7.3.2 Helsegevinster for andre
For de fleste tiltak i helsetjenesten kommer de største helsegevinstene hos de umiddelbare målindividene, dvs. pasientene. Helsegevinstkriteriet vil derfor i stor grad handle om helsegevinster for disse pasientene, det vi kan kalle direkte helsegevinster. Mange tiltak vil også gi opphav til helsegevinster for andre enn pasientene, noe vi kan kalle indirekte helsegevinster. To parter eller grupper er særlig aktuelle: pårørende og samfunnet for øvrig.4
Helsegevinster for pårørende
Helsegevinster for pårørende skyldes at de selv får bedret sin helse. Bedre helse for pårørende følger som regel fra helseforbedringer hos tiltakets umiddelbare målgruppe, men det kan også skyldes andre aspekter ved tiltaket. Flere initiativ i det siste har rettet oppmerksomheten mot pårørendes helse og livssituasjon.
Pasienters helse kan påvirke helsen til pårørende på ulike måter (Wittenberg og Prosser 2013). Blant annet kan pårørendes helse reduseres ved at a) belastningen ved å hjelpe og støtte pasienten blir for stor. Dette kan være tilfellet for pårørende til barn med alvorlige funksjonshemninger, til personer med rusproblemer og til eldre med demens; b) ved at belastningen ved å oppleve at pasienten lider eller står i fare for å dø, blir for stor; og c) ved at pasienten ikke kan oppfylle sine omsorgsoppgaver for pårørende fullt ut, noe som særlig kan gjelde pasienter med små barn. En fjerde måte helsen til en pasient kan påvirke helsen til pårørende på, er gjennom smitte. Det vil bli drøftet nærmere nedenfor. Det bør nevnes at de tre mekanismene a)–c) også kan påvirke velferden til pårørende uten å føre til redusert helse.
Tiltak i helsetjenesten kan også påvirke helsen til pårørende mer direkte, dvs. uavhengig av eventuell helseforbedring hos pasienten. Det kan særlig være tilfelle ved blant annet avlastningstiltak og tiltak som innbefatter informasjon og veiledning for pårørende.
Helsegevinster for samfunnet for øvrig
Tiltak i helsetjenesten kan gi helsegevinster også for samfunnet for øvrig, dvs. de individene som hverken er del av den umiddelbare målgruppen eller er pårørende.
Som allerede nevnt kan tiltak i helsetjenesten gi opphav til slike helsegevinster ved å redusere smittbarhet i den umiddelbare målgruppen. Tiltak kan også gi helsegevinster for samfunnet for øvrig ved å redusere bruken av tobakk og rusmidler i denne gruppen eller ved å behandle den umiddelbare målgruppen på en måte som reduserer antibiotikaresistens i samfunnet. Noen tiltak kan dessuten gi spesielt store bidrag til forskning og læring og dermed helsegevinster for andre i framtiden.
Betydning av helsegevinster for andre
Hvordan indirekte helsegevinster bør påvirke prioriteringer, har vært nokså mye diskutert (Gold et al. 1996; Brock 2003; Lippert-Rasmussen og Lauridsen 2010). Flere nasjonale og internasjonale retningslinjer anbefaler at slike indirekte effekter blir inkludert i vurderingen av tiltak (Gold et al. 1996; Finansdepartementet 2005; Helsedirektoratet 2012b; NICE 2013).
Det er flere, gode grunner til at indirekte helsegevinster bør være inkludert i helsegevinstkriteriet. En grunn er at helsegevinster hos andre enn tiltakets umiddelbare målgruppe er like reelle. I tillegg er det slik at den offentlige helsetjenesten bryr seg, og skal bry seg, om helsen til hele befolkningen. Dette understøttes av at et hovedmål for helsetjenesten er flest mulig gode leveår for alle, rettferdig fordelt. I tillegg er det å legge vekt på helsegevinster for andre i tråd med allmenne oppfatninger. De fleste vil mene at om et tiltak kan hindre smitte og på den måten hindre sykdom hos andre enn den umiddelbare målgruppen, vil det være svært relevant. Dette indikerer at indirekte gevinster bør kunne påvirke prioriteringer.
Utvalget mener imidlertid at det er to viktige begrensninger knyttet til indirekte helsegevinster i prioriteringssammenheng. En ren praktisk begrensning gjelder de tilfeller der slike gevinster i utgangspunktet ikke kan forventes å ha noen faktisk innvirkning på prioriteringer. I slike tilfeller er det en nyttig forenkling at beslutningstakeren ikke forsøker å beregne indirekte helsegevinster, men i stedet konsentrerer seg om helsegevinstene for pasientene.
Den andre begrensningen vil gjelde også indirekte helsegevinster som er betydelige og i den grad kan påvirke prioriteringer. Selv om slike helsegevinster i utgangspunktet er relevante, mener utvalget at deres innflytelse på prioriteringer bør begrenses dersom det å ta hensyn til dem vil gi opphav til urettferdige fordelingsvirkninger. Blant annet bør beregningen av helsegevinster for pårørende justeres slik at prioriteringen av pasienter eller pasientgrupper ikke avhenger av antall pårørende. Mange vil oppleve det som urettferdig dersom en pasient eller pasientgruppe får lavere prioritet enn en annen kun fordi den første har færre pårørende. Det vil særlig gjelde tilfeller der det å ha få pårørende i seg selv kan oppleves som en ulempe. Dersom denne ulempen forårsaker lavere prioritet, vil pasienten få en dobbel ulempe («double jeopardy») (Singer et al. 1995). I slike tilfeller kan betydningen av antall pårørende reduseres ved å forutsette et bestemt antall pårørende for alle pasienter (for eksempel et gjennomsnitt) og videre anta at hver av disse får den helsegevinsten som pårørende i gjennomsnitt får fra tiltaket (Basu og Meltzer 2005).
7.3.3 Øvrige gevinster
I tillegg til helsegevinster, kan tiltak i helsetjenesten gi opphav til øvrige gevinster.5
Varianter av øvrige gevinster
Det finnes mange ulike typer øvrige gevinster. Selv om flere av disse gevinstene kan tilfalle flere ulike parter, kan det være nyttig å dele dem inn etter hvilken part de typisk tilfaller. Her kan vi igjen skille mellom pasienter, pårørende og samfunnet for øvrig. Mange av disse gevinstene kan være utfordrende å måle. Det finnes også gevinster som er tett knyttet til selve finansieringen av tiltaket. Offentlig framfor privat finansiering av et tiltak kan for eksempel gi gevinster i form av redusert finansiell belastning for de som trenger tiltaket (WHO 2014b).
Øvrige gevinster for pasient
Tiltak innenfor helsetjenesten kan gi velferdsgevinster for en pasient uten at det skyldes helseforbedring hos henne eller han. Slike gevinster kan for eksempel komme fra informasjon. Diagnostiske tiltak kan iblant frambringe informasjon som gir den umiddelbare målgruppen velferdsgevinster uavhengig eventuelle helseforbedringer. Informasjon om prognose for eksisterende sykdom og debut av framtidig sykdom kan gi slike gevinster ved at folk bedre kan planlegge sine liv. Diagnostiske tiltak eller informasjonskampanjer kan også gi velferdsgevinster gjennom redusert bekymring.6 Det er imidlertid svært viktig at reduksjon av mild bekymring ikke blir tillagt for stor vekt vis-à-vis andre gevinster, og at det tas hensyn til at diagnostiske tiltak og informasjon også kan gi økt bekymring.
En annen type øvrig gevinst er knyttet til verdighet. Dette er et begrep det er vanskelig å definere presist, men det er allment akseptert at verdighet er helt sentralt, særlig i livets sluttfase. Visse tiltak i helsetjenesten kan fremme en mer verdig avslutning på livet uten at de er forventet å gi noen helseforbedring. Slike tiltak kan være spesielt tilrettelagte omgivelser og økt bruk av støttepersonell.
En tredje type øvrig gevinst dreier seg om fysiske eller psykiske endringer utover det nivået som representerer det å være frisk. Slike endringer vil som regel ikke regnes som endringer i helse. Det klassiske eksempelet her er gevinster fra ren kosmetisk kirurgi. Andre foreslåtte eksempler knytter seg til erektil dysfunksjon og behandling for hårtap hos eldre. I framtiden er det dessuten ventet flere nye behandlinger som kan heve fysisk yteevne og kognitivt funksjon hos friske, iblant kalt «enhancement», og relevansen av slike øvrige gevinster vil da bli et enda viktigere tema for helsetjenesten.
Øvrige gevinster for pårørende
Pårørende kan få øvrige gevinster blant annet som et resultat av helseforbedringer hos pasienten. Generelt skyldes det at nedsatt helse hos pasienten ofte medfører belastninger og ulemper for pårørende. Flere av måtene dette kan skje på, ble beskrevet i forbindelse med helsegevinster for pårørende.
Øvrige gevinster for samfunnet for øvrig
Tiltak i helsetjenesten kan gi opphav til mange øvrige gevinster i samfunnet for øvrig. Særlig to typer kan være viktige: produktivitetsøkninger og redusert framtidig ressursbruk.
Helseforbedringer hos pasienter kan bedre produktiviteten i samfunnet (Jamison et al. 2013). Bedre helse øker mulighetene for blant annet utdanning og arbeid, samt produktiviteten i det arbeidet som gjøres. Helseforbedringer kan altså styrke den nasjonale økonomien. En frisk og produktiv befolkning har historisk sett vært et viktig mål for mange lands helsetjeneste, også for helsetjenesten i Norge. Ressursene som frigjøres gjennom produktivitetsøkning, kan brukes på ulike goder, blant annet til tiltak i helsetjenesten. På denne måten kan øvrige gevinster selv legge et grunnlag for helsegevinster.
Helseforbedringer kan også påvirke ressursbruken i samfunnet. Her snakker vi om ressursbruken som følger av helseforbedringen selv og ikke om ressursene som blir brukt i gjennomføringen av det aktuelle tiltaket. Ressursene kan være finansielle, men også bestå i helsepersonell og utstyr. Når det gjelder helsetjenesten, kan helseforbedringer både redusere og øke ressursbruken. En helseforbedring kan redusere behovet for behandling senere, for eksempel ved å gi pasienten mulighet til å være tilstrekkelig fysisk aktiv eller ved å sikre tilstrekkelig syn og koordinasjon for å unngå fall. En helseforbedring kan også øke behovet for behandling senere og totalt sett øke ressursbruken for helsetjenesten. Det vil kunne gjelde mange livsforlengende tiltak.
Helseforbedringer kan påvirke framtidig ressursbruk også utenfor helsetjenesten, som i omsorgstjenesten, i utdanningssektoren og for folketrygden. For folketrygden kan bedret helsetilstand føre til sparte utgifter knyttet til sykepenger, arbeidsavklaringspenger og uførepensjon. Dette har vært noe av begrunnelsen for ordningen «Raskere tilbake», som er nærmere beskrevet i boks 7.1.
Boks 7.1 Ordninger for å prioritere sykemeldte i helsetjenesten
Ved utgangen av 2013 ventet omlag 275 000 personer på behandling i Norge (Helsedirektoratet 2014b). Mange var sykmeldte, og for sykmeldte i behandlingskø vil raskere behandling kunne føre til at de kommer tidligere tilbake i arbeid. Det vil både bedre livskvaliteten til de som blir behandlet, og kunne redusere folketrygdens utgifter til sykepenger. Siden 1988 har det vært ulike ordninger for behandling av sykmeldte der reduksjon i disse utgiftene har vært et sentralt mål.
I den første ordningen, som hadde et visst omfang fram til 1997, skulle sykdommens alvorlighet og ventetid være utslagsgivende for prioritet til behandling. Den økte behandlingskapasiteten som fulgte med ordningen, skulle komme alle på ventelisten til gode, uavhengig av om den enkelte faktisk var sykmeldt. Det skulle satses på diagnosegrupper der forkorting av ventetider var ventet å ha en særlig positiv effekt på arbeidsinnsats og sykepengeforbruk. Slik sett ble sykmeldte indirekte prioritert.
I 1998 ble bevilgningene til sykepengeordninger redusert, men ved inngåelsen av avtalen om et inkluderende arbeidsliv i 2001 ble ordningen med kjøp av tjenester for sykmeldte styrket. Det ble åpnet for at trygdeetaten kunne kjøpe kortvarige avklarings-, behandlings- og opptreningstiltak for personer med psykiske lidelser. Som oppfølging av et arbeid i et utvalg med partene i arbeidslivet ble det fra 2007 innført en mye mer omfattende ordning enn tidligere. Denne fikk navnet «Raskere tilbake». For 2014 er det bevilget om lag 550 mill. kroner over Helse- og omsorgsdepartementets budsjett til ordningen og vel 200 mill. kroner over Arbeids- og sosialdepartementets budsjett.
Målgruppen for Raskere tilbake er sykmeldte, delvis sykmeldte og arbeidstakere som står i fare for å bli sykemeldt. Det er også et vilkår at personene som omfattes, med stor sannsynlighet kommer raskere tilbake i arbeid som direkte følge av behandlingen som tilbys.
Ordningen Raskere tilbake er blitt evaluert av SNF i Bergen. I rapporten fra 2010 konkluderes det som følger (Holmås og Kjerstad 2010):
«Våre beregninger tyder på at Raskere tilbake samlet sett trolig ikke er en suksess i samfunnsøkonomisk forstand, fordi reduksjonen i sykefraværet er for liten. Ordningen er imidlertid meget kompleks og består av mange ulike typer tilbud. Dette, sammen med den nevnte usikkerheten knyttet til analyseresultater, tilsier at en må være åpen for at deler av ordningen kan ha samfunnsøkonomiske gunstige effekter. Ordningen har uansett bidratt til at grupper av sykmeldte har kommet betydelig raskere til behandling, dvs. at ventetiden har blitt redusert sammenliknet med de som venter på ordinær behandling. Dette har skjedd uten at ventetidene har gått opp for sistnevnte grupper av pasienter.»
Betydningen av øvrige gevinster
Hvordan øvrige gevinster bør påvirke prioriteringer er omdiskutert (Brock 2003; Segall 2007; Lippert-Rasmussen og Lauridsen 2010). Noen mener at det er et skarpt skille mellom helsegevinster og øvrige gevinster, og at prioriteringer i helsetjenesten kun bør være basert på helsegevinster. Andre mener derimot at det er åpenbart at helse ikke er alt som betyr noe, heller ikke for prioritering i helsetjenesten.
Argumenter mot fullstendig utelukkelse
Det er av flere grunner vanskelig fullstendig å utelukke betydningen av alle øvrige gevinster. En årsak til det er at de fleste i samfunnet grunnleggende bryr seg om både egne og andres liv som en helhet, dvs. på måter som også går utover helse. Dette er reflektert i offentlige budsjetter, der mye av utgiftene har som mål å bedre befolkningens velferd på andre måter enn gjennom helseforbedringer. Dette gjelder blant annet utgifter til sosiale støtteordninger, utdanning, rettsvesen og kulturtilbud.
Også innenfor helsetjenesten brukes det ressurser for å skape øvrige gevinster; en bruk som ikke åpenbart er feil. Dette gjelder for eksempel gevinster fra visse typer informasjon og fra tiltak som skal sikre pasienters verdighet. Dette synliggjør at det ikke bare er helseutfall som er av betydning, men også pasienttilfredshet mer generelt. I helseinstitusjoner brukes det også ressurser på ulike sosiale aktiviteter og kulturtilbud og på undervisning av barn i skolepliktig alder. Helsepersonell tar dessuten iblant hensyn til hvordan de aktuelle tilstandene påvirker tidsbruk og belastning for pårørende. Dersom øvrige gevinster overhodet ikke skulle bli vektlagt ved prioritering i helsetjenesten, ville det bety at selv store forskjeller i slike gevinster mellom tiltak ville blitt ignorert, også i tilfeller der helsegevinstene er tilnærmet like store.
Betydningen av øvrige gevinster i helsetjenesten reflekteres også i hvordan helseforbedringer blir verdsatt. Helseforbedringer er verdifulle helt eller delvis fordi de gir velferdsøkninger. Men disse forbedringene gir velferdsøkninger ofte eller alltid via en mellomliggende effekt. En slik effekt kan være at pasientene kan ta mer del i det sosiale livet hjemme eller i lokalsamfunnet eller har bedre mulighet til å bedrive populære fritidsaktiviteter. Helse er bare en av flere determinanter for slike muligheter. Gitt verdsettingen av helseforbedringer, blir det vanskelig å gi en prinsipiell grunn for hvorfor gevinster fra slike mulighetsforbedringer, betinget i andre determinanter enn helse, ikke skal kunne være relevante.
Det er også vanskelig å forsvare at beslutningstakere i hver enkelt sektor ikke behøver å ta hensyn til konsekvensene av sine beslutninger for målsetninger primært tilhørende andre sektorer. Mange som er opptatt av helse, mener at andre sektorer i større grad bør ta hensyn til helsekonsekvensene av sine beslutninger. Dersom man mener dette, er det vanskelig samtidig å forsvare at beslutningstakere i helsesektoren ikke skal bry seg om målsetninger i andre sektorer.
Når det gjelder økonomiske gevinster for samfunnet generelt, er det klart at samfunnets økonomi er viktig for å kunne løse mange sentrale oppgaver, inkludert de knyttet til sosiale støtteordninger, utdanning, politi og rettsvesen. Indirekte kan slike gevinster øke de tilgjengelige ressursene også innenfor helsetjenesten, men det er vanskelig å presist fastslå i hvilken grad dette skjer.
Problemer med å vektlegge øvrige gevinster
Samtidig som det er vanskelig å fullstendig utelukke at øvrige gevinster bør kunne påvirke prioriteringer, er det klart at det å ta hensyn til visse øvrige gevinster kan gi uønskede fordelingsvirkninger. Det kan særlig være tilfelle ved vektlegging av økonomiske gevinster for samfunnet. Det vil framstå som urettferdig å ta direkte hensyn til produktivitet på en måte som gjør at grupper og personer med høy inntekt får prioritet over grupper og personer med lav inntekt og at personer i lønnet arbeid får prioritet over de uten lønnet arbeid (blant personer i yrkesaktiv alder). Det kan blant annet igjen begrunnes med at slik prioritering vil innebære en dobbelt ulempe for de som blir nedprioritert.
Å ta hensyn til framtidig ressursbruk kan også gi konsekvenser som vil kunne oppleves som urettferdige og til dels absurde. Dette gjelder særlig dersom spart ressursbruk på grunn av at pasienter dør, får påvirke prioriteringer.
Nyansert tilnærming
Utvalget mener det er nødvendig med en nyansert tilnærming til øvrige gevinster. Utvalget mener de fleste øvrige gevinster er potensielt relevante for prioritering. Unntaket er blant annet gevinster fra ren kosmetisk kirurgi og de fleste funksjonsforbedringer for friske. Samtidig mener utvalget at det er betydelige begrensninger for rollen øvrige gevinster, og særlig økonomiske gevinster, bør ha i prioritering.
Den første er en praktisk begrensning på vurderingen av øvrige gevinster. I de tilfeller der disse ikke kan forventes å ha faktisk innvirkning på prioriteringer vis-à-vis helsegevinster, er det en nyttig forenkling at beslutningstakeren ikke forsøker å beregne øvrige gevinster, men i stedet konsentrerer seg om helsegevinstene.
Den andre begrensningen er en fordelingsmessig begrensning som tilsier at øvrige gevinster ikke bør vektlegges i den grad det vil gi urettferdige fordelingsvirkninger. Om det å vektlegge øvrige gevinster gir slike virkninger, vil avhenge av mange forhold, inkludert hvilken type gevinst det er snakk om, hvilke alternative tiltak som blir vurdert, på hvilket nivå i helsetjenesten vurderingen blir gjort, og hvor kraftig virkningen er. Det er derfor vanskelig å si noe helt spesifikt om når øvrige gevinster bør, og når de ikke bør tas hensyn til. Utvalget er imidlertid av den oppfatning at særlig vektlegging av økonomiske gevinster vil kunne gi urettferdige fordelingsvirkninger. Beslutningstakere bør derfor være varsomme med å la økonomiske gevinster påvirke prioritering, særlig på klinisk nivå.
På overordnet nivå vil det være flere situasjoner der vektlegging av økonomiske gevinster kan være akseptabelt. Dette kan gjelde i tilfeller der et tiltak gir en type helseforbedring som bedre legger til rette for å komme tilbake i arbeid enn den type helseforbedring et alternativt tiltak gir. På begge nivåer bør samtidig konsistens tilstrebes. Øvrige gevinster bør vektlegges så likt som mulig i beslutningssituasjoner som ligner på hverandre.
Til slutt er det også noen begrensninger knyttet til mer tekniske forhold. Det ene er at man må begrense vektleggingen av øvrige gevinster slik at man unngår dobbelttelling (Olsen og Richardson 1999). Dobbelttelling kan skje dersom anslaget for velferdsøkningen fra en helseforbedring allerede har helt eller delvis inkorporert de aktuelle øvrige gevinstene.
På denne bakgrunn anbefaler utvalget at beslutningstakere tar utgangspunkt i helsegevinstene. Dersom et aktuelt tiltak også har andre betydelige gevinster, kan disse tillegges vekt så fremt det er sikret at det ikke vil gi urettferdige fordelingsvirkninger. Beslutningstakeren bør gjøre en spesielt grundig vurdering før økonomiske gevinster blir vektlagt.
7.3.4 Individuelle helsegevinster
Total helsegevinst fra et tiltak avhenger av antall personer som får en helsegevinst og størrelsen på de individuelle helsegevinstene. Dette betyr at en gitt total helsegevinst både kan være et resultat av små helsegevinster for mange personer og store helsegevinster for få personer.
Studier av folks prioriteringsvurderinger tyder på at de ikke er likegyldig til sammensetningen av totalgevinsten fra helsetiltak (Dolan et al. 2005). For en gitt sum av helsegevinster synes mange å mene at det er mindre viktig å gi veldig små helsegevinster til veldig mange individer enn litt større helsegevinster til litt færre individer. Sammensetningen av totalgevinst fra tiltak har også blitt diskutert i forbindelse med konkrete prioriteringsprosjekter og i etisk teori (Hadorn 1991; Daniels 1994; Voorhoeve 2014).
Blant annet på bakgrunn av dette har det blitt foreslått å ta i bruk en minimumsverdi for individuell helsegevinst (Buyx et al. 2011). Mandatet ber utvalget om å vurdere «grenser for hvor liten effekten av helsehjelpen kan være for at nyttekriteriet er oppfylt». Utvalget forstår dette punktet i mandatet som et spørsmål om gjennomsnittlig individuell helsegevinst fra et tiltak må være over en viss minimumsverdi for at tiltaket i det hele tatt skal kunne bli offentlig finansiert.
Minimumsverdi for individuell helsegevinst
En minimumsverdi kan tenkes benyttet for ulike typer helsegevinster, inkludert gode leveår. Spørsmålet om en slik minimumsverdi har blant annet blitt aktualisert av en nylig publisert oversiktsstudie av alle kostnad-effektstudier gjort i 2010. Studien viste at median helsegevinst var på 0,06 kvalitetsjusterte leveår (QALYs) (Wisløff et al. 2014), der QALYs kan ses på som et spesifikt mål for gode leveår. Dette tilsvarer omtrent tre uker med god helse.
Innledningsvis er det viktig å skille mellom størrelsen på gjennomsnittsestimatet for helsegevinst for en målgruppe og størrelsen på usikkerheten knyttet til dette estimatet. Ved stor usikkerhet vil det ofte være uklart om det faktisk er noen helsegevinst, dvs. en positiv endring i helse. Før et tiltak gjennomføres, bør beslutningstaker alltid være rimelig sikker på at det i det i minste medfører en merkbar positiv endring. Dette er nært knyttet til dokumentasjonskrav og er nærmere drøftet i kapittel 10.
Når en minimumsverdi diskuteres mer generelt, er det ikke usikkerheten rundt estimatet som er det primære. Spørsmålet er om gjennomsnittlig forventet helsegevinst, selv når man er rimelig sikker på at den faktisk er positiv, må over en viss minimumsverdi som er større enn null.
Argumenter for og imot minimumsverdi
Enkelte har systematisk argumentert for en minimumsverdi for individuell helseforbedring eller helsegevinst. Blant disse er Buyx og kollegaer (Buyx et al. 2011). De antyder en minimumsverdi på 10 pst. forbedring i helserelatert livskvalitet eller tre måneders økt levetid for at offentlig finansiering skal være aktuelt. Det siste er basert på en liten studie av folks preferanser i Tyskland. Minimum tre måneders økt levetid har også vært et av flere «end-of-life» kriterier for prioritet hos National Institute of Health and Care Excellence (NICE) i Storbritannia (se kapittel 6).
Et argument som har blitt brukt til støtte for minimumsverdi, er at gevinstene som hvert enkelt individ går glipp av, alltid vil være små. Et annet argument som har blitt brukt, er at tiltak med helsegevinst under minimumsverdien og som samtidig er kostnadseffektivt, vil ha lav pris i det private markedet. Et tredje argument som har vært fremme, er at finansiering av tiltak som gir en helsegevinst under et minimumsnivå, ikke bør regnes som et kollektivt og offentlig ansvar. Et fjerde argument er at man ved bruk av en minimumsverdi i prioritering ikke trenger å ta hensyn til kostnader.
Det siste og mest fundamentale argumentet som gjerne brukes til støtte for en minimumsverdi, er at man generelt ikke bør prioritere tiltak som gir mange små individuelle gevinster dersom det finnes et alternativt tiltak som kan gi en eller flere (tilstrekkelig) store individuelle gevinster, selv om det første tiltaket totalt skulle gi mye mer helsegevinst totalt enn det siste tiltaket. Argumentet innebærer ofte at (tilstrekkelig) små potensielle gevinster blir regnet som helt irrelevante i nærvær av (tilstrekkelig) store potensielle gevinster (Voorhoeve 2014). En slik posisjon er omdiskutert og omstridt innenfor etisk teori (Daniels 1994). Noen av utfordringene er diskutert nedenfor.
Utvalget mener at de nevnte argumentene ikke gir tilstrekkelig grunnlag for en fast minimumsverdi for individuell helsegevinst. Utvalget er blant annet skeptisk til de empiriske premissene som blir brukt og mener dessuten at helsegevinster generelt må ses i sammenheng med ressursbruk og helsetap. Det finnes i tillegg flere argumenter som mer direkte imøtegår bruk av en minimumsverdi. Et argument er at også små gevinster er reelle, og at det ikke er rettferdig å se helt bort fra små gevinster til noen individer så lenge de oppleves som en positiv endring for dem. Når helsegevinster er målt i gode leveår, kan dessuten veldig små verdier innbefatte klinisk meningsfulle gevinster, slik som én ukes forkortning av et sykdomsforløp med moderate symptomer.
Det er i tillegg store utfordringer knyttet til å si noe konkret om hvor små de aktuelle gevinstene må være for at de ikke skal telles med. Det er klart at desto mindre de er, desto mindre kontroversielt vil det være å se bort fra dem. Men desto mindre minimumsverdien er, desto mindre betydning vil den også ha i praksis. Det er også store utfordringer knyttet til at mange faktorer synes å kunne påvirke hva som er riktig minimumsgrense. Disse faktorene er for eksempel type gevinst, varighet av kvalitetsforbedringer, ressursbruk, helsetap, størrelse på alternative gevinster og hvorfor den gjennomsnittlige individuelle gevinsten er liten. Når det gjelder det første, kan man ha ulikt syn på en minimumsverdi knyttet til henholdsvis kvalitetsforbedring og risikoreduksjon for død. Når det gjelder hvorfor gevinsten er liten, kan det være relevant om gjennomsnittlig gevinst er liten fordi nesten alle i målgruppen får en liten og tilnærmet like stor gevinst, eller fordi noen få får en stor gevinst, mens resten får ingen gevinst.
En minimumsverdi for helsegevinst kan videre føre til at man legger mindre vekt på helsegevinster enn øvrige gevinster. I tillegg vil oppdelingen av tiltak kunne få stor betydning. En pasient eller pasientgruppe kan trenge flere ulike tiltak som hver for seg er under minimumsverdien, men som til sammen gir betydelig gevinst. Det samme kan gjelde oppdeling over tid.
Til slutt er det verdt å nevne at helsetapskriteriet vil kunne hjelpe i mange av de situasjonene der summering av mange små helsegevinster kan framstå som spesielt problematisk. Dette gjelder i de situasjoner der målgruppen som får små individuelle helsegevinster, også har et lite gjennomsnittlig helsetap, mens målgruppen som får store individuelle helsegevinster har et stort gjennomsnittlig helsetap. Helsetapskriteriet vil da gi prioritet til tiltak for den siste målgruppen.
Utvalgets vurdering
På bakgrunn av vurderingene ovenfor mener utvalget at det ikke er grunnlag for å anbefale en minimumsverdi for helsegevinst. Alle helsegevinster, både store og små, bør imidlertid være tilstrekkelig godt dokumentert. Beslutningstakere i helsetjenesten bør alltid forsikre seg om at forventet helsegevinst fra tiltak de iverksetter, er positiv. Dokumentasjonskrav er drøftet nærmere i kapittel 10.
7.4 Ressurskriteriet
Ressurskriteriet tar hensyn til hvor mye ressurser som behøves for å gjennomføre ulike tiltak. Etter ressurskriteriet får et tiltak høyere prioritet desto mindre ressurser det er forventet å forbruke. Siden knappe ressurser alternativt kan anvendes på andre tiltak, er det bedre desto mindre ressurser tiltaket krever.
Ressurskriteriet bør ikke brukes alene, men sammen med de to andre hovedkriteriene. Det kan være riktig å prioritere et tiltak som krever mye mer ressurser enn et annet dersom det første tiltaket gir større helsegevinster eller retter seg mot individer med større helsetap.7
7.4.1 Hvorfor ressursbruk er viktig
Siden ressursene helsetjenesten har til rådighet er begrensede, vil ressurser brukt på et tiltak gjøre at et eller flere andre tiltak ikke kan gjennomføres. Det samme gjelder i samfunnet generelt. Tiltak som krever lite ressurser, vil gjøre det lettere å gjennomføre andre viktige prosjekter, og slike tiltak bør derfor få prioritet. Innenfor helsetjenesten representerer ressursbruk et sted normalt tapte helsegevinster et annet sted. Ressurskriteriet kan derfor forstås slik at det primært ikke handler om ressurser i seg selv. I stedet er kriteriet opptatt av at minst mulig helsegevinster og andre gevinster fra andre tiltak skal gå tapt på grunn av gjennomføringen at et bestemt tiltak.
Å ta hensyn til ressursbruk er så vanlig at man ofte ikke tenker på det. Helsepersonell vurderer for eksempel kontinuerlig hvordan de skal fordele sin tid og oppmerksomhet mellom ulike pasienter. Når man eksplisitt snakker om ressurser, drøfter man gjerne alternativ ressursbruk og god versus dårlig ressursbruk. Slike vurderinger er sentrale i alle sektorer, også i helsesektoren. I helsepersonelloven heter det blant annet at «[h]elsepersonell skal sørge for at helsehjelpen ikke påfører pasienter, helseinstitusjon, trygden eller andre unødvendig tidstap eller utgift». Videre framhever Legeforeningens etiske regler for leger at leger skal «ta tilbørlig hensyn til samfunnets økonomi» og «må bidra til at medisinske ressurser fordeles i henhold til allmenne etiske normer» (Den norske legeforening 2014).
7.4.2 Hvilke ressurser som er relevante
Mange ulike ressurser, i form av innsatsfaktorer, kan være nødvendige for gjennomføringen av tiltak. Et viktig spørsmål er hvilke av disse som bør påvirke prioritering, og som ressurskriteriet bør ta hensyn til. I diskusjoner om hvilke ressurser som bør inkluderes, kan det være nyttig å ta utgangspunkt i to perspektiver: helsesektorperspektivet og samfunnsperspektivet. Fra det første perspektivet bryr man seg kun om bruken av de ressursene som er stilt til disposisjon for helsetjenesten. Fra samfunnsperspektivet er i prinsippet all ressursbruk i samfunnet relevant. En kan også hevde at en annen kombinasjon av ressurser i helsetjenesten og ressurser i samfunnet for øvrig utgjør de relevante ressursene for prioriteringsbeslutninger.
Helsesektorperspektivet
Ressurser omfatter alt fra bygningsmasse, helikoptre og IKT-systemer, til teknisk utstyr og ikke minst kompetent personell. På klinisk nivå er kompetent personell og deres tid særlig viktige ressurser. Andre viktige ressurser er legemidler, materiell, teknisk utstyr og operasjonssaler.
Hvilken ressurs som primært begrenser gjennomføringen av tiltak, vil variere med tid og sted. På kirurgiske avdelinger vil det ofte være tilgjengelig personell og operasjonssaler som begrenser gjennomføringen av tiltak. På radiologiske avdelinger vil det være personell og teknisk utstyr, inkludert CT- og MR-maskiner. På intensivavdelinger vil det vanligvis være sengeplasser og tilhørende personell. I den pre-hospitale tjenesten vil det være antall ambulanser og personell. På fastlegekontorene vil fastlegenes tid være den sentrale ressursen som må fordeles mellom pasientene. Ved organtransplantasjon vil begrenset tilgang på organer gjøre at fordelingen av organer blir helt sentral.
Samfunnsperspektivet
Samfunnsperspektivet er bredere enn helsetjenesteperspektivet og inkluderer all ressursbruk i samfunnet, både i andre offentlige sektorer og i privat sektor. I et slikt perspektiv inngår ressursbruk for pasient, pårørende og samfunnet for øvrig.
For pasienten kan ressursbruken bestå i blant annet utgifter til reise. Tid er også en ressurs og vil normalt være viktigere enn det direkte økonomiske utlegget. Pasienter må ofte bruke betydelig tid på utredning og behandling, tid som ellers kunne blitt brukt på jobb eller fritid. Tilsvarende kan et tiltak medføre både utgifter og tidstap for pårørende. Et eksempel er behandlingen av klumpfot hos barn, der foreldrene må bruke flere timer daglig på tøyningsøvelser som del av behandlingen.
I samfunnet for øvrig vil ressursbruken hovedsakelig skyldes redusert produktivitet, særlig på grunn av fravær fra jobb under utredning eller behandling. Produksjonstapet kan være betydelig, også sammenliknet med ressursbruken i helsetjenesten, i forbindelse med omfattende screening eller vaksinasjonsprogram. Svineinfluensavaksineringen medførte for eksempel at mange måtte ta fri fra jobb for å ta vaksinen.
Relevant perspektiv
Hvilket perspektiv som er mest relevant, har blitt diskutert, særlig i forbindelse med økonomiske analyser (Gold et al. 1996; Olsen og Richardson 1999; Drummond et al. 2005; Jonsson 2009; Claxton et al. 2010). I Norge har flere instanser anbefalt bruk av et samfunnsperspektiv (med visse begrensninger) (Helsedirektoratet 2012b; Statens legemiddelverk 2012). Helsepersonelloven og Legeforeningens etiske regler for leger framhever også ressursbruk utover helsetjenesten. Flere av argumentene for å ta hensyn til øvrige gevinster under helsegevinstkriteriet støtter dessuten et samfunnsperspektiv knyttet til ressurskriteriet. Sparte kostnader også utenfor helsetjenesten vil normalt gjøre samfunnet bedre rustet til å løse mange sentrale oppgaver, inkludert de knyttet til sosiale støtteordninger, utdanning, politi og rettsvesen. Indirekte kan sparte ressurser utenfor helsetjenesten også øke de tilgjengelige ressursene innenfor helsetjenesten, men igjen er det vanskelig å fastslå i hvilken grad dette skjer.
I likhet med vektleggingen av øvrige gevinster kan vektlegging av ressursbruk utenfor helsetjenesten gi opphav til problematiske fordelingsvirkninger. I verdsettingen av tidsbruk vil det for eksempel være problematisk å fastslå verdien av pasienters og pårørendes tid ulikt på basis av deres inntekt.
Utvalgets holdning til hvilke ressurser som er relevante, tilsvarer derfor holdningen til gevinster fra tiltaket. Utvalget mener de fleste typer ressursbruk er potensielt relevante for prioritering. Samtidig er det begrensninger for rollen ressursbruk utenfor helsetjenesten bør spille i prioritering. Den første er en praktisk begrensning med hensyn til vurdering av ressursbruk utenfor helsetjenesten i de tilfellene der det ikke kan forventes at denne ressursbruken vil ha innvirkning på prioriteringer. I slike tilfeller er det en nyttig forenkling at beslutningstakeren ikke forsøker å beregne denne ressursbruken, men i stedet konsentrerer seg om ressursbruken innenfor helsetjenesten. Den andre begrensningen er en fordelingsmessig begrensning og tilsier at ressursbruk utenfor helsetjenesten ikke bør vektlegges dersom det vil gi urettferdige fordelingsvirkninger. Tilsvarende bør det om mulig gjøres justeringer for å unngå slike fordelingsvirkninger. For eksempel vil det være mer rettferdig å verdsette tid ut fra gjennomsnittsinntekten i samfunnet, enn ut fra hver enkelts faktiske inntekt. Dette er delvis i tråd med gjeldende anbefalinger for samfunnsøkonomiske analyser i helsesektoren (Helsedirektoratet 2012b).
Generelt bør beslutningstakerne tilstrebe konsistens mellom hvordan de behandler øvrige gevinster i anvendelsen av helsegevinstkriteriet, og hvordan de behandler ressursbruk utenfor helsetjenesten når ressurskriteriet anvendes.
På denne bakgrunn anbefaler utvalget at beslutningstakere tar utgangspunkt i ressursbruken innenfor helsetjenesten. Dersom et aktuelt tiltak utløser betydelig ressursbruk utenfor helsetjenesten kan dette tillegges vekt så fremt det er sikret at det ikke vil gi urettferdige fordelingsvirkninger.
7.4.3 Kostnadseffektivitet
I prioriteringsarbeidet i Norge og i andre land får kostnadseffektivitet betydelig oppmerksomhet (Sabik og Lie 2008), slik det er beskrevet i kapittel 6. Langt på vei vil helsegevinstkriteriet og ressurskriteriet sammen kunne ivareta hensynet til kostnadseffektivitet.
Begrepet kostnadseffektivitet
Et tiltaks kostnadseffektivitet avhenger av forholdet mellom dets kostnader og effekter eller, mer presist, forholdet mellom endringen i kostnader og endringen i effekt sammenliknet med et referansetiltak (Gold et al. 1996; Drummond et al. 2005).8 Når vi snakker om hvor kostnadseffektivt et tiltak er, tenker vi normalt på dette forholdet, dvs. størrelsen på det som kalles kostnad-effektbrøken. Jo mindre brøken er, desto mer kostnadseffektivt er tiltaket. Når vi vurderer om et tiltak er kostnadseffektivt eller ikke, tenker vi normalt på om denne brøken er mindre enn en gitt standard. Denne standarden kan representere kostnad-effektbrøken til et eller flere konkurrerende tiltak eller forutbestemte grenser. Grenser som reflekterer alternativkostnaden er spesielt relevante og er drøftet i kapittel 9. Et tiltaks kostnadseffektivitet kan også graderes slik at man for eksempel kan si at et tiltak er svært eller moderat kostnadseffektivt.
For tiltak i helsetjenesten regnes gjerne helsegevinster som den relevante effekten i kostnads-effektbrøken. Et tiltaks kostnadseffektivitet vil da avhenge av forholdet mellom tiltakets kostnader og dets helsegevinster.
Kostnadseffektivitet som kriterium
Flere har foreslått et kostnad-effektkriterium for prioritering (Williams 1992; Sabik og Lie 2008; Ord 2013). I følge et slikt kriterium øker et tiltaks prioritet, blant uavhengige tiltak som eventuelt også oppfyller visse andre krav, med tiltakets kostnadseffektivitet. Som beskrevet ovenfor utgjør et kostnad-effektkriterium i dag ett av tre overordnede kriterier i norsk helsetjeneste.
Kombinasjonen av helsegevinstkriteriet og ressurskriteriet vil kunne gi opphav til prioriteringer tilsvarende de som følger fra et kostnad-effektkriterium. I hvilken grad prioriteringsanbefalingene overlapper hverandre, vil særlig avhenge av to forhold. Det første er hvordan helsegevinstkriteriet og ressurskriteriet integreres. En mulighet er å gjøre dette i form av en ressursbruk-gevinstbrøk, der en mindre brøk betyr høyere prioritet, noe som er nærmere drøftet nedenfor. Det andre er hva som inngår i kostnader og «effekt» sammenliknet med hva som inngår i ressursbruk og helsegevinst og andre relevante gevinster. Ressursbruk kan være ulik kostnader, og gevinstene kan være ulik effekt.
I kostnad-effektanalyser (KEA) for helsetjenesten omfatter kostnader normalt de ressursene som forbrukes for å gjennomføre tiltaket, og effekt blir gjerne spesifisert i form av gode leveår (for eksempel kvalitetsjusterte leveår). I slike tilfeller vil kostnad-effektkriteriet kunne representere kjernen i helsegevinst- og ressurskriteriene. Helsegevinstkriteriet kan imidlertid også ta hensyn til relevante gevinster som går utover helsegevinster i form av gode leveår, inkludert gevinster knyttet til informasjon, verdighet, belastning hos pårørende og evt. økonomisk produktivitet og framtidig ressursbruk. Noen av disse gevinstene er vanskelige å kvantifisere, mens særlig de økonomiske virkningene ofte lettest verdsettes i form av penger. Av den grunn blir slike øvrige gevinster ofte inkludert i telleren i kostnad-effektbrøken sammen med kostnadene knyttet til ressursbruken (innsatsfaktorene).9 Resultatet er at noe av det som normalt inkluderes i telleren i kostnad-effektbrøken, vil tilhøre nevneren i en eventuell ressursbruk-gevinstbrøk.
En slik inndeling i kostnad og effekt er nyttig i økonomiske analyser, men mindre nyttig for mange beslutningssituasjoner i helsetjenesten. Særlig på klinisk nivå er det ofte mer hensiktsmessig først å vurdere virkningene av et tiltak (helsegevinstkriteriet) og dernest vurdere ressursene som blir brukt i gjennomføringen av tiltaket (ressurskriteriet). Dette gjelder spesielt i de tilfellene der ressursene ikke framstår i form av et pengebeløp for beslutningstakeren. For en radiolog vil for eksempel den mest relevante ressursen ofte være ledig tid for en CT- eller MR-maskin.
Kostnad-effektanalyser utgjør uansett et viktig grunnlag for prioriteringsbeslutninger. Slike analyser er mer inngående beskrevet i kapittel 10.
7.5 Helsetapskriteriet
Det er ikke bare helsegevinster og ressursbruk som betyr ved for prioritering. For å sikre en rettferdig fordeling er også pasientenes helsetap helt avgjørende.
Mandatet ber utvalget å «vurdere hvordan alvorlighetskriteriet kan anvendes på en systematisk og konsistent måte». I utvalgets samtaler med ulike aktører, inkludert pasient- og profesjonsorganisasjonene, har særlig konkretisering av dette kriteriet blitt etterspurt. Utvalget foreslår at helsetapskriteriet erstatter det gjeldende alvorlighetskriteriet og legger fram et detaljert forslag til konkretisering.
For å kunne konkretisere helsetapskriteriet må to grunnleggende spørsmål besvares:
Hvordan skal helsetap forstås og måles?
Hva er det presise forholdet mellom helsetap og prioritet?
Detaljer knyttet til disse to spørsmålene er diskutert i vedlegg 4.
7.5.1 Hvordan helsetap bør spesifiseres
Helsetapet for et individ kan spesifiseres som tapet i gode leveår fra et referansenivå. Utvalget mener det er helsetap over livsløpet som er mest sentralt og foreslår at referansenivået inntil videre kan være 80 gode leveår.
En slik forståelse av helsetap kan illustreres med en person som dør i en alder av 70 år, og som i løpet av livet har hatt redusert helserelatert livskvalitet tilsvarende fem gode leveår. Over livsløpet hadde denne personen da 65 gode leveår, og helsetapet ble 15 gode leveår.
I prioritering av tiltak er det forventet helsetap over livsløpet som er viktig. For alle andre enn nyfødte, kan det forventede helsetapet over livsløpet påvirkes av både faktisk helsetap i fortid og forventet helsetap i framtid. Tilsvarende, for et individ eller en gruppe, vil en tilstand som allerede har gitt symptomer, medføre helsetap både i fortid og framtid. Tilstander som ennå ikke har gitt symptomer, vil derimot kun medføre forventet helsetap i framtid. Kapittel 10 gir mer konkrete eksempler, samt en beskrivelse av hvordan helsetap kan beregnes med utgangspunkt i tilgjengelig informasjon.
Det kan være nyttig å se nærmere på hvordan det mest relevante helsetapet knytter seg til gode leveår, livsløpsperspektiv, referansenivå, eksisterende tiltak og de individene som faktisk får helsegevinst fra det aktuelle tiltaket.
Gode leveår
Begrepet gode leveår ble beskrevet ovenfor. Bruk av helsetap konkretisert i form av gode leveår krever at livskvalitet og levetid er integrert på en tilfredsstillende måte. Med vekt på gode leveår er det egentlig helsebetinget velferdstap som er sentralt, men å snakke om helsetap er en nyttig forenkling. Videre tar helsetapskriteriet ikke hensyn til andre typer velferdstap, til dels fordi utvalget ikke har funnet en god måte å integrere de typene som eventuelt kunne være relevante. Samtidig vil helsetap i form av gode leveår iblant kunne ha problemer med å fange opp forskjeller i redusert helserelatert livskvalitet mellom individer og grupper. For å unngå dette problemet kan man i visse tilfeller bruke egne referansenivå for redusert kvalitet over et lite tidsrom. Dette fordrer imidlertid at man har god grunn til å tro at individene eller gruppene man sammenlikner, ellers stort sett er like.
Livsløpsperspektiv
Utvalget mener det er gode leveår og helsetap over livsløpet som er mest sentralt for prioritering. Et livsløpsperspektiv bør derfor være utgangspunktet ved prioriteringsvurderinger. Dette er nærmere begrunnet i vedlegg 4.
Referansenivå
I det følgende vil helsetap uten nærmere spesifikasjon referere til helsetap over livsløpet med referansenivå på 80 gode leveår. Begrunnelsen for dette referansenivået er gitt i vedlegg 4. Det at referansenivået er satt så høyt som 80 gode leveår, innebærer at nesten alle vil ha et forventet helsetap over livsløpet. For nyfødte i Norge er for eksempel forventet antall gode leveår 69,7 for jenter og 66,3 for gutter (Salomon et al. 2012).
Forventet helsetap er ikke et krav for at et tiltak skal kunne få offentlig finansiering. De som kan forvente mer enn 80 gode leveår, bør få tilbud om alle tiltak som kan begrunnes i de andre kriteriene.
Eksisterende behandling
Når man skal anslå forventet helsetap, skal man se bort fra den aktuelle gevinsten fra tiltaket som blir vurdert. Man bør imidlertid ta hensyn til forventet effekt fra eksisterende tiltak. Dette er nærmere forklart og begrunnet i vedlegg 4.
Oppmerksomhet på de som får helsegevinst
Når man prioriterer tiltak, er det forventet helsetap hos de som faktisk får en helsegevinst fra tiltaket (gevinstmottakerne) som er primært relevant, og da på det tidspunktet de får denne gevinsten. Gjennomsnittlig forventet helsetap forstått på denne måten, kan iblant skille seg betydelig fra gjennomsnittlig forventet helsetap hos alle de som får et tiltak (tiltaksmottakerne), på det tidspunktet igangsettelse av tiltaket er aktuelt. En slik foskjell kan være særlig uttalt for forebyggende tiltak, slik det er nærmere beskrevet i kapittel 9. Det kan iblant være en nødvendig forenkling å vurdere forventet helsetap hos gevinst- eller tiltaksmottakerne på det tidspunkt oppstart av tiltaket er aktuelt.
7.5.2 Forholdet mellom helsetap og prioritet
Det helsetapet som er mest relevant for helsetapskriteriet, er blitt spesifisert ovenfor. Ifølge helsetapskriteriet øker da et tiltaks prioritet med forventet helsetap over livsløpet, gitt eksisterende tilbud, hos den eller de som får en helsegevinst. Det er forventet helsetap i det mottakeren får helsegevinsten som er relevant, og den aktuelle gevinsten fra tiltaket medregnes ikke.
Tiltak som gagner pasienter med stort forventet helsetap, får dermed høy prioritet og skal prioriteres over tiltak som gagner pasienter med et lite forventet helsetap. Tiltak som vil få høy prioritet etter helsetapskriteriet, inkluderer blant annet alle typer effektfull behandling for inkurabel kreft hos barn, ettersom de som hjelpes av slik behandling, vil ha et meget stort forventet helsetap over livsløpet. Selv om barn med alvorlig sykdom har stort forventet helsetap, er det likevel ikke slik at de yngre alltid har større forventet helsetap enn de eldre.
Det er også viktig å merke seg at helsetapskriteriet tar hensyn til helsetap uten den aktuelle gevinsten fra det tiltaket som blir vurdert. Videre er det viktig å være klar på skillet mellom helsegevinstkriteriet og helsetapskriteriet når det gjelder helsetap. Stort forventet helsetap kan indikere stor forventet helsegevinst, men det er ikke nødvendigvis slik. Når det er snakk om tiltak som fullstendig helbreder den tilstanden tiltaket retter seg mot, vil det ofte være slik at desto større forventet helsetapet er, desto større er også forventet helsegevinst. I de tilfellene vil både helsegevinstkriteriet og helsetapskriteriet gi tiltaket høy prioritet. I mange andre tilfeller vil imidlertid forventet helsegevinst kunne være nokså begrenset selv om forventet helsetap er stort, for eksempel på grunn av at tiltaket ikke er fullstendig helbredende. I slike tilfeller vil helsetapskriteriet gi tiltaket høy prioritet selv om helsegevinstkriteriet ikke gjør det.
Figur 7.1 viser for et utvalg tilstander og tiltak hvordan helsetap og forventet helsegevinst ikke nødvendigvis samvarierer. Figuren er basert på en studie av Lindemark og kolleger (Lindemark et al. 2014) og er kun ment som illustrasjon.10
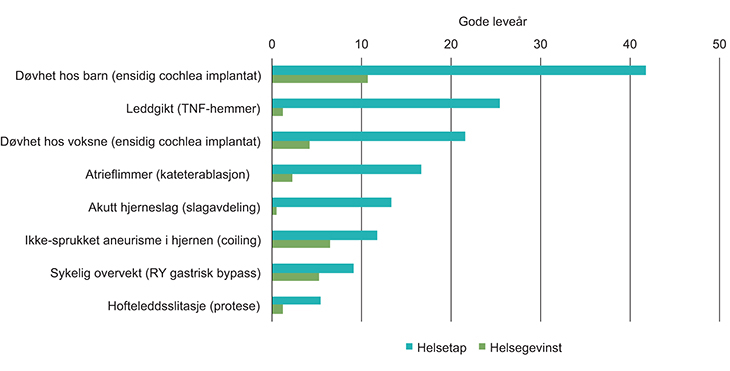
Figur 7.1 Forventet helsetap og helsegevinst for et utvalg tilstander og tiltak
Kilde: Modifisert etter Lindemark et al. 2014
Som det tydelig framkommer av figuren, trenger ikke stort helsetap å bety stor forventet helsegevinst fra et aktuelt tiltak. Leddgiktpasientene i illustrasjonen har for eksempel et større helsetap enn pasientene med sykelig overvekt og ikke-sprukket aneurisme i hjernen, samtidig som forventet gevinst fra tiltakene rettet mot de to siste målgruppene er betydelig større enn tiltaket rettet mot leddgiktpasientene.
Når det gjelder hvor mye et tiltaks prioritet bør øke når forventet helsetap øker, er dette diskutert i forbindelse med avveining nedenfor.
7.5.3 Relasjon til dagens alvorlighetskriterium
Utvalget foreslår at helsetapskriteriet erstatter dagens alvorlighetskriterium. Det er derfor nødvendig å framheve noen forskjeller og likheter mellom de to kriteriene.
Lønning II-utvalget definerte alvorlighetsgrad som «prognosetap dersom behandling eller andre tiltak ikke iverksettes». Dette ble utdypet ved å foreslå at om en tilstand er alvorlig, bør fastlegges ut fra en vurdering av «[r]isiko for død eller funksjonstap», «[g]raden av fysisk og psykisk funksjonstap» og «[s]merter, fysisk eller psykisk ubehag».
Prioriteringsforskriften fra 2000 inneholder en tilsvarende forståelse av alvorlighet. Forskriftens vilkår knyttet til alvorlighet krever at «pasienten har et visst prognosetap med hensyn til livslengde eller ikke ubetydelig nedsatt livskvalitet dersom helsehjelpen utsettes».
Det er flere likheter mellom alvorlighet slik det er framstilt av Lønning II-utvalget og i prioriteringsforskriften, og helsetap slik utvalget beskriver det. Både alvorlighet og helsetap inkluderer både livslengde og helserelatert livskvalitet. Videre refererer begge begrepene direkte til «tap» i disse dimensjonene, og de er opptatt av slikt tap både i nåtid og framtid.
Helsetapskriteriet skiller seg samtidig fra alvorlighetskriteriet på flere områder, slik det normalt blir forstått. Disse forskjellene er drøftet i vedlegg 4. Oppsummert kan man peke på én likhet og tre ulikheter. Begge kriteriene gir prioritet til de med det dårligste utgangspunktet. Men de vektlegger forskjellige utgangspunkt ettersom helsetapskriteriet favner videre, og helsetapskriteriet er spesifikt på mange områder der alvorlighetskriteriet ikke gir konkret veiledning. I tillegg refererer helsetapskriteriet til forventet helsetap hos gevinstmottakerne i det de får gevinst, mens alvolighetskriteriet normalt blir forstått som å gjelde forventet prognose hos tiltaksmottakerene i det oppstart av tiltaket er aktuelt.
7.5.4 Begrunnelse for et helsetapskriterium
Helsetap er viktig fordi helse er viktig. Å gi prioritet til de med størst helsetap har primært å gjøre med fordelingsrettferdighet og en idé om at en gitt helsegevinst er viktigere desto dårligere stilt mottakeren av helsegevinsten er i utgangspunktet (Parfit 1995; Brock 2002a). Høyere prioritet til de dårligere stilte kan begrunnes på to hovedmåter: direkte ved at disse gruppene vil komme dårligere ut uten helsehjelpen, og indirekte ved at prioritet til disse gruppene vil bidra til å redusere ulikhet i fordelingen av gode leveår. Den enkle ideen om prioritet til de som har det dårligste utgangspunktet, er kjent for mange og har bred appell. Et helsetapskriterium kan finne generell støtte både i teoretiske begrunnelser, i empiriske studier av folks holdninger og i uttalt politikk i Norge og andre land.
Som det allerede er redegjort for, er det i alle tilfeller viktig å skille skarpt mellom helsegevinstkriteriet og helsetapskriteriet når man vurderer helsetap. Helsegevinstkriteriet bryr seg ikke om helsetap i seg selv. Et stort helsetap kan i mange tilfeller være knyttet til stor forventet helsegevinst fra et tiltak, men trenger ikke være det. Helsetapskriteriet, derimot, er direkte knyttet til helsetap og gir alltid høyere prioritet til tiltak som retter seg mot dem med stort helsetap enn tiltak som retter seg mot dem med beskjedent eller intet helsetap.
Støtte i teori
Høyere prioritet til de dårligere stilte kan som nevnt begrunnes på to hovedmåter: direkte ved at disse gruppene vil komme dårligere ut uten helsehjelpen, og indirekte ved at prioritet til disse gruppene vil bidra til å redusere ulikhet i fordelingen av gode leveår. Den siste typen begrunnelse er altså nært knyttet til et likhetsideal.
Likhet har som generelt ideal bred støtte innenfor fagområdene etikk og politisk filosofi (Sen 1992; Dworkin 2000; Kymlicka 2002). Likhet i helse er én type likhet og har blitt mye diskutert. Mange finner også idealet om likhet i helse attraktivt, men da som regel under visse betingelser og i kombinasjon med andre hensyn (Culyer og Wagstaff 1993; Williams 1997; Anand 2002; Daniels 2008; Norheim og Asada 2009).
Hovedinnvendingene mot et ideal om helselikhet blir også i stor grad imøtegått dersom idealet ses i sammenheng med andre hensyn. Kombinerer vi et slikt ideal og et helsegevinstkriterium, trenger det ikke være et problem at fullstendig likhet i helse i samfunnet er uoppnåelig. Med en kombinasjon av hensyn og kriterier, trenger heller ikke likhetsidealet føre til at uforholdsmessig store ressurser blir brukt på grupper og individer som bare kan få minimal effekt av tiltakene, en innsigelse som på engelsk blir kalt «the bottomless-pit objection» (Segall 2010). En slik kombinasjon vil heller ikke ha den urimelige følge at helsen til de som har best helse, bør reduseres for å fremme likhet, en innsigelse som på engelsk blir kalt «leveling-down objection» (Norheim 2009).
Det finnes også en annen måte å begrunne et helsetapskriterium på, en måte som i seg selv er mindre utsatt for de nevnte innvendinger mot et likhetsideal. Helsetapskriteriet kan begrunnes direkte med ideen om at en gitt helsegevinst er viktigere desto dårligere stilt mottakeren av helsegevinsten er i utgangspunktet (Parfit 1995; Brock 2002a). En slik begrunnelse er ikke direkte relatert til helsen til andre i samfunnet og heller ikke direkte knyttet til et likhetsideal.
Støtte i empiriske studier
Det er foretatt flere empiriske studier av befolkningens uttalte holdninger til prioritering. Disse studiene har vist at de fleste bryr seg om hvordan helsegevinster er fordelt og ikke bare om summen av slike gevinster (Dolan et al. 2005). Mer spesifikt har mange av disse studiene gitt støtte til prioritet til de med dårligere utgangspunkt bredt forstått (Nord 1999; Schwappach 2002; Dolan et al. 2005; Shah 2009; Richardson et al. 2011). Studiene fant blant annet at de fleste av respondentene ønsket å gi prioritet til de med dårlig helsestatus (Nord 1993; Dolan 1998; Ubel 1999; Nord og Johansen 2014), med lav forventet gjenstående kvalitetsjustert levetid (Defechereux et al. 2012), med lav alder (Nord et al. 1996; Johannesson og Johansson 1997) eller med lav forventet kvalitetsjustert levetid over livsløpet (Andersson og Lyttkens 1999; Bleichrodt et al. 2005; Dolan og Tsuchiya 2012; Olsen 2013a; Ottersen et al. 2014). Flere av disse studiene ble gjennomført i Norge. Også i Medborgerpanelet ble det gitt betydelig støtte til prioritet til de med det dårligste utgangspunktet, i form av en alvorlig tilstand. Respondentene ble bedt om å vurdere en venteliste for kneoperasjon, der operasjonen ville bedre knefunksjonen like mye for alle. Over 80 pst. av respondentene sa seg da enig i at de med mest alvorlig sykdom som hovedregel burde rykke fram i køen.
De ulike studiene knytter det å ha et dårlig utgangspunkt til ulike begreper, og begrepene blir definert på ulike måter. Ikke alle de nevnte studiene gir derfor direkte støtte til helsetapskriteriet akkurat slik utvalget definerer det. Utvalgets definisjon er nærmere utdypet og begrunnet i vedlegg 4.
Støtte i uttalt politikk
I Norge er alvorlighetskriteriet etablert som et av tre overordnede kriterier. Eksplisitt støtte til økt prioritet på basis av helsetap, alvorlighetsgrad eller lignende finner vi også i land som Nederland, Storbritannia og Sverige (Sabik og Lie 2008). Prioritering i andre land er beskrevet i kapittel 6.
7.6 Avveining mellom kriterier
Hittil i dette kapittelet har de tre hovedkriteriene blitt diskutert hver for seg. Mandatet ber utvalget «vurdere om ev. nye eller endrede kriterier bør sidestilles eller om de bør vektes ulikt». Det er derfor grunn til å se nærmere på forholdet mellom de tre kriteriene og avveiningen mellom dem.
De tre kriteriene er beskrevet som primært graderte kriterier. Mer konkret sier kriteriene at prioritet øker med henholdsvis økende helsegevinst (og andre relevante gevinster), synkende ressursbruk og økende helsetap. Siden det er snakk om graderte kriterier, er det ikke naturlig å hevde at ett eller flere kriterier må være oppfylt for at et tiltak skal bli tilbudt og finansiert. Det er et krav om en klart positiv forventet gevinst (dvs. større enn null), men utover det er det ikke naturlig å si at tiltaket må gi en gevinst over et bestemt nivå, må ha en ressursbruk under et bestemt nivå eller må gagne individer med et helsetap over et visst nivå. Graderte kriterier kan imidlertid kombineres med grenseverdier som beskrevet i kapittel 9.
Mandatet spør om prioriteringskriteriene bør «sidestilles». Etter utvalgets mening skal de ikke nødvendigvis være sidestilt, i betydningen av å bli vektlagt eksakt like mye. Men kriteriene bør vurderes samlet der de er relevante. Det er dermed en totalvurdering basert på alle de tre kriteriene som bør avgjøre hvilken prioritet hvert enkelt tiltak skal ha. Hvordan kriteriene veies mot hverandre blir da viktig.
En forenklet framgangsmåte vil bli presentert nedenfor. Denne måten passer best for formaliserte vurderinger på ledelsesnivå. Grunnideen kan imidlertid brukes av helsepersonell på klinisk nivå selv om informasjonstilgangen der er annerledes. I en forenklet modell for avveining vil uansett visse aspekter ved de tre kriteriene bli framhevet, og andre nedtonet. Framgangsmåten foreslått nedenfor vil blant annet særlig vektlegge helsegevinster. Avveining mot øvrige gevinster kan i prinsippet gjøres på samme måte, men som tidligere beskrevet vil det være utfordringer knyttet til tallfesting og verdsetting.
7.6.1 Avveining mellom helsegevinst og ressursbruk
Når de tre kriteriene skal vurderes, kan det være nyttig først å se på forholdet mellom helsegevinst og ressursbruk og deretter hvordan dette forholdet relaterer seg til helsetap. Grunner for først å vurdere helsegevinst er nevnt tidligere. Som det også er redegjort for tidligere, bør en slik vurdering inkludere en innledende bedømmelse av dokumentasjonen og en forsikring om at helsegevinsten er positiv. En grunn for deretter å vurdere ressursbruk er at det kan være lettere å si noe presist om hvordan forholdet bør være mellom helsegevinst og ressursbruk enn mellom helsegevinst og helsetap. Utvalget foreslår at når helsegevinst og ressursbruk vurderes, bør prioritet øke med brøken av de to.11 En slik tankegang er kjent fra det någjeldende kostnad-effektkriteriet, og sammenhengen mellom en slik brøk og en standard kostnad-effektbrøk ble beskrevet ovenfor. Forenklet kan man si at denne måten å avveie helsegevinstkriteriet mot ressurskriteriet på samsvarer med å si at prioritet skal synke med kostnad-effektbrøken. Å gi prioritet på denne måten kan blant annet begrunnes ut fra ønsket om å få mest mulig helsegevinst ut av de tilgjengelige ressursene. Siden det kan være forvirrende å både snakke om en helsegevinst-ressursbrøk og en kostnad-effektbrøk, vil det siste bli vektlagt fordi det er det vanlige begrepet.
7.6.2 Avveining mot helsetap
Det er mange måter et helsetapskriterium kan integreres med helsegevinst- og ressurskriteriene på (Baeten et al. 2010; Johri og Norheim 2012; Marsh et al. 2014). Utvalget finner to måter spesielt nyttige. Den mest presise måten består i å vekte hver enkelt gevinstenhet (for eksempel et godt leveår) etter størrelsen på helsetapet hos gevinstmottakeren på det tidspunktet hun eller han mottar den enheten. Vekte innebærer her å justere verdien av en gitt helsegevinst.
Direkte vekting av hver enkelt gevinstenhet er krevende. Det vil derfor ofte være behov for en enklere måte å avveie de tre kriteriene mot hverandre på. Det kan gjøres ved å vekte totalgevinsten fra tiltaket direkte og kun bruke en forenklet regel for størrelsen på vektene. En slik regel kan knyttes direkte til målgruppens helsetap, eller man kan forenkle ytterligere ved å knytte regelen kun til målgruppens helsetapsklasse. En kombinasjon er også mulig: å ta utgangspunkt helsetapsklasser og bruke en regel som tillater vekting både mellom og innenfor klassene. En slik framgangsmåte kan bestå av følgende tre trinn:
Anslå forventet helsegevinst og ressursbruk og med det kostnad-effektbrøken.
Anslå forventet helsetap og plassere aktuelle målgrupper i helsetapsklasser.
Gjøre en avveining etter en forenklet regel knyttet til disse klassene.
Trinn 1 ble beskrevet ovenfor. Trinn 2 og 3 vil bli beskrevet i det følgende.
Beregning av helsetap og plassering av målgrupper i helsetapsklasser
Det mest relevante helsetapet for et individ er forskjellen mellom et referansenivå for gode leveår og forventet antall gode leveår over livsløpet for dette individet gitt eksisterende tiltak. Et referansenivå på 80 gode leveår ble foreslått ovenfor. Ved prioritering av tiltak kan man anslå forventet helsetap for målgruppene til de tiltakene man vurderer. Hvordan anslaget kan bli gjort vil avhenge av tilgjengelig informasjon og av hvor spesifikk målgruppen er. Ved begrenset informasjon vil anslaget for helsetapet normalt bestå av det helsetapet målgruppen kan forvente seg over livsløpet som del av gjennomsnittsbefolkningen og det helsetapet de kan forvente over livsløpet på grunn av den aktuelle tilstanden tiltaket retter seg mot. På basis av slike anslag kan målgruppen bli plassert i en helsetapsklasse. Selv dersom man vil skille mellom helsetap også innenfor hver klasse, kan en innledende grovinndeling være et nyttig, blant annet for å hjelpe tenkning, kommunikasjon og diskusjon.
Utvalget foreslår at det i første omgang etableres tre helsetapsklasser, definert på basis av helsetap slik det er vist i tabell 7.1. Tabellen gir også eksempler på tilstander som er assosiert med helsetapene det er snakk om. Hvordan disse helsetapene er beregnet er beskrevet i kapittel 10. Helsetap knyttet til en større utvalg tilstander er vist i figur 10.1.
Tabell 7.1 Helsetapsklasser og assosierte tilstander
Helsetapsklasse | Helsetap hos målgruppen (tapte gode leveår) | Assosierte tilstander |
|---|---|---|
1 | Moderat (<15) | Atrieflimmer, Alzheimers sykdom, akutt koronarsyndrom |
2 | Stort (15–30) | Hjerneslag, diabetes type II, hepatitt C, kronisk hjertesvikt, avansert brystkreft |
3 | Meget stort (30–45) | Multippel sklerose, osteosarkom |
Det er mulig at målgruppen til et tiltak har helsetap større enn 45 gode leveår. En slik tilleggsklasse er ikke vist i tabellen.
Utvalget foreslår at plasseringen av tilstander i helsetapsklasser bør
bygge på epidemiologisk kunnskap om helsetap for den aktuelle målgruppe
bygge på veiledende grenser som angitt i tabell 7.1 eller oppdaterte grenser
involvere faglig ekspertise og brukere med kunnskap om den aktuelle tilstanden
Avveining etter forenklet regel
Når de aktuelle målgruppene er plassert i helsetapsklasser, kan tiltakenes helsegevinster vektes etter en forenklet regel. Som utgangspunkt vil utvalget foreslå en 1–2–3-regel, der vektene øker noenlunde gradvis med helsetap fra og med helseklasse 1 til og med helseklasse 3. Etter denne regelen er det minste mulige helsetapet i helsetapsklasse 1 knyttet til en vekt på 1, det minste mulige helsetapet i helsetapsklasse 2 knyttet til en vekt på 2 og det minste mulige helsetapet i helsetapsklasse 3 knyttet til en vekt på 3. Oppsummert: det minste mulige helsetapet i helsetapsklasse 1, 2 og 3 er knyttet til en vekt på henholdsvis 1, 2 og 3.
Mer spesifikt kan disse vektene multipliseres med totalgevinsten fra tiltaket. Dette gjør at vi kan beregne helsetapsjustert kostnad/effekt for ulike tiltak. Denne justeringen vil kunne gjøre at rangeringen av tiltak endrer seg. Figur 7.2 viser dette. Figuren bygger på data fra en nederlandsk studie fra 2005 (Bleichrodt et al. 2005) og er kun ment som en illustrasjon.1213 I kolonnen til venstre er tiltakene rangert etter kostnad-effektbrøken alene, fra lavest til høyest. I kolonnen til høyre er tiltakene rangert etter helsetapsjustert kostnad/effekt der helsegevinstene er vektet i samsvar med 1–2–3-regelen. Pilene viser hvordan rangeringen endres for flere tiltak og illustrerer dermed hvordan vektleggingen av helsetap kan påvirke prioriteringer.
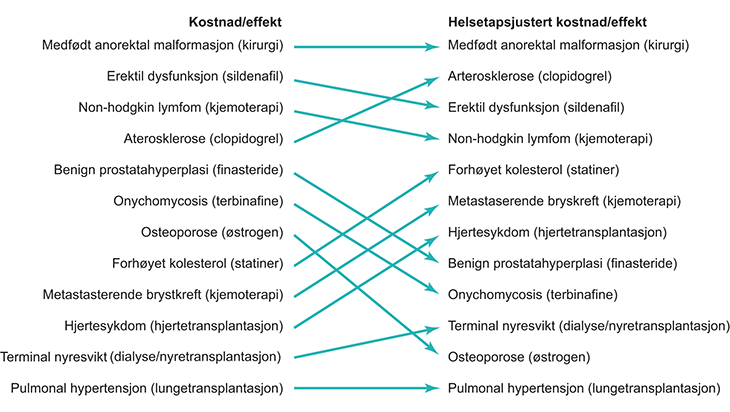
Figur 7.2 Rangering av tiltak etter kostnad/effekt og helsetapsjustert kostnad/effekt
Kilde: Modifisert etter Bleichrodt et al. 2005
Figuren viser tydelig hvordan rangeringen av tiltak på basis av deres rene kostnad-effektbrøk skiller seg fra rangeringen av de samme tiltakene på basis av deres helsetapsjusterte kostnad-effekt brøk. For eksempel får tiltakene rettet mot benign prostatahyperplasi (godartet forstørrelse av blærehalskjertelen) og onychomycosis (neglesopp) lavere prioritet dersom helsetap vektlegges. Tiltakene rettet mot aterosklerose (blodåreforkalkning) og metastaserende brystkreft (brystkreft med spredning) får derimot høyere prioritet.
1–2–3-regelen kan være nyttig for annet enn direkte vekting av helsegevinster. Den kan blant annet brukes til å justere grenseverdier, slik det er beskrevet i kapittel 9. En 1–2–3-regel kan også løsrives fra helsetapsklasser og kobles direkte til målgruppenes mer spesifikke helsetap. Til sist kan en modifisert 1–2–3-regel brukes til vekting av hver enkelt gevinstenhet, dvs. vekting på marginen.
Flere forbehold må tas når man bruker 1–2–3- regelen. Dersom helsegevinsten blir svært stor, for eksempel over 15 gode leveår, bør vekten for totalgevinsten nedjusteres noe, fordi den vektes direkte og ikke hver enhet helsegevinst. Videre sier 1–2–3-regelen ikke noe om vekting av gevinster ved helsetap større enn 45 leveår.
Mer grunnleggende mener utvalget at prinsipper eller empiriske studier ikke kan gi utvetydig støtte til eksakte vekter, dvs. støtte til hvorfor akkurat en vekt er bedre enn en litt annen vekt. I litteraturen er det nokså stor variasjon mellom de vektene som har blitt foreslått for helsetap eller relaterte karakteristika ved tiltakets målgruppe (Andersson og Lyttkens 1999; Bleichrodt et al. 2005; Dolan og Tsuchiya 2012; Olsen 2013a; Ottersen et al. 2014). Dette betyr imidlertid ikke at alle mulige vekter er like rimelige. Utvalget mener dessuten at det er svært viktig å forsøke å formulere en forenklet regel for vekting. Én grunn er at både mandatet og flere institusjoner etterspør konkretisering av prioriteringskriteriene, og særlig av det kriteriet som har med helsetap å gjøre. Mandatet ber blant annet utvalget «vurdere hvordan alvorlighetskriteriet kan anvendes på en systematisk og konsistent måte». Videre har institusjoner som Statens legemiddelverk ønsket seg en betydelig spesifisering av kriteriene og helst tallfesting av hvordan kriteriene bør avveies mot hverandre.
Med utgangspunkt i disse betraktningene mener utvalget at 1–2–3-regelen utgjør et rimelig utgangspunkt for avveining og bruk av helsetapskriteriet. Senere, for eksempel etter to–tre års utprøving, bør vektingsregelen eventuelt justeres og det etter en grundig prosess. Siden bør regelen revurderes jevnlig.
7.7 Oppsummerende vurderinger og anbefalinger
Utvalget foreslår tre overordnede kriterier for prioritering i norsk helsetjeneste: helsegevinstkriteriet, ressurskriteriet og helsetapskriteriet. Kriteriene bør alltid ses i sammenheng med hverandre og er ment å være relevante for hele helsetjenesten.
Sammenliknet med dagens tre kriterier, framstår de nye kriteriene som klarere avgrenset og mer relevante på klinisk nivå. De nye kriteriene har mange likheter med dagens kriterier, men det er også flere sentrale forskjeller. I tillegg er de nye kriteriene konkretisert i betydelig grad.
Ifølge helsegevinstkriteriet øker et tiltaks prioritet med forventet helsegevinst (og annen relevant velferdsgevinst) fra tiltaket. Det er viktig med et generelt mål på helsegevinst som sammenstiller gevinster knyttet til levetid og livskvalitet. Utvalget mener at gode leveår er et slikt mål og at det bør være det overordnede begrepet for helsegevinst i helsetjenesten.
For helsegevinstkriteriet vil helsegevinster hos den umiddelbare målgruppen normalt ha størst betydning. I tillegg tar kriteriet hensyn til helsegevinster for pårørende og samfunnet for øvrig, samt øvrige gevinster for alle parter. Disse gevinstene er relatert til blant annet informasjon, verdighet, pårørendes innsats, produksjonsgevinster og redusert framtidig ressursbruk i samfunnet. Utvalget anbefaler at beslutningstakere ved vurdering av prioritet tar utgangspunkt i helsegevinstene. Dersom et aktuelt tiltak også har andre betydelige gevinster, kan disse tillegges vekt så fremt det er sikret at det ikke vil gi urettferdige fordelingsvirkninger.
Helsesektorens ressurser er begrensede og har alltid alternative anvendelser. Derfor er det høyst prioriteringsrelevant å ta hensyn til hvor mye ressurser et tiltak legger beslag på. Etter ressurskriteriet får et tiltak høyere prioritet desto mindre ressurser det er forventet å forbruke. Utvalget anbefaler at beslutningstakere tar utgangspunkt i ressursbruken innenfor helsetjenesten. Dersom et aktuelt tiltak utløser betydelig ressursbruk utenfor helsetjenesten, kan dette tillegges vekt så fremt det er sikret at det ikke vil gi urettferdige fordelingsvirkninger.
Kombinasjonen av helsegevinstkriteriet og ressurskriteriet vil under visse forutsetninger gi opphav til prioriteringer tilsvarende de som følger fra et kostnad-effektkriterium.
Ifølge helsetapskriteriet øker et tiltaks prioritet med forventet helsetap over livsløpet hos den eller de som får helsegevinst. Det relevante helsetapet er tapet i gode leveår, gitt eksisterende tilbud, relativt til et referansenivå på 80 gode leveår. Sammenliknet med dagens alvorlighetskriterium er det særlig én likhet og tre ulikheter. Begge kriteriene gir prioritet til de med det dårligste utgangspunktet. Men de vektlegger forskjellige utgangspunkt ettersom helsetapskriteriet favner videre, og helsetapskriteriet er spesifikt på mange områder der alvorlighetskriteriet ikke gir konkret veiledning. I tillegg refererer helsetapskriteriet til forventet helsetap hos gevinstmottakerne i det de får gevinst, mens alvolighetskriteriet normalt blir forstått som å gjelde forventet prognose hos tiltaksmottakerene i det oppstart av tiltaket er aktuelt.
Avveiningen mellom de tre kriteriene er viktig. Utvalget anbefaler å anvende en forenklet prosedyre med tre trinn i mange situasjoner: først anslå forventet helsegevinst og ressursbruk og med det kostnad-effektbrøken; deretter anslå forventet helsetap og plassere aktuelle målgrupper i helsetapsklasser; og til sist gjøre en avveining etter en forenklet regel knyttet til disse klassene. Som utgangspunkt anbefaler utvalget en 1–2–3-regel, der det minste mulige helsetapet i helsetapsklasse 1, 2 og 3 er knyttet til en vekt på henholdsvis 1, 2 og 3. Også ved mindre strukturerte vurderinger vil en tilsvarende tankegang være nyttig.
8 Andre foreslåtte kriterier
I kapittel 7 foreslo utvalget tre overordnede kriterier for prioritering i norsk helsetjeneste:
Helsegevinstkriteriet
Ressurskriteriet
Helsetapskriteriet
Andre kriterier har også blitt foreslått. Med henvisning til de tre kriteriene anbefalt av Lønning II-utvalget, ber mandatet utvalget om å «vurdere om også andre kriterier skal legges til grunn ved prioriteringer». Det er derfor nyttig å vurdere om det er behov for å supplere de tre hovedkriteriene, eller om det er mest hensiktsmessig at helsetjenesten konsentrerer seg om dem.
En rekke kriterier har blitt foreslått eller diskutert i norsk og internasjonal litteratur (NOU 1987; Kilner 1990; Elster 1992; Norheim 1996; NOU 1997; NOU 1997; Musgrove 1999; Cookson og Dolan 2000; Feiring 2004; Kapiriri og Norheim 2004; Noorani et al. 2007; Persad et al. 2009; Orr et al. 2011; Norheim et al. 2014). Det er begrenset enighet om terminologi og kategorisering, og kriteriene overlapper ofte hverandre. I det følgende vil utvalget se nærmere på de fire potensielle tilleggskriteriene som mandatet nevner spesifikt. Dette er kriterier relatert til alder, mangel på alternativt tiltak, bidrag til innovasjon og sjeldne tilstander.
I vurderingen av kriterier er det viktig å være oppmerksom på hvordan de potensielle tilleggskriteriene kan overlappe et eller flere av de tre hovedkriteriene. Noen av de hensynene som er knyttet til de potensielle tilleggskriteriene, vil derfor allerede være helt eller delvis ivaretatt av hovedkriteriene. Samtidig er det viktig å være oppmerksom på hvordan hvert enkelt tilleggskriterium vil kunne påvirke hovedkriteriene. For at et tilleggskriterium skal være praktisk relevant, og mer enn en «tie-breaker», bør det kunne veie tyngre enn et av hovedkriteriene i alle fall i noen tilfeller. Dette betyr også at dersom man introduserer et tilleggskriterium, vil det normalt gå på «bekostning» av ett eller flere av de tre hovedkriteriene, dvs. det vil svekke deres betydning for prioriteringer. I vurderingen av potensielle tilleggskriterier bør man derfor alltid spørre seg om man er villig til å «ofre» noe av hovedkriteriene for det mulige tilleggskriteriet.
Utvalget konkluderer med at i den grad de fire potensielle tilleggskriteriene representerer relevante hensyn, er disse hensynene allerede ivaretatt av de tre hovedkriteriene. De fire foreslåtte kriteriene bør derfor ikke tilegges selvstendig vekt, og det er ikke grunnlag for tilleggskriterier på linje med de tre hovedkriteriene. Samtidig kan alder, mangel på alternativt tiltak, bidrag til innovasjon og sjeldenhet påvirke prioritet via hovedkriteriene.
8.1 Alder
I mandatet bes utvalget vurdere «hvorvidt alder bør ha egenverdi ved prioritering». Utvalget forstår dette som et spørsmål om hvorvidt alder bør ha en selvstendig påvirkning på prioritering, og om det bør benyttes et selvstendig alderskriterium ved prioritering i helsetjenesten.
8.1.1 Dagens normer og praksis
Lønning II-utvalget mente at alder som kriterium kan inngå i skjønnsmessige prioriteringsbeslutninger på klinisk nivå. Utvalget pekte blant annet på at alder er relevant i den grad det har betydning for behandlingens risiko eller effekt. Videre mente utvalget at alder som kriterium kan legges til grunn ved fordeling av svært knappe goder, og at i en situasjon med ressursknapphet er det rimelig at det ikke igangsettes omfattende livsforlengende behandling ved svært høy alder.
Andre sentrale dokumenter sier lite om hvordan alder bør påvirke prioriteringer. Dette inkluderer helsepersonelloven, pasientrettighetsloven, prioriteringsforskriften og Legeforeningens etiske regler for leger. Noe mer utfyllende er retningslinjene for det nasjonale systemet for innføring av nye metoder i spesialisthelsetjenesten. I vurderingen av nye metoder er det bestemt at «aldersnøytralitet» skal legges til grunn. Med dette forstås at «[d]et er den aktuelle metodens eventuelle dårligere effektivitet eller økende bivirkninger/komplikasjoner med økende alder som vil måtte trekkes inn i den enkelte vurdering, ikke alder i seg selv» (se boks 5.3).
Alder har også en sentral plass i mange, mer konkrete anbefalinger. Et eksempel er Helsedirektoratets prioriteringsveiledere, der alder inkluderes under forhold som bør vurderes ved den individuelle rettighets- og fristtildelingen (Helsebiblioteket 2014). Tilsvarende bygger nasjonale og internasjonale faglige retningslinjer ofte på en eller flere typer aldersinndeling (Helsedirektoratet 2009). Alder gjør seg også gjeldende i praksis på mange ulike måter. Et eksempel er hvordan alder delvis avgjorde i hvilken rekkefølge befolkningen fikk vaksine under utbruddet av svineinfluensa i 2009 (Moe og Hultgren 2009). Et helt annet eksempel er den politiske beslutningen om kortere ventetid for psykiatrisk utredning og behandling for barn og ungdom (Helsedirektoratet 2008).
Alder er av stor betydning når helsepersonell vurderer pasienter. Dette vises ved for eksempel hvor tidlig alder blir nevnt når kollegaer diskuterer pasienter. Blant annet er alder viktig i diagnostikken fordi det sier noe om risikoen for ulike tilstander, inkludert kreft og hjerte-kar-sykdom. Alder kan også si noe om hvor alvorlig en sykdom kan forventes å bli. Lungebetennelse og influensa blir for eksempel ofte mer alvorlig for de svært unge og de svært gamle. Alder kan også indikere hvor stor gevinst som kan forventes av vellykket behandling. Dette er nærmere beskrevet nedenfor. Samtidig kan alder si noe om risikoen ved behandling. Små barn og eldre har for eksempel ofte økt risiko for komplikasjoner under og etter kirurgi, noe blant annet anestesileger tar hensyn til.
Helsepersonell tillegger altså alder vekt i sine vurderinger, mer eller mindre ubevisst. I noen tilfeller er helseinstitusjonene klare på at alder påvirker prioriteringer. I akuttmottaket på Akershus Universitetssykehus (AHUS) hang det tidligere en plakat som forklarer pasientene hvilke kriterier som brukes for å bestemme i hvilken rekkefølge de blir tilsett. Plakatteksten gjorde det blant annet klart at barn prioriteres før eldre.
Normene uttrykt både i sentrale dokumenter og i helsepersonells praksis indikerer at alder har en veletablert rolle i prioritering i Norge i dag. Til en viss grad synes dette å stå i kontrast til de uttalte holdningene blant helsepersonell og hos folk flest. I empiriske studier finner man at helsepersonell kan være både støttende og avvisende til aldersbasert prioritering (Neuberger et al. 1998; Ryynänen et al. 1999; Werntoft og Edberg 2009). Dette samsvarer med de erfaringene utvalgets medlemmer har: de har både møtt helsepersonell som har uttrykt at prioritering med utgangspunkt i alder er uetisk, og de har møtt helsepersonell som mener at slik prioritering er åpenbart riktig. Også empiriske studier av holdningene i befolkningen viser sprikende resultater (Dolan et al. 2005).
Den tilsynelatende uenigheten om hvilken rolle alder bør spille i prioritering, kan bero på at alder kan påvirke prioriteringer på mange ulike måter. Noen av disse er hensiktsmessige og legitime, mens andre ikke er det.
8.1.2 Et avgjørende skille
Utvalget mener særlig én distinksjon er helt avgjørende når det gjelder alder: om alder spiller en selvstendig eller uselvstendig rolle.
Det første innebærer at alder i seg selv blir vektlagt og på den måten får påvirke prioriteringer. At alder per se blir vektlagt betyr at alder vil bli regnet som relevant selv når det er tatt tilstrekkelig hensyn til alle andre faktorer. Det andre alternativet er at alder kun spiller en avledet rolle, noe som kan skje på to måter. For det første kan alder spille en avledet rolle ved at aldersrelatert prioritering er en konsekvens av at beslutningstakere vektlegger ett eller flere andre hensyn. Alderens rolle i prioritering bygger da på en korrelasjon mellom alder og en annen karakteristikk med selvstendig betydning. Korrelasjonen vil gjøre at prioritering etter den karakteristikken resulterer i prioriteringer som samvarierer med alder. Det trenger verken å være forventet eller ønsket av beslutningstakeren. Dette kan kalles indirekte aldersprioritering. Et eksempel er prioritering etter antall forventede gode leveår fra tiltaket. Det kan gi opphav til indirekte aldersprioritering blant annet fordi eldre ofte har kortere gjenværende levetid enn yngre (Tsuchiya 2000; Edlin et al. 2008).
For det andre kan alder spille en avledet rolle ved at beslutningstakere aktivt benytter en kjent eller antatt korrelasjon mellom alder og en karakteristikk med selvstendig betydning for å kunne bedre vektlegge den sistnevnte karakteristikken. I visse tilfeller kan det da være hensiktsmessig for beslutningstakeren å bruke alder som en av flere indikatorer for den relevante karakteristikken. Alder fungerer da som et indikatorkriterium (Feiring 2004). Dette er særlig nyttig i de tilfellene der det er lettere å observere alder enn den relevante karakteristikken direkte. Mer spesifikt kan beslutningstakeren da vektlegge alder i den grad og på den måte alder korrelerer med denne karakteristikken. Lønning II-utvalget foreslo for eksempel at alder er relevant i den grad det har betydning for behandlingens risiko eller effekt. En tilsvarende rolle har alder også i mange retningslinjer og i klinisk praksis generelt, slik det ble beskrevet ovenfor. Som for alle indikatorer, vil uansett rimeligheten av å bruke alder på disse måtene avhenge av hvor godt alder og den aktuelle karakteristikken er korrelert.
8.1.3 Alder og hovedkriteriene
Alder er korrelert med flere av karakteristikkene som hovedkriteriene legger vekt på. Hovedkriteriene kan derfor gi opphav til visse former for indirekte aldersprioritering. I tillegg vil det i flere tilfeller være nyttig for å beslutningstakeren å bruke alder som indikator når hun eller han vil prioritere etter hovedkriteriene.
Helsegevinstkriteriet
Helsegevinstkriteriet tar hensyn til flere typer gevinster som er korrelert med alder. Forventet helsegevinst fra et tiltak kan for eksempel avhenge av risiko for sykdom eller forverring i målgruppen, noe som igjen er korrelert med alder. Dette er særlig aktuelt for diagnostiske og forebyggende tiltak. For noen tilstander er risikoen størst i ung alder (for eksempel svineinfluensa), mens for mange andre tilstander er den størst i høy alder (for eksempel hjerte- og karsykdom og prostatakreft). Som beskrevet ovenfor kan også risiko for at en gitt tilstand blir alvorlig variere med alder, og forventet helsegevinst fra et helbredende tiltak vil dermed variere tilsvarende.
Videre vil helsegevinstkriteriet ofte kunne favorisere yngre framfor eldre fordi de yngre har lengre forventet gjenværende levetid, annet likt. I tillegg er alder blant annet korrelert med sykelighet og komorbiditet, risiko for komplikasjoner under behandling, og yrkesaktivitet og produktivitetsgevinster.
Eksemplene beskrevet her viser hvordan indirekte aldersprioritering etter helsegevinstkriteriet ikke alltid favoriserer de yngre framfor de eldre, selv om det ofte vil gjøre det.
Ressurskriteriet
Bruken av innsatsfaktorer kan også være korrelert med alder. Visse tiltak vil for eksempel være mer komplekse å gjennomføre for småbarn og eldre, blant annet på grunn av aldersbetingede fysiologiske variasjoner eller generell sykelighet. Slike forhold vil ofte føre til økt ressursbruk.
Helsetapskriteriet
Som beskrevet ovenfor er helsetap og alder til en viss grad korrelert. Høyere alder innebærer normalt mindre forventet helsetap. Men det er ikke bestandig slik. Av to personer eller grupper kan den eldre ha større helsetap på grunn av andre forhold, som for eksempel sykdom som reduserer helserelatert livskvalitet, livslengde eller begge deler.
8.1.4 Begrensninger
Mange mener at det bør være visse begrensninger for hvordan prioritet varierer med alder, og for hvordan alder påvirker prioriteringer, selv i de tilfellene der alder i seg selv ikke blir vektlagt. Urettmessig variasjon eller påvirkning blir iblant diskutert i form av henholdsvis indirekte diskriminering og statistisk diskriminering (Alexander 1992; Hellman 2008; Lippert-Rasmussen 2014). De fleste er enige i at en viss indirekte aldersprioritering er akseptabel, og at også bruk av alder som indikator kan være både nyttig og legitimt. Dette ser vi også av den utbredte bruken av alder som indikator i klinisk praksis.
Begrunnelsen for indirekte aldersprioritering som en konsekvens av de tre hovedkriteriene følger av begrunnelsen for de tre kriteriene selv. Hovedmotivasjonen for alder som indikator følger av hovedkriteriene i tillegg til eventuell kjent korrelasjon med alder. Dette fremhever hvordan alder kun bør spille en rolle i prioritering i den grad det kan begrunnes ut fra de tre hovedkriteriene.
Også mer generelt er det begrensninger knyttet til bruk av alder som indikator (Feiring 2004). Blant annet bør korrelasjonen som legges til grunn, være tilstrekkelig dokumentert. At alder kun bør brukes som indikator i den grad det kan begrunnes ut fra de tre hovedkriteriene betyr blant annet at også andre indikatorer må tas i bruk, og at de ulike indikatorene må sammenstilles på en god måte. Særlig når det gjøres prioriteringer mellom enkeltindivider, er det viktig å ta tilstrekkelig hensyn til unntak fra den generelle sammenhengen mellom alder og den karakteristikken som er mer direkte relevant for kriteriene. Selv om for eksempel økende alder er korrelert med økende verdi av en annen karakteristikk (for eksempel risiko), vil det normalt ikke være slik for alle individer og i alle situasjoner. Dette skyldes blant annet at kronologisk alder ofte kan være forskjellig fra biologisk alder.
Dersom man foretar tilstrekkelige begrensninger, er det ofte akseptert at det å ta hensyn til alder ikke trenger å innebære forskjellsbehandling eller diskriminering i negativ forstand. Dette gjelder blant annet for alder som en av flere indikatorer for utvelgelse av pasienter til transplantasjon eller in vitro fertilisering. Alder som indikator på helsegevinst og helsetap kan i slike tilfeller aksepteres. En grunn er at alder kan være relatert til noe som i seg selv er av betydning, slik det har blitt beskrevet ovenfor. I tillegg er alder en spesiell karakteristikk ved personer ved at den endrer seg gjennom livet, til forskjell fra for eksempel hudfarge og kjønn, og gjør dette på en måte som er lik for alle som ikke dør. De fleste vil derfor få både høy og lav prioritet i løpet av livet. Der prioritet synker med alder, vil det dessuten være slik at de som har lavere prioritet, vil ha hatt høyere prioritet tidligere i livet (Kappel og Sandøe 1994). Det er også slik at høy alder, særlig sett ut fra et livsløpsperspektiv, ikke nødvendigvis er å betrakte som en ulempe i seg selv. I stedet kan høy alder indikere noe fordelaktig: at man har fått leve et langt liv.
8.1.5 Utvalgets vurdering
Utvalget mener at alder i seg selv ikke er relevant som kriterium for prioritering og ikke bør vektlegges i seg selv. Det betyr også at alder per se aldri bør ekskludere noen fra behandling. På denne bakgrunn mener utvalget at det ikke er grunnlag for noe eget alderskriterium som skal gå utover de tre hovedkriteriene.
Utvalget mener imidlertid at indirekte aldersprioritering kan være akseptabelt i den grad det følger av en riktig bruk av de tre hovedkriteriene. Utvalget mener også at alder kan være en nyttig og legitim indikator i anvendelsen av disse kriteriene. Alder bør imidlertid kun brukes som indikator i den grad det kan begrunnes ut fra de tre hovedkriteriene. Det følger av dette at alder ikke bør brukes som indikator alene, og at det ikke er grunnlag for absolutte aldersgrenser for tilbud om offentlige helsetjenester.
8.2 Mangel på alternativt tiltak
I mandatet bes utvalget om å vurdere om «et tiltak skal prioriteres dersom det ikke eksisterer andre alternative behandlingsformer». Flere har diskutert hvorvidt tiltak rettet mot en tilstand eller målgruppe uten noe alternativt tiltak bør få prioritet (Hughes et al. 2005; McCabe et al. 2006; Orr et al. 2011; Pinxten et al. 2012).
8.2.1 Konkretisering
Et mangel-på-alternativ-kriterium må konkretiseres betydelig for å kunne vurderes. Det er særlig viktig å være klar på hva som menes med «tiltak», og hva som avgrenser en tilstand eller målgruppe fra en annen.
Tiltak
Først må det avklares hva som menes med alternativ «behandlingsform» eller alternativt «tiltak».14 Normalt regnes blant annet støttende og lindrende behandling som tiltak. I et mangel-på-alternativ-kriterium kan man imidlertid ikke regne all slik behandling som tiltak. Dette er fordi alle i Norge får tilbud om i alle fall enkel støttende og lindrende behandling, og alle andre tiltak vil ha slik behandling som et alternativt tiltak. Akkurat hvilke tiltak de som har foreslått et mangel-på-alternativ kriterium selv mener er og ikke er relevante som alternative tiltak, er uklart. Blant annet har sykdomsmodifiserende behandling og aktiv behandling blitt foreslått som relevante typer tiltak, men disse begrepene gir ingen umiddelbar klar og rimelig avgrensning. I det følgende vil «alternativt tiltak» og «etablert tiltak» vise til tiltak som går utover enkel, støttende og lindrende behandling og samtidig forventes å gi mer enn en marginal helsegevinst. For et plausibelt mangel-på-alternativ-kriterium er det dessuten ikke nok at det alternative tiltaket eksisterer i betydning av å være utviklet. Det må også være tilstrekkelig dokumentert og implementert.
Tilstand og målgruppe
Et tiltak uten alternativ er forstått som et tiltak som retter seg mot en tilstand eller målgruppe som det ikke finnes et annet, etablert tiltak for. For eksempel så mange på medisinen ipilimumab som et slikt tiltak da den først ble vurdert for behandling av hudkreft for et par år tilbake. Dersom mangel på alternativ forstås på denne måten, blir inndelingen av tilstand og målgrupper viktig. Det finnes, for å bruke et annet eksempel, mange etablerte tiltak for lungekreft generelt, samtidig som det for såkalt småcellet lungekreft er svært begrensede behandlingsmuligheter. På samme måte finnes det etablerte tiltak for noen former for multippel sklerose (MS), men i liten eller ingen grad for det som kalles primær progressiv MS (Helsedirektoratet 2011a). Det synes rimelig at et mangel-på-alternativ-kriterium tar hensyn til slike variasjoner.
Et særlig viktig spørsmål når det gjelder både tilstander og målgrupper, er om inndelingen skal ta hensyn til stadier i tilstands- eller behandlingsforløpet. Dersom tilstander og målgrupper knyttes til stadium, vil dette kunne ha to viktige konsekvenser. Den første er at mangel-på-alternativ-kriteriet vil kunne gi prioritet til alle tiltak som retter seg mot pasienter som, på det tidspunkt tiltaket er aktuelt, ellers ikke kan forvente fremtidige tiltak utover enkel støttende og lindrende behandling. Det vil for eksempel inkludere mange av de pasientene som sies å være i en terminal fase. Kriteriet vil derfor favne vidt og gå langt utover bare å prioritere tiltak rettet mot klart avgrensete sykdommer uten et etablert tiltak noe som helst sted i forløpet.
Den andre følgen av et mangel-på-alternativ-kriterium som skiller mellom ulike stadier er at det ofte vil gi prioritet selv til tiltak der mange i målgruppen allerede har fått en eller flere typer behandling for sin grunnleggende tilstand. Generelt kan man si at et slikt kriterium vil gi prioritet til tiltak som retter seg mot enhver tilstand eller målgruppe som det ikke finnes noen gjenværende tiltak for. Spørsmålet om hvorvidt et slikt kriterium bør benyttes, er blant annet knyttet til spørsmålet om såkalte «last chance therapies», og om tiltak i livets sluttfase bør få prioritet (Daniels og Sabin 1998; Fleck 2001; Menzel 2011).
Et kriterium som ikke skiller mellom ulike stadier i et sykdomsforløp, knytter seg derimot tettere til andre spørsmål og hensyn. Flere av disse blir diskutert nedenfor. Både en stadie-avhengig og en stadie-uavhengig versjon av mangel-på-alternativ-kriteriet synes å kunne være relevant. De to versjonene vil imidlertid ha ulike prioriteringskonsekvenser, og de vil trenge ulike begrunnelser. I det følgende vil mangel-på-alternativ-kriteriet bli forstått slik at de relevante tilstandene og målgruppene ikke er inndelt etter stadium. Dette er blant annet i tråd med hvordan hensynet til mangel på alternativ som regel fremstår i debatten om sjeldne tilstander (Hughes et al. 2005; McCabe et al. 2006; Pinxten et al. 2012).
Oppsummert kan et mangel-på-alternativ-kriterium forstås som det kriteriet som gir følgende tiltak prioritet: tiltak rettet mot en tilstand eller målgruppe der det ikke er et tilstrekkelig, etablert tilbud om noe tiltak som går utover enkel støttende og lindrende behandling, og som samtidig forventes å gi mer enn en marginal helsegevinst.
8.2.2 Foreslått begrunnelse
Flere ulike grunner for et mangel-på-alternativ-kriterium har blitt foreslått eller kan tenkes å støtte et slikt kriterium (Hughes et al. 2005; Orr et al. 2011; Pinxten et al. 2012).
Dårligere stilt
En mulig grunn er at personer med en tilstand uten noe etablert tiltak er dårligere stilt enn personer med en tilstand med ett eller flere etablerte tiltak. Om det faktisk forholder seg slik, avhenger blant annet av hva som menes med «dårligere stilt». I kapittel 7 foreslo utvalget at den mest relevante forståelsen av «dårligere stilt» i prioriteringssammenheng er i form av å ha større helsetap, der helsetapet er justert for effekten av allerede etablerte tiltak. I den grad tiltak uten alternativer er assosiert med større helsetap, vil derfor helsetapskriteriet ta hensyn til dette.
Forlatt av helsetjenesten
En annen mulig begrunnelse for mangel-på-alternativ-kriteriet er at personer med en tilstand uten etablert tilbud om noe som helst tiltak er forlatt, sviktet eller oppgitt av helsetjenesten (Hughes et al. 2005). Ideen er at innføringen av det første tiltaket da blir ekstra viktig, og at slike tiltak uten alternativer bør prioriteres. Dette argumentet tar imidlertid ikke tilstrekkelig hensyn til at alle i Norge får tilbud om støttende og lindrende behandling i helsetjenesten når de trenger det. Selv for tilstander som mangler tiltak som går utover slik behandling, blir det derfor unaturlig å si at personer med disse tilstandene blir forlatt av helsetjenesten.
Ressursbruk
En tredje mulig begrunnelse bygger på ideen om at de med en tilstand uten noen etablerte tiltak ikke en gang har fått glede av litt av helsetjenestens ressurser, og at tiltak rettet mot slike tilstander derfor bør få prioritet. En slik argumentasjon er problematisk av minst tre grunner.
For det første kan støttende og lindrende tiltak være ressurskrevende. For det andre kan personer med en tilstand uten etablerte tiltak ha, ha hatt eller senere få andre tilstander med etablert, ressurskrevende behandling. For det tredje er det generelt vanskelig å forsvare en praksis der pasienter får prioritet etter hvor mye ressurser helsetjenesten allerede har brukt eller forventer å bruke på dem som person, og på en måte som går utover helsegevinster og ressursbruk knyttet til det aktuelle tiltaket.
Håp
En fjerde mulig begrunnelse for et mangel-på-alternativ-kriterium handler om håp. Ideen er at innføringen av tiltak som ikke har et etablert alternativ, i spesielt stor grad vil fremme og bevare håp hos dem med tilstanden. Dette kan særlig gjelde håpet om å bli frisk eller om å få det bedre enn tilstandens naturlige forløp skulle tilsi.
Tiltak rettet mot tilstander uten eksisterende tiltak bidrar trolig ofte til å fremme og bevare håp. En slik gevinst synes dessuten å være relevant for prioritering, særlig tatt i betraktning at livskvalitet og andre øvrige velferdsgevinster er det.15 Tiltak som spesielt fremmer og bevarer håp, kan derfor fanges inn av helsegevinstkriteriet slik det er definert i kapittel 7.
Det er like fullt viktig å være oppmerksom på at det ikke bare er tiltak rettet mot tilstander helt uten etablerte tiltak som vil ha spesielt stor innvirkning på håp. Nær sagt alle tiltak som retter seg mot personer uten gjenværende behandlingsmuligheter, kan ventes å bidra til å fremme og bevare håp i spesielt stor grad. Som drøftet ovenfor befinner mange personer seg i en situasjon der de har fått flere ulike behandlinger for sin tilstand, men uten å bli helt friske. Utsiktene til å få ytterligere et tiltak kan da fremme og bevare håpet om å bli frisk eller i det minste å få det bedre.
Når det gjelder et tiltaks innvirkning på håp, er det også mange andre faktorer enn alternative tiltak som spiller inn. Blant disse er sannsynligheten for at tiltaket skal virke, forventet helsegevinst dersom det oppnås, og om tiltaket inkluderer en mulighet for å kunne bli helt frisk.
Dersom håp om helsegevinst tillegges vekt som velferdsgevinst utover selve helsegevinsten, vil det kunne føre til at visse tiltak blir prioritert selv om annen ressursbruk ville gitt størst helsegevinst. Med andre ord: dersom man tillegger håp en slik selvstendig betydning, vil man måtte forvente å forsake noe helsegevinst. I noen grad synes dette akseptabelt, og studier av folks holdninger i Australia og USA tyder på at mange er villig til å gjøre slike offer (Nord et al. 1995; Ubel og Loewenstein 1996). Det er imidlertid viktig at styrket håp ikke tillegges for stor vekt vis-à-vis helsegevinster, og de ulike gevinstene må som ellers balanseres mot hverandre.
8.2.3 Utvalgets vurdering
I den grad tiltak uten alternativer er knyttet til betydelig helsetap, og det er ofte grunnen til at mangel på alternativer trekkes fram, vil helsetapskriteriet ta hensyn til dette. Slik helsegevinstkriteriet er spesifisert i kapittel 7, kan det dessuten ta hensyn til gevinster relatert til håp. I den grad tiltak uten alternativer bidrar til å fremme og bevare håp, kan derfor dette ivaretas av helsegevinstkriteriet. Utvalget finner ikke grunner som skulle tilsi et separat mangel-på-alternativ-kriterium og dermed en svekkelse av de tre hovedkriteriene.
8.3 Bidrag til innovasjon
Blant kriteriene mandatet ber utvalget vurdere, er et knyttet til «om et tiltak kan gi bidrag til innovasjon i behandlingsmetoder». Utvalget har forstått dette slik at mandatet ber utvalget vurdere om helsetjenesten bør ha et eget innovasjonskriterium som tilsier at tiltak som forventes å gi særlige bidrag til innovasjon, skal ha prioritet. Et slikt kriterium knyttet til tiltakets innovasjonspotensiale er blitt diskutert av flere (Claxton et al. 2008; Claxton et al. 2009; Orr et al. 2011).
Også en annen type innovasjonskriterium har blitt diskutert. Ifølge dette skal tiltak som representerer en allerede realisert innovasjon, ha prioritet (Kennedy 2009; Aronson et al. 2012). Et slik kriterium vil ikke bli drøftet av utvalget.
8.3.1 Innovasjon
Innovasjon har blitt definert på ulike måter (Nærings- og fiskeridepartementet 2008; Varkey et al. 2008; Kennedy 2009; Ferner et al. 2010; Omachonu og Einspruch 2010; NOU 2011; Aronson et al. 2012). Felles for de mange definisjonene er at de sier at en innovasjon er noe nytt og typisk noe som går utover å være ren idé eller teoretisk kunnskap.16 Dette nye kan være et produkt eller en tjeneste, en prosess eller en organisasjonsform. For å være en innovasjon må det nye som regel også medføre positiv verdi. I helsetjenesten representerer forbedret helse for brukerne en særlig viktig verdi.
En del definisjoner av begrepet krever dessuten at grad av nyhet og eventuelt grad av verdi skal være over en viss terskel. For eksempel mener mange at en innovasjon må representere noe betydelig nytt. Forstått på denne måten har innovasjon utvilsomt bidratt til å utvikle helsetjenesten og til å fremme folkehelsen. Blant legemidler som har revolusjonert medisinen, kan nevnes antibiotika, steroider, morfin (smertestillende), acetylsalisylsyre (blodfortynnende), insulin (blodsukkersenkende) og statiner (kolesterolsenkende), i tillegg til vaksiner og anestesi mer generelt. Eksempler på banebrytende prosedyrer er transplantasjoner, kikkhullskirurgi, perkutan koronar intervensjon og endoskopi, samt diagnostiske metoder som røntgen og senere CT og MR. Utenfor helsetjenesten finner vi viktige innovasjoner som utviklingen av hygienetiltak og regulering av skadelig stoffer, inkludert tobakk. De fleste innovasjoner er naturlig nok mindre grensesprengende enn de nevnte.
Innovasjon er også en kontinuerlig prosess, og helsetiltak kan i seg selv bidra til videre innovasjon. Et spørsmål er om tiltak som forventes å gi særlige bidrag til innovasjon, skal ha prioritet over tiltak som i mindre grad forventes å gi slike bidrag.
8.3.2 Hvordan helsetiltak kan bidra til innovasjon
Betalingen som følger implementeringen av et tiltak, kan bidra til innovasjon på to måter. Den som mottar betalingen, vil få mer midler til å finansiere videre forskning og utvikling, og betalingen vil kunne signalisere til alle utviklere en viss betalingsvilje for framtidige tiltak.
Mandatet peker på helsetiltak mer direkte, i form av situasjoner der «et tiltak kan gi bidrag til innovasjon i behandlingsmetoder». Helsetiltak kan i seg selv bidra til innovasjon på to måter: ved at de gir helsepersonell og virksomheter praktisk erfaring, og ved at de bidrar til ny kunnskap. Begge deler kan gi innovasjon i form av forbedringer av det aktuelle tiltaket, forbedringer av andre, eksisterende tiltak eller å gi opphav til nye tiltak.
Helsepersonell og virksomheter som får erfaring i å gjennomføre et gitt tiltak, vil etter hvert utføre det bedre, sikrere og mer effektivt. På den måten kan helsegevinsten fra tiltaket bli større, ressursbruken lavere eller begge deler. Det samme kan skje mer indirekte via ny statistikk. Innføringen av de første typene kikkhullskirurgi hadde blant annet slike effekter og ga i tillegg opphav til andre typer kikkhullskirurgi. Til en viss grad kan man si det samme om tidlig bruk av en gitt legemiddelklasse.
Både praktisk erfaring og ny statistikk kan dessuten gjøre at man blir bedre til å skille ut de pasientene som får god effekt og lite bivirkninger fra tiltaket. I en stor målgruppe er det ofte en mindre gruppe som ikke får noen helsegevinst fra tiltaket. Dersom man klarer å identifisere disse og la være å behandle dem, vil tiltaket gi større gjennomsnittlig helsegevinst per pasient, og man unngår unødvendig behandling. Målet med fase IV-studien av legemiddelet ipilimumab for pasienter med føflekkreft er blant annet bedre å kunne skille mellom de pasientene som har, og de som ikke har nytte av behandlingen (REK 2014). Behandling og forskning kan også kombineres på mange andre måter, og den presise grensen mellom forskning og behandling har blitt mye diskutert.
Mange tiltak kan ha innovasjonseffekter av noen av de typene som er beskrevet her. For at forventet bidrag til innovasjon skal kunne påvirke prioriteringer mellom tiltak, må det uansett være påviselige forskjeller mellom tiltakene på dette punktet.
8.3.3 Konsekvenser av et innovasjonskriterium
Dersom det innføres et kriterium i tillegg til de tre hovedkriteriene, vil betydningen av de tre bli redusert. Et innovasjonskriterium kan ha slik effekt generelt eller spesifikt knyttet til ett av hovedkriteriene. For eksempel kan et innovasjonskriterium innebære at man tillater en noe høyere ressursbruk for tiltak med stort innovasjonspotensiale, sammenlignet med andre ellers like tiltak. Alternativt kan et innovasjonskriterium innebære at et tiltak med stort innovasjonspotensiale blir møtt med et noe lavere dokumentasjonskrav, i alle fall på kort sikt, enn andre tiltak.
Når man skal vurdere de mer presise implikasjonene av et innovasjonskriterium, er det en nyttig forenkling å forutsette at helsetapet knyttet til de ulike tiltakene er likt, og i første omgang at også dokumentasjonsnivået er det. Gitt disse forutsetningene er det lett å se hvordan et innovasjonskriterium vil kunne medføre prioritet til et tiltak som direkte gir mindre helsegevinst i forhold til ressursbruk enn et annet, dersom det første tiltaket kommer med et større innovasjonspotensiale. I alle fall på kort sikt vil da helsetjenesten og samfunnet gå glipp av gode leveår som ellers kunne blitt vunnet. Et avgjørende spørsmål blir om gevinstene fra en eventuell innovasjon, justert for sannsynlighet, er store nok på lengre sikt til å kompensere for dette tapet.
Gevinstene fra forskning og innovasjon er utfordrende å anslå, både generelt og i de fleste enkelttilfeller. Spørsmålet om et innovasjonskriterium for prioritering av helsetiltak involverer i tillegg flere kompliserende faktorer knyttet til dynamiske effekter. Slike effekter gjør det usikkert om et slikt kriterium vil være fordelaktig for folkehelsen på lengre sikt. For det første kan prioritet på basis av innovasjonspotensiale redusere insentivene og mulighetene til å realisere slike potensialer (Claxton et al. 2009; Griffin et al. 2011). For det andre kan prioritet på basis av innovasjonspotensiale gjøre at man betaler flere ganger for de «samme» gevinstene (Claxton et al. 2008; Claxton et al. 2009). Dette kan skje dersom helsetjenesten først finansierer et tiltak delvis på basis av gevinster knyttet til dets innovasjonspotensiale, og dersom helsetjenesten deretter finansierer tiltaket som representerer innovasjonen på basis av dets gevinster. Selv i tilfeller med vellykket innovasjon kan da helsetjenesten ende opp med å bruke mer ressurser per helsegevinst enn nødvendig og dermed vinne færre gode leveår totalt enn man ellers kunne ha gjort dersom ressursene hadde blitt brukt på andre tiltak. Disse effektene vil ikke alltid være til stede, men de gjør det usikkert om et innovasjonskriterium vil være til fordel for folkehelsen, selv på lengre sikt. Der de nevnte effektene ikke er til stede, og der de potensielle gevinstene uten videre vil bli realisert dersom innovasjonen lykkes, kan hensynet til de potensielle gevinstene ivaretas av helsegevinstkriteriet.
Som nevnt kan et innovasjonskriterium også fungere slik at det medfører noe lavere dokumentasjonskrav for tiltak med særlig stort innovasjonspotensiale. Dette vil gjøre at visse tiltak blir prioritert og innført tidligere enn de ellers hadde blitt. Dessverre kan også en slik praksis påvirke utviklernes insentiver negativt. Dersom helsetjenesten firer på dokumentasjonskravene, vil det blant annet kunne redusere insentivene og mulighetene til å frembringe god dokumentasjon (Claxton et al. 2009; Griffin et al. 2011). Ulike måter for å unngå dette problemet har blitt foreslått og diskutert (Walker et al. 2012). Blant annet kan visse beslutninger om offentlig finansiering være tidsbegrensede og fortsatt finansiering være betinget i videre studier og frembringelse av ytterligere dokumentasjon. Utvalget mener slike tilnærminger kan vurderes nærmere også i en norsk sammenheng, selv om tidsbegrensede ordninger ofte er vanskelig å avvikle.
I tillegg til at innovasjonspotensialet kan påvirke dokumentasjonskrav, kan tiltakets gjeldende dokumentasjon påvirke dets innovasjonspotensial. Med innovasjon bredt definert kan begrenset dokumentasjon til dels representere innovasjonspotensiale. I den grad dette tillates, vil et innovasjonskriterium kunne motvirke dokumentasjonskravene beskrevet i kapittel 10.
8.3.4 Utvalgets vurdering
Utvalget mener at det i dag ikke er tilstrekkelig grunnlag for å anbefale et eget innovasjonskriterium for prioritering av helsetiltak. Utvalget mener uansett at det er andre, viktigere måter å stimulere til innovasjon. En av disse er å gi helsegevinstkriteriet en sentral rolle i prioritering. Et slikt kriterium vil bidra til innovasjon ved at utviklere vet at prioritet følger tiltakets effektivitet i form av gode leveår (Vernon et al. 2009). Mer generelt vil de tre hovedkriteriene samlet gi et signal om hva den offentlige helsetjenesten vil etterspørre og finansiere. I tillegg bør myndighetene og helsetjenesten oppmuntre til innovasjon via andre former for regulering og gjennom direkte støtte til forskning og utvikling (Helse- og omsorgsdepartementet 2014a; Salman et al. 2014). Utvalget mener samtidig at det er grunn til å se nærmere på muligheten for å gjøre beslutninger om offentlig finansiering tidsbegrensede og fortsatt finansiering betinget av videre studier og frembringelse av ytterligere dokumentasjon. I alle tilfeller bør de ulike virkemidlene ses i sammenheng. Det er summen av virkemidler og insentiver som er avgjørende for å oppnå den riktige balansen mellom finansiering av innovasjon og finansieringen av tiltak som gir gevinster også på kort sikt.
8.4 Sjeldenhet
8.4.1 Bakgrunn
Sjelden tilstand har blitt definert på ulike måter. Ifølge en vanlig definisjon i Norge er en sjelden tilstand en tilstand som forekommer hos mindre enn 1 per 10 000 innbyggere (Helse- og omsorgsdepartementet 2013; Helsedirektoratet 2014c).17 Det betyr kun litt flere enn 500 personer her i landet. Mellom 6 000 og 8 000 sjeldne diagnoser har blitt beskrevet, og det er antatt at rundt 30 000 mennesker i Norge har en sjelden tilstand (Eurordis 2014, Helsedirektoratet 2014c).18 Hver uke blir dessuten flere nye tilstander beskrevet i medisinsk litteratur.19 Av sjeldne diagnoser som særlig har blitt diskutert i prioriteringssammenheng, kan nevnes blødersykdom (hemofili), cystisk fibrose, Gauchers sykdom og Pompes sykdom.
Det er flere utfordringer knyttet til sjeldne tilstander. Legemiddelindustrien kan ha begrensede insentiver til å utvikle legemidler for slik tilstander fordi markedspotensialet er lite. I tillegg kan utviklingen være ekstra krevende, blant annet på grunn av få potensielle forskningsdeltakere. Dersom et legemiddel blir utviklet, kan det ofte bli svært dyrt fordi det er få pasienter å dele utviklingskostnadene på. Det at en tilstand er sjelden, gjør i tillegg at kompetansen på slike tilstander blant helsepersonell ofte er svært begrenset. Dette er en utfordring for helsetjenesten og de med sjeldne tilstander, også uavhengig av tilgangen på legemidler.
Sjeldenhet er ikke formelt anerkjent som selvstendig prioriteringshensyn i Norge. EU vedtok i 1999 imidlertid en egen ordning om «orphan medicinal products», og denne ordningen er det tatt hensyn til i norsk lovverk gjennom legemiddelforskriftens § 15-7. Legemidler som får «orphan status» har blant annet forlenget patenttid og har mindre omfattende krav til dokumentasjon av effekt og sikkerhet. Formålet med ordningen er å gjøre det lettere å få fram legemidler til behandling av sjeldne sykdommer. Per i dag gir dessuten sjeldenhet grunnlag for individuell refusjon etter blåreseptforskriften (Helse- og omsorgsdepartementet 2013). Helse- og omsorgsdepartementet har imidlertid hatt et utkast til endring av blåreseptforskriften § 3 – individuell refusjon – på høring. I høringen foreslås det å innføre fire grunnvilkår for individuell stønad; sykdommens alvorlighet, legemidlets effektdokumentasjon, behandlingens kostnadseffektivitet og behandlingens varighet. Høringsforslaget innebærer at sjeldenhet ikke lenger får noen selvstendig betydning, men at sykdommens alvorlighetsgrad skal vektlegges. Høringsinnspillene er nå til behandling i departementet.
Hvilken rolle sjeldenhet bør spille i prioritering, har vært gjenstand for stor debatt de siste årene, både i og utenfor Norge (Heiberg et al. 2014a; Heiberg et al. 2014b; Nord 2014). Sterke stemmer har krevd at sjeldne diagnoser skal ha prioritet over ikke-sjeldne diagnoser, mens andre sterke stemmer har hevdet at det bør være lik prioritet. Nasjonalt råd for kvalitet og prioritering i helse- og omsorgstjenesten konkluderte sin vurdering av sjeldne tilstander med at tiltak rettet mot disse tilstandene bør «vurderes i tråd med § 2 i prioriteringsforskriftens krav om en samlet vurdering av tilstandens alvorlighet, av dokumentert forventet nytte av helsehjelpen og av rimeligheten i forholdet mellom kostnadene og tiltakets effekt» (Nasjonalt råd 2010). Rådet anbefalte således at sjeldenhet ikke skal gis selvstendig vekt ved prioritering.
8.4.2 Det grunnleggende spørsmålet
Det grunnleggende spørsmålet er om sjeldenhet bør gis selvstendig vekt ved prioritering, dvs. om helsetjenesten bør bruke et selvstendig sjeldenhetskriterium. Et slikt kriterium vil kreve at tiltak som retter seg mot sjeldne diagnoser, skal ha prioritet over tiltak som retter seg mot ikke-sjeldne tilstander. Med selvstendig menes at kriteriet gir prioritet til sjeldenhet utover det som eventuelt blir gitt indirekte via de tre hovedkriteriene og eventuelle andre tilleggskriterier. Økt prioritet vil her innebære at betydningen av ett eller flere av de tre hovedkriteriene blir redusert.
8.4.3 Aktuelle argumenter og hensyn
En nylig presentert, empirisk studie av et representativt utvalg av Norges befolkning gir ikke særlig støtte til et selvstendig sjeldenhetskriterium (Desser et al. 2010). Flere ulike argumenter har likevel blitt presentert for å støtte et slikt kriterium (Gericke et al. 2005; Hughes et al. 2005; McCabe et al. 2005; McCabe et al. 2006; Largent og Pearson 2012; Pinxten et al. 2012). Disse argumentene er hovedsakelig knyttet til følgende forhold: alvorlighet og helsegevinst, mangel på alternativt tiltak, behov for kompensasjon, og budsjettkonsekvenser.
Argumentene som har blitt fremsatt i favør av et sjeldenhetskriterium, kan grovt oppsummeres slik:
Alvorlighet og helsegevinst: Tiltak rettet mot sjeldne tilstander bør få økt prioritet fordi tilstandene ofte er alvorlige og tiltakene kan gi svært stor helsegevinst.
Mangel på alternativt tiltak: Tiltak rettet mot sjeldne tilstander bør få økt prioritet fordi det ofte ikke eksisterer noe alternativt tiltak for hver av disse tilstandene.
Behov for kompensasjon: Tiltak rettet mot sjeldne tilstander bør få økt prioritet for å motvirke mekanismer som medfører lav prioritet grunnet sjeldenhet.
Budsjettkonsekvenser: Tiltak rettet mot sjeldne tilstander bør få økt prioritet fordi offentlig finansiering av slike tiltak vil ha beskjedne totale kostnader og dermed beskjedne budsjettkonsekvenser.
Det er nyttig å se nærmere på disse argumentene.
Alvorlighet og helsegevinst
Ett argument har vært at sjeldne diagnoser ofte er alvorlige og gir et betydelig helsetap. Mange sjeldne diagnoser medfører betydelig nedsatt livslengde, betydelig redusert livskvalitet eller en kombinasjon av begge deler. Ser vi på de tre hovedkriteriene, er det klart at slike hensyn allerede er integrert i helsetapskriteriet, spesielt siden dette kriteriet tar hensyn til hele livsløpet. Samtidig er det slik at en god del sjeldne tilstander ikke er alvorlige, mens mange vanlige tilstander er det (Institute of Medicine 2010; Mazzucato et al. 2014). Sammenhengen mellom sjeldenhet og alvorlighet er med andre ord ikke entydig.
Et annet, til dels beslektet argument har vært at behandling for sjeldne tilstander, i tillegg til å gi betydelig helsetap, ofte kan gi svært store helsegevinster over et helt liv. Noen ganger kan den aktuelle behandlingen gjøre at personen kan leve et helt normalt liv med en svært alvorlig grunntilstand. I slike situasjoner er naturligvis behandlingsimperativet sterkt. Men det er det også ut fra hovedkriteriene, som allerede ivaretar de aktuelle hensynene: helsetapskriteriet tar hensyn til helsetap og helsegevinstkriteriet tar hensyn til helsegevinster. I tillegg er det slik at sammenhengen mellom sjeldenhet på den ene siden og helsetap og helsegevinst på den andre ikke er entydig.
Mangel på alternativt tiltak
Et annet argument bygger på et premiss om at når man vurderer et tiltak rettet mot en sjelden tilstand, finnes det ofte ikke alternative tiltak. Til dette kobles ideen om at mangel på alternativer bør medføre økt prioritet. Hensynet til mangel på alternativer er imidlertid allerede delvis ivaretatt av helsetapskriteriet, slik som beskrevet ovenfor og i kapittel 7. Utover dette finner ikke utvalget tilstrekkelig grunnlag for å legge selvstendig vekt på mangel på alternativt tiltak. Sammenhengen mellom sjeldenhet og mangel på alternative tiltak er dessuten ikke entydig.
Behov for kompensasjon
Et tredje argument er at tiltak rettet mot sjeldne tilstander bør få økt prioritet for å motvirke mekanismer som medfører lav prioritet på grunn av sjeldenhet. Dette argumentet er spesielt ved at det er negativt formulert og tar utgangspunkt i gjeldende mekanismer, inkludert kriterier, som påvirker prioritet. Særlig aktuelle mekanismer og kriterier er de som innebærer lavere prioritet ved høyere kostnader og svakere dokumentasjon knyttet til tiltaket. Disse kan medføre at sjeldenhet indirekte forårsaker lavere prioritet i de tilfellene der sjeldenhet mer direkte forårsaker høyere ressursbruk eller svakere dokumentasjon.
Et slikt argument er ofte basert på en idé om at sjeldenhet er en vilkårlig årsak til lav prioritet og eventuelt en bestemt tolkning av idealet om tilgangslikhet, dvs. idealet om at alle skal ha lik tilgang til helsetjenester.
At noe er vilkårlig, vil normalt innebære at det ikke bør være direkte bestemmende for prioritering. Det betyr ikke at man nødvendigvis bør kompensere for alle utilsiktede virkninger av sjeldenhet. Med andre ord: at noe er vilkårlig, utløser ikke uten videre et kompensasjonskrav. Dersom det gjorde det, og dersom det helt eller delvis skulle kompenseres for alle vilkårlige determinanter for helsegevinst, ressursbruk og helsetap, ville de tre hovedkriteriene miste nær all revelans. Hvilken sykdom et individ får, regnes også mer generelt som helt eller i stor grad vilkårlig, og det er mange vilkårlige determinanter for utviklingen av effektiv behandling. Dersom man ikke skal kompensere for alle vilkårlige faktorer, blir det et spørsmål om hvorfor det skal kompenseres for sjeldenhet, mens man ikke skal kompensere for andre vilkårlige faktorer.
Når det gjelder idealet om tilgangslikhet, tilsier uansett ikke det at tilgang til helsetjenester skal være uavhengig av alle faktorer. Helt generelt ligger det i dette idealet kun at tilgangen skal være uavhengig eller ikke hindres av et gitt sett med faktorer. Folk er ofte uenige om akkurat hvilke faktorer som er relevante. Ideen om at sjeldenhet er vilkårlig, er iblant koblet til en idé om at diagnose generelt er vilkårlig på en måte som krever at tilgangen til, og tilstedeværelsen av, effektive tiltak skal være uavhengig av diagnose. Under én fortolkning er dette et ukontroversielt, nærmest åpenbart ideal. Iblant utledes det imidlertid fra dette at man bør være villig til å skape betydelig færre helsegevinster (også justert for helsetap) eller behandle betydelig færre individer totalt for å kunne redusere forskjellen i tilgang til effektive tiltak mellom ulike diagnoser. Dette synes urimelig fordi diagnose i hovedsak er en «navnelapp» og har liten selvstendig relevans når egenskaper som helsegevinst og helsetap allerede er tatt hensyn til. Før man vet hvilken diagnose man har, vil de fleste være langt mer interessert i at den totale sannsynligheten for effektiv behandling er så stor som mulig, justert for helsetap, enn at navnet på tilstanden skal ha mindre å si. Bak et «slør av uvitenhet» er det derfor gode grunner til at man ikke vil velge å ha et eget sjeldenhetskriterium (se også boks 3.1).
Mer nyanserte argumenter konsentrerer seg om en spesifikk sammenheng mellom sjeldenhet og lav prioritet. Spesielt mye diskutert er markedsmekanismen for utvikling av nye legemidler. Noen hevder at dersom sjeldenhet fører til lav prioritet via en urettferdig eller på annen måte problematisk markedsmekanisme, så er kompensasjon berettiget. Et slikt argument må først begrunnes med hvilken måte markedet er problematisk, og om det er uhensiktsmessig om markedet favoriserer de tilstandene som rammer flest. En variant av spørsmålet diskutert ovenfor dukker også opp igjen: er det påkrevet med kompensasjon for all vilkårlig disfavorisering som følger av den gjeldende markedsmekanismen? Dette virker ikke rimelig. Videre er det dessuten lite som tilsier at denne disfavoriseringen er entydig knyttet til sjeldenhet, noe som uansett setter spørsmålstegn ved hvor berettiget det er å innføre et eget sjeldenhetskriterium.
Budsjettkonsekvenser
Et fjerde argument bygger på at finansieringen av tiltak rettet mot sjeldne tilstander ofte gir beskjedne budsjettkonsekvenser, selv for dyre tiltak siden målgruppen er liten. Dette har blant annet blitt brukt som argument for at tiltak rettet mot sjeldne tilstander bør få høyere prioritet, for eksempel i form av at man aksepterer en høyere kostnad for disse tiltakene enn tiltak rettet mot ikke-sjeldne tilstander.
Utvalget mener at det ikke er noe problem at implementeringen av et tiltak har store budsjettkonsekvenser så lenge verdien av det som fortrenges, er mindre enn verdien av det aktuelle tiltaket. Sannsynligheten for at dette er tilfelle øker i den grad det aktuelle tiltaket gis prioritet ut fra de tre hovedkriteriene. Iblant kan dessuten tiltaket som er rettet mot en ikke-sjelden tilstand, implementeres delvis, slik at budsjettkonsekvensene tilsvarer dem for tiltaket rettet mot den sjeldne tilstanden. I slike tilfeller faller uansett argumentet om økt prioritet til tiltak rettet mot sjeldne tilstander på grunn av budsjettkonsekvenser bort.
Å gi prioritet på grunnlag av totale budsjettkonsekvenser kan også utfordre idealet om likebehandling. Det gjelder spesielt for de som mener sjeldenhet er en vilkårlig grunn til å bli disfavorisert. De som mener dette, må da gi en god grunn for hvorfor favorisering pga. sjeldenhet og budsjettkonsekvenser samtidig er akseptabelt.
Det er også grunn til så stille spørsmål ved premisset om beskjedne budsjettkonsekvenser. Omkring 30 000 mennesker i Norge i dag har en sjelden tilstand, og i alt er det beskrevet mellom 6 000 og 8 000 tilstander. Det finnes spesifikk behandling for litt over 300 tilstander (FDA 2009). Som gruppe kan derfor behandling av alle med sjelden tilstand gi store budsjettkonsekvenser. Presset på budsjettene vil trolig også øke i fremtiden, gitt den raske økningen i både nye sjeldne tilstander og ny behandling av dem, inkludert såkalt skreddersydd behandling.
8.4.4 Utvalgets vurdering
Utvalget mener at ingen av argumentene nevnt ovenfor gir grunnlag for et selvstendig sjeldenhetskriterium. Dette skyldes for det første at sammenhengen mellom sjeldenhet og faktorene nevnt i punktene a) til d) ovenfor ikke er entydig: sjeldne tilstander er ikke alltid knyttet til disse faktorene og ikke-sjeldne tilstander kan være knyttet til dem. Samtidig er det et spørsmål om disse faktorene er relevante for prioritering. Utvalget mener de faktorene som er relevante, i hovedsak er ivaretatt av de tre overordnede kriteriene.
Utover dette mener utvalget at sjeldenhet, og en tilstands frekvens mer generelt, ikke kan være relevant i seg selv. Utvalget mener derfor at den mest relevante tolkningen av likebehandling, sammen med hensynene knyttet til de tre hovedkriteriene, gir grunnlag for lik prioritet til sjeldne og ikke-sjeldne tilstander. Gitt alle disse vurderingene, konkluderer utvalget med at det ikke er grunnlag for et selvstendig sjeldenhetskriterium.
Utvalget mener like fullt at det er svært viktig med god behandling for sjeldne tilstander, spesielt i de tilfellene der tilstanden innebærer et betydelig helsetap, og der tiltaket gir stor helsegevinst. Det er også mye som kan og bør gjøres for å bedre helsehjelpen for de med sjeldne tilstander (Council of the European Union 2009; DOH 2013). Dette inkluderer blant annet styrket spesialisering og samarbeid, samt bedre monitorering og registrering.
9 Bruk av kriterier i konkrete situasjoner
Hver eneste dag tas det tusenvis av prioriteringsbeslutninger på ulike nivåer i norsk helsetjeneste. Beslutningssituasjonene kan være svært forskjellige. I de foregående kapitlene har utvalget diskutert generelle hensyn og kriterier. I dette kapittelet vil det bli drøftet hvordan de tre hovedkriteriene kan brukes i ulike situasjoner. Det er nyttig å vise hvordan kriteriene kan brukes på flere nivåer, og hvordan de kan brukes både direkte og sammen med grenseverdier. Til slutt blir det illustrert hvordan kriteriene kan anvendes i tre spesifikke situasjoner: allmennlegens vurdering av om en pasient skal henvises til videre utredning; sykehuslegens vurdering av om en pasient skal få plass på intensivavdeling; og helseplanleggerens vurdering av forebyggende folkehelsetiltak.
9.1 Prioritering på ulike nivåer
Helsetjenesten kan, som vist i kapittel 4, beskrives som et hierarki bestående av flere nivåer. Et hovedskille mellom ulike prioriteringssituasjoner er hvilket nivå de befinner seg på. Helsetjenesten kan deles inn i nivåer på flere måter, men det mest grunnleggende skillet i prioriteringssammenheng er mellom et ledelsesnivå, bredt definert, og et klinisk nivå.20
På ledelsesnivå styrer og administrerer ulike aktører helsetjenesten uten å møte den enkelte pasient, og på dette nivået vil hver enkelt vurdering og hvert enkelt tiltak normalt gjelde grupper av individer. Prioriteringsvurderinger på ledelsesnivå har typisk følgende kjennetegn: hvert av de aktuelle tiltakene er rettet mot grupper; enkeltindividene som blir påvirket av tiltaket, er ukjent for beslutningstakeren; og tiltakene kan først iverksettelse på noe lengre sikt. Ledelsesnivået kan deles inn på flere ulike måter. Man kan blant annet skille mellom et politisk og et administrativt nivå og mellom et nasjonalt, regionalt og lokalt nivå. På ledelsesnivå finner vi enhetsledere på sykehus og i helseforetak og aktører med nasjonalt ansvar, som Helse- og omsorgsdepartementet, Helsedirektoratet og Statens legemiddelverk. I det nasjonale systemet for innføring av nye metoder i spesialisthelsetjenesten tas det også beslutninger med nasjonalt gyldighetsområde.
På klinisk nivå møter helsepersonell den enkelte pasient, og på dette nivået er normalt hver enkelt vurdering og hvert tiltak hovedsakelig rettet mot et enkelt individ. Prioriteringsvurderinger på klinisk nivå har typisk følgende kjennetegn: minst ett av de aktuelle tiltakene er rettet mot et enkeltindivid, minst ett av individene er kjent for beslutningstakeren, og tiltakene kan iverksettes raskt. Leger både i kommune- og spesialisthelsetjenesten tar slike beslutninger. Fastleger må for eksempel ofte avgjøre om den pasienten hun eller han har foran seg skal henvises til videre utredning, eller om en slik henvisning vil gå for mye ut over andre pasienter. Sykehusleger må blant annet avgjøre i hvilken rekkefølge pasientene de har ansvar, for skal utredes eller behandles (Norheim 2008).
9.1.1 Nærmere om forskjeller mellom nivåene
Utvalget mener altså at de overordnede prioriteringskriteriene er relevante både på klinisk nivå og på ledelsesnivå. Det betyr at beslutningstakere på begge nivåer bør ta hensyn til helsegevinst, ressurser og helsetap så godt det lar seg gjøre med den informasjon som er tilgjengelig. Ofte blir det sagt at ulike hensyn og kriterier er relevante for prioritering på de ulike nivåene, men uten at det blir klargjort hvilke forskjeller mellom nivåene som begrunner denne variasjonen i relevans. Flere forskjeller har imidlertid blitt foreslått og diskutert (Cubbon 1991; Kamm 1994; Brock 2002b; Brock 2003; Bærøe 2009; Helsedirektoratet 2012a; Winberg et al. 2014). Det kan derfor være hensiktsmessig å diskutere noen av disse forskjellene, og hvordan de tre hovedkriteriene forholder seg til dem. Det er særlig nyttig å beskrive hvordan bruken av de tre kriteriene kan variere ut fra forskjellene mellom nivåer. Den generelle begrunnelsen for hvert av de tre kriteriene ble gitt i kapittel 7.
Noen av de mest prioriteringsrelevante forskjellene mellom ledelsesnivå og klinisk nivå er relatert til følgende hensyn:
Hva som fordeles
Alternativ ressursbruk
Tidspunkt for iverksettelse av tiltak
Tiltakenes målenhet
Forutgående rammebeslutning
Tilgjengelig informasjon
Sosial rolle og relasjon
Hva som fordeles
Den typiske beslutning på de to nivåene skiller seg fra hverandre når det gjelder hvilken type ressurs som blir direkte fordelt. På ledelsesnivå gjelder prioriteringsbeslutningene ofte fordeling av finansielle ressurser eller penger gjennom budsjettdisposisjoner. Sykehusledere må vurdere om deler av neste års budsjett skal brukes på å bygge flere operasjonssaler, å øke bemanningen i akuttmottak, å kjøpe flere MR-maskiner, eller noe annet.
På klinisk nivå er det er som regel ikke-finansielle ressurser som fordeles direkte. Det kan blant annet være radiologiske undersøkelser, operasjoner, sengeplasser på intensivavdeling, hjerteovervåkning med telemetri og ikke minst helsepersonells tid og oppmerksomhet.
Ressurskriteriet inkluderer all relevant ressursbruk og kan ta hensyn til både finansielle og ikke-finansielle ressurser. Kriteriet kan derfor brukes, sammen med de to andre hovedkriteriene, både på ledelsesnivå og klinisk nivå.
Alternativ ressursbruk
Hva som fordeles, er også knyttet et annet hensyn: alternativ bruk av ressursene. På ledelsesnivå kan beslutningstakeren som regel bruke ressursene som skal fordeles på svært mange ulike måter, selv om det også her er forutbestemte begrensninger. Dersom ledelsen ikke øker den delen av budsjettet som primært er rettet mot hjertesykdommer, kan den for eksempel gi en større økning til den delen som har med kreftbehandling å gjøre. Dersom det ikke bygges en ny operasjonssal, kan ledelsen i stedet øke bemanningen i akuttmottak eller kjøpe nye MR-maskiner.
For beslutningstakeren på klinisk nivå er ofte alternativ bruk av den ressursen de direkte fordeler, mer begrenset. Dette er gjerne tilfelle når helsepersonell fordeler sin egen tid, et telemetriapparat eller en sengeplass på intensivavdelingen. Slike ressurser kan i liten eller ubetydelig grad byttes inn i andre typer ressurser på kort sikt. Det begrenser også hvilke typer tiltak og hvilke pasienter som er aktuelle i prioriteringsvurderingen. For slike ressurser trenger beslutningstakeren normalt ikke vurdere om tiltaket ressursene brukes til, generelt er verdt kostnaden for helsetjenesten eller samfunnet som helhet. Beslutningstakeren kan i stedet begrense seg til å vurdere om de aktuelle ressursene er fordelt på best mulig måte mellom de aktuelle pasientene.
For eksempel når det gjelder telemetriapparater, kan legen begrense seg til å vurdere hvordan sykehusets apparater best kan fordeles på de pasientene som er på sykehuset og som vil ha fordel av å ha telemetriovervåkning. Dette eksempelet viser også hvordan det for ikke-finansielle ressurser på klinisk nivå iblant ikke vil finnes noe reel alternativ bruk av en gitt ressurs. På ett tidspunkt kan mange av telemetriapparatene på et sykehus være ledige. Dersom sykehuslegen velger å gi en pasient et slikt apparat, vil det i hovedsak ikke gå ut over andre pasienter.
Prioriteringsvurderinger på klinisk nivå involverer altså ofte ressurser med begrensede alternative bruksområder, samtidig som antall alternativer kan variere betydelig over kort tid. De tre hovedkriteriene kan ta hensyn til dette ettersom kriteriene er ment nettopp å rangere de reelle alternative tiltak i den aktuelle beslutningssituasjonen. Dersom ressursbruken er identisk, kan tiltakene rangeres etter helsegevinst og helsetap alene.
En del beslutninger på klinisk nivå utløser imidlertid også et betydelig forbruk av helsetjenestens eller av samfunnets mer generelle finansielle ressurser. Slike situasjoner er nærmere beskrevet nedenfor.
Tidspunkt for iverksettelse av tiltak
En annen forskjell mellom typiske beslutninger på de ulike nivåene er starttidspunkt for tiltaket sett i forhold til tidspunktet for beslutningen. På ledelsesnivå vil det normalt gå en viss tid fra beslutningen om å gjennomføre et tiltak blir tatt, til gjennomføringen starter. På klinisk nivå derimot starter ofte tiltaket raskt eller umiddelbart etter beslutningen. De tre hovedkriteriene kan brukes i begge tilfeller. Kriteriene bryr seg ikke om tiden fram til start av tiltak i seg selv. Men de bryr seg om forventet helsegevinst, ressursbruk og helsetap. I bruken av kriteriene vil det derfor være naturlig å ta hensyn til eventuell usikkerhet som følger av avstanden i tid mellom beslutning og oppstart av tiltak. Hovedkriteriene kan derfor iblant være enklere å bruke på klinisk nivå enn på ledelsesnivå.
Tiltakenes målenhet
I prioriteringssituasjoner på ledelsesnivå vil beslutningen normalt utelukkende gjelde grupper av individer, og man snakker da også iblant om et gruppenivå. På klinisk nivå vil derimot beslutningen som regel gjelde minst ett enkeltindivid direkte. Slik de tre hovedkriteriene er definert, kan de brukes både til å prioritere mellom tiltak rettet mot grupper og tiltak rettet mot enkeltindivider.
Forutgående rammebeslutning
Prioriteringspraksis på klinisk nivå setter ofte visse begrensninger for beslutningene på ledelsesnivå. Det motsatte kan imidlertid sies å gjelde i enda større grad: prioriteringsbeslutninger på ledelsesnivå setter rammene for prioriteringsbeslutninger på klinisk nivå. Mange av beslutningene på ledelsesnivå påvirker total kapasitet, og Lønning-II utvalget beskrev disse som kapasitetsbeslutninger. For eksempel når sykehusledelsen avgjør hvor mange MR-maskiner som skal kjøpes, avgjør dette i stor grad hvor mange MR-undersøkelser som kan gjennomføres.
Beslutninger på ledelsesnivå kan også sette rammer for beslutninger på klinisk nivå ved å gi ulike føringer og retningslinjer, og det kan eventuelt gjøres samtidig med at totalkapasitet bestemmes. Dette er ikke uvanlig når det gjelder innføringen av legemidler. I Statens legemiddelverk blir det for eksempel regelmessig avgjort om et legemiddel skal få offentlig finansiering og i så fall for hvilke indikasjoner det skal gjelde.
Prioriteringsbeslutninger på klinisk nivå må forholde seg til ulike rammebeslutninger gjort på ledelsesnivå. Siden disse rammebeslutningene i Norge normalt må sies å ha en demokratisk legitimitet, kan ikke beslutningstakeren på klinisk nivå ignorere disse beslutningene. Helst bør rammene selv være bestemt ut fra de tre hovedkriteriene. I den grad rammebeslutningene gir rom for å differensiere mellom undergrupper eller enkeltpasienter, bør helsepersonell bruke de tre hovedkriteriene til å gjøre det.
Tilgjengelig informasjon
Hvor godt informasjonsgrunnlag beslutningstakeren har for sine vurderinger, varierer mye både på ledelsesnivå og klinisk nivå. Også mellom de to nivåene er det en betydelig forskjell i hvilken informasjon som vanligvis er tilgjengelig for beslutningstakeren.
Beslutningstakere på ledelsesnivå kan ha inngående informasjon om total- og gjennomsnittsverdier for ulike tiltaks målgruppe som helhet. Det kan være informasjon om totalt antall reddete liv og gjennomsnittlig alder i den gruppen. Iblant har beslutningstakeren også kjennskap til karakteristika ved tiltakene og målgruppene som er mer direkte relevant for de tre overordnede prioriteringskriteriene. Beslutningstakere på ledelsesnivå har for eksempel stadig oftere informasjon om helsegevinster i form av gode leveår.
Hver enkelt målgruppe vil imidlertid ofte være heterogen, dvs. at individene i målgruppen er forskjellige. Individene eller undergruppene kan for eksempel være ulike når det gjelder forventet helsegevinst, forventet ressursbruk eller forventet helsetap. Ofte vil beslutningstakeren ha begrenset informasjon om slik variasjon. Av den grunn og mer generelt har beslutningstakere på ledelsesnivå ofte lite spesifikk informasjon om enkeltpasientene som blir berørt av deres beslutninger.
På klinisk nivå er det normalt annerledes. Beslutningstakeren har betydelig informasjon om minst ett av individene som blir berørt av beslutningen. Dette er tydelig når beslutningstakeren er pasientens fastlege, men også annet helsepersonell vil normalt ha inngående informasjon om den aktuelle pasienten når de skal ta prioriteringsbeslutninger. Slik informasjon kan være kunnskap om kjønn, alder, legemiddelbruk, tidligere sykehistorie, symptomer og aktuell sykehistorie, kliniske funn og funn fra andre undersøkelser, som blodprøver og radiologiske undersøkelser. I tillegg vil beslutningstakeren ofte ha noe informasjon om preferansene, ønskene og den sosiale situasjonen til den aktuelle pasienten.
Helsepersonell bruker kontinuerlig slik informasjon i diagnostikk og behandling av pasienter. En gjennomgående utfordring er å koble kunnskap om grupper, både personlige erfaring og innsikt fra vitenskapelige studier, til det aktuelle enkeltindividet. Hvordan denne informasjonsoverføringen fra gruppe til individ best kan gjøres, er et sentralt tema i kunnskapsbasert medisin, og det finnes mye litteratur om dette (McAlister et al. 2000; Kravitz et al. 2004). De samme framgangsmåtene er relevante når helsepersonell skal gjøre anslag for enkeltindivider til bruk i prioritering på klinisk nivå.
En annen generell utfordring for helsepersonell er å koble lett tilgjengelig informasjon til de karakteristika ved tiltaket som man mer grunnleggende bryr seg om. Når det gjelder effekt av behandling, er det et viktig skille mellom myke og harde endepunkter. Et eksempel på et mykt endepunkt er reduksjon i blodtrykk fra blodtrykksbehandling (målt i mm Hg). Blodtrykksreduksjon har liten betydning i seg selv, men har blant annet en kjent relasjon til et hardt endepunkt i form av risikoreduksjon for død. Særlig på klinisk nivå kan det være utfordrende for beslutningstakeren å oversette tilgjengelig informasjon til de karakteristika som er direkte relevant for de tre overordnede prioriteringskriteriene, inkludert helsegevinst og helsetap. I mange tilfeller vil det være viktig at beslutningstakeren i det minste forsøker å gjøre et anslag for helsegevinst og helsetap knyttet til de tiltakene hun eller han vurderer. I andre tilfeller er det imidlertid ikke nødvendig. Det er tilfeller der alle de reelle alternativene beslutningstakeren vurderer, kun skiller seg fra hverandre på én relevant måte. Fordelingen av telemetriapparater kan igjen være et eksempel. Dersom det er to kandidater til ett apparat, og de to kandidatene kun er forskjellige når det gjelder risiko for hjerterytmeforstyrrelser det neste døgnet, kan apparatet gis til den med størst risiko uten å først måtte beregne helsegevinst og helsetap.
Det er også andre forskjeller i tilgang til informasjon for beslutningstakere på de to nivåene. Det første er at beslutningstakeren på klinisk nivå nokså ofte vil ha begrenset informasjon om alternativ ressursanvendelse. Som nevnt tidligere gjelder det blant annet når legen utløser bruk av ressurser andre steder i helsetjenesten eller i samfunnet for øvrig. Men det gjelder også i de mange tilfellene der beslutningstakeren kun har informasjon om noen av de pasientene som konkurrerer om en begrenset ikke-finansiell ressurs mer lokalt. Allmennlegene må for eksempel ofte vurdere om de skal innfri en pasients ønske om en MR-undersøkelse av rygg eller kne. Når legen vurderer, vet hun eller han normalt ikke hvilken annen pasient som ikke får MR-undersøkelse eller må vente lenger. Legen må da gjøre seg opp en mening om hva slags pasient som eventuelt blir fortrengt. En slik situasjon er beskrevet nærmere nedenfor.
Rolle og relasjon
Beslutningstakerens sosiale rolle og relasjon til pasienten er en annen markert forskjell mellom de to nivåene.
På ledelsesnivå har beslutningstakeren en sosial rolle som innebærer en forventning om at hun eller han skal ta hensyn til alle i den gruppen hun eller han har ledelsesansvar for. For sykehusledelsen vil det normalt inkludere alle nåværende og potensielle pasienter, og for helseledelsen i kommunen vil dette inkludere alle kommunens innbyggere.
På klinisk nivå har beslutningstakeren ofte legerollen eller behandlerrollen, en rolle som er tett knyttet til lege-pasient forholdet.21 En slik rolle og et slikt forhold, vil mange mene, har betydning for legens praksis og prioriteringer. To forhold er priviligering av aktuell pasient over andre pasienter, og priviligering av helse over andre goder.
Privilegering av «egen» pasient
Flere har hevdet at det å ha legerollen og det å være lege i et lege-pasient forhold betyr at legen utelukkende eller nærmest utelukkende skal ta hensyn til den aktuelle pasienten (Angell 1993). Dette blir iblant koblet til forestillingen om at legen skal være pasientens advokat, og at legen kun skal bry seg om enkeltindividet foran seg.
Tanken om at legen bare bør ta hensyn til sin pasient, og ikke andre pasienter eller samfunnet for øvrig, er svært omstridt, og er ikke en holdning eller påstand som utvalget kan gi sin tilslutning til. Dersom legen ikke tar hensyn til andre pasienter, vil hun eller han lett kunne handle på en måte som går urettmessig ut over andre pasienter, som også er enkeltindivider med reelle behov. For å oppnå en rettferdig helsetjeneste må leger og annet helsepersonell avveie behovet den aktuelle pasienten har, opp mot andre pasienters behov. Å sette ulike pasienter opp mot hverandre er noe leger gjør allerede i dag. Leger på sykehus må ofte velge mellom hvilke av egne pasienter som skal få undersøkelse eller operasjon først, og leger generelt velger ofte en noe mindre effektiv antibiotika til egen pasient fordi de ønsker å hindre resistensutvikling i samfunnet og dermed ulempe for andre.
Like fullt er legen ofte den som er i best posisjon til å hjelpe pasienten foran seg – og bør i den grad «privilegere» den pasienten. Legen har også rollen som pasientens advokat, men denne rollen innebærer ikke at legen bør hjelpe egen pasient til urettmessig å fortrenge andre pasienter. Advokatanalogien svikter dessuten i de tilfellene der legen både er advokat og dommer, og der de andre pasientenes advokat, dvs. deres lege, ikke er til stede. Legens advokatrolle bør derfor bestå i å sikre at egen pasient får den behandlingen som pasienten har rett på etter de overordnede prioriteringskriteriene, hverken mer eller mindre.
Et kjennetegn ved den typiske beslutningssituasjon på klinisk nivå er også at minst ett av tiltakene er rettet mot en pasient som beslutningstakeren kjenner identiteten til. Ofte sammenfaller det med lege-pasient forholdet, men ikke alltid. Selv om det er mindre vanlig på ledelsesnivå, kan målgruppen eller målindividet for det aktuelle tiltaket være identifisert for beslutningstakeren også der, blant annet via media.
Det pågår en debatt om identifiserte pasienter bør få prioritet over ikke-identifiserte eller såkalte statistiske pasienter (Daniels 2012; Faust og Menzel 2012). I den grad det er mindre usikkerhet knyttet til tiltak rettet mot identifiserte pasienter, er det fornuftig. Derimot er det vanskelig å finne tilstrekkelige grunner for at helsegevinster til identifiserte pasienter i seg selv bør tillegges større vekt enn helsegevinster til andre pasienter. I samsvar med dette, tar de tre overordnede prioriteringskriteriene hensyn til usikkerhet, men gir ingen ekstra prioritet til identifiserte pasienter per se.
Priviligering av helse
Det har blitt foreslått at med legerollen og lege-pasient forholdet kommer en forventing om at legen privilegerer helse, og at legen utelukkende eller nærmest utelukkende legger vekt på det som har med helse å gjøre (Brock 2002b). Selv om det er vanskelig klart å avgrense hva som har med helse å gjøre, innebærer det normalt en forventning om at legen skal legge liten eller ingen vekt på øvrige gevinster for samfunnet for øvrig og på ressursbruk utenfor helsetjenesten (beskrevet i kapittel 7 og 10). Denne forventningen kan blant annet være med på å forklare hvorfor mange finner det problematisk om helsepersonell tar hensyn til produktivitetsgevinster og sparte ressurser utenfor helsetjenesten. Dette kan igjen forklare hvorfor en del er skeptiske til ordningen «Raskere tilbake» (beskrevet i boks 7.1). En forventning om priviligering av helse kan også være en av grunnene til at flere er skeptiske til å kompensere for lav sosio-økonomisk status, slik det blir diskutert i vedlegg 4.
Det er ikke lett å finne klare prinsipielle grunner for hvorfor helse skal vektlegges i mye større grad på klinisk nivå enn på ledelsesnivå innenfor helsetjenesten (Brock 2003; Lippert-Rasmussen og Lauridsen 2010). Utvalget anerkjenner like fullt mange av de intuisjonene som synes å støtte en slik forskjell. En viss forskjell kan også være nødvendig for å ivareta lege-pasient forholdet. Som beskrevet i kapittel 7 og 10 tillater hovedkriteriene å gå utover et helsetjenesteperspektiv kun dersom dette ikke vil gi urettferdige fordelingsvirkninger. Kriteriene kan derfor legge mindre vekt på det som ikke har direkte med helse å gjøre når kriteriene brukes på klinisk nivå sammenliknet med når de brukes på ledelsesnivå.
9.1.2 Samspill mellom nivåene
De to nivåene påvirker hverandre (Klein et al. 1996). Det er kanskje mest åpenbart at prioriteringsbeslutninger på ledelsesnivå setter rammene for beslutninger på klinisk nivå, slik det ble beskrevet tidligere. Men ledelsesnivået kan og bør bare styre klinisk prioritering i en viss grad. Blant annet på grunn av kompleksiteten i medisinen og behovet for å ta hensyn til individuelle forhold må helsepersonell gis betydelig rom for å gjøre gode prioriteringer. Med dette følger også et ansvar hos helsepersonell for å gjøre dette på en grundig måte.
Prioriteringer på klinisk nivå vil kollektivt påvirke handlingsrommet på ledelsesnivå. For å få gode beslutninger på ledelsesnivå er det helt nødvendig med innspill fra det kliniske nivået. Gjensidig forståelse og samarbeid på tvers av nivåene er avgjørende for god og konsistent prioritering i helsetjenesten.
9.2 Direkte bruk av kriteriene
De tre hovedkriteriene kan i mange situasjoner brukes direkte i vurderingen av både nye og eksisterende tiltak, på alle nivåer. Det gjelder situasjoner der beslutningstaker har tilstrekkelig informasjon om alle eller de mest relevante tiltakene som konkurrerer om de samme ressursene. Ingen beslutningstaker har inngående informasjon om alle eksisterende og potensielle tiltak i hele helsetjenesten, men ofte vil det være gjort en forutgående avgrensning av tiltak. En slik avgrensning kan skyldes begrensninger på hva beslutningstakeren faktisk kan gjøre og kontrollere, noe som kan være knyttet til fastsatte budsjett eller ressursrammer. En slik avgrensning kan også følge av en innledende vurdering av hvilke tiltak som er de beste kandidatene for å bli nærmere undersøkt.22
Situasjonene der kriteriene kan brukes direkte, er mange og ulike. Det er nyttig å se på særlig fire typer situasjoner: valg ved ressursøkning, valg ved ressursreduksjon, valg ved uendret ressursramme og vurdering av nye tiltak. Der det ikke finnes tilstrekkelig informasjon om de spesifikke tiltakene som ressursene reelt kan brukes på, kan grenseverdier være nyttige. Slike verdier er drøftet nedenfor.
9.2.1 Valg ved ressursøkning
Iblant blir ekstra ressurser tilgjengelige for beslutningstakeren, og hun eller han må velge hva disse ressursene skal brukes til. Oppskalering av både nye og eksisterende tiltak varierer betydelig når det gjelder helsegevinst, ressursbruk og helsetap. Det vil derfor sjelden være optimalt å passivt ta utgangspunkt i den historiske fordelingen og oppskalere alle tiltak tilsvarende mye. I stedet bør fordelingen av nye ressurser og valg av hvilke tiltak som skal oppskaleres, gjøres aktivt og systematisk. Beslutningstakeren bør forsøke å identifisere det tiltaket eller den gruppen av tiltak som vil gi flest gode leveår for de ekstra ressursene, justert for helsetap. For å gjøre dette kan beslutningstakeren først lage en liste over de beste kandidatene og deretter bruke de tre hovedkriteriene til å rangere dem.
9.2.2 Valg ved ressursreduksjon
I andre tilfeller skjer det en reduksjon i totale tilgjengelige ressurser. Dette er for tiden ikke tilfelle for norsk helsetjeneste som helhet, men det er jevnlig tilfelle for mer lokale budsjett og ressursrammer. Beslutningstakeren må da velge hvilket eller hvilke tiltak som skal nedskaleres. Igjen vil det sjelden være optimalt å passivt ta utgangspunkt i den historiske fordelingen og nedskalere alle tiltak tilsvarende mye. I stedet bør beslutningstakeren aktivt søke det eller de eksisterende tiltak der en nedskalering er minst problematisk etter hovedkriteriene, dvs. fører til minst reduksjon av vunne gode leveår, justert for helsetap. Beslutningstakeren kan da først identifisere de beste kandidatene og deretter rangere disse på basis av de tre kriteriene.
9.2.3 Valg innenfor uendret ressursramme
Ofte må beslutningstakeren velge mellom tiltak innenfor en gitt ressursramme uten at dette er koblet til noen økning eller reduksjon i totale ressurser. Det kan her være nyttig å skille mellom fordeling og omfordeling.
Fordeling
På klinisk nivå har beslutningstakeren ofte faste rammer, for eksempel i form av forutbestemt tilgang på utrednings- eller behandlingskapasitet, forutbestemt budsjett eller forutbestemt begrensning på hvilke tiltak som er aktuelle. Situasjoner av denne typen oppstår blant annet ved behandlingen av akutt syke pasienter på sykehus. For eksempel er ofte antall intensivsenger, telemetriapparater (for hjerteovervåkning) eller apparater for ikke-invasiv pustestøtte mindre enn det de innlagte pasientene kunne hatt nytte av. Det ansvarlige helsepersonellet kan da bruke de tre hovedkriteriene i vurderingen av hvilke pasienter som bør få de knappe godene. En tilsvarende situasjon kan oppstå ved fordeling av organer ved organtransplantasjon.
Iblant skal beslutningstakeren bare bestemme rekkefølgen av tiltak som allerede er bestemt implementert. Den initielle bestemmelsen om at de aktuelle tiltakene skal settes i verk, kan ha blitt gjort av den samme beslutningstakeren eller av andre. Dette er en vanlig situasjon på klinisk nivå. Kirurger må for eksempel avgjøre rekkefølgen av pasienter som venter på operasjon. Tilsvarende må radiologer (røntgenleger) avgjøre rekkefølgen av pasienter som venter på bildeundersøkelse. «Triage» i akuttmottak er også et viktig eksempel.
Omfordeling
Fordelingen innenfor en gitt ressursramme i en periode blir ofte i stor grad videreført i neste periode. En sentral del av prioriteringsarbeidet er imidlertid å vurdere om den gjeldende fordelingen bør endres, inkludert om det bør gjøres en omfordeling mellom eksisterende tiltak. Beslutningstakere bør kontinuerlig søke å omfordele ressurser fra det tiltaket som på marginen gir færrest gode leveår i forhold til ressursbruk (justert for helsetap) til det tiltaket som på marginen gir flest gode leveår i forhold til ressursbruk (justert for helsetap). Beslutningstakeren bør med andre ord nedskalere det første tiltaket til fordel for en oppskalering av det andre tiltaket. Dette vil føre til at helsetjenesten klarer å skape flere gode leveår, justert for helsetap.
For å kunne foreta slike omfordelinger, bør beslutningstakere i helsetjenesten være på konstant utkikk etter tiltak som bør oppskaleres, og tiltak som bør nedskaleres for å frigjøre ressurser for viktigere tiltak (Polisena et al. 2013). Helst bør det også finnes systematiske prosesser som kontinuerlig søker etter tiltak i begge kategorier, og de tre hovedkriteriene kan støtte dette arbeidet. Kandidater for opp- og nedskalering har blant annet blitt foreslått av flere fagmedisinske foreninger i Legeforeningen (beskrevet i vedlegg 2). Når kandidater er identifisert kan den mer inngående vurderingen og rangeringen av dem også gjøres på basis av de tre hovedkriteriene.
I tilfeller der det er gjort en forutgående beslutning om å innføre et nytt tiltak eller å oppskalere et eksisterende tiltak, vil de tre kriteriene kunne brukes til å identifisere hvilket eller hvilke tiltak som bør nedskaleres, på samme måte som i en situasjon der den totale ressursrammen har blitt redusert.
9.2.4 Valg ved vurdering av nytt tiltak
Vurderingen av et nytt tiltak kan være knyttet til flere av situasjonene beskrevet ovenfor. Blant annet blir nye tiltak ofte vurdert i forbindelse med en ressursøkning. Beslutningstakeren kan da vurdere det nye tiltaket opp mot best mulig oppskalering av eksisterende tiltak på samme måte som for ulike eksisterende tiltak.
En annen vanlig situasjon er at et nytt tiltak vurderes innført innenfor en uendret ressursramme. I noen av disse situasjonene har beslutningstakeren selv god kontroll over hvilket tiltak som vil bli fortrengt ved eventuell innføring av det nye tiltaket. I slike tilfeller bør det nye tiltaket sammenliknes med det eksisterende tiltaket som på marginen gir færrest gode leveår i forhold til ressursbruk, justert for helsetap. Dersom det nye tiltaket får lavere prioritet enn dette tiltaket etter de tre hovedkriteriene, bør det nye tiltaket ikke innføres. Grunnen er at selv hvis beslutningstakeren overfører ressurser til det nye tiltaket fra det minst viktige eksisterende tiltaket, vil antall gode leveår, justert for helsetap, bli redusert.23 Selv dersom det nye tiltaket er mer prioriteringsverdig enn det minst viktige eksisterende tiltaket, er det ikke opplagt at det nye tiltaket bør innføres. Grunnen er at ressursene som kan frigjøres ved en nedskalering av det minst viktige tiltaket, potensielt kan brukes til å oppskalere et viktigere eksisterende tiltak. For at innføring av det nye tiltaket skal være den aller beste løsningen, må det nye tiltaket være mer prioriteringsverdig enn det viktigste eksisterende tiltaket. Det blir altså et spørsmål om omfordeling på samme måte som beskrevet over, men nå med både nye og eksisterende tiltak involvert.
9.3 Tre konkrete situasjoner
Ovenfor har det blitt gitt en rekke eksempler på hvordan de tre hovedkriteriene kan brukes både på ledelsesnivå og klinisk nivå. Likevel kan det være nyttig å illustrere enda mer inngående hvordan kriteriene kan brukes ved å se på tre konkrete situasjoner: allmennlegens vurdering av om en pasient skal henvises til videre utredning; sykehuslegens vurdering av om en pasient skal få plass på intensivavdeling; og helseplanleggerens vurdering av forebyggende folkehelsetiltak.
9.3.1 Henvisning fra allmennpraksis til videre utredning
Allmennlegen må ofte avgjøre om hun eller han skal henvise pasienten foran seg til videre utredning. Dette gjelder henvisning til radiologisk undersøkelse, men også henvisning til annen spesialist i og utenfor sykehus.
Når allmennlegen vurderer å henvise, kan det være nyttig for henne eller han å stille seg følgende spørsmål:
Hvilke kjennetegn har utredningen?
Hvor stor vil helsegevinsten være?
Hva vil ressursbruken være?
Hvor stort helsetap vil pasienten ellers ha?
Hvilke kjennetegn har de fortrengte tiltakene?
Hvilke kjennetegn har utredningen?
Hvor stor vil helsegevinsten være?
For å svare på dette bør legen særlig vurdere om utredningen vil gi ny informasjon som vil påvirke videre behandling og, i så fall, om forskjellen i behandling vil utgjøre noen praktisk forskjell for pasienten. Legen bør blant annet stille seg følgende spørsmål:
Er pretest sannsynlighet for den aktuelle tilstanden allerede før utredning så stor at ytterligere diagnostikk ikke vil påvirke behandlingsvalg uansett utfall? En situasjon som kan være slik, er betydelig forhøyet blodtrykk etter gjentatte uavhengige målinger.
Er pretest sannsynlighet for den aktuelle tilstanden så liten at videre utredning nesten helt sikkert ikke vil føre til et positivt funn som trenger videre tiltak. Eksempler på situasjoner som ofte kan være slik, er: tilfeldig påviste blodprøvesvar rett utenfor normalområdet og friskt blod på toalettpapiret uten anemi eller jernmangel hvor rektal eksplorasjon og anorectoskopi er utført med normale funn.
Vil sikrere diagnose medføre behandling som gir en klinisk relevant behandlingsgevinst? Eksempler på situasjoner der dette ofte ikke er tilfelle, er: positiv prostata-spesifikk antigentest hos asymptomatiske sykehjemspasienter; daginkontinens hos barn under seks år; søvnforstyrrelser hos barn; og ukomplisert obstipasjon hos barn.
Dersom utredningen ikke er forventet å totalt sett være positiv for akkurat den pasienten, bør pasienten naturligvis ikke henvises. Hvis forventet gevinst er positiv, kan anslaget for helsegevinst brukes til å vurdere prioritet vis-à-vis andre tiltak.
Hva vil ressursbruken være?
Ved henvisning til radiologisk undersøkelse vil ressursbruken inkludere for eksempel én CT- undersøkelse eller én MR-undersøkelse. Ved henvisning til utredning hos annen spesialist vil ressursbruken inkludere for eksempel én times oppmerksomhet fra en spesialist. Selv om disse typene ressurser gjerne utgjør den viktigste delen av ressursbruken, kan det det også være andre typer ressurser som blir brukt.
Hvor stort helsetap vil pasienten ellers ha?
Iblant vil allmennlegen være usikker på om den aktuelle utredningen bør bli prioritert selv etter at hun eller han har tatt hensyn til forventet helsegevinst og ressursbruk. I slike tilfeller bør legen vurdere forventet helsetap i det pasienten eventuelt får helsegevinst fra den aktuelle utredningen. Legen kan da ta utgangspunkt i helsetapet pasienten kan forvente uten utredningen. Dersom helsetapet er stort, er det en ekstra grunn til å henvise pasienten.
Hvilke kjennetegn har de fortrengte tiltakene?
Ved ressursknapphet vil et gjennomført tiltak normalt fortrenge et annet. Allmennlegen bør derfor sammenlikne den aktuelle utredningen mot det eller de tiltak som utredningen risikerer å fortrenge. Dersom det finnes gode retningslinjer for henvisning der det allerede er tatt hensyn til alternativ bruk av ressursene, kan allmennlegen i stor grad støtte seg til disse (se kapittel 12). Dersom det ikke finnes slike retningslinjer, bør allmennlegen forsøke å gjøre en vurdering av om den aktuelle utredningen er viktigere enn det som kan forventes å bli fortrengt. De tre overordnede prioriteringskriteriene bør være sentrale i denne vurderingen.
9.3.2 Tildeling av sengeplass på intensivavdeling
De fleste sykehus har minst en intensivavdeling. På en slik avdeling får pasientene ekstra tett oppfølgning og ofte omfattende behandling. Sammenliknet med andre avdelinger, er det mer avansert utstyr og flere sykepleiere per sengeplass, og det brukes i gjennomsnitt mye mer ressurser per pasient. Mange av pasientene som blir lagt inn på intensivavdeling har akutt og alvorlig organsvikt, for eksempel manglende evne til å puste på egenhånd.
Hver avdeling har et begrenset antall sengeplasser og begrenset tilgjengelig personell. På kort sikt kan man ikke uten videre øke denne kapasiteten. På et sykehus kan det derfor være flere pasienter som er aktuelle for å ligge på intensivavdelingen enn det er sengeplasser til. På mange sykehus oppstår slike situasjoner nærmest daglig.
Vurdering om innleggelse
Pasienter blir som regel vurdert for innleggelse på intensivavdelingen ved at legen som har ansvaret for pasienten utenfor intensivavdelingen kontakter legen som er ansvarlig for intensivavdelingen. Disse legene vil da diskutere pasienten, og intensivlegen vil normalt avgjøre om pasienten skal flyttes til intensivavdelingen.
Det grunnleggende spørsmålet for intensivlegen er derfor om den aktuelle pasienten skal få tilbud om en sengeplass på avdelingen. Dette kan innebære at legen må avgjøre om denne pasienten skal prioriteres over andre kjente kandidater for overflytting. Det kan også være relevant å vurdere om den aktuelle pasienten skal prioriteres over noen av pasientene som allerede er på avdelingen og som kan flyttes ut.
Mange kriterier for utvelgelse av pasienter til intensivavdeling har blitt diskutert og mange faktorer har blitt vist å påvirke slike utvelgelser (Task Force of the American College of Critical Care Medicine 1999; Mielke et al. 2003; Sinuff et al. 2004; Scheunemann og White 2011; Boumendil et al. 2012; Sprung et al. 2013). Det er ikke konsensus om akkurat hvilke kriterier som bør brukes, verken i Norge eller internasjonalt, selv om det er bred enighet om flere generelle prinsipper .
Bruk av de tre hovedkriteriene
De tre hovedkriteriene er ment å gjelde hele helsetjenesten. Det er derfor nyttig å se nærmere på hvordan kriteriene kan brukes også i tildelingen av sengeplass på intensivavdeling. Beslutninger om overflytting til intensivavdeling tas ofte under tidspress og med begrenset informasjon, og framstillingen vil derfor være noe stilisert.
Når intensivlegen vurderer om en gitt pasient bør legges inn på intensivavdelingen, kan det være nyttig for han eller henne å stille seg følgende spørsmål:
Hvilke kjennetegn har den aktuelle pasienten?
Hvor stor vil helsegevinsten være? Mer spesifikt: hvor stor tilleggsgevinst vil pasienten få fra behandling på intensivavdelingen sammenliknet med behandling på annen avdeling?
Hva vil ressursbruken være? Mer spesifikt: hvor mye ekstra ressurser vil bli brukt ved behandling på intensivavdelingen sammenliknet med annen avdeling?
Hvor stort helsetap vil pasienten ellers ha? Mer spesifikt: hva vil forventet helsetap over livsløpet være uten innleggelse på intensiv?
Hvilke kjennetegn har de fortrengte pasientene?
Hvilke kjennetegn har den aktuelle pasienten?
Hvor stor vil helsegevinsten være?
Når legen vurderer forventet helsegevinst, bør det første spørsmålet være om behandlingen totalt sett vil være positiv for den aktuelle pasienten. Det relevante sammenlikningsgrunnlaget er ikke ingen behandling, men behandling ved en annen avdeling på sykehuset. I tråd med helsegevinstkriteriet er det gode leveår som primært er relevant. Dette betyr at gevinster knyttet til både økt levetid og livskvalitet bør vurderes. Det betyr også at det ikke bare er risikoen for død som betyr noe, men hvor mange leveår som vil tapes dersom pasienten dør.
Innledningsvis kan legen særlig stille seg følgende spørsmål:
Er sannsynligheten for et bra utfall svært høy selv om pasienten blir liggende på en annen avdeling? Dette vil kunne gjelde bevisste og stabile pasienter med diabetes ketoacidose eller rusmiddelforgiftning, samt pasienter med mild hjertesvikt.
Er sannsynligheten for et dårlig utfall svært høy selv om pasienten blir overflyttet intensivavdelingen? Dette vil kunne gjelde pasienter med stor irreversibel hjerneskade, irreversibel svikt i flere organer eller kreft med spredning som ikke responderer på behandling.
Dersom svaret på et av disse spørsmålene er ja, bør pasienten normalt ikke flyttes til intensivavdelingen fordi det ikke kan forventes å gi noen ekstra helsegevinst. Intensiv overvåkning og behandling kan oppleves som unødvendig belastende for pasienten, og for den samtykkekompetente pasient er naturligvis samtykke også nødvendig før overflytting.
Dersom utfallet ved intensiv overvåking og behandling er ventet å være bedre enn utfallet uten, bør legen vurdere om en overflytting kan gå utover noen andre pasienter. Noen ganger vil en overflytting ikke gjør det, for eksempel fordi det er ledige sengeplasser og personellet ikke kan brukes på andre oppgaver. I slike tilfeller kan enhver pasient med positiv forventet gevinst normalt legges inn på intensivavdelingen. Andre ganger kan en overflytting ventes å gå utover andre pasienter, for eksempel ved å oppta en sengeplass en annen pasient har behov for og ellers hadde fått. Det kan også skje ved at personalet må fordele sin tid på flere pasienter og at andre pasienter dermed får mindre oppmerksomhet. I tilfeller som disse bør intensivlegen vurdere behandlingen av både den aktuelle pasienten og kandidatene mer inngående.
Dette vil i første omgang innebære å anslå hvor stor tilleggsgevinsten fra intensivbehandlingen vil bli, sammenliknet med behandling på en alternativ avdeling. Her er det ikke bare eventuelle utfall under oppholdet på intensivavdelingen eller på sykehuset som er relevante, men også utfall på langt sikt, dvs. resten av livet. Intensivlegen bør etter beste evne anslå helsegevinsten i form av økt levetid eller livskvalitet med den informasjonen som er tilgjengelig. I denne vurderingen kan det være nyttig å vurdere følgende spørsmål:
Hvor mye vil en innleggelse på intensivavdelingen redusere risikoen for død?24
Hvor mange leveår kan forventes å bli reddet, gitt denne risikoreduksjonen?
Hvilken helserelatert livskvalitet kan forventes for disse årene?
Å svare på disse spørsmålene og det mer generelle spørsmålet om antall gode leveår er svært utfordrende. Intensivlegen må bruke tilgjengelig informasjon for sine anslag, inkludert informasjon om diagnose og diagnostisk kategori, alder, alvorlighet, funksjonsstatus og komorbiditet. Det er også utviklet ulike skåringssystem, blant annet knyttet til funksjonen av vitale organsystem som lunge, hjerte, nyre, lever, for hjelpe beslutningstakeren i disse situasjonene, men det finnes ennå ikke et pålitelig system for å predikere presise utfall på lang sikt – inkludert overlevelse og gode leveår – med informasjon som er tilgjengelig når avgjørelsen skal tas (Strand og Flaatten 2008; Sprung et al. 2012). Helsegevinstkriteriet kan likevel være nyttig for å strukturere vurderingen, og det kan være nyttig i arbeidet med å utvikle retningslinjer for klinisk prioritering på en intensivavdeling.
Hva vil ressursbruken være?
For hvert døgn en pasient opptar en sengeplass på intensivavdelingen vil det bli brukt mye ressurser knyttet til teknisk utstyr og personell. En måte pasientene skiller seg fra hverandre er hvor lenge de er forventet å måtte ligge på avdelingen. I de tilfeller det er mangel på sengeplasser kan dette være relevant å vurdere. Dersom en pasient bare trenger kort tid på intensivavdelingen kan det være grunn til å gi pasienten prioritet fordi sengeplassen raskt vil være ledig for andre pasienter. Det kan også være andre forskjeller mellom pasientene når det gjelder ressursbruk.25
Hvor stort helsetap vil pasienten ellers ha?
Iblant vil intensivlegen være usikker om på hvilken pasient som skal få en sengeplass på intensiv selv etter å ha vurdert helsegevinst og ressursbruk. I slike tilfeller bør legen vurdere forventet helsetap i det pasienten eventuelt får helsegevinst fra oppholdet på intensivavdelingen. Legen kan da ta utgangspunkt i forventet helsetap over livsløpet uten innleggelse på intensiv. Iblant kan legen forvente at pasienten vil dø uten intensivbehandling, men ikke alltid. En del pasienter blir for eksempel lagt inn på intensivavdelingen for nøye overvåkning i tilfelle en komplikasjon skulle oppstå, selv om det er mest sannsynlig at den ikke vil det. Når legen har vurdert risikoen for død uten oppholdet på intensivavdelingen, bør hun eller han anslå hvor mange gode leveår som vil gå tapt dersom pasienten dør. Den med størst risiko for å dø på kort sikt trenger ikke å være den med det største helsetapet. Andre faktorer påvirker også, inkludert flere av de som er relevante for predikeringen av helsegevinst. På grunnlag av disse vurderingene, kan intensivlegen så anslå helsetapet. Blant pasienter som ellers er like, bør pasienten med det største forventede helsetapet normalt legges inn på avdelingen.
Hvilke kjennetegn har de fortrengte pasientene?
I mange tilfeller vil det være flere pasienter som vil ha nytte av å ligge på intensivavdelingen enn det er sengeplasser med tilgengelig personell. Når intensivlegen får forespørsel om overflytting av en gitt pasient, vil legen ofte ha kjennskap til andre kandidater for overflyttingen og pasientene som allerede ligger på intensivavdelingen. I slike tilfeller, bør legen sammenlikne pasientene og bruke de tre hovedkriteriene til å avgjøre hvilken eller hvilke pasienter som skal få plass på avdelingen.
Prosess og brukermedvirkning
Beslutningen om en pasient får eller ikke får tilbud om plass på intensivavdelingen kan være svært avgjørende for pasientens videre liv og helse. Det er noe uenighet om de konkrete kriteriene for innleggelse på intensivavdelingen, og det er nokså betydelig praksisvariasjon mellom sykehus og mellom leger innenfor sykehus (Boumendil et al. 2012; Norsk intensivregister 2013). Dette gir grunn til å ha en god prosess for utvelgelse av pasienter til intensivavdelingen. Det har blitt foreslått at en slik prosess, med visse tilpasninger, kan baseres på rammeverket «Ansvar for rimelige beslutninger» (Mielke et al. 2003; Strosberg og Teres 2003), som blir inngående drøftet i kapittel 11. I tråd med dette rammeverket bør kriteriene som blir brukt være relevante og oppleves som relevante. Gitt utvalgets anbefalinger betyr det at de konkrete kriteriene bør være basert på de tre overordnede kriteriene for prioritering og på god faglig dokumentasjon. Det bør være åpenhet omkring prosessen og kriteriene som blir brukt. Det bør også være utviklet klare og eksplisitte retningslinjer, og disse bør være gjort kjent både for personell, pasienter og pårørende. I tillegg bør pasienter og pårørende bli grundig informert om spesifikke beslutninger som angår dem, og det bør være mulig å omgjøre beslutninger dersom ny kunnskap kommer fram. Til sist bør de konkrete kriteriene og retningslinjene jevnlig diskuteres og oppdateres. Slik kan prioriteringsarbeidet stadig bli bedre.
9.3.3 Vurdering av forebyggende tiltak
Både i diskusjoner om prioritering og ellers rettes oppmerksomheten gjerne mot behandling av manifest sykdom. Et sentralt prioriteringsspørsmål er derfor om forebyggende tiltak får tilstrekkelig oppmerksomhet og ressurser sammenliknet med behandling (Faust og Menzel 2012; Helsedirektoratet 2012a). Et annet viktig spørsmål er hvordan spesifikke forebyggende tiltak bør rangeres, både i forhold til andre forebyggende tiltak og i forhold til behandling. Behandling blir i dette underkapittelet forstått som ikke-forebyggende tiltak.
Utvalget mener at forebyggende tiltak bør få økt oppmerksomhet, og da spesielt på to måter. Det bør gjøres mer for å samle inn relevant data og analysere kunnskapsgrunnlaget for forebyggende tiltak, slik det er beskrevet i kapittel 12. Videre bør det sikres at forebyggende tiltak som blir funnet prioriteringsverdige etter de tre hovedkriteriene, og eventuelt andre relevante hensyn, faktisk blir innført.
Det er derfor nyttig å vise hvordan de tre hovedkriteriene kan brukes i prioriteringsvurderinger av forebyggende tiltak, og særlig befolkningsrettede forebyggende tiltak. Det er også nyttig å beskrive hvordan egenskaper ved de tre kriteriene generelt påvirker prioriteringen av forebyggende tiltak vis-à-vis behandling.
Når beslutningstakeren vurderer et forebyggende tiltak, kan det være nyttig for henne eller han å stille seg følgende spørsmål:
Hvilke kjennetegn har det aktuelle tiltaket?
Hvor stor vil helsegevinsten være?
Hva vil ressursbruken være?
Hvor stort helsetap vil målgruppen ellers ha?
Hvilke kjennetegn har de fortrengte tiltakene?
Hvilke kjennetegn har det aktuelle tiltaket?
Hvor stor vil helsegevinsten være?
Nøye vurdering av helsegevinster er naturligvis helt sentralt for forebyggende tiltak, som for andre tiltak. Det relevante sammenlikningsgrunnlaget kan være ingen tiltak, andre forebyggende tiltak eller behandling. Helst bør helsegevinster i form av gode leveår vurderes, slik at både økt levetid og bedret livskvalitet blir vektlagt. I tråd med helsegevinstkriteriet kan det også være aktuelt å ta hensyn til øvrige velferdsgevinster.
Flere egenskaper ved helsegevinstkriteriet, slik det blir foreslått konkretisert, gjør det vel anlagt til å prioritere forebyggende tiltak. Særlig det at utvalget anbefaler å ikke diskontere helsegevinster (kapittel 10), vil normalt være til fordel for forebyggende tiltak.
Dokumentasjonen må også vurderes nøye, slik det er nærmere beskrevet i kapittel 10. Når man skal identifisere effektive tiltak på folkehelseområdet, står man imidlertid overfor den utfordring at det er vanskelig å overføre evidenskravene som gjelder kurativ medisin. På noen områder er det lettere å skaffe evidens enn på andre områder. De tiltakene som retter seg mot individer er ofte enklest å evaluere, mens de befolkningsrettede og universelle tiltakene kan være vanskeligst å evaluere. Stiller man urimelig strenge og snevre krav til evidens på folkehelsefeltet, vil ofte få eller ingen tiltak fremstå som effektive. Når strategiene for norsk tobakkspolitikk ble lagt på 1960-tallet, var evidensgrunnlaget for hva som var effektive befolkningsrettede tiltak svært mangelfullt. Ut fra faglige vurderinger og skjønn la en likevel grunnlaget for et tiltaksprogram som sannsynligvis har bidratt til nedgangen i røyking i den norske befolkningen. I den sammenheng er det også interessant at Mackenbach og medarbeidere mener å ha dokumentert at de befolkningsrettede tiltakene bidro langt sterkere enn de individrettede til å forebygge dødsfall i den nederlandske befolkningen i perioden 1970–2010 (Mackenbach et al. 2012). Dette er i samsvar med Geoffrey Roses konklusjon når han sammenlignet befolkningsrettede strategier med høyrisikostrategier (Rose 1992).
I vedlegg 5 beskrives kunnskapsgrunnlaget for tre folkehelsetiltak, knyttet til henholdsvis fysisk aktivitet, fall hos eldre og depresjon hos ungdom. Dette er tiltak som Folkehelseinstituttet mener har veldokumentert, god effekt, samtidig som de ikke er blitt fullt ut implementert i Norge. Utvalget mener disse tiltakene bør bli vurdert for økt prioritet, og at det bør gjøres en helseøkonomisk evaluering av forholdet mellom helsegevinst, ressursbruk og helsetap for hvert av tiltakene.
Hva vil ressursbruken være?
Ressursbruken bør nøye vurderes for forebyggende tiltak, som for andre tiltak. Beslutningstakeren bør ta utgangspunkt i ressursbruk i helsesektoren, slik det ble beskrevet i kapittel 7. Dersom det aktuelle tiltaket utløser en betydelig ressursbruk utenfor helsetjenesten, kan det tillegges vekt i den grad det ikke vil gi urettferdige fordelingsvirkninger
Hvor stort helsetap vil målgruppen ellers ha?
Etter at beslutningstakeren har vurdert helsegevinster og ressursbruk, kan hun eller han fortsatt være usikker på om det aktuelle tiltaket bør prioriteres. I slike tilfeller bør målgruppens helsetap vurderes. I tråd med slik helsetapskriteriet har blitt konkretisert, er det helsetapet hos de som faktisk får en helsegevinst fra tiltaket, på det tidspunkt de får gevinsten, som er primært relevant. Dette skiller seg fra det gjeldende alvorlighetskriteriet, slik det ofte blir forstått, og kan være av stor betydning for prioriteringen av forebyggende tiltak. Alvorlighetskriteriet blir gjerne oppfattet slik at det vektlegger hvor alvorlig tilstanden er for de som mottar tiltaket på det tidspunktet oppstart av tiltaket er aktuelt. Denne forskjellen kan være av stor betydning for hvordan forebyggende tiltak blir prioritert vis-à-vis behandling. For forebyggende tiltak kan gjennomsnittlig helsetap hos de som får helsegevinst (gevinstmottakerne), på det tidspunktet de får gevinst, skille seg markant fra gjennomsnittlig helsetap hos alle de som får et tiltak (tiltaksmottakerne), på det tidspunkt tiltaket er aktuelt.
Dette kan illustreres ved hjelp av HPV-vaksinen for forebygging av kreft i livmorhalsen. Vaksinen er aktuell for friske jenter i alderen 12–16 år. Disse har lav risiko for å utvikle kreft i livmorhalsen, og tilstanden deres, når de får vaksinen, er derfor ikke alvorlig. Etter en vanlig fortolkning av alvorlighetskriteriet, får derfor HPV-vaksine ikke noen ekstra prioritet på basis av alvorlighet. Dersom alvorlighet brukes som et nødvendig vilkår for offentlig finansiering, kan HPV-vaksine til og med bli utelukket fra slik finansiering uavhengig av andre forhold ved vaksinen. Kvinner som utvikler kreft i livmorhalsen får imidlertid en tilstand med betydelig gjennomsnittlig helsetap, selv med eksisterende behandling. De kvinnene som faktisk får gevinst fra HPV-vaksinen er de som ellers ville utviklet kreft. Helsegevinstene tilfaller altså personer som har et betydelig helsetap i det de får gevinst. Helsetapskriteriet tar hensyn til dette og gir økt prioritet.
Helsetapskriteriet vurderer på denne måten forebygging og behandling mer likeverdig enn alvorlighetskriteriet. Utvalget mener også at helsetapskriteriet mye bedre fanger det sentrale fordelingshensynet knyttet til slike forebyggende tiltak.
Hvilke kjennetegn har de fortrengte tiltakene?
Når beslutningstakeren vurderer ett eller flere forebyggende tiltak, bør hun eller han også tenke på det eller de tiltakene hvert av de aktuelle tiltakene risikerer å fortrenge. Tiltakene som fortrenges kan være behandling, men også andre forebyggende tiltak. Beslutningstakeren bør forsøke å anslå egenskapene til de tiltakene som vil bli fortrengt, og så vurdere om hvert av de aktuelle tiltakene er viktigere enn disse. De tre overordnede prioriteringskriteriene kan og bør være sentrale i denne vurderingen.
9.4 Bruk av kriteriene sammen med grenseverdier
Prioriteringskriteriene sier noe om forholdet mellom en bestemt egenskap ved tiltak og prioritet. Mer spesifikt sier hovedkriteriene hvordan prioritet varierer med forventet helsegevinst, ressursbruk og helsetap. Slik kan kriteriene brukes til å rangere ulike tiltak.
I visse tilfeller vurderes imidlertid et tiltak separat, dvs. uten direkte sammenlikning med andre konkrete, konkurrerende tiltak. Særlig da kan det være nyttig å kombinere kriteriene med en eller flere grenseverdier. Typisk blir grenseverdier brukt slik at alle måleverdier under grenseverdien indikerer én beslutning eller vurdering, mens alle måleverdier over grenseverdien indikerer en annen. Blant annet i prioriteringsforskriften har kriteriene denne funksjonen selv om de eksakte verdiene ikke er presist definert. Et av vilkårene for rett til nødvendig helsehjelp er at «pasienten har et visst prognosetap med hensyn til livslengde eller ikke ubetydelig nedsatt livskvalitet dersom helsehjelpen utsettes». Dersom dette vilkåret er oppfylt, kan pasienten ha en slik rett, mens dersom det ikke er oppfylt, har pasienten ikke rett på helsehjelp.
I mandatet bes utvalget vurdere «hvorvidt det bør innføres grense(r) for hva som menes med et rimelig forhold mellom kostnad og effekt, og hvorvidt det bør være en eller flere grenser avhengig av prioriteringssituasjonen». Det spørres altså om grense(r) for en gitt vurdering, nemlig vurderingen om forholdet mellom kostnad og effekt er rimelig. Utvalget har tolket dette som et spørsmål om den maksimale kostnad-effektbrøken som representerer et rimelig forhold mellom kostnad og effekt. Denne brøken samsvarer med ressursbruk-helsegevinstbrøken under de forutsetninger som er beskrevet i kapittel 7.
De tre overordnede kriteriene er ment å gjelde for hele helsetjenesten, med dens mange, svært ulike beslutningssituasjoner. Rollen til grenseverdier vil av den grunn også variere. Som beskrevet ovenfor kan hovedkriteriene i mange situasjoner brukes direkte, og grenseverdier vil da være unødvendige. I andre situasjoner kan grenseverdier være svært nyttige.
9.4.1 Når grenseverdier er nyttige
Grenseverdier kan være nyttige særlig i situasjoner der beslutningstakeren vurderer om ett tiltak skal implementeres eller ikke og samtidig har utilstrekkelig informasjon om de spesifikke tiltakene som konkurrerer om de samme ressursene. Mange situasjoner er som dette på klinisk nivå. Når en allmennlege vurderer å henvise pasienten foran seg til MR, vet hun eller han normalt ikke hvilke andre pasienter som må vente eller ikke får MR-undersøkelse dersom hun eller han velger å henvise. Tilsvarende, når en sykehuslege vurderer om en inneliggende pasient skal få en dyr medisin, vet hun eller han normalt ikke hvilke tiltak for andre pasienter som ressursene ellers kunne blitt brukt på.
På ledelsesnivå vil det være mange situasjoner der beslutningstakeren må si ja eller nei til et gitt tiltak, men ikke har presis informasjon om de tiltakene som reelt konkurrerer om de samme ressursene, dvs. de tiltakene som faktisk vil bli fortrengt. Det aktuelle tiltaket kan være et eksisterende tiltak som vurderes opp- eller nedskalert eller et nytt tiltak som vurderes innført.
En konkret situasjon der grenseverdier kan være nyttige, er vurderingen av opptak av legemiddel i blåreseptordningen. I de fleste tilfeller er det Statens legemiddelverk (SLV) som avgjør hvilke medisiner som kan gis på blå resept. SLV vet i en slik situasjon normalt ikke hvilke konkrete tiltak26 som vil bli fortrengt dersom de beslutter å ta opp legemiddelet. Dersom kostnadene knyttet til legemiddelet overstiger den såkalte bagatellgrensen, blir beslutningen om refusjon ikke tatt av SLV selv, men i Stortinget i forbindelse med statsbudsjettet.
En annen situasjon der grenseverdier kan være nyttige, er vurderingen av nye metoder i spesialisthelsetjenesten. Et nasjonalt system for innføring av nye metoder i spesialisthelsetjenesten har nylig blitt tatt i bruk i Norge (Helsedirektoratet 2013b). I det systemet forstås metode bredt som alle tiltak for å forebygge, utrede, diagnostisere og behandle sykdom samt tiltak for rehabilitering av pasienter og organisering av helsetjenester. Den endelig beslutningen skal i mange tilfeller bli tatt i et beslutningsforum som består av de administrerende direktørene i de fire regionale helseforetakene. Ressursene til en eventuell ny metode må normalt helt eller i stor grad finnes innenfor eksisterende rammer. Ideelt sett bør direktørene ha kontroll over hvilke tiltak som blir nedskalert ved eventuell innføring av ny metode. Dersom de også har tilstrekkelig informasjon om den beste kandidaten for nedskalering, dvs. det minst viktige, eksisterende tiltaket som kan bli nedskalert, kan de sammenlikne det med den nye metoden ved hjelp av de tre hovedkriteriene. I tillegg bør de sammenlikne den beste kandidaten for oppskalering blant de eksisterende tiltakene, slik det ble beskrevet ovenfor. I den grad de ikke har tilstrekkelig informasjon eller kontroll, kan en grenseverdi være nyttig.
9.4.2 Hva grenseverdier bør reflektere
Hovedfunksjonen til grenseverdier, i denne sammenheng, er å knytte en måleverdi ved et tiltak til en konkret vurdering av tiltaket. Mer spesifikt gjelder dette vurderingen om kostnad-effektbrøken til det aktuelle tiltaket er rimelig eller ikke.
Utvalget foreslår at grenseverdier da bør være basert på det beste anslaget for alternativkostnaden til det tiltaket som blir vurdert. I en valgsituasjon er alternativkostnaden til et tiltak verdien av den beste reelle alternative ressursbruken.27 Innenfor helsetjenesten vil det i hovedsak tilsvare verdien av det beste tiltaket, eller av den beste gruppen av tiltak, som vil bli fortrengt dersom det aktuelle tiltaket iverksettes. Alternativkostnad og verdi er her ikke primært knyttet til kroner og øre, men til helsegevinster som ikke blir skapt dersom det aktuelle tiltaket blir iverksatt.28 Selv om verdien av et tiltak avhenger av mange faktorer, krever bruk av grenseverdier en viss forenkling. I tråd med de tre hovedkriteriene er en nyttig forenkling at verdi og alternativkostnad uttrykkes i form av gode leveår, justert for helsetap.
Begrunnelsen for å vurdere alternativkostnad og for å koble grenseverdi til denne er å sikre at beslutningstakeren velger det alternativet som er mest verdifullt, dvs. det alternativet som gir flest gode leveår, justert for helsetap. Når beslutningstakeren vurderer et gitt tiltak, sikres det på følgende måte: Beslutningstakeren sammenlikner verdien av det aktuelle tiltaket med alternativkostnaden, dvs. verdien av det beste reelle alternativet. Dersom verdien av det aktuelle tiltaket er høyere enn alternativkostnaden, bør tiltaket iverksettes. Dersom verdien av tiltaket er lavere enn alternativkostnaden, bør tiltaket ikke iverksettes. Ved en riktig vurdering av alternativkostnad sikrer beslutningstakeren at det beste alternativet velges og hindrer at man iverksetter et tiltak som fortrenger mer verdifulle tiltak, noe som ville gjort at man reddet færre gode leveår, justert for helsetap, enn man ellers kunne.
Det beste anslaget for alternativkostnaden til et tiltak vil avhenge av flere aspekter ved valgsituasjonen. Én situasjon skiller seg imidlertid ut når det gjelder generell relevans og tilgjengelig estimat for alternativkostnaden. Det er en situasjon der beslutningstakeren a) vurderer om ett gitt tiltak skal bli offentlig finansiert eller ikke; b) har liten eller ingen kontroll over hva ressursene vil bli brukt til dersom hun eller han sier nei; c) har grunn til å tro at ressursene ellers vil bli brukt innenfor helsetjenesten; men d) har ingen mer presis informasjon om hva ressursene ellers vil bli brukt til. Dette kan kalles standardsituasjonen, og flere av valgsituasjonene beskrevet ovenfor ligner til en viss grad på denne. SLVs vurdering av opptak av legemidler i blåreseptordningen har mange av de samme kjennetegnene som denne standardsituasjonen, i alle fall når det er grunn til å tro at ressursene ellers ville blitt brukt innenfor helsetjenesten.
Alternativkostnaden kan, som beskrevet, uttrykkes i form av antall gode leveår, justert for helsetap. I standardsituasjonen vil den grenseverdien som mest direkte reflekterer alternativkostnaden, være lik gjennomsnittlig kostnad per gode leveår vunnet (justert for helsetap) i helsetjenesten ved marginale endringer i helsebudsjettet. Dette er ikke gjennomsnittet av kostnader og gode leveår for alle tiltak som blir gjennomført i helsetjenesten, kun gjennomsnittet for de endringer som følger fra en liten økning eller reduksjon i helsebudsjettet. At denne brøken er et fornuftig utgangspunkt, kan lettest illustreres ved å forutsette at helsetapet er likt for alle tiltak. Dersom tiltaket som vurderes, har en kostnad-effektbrøk under en slik grenseverdi kan forholdet mellom kostnad og effekt regnes som rimelig fordi det er grunn til å tro at tiltaket vil frambringe flere helsegevinster enn det fortrenger. Dersom tiltaket som vurderes, har en kostnad-effektbrøk over en slik grenseverdi kan forholdet mellom kostnad og effekt ikke uten videre regnes som rimelig, fordi det grunn til å tro at tiltaket vil fortrenge flere helsegevinster enn det selv vil frambringe.
9.4.3 Beregning av grenseverdier
Utvalget mener altså at grenseverdier kan være nyttige og at grenseverdier for standardsituasjonen bør være basert på gjennomsnittlig kostnad-effektbrøk ved marginale endringer i helsebudsjettet. Størrelsen på denne brøken er et empirisk spørsmål, og hvor nyttig grenseverdier faktisk vil være, vil avhenge av hvor godt estimat som finnes for den brøken. Som for de fleste andre land finnes det ikke et grundig estimat for helsetjenesten i Norge. Et slik estimat har imidlertid nylig blitt utarbeidet for den nasjonale helsetjenesten i England (Claxton et al. 2013). Ved å studere variasjon i ressursbruk og årsaksspesifikk dødelighet over tid og på tvers av ulike områder har man beregnet hvor mye en liten endring i helsebudsjettene påvirket antallet gode leveår som ble generert. Disse variasjonene tilsvarte at man ved små endringer i budsjettet betalte om lag £13 000 i gjennomsnitt for hvert ekstra gode leveår (ca. 130 000 norske kroner med dagens kurs). Selv om forfatterne av studien kaller estimatet konservativt, er det lavere enn mange hadde forventet, og lavere enn den gjeldende grenseverdien som blir brukt av National Institute for Health and Care Excellence (NICE) i Storbritannia.
Estimatet for England kan ikke uten videre overføres til norske forhold. Helsedirektoratet viser i et notat til utvalget at den tilsvarende kostnad-effektbrøken i Norge, gitt visse antagelser, vil være på ca. 215 000 kroner per gode leveår (Helsedirektoratet 2014d). Dette anslaget er likt estimatet for Norge som ble utarbeidet av Karl Claxton og medarbeidere for utvalget.29 Dette tallet er betydelig lavere enn mange av de grenseverdiene som har blitt diskutert i Norge de siste årene, og lavere enn kostnaden per gode leveår ved flere av de nye tiltakene som nylig har blitt innført (Kristiansen og Gyrd-Hansen 2007; Nasjonalt råd 2012; Helsedirektoratet 2014e).
Dersom dette estimatet skulle reflektere den virkelige alternativkostnaden i Norge, ville det bety at innføringen av et nytt tiltak innenfor eksisterende helsebudsjett som koster merenn 215 000 kroner per vunnet godt leveår, fører til at samfunnet «mister» flere gode leveår enn det får igjen. Dette er tilfellet uansett hva «betalingsvilligheten» for et godt leveår skulle være.
Estimatet på 215 000 kroner er bare en forenklet overføring fra en engelsk kontekst. Både det opprinnelig estimatet og denne overføringen er usikker. Den engelske studien måtte naturligvis gjøre en rekke antagelser (Claxton et al. 2013; Raftery 2014). Når det gjelder overføringen til Norge, er det viktig å være oppmerksom på flere forskjeller mellom helsetjenestene i England og Norge som kan påvirke gjennomsnittlig kostnad per gode leveår vunnet ved marginale endringer i helsebudsjettet. Blant disse er forskjeller i inntekt, effektivitet, eksisterende prioriteringer og hvor mye ressurser som brukes på helsetjenesten.
Disse forskjellene undestreker behovet for at det snarest settes i gang et arbeid med å finne et bedre estimat for den norske helsetjenesten, det vil et estimat for hva som er gjennomsnittlig kostnad per gode leveår vunnet i den norske helsetjenesten ved marginale endringer i helsebudsjettet. Utarbeidelsen av dette estimatet bør samsvare med hvordan de tre overordnede kriteriene er blitt foreslått konkretisert.
9.4.4 Justering for helsetap
En grenseverdi lik gjennomsnittlig kostnad-effektbrøk for marginale endringer i helsebudsjettet tar ikke direkte hensyn til helsetap, hverken helsetapet knyttet til det aktuelle tiltaket eller helsetapet knyttet til de tiltakene som blir fortrengt. Helsetap er, som det har blitt beskrevet i kapittel 7, imidlertid svært sentralt for prioritering. Et godt leveår som tilfaller noen med stort helsetap, er viktigere enn et godt leveår som gagner noen med lite helsetap.
Det er to hovedmåter for å ta hensyn til helsetap ved bruk av grenseverdier. En mulighet er å ha en grenseverdi for den helsetapsjusterte kostnad-effektbrøken til det aktuelle tiltaket. Helsegevinstene fra det aktuelle tiltaket kan da vektes slik det ble beskrevet i kapittel 7. Ved en slik framgangsmåte trenger man bare én enkelt grenseverdi, en som direkte reflekterer alternativkostnaden på den måten det ble beskrevet tidligere. Grenseverdien er da selv en helsetapsjustert kostnad-effektbrøk der den rene kostnad-effektbrøken er justert for helsetapet knyttet til de helsegevinstene som blir fortrengt.
Utvalget mener imidlertid at en annen tilnærming er enklere og mer i tråd med utvalgets mandat. Den innebærer å ha flere grenseverdier for den rene kostnad-effektbrøken, der grenseverdiene varierer etter helsetapet knyttet til tiltaket som blir vurdert. Disse grenseverdiene er da basert på alternativkostnaden, men justert for forskjeller i helsetap mellom det aktuelle tiltaket og de tiltakene som blir fortrengt, for å bedre reflektere verdien av det aktuelle tiltaket. En slik tilnærming gjør at grenseverdiene gjelder for den rene kostnad-effektbrøken, samtidig som betydningen av helsetap blir gjort klar og eksplisitt.
Utvalget mener det er viktig at det snarest settes i gang et arbeid med å finne et godt estimat for helsetapet knyttet til de tiltak og helsegevinster som blir fortrengt ved marginale endringer i det norske helsebudsjettet.
9.4.5 Trappetrinnsmodell og illustrasjon
I stedet for én enkelt grenseverdi mener utvalget at det er behov for et sett med grenseverdier, differensiert etter helsetap. Utvalget vil foreslå en trappetrinnsmodell og beskrive hvordan man kan gå fram for å etablere grenseverdiene i en slik modell, til bruk i situasjoner som tilsvarer det som ble kalt standardsituasjonen. Utvalget vil også illustrere modellen og framgangsmåten ved hjelp av tentative grenseverdier. Modellen og framgangsmåtens egnethet står ikke og faller på om disse grenseverdiene vurderes som de riktige. Framgangsmåten kan beskrives i form av tre trinn.
Første trinn vil være å anslå gjennomsnittlig kostnad-effektbrøk ved marginale endringer i helsebudsjettet i Norge. Et presist anslag finnes ikke i dag. For illustrasjon kan estimatet overført fra England brukes. Som beskrevet ovenfor er dette estimatet på 215 000 kroner per gode leveår. Den faktiske gjennomsnittlige kostnad-effektbrøken ved marginale endringer i helsebudsjettet kan ligge noe lavere eller høyere enn dette estimatet. Utvalget har valgt et noe høyere estimat, 275 000 kroner per gode leveår, i illustrasjonen av trappetrinnsmodellen.
Andre trinn vil være å anslå det gjennomsnittlige helsetapet knyttet til de helsegevinstene som inngår i den estimerte kostnad-effektbrøken. Dette helsetapet vil avhenge av målgruppene til de tiltakene som blir oppskalert eller nedskalert ved marginale endringer i helsebudsjettet. Studien fra England beregnet ikke dette, og det finnes heller ingen andre godt dokumenterte estimater. En kan imidlertid tenke seg at når det gjelder endringer på marginen av helsebudsjettet i Norge, vil helsetapet normalt være lite. En mulighet er derfor å tenke seg at det gjennomsnittlige helsetapet vil kunne plasseres i nedre del av helsetapsklasse 1.
Tredje trinn vil være å bruke en regel for avveining mellom kostnad/effekt og helsetap. Her kan man bruke 1–2–3-regelen, beskrevet i kapittel 7. Etter denne regelen øker vektene gradvis fra helsetapsklasse 1 til helsetapsklasse 3. Mer spesifikt er det minste, mulige helsetapet i helsetapsklasse 1, 2 og 3 knyttet til en vekt på henholdsvis 1, 2 og 3. Denne regelen kan kombineres med anslaget om at grenseverdien på 275 000 kroner per gode leveår er koblet til nedre del av helsetapsklasse 1. På denne bakgrunn er det grunn til foreslå en grenseverdi for helsetapsklasse 0 på 250 000 kroner, og grenseverdier for helsetapsklasse 1 på mellom 250 000 og 500 000 kroner. Grenseverdiene for helsetapsklasse 2 blir mellom 500 000 og 750 000 kroner, og for helsetapsklasse 3 mellom 750 000 og 1 000 000 kroner. Intervallene tar hensyn til at det er betydelig variasjon i helsetap også innenfor helsetapsklassene. Desto større helsetap innenfor klassen, desto høyere grenseverdi innenfor det intervallet.
Utvalget mener denne framgangsmåten kan være nyttig for å etablere et sett med differensierte grenseverdier. Utvalget understreker at det er viktig å sette i gang et systematisk arbeid for å komme til sikrere estimater for den norske helsetjenesten. Det er like fullt nyttig å illustrere hvordan trappetrinnsmodellen for grenseverdier kan se ut, med bruk av de tentative grenseverdiene. Dette er gjort i figur 9.1, der forslag til grenseverdier for de ulike helsetapsklassene er vist. Trappetrinnsmodellen framhever blant annet hvordan grenseverdien øker med økende helsetap.
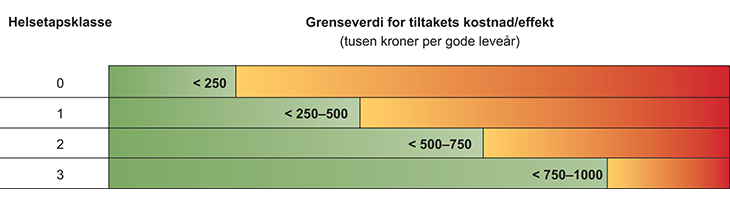
Figur 9.1 Trappetrinnsmodellen med tentative grenseverdier
Dersom tiltaket som vurderes, har en kostnad-effektbrøk innenfor det grønne området, bør forholdet mellom kostnad og effekt kunne regnes som rimelig, gitt helsetapet. Beslutningstakeren vil da normalt ha god grunn til å innføre eller videreføre det aktuelle tiltaket.
I andre tilfeller vil tiltaket som vurderes, ha en kostnad-effektbrøk som er større enn høyeste verdi i det relevante intervallet. Tiltakets kostnad-effektbrøk vil da falle i det som er illustrert som det gul-røde området. For å avgjøre om kostnad-effektbrøken likevel kan vurderes som rimelig, bør beslutningstakeren vurdere om følgende særskilte forhold er tilstede:
Tiltaket har egenskaper som tilsier høy prioritet etter de tre hovedkriteriene, men som ikke er tilstrekkelig reflektert i kostnad-effektbrøken og helsetap, slik disse er beregnet. Disse egenskapene kan være knyttet til gevinster som kan være vanskelig å måle, slik som gevinster relatert til informasjon, verdighet, og særlig belastning hos pårørende. Det kan også være egenskaper knyttet til svært store helsetap (>45 gode leveår) hos målgruppen eller andre fordelingshensyn ivaretatt av de tre kriteriene. For at slike egenskaper ved tiltaket skal kunne heve den kostnad-effektbrøken som kan vurderes som rimelig, må det være grunn til å anta at det aktuelle tiltaket har disse egenskapene i større grad enn de tiltakene som blir fortrengt.
Det finnes helt eksepsjonelle grunner som tilsier at tiltaket bør få høy prioritet som ikke fanges opp av de tre overordnede kriteriene. For at slike grunner skal kunne heve den kostnad-effektbrøken som kan vurderes som rimelig, må det igjen være grunn til å anta at det aktuelle tiltaket faktisk skiller seg fra de tiltakene som blir fortrengt på de aktuelle områdene.
Dersom et av disse forholdene er til stede, kan det være grunn til å akseptere en kostnad-effektbrøk i det gul-røde området som rimelig. Det krever imidlertid en spesielt grundig vurdering. Det er også slik at desto høyere kostnad-effektbrøken er, og desto nærmere det helt røde området den kommer, desto mer tungtveiende og spesielle grunner er nødvendige. Dette er fordi desto høyere kostnad-effektbrøken er, desto flere helsegevinster går tapt for andre ved finansiering av det aktuelle tiltaket.
Akkurat hva en spesielt grundig vurdering bør innebære, vil variere etter beslutningssituasjon. Én spesielt viktig situasjon er Statens legemiddelverks vurdering av opptak av legemiddel i blåreseptordningen. Dersom man får etablert en trappetrinnsmodell med grenseverdier som er tilpasset denne situasjonen, kan tiltak som faller i gult-rødt område utløse en bestemt type vurdering. For eksempel kan det i slike tilfeller være hensiktsmessig at det innhentes råd fra Nasjonalt råd for kvalitet og prioritering i helse- og omsorgstjenesten. Generelt mener utvalget at dagens bagatellgrense, knyttet til kostnader, bør økes noe for tiltak innenfor akseptable grenseverdier.30 Dersom det kan foreligge særlige grunner for å gå utover ellers gjeldende grenser for forholdet mellom ressursbruk og helsegevinst, bør denne beslutningen overføres til Helse- og omsorgsdepartementet og Stortinget. Å be om en vurdering fra Nasjonalt råd for tiltak som faller i gult-rødt område i trappetrinnsmodellen, kan også være en god framgangsmåte for Nasjonalt system for innføring av nye metoder i spesialisthelsetjenesten.
9.4.6 Lokale ressursrammer
En del beslutningssituasjoner i helsetjenesten ligner på standardsituasjonen bortsett fra at beslutningstakeren vet eller har grunn til å tro at ressursene ellers vil bli brukt innfor en lokal ressursramme. Beslutningstakeren vet altså noe mer spesifikt enn at ressursene ellers vil bli brukt innenfor helsetjenesten. I slike situasjoner kunne man tenkt seg en grenseverdi basert på tilsvarende tankegang som for standardsituasjonen (Appleby et al. 2009; Claxton et al. 2013; Eckermann og Pekarsky 2014). Mer spesifikt kunne man bruke grenseverdier basert på en gjennomsnittlig kostnad-effektbrøk for marginale endringer i det lokale budsjettet.
Den gjennomsnittlige kostnad-effektbrøken for slike endringer kan imidlertid variere betydelig mellom de ulike lokale budsjettene i helsetjenesten (Adang et al. 2005; Appleby et al. 2009; Bridges et al. 2010; Claxton et al. 2013; Eckermann og Pekarsky 2014). Brøken er for eksempel neppe den samme for alle helseforetak og alle enheter innenfor helseforetak, selv dersom man skulle ønske at det var slik. På grunn av slik variasjon er det også grunn til å tro at de gjennomsnittlige kostnad-effektbrøkene for de ulike lokale budsjettene er både lavere og høyere enn for helsetjenesten generelt.
Selv om det er vanskelig å komme opp med presise estimater knyttet til hver enkelt lokale ressursramme, kan det likevel være nyttig for beslutningstakerne å tenke på den måten som har blitt beskrevet.
9.4.7 Betalingsvillighet
I diskusjoner om grenseverdier har mange koblet slike verdier til maksimal betalingsvillighet (Eichler et al. 2004; Ryen og Svensson 2014). Utvalget mener at betalingsvillighet ikke er relevant for grenseverdier som er knyttet til ressursbruk innenfor et gitt helsebudsjett. Utvalget mener i stedet at det er alternativkostnaden som primært er relevant og finner støtte for dette i nyere litteratur (Pekarsky 2012; Claxton et al. 2013; Eckermann og Pekarsky 2014). Det er dessuten betydelige problemer knyttet til måling av betalingsvillighet. Anslagene for maksimal betalingsvillighet for et godt leveår varierer for eksempel fra ca. 80 000 til 880 000 kroner (Bobinac et al. 2010; Bobinac et al. 2014). Utvalget mener imidlertid at maksimal betalingsvillighet kan være nyttig i samfunnsøkonomiske kostnad-nytteanalyser for prioritering på tvers av sektorer.
9.4.8 Markedsforhold
Et tiltaks kostnad-effektbrøk avhenger av markedsprisen på innsatsfaktorer som lønn, utstyr og legemidler. For noen av disse innsatsfaktorene vil en eksplisitt grenseverdi selv kunne forventes å påvirke prisen. Det vil særlig kunne være tilfelle når tiltaket omfatter patentert teknologi, inkludert legemidler, som har liten konkurranse fra alternative tiltak.
Det har blitt diskutert hvordan prisen på legemidler kan endre seg dersom helsetjenesten tar i bruk en eksplisitt grenseverdi for kostnad-effektbrøken og denne brøken blir tillagt vekt ved beslutninger om offentlig finansiering (Claxton 2007; Webb og Walker 2007; Pekarsky 2012). Prisen er en funksjon av flere forhold enn rene produksjons- og utviklingskostnader. Det har blitt foreslått at legemidler som ellers ville hatt en kostnad-effektbrøk over grenseverdien vil komme til å bli prissatt lavere, slik at brøken kommer under grenseverdien. Samtidig har det blitt sagt at legemidler som ellers ville hatt en kostnad-effektbrøk godt under grenseverdien, kan komme til å bli prissatt slik at brøken kommer nærmere eller blir lik grenseverdien. De totale konsekvensene for helsetjenesten og folkehelsen på lang og mellomlang sikt er også blitt diskutert uten at noen entydig konklusjon er trukket.
Dynamiske og strategiske forhold knyttet til grenseverdier har hovedsakelig blitt diskutert i sammenheng med såkalt «value-based pricing» av legemidler og i liten grad i forbindelse med andre ordninger for prisfastsettelse. I Norge fastsettes maksimal innkjøpspris til apotek med utgangspunkt i internasjonale prissammenlikninger (Statens legemiddelverk 2014). Dette kan påvirke konsekvensene av å ta i bruk eksplisitt grenseverdier for hva som vurderes som et rimelig forhold mellom kostnad og effekt (differensiert etter helsetap). Når man vurderer de dynamiske effektene av bruk av eksplisitte grenser, må man også være oppmerksom på at mange av disse effektene hovedsakelig gjelder patentert teknologi, inkludert legemidler, som har liten konkurranse fra alternative tiltak. Det har dessuten blitt foreslått at disse effektene i stor grad er tilstede også ved implisitte grenseverdier (Vernon et al. 2009; Pekarsky 2012).
Mer generelt vil konsekvensene av å ta i bruk eksplisitte grenseverdier avhenge av hvor tett koblingen er mellom vurdering av kostnad-effektbrøken og den faktiske avgjørelsen om offentlige finansiering. På denne bakgrunn vil det være grunn til å gi rom for forhandlinger mellom myndighetene og de som selger legemiddelet. Fordelene med et slik forhandlingsrom gir en ytterligere grunn for at grenseverdiene ikke bør gis en rolle som betyr at tiltak med kostnad-effektbrøk under grenseverdien automatisk skal bli offentlig finansiert.
Bruk av eksplisitte grenseverdier i vurderingen av tiltak kan uansett sende et signal til legemiddelindustrien og andre utviklere om hva den norske helsetjenesten ønsker å finansiere, selv om Norge utgjør en liten del av det globale markedet (Vernon et al. 2009).
9.5 Oppsummerende vurderinger og anbefalinger
Utvalget mener helsegevinstkriteriet, ressurskriteriet og helsetapskriteriet er relevante for hele helsetjenesten. Disse hovedkriteriene kan anvendes på alle nivåer i helsetjenesten og i et bredt spekter av ulike situasjoner. Nøyaktig hvordan kriteriene best kan bli brukt, vil variere noe.
I mange situasjoner kan kriteriene brukes direkte, dvs. uten grenseverdier. Det gjelder i situasjoner der beslutningstaker har tilstrekkelig informasjon om alle eller de mest relevante tiltakene som konkurrerer om de samme ressursene. En forutgående avgrensning av aktuelle tiltak vil kunne gjøre at dette er tilfelle.
I andre situasjoner er det nyttig å bruke hovedkriteriene sammen med grenseverdier. Det gjelder særlig når beslutningstaker vurderer om et bestemt tiltak skal implementeres eller ikke, og det samtidig er utilstrekkelig informasjon om de spesifikke tiltakene som konkurrerer om de samme ressursene. Spesielt nyttig vil det være med grenseverdier for hva som er et rimelig forhold mellom kostnad og effekt. Utvalget foreslår at slike grenseverdier bør være basert på det beste anslaget for alternativkostnaden til det tiltaket som blir vurdert. Utvalget framhever at en slik tankegang er generelt relevant for beslutningstakere, også i de tilfeller der et presist estimat for alternativkostnaden ikke er tilgjengelig.
Det beste anslaget for alternativkostnaden til et tiltak vil avhenge av flere aspekter ved valgsituasjonen. I det som er kalt standardsituasjonen, vil den grenseverdien som mest direkte reflekterer alternativkostnaden være lik gjennomsnittlig kostnad per gode leveår vunnet (justert for helsetap) i helsetjenesten ved marginale endringer i helsebudsjettet.
Ut fra en slik tilnærming foreslår utvalget at det bør benyttes et sett med differensierte grenseverdier, en trappetrinnsmodell, der grenseverdiene varierer med helsetapet tilknyttet det aktuelle tiltaket. En slik modell, med tentative grenseverdier, er illustrert ved bruk av data fra helsetjenesten i England.
Det er viktig å utvikle grenseverdier basert på data for den norske helsetjenesten. Utvalget anbefaler at det snarest settes i gang et arbeid med å finne et godt estimat for hva som er gjennomsnittlig kostnad per gode leveår vunnet i den norske helsetjenesten ved marginale endringer i helsebudsjettet. Gjennomsnittlig helsetap knyttet til disse endringene bør samtidig beregnes. Utarbeidelsen av slike estimater bør samsvare med hvordan de tre overordnede kriteriene er blitt foreslått konkretisert.
10 Måling av helsegevinst, ressurser og helsetap
Måling av helsegevinst, ressurser og helsetap er sentralt for bruken av de overordnede kriteriene. Metoder for måling av helsegevinster og ressursbruk er beskrevet i en stadig voksende faglitteratur. I dette kapitlet gis en kort innføring i denne litteraturen, med vekt på noen fordelingsmessige sider ved metodene. Metoder for måling av helsetap er det mer begrenset litteratur om. Utvalget vil likevel vise hvordan helsetap kan beregnes, slik at man på en åpen måte kan foreta avveininger mellom de tre kriteriene.
Kostnad-effektanalyser (KEA) er et område der presis måling av helsegevinst og ressursbruk er spesielt viktig. Mye av litteraturen om metoder for måling er dessuten knyttet til slike analyser. I dette kapittelet vil derfor den rollen kostnad-effektanalyser spiller, bli belyst. Videre vil utvalget se på hvordan analyseresultater bør rapporteres til beslutningstakerne.
10.1 Måling av helsegevinster og øvrige gevinster
Et tiltak i helsetjenesten kan gi ulike typer effekter, både positive og negative. Den avgjørende effekten er helsegevinster. Vi kan skille mellom tre typer gevinster og tre parter som vil kunne få disse gevinstene. Dette er illustrert i tabell 10.1. Mest sentralt er helsegevinsten for pasienten (rute 1). Denne direkte helsegevinsten er normalt selve driveren for andres eventuelle helsegevinster og for de øvrige gevinster som tiltaket eventuelt gir (rutene 2 til 9).
Tabell 10.1 Mulige gevinster fra tiltak og partene som kan få dem
Effekt ® Parter ¯ | Helsegevinst: fysisk & mental | Inntekt/arbeid | Øvrig gevinst |
|---|---|---|---|
Pasient | 1 | 4 | 7 |
Pårørende | 2 | 5 | 8 |
Samfunnet for øvrig | 3 | 6 | 9 |
10.1.1 Effekt i form av helsegevinster
Forventet helsegevinst fra et tiltak kan beregnes ved hjelp av informasjon fra medisinske forsøk eller helseregistre. Det vil alltid være noe usikkerhet om forventet effekt, og noen ganger er dokumentasjonen svak. Dokumentasjonsgrunnlaget vil kunne endres over tid når nye pasientgrupper blir aktuelle, og når ny teknologi og mer informasjon blir tilgjengelig. Solid faglig kompetanse er nødvendig for å gjøre jevnlige, systematiske og kritiske analyser av dokumentasjonsgrunnlaget. I Norge har Nasjonalt kunnskapssenter for helsetjenesten en sentral rolle i dette arbeidet.
Utvalget vil understreke betydningen av grundige og oppdaterte kunnskapsoppsummeringer. Ved å oppsummere resultater fra relevant forskning framskaffes helt avgjørende beslutningsgrunnlag: 1) Hvor gode og hvor omfattende er studiene som ligger til grunn, med andre ord dokumentasjonen? 2) Hva er dokumentert, med andre ord hvilket utfallsmål er brukt? og 3) Hvor stor er økningen i livslengde og/eller forbedringen i livskvalitet og dermed den forventede helsegevinsten?
De aller fleste utfallsmål som anvendes i kliniske studier, er sykdomsspesifikke. Hensikten er som regel å finne ut om en ny behandling for en bestemt pasientgruppe med en spesifikk diagnose er bedre enn eksisterende behandling: Hva gir størst blodtrykksreduksjon for hjertepasienter? Hva gir størst reduksjon på en depresjonsskår for deprimerte pasienter?
Mens sykdomsspesifikke utfallsmål er relevant for å sammenlikne ulike tiltak for samme sykdom, kan de ikke brukes direkte til å sammenlikne effekten av ulike tiltak for ulike pasientgrupper. Spørsmålet blir: Er det større helseforbedringer i å gi hjertepasienter blodtrykksmedisin enn å gi de deprimerte antidepressiva? For å prioritere ut fra helsegevinstkriteriet trenger vi derfor sammenliknbare utfallsmål.
Sammenliknbare utfallsmål
En vesentlig del av ressursbruken i norsk helsetjeneste har ikke til hensikt å øke folks livslengde, men å forbedre deres helserelaterte livskvalitet. Selv om god helse er assosiert med økt livslengde, dreier oppmerksomheten seg her primært om å skape vesentlige, og varige, helsetilstandsforbedringer.
Det er flere metodiske utfordringer forbundet med måling av helserelatert livskvalitet (HRQoL; health-related quality of life). For det første må man velge et deskriptivt system som på en meningsfull måte beskriver relevante helsedimensjoner. Disse inkluderer fysiske og mentale dimensjoner, og gjerne også sosial funksjon. Deskriptive systemer som er ment å kunne sammenlikne helsetilstander på tvers av diagnoser, omtales som generiske systemer til forskjell fra de sykdomsspesifikke systemene.
De mest utbredte, preferansebaserte, generiske systemene er EQ-5D og SF-6D (en kortversjon av SF36) (Brazier et al. 2007). Det finske systemet 15D har også vært anvendt i Norge. I Storbritannia har sykehusene systematisk iverksatt kvalitetssikring gjennom såkalte «patient reported outcome measures» (PROM), der man bruker EQ-5D. I Sverige planlegges en liknende tilnærming til kvalitetssikring i sykehus. I Norge er EQ-5D og ulike versjoner av SF36 brukt i en rekke nasjonale kvalitetsregistre og kliniske studier.
Verdsetting av helsetilstander bør være basert på pasienters erfaringer eller på velinformerte preferanser i representative befolkningsutvalg. Utfordringen ligger i å verdsette ulike helsetilstander på en sammenliknbar skala, fra 0 (verst tenkelige helse) til 1 (best tenkelige helse). Selv om det ikke er store forskjeller mellom land med relativt lik kultur, er det grunn til å bemerke at Sverige, Danmark og Finland alle har utviklet verdsettingstariffer for helserelatert livskvalitet, men det er ennå ikke gjort i Norge. Utvalget etterlyser verdsettingstariffer basert på nordmenns preferanser. De aller fleste kostnad-effektstudier som blir presentert for norske beslutningstakere, bygger på EQ-5D og SF-6D. Det vil derfor være mest hensiktsmessig å utvikle norske verdsettingstariffer for disse instrumentene.
Begrepet livskvalitet gir assosiasjoner til et bredt sett av dimensjoner som ikke bare dreier seg om helse. I de sammenhenger hvor man søker å måle forbedringer i folks helsetilstand, har man derfor valgt å avgrense begrepet til helserelatert livskvalitet. Metodene som anvendes, varierer mye i hvor bredt de favner. Ett instrument (EQ-5D) legger størst vekt på fysisk funksjon og bare én dimensjon for mental helse. Et annet gir en bredere beskrivelse av ulike fysiske, mentale og sosiale dimensjoner (SF36), mens et tredje (AQoL) inneholder omfattende beskrivelser av mental helse og mer generell velvære (Richardson et al. 2014).
Boks 10.1 Nyttebegrepet i livets sluttfase
Det er ikke bare størrelsen på den økte livslengde som har prioriteringsrelevans, men også hvilken situasjon pasienten er i. I mandatet ble utvalget bedt om å vurdere «nyttebegrepet ifm livsforlengende behandling i livets sluttfase». Behandling i livets sluttfase vil blant annet dreie seg om terminale stadier i et langt sykdomsforløp, eller om meget gamle pasienter der livet naturlig ebber ut som følge av gradvis sviktende funksjon i sentrale organer. Spørsmålet blir hvilke etiske hensyn som skulle ha særlig prioriteringsrelevans for livets sluttfase. I England har man brukt et «end-of-life» kriterium (se kapittel 6) som gir høyere prioritet til pasientgrupper med kortere gjenværende levetid enn 24 måneder, dersom aktuell behandling kan gi minst tre måneder økt forventet livslengde. Utvalget har vurdert dette, men foreslår ikke et slikt kriterium.
I livets sluttfase er det som regel ikke tale om å vurdere alternative kurative tiltak, men i stedet om å sikre god omsorg og et godt palliativt tilbud. Dette innebærer å anerkjenne pasientens sårbarhet og å ivareta den enkeltes integritet og verdighet. Her er det helt avgjørende å ta seg god tid og å vektlegge god kommunikasjon (Skår et al. 2014).
Det er ikke nok å beregne endringer i helsetilstand. En langvarig forbedring i helsetilstand er opplagt bedre enn en kortvarig, men det er mindre opplagt om en langvarig liten helsetilstandsforbedring er bedre enn en kortvarig stor helsetilstandsforbedring. Vi trenger derfor en måleenhet som både fanger opp forbedring i helsetilstand og tar hensyn til den varigheten den har. Den klart vanligste metoden for å ta hensyn til ulike grader av livskvalitetsforbedringer med tilhørende ulik varighet i en sammenliknbar måleenhet er såkalte kvalitetsjusterte leveår (Quality Adjusted Life Years, QALYs). Her tilsvarer ett ekstra vunnet leveår i best tenkelige helse én QALY, det samme som en forbedring i helserelatert livskvalitet fra 0,5 til 1,0 med en varighet på to år.
Det er viktig å skille mellom bruk av QALYs i prioritering mellom pasientgrupper og i prioritering mellom enkeltpasienter. QALYs kan være til hjelp for å avgjøre om gjennomsnittlig helsegevinst fra en et tiltak for en bestemt pasientgruppe er større enn gjennomsnittlig helsegevinst fra et annet tiltak for en annen pasientgruppe. QALYs er ikke tenkt brukt direkte på klinisk nivå. Se utfyllende drøfting i kapittel 9.
I mandatet er utvalget bedt om å «gi en vurdering av bruk av QALYs som metode for å vurdere nytte på en systematisk og konsistent måte, samt behovet for å gi valide anslag for verdsetting av helsetilstander og helseforbedringer». Utvalget mener QALY-metoden er meget relevant, fordi den måler helsegevinster i en sammenliknbar enhet, enten gevinsten skyldes økt levetid eller forbedret livskvalitet. Utvalget mener at måling av helserelatert livskvalitet bør være basert på velinformerte preferanser. Derfor ser utvalget behov for forskning som kan gi mer valide anslag på disse tallene.
For prioriteringsbeslutninger mener utvalget det er viktig å rapportere beregningen av QALY-gevinstene på en oversiktlig og etterprøvbar måte. Selv om QALYs som metode ikke er ferdig utviklet, og neppe noensinne vil gi tall som alle kan bli enige om, mener utvalget at metodens kjerne er viktig å bygge videre på. For prioriteringsformål trenger vi sammenliknbare utfallsmål, både for å dokumentere effekten av nye tiltak, men også for å måle effekt av eksisterende tiltak. For å kunne ta hensyn til de ulike effekters varierende omfang må disse kunne uttrykkes i sammenliknbare enheter.
Boks 10.2 Ulikhet i nyttevurderinger mellom pasienter og tilbydere
I mandatet ble utvalget bedt om å vurdere «hvorvidt behandlere og tjenesten vurderer nyttebegrepet og viktige utfallsmål for behandling forskjellig fra pasienter». Generelt vil behandlere ha en tendens til å vektlegge observerbare symptomer og pasienters funksjonsnivå. Pasienter kan ofte vektlegge andre aspekter ved sin tilstand. For eksempel viser studier at pasienter vurderer angst og depresjon som viktigere vis-à-vis fysisk funksjon enn de som ikke har erfart slike tilstander. Mens mange pasienter i stor grad kan tilpasse seg («adaptation») svikt i fysisk funksjon, er det ofte vanskeligere når det gjelder mentale helsedimensjoner. Det er følgelig økende interesse for å basere verdsettingen av kvalitativt ulike helsetilstander på preferansene til de som har erfart de aktuelle tilstandene, for eksempel gjennom såkalte «pasientrapporterte utfallsmål» (PROM).
I livets sluttfase vil det kunne være store forskjeller mellom behandlere og pasientenes nyttevurderinger. Mens behandlere kan vektlegge økt livslengde, kan pasienten selv vektlegge livskvalitet. Pasienten kan foretrekke lindring og omsorg, heller enn å bli utsatt for omfattende inngrep som ikke kan forventes å gi vesentlige økning i livslengde, og kanskje også kan medføre ytterligere forverring i livskvalitet. Slik utvalget ser det, dreier det seg om verdighet og kommunikasjon og om å respektere pasientens egne avveininger mellom hensynet til livslengde og livskvalitet.
På den andre siden vil noen pasienter eller pårørende ønske behandling som ansvarlig helsepersonell mener ikke er til pasientens beste, enten fordi behandlingen etter all sannsynlighet ikke vil gi noen helsegevinst, eller fordi den vil ha uakseptabelt store bivirkninger. Helsepersonellet kan også synes det ikke er et rimelig forhold mellom ressursbruk og effekt. Slik uenighet ender fra tid til annen opp i mediene. Dette vil være belastende for dem som «nekter» pasienten behandling. Kliniske etikk-komiteer kan i slike tilfeller være et nyttig forum for å drøfte slik uenighet (se kapittel 12).
10.1.2 Effekt i form av økt økonomisk produktivitet
Dersom helsetilstandsforbedringene blir tilstrekkelig store, kan tidligere pasienter og pårørende komme tilbake til arbeidslivet. Overgangen fra syk og arbeidsudyktig til frisk og arbeidsdyktig gir økonomiske gevinster både for offentlig og privat sektor. Produksjonsgevinster for samfunnet er verdien av den økte produksjonen som følge av at folk kommer tilbake i jobb. Ved beregning av de samfunnsøkonomiske konsekvensene er det viktig å skille mellom overføringer og realøkonomiske virkninger, for å unngå at man summerer inntekter for en part med utgifter for en annen part. Dette berører et fagøkonomisk spørsmål om korrekt beregning av samfunnets samlede produksjonsgevinster.
Et annet spørsmål er om, og i hvilken grad, disse økonomiske gevinstene har prioriteringsrelevans. Mens helsegevinstkriteriet er klar på at et tiltaks prioritet øker med størrelsen på helsegevinsten, er det mindre opplagt at et tiltaks prioritet også bør øke med størrelsen på produksjonsgevinsten. En slik prioriteringsregel vil nemlig ha fordelingsmessige konsekvenser i favør av pasientgrupper som kan returnere til arbeidslivet. Videre vil høytlønnede framstå som mer «lønnsomme» å behandle enn lavtlønnede.
Spørsmålet om i hvilken grad man skal ta hensyn til slike produksjonsgevinster, dreier seg om en klassisk avveining mellom effektivitet og likhet. En målsetting om «lik tilgang for like behov», uavhengig av folks arbeidsdeltakelse og inntekt, tilsier at produksjonsgevinster ikke skal påvirke prioriteringene. Derimot tilsier hensynet til samfunnets totale verdiskaping at produksjonsgevinster bør tas hensyn til. I denne avveiningen kan det være relevant å se på fordelingen av de ulike delene av den samlede produksjonsgevinsten, med andre ord hvem som vil få glede av den. Spørsmålene blir da: Hvor stor del kommer i form av privat netto inntektsøkning for pasienter og pårørende, og hvor mye kommer resten av samfunnet til gode gjennom skattebidrag og trygdebesparelser til finansiering av fellesgoder inkludert helsetjenester?
Utvalget mener at de deler av produksjonsgevinstene som påvirker fellesskapets ressurser, med andre ord de offentlige budsjetter, i form av økt skatteinngang og sparte trygdeutgifter, kan være mer relevant for prioritering enn produksjonsgevinstene som påvirker privat konsum og overskudd i privat sektor. Selv om slike privatøkonomiske gevinster opplagt gir nytte for de grupper de tilfaller, mener utvalget at en vektlegging av slike gevinster kan føre til at helsetiltak for den arbeidsføre befolkningen blir favorisert i for stor grad. Produksjonsgevinster som påvirker offentlige budsjetter, kan være mer relevante for prioritering fordi slike økonomiske gevinster er til nytte også for andre grupper, gjennom finansiering av flere helsetiltak eller offentlige fellesgoder. Produksjonsgevinster som kommer fra vektlegging av tiltak rettet mot yrkesaktive grupper, kan for eksempel gjøre det lettere å finansiere tiltak rettet mot ikke-yrkesaktive grupper.
Et kompliserende forhold er at ressursknapphet kan dreie seg om noe annet enn mangel på penger, nemlig mangel på spesialisert helsepersonell (se boks 3.2). På kort sikt kan det være slik at det ikke er gjenværende kapasitet til å behandle de pasientgruppene som ikke blir prioritert, selv om de økonomiske gevinstene fra å behandle de som kommer raskere tilbake til yrkeslivet skulle være store nok til å dekke behandlingskostnadene for de gruppene. Dette understreker at det bør vises spesiell varsomhet med å innføre ordninger som innebærer systematisk prioritering mellom pasienter avhengig av deres arbeidsdeltakelse. På denne bakgrunn gjentar utvalget anbefalingen fra kapittel 7 om at beslutningstakere bør ta utgangspunkt i helsegevinstene. Dersom det også er andre gevinster som er betydelige, inkludert produksjonsgevinster, kan slike gevinster tillegges vekt i den grad de ikke gir urettferdige fordelingsvirkninger. I tråd med dette bør kostnad-effektanalyser ledsages av en separat rapportering av øvrige gevinster, inkludert produksjonsgevinster, og av hvem som får disse gevinstene.
10.2 Måling av ressursbruk
I Norge fastsetter demokratisk valgte organer størrelsen på de offentlige helsebudsjetter. Premisset for utvalgets arbeid er at de offentlige helsebudsjetter i hovedsak er gitt, og at ressursene alltid har alternative anvendelser. Ved vurdering av et tiltak bør man derfor avklare hvorvidt helsegevinstene fra det aktuelle tiltaket er større enn de helsegevinster som tapes når andre tiltak fortrenges. Målsetningen om flest mulig gode leveår for alle, rettferdig fordelt, tilsier at det er viktig å vurdere hvor mye ressurser som kreves for å oppnå gode leveår på ulike områder.
I den politiske debatten snakkes det om «friske penger» når tiltakets kostnader finansieres gjennom en tilleggsbevilgning utenom sektorens allerede tildelte budsjett. Utvalget vil minne om at også «friske penger» har alternative anvendelser for andre pasientgrupper. Derfor bør gevinstene fra et aktuelt tiltak også i slike tilfeller vurderes opp mot gevinstene fra andre måter å bruke ressursene på.
10.2.1 Ressursbruk og kostnader
I helsetjenesten kan ressursknapphet oppleves som mangel på kompetent personell eller mangel på penger. Ved knapphet på spesialistkompetanse vil det å utvide behandlingstilbudet for én pasientgruppe nødvendigvis gå ut over andre grupper (se boks 3.2). Igjen blir det viktig å finne ut om helsegevinsten for den ene pasientgruppen er større enn den tapte helsegevinsten for andre grupper.
I stedet for å måle noe ressursbruk for eksempel i timeverk vil det som regel være hensiktsmessig å måle all ressursbruk i samme enhet: i penger. Når vi i det videre snakker om kostnadene knyttet til et tiltak, er det som et mål på hvor mye ressurser tiltaket krever. Fordi om lag 75 pst. av helsesektorens driftskostnader går til lønn, vil kostnadene i vesentlig grad være et uttrykk for hvor mange timeverk som medgår.
I tillegg til kostnader for helsesektoren vil mange forebyggings- og behandlingstiltak også innebære kostnader i andre sektorer. Det kan for eksempel være produksjonstap når folk er borte fra jobb for å få behandling. Ved screening og vaksinasjonstiltak vil det kunne utgjøre store kostnader for samfunnet. I tillegg kan pasienter og pårørende ha reiseutgifter. Hvordan slike kostnader skal beregnes er angitt i Rundskriv R fra Finansdepartementet (2014).
10.2.2 Kostnad-nytteanalyser og kostnad-effektanalyser
Om et nytt tiltak bør prioriteres, avhenger ikke av om det er billig eller dyrt, men av forholdet mellom ressursbruk og helsegevinster. I litteraturen skiller man mellom kostnad-nytteanalyser (KNA) og kostnad-effektanalyser (KEA).31 KNA verdsetter gevinstene i penger, mens KEA verdsetter gevinstene i helsetermer. Hovedprinsippet i en kostnad-nytteanalyse er at et tiltak er verdt det befolkningen til sammen er villig til å betale for det. Dersom betalingsvilligheten er større enn summen av kostnadene, defineres tiltaket som samfunnsøkonomisk lønnsomt. Særlig for helsetiltak er det en rekke metodeproblemer knyttet til anslag for betalingsvilligheten, samt fordelingsmessige problemer knyttet til blant annet at folks betalingsvillighet avhenger av deres betalingsevne (Cookson 2003). Av slike årsaker er kostnad-effektanalyser mest brukt i helseøkonomiske evalueringer.
En kostnad-effektanalyse viser forholdstallet mellom et tiltaks kostnader og dets effekter, for eksempel som kostnader per unngått beinbrudd, eller kostnader per vunnet kvalitetsjustert leveår (QALY). Forholdstallet er et uttrykk for hvor kostnadseffektivt et tiltak er: desto lavere kostnader per QALY, desto mer kostnadseffektivt er tiltaket. Informasjon om dette forholdstallet kan brukes til å styre ressursbruken mot de mest kostnadseffektive helsetiltakene og dermed oppnå en større samlet helsegevinst.
Selv om en kostnad-effektanalyse ender opp med ett tall for brøkens størrelse, ligger det en rekke metodiske og normative valg til grunn for beregningene. Disse valgene vil påvirke kostnad-effektbrøken. Et avgjørende spørsmål er nettopp hvilke kostnader og effekter man velger å ta hensyn til.
Perspektiv og rapportering
Helseøkonomisk litteratur er opptatt av hvor bredt analyseperspektivet bør være. Et helsesektorperspektiv tar kun hensyn til helsesektorens kostnader, mens et samfunnsperspektiv i prinsippet tar hensyn til ressurskonsekvensene i alle samfunnssektorer. I kostnad-effekt-termer er dette et spørsmål om man kun har helsesektorens kostnader i telleren, eller om man også legger til kostnader i andre sektorer (for eksempel produksjonstap) og trekker fra produksjonsgevinster.
Argumenter knyttet til hvilke ressurser som bør vektlegges, ble beskrevet i kapittel 7. På bakgrunn av disse argumentene anbefalte utvalget at beslutningstakere tar utgangspunkt i ressursbruken innenfor helsetjenesten. Dersom de aktuelle tiltakene utløser en betydelig ressursbruk utenfor helsetjenesten, kan det tillegges vekt i den grad det ikke vil gi urettferdige fordelingsvirkninger. I samsvar med denne anbefalingen mener utvalget at ressursbruk utenfor helsetjenesten bør rapporteres som tillegg til kostnad-effektanalyser gjort ut fra et helsesektorperspektiv.
Diskontering
I samfunnsøkonomiske analyser brukes normalt en kalkulasjonsrente (diskonteringssats) for å ta hensyn til at kostnader og effekter oppstår på ulike tidspunkt. Verdien av framtidige hendelser blir derved nedjustert til en nåverdi. I Norge er denne kalkulasjonsrenten fastsatt til 4 pst. Selv om det er en standard forutsetning å diskontere kostnader og effekter på denne måten, er det ikke umiddelbart opplagt at det også bør gjelde for framtidige helsegevinster. For eksempel vil nåverdien av en ett års levetidsgevinst om 20 år diskontert med 4 pst. årlig, bli mer enn halvert. I motsetning til rentemarkedet for penger finnes det ikke noe tilsvarende intertemporalt marked for helse, der man kan redusere sin helse inneværende år for så å få mer helse igjen neste år.
Diskontering har liten betydning ved rangering av kurative tiltak som gir umiddelbare helsegevinster. Diskontering kan derimot ha stor betydning for prioritering mellom kurative tiltak og forebyggende tiltak der helsegevinstene melder seg langt fram i tid. Uten diskontering framstår forebyggingstiltak mer prioriteringsverdige enn med diskontering.
I faglitteraturen er det uenighet både om, og i hvilket omfang, framtidige helsegevinster bør tillegges lavere verdi. I økonomisk litteratur inngår diskontering som en mer eller mindre selvfølgelig del av kostnad-effektformelen. For etikere og i helseprofesjoner flest er imidlertid ideen om å tillegge framtidige helsegevinster lavere verdi langt fra opplagt. Det krever en normativ begrunnelse av en annen karakter enn at det inngår i formelen.
Det hersker fortsatt uenighet om helsesektoren bør anvende en lavere diskonteringsrate enn andre sektorer, og om helsegevinster bør kunne diskonteres etter en lavere rate enn kostnader. Like fullt har dette vært praksis i noen lands retningslinjer. Et sentralt spørsmål er om, og i hvilken grad, befolkningen verdsetter egne framtidige helsegevinster lavere, og om de er tilstrekkelig upartiske i sin verdsetting av framtidige generasjoners helse. Utvalget anbefaler at man ved prioriteringer måler helsegevinster i udiskonterte enheter. Det vil også gjøre det lettere å sammenlikne med helsetapenes størrelser som uttrykkes i udiskonterte enheter.
Kostnader og effekters gjennomsnittlige størrelse
Kostnad-effektberegninger er knyttet til en brøk som ikke tar hensyn til de absolutte størrelsene på teller (kostnader) og nevner (helsegevinster). Dersom effekten er svært liten, men tiltaket fortsatt er kostnadseffektivt, skyldes det at kostnadene er tilsvarende svært lave. Utvalget mener at størrelsene på kostnader og forventede effekter for den enkelte bruker/pasient kan ha prioriteringsrelevans, og derfor bør rapporteres separat. Ved svært lave kostnader foreligger nemlig ikke noe forsikringsmotiv for eget eventuelt framtidig bruk av tjenesten, og folk vil da kunne foretrekke å finansiere tjenesten gjennom egenbetaling. Ved svært lav effekt vil folk som regel ha et begrenset omfordelingsmotiv for å bidra til finansiering av medborgernes bruk av tjenester.
10.2.3 Kostnad-nytteanalyser og betalingsvillighet
I kostnad-nytteanalyser verdsettes helsegevinster i penger, for eksempel uttrykt ved hvor mye samfunnet er villig til å betale for et vunnet kvalitetsjustert leveår (QALY). En slik verdsetting kan gjøres enten med utgangspunkt i en eksisterende fastsatt verdsetting av et statistisk liv (VSL) fra andre sektorer, eller basert på studier av befolkningens betalingsvillighet for en vunnet QALY.
Hagen-utvalget som vurderte samfunnsøkonomiske analyser (NOU2012:16), anbefalte et mål for VSL som var sektorovergripende, men uttrykte samtidig forbehold om å skulle gå veien fra et estimat for samfunnets verdsetting av et spart liv til å fastsette en økonomisk verdi på en del av et liv, målt ved helseenheter. Slike omregninger fra økonomisk verdsetting av et statistisk liv til økonomisk verdsetting av et godt leveår, er beheftet med metodiske problemer og normative utfordringer.
Den alternative metoden er å spørre folk direkte om deres betalingsvillighet for tiltak som forventes å gi et vunnet kvalitetsjustert leveår. En rekke slike studier har vært utført, samtidig med at en omfattende litteratur har pekt på alvorlige metodeproblemer. Det viser seg nemlig at «som du spør, får du svar». Den uttrykte betalingsvilligheten avhenger av måten spørsmålene er formulert på. Et annet problem er at betalingsvilligheten ikke er sensitiv til helsegevinstens størrelse (Olsen et al. 2004; Bobinac et al. 2010; Donaldson et al. 2010; Bobinac et al. 2014; Gyrd-Hansen et al. 2014). Så lenge det ikke finnes én faglig korrekt måte å formulere spørsmålet på, vil derfor ikke én beregnet verdi være riktigere enn en annen.
Videre må det påpekes at det ikke nødvendigvis er demokratisk vilje til, ved offentlig innsats og bevilgninger, å sørge for at summen av individers betalingsvillighet blir realisert.
Utvalget vil i tillegg peke på at et anslag for betalingsvillighet, uavhengig av hvilket nivå som anvendes, kan få fram en mulig rangering av ulike tiltak uten at det bør brukes som en grenseverdi for beslutninger. I en slik sammenheng kan det være viktig at det brukes de samme anslagene for verdsetting av for eksempel helseeffekter på tvers av ulike sektorer. Ulik verdsetting på tvers av sektorer kan føre til dårlig ressursallokering. Utvalget vil imidlertid vektlegge at prioriteringer mellom ulike sektorer, heller enn å være basert på generell betalingsvillighet, bør være basert på mer detaljerte analyser av alternativkostnader innenfor de ulike sektorers budsjettrammer. Tiltak knyttet til helse bør prioriteres innenfor de sektorer der alternativkostnadene er lavest.
Avveining av ressursbruk mellom ulike sektorer vil imidlertid ikke bare avhenge av effekter på helse, men også av andre og bredere samfunnsmål, noe som ligger utenfor utvalgets mandat.
Ser man hen til de problemene som er nevnt ovenfor, mener utvalget at det ikke er grunnlag for å la anslag fra betalingsvillighetstudier ha føringer for nivået på grenseverdier. Det er på denne bakgrunn desto viktigere at det arbeides med å utarbeide mer nøyaktige estimater for de marginale alternativkostnader for tiltak innenfor den norske helsetjenesten.
10.3 Måling av helsetap
Pålitelig informasjon om helsetap er ikke alltid umiddelbart tilgjengelig for beslutningstakere i helsesektoren. Men det finnes flere relevante informasjonskilder for beregning av forventet helsetap. For eksempel kan sammenliknende kliniske studier ofte gi en indikasjon på helsetapet gitt eksisterende tilbud (Lindemark et al. 2014). Det er også utviklet ulike databaser som kan gi informasjon om helsetapet, blant dem det globale sykdomsbyrdeprosjektet (Murray et al. 2012a).
En illustrasjon av helsetapet, knyttet til et utvalg tilstander, er vist i figur 10.1. Helsetapet er her beregnet med utgangspunkt i data fra National Institute for Health and Care Excellence (NICE) i Storbritannia (NICE 2014b). Konkret gjelder det data for målgruppens gjennomsnittlige alder og gjennomsnittlige gjenværende kvalitetsjusterte leveår (QALYs) uten det aktuelle tiltaket (på det tidspunkt tiltaket er aktuelt). Alder ble omregnet til tidligere gode leveår ved hjelp av data for Norge fra det globale sykdomsbyrdeprosjektet. Helsetapet ble så beregnet ved å finne differansen mellom 80 og totalen av gode leveår i fortid og fremtid. Det er viktig å være oppmerksom på at helsetapet i tabellen viser summen av helsetapet som de med tilstanden har som del av gjennomsnittsbefolkningen og det ekstra helsetapet de har på grunn av akkurat den tilstanden.
Figur 10.1 Utvalg tilstander og gjennomsnittlig helsetap
Kilde: NICE 2014b
Tabellen viser hvordan det kan være betydelig forskjeller i gjennomsnittlig helsetap mellom tilstander. Attakvis multippel sklerose (MS) har for eksempel et helsetap på 43 gode leveår, mens venøse tromboembolier (blodpropp) har et helsetap på ti gode leveår. Mange tilstander som antas å ha stort forventet helsetap er ikke vist i tabellen, inkludert tilstander knyttet til rus og psykiatri. Et eksempel er schizofreni.
Inntil god informasjon om helsetap er bedre tilgjengelig, må beslutningstakerne i større grad gjøre kvalifiserte antagelser. Særlig helsepersonell er vant med å gjøre anslag for prognose og alvorlighet, og disse har mange fellestrekk med anslag for helsetap.
10.4 Krav til god dokumentasjon
Gode prioriteringsbeslutninger forutsetter, uansett om det er en beslutning som gjelder en gruppe eller en enkelt pasient, at det foreligger relevant informasjon på beslutningstidspunktet. Med relevant mener utvalget i denne sammenhengen at den er egnet til å belyse de overordnede prioriteringskriteriene, knyttet til helsegevinst, ressursbruk og helsetap. I tillegg til at informasjonen er relevant, bør informasjonen være av høy kvalitet.
Innledningsvis skal det bemerkes at det er ulike kilder til kunnskap: forskning, kvalitetsregistre og andre databaser over pasientinformasjon, og erfaring.
God dokumentasjon av helsegevinst, ressursbruk og helsetap ved forebygging, utredning, diagnostikk, behandling eller rehabilitering er etter utvalgets mening en forutsetning for god prioritering. Alle tjenester som prioriteres skal som hovedregel være basert på god vitenskapelig dokumentasjon. Helsetjenester hvor det for eksempel kan stilles spørsmål ved virkningen, eller som er dokumentert uvirksomme, skal enten ha lav prioritet eller tas helt ut av det offentlige tilbud. Der det finnes lovende tiltak hvor dokumentasjonsgrunnlaget er svakt på grunn av lav antall studier, bør eventuell innføring skje i regi av et forskningsprosjekt slik at kunnskapsgrunnlaget styrkes.
Metoder for framskaffelse av slik dokumentasjon kan deles inn i randomiserte kontrollerte forsøk og observasjonsstudier. Helseregistre kan være en relevant annen kilde for dokumentasjon. Helseregistre kan være eksisterende nasjonale registre av typen fødselsregister, kreftregister og dødsårsaksregister, eller det kan være lokale, regionale eller nasjonale diagnoseregistre som er etablert på ad hoc-basis ved faglig kollegialt samarbeid (jf. kapittel 4). Det er fortsatt et stort behov for resultatfokusert, pasientnær forskning innenfor alle områder av medisinen. Det blir enklere fremover når informasjon dokumentert i pasientjournaler lettere kan gjenbrukes til kvalitetsformål og prioritering i helsesektoren.
I Norge er det særlig Nasjonalt kunnskapssenter for helsetjenesten og akademiske miljøer som utfører og publiserer kunnskapsoppsummeringer, metaanalyser og medisinske metodevurderinger (HTA-rapporter).
10.4.1 Dokumentasjon av helsegevinst
En måte å oppsummere forskningslitteratur på er å utarbeide det som på norsk kalles en systematisk oversikt (på engelsk «systematic review»).32 Det vil si en rapport utarbeidet på bakgrunn av vitenskapelig utviklede kriterier. Disse kriteriene skal redusere risiko for feil i prosessen, som for eksempel skjevt utvalg av studier, inklusjon av studier som ikke har god nok vitenskapelig kvalitet og så videre (Kunnskapssenteret 2011). En systematisk oversikt skal undersøke effekten av et tiltak, for eksempel en ny diagnostisk metode, en ny behandlingsform eller et nytt medikament. Figur 10.2 illustrerer stegene i utarbeidelsen av en slik oversikt.
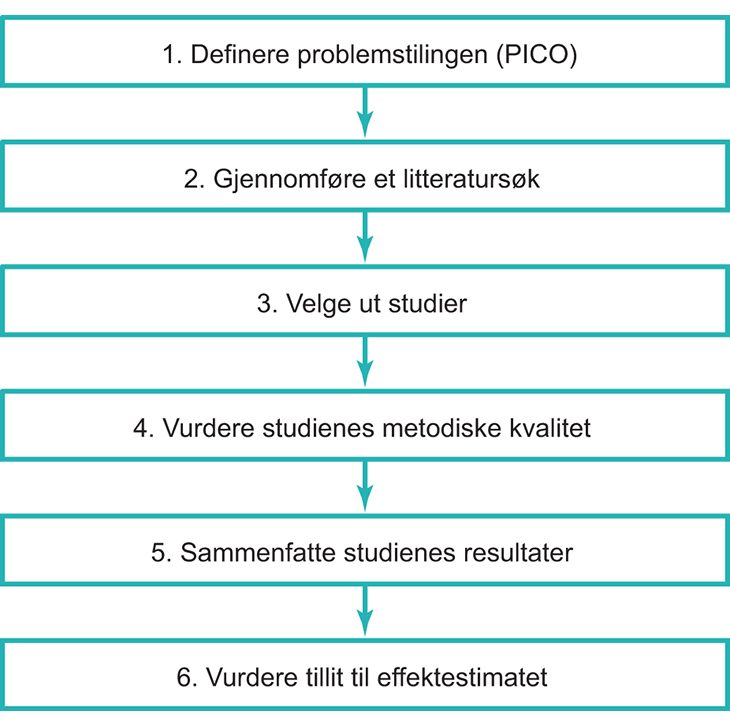
Figur 10.2 Prosess for en systematisk oversikt
En systematisk oversikt svarer på to spørsmål. Det første er om metoden er virksom og sikker. Det andre er hvem som eventuelt kan ha nytte av metoden. En systematisk oversikt er derfor egnet til å understøtte beslutninger hvor svar på disse to spørsmålene er tilstrekkelig. Dette er normalt sett ikke nok når det skal treffes en prioriteringsbeslutning. For å kunne prioritere trengs også informasjon om helsegevinstens størrelse, hvilken ressursbruk tiltaket krever, samt informasjon om helsetap. I en prioriteringskontekst vil informasjon fra en systematisk oversikt kunne benyttes for å vurdere hvor stor helsegevinsten ved et bestemt tiltak vil være.
I noen kunnskapsoppsummeringer og metaanalyser finnes det informasjon om «effektstørrelser». I denne sammenheng betyr ofte effektstørrelse kun relativ eller absolutt risikoreduksjon (for død eller andre utfallsmål) eller antall som må behandles for å oppnå ett positivt utfall («numbers needed to treat»). Informasjon om risikoreduksjon er imidlertid ikke tilstrekkelig til å si noe om helsegevinstens størrelse, dvs. varighet og livskvalitetsforbedring. Det krever ytterligere analyser som oversetter slike «effektmål» til sammenliknbare mål på helsegevinst. For prioritering er det ønskelig at «effektstørrelser» oversettes til den generiske måleenheten «gode leveår». Disse analysemetodene er diskutert ovenfor.
10.4.2 Dokumentasjon av ressursbruk
Informasjonen om effekten av et tiltak som fremkommer i en systematisk oversikt, kan i neste omgang inngå som en viktig del av en medisinsk metodevurdering. Det som skiller en systematisk oversikt fra en medisinsk metodevurdering, er at sistnevnte også inneholder en analyse av konsekvensene ved å innføre et tiltak eller å endre praksis. Dette kan være analyser av økonomiske, organisatoriske, etiske og juridiske konsekvenser for pasient og samfunn. En metodevurdering kan dermed inngå som en del av beslutningsgrunnlaget for prioritering, men også den må suppleres med ytterligere informasjon om helsetap. Analyser av ressursbruk, dvs. kostnadsdelen i kostnad-effekt analyser, inngår ofte i medisinske metodevurderinger.
10.4.3 Dokumentasjon av helsetap
Dokumentasjon av helsetap er et relativt nytt fagområde og bygger blant annet på populasjonsbaserte epidemiologiske studier (sykdomsbyrdeanalyser). I tillegg kan informasjonen også modelleres i helseøkonomiske studier eller hentes ut fra prognosedata i komparatorarmen i randomiserte kliniske studier. Det er fortsatt ikke utviklet sjekklister for vurdering av dokumentasjonens kvalitet for helsetap, men det foreligger etter hvert studier av enkelte større sykdomsgrupper som kan konsulteres (Jia et al. 2013).
10.4.4 Dokumentasjonskrav for anbefalinger i faglige retningslinjer
Dokumentasjonskrav er også direkte relevant og mye brukt i faglige retningslinjer (boks 10.3). Denne typen gradering er nyttig og gjør det klart at faglige anbefalinger kan ha ulik styrke. Utvalget vil samtidig understreke at det ikke bare er dokumentasjonens kvalitet og gradering som bør avgjøre et tiltaks prioritet. De tre hovedkriteriene bør også inngå i totalvurderingen av om en behandling eller et medikament skal være en del av en faglig retningslinje. Dette er grundigere omtalt i kapittel 12.
Boks 10.3 Eksempel på dokumentasjonskrav og gradering av anbefalinger i faglige retningslinjer
Det finnes mange ulike systemer for gradering av dokumentasjonens kvalitet og gradering av faglige anbefalinger. Et eksempel er et enkelt system utarbeidet av det Europeiske selskapet for kardiologi.
Definisjon | |
|---|---|
Klasse I | God evidens og/eller generell enighet at en gitt behandling eller prosedyre er fordelaktig, nyttig, effektiv |
Klasse II | Motstridende evidens og/eller divergerende meninger om nytten/effekten av behandlingen eller prosedyren |
Klasse IIa | Vurderingen av evidensen er i favør av nytte/effekt |
Klasse IIb | Vurderingen av evidensen er ikke i favør av nytte/effekt |
Klasse III | Evidens eller generell enighet om at behandlingen eller prosedyren ikke er nyttig/effektiv, og i noen tilfeller kan være skadelig |
10.5 Dokumentasjonskrav og de tre prioriteringskriteriene
Medisinsk vitenskap kan ofte, men ikke alltid gi informasjon om en tjeneste virker eller ikke. Hvis kunnskapsgrunnlaget er av høy kvalitet og gir stor tillit til at effektestimatet ligger nær den sanne effekten, kan beslutningstakerne uten videre anvende de tre kriteriene for å vurdere prioritet. Kunnskapssenterets skala for å vurdere kvaliteten på den samlede dokumentasjonen er vist i boks 10.4. I andre tilfeller er kunnskapsgrunnlaget av lav eller middels kvalitet. Hvis kunnskapsgrunnlaget har lav kvalitet, bør det vurderes om tilliten til effektestimatet er så liten at den aktuelle tjenesten ikke skal ha prioritet. Dersom dokumentasjonen er av middels kvalitet, bør beslutningstakerne avveie usikkerheten om hvorvidt tjenesten virker eller ikke mot de tre prioriteringskriteriene. Denne situasjonen er svært vanlig.
Boks 10.4 Kunnskapssenterets skala for å vurdere kvaliteten på den samlede dokumentasjonen
Høy kvalitet: Stor tillit til at effektestimatet ligger nær den sanne effekten.
Middels kvalitet: Middels tillit til effektestimatet: det ligger sannsynligvis nær den sanne effekten, men det er også en mulighet for at den kan være forskjellig.
Lav kvalitet: Begrenset tillit til effektestimatet: den sanne effekten kan være vesentlig ulik effektestimatet.
Svært lav kvalitet: Liten tillit til at effektestimatet ligger nær den sanne effekten.
I de tilfeller hvor det er sannsynlig at effektestimatet ligger nær den sanne effekten, men det også er en mulighet for at den kan være forskjellig, må beslutningstakerne veie usikkerheten opp mot størrelsen på tjenestens helsegevinst, ressursbruken og helstapet uten den aktuelle tjenesten. For eksempel: hvis et tiltak for pasienter med en psykiatrisk lidelse har brukbar helsegevinst, ressursbruken er stor og helsetapet også er stort, så vil ikke nødvendigvis middels kvalitet på dokumentasjonen gjøre det helt uaktuelt for prioritet. På den annen side kan en tjeneste hvor dokumentasjonens kvalitet er middels, helsegevinsten er liten, helstapet er lite og kostnadene store, blir vurdert til lav prioritet. Med andre ord: en helhetlig avveining er nødvendig.
Utvalget ønsker ikke at det skal gå automatikk i vurderingen av dokumentasjonens kvalitet. Dette av to grunner. For det første er det slik at ulike tilstanders natur kan gjøre det vanskelig å skaffe dokumentasjon med aller høyeste kvalitet. For det andre er det slik at det eksisterer store skjevheter mellom fagområder og tilstander med hensyn til hvor godt effekten av ulike tjenester er studert. Fagområdene kardiologi og onkologi er gode eksempler på områder hvor det foreligger svært mange studier av god kvalitet for de aller fleste aktuelle intervensjoner. Andre fagområder, som psykiatri og spesialisert rusbehandling, kan ikke vise til like mange studier av god kvalitet. Årsakene til dette er mange og sammensatte, inkludert ulikhet i midler til forskning og utvikling fra legemiddelindustrien og myndighetene, fagenes faglige prestisje og intern faglig kultur. Hvis dokumentasjonskravene settes likt under ellers svært ulike forhold, kan dette videreføre en ressursfordeling som ikke er ønsket ut fra overordnede mål for prioritering.
Til dette må det likevel tilføyes at god dokumentasjon for alle tjenester som tilbys i helsesektoren i seg selv er et mål, og at den systematiske tilnærmingen som mange fagområder har til systematisk utprøving av hva som virker og ikke, er forbilledlig. Vurderingen av dokumentasjonens kvalitet skal også være kritisk, og kvaliteten bør være så høy som mulig for at en tjeneste skal gis prioritet.
10.6 Utvalget anbefaler
En sammenliknbar måleenhet for helsegevinster er nødvendig som beslutningsstøtte ved prioritering mellom ulike pasientgrupper. En slik måleenhet er gode leveår. Til tross for sine metodeproblemer framstår kvalitetsjusterte leveår (QALYs) som en godt egnet måleenhet for å uttrykke helsegevinsters ulike størrelser, fordi denne enheten både fanger opp forbedret livskvalitet og økt levetid.
For å få mer valide tall til bruk i norske prioriteringsbeslutninger, er det behov for forskning basert på norske pasienter og befolkningens verdsetting av helsetilstander.
Kostnad-effektanalyser er et sentralt verktøy for på en systematisk måte å sammenstille et tiltaks ressursbruk og helsegevinster. Siden ulike typer kostnader og effekter har ulik prioriteringsrelevans, bør de presenteres på en mest mulig åpen og gjennomsiktig måte. Utvalget anbefaler at kostnad-effektanalysene tar utgangspunkt i et helsesektorperspektiv; helsesektorens kostnader per helsegevinstenhet. Der det anses relevant, bør konsekvensene i øvrige sektorer også rapporteres, men separat fra de beregninger som ligger til grunn for kostnad-effektbrøkens størrelse.
Alle tjenester som prioriteres skal som hovedregel være basert på god vitenskapelig dokumentasjon. Helsetjenester hvor det for eksempel kan stilles spørsmål ved virkningen, eller som er dokumentert uvirksomme, skal enten ha lav prioritet eller tas helt ut av det offentlige tilbud. Systematiske og oppdaterte kunnskapsoppsummeringer er en forutsetning for god prioritering.
Fotnoter
For å forenkle diskusjonen av kriterier, vil det som regel bli lagt til grunn at tiltakene som skal rangeres er uavhengige, dvs. at et tiltak ikke gjør noen av de andre tiltakene overflødige. Det vil også bli forutsatt at tiltakene kan implementeres i mindre enn full skala.
Det har blant annet blitt hevdet at vi ikke kan måle generell helse per se, men at vi kan måle velferdsgevinster fra endringer i helse (Hausman 2012).
Dette gjelder også livsforlengende tiltak med bivirkninger som påvirker livskvalitet.
Målindividet eller målindividene for et tiltak vil tidvis bli kalt tiltakets «målgruppe» uavhengig om det gjelder ett eller flere individer.
Øvrige gevinster er her velferdsgevinster som ikke skyldes helseforbedringer hos de individene som får velferdsøkning.
Flere vanlige metoder for beregning av gode leveår tar imidlertid hensyn til bekymring.
Blant annet av denne grunn er det lite hensiktsmessig å sette en maksimal grense for total ressursbruk for at et tiltak i det hele tatt skal kunne få offentlig finansiering. De fleste foreslåtte grenser for ressursbruk knytter seg derfor til ressursbruk per enhet helsegevinst. Slike grenser er diskutert i kapittel 9.
Referansetiltaket er et gjensidig utelukkende tiltak, men kan også bety ikke å gjøre noe. Det primære referansetiltaket eller komparatoren vil normalt være det tiltaket som mest sannsynlig erstattes dersom det aktuelle tiltaket iverksettes. Det aktuelle eller nye tiltaket vil i det følgende antas å være både mer ressurskrevende og mer effektivt enn komparatoren.
Negative gevinster blir da regnet som kostnader og positive gevinster som negative kostnader.
Studien sammenfattet for flere tiltak data om målgruppens gjennomsnittlige alder, målgruppens gjennomsnittlige gjenværende kvalitetsjusterte leveår (QALYs) med standard behandling, og tiltakets helsegevinst i form av QALYs (sammenliknet med standard behandling). Som del av utvalgsarbeidet har alder blitt omregnet til tidligere gode leveår ved hjelp av data for Norge fra det globale sykdomsbyrdeprosjektet (Salomon et al. 2013). Helsetapet ble så beregnet ved å finne differansen mellom 80 og summen av gode leveår i fortid og framtid.
Dette gjelder de tilfellene der helsegevinsten fra tiltaket er større enn helsegevinsten fra tiltaket det sammenliknes med (komparatoren).
Studien presenterte data for kostnad per kvalitetsjustert leveår (QALYs) for et utvalg tiltak, samt målgruppenes forventede antall kvalitetsjusterte leveår (QALYs) over livsløpet uten det aktuelle tiltaket. Det siste ble her brukt til å beregne helsetapet. Kostnad-effekt brøkene ble deretter vektet i tråd med 1-2-3-regelen.
Rangeringene er ikke nødvendigvis representative for Norge i dag. Blant annet vil dagens priser i Norge kunne skille seg betydelig fra prisene som ble lagt til grunn i studien.
«Behandlingsform» blir tolket som synonymt med «tiltak». Det innebærer at mandatet tolkes slik at det referer til mangel på alternativ behandling heller enn behandlingsform.
Å fremme og bevare håp kan i visse tilfeller også ha negative effekter. Pasienter kan for eksempel utsette å gjøre tilpasninger som totalt sett vil gjøre livet deres bedre (Menzel 2011).
«Innovasjon» kan også referere til prosessen eller aktiviteten som leder til dette.
Enkelte definisjoner krever også andre egenskaper, for eksempel at tilstanden er medfødt.
Anslaget for antall sjeldne diagnoser er basert på en definisjon som kun krever at diagnosen skal affisere mindre enn 5 av 10 000 personer.
I følge European Medicines Agency (EMA) blir i gjennomsnitt fem nye sjeldne sykdommer beskrevet hver uke, men EMA bruker en mer vid definisjon av sjeldenhet (5 per 10 000).
Klinisk nivå regnes ofte som synonymt med eller tett relatert til mikronivå og nivået for andreordensbeslutninger. Tilsvarende kan ledelsesnivået regnes som synonymt med eller tett relatert til nivået for førsteordensbeslutninger og det vil kunne inkludere både et makronivå og et meso-nivå slik disse ofte blir forstått.
Betraktningene her gjelder helsepersonell generelt.
Iblant kan det være hensiktsmessig å samtidig sammenlikne ett eller flere av de aktuelle tiltakene med en grenseverdi av typen som blir diskutert nedenfor.
Teoretisk kan det finnes unntak ved store forskjeller i øvrige gevinster mellom tiltakene.
For noen pasienter kan det også være relevant å spørre om livskvalitetsforbedringer fra behandlingen.
I visse tilfeller kan det være grunn til å vurdere ressursbruken på intensivavdelingen direkte opp mot ressursbruken på den alternativene avdelingen for å få riktig rangering av pasienter. I tråd med ressurskriteriet er det forskjellen i ressursbruk som er relevant.
Som tidligere er det her snakk om uavhengig tiltak.
Man kan for eksempel tenke seg at i en gitt situasjon er det bare nok ressurser til ett av tre tiltak, A, B og C. For å illustrere kan vi anta at det bare er gode leveår vi bryr oss om, og at tiltakene bare er ulike på dette punktet. A, B og C gir henholdsvis tre, to og ett godt leveår i gevinst. Alternativkostnaden til A er to gode leveår, mens alternativkostnaden til B og C tre gode leveår. Her og i teksten gjøres som regel der forenkling at verdien av innsatsfaktorene ikke medberegnes i alternativkostnaden.
Tilsvarende, dersom man vil snakke om «prisen» på et liv eller et godt leveår knyttet til et tiltak, er denne prisen egentlig antall andre liv eller gode leveår man ikke får reddet hvis det tiltaket blir implementert. Grenseverdier er uansett ikke ment å reflektere den reelle verdien av liv og leveår.
I statsbudsjettet for 2015 er bagatellgrensen foreslått økt til 25 millioner kroner.
Kostnad-nytteanalyser kalles iblant nytte-kostnadsanalyser.
Avsnittet bygger i hovedsak på Norderhaug et al. 2012.