4 Xenotransplantasjon: Transplantasjon fra dyr til mennesker
4.1 Xenotransplantasjon
4.1.1 Definisjon
Begrepet xenotransplantasjon er satt sammen av xeno, som er utledet fra det greske ordet for fremmed, og transplantasjon. Xenotransplantasjon er dermed en betegnelse på overføring av celler, vev eller organer mellom artsfremmede individer.
Fokus for denne utredningen er xenotransplantasjon for å lindre eller kurere sykdom hos mennesker, selv om man for å utvikle denne metoden må utføre transplantasjon også mellom andre dyrearter. Nye bioteknologiske muligheter og nye anvendelsesområder for levende animalsk vev i behandling av sykdom krever en definisjon av begrepet som inkluderer kontakt mellom så vel som overføring av celler, vev eller organer fra dyr til mennesker. Dette må også ses i sammenheng med økt oppmerksomhet på alvorlig infeksjonssykdom.
Utvalget har lagt til grunn følgende definisjon: Xenotransplantasjon er transplantasjon, implantasjon eller infusjon til mennesker av
a) levende celler, vev eller organer fra dyr
eller
b) menneskelige kroppsvæsker, celler, vev eller organer som utenfor kroppen har hatt kontakt med levende celler, vev eller organer fra dyr.
Denne definisjonen av xenotransplantasjon er i samsvar med de oppdaterte definisjoner som blir benyttet av blant andre de amerikanske helsemyndighetene og Europarådet og innebærer en viss utvidelse av definisjonen slik den er formulert i Ot.prp. nr. 77 (1999-2000). Her defineres xenotransplantasjon som overføring av biologisk materiale i form av levende celler, vev og hele organer fra dyr til mennesker, inkludert bruk av biologisk materiale som er koplet til mennesket utenfor kroppen (såkalt ekstrakorporeal perfusjon). Utvalgets definisjon omfatter i tillegg overføring av levende celler og vev som ikke har hatt kontakt med kroppen, men som for eksempel har vært dyrket i kultur i kontakt med levende dyreceller. Slik teknikk anvendes i enkelte land ved kultivering av ny hud til pasienter med alvorlige brannskader og i forbindelse med andre former for plastisk kirurgi. Den utvidede definisjonen er primært relevant i forhold til smittefare, som vil bli diskutert nærmere i kapittel 6.
4.1.2 Hvorfor xenotransplantasjon?
4.1.2.1 Tilgangen på organer
Et viktig argument for å utvikle xenotransplantasjon, er at denne metoden kan sørge for en tilnærmet ubegrenset tilgang til organer for transplantasjon. For personer med livstruende og irreversibel organsvikt er transplantasjon den beste og ofte eneste gjenværende behandlingsmuligheten. Ved organtransplantasjon er 60-90 prosent av pasientene i live etter fem år, noe som innebærer en stor helsegevinst for disse pasientene i forhold til pasienter som aldri fikk sjansen til transplantasjon. De fleste pasientene oppnår også en klar gevinst i livskvalitet. Dette er spesielt relevant for nyretransplantasjon, som ofte ikke er nødvendig for å redde liv, men hvor kronisk dialysebehandling er et langt dårligere alternativ.
Det er et vanlig problem at tilgangen på organer ikke kan dekke behovet for allotransplantasjon. På verdensbasis står det anslagsvis 150 000 pasienter på venteliste for organer. Mindre enn en tredjedel av det totale antallet pasienter vil få det organet de trenger, og opp mot 50 prosent dør mens de venter på et donorhjerte. I Norge stod 220 pasienter på venteliste ved inngangen til 2001, og av disse ventet 177 på nyrer. Mest kritisk er imidlertid mangelen på hjerte- og lungetransplantater, og i tidsrommet 1993-2000 døde årlig 12-20 prosent av de aktuelle hjertepasientene før de fikk tilbud om et organ. Avstanden mellom behov og tilbud har tiltatt de siste årene, særlig har ventelistene for nyretranplantasjon og lungetransplantasjon økt. Dette har sammenheng med at behandlingstilbudet er blitt mer kjent og at nye, mer effektive immundempende legemidler og bedre prosedyrer for testing av forlikelighet har gitt bedre resultater og dermed senket terskelen for transplantasjon.
Ventelistetallene er ikke et endelig uttrykk for behovet for organer. Kriteriene for å få organer er strenge. Siden det i dag er stor mangel på hjerter, må de pasientene prioriteres som etter all sannsynlighet vil få mest nytte av hjertet. Dersom transplantasjon for eksempel skulle tilbys alle terminale hjertesviktpasienter i aldersgruppen 60-65 år, ville dette alene doble behovet for donorhjerter i Norge. Annen samtidig sykdom er også en risikofaktor som kan gjøre en pasient uaktuell for ventelisten. Etiske dilemmaer som følger av slik seleksjon vil kunne unngås ved xenotransplantasjon.
4.1.2.2 Bedre transplantasjoner
Ved xenotransplantasjon kan organene i prinsippet tilpasses den enkelte mottaker. Målsetningen er at riktig organstørrelse enkelt skal kunne finnes til for eksempel barn. Dyrene vil dessuten potensielt kunne avles eller genmodifiseres slik at organene tilpasses mottakerens immunapparat.
Videre vil xenotransplantasjon kunne utføres elektivt, det vil si at man kan velge tid og sted for operasjonen langt friere enn ved allotransplantasjon fra nylig avdøde donorer. Som man har erfart ved nyretransplantasjon fra levende donorer, kan dette innebære en lang rekke fordeler for pasienten og det kirurgiske teamet. Ved elektiv transplantasjon kan immundempende medikamenter gis på det gunstigste tidspunktet for pasienten, og logistikken vil kunne forberedes i god tid før operasjonen. Ved kritisk organsvikt kan xenotransplantasjon gjøre det mulig å behandle pasienten innen svært kort tid. Dette kan være både livsforlengende og hindre komplikasjoner som ellers ville gjøre allotransplantasjon på en kritisk syk pasient mer risikabel og kostbar. Xenotransplantater kan også kontrolleres bedre før operasjonen med hensyn til både funksjon og infeksjon med kjente mikroorganismer.
4.1.2.3 Nye behandlingsformer
Xenotransplantasjon kan utgjøre en ny behandlingsform ved enkelte sykdommer. Et eksempel er insulinkrevende sukkersyke der den vanlige behandlingen er daglige insulininjeksjoner. Ved vellykket transplantasjon av insulinproduserende celler fra grisens bukspyttkjertel, vil pasienten kunne få langt bedre kontroll over sitt blodsukker og få færre komplikasjoner knyttet til sykdommen.
Parkinsons sykdom skyldes manglende dopamin-produksjon i pasientens hjerne, og det finnes i dag ingen effektiv behandling for dette. For tiden gjøres det terapeutiske forsøk med å transplantere dopaminproduserende hjerneceller fra gris til pasienter med denne sykdommen.
4.1.3 Historisk bakgrunn
Ideen om xenotransplantasjon har en lang historie, men seriøs forskning innen feltet begynte først på 1960-tallet. Transplantasjon mellom mennesker hadde da blitt etablert ved hjelp av det immundempende medikamentet azathioprin, og mangelen på allo-organer var allerede blitt merkbar. Ved Tulane-universitetet i Louisiana gjennomførte man mellom 1963 og 1965 13 nyretransplantasjoner med sjimpanser som donorer. De fleste nyrene fungerte mellom 9 og 60 dager, men én pasient overlevde i hele 9 måneder. Denne pasienten kunne til og med gå tilbake til sitt arbeide. Dette skapte en viss optimisme, og i de følgende årene ble det gjort en rekke andre xenotransplantasjoner med hjerte, lever og nyre fra ulike kildedyr. Imidlertid overlevde ingen av disse pasienter over 70 dager, og av dem som mottok organer fra andre dyr enn aper, var det ikke en eneste som overlevde operasjonsdagen. Resultatene fra de første kliniske forsøkene med xenotransplantasjon av organer var med andre ord skuffende, og aktiviteten har derfor vært liten inntil begynnelsen av 1990-tallet. Økt forståelse av immunresponsen, nye immundempende midler og ikke minst genteknologi har gitt fornyet håp om at xenotransplantasjon en gang vil komme til klinisk anvendelse.
Fra et medisinsk ståsted er det flere viktige hindringer som må forseres før xenotransplantasjon kan bli en realitet. Risikoen for at farlig og smittsom sykdom skal overføres fra dyr til mennesker er i dag én hovedårsak til at det ikke utføres nye kliniske forsøk med xenotransplantasjon av solide organer (se kapittel 6). Dette kapittelet tar for seg andre forhold, nemlig de immunologiske reaksjonene som fører til avstøtning av xenotransplantatet, og de anatomiske, fysiologiske og molekylære ulikhetene mellom dyr og mennesker.
4.2 Valg av kildedyr
Hvilket dyr som benyttes som kilde for transplantatene er av stor betydning for muligheter og risiko ved xenotransplantasjon.
4.2.1 Primater
Mennesket deler omlag 98 prosent av sitt arvestoff med de store apene: sjimpanse, gorilla og orangutang. I likhet med mennesket mangler disse artene et spesielt sukkermolekyl (Gal1,3Gal), som finnes hos alle andre pattedyr, og som setter igang den hyperakutte avstøtningsreaksjonen ved organtransplantasjon fra slike dyr til menneske. En logisk måte å unngå den hyperakutte reaksjonen, ville derfor være å bruke organer fra for eksempel sjimpanse til all xenotransplantasjon til menneske.
Det er imidlertid mange forhold som gjør bruk av menneskeaper som kildedyr uaktuell. Det nære slektskapet øker risikoen for overføring av nye farlige mikrober fra viltlevende aper til mennesker (se kapittel 6). Samtlige menneskeaper er dessuten utrydningstruet, de formerer seg langsomt både i frihet og fangenskap, og vil ikke kunne skaffes i tilstrekkelig antall til å utgjøre en stabil ressurs som kildedyr. Disse artenes nære slektskap med mennesket betyr at de deler mange av menneskets sosiale, emosjonelle og mentale egenskaper. Det er derfor etisk betenkelig å benytte dem som organprodusenter selv om det ellers hadde vært mulig.
Blant de mer fjerntstående primatene, dyreapene, er bavianen en mulig kandidat som kildedyr. Den er immunologisk relativt forlikelig med mennesket, og fins fremdeles i tilstrekkelig antall i naturen til å bli vurdert som potensielt kildedyr. Dens nære slektskap med mennesket gjør imidlertid risikoen for overføring av farlige mikrober mellom artene av samme størrelsesorden som for menneskeapenes vedkommende.
Bavianenes reproduksjonsrate er dessuten ganske langsom, slik at det ville bli svært dyrt og tidkrevende å drive bavianoppdrett med tanke på xenotransplantasjon. Bavianen når fruktbarhetsalderen etter 3-6 år. Den får vanligvis bare en unge av gangen etter en drektighetstid på seks måneder, og det er omtrent tre år mellom fødslene. Det tar ca 9-12 år før bavianen er fullt utvokst, og den blir maksimalt 20-40 kilo tung. Derfor vil organer som bavianhjerte og -lunger vanskelig kunne fungere i en stor menneskekropp. Bavianens store atferdsmessige og mentale likhet med menneskeapene gjør at de samme etiske betenkelighetene gjelder, som ved bruk av sjimpanser som kildedyr.
Den immunologiske og fysiologiske likheten mellom mennesker og andre primater gjør imidlertid primatene velegnet som forsøksdyr i prekliniske forsøk, der for eksempel bavianer kan brukes som mottakere av organer fra gris. Likevel vil kliniske forsøk på mennesker være nødvendige for å skaffe definitiv kunnskap om effektene av xenotransplantasjon på menneske.
4.2.2 Griser
På grunn av de fundamentale problemene som er forbundet med å bruke aper som kildedyr, har den mer fjerntstående grisen av flere grunner blitt oppfattet som det mest aktuelle kildedyret for xenotransplantasjon. Grisen har levd sammen med mennesker i 9000 år, og deler derfor mange mikroorganismer med oss. I senere år har dessuten grisestammer som er kontrollert for spesifikke patogene mikroorganismer blitt etablert. Grisen egner seg også godt til avl under sterile forhold.
Grisen får store kull med unger, som oftest rundt ti unger per fødsel, og er drektig i mindre enn fire måneder. I tillegg er griser billige å holde og vokser raskt til den størrelsen som må til for å gi organer til et voksent menneske. Innen seks måneder vil en gris ofte ha samme kroppsvekt som et voksent menneske.
Grisen har også visse anatomiske og fysiologiske likheter med mennesket som kan være nyttige ved xenotransplantasjon. Griser er omnivore, det vil si at de som menneskene er egnet til å spise både plante- og dyrefor. Fordøyelsesfysiologien er dermed relativt lik for griser og mennesker. Det er likheter også i nyrestruktur og -funksjoner, lungefysiologi, koronararterieforløp og hemodynamikk. I tillegg er grisens fysiologi relativt godt utforsket, i medisinsk sammenheng gjelder dette spesielt dens hjerte- og karsystem. Et stort antall griseraser med spesifikke egenskaper (for eksempel lav fettprosent, høy tilvekst, effektiv fôrutnyttelse eller lav disposisjon for visse sykdommer) har blitt fremavlet. Det har tidligere vært et problem at man ikke har vært i stand til å klone griser. I mars 2000 kom imidlertid den første rapporten om vellykket kloning av gris, med fem genetisk identiske og friske grisunger som resultat.
4.3 Immunologiske problemer ved xenotransplantasjon
4.3.1 Hyperakutt avstøtning
Den første immunologiske hindringen ved transplantasjon av et organ fra gris til menneske er den hyperakutte avstøtningen som skjer i løpet av noen minutter. Avstøtningen skyldes antistoffer hovedsakelig rettet mot ett antigen som finnes hos grisen og alle andre pattedyr enn mennesket og dets nærmeste slektninger blant apene (den gamle verdens aper). Antigenet er et galaktose sukker som kalles Galα1,3Gal (forkortes gjerne til Gal) der de to endemolekylene er spleiset på et bestemt sted og benevnt som en alfa-1-3 kobling.
Grunnen til at reaksjonen kan skje så hurtig er at antistoffene allerede sirkulerer i blodet hos mennesket. De kalles naturlig forekommende antistoffer og utvikles trolig tidlig etter fødselen som resultat av normal bakteriekolonisering i tarmen. Dette spesielle antigenet finnes nemlig også på overflaten hos mange bakterier, virus og parasitter og det antas at antistoffene mot dette antigenet bidrar i forsvaret mot visse mikrober.
Hos grisen finnes Gal-sukkeret på endotelcellene, det vil si i innerkledningene i blodårene. Etter transplantasjon av et organ fra gris til menneske vil først antistoffene i blodet binde seg til Gal-sukkeret på innsiden av griseblodårene. Dette setter i gang en kaskadereaksjon med proteiner som kalles komplementfaktorer. Komplementangrepet kan forårsake forandringer i endotelcellenes form og til tap av heparansulfat, slik at de mister evnen til å hindre at blodet koagulerer. Dette vil ofte føre til tetting av blodårene (trombose) i de transplanterte organene. Dessuten vil endotelcellene trekke seg sammen, noe som medfører blødning og væskeansamling i vevet. Videre blir det frigjort en rekke betennelsesfaktorer som gir skade i vevet. Resultatet er at organet blir ute av stand til å fungere i løpet av kort tid. Ingen av de eksisterende immundempende legemidlene kan forebygge den hyperakutte avstøtningen ved xenotransplantasjon.
4.3.1.1 Griser genmodifisert for Gal-sukker
Ved xenotransplantasjon kan det være nødvendig å gå et stort steg videre i transplantasjonsimmunologien, ved å gjøre en genetisk endring på kildeorganet før transplantasjon. Genteknologien har gjort det mulig å slå ut et eksisterende gen (såkalt «knock-out») eller introdusere nye gener hos dyret. I sistnevnte tilfelle karakteriseres dyret som «transgen». Man har lykkes i å fremstille og klone transgene griser, mens «knock-out» teknologi foreløpig er begrenset til mus.
Forskningen for å modifisere kildedyrets organer er konsentrert om to strategier. Den ene går ut på å unngå bindingen mellom antigen og antistoff og den andre retter seg mot den påfølgende aktiveringen av komplementsystemet.
Den mest effektive måten å unngå at antistoffene binder seg til Gal på, er enten å endre den kjemiske sammensetningen til dette sukkeret eller å fjerne det fra dyret eller organet. Gal-sukkeret fremstilles av et enzym som heter α1,3 galactosyltransferase (galα1,3 gal), som er styrt av kun ett enkelt gen. Teoretisk skulle det derfor være mulig å slå av dette genet ved hjelp av genteknologi, uten at grisens levedyktighet påvirkes. Det er laget «knock-out» mus hvor genet for galα1,3 gal er blitt slått av. Erfaringene med «knock-out»-mus viser imidlertid at problemet med hyperakutt avstøtning ikke vil være løst bare ved å eliminere Gal. De Gal-negative museorganene er fortsatt utsatt for en viss skade når de blir akutt eksponert for humant serum. Man vet i dag at det også finnes andre antigener hos grisen som mennesket har naturlig forekommende antistoffer mot, selv om disse er av mindre betydning enn Gal.
Problemet med å slå ut genet for Gal har stimulert utviklingen av en annen teknikk for å passivisere genet. Det er nemlig mulig å legge til gener i grisens genom, og en strategi har derfor vært å fremstille en gris som uttrykker et sukker som kan konkurrere med, og fortrenge, Gal-sukkeret. Det har vært gjort forsøk med å introdusere i griseceller et gen som koder for et sukkerproduserende enzym som finnes hos mennesker og som syntetiserer substans H, som er en del ABO blodgruppesystemet (α-1, 2-fucosyltransferase). Resultatet har vært at bare omtrent 10-50 prosent av Gal-sukkeret da blir uttrykt. Dette er likevel for mye, i og med at antallet Gal-molekyler på overflaten av hver enkelt grisecelle er svært stort (10-30 millioner) og at mer enn 95% reduksjon av Gal sukkeret er nødvendig for å unngå avstøtning. Dersom det lykkes å lage «knock-out» gris vil man helt kunne fjerne Gal-epitopen fra grisen. Alternative metoder for å hindre binding av antistoff er å enzymatisk fjerne Gal-epitopen fra organet ved å gjennomspyle det med et enzym som spalter av Gal. Videre har man fjernet antistoffene fra giveren ved ulike absorbsjonsteknikker, men problemet er at de kommer meget raskt tilbake igjen. Nye forsøk gjøres nå for spesifikt å slå ut bare de B-cellene som lager anti-Gal antistoffer.
4.3.1.2 Griser transgene for komplementregulatorer
Den foreløpig mest suksessrike strategien for å unngå hyperakutt avstøtning retter seg mot komplementaktiveringen. De forskjellige dyr er beskyttet mot komplement fra deres egen art fordi det finnes ulike komplement reguleringsproteiner på overflaten av cellene. De viktigste er DAF ( decay accelerating factor), MCP ( membrane cofactor protein), CD59 ( protectin) og CR1 (komplement reseptor 1, som nå finnes i en løselig form: sCR1). Flere ulike forskergrupper har laget transgene griser for en eller flere av disse humane (h) regulatorene. Den mest anvendte så langt er «hDAF-grisen». Det har nylig vist seg at ved å uttrykke grise-DAF i høy konsentrasjon på grisens egne endotelcelle, hvor den vanligvis ikke finnes, får man trolig en like god effekt som ved å introdusere human DAF. Andre transgene griser er under utprøving i andre grupper, spesielt i USA og Australia (MCP, CD59). For å teste den immunologiske effekten, har organer fra hDAF-griser blitt transplantert til aper. Disse forsøkene har gitt gode resultater. I309 av 314 forsøk unngikk man hyperakutt avstøtning.
4.3.2 Akutt vaskulær avstøtning
Immunreaksjonen ved xenotransplantasjon har vært sammenlignet med en løk; så snart man har kommet forbi ett lag, åpenbarer det neste seg. Som nevnt ovenfor har man klart å komme ganske langt når det gjelder den hyperakutte avstøtningen, selv om det nok også her gjenstår en del arbeid. Foreløpig har ingen forskningsgrupper kunnet rapportere om overlevelsestider ved livsoppholdende transplantasjon av xenoorganer henimot det en anser som nødvendig for å kunne starte med kliniske forsøk. Foreløpig er den lengste rapporterte overlevelse 39 dager for bavianer med livsoppholdende hjertetransplanter og 78 dager for makakaper med livsoppholdende nyretransplantater. Siden det har vært relativt mange komplikasjoner forårsaket av immundempende legemidler i disse forsøkene, har de også reist nye problemstillinger.
Problemene er i hovedsak knyttet til den akutte vaskulære avstøtningen, som inntreffer i løpet av få dager etter transplantasjonen. Den skyldes delvis antistoffer som blir formet av organmottakerens immunsystem etter at det har kommet i kontakt med xeno-organet og delvis de naturlig forekommende antistoffene som forårsaker den hyperakutte avstøtningen. Mekanismen for denne reaksjonen er imidlertid ikke helt klarlagt. Det er nylig vist at de naturlig forekommende anti-Gal antistoffene er av vesentlig betydning, men også makrofager og naturlige drepeceller kan ha betydning. Komplementsystemets rolle i den akutte vaskulære avstøtning er ikke klarlagt. Avstøtningen er karakterisert ved skader i endotelcellene, væskeansamling og manglende blodtilførsel. Kun svært høye doser med immundempende legemidler har kunnet forlenget levetiden til forsøksdyrene til uker i stedet for dager.
4.3.3 Cellulær avstøtning
Hvis problemene omkring den akutt vaskulære avstøtningen løses, vil den neste immunologiske utfordringen bli den cellulære avstøtningsreaksjonen. Den analoge tilstanden ved allotransplantasjon kalles akutt cellulær avstøtning og er forårsaket av aktiverte T-lymfocytter som angriper organet. Det er holdepunkter for at den cellulære avstøtningen av et griseorgan vil være minst like kraftig som avstøtningen av et allotransplantat. Det er håp om at nye immundempende medikamenter og eventuell induksjon av toleranse hos mottakeren i framtiden vil kunne løse problemene omkring cellulær avstøtning.
4.3.4 Kronisk avstøtning
Ved allotransplantasjon ser man også en kronisk avstøtningsreaksjon som gjerne kommer etter flere år og som er vanskelig å behandle. Årsaken til denne form for avstøtning er ikke klarlagt. Det er sannsynligvis mange faktorer som hver for seg eller i kombinasjon kan være utløsende. Selv om det er ikke er påvist at en tilsvarende reaksjon vil kunne komme etter xentransplantasjon, er det sannsynlig at kronisk avstøtning vil være et like stort problem som ved allotransplantasjon.
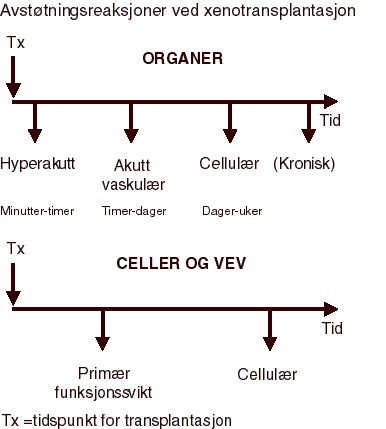
Figur 4.1 De immunologiske avstøtningsreaksjonene ved xenotransplantasjon av hele organer skiller seg i prinsipp ikke særlig fra de vi kan se ved allotransplantasjon. De utløses av reaksjoner mellom mottakerens blod og cellene som dekker innsiden av blodkarene i det transplanterte organ. De ulike reaksjonene er nærmere beskrevet i teksten. Celler skiller seg fra hele organer ved at de ikke har blodkar. De avstøtes derfor ikke umiddelbart, men gradvis av det cellulære immunapparatet. De kan imidlertid svikte allerede fra transplantasjonstidspunktet fordi funksjonen avtar i forbindelse med transplantasjonen.
4.3.5 Tilpasning av mottakeren
Induksjon av immunologisk toleranse er en av de fremste målsetningene innenfor transplantasjonsimmunologien. Hovedmålet er å manipulere mottakerens immunsystem til å betrakte det nye organet som eget («selv») istedenfor fremmed («ikke-selv»). Dette kan i teorien oppnås ved at man setter immunsystemet ut av spill for en kortere periode, for eksempel ved bestråling av hele kroppen. Immunsystemet mister «hukommelsen» i forbindelse med bestrålingen, og må reetablere minnet om hvilke vev det skal beskytte. Alle celler og organer som finnes i kroppen vil nå bli betraktet som en del av kroppen.
I forsøk med allotransplantasjon, både hos dyr og mennesker, har man delvis lyktes med å indusere slik toleranse for mottakeren ved å overføre lymfoide celler fra giverens benmarg eller thymus i tillegg til organet. Metoden har vært prøvd ved xenotransplantasjon mellom nær beslektede apearter, men det ser ut til å være vanskeligere å oppnå effektiv toleranse ved xeno- enn ved allotransplantasjon.
Vellykket induksjon av toleranse ville være å foretrekke fremfor langvarig bruk av immundempende legemidler. Toleransen vil bare gjelde det nye organet i tillegg til pasientens egen kropp, slik at immunsystemet kan virke normalt mot fiendtlige organismer etter behandlingen. Slik ville pasienten være like godt beskyttet mot infeksjoner og kreft som før behandlingen, og unngå den betydelig høyere risikoen for slike sykdommer som man ser hos pasienter som får immundempende legemidler over lengre tid. De mange andre bivirkningene av slike legemidler vil også kunne unngås. Problemet med kronisk avstøtning etter flere år, som er det største problemet ved allotransplantasjon i dag, vil kanskje også kunne løses ved indusert toleranse.
Det gjøres for tiden forskning med å skape toleranse for griseorganer hos bavianer. Den viktigste barrieren har foreløpig vist seg å være antistoffer mot gris som sirkulerer i blodet hos bavianen. Disse forårsaker avstøtning før toleranse kan bli indusert. Selv om stråling kan eliminere kroppens T-lymfocytter, stanser det ikke produksjonen av antistoffer hos B-lymfocyttene og plasmacellene. Et annet problem ved overføring av benmargsceller som ledd i toleranseutvikling er såkalt molekylær inkompatibilitet. Det vil si at cellene fra kildedyret ikke kommuniserer fullgodt med cellene hos mottaker. Kommunikasjon mellom cellenes overflatemolekyler er av vesentlig betydning for at benmargceller fra kildedyret skal passere over til benmargen hos mottaker. Det arbeides intenst for å finne hvilke molekyler som kommuniserer og hvilke som ikke gjøre det, slik at man for eksempel kan tilføre fra kildedyret de faktorer som trengs for å opprette kommunikasjonen. Det antas imidlertid at det enda vil ta lang tid å utvikle et anvendbart regime for induksjon av toleranse for klinisk bruk.
4.4 Xenotransplantasjon av organer
4.4.1 Generelle fysiologiske faktorer
Det fysiologiske samspillet mellom kroppens ulike organer skjer hovedsakelig gjennom nervesystemet og gjennom blodsirkulasjonen. Selv om alle nervegrener skjæres av under en transplantasjon, har erfaringen med allotransplantasjoner vist at organet likevel kan fungere godt. Sannsynligvis har dette sammenheng med at nervesystemets kjemiske budbringere, som for eksempel adrenalin og noradrenalin, kan utskilles direkte fra binyremargen og via blodet påvirke organene direkte.
Når det gjelder andre hormoner er situasjonen mer usikker. Den ene hovedtypen hormoner, steroidhormonene, har stort sett samme kjemiske oppbygning hos dyr som hos mennesker. Den andre type hormoner, som består av proteiner, er artsspesifikke. Dette innebærer at et hormon fra kildedyret kanskje ikke vil klare å binde seg til hormonreseptoren hos mottakeren eller at hormoner fra mottaker ikke kan binde seg til hormoner fra kildedyret og vice versa. Bruken av griseinsulin for å behandle diabetes, har imidlertid vist at også denne typen hormoner kan fungere godt over artsgrensene.
Andre forhold som ikke er helt klarlagt er effekten av ulik kroppstemperatur mellom kildedyr og mottaker (grisen har ca. 39 grader Celsius som normaltemperatur) og eventuelle fysiologiske forskjeller relatert til vekst og differensiering. Det er for eksempel uklart om griseorgan kommer til å fortsette å vokse etter å ha blitt transplantert til mennesker. Nye studier på aper tyder på at grisenyrer raskt tilpasser seg verten når det gjelder vekst og fysiologi. De endelige svar på disse spørsmålene vil imidlertid neppe bli avklart før eventuelle kliniske forsøk på mennesker blir utført.
4.4.2 Aktuelle organer
4.4.2.1 Nyre
Nyrene er ett av de organene som er livsnødvendige for å opprettholde kroppens homeostase, dvs. dens indre likevekt. Nyren regulerer kroppens totale væskemengde samt blodets surhetsgrad, pH, og sørger for normal konsentrasjon av oppløste stoffer, deriblant ulike salter, glukose, urea etc. Den kontrollerer blodtrykket, dels ved å holde blodvolumet optimalt, dels ved å produsere blodtrykksregulerende hormoner.
En menneskenyre filtrerer mellom 1000 og 2000 liter blod i døgnet, og produserer omkring 1,5 liter urin, mens en grisenyre har enda litt større kapasitet. Urinens konsentrasjon og pH er lik hos de to artene. I motsetning til menneskenyren skiller imidlertid grisenyren ut praktisk talt all urinsyre. Dette kan være en fordel, i og med at urinsyregikt som skyldes opphopning av urinsyre i leddene er vanlig forekommende etter allotransplantasjon.
Nyren produserer forskjellige hormoner og enzymer som dels påvirker organets egen funksjon, dels andre systemer i kroppen. Ved fall i blodtrykket frisetter nyrene for eksempel hormonet renin, som stimulerer dannelsen av angiotensin II. Angiotensinet får kroppens blodkar til å trekke seg sammen slik at blodtrykket øker samtidig som filtrasjonshastigheten i nyren reduseres. Angiotensinet stimulerer dessuten binyrene til å frisette hormonet aldosteron, som får nyrene til å holde natrium (og dermed vann) tilbake i kroppen slik at blodtrykket opprettholdes. Sammensetningen av aminosyrene til grisens renin og angiotensin er foreløpig ikke kjent. Man vet derfor ikke hvorvidt de er forskjellig fra menneskets eller om systemet vil fungere som det skal etter en xenotransplantasjon. Eventuelle forskjeller i aminosyresammensetningen kan utløse immunreaksjoner hos pasienten.
Dersom blodvolumet blir for stort, for eksempel på grunn av for stor aktivitet i renin-angiotensin-aldosteron-systemet, utskiller hjertets forkamre visse proteinhormoner som transporteres via blodet til nyrene. Det viktigste av disse er antinatriuretisk faktor (ANF), som har lik struktur hos gris og menneske. Man må derfor anta at en transplantert grisenyre vil kunne reagere normalt på ANF fra pasienten.
Nyrene påvirkes også av et spesielt vannsparende hormon, ADH, som utskilles i hjernens hypothalamus. ADH fra gris virker godt hos mennesker, så man kan regne med at en grisenyre vil reagere normalt på menneske-ADH. Væskebalanse og blodtrykk reguleres normalt i et samspill mellom renin-angiotensin-aldosteron-systemet, ANF og ADH. Det sympatiske nervesystemet er også viktig i dette samspillet, men direkte nerveforsyning av nyrene er ikke strengt nødvendig, siden lignende effekter oppnås via noradrenalin og adrenalin som sirkulerer i blodet.
Nyren lager også hormonet erytropoeitin (EPO), som stimulerer produksjonen av røde blodlegemer i benmargen. Den kjemiske sammensetningen av EPO fra gris skiller seg så mye fra menneskets EPO at man ikke kan vente å få effekt etter en xenotransplantasjon. Pasienten vil derfor måtte få tilført humant EPO medikamentelt (en behandling som i dag gis til dialysepasienter) resten av livet. Det er uavklart om grisenyren vil fortsette å produsere sitt eget EPO etter transplantasjon, og om dette vil skape kliniske problemer, for eksempel i form av immunisering.
Nyrene produserer dessuten kalcitrol, som regulerer kalsium-fosfat-stoffskiftet, kallikrein, som styrer den lokale proteinsyntesen, og prostaglandiner, som blant mye annet regulerer den lokale blodforsyningen i organet. Det er til dels store ulikheter mellom artene for disse stoffenes vedkommende, og deres effekt og funksjon etter en xenotransplantasjon er foreløpig uavklart.
Selv om det hittil ikke har vært gjort forsøk med xenotransplantasjon av grisenyrer til menneske, har det vært gjort andre forsøk som viser at en slik transplantasjon ville kunne ha klinisk effekt. Grisenyrer som har vært koplet til pasientens blodomløp via plastslanger (ekstrakorporeal perfusjon), produserte urin, men forsøket varte så kort at det ikke var mulig å observere andre fysiologiske effekter. I dyreforsøk har grisenyrer fungert i opp til tre uker hos bavianer som fikk høye doser immundempende medikamenter for å hindre avstøtning. Nyrer fra transgene griser har dessuten produsert normal urin i inntil tre måneder hos makakaper. Apene utviklet imidlertid endringer i kalsium-fosfat-balansen, som ville fordre medikamentell behandling hos et menneske. I tillegg fikk dyrene anemi, et tegn på at grisens EPO ikke hadde effekt hos mottaker. Når man ga humant EPO til apene, ble blodverdiene normalisert.
Som vi har sett, eksisterer det en rekke uavklarte fysiologiske spørsmål som bare kan besvares gjennom kliniske forsøk på mennesker.
4.4.2.2 Hjerte
Hjertet kan på grunnlag av fysiologiske og biokjemiske betraktninger være det mest aktuelle organet for xenotransplantasjon. Hjertets hovedfunksjon er å pumpe blod som det mottar fra kroppens ulike vev videre til lungene, der blodet tar opp oksygen og avgir karbondioksid. Karbondioksid utåndes, mens blodet fortsetter tilbake fra lungene til hjertet for å pumpes videre ut i kroppen.
Hjertets størrelse og den mengde blod som pumpes ut per minutt er proporsjonal med kroppsvekten. Grisens størrelse er derfor av betydning ved xenotransplantasjon. Grisens normale kroppsstilling er horisontal, og det gjenstår å avklare om grisens hjerte vil ha de samme mekanismene som menneskehjertet for å opprettholde blodforsyningen til hjernen i stående stilling. Også hjerteklaffene har et noe annerledes utseende hos de to artene. Det sistnevnte skal likevel ikke ha noen betydning, siden denaturerte hjerteklaffer fra gris, som ikke inneholder levende celler, allerede brukes for å erstatte skadede klaffer hos mennesket.
På grunn av hyperakutt avstøtning, finnes ingen gode data om hvordan et grisehjerte vil fungere i mennesket. Hjerter fra transgene griser har imidlertid blitt transplantert til bavian og opprettholdt blodsirkulasjonen til dette halvt oppreiste dyret i over en måned.
Senere års forskning har vist at hjertet ikke bare er en blodpumpe, men at det også produserer hormoner. Kunnskapen om hvordan disse vil fungere etter xenotransplantasjon, og hvordan samspillet med menneskenyren vil foregå, er ennå ufullstendig.
4.4.2.3 Lunge
Lunge regnes foreløpig som lite aktuelt for xenotransplantasjon. Prekliniske forsøk har hittil vært skuffende uten rapporter om organoverlevelse utover første døgn. Det har hittil ikke vært utført noen forsøk med klinisk xenotransplantasjon av lunge. Blant annet tyder forskningsresultater på at det er høyere lungekarmotstand i gris sammenlignet med menneske.
4.4.2.4 Lever
Leveren er kroppens biokjemisentrum, den fremstiller proteiner og en mengde andre kjemiske stoffer, og bryter ned avfalls- og giftstoffer. Sammen med nyrene er den kroppens viktigste renselses- og avgiftningsorgan. Mange av stoffene leveren produserer er artsspesifikke, noe som vanskeliggjør permanent organtransplantasjon av lever over artsgrensene. Likevel har det vært gjort flere forsøk med å utnytte griseleverens rensefunksjon under en forbigående leversvikt hos mennesket, ved å kople pasienten til en lever-dialysemaskin, der enten celler fra griselever eller hele organet fungerer som filter.
Tabell 4.1 : Xenotransplantasjon av hjerte til menneske
| År | Kirurg | Land | Kildedyr | Transplantatets overlevelsestid |
| 1964 | Hardy | USA | Sjimpanse | 2 timer |
| 1968 | Ross | England | Gris | 4 minutter |
| 1968 | Cooley | USA | Sau | 0 minutter |
| 1969 | Marion | Frankrike | Sjimpanse | 2 minutter |
| 1977 | Barnard | Sør-Afrika | Bavian | 5 timer |
| 1977 | Barnard | Sør-Afrika | Sjimpanse | 4 dager |
| 1984 | Bailey | USA | Bavian | 20 dager |
Tabellen gir en oversikt over kliniske forsøk med transplantasjon av hjerte fra dyr til menneske. Overlevelsestiden refererer til organets, og ikke pasientens, overlevelse.
Tabell 4.2 : Xenotransplantasjon av nyre til menneske
| År | Kirurg | Land | Kildedyr | Transplantatets overlevelsestid |
| 1963 | Reemtsma | USA | 13 sjimpanser | Fra 9 dager til |
| 9 måneder | ||||
| 1964 | Starzl | USA | 6 bavianer | 19-60 dager |
Tabellen gir en oversikt over kliniske forsøk med transplantasjon av nyre fra dyr til menneske. Overlevelsestiden refererer til organets, og ikke pasientens, overlevelse. Tabellen er ikke uttømmende, i den forstand at enkelte andre, isolerte forsøk ble gjennomført på 1960-tallet. De siste 30 årene er det ikke xenotransplantert nyre til menneske.
Tabell 4.3 : Kliniske forsøk med transplantasjon av lever fra dyr til menneske
| År | Kirurg | Land | Kildedyr | Transplantatets overlevelsestid |
| 1966-1973 | Starzl | USA | 5 sjimpanser | Opp til 14 dager |
| 1992 | Starzl | USA | Bavian | 70 dager |
| 1993 | Starzl | USA | Bavian | 27 dager |
| 1993 | Makowka | USA | Gris | Få timer |
Tabellen gir en oversikt over kliniske forsøk med transplantasjon av lever fra dyr til menneske. Overlevelsestiden refererer til organets, og ikke pasientens, overlevelse. Tabellen er ikke uttømmende, i den forstand at enkelte andre, isolerte forsøk ble gjennomført på slutten av 1960-tallet.
4.5 Xenotransplantasjon av celler
Det er sannsynligvis mindre problematisk å oppnå gode resultater med xenotransplantasjon av celler enn med organer. Cellevev og enkeltceller kan bli transplantert uten blodårer eller funksjonell blodtilførsel, og nye blodårer kan vokse inn i transplantatet fra verten. En viktig fysiologisk forskjell er at organer inneholder mange forskjellige celletyper og har et komplisert samspill med kroppens øvrige vev. Det er dessuten lettere å biologisk manipulere celler enn organer, og de kan oppbevares utenfor kroppen i lengre perioder. Enda viktigere er den immunologiske forskjellen mellom organ og celle. Den hyperakutte avstøtningen som inntreffer ved xenotransplantasjon av griseorganer, sees ikke ved celletransplantasjon, men en primær funksjonssvikt som følge av at cellene av ulike årsaker ikke fungerer som de skal etter transplantasjonen er ikke uvanlig. Det er nylig vist at øyceller fra bukspyttkjertelen hos gris kan angripes av komplementsystemet direkte, uten at antistoffer forårsaker aktiveringen. Det kan derfor være viktig å beskytte disse cellene mot komplementangrep.
Celler vil imidlertid kunne sette i gang akutt cellulær avstøtningsreaksjon, siden det også finnes en rekke antigener som ikke nødvendigvis er uttrykt på endotelcellene, og som vil aktivere mottakerens T-lymfocytter. Denne reaksjonen er langt kraftigere enn tilsvarende ved allotransplantasjon. En måte å unngå cellemediert avstøtning på, er å anvende såkalte immunisoleringssystemer. Grunnprinsippet er at de transplanterte cellene blir fysisk adskilt fra vertens immunologiske miljø ved innkapsling i en syntetisk, semi-permeabel membran. Små molekyler, som næringsstoffer, oksygen og visse terapeutiske midler, kan trenge gjennom membranen, mens antistoffer og hvite blodceller ikke trenger gjennom. Kliniske forsøk med denne teknikken er på begynnerstadiet.
4.5.1 Aktuelle celletyper
4.5.1.1 Celler for produksjon av hormonet insulin
Disse cellene har en sentral funksjon i stoffskiftet. Insulin lages i de 1-2 millioner betacellene i Langerhanscelleøyer i bukspyttkjertelen. Som nevnt ovenfor, fungerer griseinsulin godt i mennesket, og har vært brukt mot diabetes med godt resultat i en årrekke. Hos begge artene stimuleres insulinutskillelse av glukose, og det normale blodsukkernivået hos artene er det samme. Transplantasjon av Langerhans' celleøyer fra gris har hatt god effekt ved eksperimentell diabetes hos mus, rotte og hund. I Sverige har kliniske forsøk med xenotransplantasjon av øyceller til mennesker vært utført, og indirekte tegn på insulinproduksjon ble observert. I og med at pasientene fortsatte med insulinsprøyter, kunne imidlertid effekten ikke måles nøyaktig.
4.5.1.2 Nerveceller i hjernen
Ved Parkinsons sykdom slutter de hjernecellene som produserer stoffet dopamin å fungere, uten at man kjenner årsaken til dette. Pasienter rammes av skjelvinger, nedsatt bevegelsesevne og manglende mimikk. I dag finnes legemidler som kan utsette sykdommens forløp, men bare for noen år. De eneste forsøk som har kunnet påvirke sykdomsutviklingen hos noen pasienter, har vært allotransplantasjon av celler fra aborterte foster. Dette har gitt håp om at xenotransplantasjon kan bli et terapeutisk tilbud til disse pasientene i og med at strukturen til dopamin er lik hos et stort antall dyrearter og mennesket.
Forsøk som har vært gjort med transplantasjon til rotter og aper med kjemisk fremkalt Parkinsonisme, viser at føtale dopaminproduserende celler fra gris gir forbedringer i symptomene. Avanserte kliniske forsøk med transplantasjon av slike celler til menneske pågår for tiden i USA. For å unngå avstøtning får pasientene immundempende legemidler eller blir behandlet med fragmenter av antistoffer som maskerer implantasjon av cellene. Foreløpige rapporter fra den første studien tyder på at man ennå ikke har kunnet oppnå god effekt med denne typen terapi, men det er for tidlig å dra sikre konklusjoner.
Andre nevrologiske lidelser som Huntingtons sykdom, Alzheimers sykdom, slag og epilepsi, er også aktuelle i forbindelse med xenotransplantasjon.
4.6 Bioartifisielle organer
Kunstige organer som er basert på levende celler kalles bioartifisielle organer. En kunstig nyre (dialysemaskin) og et kunstig (mekanisk) hjerte er laget av syntetiske materialer. De kan over en viss tid erstatte funksjonen til de respektive levende organene. Mange organer kan på grunn av sin biologiske funksjon ikke erstattes av syntetisk materiale. Det kreves levende celler for å utføre organets oppgaver. Leveren er et slikt organ. Ved kronisk leversvikt i endestadium eller ved akutt alvorlig leversikt har allotransplantasjon fra avdød donor til nå vært eneste livreddende behandling. Nylig har man startet forsøk med transplantasjon av en del av leveren fra levende giver, spesielt ved transplantasjon til barn. Risikoen for giver er imidlertid ikke ubetydelig og denne virksomheten vil trolig forbli begrenset (se kapittel 5).
Xenotransplantasjon av lever fra gris til menneske som permanent behandling ansees som lite realistisk på grunn av leverens mangfoldige biologiske funksjoner. Imidlertid vil bruk av griselever som midlertidig behandling i påvente av tilgjengelig lever for transplantasjon være aktuelt. Ved akutt leversvikt, som for eksempel ved overdosering av medikamenter eller visse leverbetennelser, vil leveren kunne normaliseres igjen etter en tid dersom dens funksjoner kunne opprettholdes midlertidig ved perfusjon av blodet gjennom en griselever. Som et alternativ til å bruke griselever til disse formål, har man utviklet søyler som består av dyrkede griseleverceller komplett dekket med en membran. Ved å føre blodet fra pasienten gjennom en slik søyle (bioartifisiell lever) kan levercellene ivareta leverfunksjonen inntil pasientens lever er restituert eller til human lever er tilgjengelig.
Bioartifisiell lever er allerede under klinisk utprøvning i fase II og III. Det antas at smitterisikoen ved denne behandlingen er minimal fordi membranen som dekker cellene ikke slipper virus gjennom. Det er imidlertid ikke avklart enda om denne prosedyren vil kunne føre til immunisering av pasienten eller om kontakten mellom grisecellene og vevsvæsken fra pasienten vil kunne føre til en slags avstøtningsreaksjon og dermed ødelegge levercellene. Dersom resultatene som etter hvert kommer er lovende, vil man forvente at denne type behandling raskt kan bli etablert ved de sentra som driver levertransplantasjon.
4.7 Sammenfatning
Det kan skilles mellom tre hovedtyper av xenotransplantasjon: transplantasjon av hele organer, transplantasjon av celler, og bruk av bioartifisielle organer.
Xenotransplantasjon vil kunne gi en tilnærmet ubegrenset tilgang til hele organer for transplantasjon. For personer med livstruende og irreversibel organsvikt er transplantasjon den beste og ofte eneste gjenværende behandlingsmuligheten. Det er imidlertid et utbredt problem at tilgangen på organer ikke kan dekke behovet. Ved xenotransplantasjon kan organene i prinsippet også tilpasses den enkelte mottaker, og man kan velge tid og sted for operasjonen langt friere enn ved allotransplantasjon fra nylig avdød giver.
Selv om mye forskning gjenstår, er det holdepunkter for at hjerte og nyre fra gris fysiologisk vil kunne fungere i mennesket. Imidlertid har problemer med immunologisk avstøtning av organer i dyremodeller vært større enn tidligere antatt. Selv om man ved transplantasjon av hjerter og nyrer fra genmodifiserte griser til aper har kommet forbi den første immunologiske barrieren, hyperakutt avstøtning, er forventningene til overlevelsestid ikke innfridd. Det har vist seg at den akutte vaskulære avstøtningen ved xenotransplantasjon av organer fra gris til primater kun har latt seg utsette, men ikke eliminere, ved hjelp av tilgjengelige immundempende midler. Nye metoder for å komme forbi de immunologiske hindringene vil derfor måtte utvikles. Det er følgelig liten grunn til å tro at xenotransplantasjon av hele organer vil være aktuelt for klinisk utprøvning i større skala i løpet av de nærmeste årene.
Nyretransplantasjon med griseorganer vil trolig først bli aktuelt når prognosen for transplantatoverlevelse anses som god, da pasienter med kronisk nyresvikt som oftest har permanent dialyse som alternativ til transplantasjon. På den annen side kan dialysepasienter være egnet for forsøk med xenotransplantasjon fordi de kan gå tilbake til dialyse dersom transplantatet svikter. Langvarig dialyse er dessuten en kostnadskrevende behandlingsform som kan være meget belastende for pasienten.
Hjertetransplantasjon med gris som donor, kan ha et stort anvendelsesområde hvis de immunologiske hindringene kan kontrolleres, da mangelen på humane transplantater er særlig stor. Selv om kunstige hjerter kan være et alternativ, kan slike pumper også være en nødvendig forutsetning ved klinisk xenotransplantasjon hvis transplantatene svikter.
Organtransplantasjon av hel lever fra gris kan ikke anses som realistisk på grunn av de store forskjellene mellom gris og menneske, blant annet når det gjelder leverens biokjemi.
Det er et betydelig større behov for lungetransplantasjoner enn det som er mulig i dag med tilgang fra humane givere. De eksperimentelle resultatene man har oppnådd med xenotransplantasjon av lunge har imidlertid vært så svake at klinisk utprøving foreløpig anses som uaktuell.
Xenotransplantasjon av celler kan utgjøre en ny behandlingsform ved en rekke sykdommer. Et eksempel er insulinkrevende sukkersyke der den vanlige behandlingen er daglige insulininjeksjoner. Ved vellykket transplantasjon av insulinproduserende celler fra grisens bukspyttkjertel, vil pasienten kunne få langt bedre kontroll over sitt blodsukker og få færre komplikasjoner knyttet til sykdommen.
Et annet eksempel er Parkinsons sykdom, som skyldes manglende dopamin-produksjon i hjernen. For tiden gjøres det avanserte kliniske forsøk med å transplantere dopaminproduserende hjerneceller fra gris til pasienter med denne sykdommen. Forskning med transplantasjon av føtale nerveceller fra gris til slagpasienter og pasienter med Huntingtons sykdom og epilepsi er også i gang.
Det er sannsynligvis mindre problematisk å unngå avstøtning med xenotransplantasjon av celler enn med organer. En viktig forskjell er at organer inneholder mange forskjellige celletyper og har et komplisert samspill med kroppens øvrige vev. Transplanterte organer må tilkobles mottakerens karsystem slik at organet med sine blodkar møter mottakers blod og dermed direkte utsettes for avstøtningsreaksjoner. Det er videre lettere å biologisk manipulere celler enn organer, og de kan oppbevares utenfor kroppen i lengre perioder. Endelig er den immunologiske reaksjonen mot organer og celler forskjellig. Den hyperakutte avstøtningen som inntreffer ved xenotransplantasjon av griseorganer, er betinget av blodgjennomstrømningen av organet, og tilsvarende sees ikke ved celletransplantasjon. Cellevev og enkeltceller kan bli transplantert uten blodårer eller funksjonell blodtilførsel, og nye blodårer kan vokse inn i transplantatet fra verten. Celler vil imidlertid kunne utløse andre typer avstøtningsreaksjoner. I noen tilfeller vil man kunne hindre dette ved at de transplanterte cellene blir fysisk adskilt fra vertens immunologiske miljø ved innkapsling i en membran.
Kunstige organer som er basert på levende celler kalles bioartifisielle organer. Ved akutt leversvikt som for eksempel ved overdosering av medikamenter eller visse leverbetennelser, vil leveren kunne normaliseres igjen etter en tid dersom dens funksjoner kunne opprettholdes midlertidig ved perfusjon av blodet gjennom en griselever. Som et alternativ til å bruke intakt griselever, har man utviklet søyler som består av dyrkede griseleverceller komplett dekket med en membran. Ved å føre blodet fra pasienten gjennom en slik søyle (bioartifisiell lever) vil levercellene kunne ivareta leverens avgiftningsfunksjon inntil pasientens egen lever er restituert eller til annen human lever er tilgjengelig.
De umiddelbare kliniske problemene for pasienten synes overkommelige når det gjelder bruk av bioartifisielle organer. Bioartifisiell lever er allerede under klinisk utprøvning. Det antas at smitterisikoen ved denne behandlingen er minimal fordi membranen som dekker cellene ikke slipper virus gjennom. Det er imidlertid ennå ikke avklart om denne prosedyren vil føre til immunisering eller skade av cellene. Dersom resultatene som etter hvert kommer er lovende, vil man forvente at denne type behandling raskt kan bli etablert ved de sentra som driver levertransplantasjon.