1 Retningslinjer for helserisikovurdering av ny mat
Utgitt av Statens næringsmiddeltilsyn (SNT) mai 1998
Forord
Statens næringsmiddeltilsyn (SNT) nedsatte 11. februar 1997 en arbeidsgruppe for å lage retningslinjer for helserisikovurdering av ny mat, med vekt på genmodifisert mat. Retningslinjene inneholder krav til dokumentasjon som skal følge søknader. Den primære målgruppen for retningslinjene er bransjen.
Arbeidsgruppen har hatt følgende sammensetning:
Arne Mikalsen, avd. for miljømedisin, Folkehelsa
Rune Blomhoff, Institutt for ernæringsforskning, Universitetet i Oslo/Statens ernæringsråd
Hanne-Grete Nilsen, SNT
Solbjørg Hogstad, SNT deltok i avslutningen av arbeidet.
Retningslinjene er godkjente av en gruppe nedfelt fra SNTs vitenskapelige komite.
Retningslinjene er basert på internasjonale retningslinjer og anbefalinger, primært fra EU-kommisjonens Scientific Committee for Food .
Retningslinjene vil bli revidert ved behov.
Oslo, 19. mai l998
1.1 Innledning
1.1.1 Bakgrunn
Begrepet «ny mat» omfatter et vidt spekter av matvarer og fremstillingsmåter der disse ikke har tradisjon for bruk til mat i Norge, som for eksempel genmodifisert mat, nye ingredienser som fetterstattere eller proteiner fra bakterier og gjær og matvarer som vi ikke tidligere har hatt i vårt kosthold som eksotiske frukter. Ny mat stiller oss overfor nye utfordringer. De kan inneholde stoffer som kan ha utilsiktete effekter på helsa og vil ofte erstatte andre kjente matvarer som inngår som en del av basiskosten. De ernæringsmessige konsekvenser må derfor også vurderes.
En rekke internasjonale organisasjoner har utarbeidet prinsipper og retningslinjer for helsemessig vurderinger av ny mat. Det er hittil lagt mest vekt på genmodifisert mat i dette arbeidet. De norske retningslinjene bygger primært på EUs retningslinjer (Commision recommendation, juli 1997) som er laget til bruk i forvaltningen av EUs Novel Foodsforordning (Parlaments og rådsforordning, mai 1997).
De norske retningslinjene skal benyttes ved forvaltningen av følgende to godkjenningsordninger:
I: Lov 2 april 1993 nr. 38 (genteknologiloven) krever i henhold til §10 godkjenning av utsetting av genmodifiserte organismer. Dette omfatter blant annet genmodifiserte, levende og reproduksjonsdyktige planter, dyr og mikroorganismer som skal selges som mat. Ansvaret for behandling av slike søknader ligger i Miljøverndepartementet. Ansvaret for den helsemessige vurderingen er lagt til Sosial-og helsedepartementet. SNT foretar vurdering av de helsemessige konsekvenser av genmodifiserte organismer brukt som mat.
II: Det vil i løpet av første halvdel av 1998 gjøres gjeldende krav om godkjenning av nye næringsmidler og næringsmiddelingredienser samt genmodifiserte næringsmidler og næringsmiddelingredienser ved en endring av generell forskrift 1983 nr. 1252 for produksjon og frambud mv. av næringsmidler, gitt med hjemmel i næringsmiddelloven. Bearbeidet genmodifisert mat som ikke omfattes av genteknologiloven, vil i tillegg til andre typer ny mat, omfattes av denne godkjenningsordning. Ansvaret for søknader om godkjenning av denne type mat ligger i Statens næringsmiddeltilsyn.
Retningslinjene inneholder minimumskrav til dokumentasjon som skal følge søknader og omhandler kun helserisikovurdering. Det henvises til Miljøverndepartementet vedrørende dokumentasjonkrav og vurdering av genmodifiserte organismer med henblikk på effekter på miljø, etiske aspekter, samfunnsmessig nytte og bærekraftig utvikling i henhold til genteknologiloven.
1.1.2 Omfang
Retningslinjene omfatter næringsmidler og næringsmiddelingredienser som ut i fra produksjonsmåte og/eller sammensetning er å anse som nye på det norske markedet. Det gjøres oppmerksom på at genmodifiserte næringsmidler og næringsmiddelingredienser som allerede eksisterer på det norske markedet også omfattes. Det vil i praksis bety at når godkjenningskravet i generell forskrift trer i kraft, skal det søkes om godkjenning av eventuelle genmodifiserte næringsmidler og næringsmiddelingredienser som allerede måtte eksistere på det norske markedet ved ikrafttredelse. Dette til forskjell fra EUs Novel Foodsforordning, ettersom den ikke omfatter genmodifiserte næringsmidler og næringsmiddelingredienser som allerede eksisterer på markedet.
Det er i retningslinjene foreløpig lagt vekt på genmodifisert mat, men på sikt skal retningslinjene bygges ut med mer detaljer med hensyn til andre kategorier av ny mat.
Ny mat som omfattes av retningslinjene hører inn under en eller flere av følgende seks kategorier. Ny mat i kategori a godkjennes i henhold til genteknologiloven. Mat fra kategoriene b - f godkjennes i henhold til næringsmiddelloven.
a) Næringsmidler og næringsmiddelingredienser som består av eller inneholder genmodifiserte organismer (dvs. genmodifiserte, levende og reproduksjondyktige planter, dyr og mikroorganismer, hvor den genetiske sammensetningen er endret ved bruk av genteknologi).
Eksempler på mat som består av genmodifiserte organismer: Genmodifiserte tomater, genmodifiserte maiskolber, genmodifiserte soyabønner. Eksempler på mat som inneholder genmodifiserte organismer: Salat som inneholder friske genmodifiserte tomatbiter, en yoghurt som inneholder genmodifiserte melkesyrebakterier.
b) Næringsmidler og næringsmiddelingredienser som er fremstilt på grunnlag av , men som ikke inneholder genmodifiserte organismer.
Eksempler: Tomatpuré, frosne grønnsaker, hermetisert mais, cornflakes, soyaolje, egg, kjøtt, fiskefilet, melk som stammer fra genmodifiserte organismer.
Søknadsprosedyre for kategori b er vist i figur 1.1.
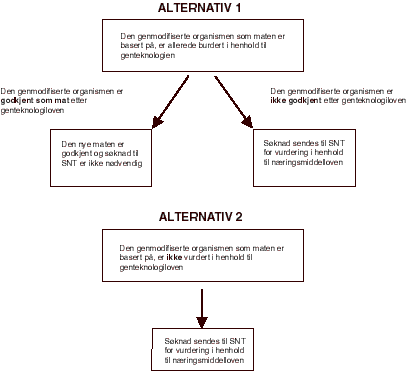
Figur 1.1 Søknadsprosedyre for genmodifisert mat som er fremstilt på grunnlag av, men ikke inneholder genmodifiserte organismer («kategori b»)
c) Næringsmidler og næringsmiddelingredienser med ny eller med hensikt endret primær molekylstruktur.
Eksempler: Fetterstattere ( «Olestra»), nye/endrete proteiner og karbohydrater.
d) Næringsmidler og næringsmiddelingredienser som består av eller er isolert fra mikroorganismer, sopp eller alger.
Eksempler: All ny mat fra slike organismer, eks. nye bakterier, encelleproteiner, tang- og tareprodukter, proteiner fra sopp (eks. «Quorn»).
e) Næringsmidler og næringsmiddelingredienser som ikke er genmodifiserte og som består av eller er isolert fra planter eller dyr, med unntak av næringsmidler som er fremstilt gjennom tradisjonell oppformering eller foredling og som tidligere er brukt som næringsmidler uten risiko.
Eksempler: Nye dyphavsfisker, nye eksotiske frukter og grønnsaker.
f) Næringsmidler og næringsmiddelingredienser hvor det benyttes en produksjonsmetode som normalt ikke anvendes, når denne innebærer betydelige forandringer av sammensetningen eller strukturen av næringsmiddelet som angår næringsverdi, stoffomsetning og innhold av ikke ønskelige forbindelser.
Eksempler: UVC-bestråling av matvarer, nye tørke- og fryseteknikker, nye prosesser katalysert av enzymer.
1.2 Krav til dokumentasjon som skal følge søknaden
1.2.1 Oversikt
Søknader om godkjenning og andre henvendelser vil bli vurdert fra sak til sak. Krav til dokumentasjon og vurdering av søknadene følger en trinnvis prosess som går fra enkle til stadig mer utfyllende krav avhengig av hva slags matvareprodukt søknaden gjelder. Et nøkkelbegrep i den innledende vurderingen av et næringsmiddel/næringsmiddelingrediens er begrepet «vesentlig lik» (eng.: «substantial equivalent»). I mange tilfelle vil ny mat helt eller delvis være lik tradisjonell mat. Det første trinnet i helserisikovurderingen av ny mat blir derfor å fastslå om næringsmiddelet/næringsmiddelingrediensen skiller seg fra en sammenlignbar tradisjonell vare i vesentlig grad. Hvis det etter vurdering viser seg at næringsmiddelet/næringsmiddelingrediensen ikke skiller seg i vesentlig grad fra tradisjonell vare, kreves ikke videre helserisikovurdering. Den nye maten er i dette tilfellet verken mer eller mindre helsemessig trygg enn den tradisjonelle maten.
Begrepet «substantial equivalence» ble av FAO/WHO (1991, 1996), WHO (1995) og OECD (1993, 1996) ment å være et praktisk redskap for helserisikovurdering av et næringsmiddel som er produsert ved hjelp av moderne bioteknologi. «Substantial equivalence» er konstruert for at helserisikovurderinger av ny mat skal konsentrere seg om forskjeller mellom det nye næringsmiddelet/næringsmiddelingrediensen og det tradisjonelle motstykket. Med «substantial equivalence» menes at kjemisk sammensetning, næringsverdi, stoffomsetning og bruksmåte for den nye maten er innenfor kjente og målbare naturlige variasjoner for det tradisjonelle motstykket. Fastsetting av «substantial equivalence» gir forsikringer om at den nye maten i det vesentlige er lik sitt tradisjonelle motstykke når det gjelder den relative helsemessige tryggheten.
Selve sammenligningen av den nye maten med det tradisjonelle er altså ingen vurdering av helsemessige sider av maten, men et innledende trinn for å avgjøre om videre helsemessig vurdering er nødvendig. Med hensyn til «substantial equivalence» skilles det mellom tre grupper som er illustrert i figur 1.2.
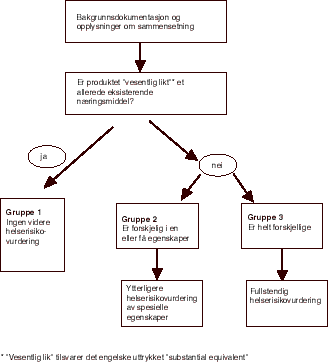
Figur 1.2 Oversikt over helserisikovurdering av ny mat
Tabell 1.1gir en oversikt over minimumskrav til hvilken dokumentasjon som angår helsemessige spørsmål som søker må skaffe til veie ved søknad om markedsføring av ulike typer ny mat. Tabellen gir også henvisning til mer detaljerte beskrivelser av dokumentasjonskravene i retningslinjene.
Tabell 1.1 Tabell over dokumentasjonskrav («X») for helserisikovurdering av de ulike gruppene 1-3 som beskrevet i figur 1 ( «gm»: genmodifisert mat)
| Nærmere beskrevet i kapittel | Gruppe 1 | Gruppe 2 | Gruppe 3 | |||
| ikke gm | gm | ikke gm | gm | ikke gm | gm | |
| 2.2.: Bakgrunnsinformasjon | X | X | X | X | X | X |
| 2.3.: Ytterligere bakgrunnsinformasjon for genmodifisert mat | X | X | X | |||
| 2.4.: Sammensetning (næringsstoffer, kritiske toksiner, allergener, anti-næringsstoffer) | X | X | X | X | X | X |
| 2.5.: Ytterligere om sammensetning i genmodifiserte næringsmidler og næringsmiddelingredienser (f.eks. utilsiktete metabolitter, antibiotikaresistens) | X | X | X | |||
| 2.7.: Ytterligere om toksikologi, ernæring, allergi | X | X | X | X | ||
| 2.8.: Ytterligere dokumentasjon (foringsforsøk på dyr, eventuelt ernæringsstudier av mennesker, m.m.) | X | X | ||||
1.2.2 Bakgrunnsdokumentasjon som skal følge alle søknader
Bakgrunnsdokumentasjon om næringsmiddelet/næringsmiddelingrediensen er nødvendig for å avgjøre hvilke parametre som i neste trinn bør undersøkes når man skal vurdere om det nye næringsmiddelet/næringsmiddelingrediensen skiller seg vesentlig fra det tradisjonelle motstykket med hensyn til kjemisk sammensetning, næringsverdi og bruksegenskaper.
For alle kategorier ny mat må følgende informasjon legges ved søknaden:
Administrative data: Søker, firma, adresser etc.
Tekniske opplysninger om selve næringsmiddelet/næringsmiddelingrediensen: Produktnavn, type næringsmiddel, kategori av ny mat
Hva utgangspunktet er for næringsmiddelet/ næringsmiddelingrediensen: Plante, dyr, mikroorganisme eller kjemisk syntese.
Hvordan næringsmiddelet/næringsmiddelingrediensen er fremkommet: Naturlig forekommende, tradisjonell avl, genteknologi etc.
Opplysninger om råvaren som er utgangspunktet for næringsmiddelet/ næringsmiddelingrediensen: Taksonomisk klassifisering, tidligere brukt som mat i Norge og andre land.
Metode for produksjon og videre bearbeiding
Tidligere bruk av selve næringsmiddelet/næringsmiddelingrediensen som mat i Norge og andre land
Hensikten med næringsmiddelet/næringsmiddelingrediensen (lavere produksjonskostnader, endret sammensetning, mm)
Forventet bruk av næringsmiddelet/næringsmiddelingrediensen (spesifikke produkter i næringsmiddelindustrien, ferskvarekonsum, mm)
1.2.3 Ytterligere bakgrunnsinformasjon for genmodifisert mat
Beskrivelse av verten (dvs. den organisme som det genetiske materialet er satt inn i): Genotypiske og fenotypiske karakteristika (morfologi, vekst, avkastning, tørrstoffinnhold, opptak av miljøgifter, motstandsdyktighet mot sykdommer, patogenisitet, innhold av uønskede stoffer, næringsstoffer, sekundære metabolitter mm).
Beskrivelse av vektoren (dvs. transportør for genmaterialet fra donor til vert) , og de nye genene: Type vektor, vektorens gener og evt. markørgener, transformasjonsteknikk, historisk bruk, promotoraktivitet.
Beskrivelse av den genmodifiserte organismen. Stabiliteten til de innsatte genene over flere generasjoner. Antall kopier av det nye genet, nivået av genproduktet og funksjonen til genproduktet. Beskrivelse av genotypiske og fenotypiske egenskaper. For næringsmidler/ næringsmiddelingredienser av kategori b gjelder dette for råstoffet som er utgangspunkt for produksjon av den nye maten. F.eks. vil det for soyaolje være den genmodifiserte soyaplanten. Egenskapene til den genmodifiserte organismen sammenliknes med egenskapene til verten.
Beskrivelse av hvilke identifikasjonsmetoder som er benyttet, som fenotypiske og molekylærbiologiske teknikker.
1.2.4 Opplysninger om sammensetning som skal følge alle søknader
Næringsstoffer
Det kreves dokumentasjon fra analyser av innholdet av sentrale næringsstoffer, både de som finnes i råvarene og de som kan dannes/endres i de ulike trinn i bearbeidingsprosessen fram til ferdig næringsmiddel/næringsmiddelingrediens .
Kritiske næringsstoffer er her de forbindelsene i den nye maten som kan ha vesentlig betydning for ernæringen. Dette kan være hovednæringsstoffer (proteiner, fett, karbohydrater), vitaminer eller mineraler, avhengig av type næringsmiddel/næringsmiddelingrediens. Hva som er sentrale næringsstoffer i ny mat vil til enhver tid være reflektert av aksepterte vitenskapelige vurderinger og hvilken plass matvaren har i kostholdet. Hvis det f.eks. settes inn et gen som påvirker aminosyresyntesen, må det foreligge data over aminosyreprofil og proteininnhold (totalt eller spesifikke proteiner). Hvis det dreier seg om et næringsmiddel/næringsmiddelingrediens som er kjent som vitaminkilde, vil det være viktig å få dokumentert om det har endret innhold av vitaminet i forhold til det tradisjonelle. For eksempel vil det kreves analyse av innhold av vitamin C i genmodifisert appelsin.
Kritiske toksiner
Det kreves dokumentasjon fra analyser av innholdet av kritiske toksiner, både de som finnes i råvarene og de som dannes i bearbeidingsprosessen fram til ferdig næringsmiddel/næringsmiddelingrediens .
Kritiske toksiner er de toksiner som er en naturlig del av organismen og omfatter komponenter som har et iboende toksisk potensiale og som forekommer i et nivå som gjør at de kan være en helserisiko. Hvis den nye maten er avledet fra et råstoff som er kjent å inneholde et naturlig giftstoff (for eksempel glykoalkaloidene solanin og chakonin i potet, erukasyre i rapsolje) må innholdet av disse forbindelsene være dokumentert, slik at man kan sammenligne dette i forhold til det tradisjonelle råstoffet.
Anti-næringsstoffer
Innholdet av anti-næringsstoffer, dvs. stoffer som negativt påvirker næringsverdien må dokumenteres. Dette kan f.eks. være fytinsyre i korn som kan binde og hindre opptak av mineraler. Ved tilstedeværelse av anti-næringsstoffer må det dokumenteres at næringsmiddelet/næringsmiddelingrediensen alltid vil bli bearbeidet på en måte som bryter ned slike stoffer.
Allergener
Innholdet av allergener, både de som finnes i råvarene og i det ferdige næringsmiddelet/næringsmiddelingrediensen skal dokumenteres.
1.2.5 Ytterligere dokumentasjon om sammensetning for genmodifisert mat
Antibiotikaresistens
Både i de tilfeller hvor råvaren eller det ferdige næringsmiddelet/næringsmiddelingrediensen er tilført gener som koder for antibiotikaresistens, skal dette dokumenteres.
Når antibiotikaresistensgenet er benyttet til seleksjon av genmodifiserte planteceller skal det dokumenteres hvor mange kopier som er satt inn, mengde enzym som uttrykkes i f.eks. forskjellige plantedeler, nedbrytbarheten av plantens DNA, transformasjonsforsøk med kompetente bakterier av plantematerialets DNA før og etter fordøyelse i simulerte mage-tarmsafter.
Selv om antibiotikaresistensgenetikke uttrykkes i planten skal det dokumenteres hvor mange kopier som er satt inn og nedbrytbarhet av plantens DNA, transformasjonsforsøk med kompetente bakterier av plantematerialets DNA før og etter fordøyelse i simulerte mage-tarmsafter.
Stortinget vedtok i juni 1997 at alle produkter som inneholder gener som koder for antibiotikaresistens bør forbys. Hvorvidt dette vedtaket også omfatter bearbeidede næringsmidler/næringsmiddelingredienser er ennå ikke helt avklart.
Allergener
Hvis næringsmiddelet/næringsmiddelingrediensen er tilført gener som kan forårsake allergi/intoleranse, skal dette dokumenteres.
Utilsiktede metabolske forbindelser
For genmodifiserte næringsmidler/næringsmiddelingredienser må det også dokumenteres om de innsatte genene kan gi utilsiktede metabolske forbindelser. I praksis innebærer dette at ved søknad om markedsføring av en olje fra en genmodifisert plante, må det også foreligge slik dokumentasjon om selve planten.
1.2.6 Vurdering om det er krav til ytterligere dokumentasjon
Ut i fra opplysninger gitt i dokumentasjon som beskrevet under 2.2 - 2.5, vil næringsmiddelet/næringsmiddelingrediensen bli klassifisert i en av tre grupper. Behov for ytterligere dokumentasjon vil da bli fastlagt.
Gruppe 1:
Næringsmiddelet/næringsmiddelingrediensen er i det vesentlige lik det eksisterende, det vil si «substantial equivalent». Når «substantial equivalence» kan konstateres for en ny mat i forhold til et helsemessig akseptert tradisjonelt næringsmiddel/næringsmiddelingrediens er det ikke behov for videre helserisikovurdering av den nye maten.
Eksempel: Hvis en soyaolje fremstilt fra genmodifisert soyabønne konstateres å være vesentlig lik vanlig soyaolje, kreves ingen ytterligere vurdering.
Det er ikke behov for ytterligere dokumentasjon
1.2.7 Krav til ytterligere dokumentasjon for gruppe 2 og 3
Gruppe 2:
Det nye næringsmiddelet/næringsmiddelingrediensen er i det vesentlige lik det tradisjonelle motstykket - med unntak av en eller noen få spesifikke egenskaper. Etter at det er konstatert at den nye maten skiller seg fra tradisjonell mat når det gjelder enkelte spesielle egenskaper, fokuseres det i den videre helserisikovurderingen på helsemessige aspekter ved de nye egenskapene.
Eksempel: Mange av de genmodifiserte næringsmidler/næringsmiddelingredienser.
Toksikologi/mikrobiologi
Tradisjonelle toksikologiske tester kan ikke brukes hvor hele næringsmiddelet/næringsmiddelingrediensen skal testes (for eksempel en hel mais). Hvis det derimot gjelder næringsmidler/næringsmiddelingredienser som er avgrensede definerte mikrokomponenter eller i seg selv er et isolert stoff (f.eks. kategori c), kan tradisjonelle toksikologiske tester benyttes.
For ny mat av kategori a og b (genmodifisert mat) vil den videre toksikologiske vurderingen typisk fokusere på proteinene som de nye genene koder for, samt metabolittene som produseres fra disse proteinene. Eventuelle utilsiktede, uventede effekter som følge av genmodifiseringen og eventuelle metabolitter som følge av slike effekter må også undersøkes. Det er en forutsetning at det også framlegges dokumentasjon på at eventuelle helsemessige betenkelige komponenter, som er lite kjent i Norge, ikke er til stede i den nye maten.
Proteiner som skiller seg vesentlig fra de som forekommer i det tradisjonelle motstykket må vurderes med hensyn til potensiell giftighet og allergenisitet. Også nedbrytingsprodukter av disse må vurderes.
Følgende dokumentasjon kreves:
Aminosyresekvens: Det må vises at det ikke er homologi til kjente toksiner.
Fordøyelse/omsetning: Nedbrytningshastighet i mage og tarm, nedbrytingsprodukter. For proteiner som ikke brytes raskt ned må behov for ytterligere toksikologiske tester vurderes.
Effekt av normal bearbeiding av ny mat.
Mulighet for genoverføring til bakterier i tarmen. Gjelder spesielt antibiotikaresistensgener. Bruk i humanmedisin av det aktuelle antibiotikum må dokumenteres.
Inaktivering av peroralt administerte antibiotika på grunn av uttrykking av enzymer kodet for av markørgen.
I tillegg kan det bli aktuelt å kreve in vivo og in vitro tester for akutt og kronisk helsefare for de spesifikke egenskapene. Det vil da kunne kreves fôringsforsøk i tråd med det som kreves for f.eks. tilsetningsstoffer.
Ernæringsmessige aspekter
Det må dokumenteres hvilken ernæringsmessig betydning de nye egenskapene kan ha både ved det forventede normale inntak og et maksimalt inntak (spesielt vektlegges grupper med høyt inntak). Denne dokumentasjonen skal baseres på grundig og relevant litteratur og analyser av sammensetningen av den nye maten. Hvis den nye maten forventes å spille en viktig rolle i kostholdet er det nødvendig å foreta modellberegninger for å beregne humant inntak av næringsstoffer ut fra forventede endringer i kostholdet. Det må tas hensyn til endret bruk og inntak av den nye maten. Man må også ta nødvendig hensyn til inntaket hos spesielt sårbare grupper som spedbarn, småbarn, gravide, ammende kvinner, eldre og individer med kroniske sykdommer (som f.eks. diabetes og malabsorpsjon). Det er nødvendig med informasjon om langsiktige og kortsiktige ernæringseffekter av å spise ny mat.
Hvis de nye genene i genmodifisert mat er vist å føre til endringer i sammensetning og struktur av fett, karbohydrater, vitaminer etc., må ernæringsmessige og fysiologiske effekter dokumenteres.
Allergi
Proteiner, og nedbrytingsprodukter fra disse, som i den nye maten skiller seg vesentlig fra de som forekommer i det tradisjonelle motstykket, må vurderes med hensyn til potensiell allergenisitet. Følgende dokumentasjon kreves:
Eventuell (mangel på) sekvenshomologi til epitoper på kjente allergener
Varmestabilitet
pH-sensitivitet
Nedbrytbarhet av mage-tarmproteaser
Påvisbare mengder i plasma
Molekylvekt.
Ytterligere informasjon kan komme fra eksponering av mindre grupper mennesker før markedsføring og rapporter fra sensibilisering av arbeidere under utvikling av den nye maten.
Den immunologiske reaktiviteten til personer som reagerer mot det tradisjonelle næringsmiddelet må, som et generelt prinsipp for helserisikovurdering være utgangspunktet for både in vitro og in vivo tester av produkter som ut fra ovenfor nevnte dokumentasjon mistenkes å være allergent. Dette kan reise en del etiske spørsmål som først må avklares i de enkelte tilfeller (f.eks. om det er forsvarlig å utføre tester på sensitive personer).
Dersom et protein fra en ny matvare blir uttrykt av gener som stammer fra en organisme som er en kjent kilde til matallergiske reaksjoner, kan sera fra personer som reagerer allergisk mot denne kilden benyttes til spesifikke immunologiske tester, f.eks. Western blotting eller radioallergensorbent test (RAST). Dersom in vitro tester er negative kan det utføres prikktest på hud eller klinisk overvåket dobbelt blind placebo kontrollert provokasjonstest.
Alle slike studier skal være i overensstemmelse med relevante elementer og etiske prinsipper som er nedfelt i retningslinjene for god klinisk praksis og god laboratoriepraksis.
1.2.8 Ytterligere krav til dokumentasjon for gruppe 3
Gruppe 3:
Det nye næringsmiddelet/næringsmiddelingrediensen er vesentlig forskjellig fra det tradisjonelle motstykket I slike tilfeller gjøres en helsemessig risikovurdering som omfatter hele det nye næringsmiddelet/næringsmiddelingrediensen. Eksempel her kan være fetterstattere eller nye proteinprodukter og annet under kategori c - f (se kap. 1.2).
Foreløpig mangler man erfaring med å undersøke slike typer ny mat og det er derfor nødvendig å utvikle retningslinjer og metoder etterhvert som det blir aktuelt.
Dyreforsøk og fôringsforsøk
I fôringsforsøk på dyr er det viktig at ernæringsmessige og toksikologiske aspekter integreres i vurderingen av ny mat. Grundig kunnskap om næringsverdien til ny mat (f.eks. energi- og proteininnhold og biotilgjengelighet av mikronæringsstoffer) er nødvendig for en tilfredsstillende toksikologisk vurdering.
Dersom det viser seg nødvendig med en full toksikologisk vurdering av en ny mat vil det kunne medføre visse metodiske tilpasninger. Et minimumskrav er at det er utført et 90 dagers fôringsforsøk hos gnager. Andre toksikologiske studier som kan vise seg nødvendige, er mutasjons-, reproduksjons- og teratogenstudier.
Når man utfører toksikologiske fôringsforsøk med dyr, skal maksimalt inntak av ny mat tilsvare den høyeste mengden som ikke forårsaker ernæringsmessig ubalanse, og den laveste mengden skal tilsvare nivået som er sammenlignbart med det anslåtte inntak i et humant kosthold.
Hvis det beregnede inntak hos forbrukere er høyt, kan det være vanskelig å utføre dyreforsøk med maksimalt inntak for toksikologisk testing. I slike tilfeller skal dyreforsøkene suppleres med absorpsjons og metabolismestudier i dyr og evt. i mennesker. En helhetlig vitenskapelig vurdering av hver enkelt ny mat må eventuelt ligge til grunn for bruk av slike toksikologiske vurderinger.
Ernæringsstudier av mennesker
Det kan bli nødvendig å utføre studier med mennesker for å se på næringsverdi av den nye maten. I slike tilfeller må det på forhånd være vist i dyreforsøk at den nye maten ikke er helseskadelig.
1.2.9 Krav til kvaliteten på de kjemiske analysene mm
Alle analyser som er omtalt i dokumentasjonsmateriale, må være basert på aksepterte vitenskapelige prinsipper. OECDs retningslinjer for «Good Laboratory Practice» må følges.
For en grundigere beskrivelse av dokumentasjonskravene som er omtalt i disse retningslinjene, se WHO (1995) og EUs retningslinjer (Commission recommendation, juli 1997) med vedlagte flytskjemaer.
1.3 Referanser og litteratur
Commission recommendation, juli 1997. Commision regulation of 29 July 1997 concerning the scientific aspects and the presentation of information necessary to support applications for the placing on the market of novel foods and novel food ingredients and the preparation of initial assessment reports under the Regulation (EC) No 258/97 of the European Parliament and of the Council (97/618/EC). Official Journal of the European Communities nr. L 253/1.
FAO/WHO 1991. Strategies for assessing the safety of foods produced by biotechnology.
FAO/WHO consultation, Geneva 1991.
FAO/WHO 1996 Biotechnology and food safety. Food and nutrition paper 61.
Genteknologiloven (Miljøverndepartementet, 1993).
Næringsmiddelloven, endring av generell forskrift 1983 nr. 1252 for produksjon og frambud mv. av næringsmidler (1998).
OECD 1993. Safety Evaluation of Foods Derived by Modern Biotechnology. ISBN 92-64-13859-5.
OECD 1996 Food Safety Evaluation. ISBN 92-64-14867-1.
Parlaments- og rådsforordning, mai 1997. Europaparlamentets og rådets forordning (EF) nr. 258/97 av 27. januar 1997 om nye næringsmidler og nye næringsmiddelingredienser. Official Journal of the European Communities nr. L 43, 14.02.97, s.1.
WHO 1995. Application of the principles of substantial equivalence to the safety evaluation of foods or food components from plants derived by modern biotechnology. WHO Workshop 1995. WHO food safety unit, WHO/FNU/FOS/95.1.